אי ספיקה שחלתית מוקדמת - אטיולוגיה ומניעה אפשרית - Premature ovarian failure - etiology and prevention
| אי ספיקה שחלתית מוקדמת – אטיולוגיה ומניעה אפשרית | ||
|---|---|---|
| Premature ovarian failure – etiology and prevention | ||
| ||
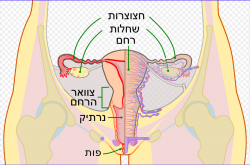
מבנה מערכת המין הנקבית. השחלות באפור באיור
| ||
| ICD-10 | Chapter E 28.3 | |
| ICD-9 | 256.31 | |
| MeSH | D016649 | |
| יוצר הערך | פרופ' זאב בלומנפלד |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אי ספיקה שחלתית מוקדמת
אי ספיקה שחלתית מוקדמת מוגדרת כמנופאוזה (Menopause, גיל המעבר) לפני גיל 40.
אפידמיולוגיה
אי ספיקה שחלתית מוקדמת היא הפרעה הטרוגנית (Heterogenous) החלה באחוז אחד מאוכלוסיית הנשים שלפני גיל 40, ובעשירית האחוז מהנשים הצעירות מגיל 30. אי ספיקה שחלתית מוקדמת יכולה להופיע בכל שלב בחיים לפני גיל 40, אפילו לפני גיל ההתבגרות.
אטיולוגיה
אי ספיקה שחלתית מוקדמת קשורה באטיולוגיות (Etiology) שונות: כרומוזומליות (Chromosome), גנטיות (Genetic)[1][2][3][4][5], אנזימטיות (Enzymatic)[2][6][7], יאטרוגניות (Iatrogenic)[2][8], מטבוליות (Metabolic)[2][6][7] וזיהומיות[1][2][3][4][5][6][7][8][9]. רק בפחות ממחצית מהמקרים, ניתן לאבחן ולהגיע לגורם[1][2][3]. בשני העשורים האחרונים, תוארו גנים רבים כקשורים בתפקוד ההורמונלי (Hormonal) ומקצתם נמצאו קשורים לאי ספיקה שחלתית מוקדמת, בהם הגנים: CYP17, CYP19, BMP15, GDF9, GPR3, Luteinizing Hormone) LH, הורמון הצהבה), LHR (Luteinizing Hormone Receptor), FSHR (Follicle Stimulating Hormone Receptor, הקולטן להורמון מגרה הזקיק) וכן חלבונים קושרי DNA ופקטורי (Factors) שעתוק, כגון: NOBOX, LHX8 וחלבונים קושרי RNA כ-NANOS[2][3]. בחלק מהנשים עם אי ספיקה שחלתית מוקדמת, קשורה האטיולוגיה להכרה מוטעית של חלק מהאנטיגנים (antigens) השחלתיים על ידי מערכת החיסון, ויצירת נוגדנים עצמיים כנגד אותם אנטיגנים שחלתיים; דבר זה קשור לנוכחות נוגדנים עצמיים כנגד רקמות שונות ושכיחות יתר של מחלות אוטואימוניות (Autoimmune) בנשים אלו[1]. במקצת מהנשים, ניתן להשיג היריון על ידי שילוב אגוניסט (Agonist) ל-GnRH (Gonadotropin Releasing Hormone), Glucocorticosteroids והשראת ביוץ על ידי מנות גבוהות יחסית של Gonadotropins[10]. הצלחות אלו תועדו במספר סדרות קטנות ותיאורי מקרים, אך לא הוכחו בעבודות פרוספקטיביות (Prospective) מבוקרות[11].
סיבה יאטרוגנית לאי ספיקה שחלתית מוקדמת, שחשיבותה עולה, היא טיפולים כימותרפיים (Chemotherapy) ו-רדיותרפיים (Radiotherapy) קודמים בנשים צעירות[8]. בעקבות שיפור ניכר בהישרדות חולות צעירות לאחר טיפולים מודרניים במחלות ממאירות בגיל הצעיר, כדוגמת Lymphoma ו-Leukemia, עד כ-90 אחוזים ממטופלות אלו עשויות לשרוד שנים רבות, דבר המעלה את הצורך לעשות כל מאמץ אפשרי על מנת להקטין את הסיכון לאי ספיקה שחלתית מוקדמת בנשים אלו[8]. יתרה מזאת, פרסום עדכני של ה-World Health Organization) WHO, ארגון הבריאות העולמי) אומר שמחלת הסרטן תעבור למקום הראשון כסיבה העיקרית לתמותה, לפני מחלות לב. בשנה הבאה, מוערך כי אחד או אחת מכל 250 מבוגרים, יהיו ניצולים של סרטן קודם[12]. שילוב זה, של עלייה בשכיחות מחלות ממאירות בכלל וגם בנשים צעירות, יחד עם שיפור משמעותי בשיעורי ההישרדות, מעלה את החשיבות של גורם יאטרוגני זה כסיבה לאי ספיקה שחלתית מוקדמת, הניתנת לטיפול ומניעה במרבית המקרים[8][12]. אכן, 8 אחוזים מהילדות שסבלו ממחלת הסרטן בילדותן, תסבולנה מאי ספיקה שחלתית מוקדמת עד גיל 40- לעומת אחוז אחד באוכלוסייה הכללית, ולעומת כמחצית (80-20 אחוזים) מאלו המטופלות בכימותרפיה או ברדיותרפיה בתקופת הפריון[8][12].
מודלים טרנסגניים (Transgenic) בעכברים תרמו רבות להבנת הגנטיקה של אי ספיקה שחלתית מוקדמת[13]. סונתזו והונדסו מעל 200 מודלים טרנסגניים כאלו, במטרה להבין את המנגנון הגנטי-מולקולרי (Molecular) הגורם להרס זקיקים ואי ספיקה שחלתית מוקדמת[13]. האופי ההטרוגני של אי ספיקה שחלתית מוקדמת ניתן להבנה, לפחות באופן חלקי, בעקבות גילוי גנים בודדים רבים על כרומוזום X או על כרומוזומים אוטוזומליים (Autosomal), הקשורים לאי ספיקה שחלתית מוקדמת[2][3][13]. מפאת קוצר היריעה והמקום, לא נוכל להרחיב בפירוט ותיאור כל ההפרעות הללו והקורא מופנה לסקירות עדכניות שפורסמו[2][3][13][14]. נזכיר בקצרה את מקצתן:
תסמונת Turner (45XO) וחוסרים בכרומוזום X
תסמונת Turner היא המונוזומיה (Monosomie) היחידה המאפשרת חיים ובאופן פתוגנומוני (Pathogenomonic) תואר: קומה נמוכה, צוואר מעובה, פטמות מרוחקות זו מזו ("חזה מגן - Shield chest"), הצטייקות אבי העורקים ועוד, בנוסף על אי ספיקה שחלתית מוקדמת. הסיבה היא אי ספיקה האפלואידית (Haploid) של כרומוזום X, היות שבתחילת חלוקת ההפחתה הראשונה, שני כרומוזומי ה-X פעילים בביצית הלא בשלה[2][3][14]. לפיכך, השחלות חסרות זקיקים והן מופיעות באופן טיפוסי (Gonadal dysgenesis) כשרוך שטוח ולבן של רקמת חיבור (נקרא: Streak gonads) כבר בילדות ברוב המקרים, אם כי לא בכולם[2][3][14]. החשיבות הקלינית של מומי לב ואבי העורקים היא הסיכון המוגבר לחיי היולדת עם תסמונת Turner, במקרי היריון שהושג על ידי תרומת ביציות, דבר הדורש שיקול רציני והסכמה מדעת של חולות אלו לפני טיפול מסוכן זה.
בנשים עם מונוזומיה X חלקית (מצב הנקרא Mosaicism), מופיעה אי ספיקה שחלתית מוקדמת גם כאשר גיל ההופעה וחסר הזקיקים תלויים בדרגת החסר וה-Mosaicism[2][3][14]. תוארו מספר חסרים גנטיים בכרומוזום X, כגון: קטע סופי של Xp11.2 p22.1, Xq (Xq27q28), Xq כקשורים לאי ספיקה שחלתית מוקדמת[2][3][14].
BMP15, GDF9, FMR1, & POF1B
הגן (Gene) FMRI הוא בעל חשיבות קלינית, בנוסף על העניין המדעי שהוא מעורר: מיקומו של גן זה הוא ב-Xp27, והוא גורם לתסמונת ה-X השביר (FRAXA), כאשר ה-Trinucleotide CGG מופיע יותר מ-200 פעמים, במקום 6–49 פעמים באופן נורמלי[2][3][14]. נשים עם קדם-מוטציה (Mutation) ברצף זה (כלומר בין 54 ל-199 חזרות) הן בסיכון יתר לאי ספיקה שחלתית מוקדמת בשכיחות של 20–28 אחוזים, לעומת 14 אחוזים במקרי מוטציה מלאה (כלומר, פחות מ-200 חזרות); בכ-2 עד 5 אחוזים מהנשים עם אי ספיקה שחלתית מוקדמת בלתי מוסברת, מוצאים קדם-מוטציה ברצף לגן: בין 54 ל-199 חזרות[3]. היות ש-13–15 אחוזים מהנשים עם הקדם-מוטציה, שבמשפחתן נמצאה תסמונת ה-X השביר, תסבולנה אי ספיקה שחלתית מוקדמת, מומלץ לבצע סריקה להפרעה זו בקרובות משפחה של נשים עם אי ספיקה שחלתית מוקדמת והפרעה בגן זה, ולהימנע מתרומת ביציות בין קרובות במשפחות בהן מופיעה תסמונת ה-X השביר.
הגן POFIB ממוקם על Xq21- מיקום קריטי על כרומוזום X, הקשור לאי ספיקה שחלתית מוקדמת בשל היות נשים אלו הומוזיגוטיות (Homozygot) למוטציה R329Q באקסון (Exon) 10 של הגן POFIB, בעוד שקרובותיהן ההטרוזיגוטיות (Heterozygote) היו נורמליות[2][14].
גנים אוטוזומליים הקשורים לאי ספיקה שחלתית מוקדמת
הקולטן ל-FSH (Follicle Stimulating Hormone)
בעכברים, פעילות הגן לקולטן של FSH קריטית רק החל מתקופת הזקיק ה-Pre-enteral ולא בהכרח קודם לכן[2][14]. ההשלכה למצב בנשים עדיין לא הובהרה חד משמעית וזאת בשל העובדה שבעכברים טרנסגניים לקולטן של FSH נצפו שלבים מתקדמים יותר של זקיקים, מאשר בנשים עם אי ספיקה שחלתית מוקדמת[2][3][15]. עכברים טרנסגניים יכולים לייצר זקיקים Pre-enteral, בעוד שנשים עם אי ספיקה שחלתית מוקדמת, בשל מוטציה (Mutation) בקולטן ל-FSH, אינן מבשילות זקיקים מעבר לשלב של זקיקים ראשוניים. בעשור האחרון נמצאה בפינלנד מוטציה ספציפית: Ala189Val (Ala=Alanine, Val=Valine), אך הדבר לא תואר באוכלוסיות אחרות מחוץ לפינלנד[2][3][14].
Forkhead box L2) FOXL2)
מוטציות בגן FOXL2 גורמות לתסמונת BPES (Blepharophimosis, Ptosis and Epicanthus inversus Syndrome) מסוג 1 או 2 בבני אדם[2][3][14]. תסמונת זו מסוג 1 גורמת לאי ספיקה שחלתית מוקדמת בנשים[2]. חוסר בגן FOXL2 גורם לביטויים של גנים הקשורים בהתמיינות זכרית, כדוגמת: WT12-I DMRTI ,FGF9. חוסר בשני הגורמים הסומאטיים (Somatic) FOXL2 ו-WNT4, גורם לתסמונת Sex reversal XX שבה יש מבנה של אשכים, כולל צינוריות סמיניפריים (Seminiferous tubules) ו-Spermatogonia, בגונדה (Gonad) בעלת קריוטיפ (Karyotype) נקבי ואי ספיקה שחלתית מוקדמת[2][16].
FOXO3A (Factor forkhead box O-3)
עכברים החסרים גן זה דומים לנשים עם אי ספיקה שחלתית מוקדמת[2][3][14]. הגן FOXO3A, ככל הנראה, הוא מדכא פיזיולוגי (Physiology) או ממתן את קצב השפעול וההבשלה של הזקיקים השחלתיים, היות שבעכברים המהונדסים לחסר גן זה (Knockout mice) מתרחש שפעול מואץ ומוגזם של הזקיקים; דבר זה גורם לדלדול מהיר של המלאי וכניסה לאי ספיקה שחלתית מוקדמת[2][3][14]. מוטציות בגן FOXO3A ובגן הדומה לו FOXOIA נמצאו ב-1.11 אחוזים וב-2.2 אחוזים, בהתאמה, בנשים עם אי ספיקה שחלתית מוקדמת[2].
PTEN ו-PI3K (Phosphatase and Tensin ו- Phosphatidylinositol 3-kinase)
הגן PTEN (Phosphatase and Tensin), המתפקד כמדכא גידולים (Tumor suppressor), ו-PI3K (Phosphatidylinositol 3-kinase) קשורים לאי ספיקה שחלתית מוקדמת בנשים, עקב כך שהאחרון מווסת את גורל הזקיקים ה-Primordial[2][17]. בנוסף, חסר מערכתי של הגן PTEN גורם לתמותה ואילו חסר מקומי של הגן ברחם גורם לסרטן רירית הרחם. במקרה של שפעול מוגזם של הזקיקים ה-Primordial, יש דלדול של המאגר ואי ספיקה שחלתית מוקדמת[2][17][18].
Growth Differentiation Factor 9) GDF9)
גן זה, GDF9, והגן הדומה לו BMP15 שייכים למשפחת ה- TGF-beta (Transforming Growth Factor beta), הבאה לידי ביטוי בזקיקים גדלים אך לא בזקיקים Primordial נחים (דהיינו- שאינם פעילים ביולוגית). מעריכים שגנים אלו אחראים לדו-שיח שבין תאי הגרנולוזה הסומאטיים (Somatic granulosa cells) והביצית, וכן לתהליכים החשובים החלים בעקבות העברת מידע דו-סטרי זה[2][18]. הגן GDF9 ממוקם על כרומוזום 5q31.1 ומוטציות בו מהוות סיבה נדירה לאי ספיקה שחלתית מוקדמת בנשים[2][18].
NOBOX (Newborn Ovary Homeobox - Encoding Gene)
NOBOX מבוטא בזקיקים Primordial וגם בזקיקים גדלים[2][18]. עכברים טרנסגניים החסרים NOBOX מראים אבדן מהיר ומואץ של זקיקים, הגורם לדלדולם ולאטרופיה (Atrophy) שחלתית תוך שבועיים[2][18]. חשיבותו של גן זה בכך שהוא מווסת באופן ישיר את הגן GDF9 והוא חיוני לתפקוד מספר גנים הספציפיים לביצית, המווסתים יצירת זקיקים, כדוגמת: HIFOO, ZARI, MOS, RFPL4 ו-BMP15[2][18].
LHX8 ו-SOHLH (8 LIM homeobox)
LHX8 (8 LIM homeobox) הוא מווסת שעתוק ספציפי לביצית, החיוני להתפתחות הפיזיולוגית התקינה[2]. למרות שעכברים טרנסגניים החסרים שני גנים אלו סובלים מאי ספיקה שחלתית מוקדמת זמן קצר לאחר לידתם, עקב דלדול מאגר הזקיקים השחלתיים, הקשר ביניהם ובין אי ספיקה שחלתית מוקדמת בנשים טרם הוכח[2][18].
FIGLA
גן זה מבוטא בביציות בשלב ה-Metaphase II, גם במכרסמים וגם בנשים[2][18][19]. פעילותו התקינה של גן זה חיונית לוויסות הגנים ZP3-I ZPI, ZP2 האחראים להפרשת חלבוני ה-Zona Pellucida[2][18]. מוטציות בגן FIGLA קשורות לאי ספיקה שחלתית מוקדמת בנשים[2][18][19].
OCT4 (POU5F1)
גן זה, המבוטא בזקיקים Primordial בנשים, אחראי לשמירת מאגר הזקיקים ה-Primordial ולרכישת יכולת מיוטית (Meiotic competence)[2][18][20][21]. הקשר שלו לאי ספיקה שחלתית מוקדמת הוצע, אך לא הוכח מעבר לכל ספק[2][18][20][21].
DAZL ו-VASA
DAZL הוא חלבון קושר RNA, שזוהה בביציות מכרסמים. חוסר בו בעכברים טרנסגניים גורם לאבדן כל הביציות בתחילת המיוזה (Meiosis)[2][18]. הקשר עם אי ספיקה שחלתית מוקדמת בנשים הוצע, אך עדיין דורש הוכחה.
GPR3
חיוני לשמירת מצב ה-Meiotic arrest על ידי קיום רמות גבוהות של Cyclic Adenosine MonoPhosphate) cAMP)[2][18]. הקשר שלו לאי ספיקה שחלתית מוקדמת הוצע, אך לא הוכח מעבר לכל ספק[2][18].
NR6A1 (GCNF)
קולטן גרעיני "יתום" (Orphan nuclear receptor), שכנראה מעלה את הביטוי של BMP15 ושל GDF9, ובעל חשיבות רבה בהבשלת הביצית ובהתפתחות העובר בטרם השרשתו ב-Endometrium[2][18]. תפקידו באדם לא ברור עדיין.
TAF4B (TAFII105)
גן זה מבוטא בביציות וסבורים כי הוא מווסת את האפקט המעורר של FSH על תאי ה-Granulosa, על ידי הגברת האפקט של 3-IGFBP[2][18]. למרות שרב הפיתוי לקשור אותו לאי ספיקה שחלתית מוקדמת, אין לכך עדיין הוכחה[2][18].
GATA4 ו-GATA6
אלו פקטורי שעתוק החיוניים להתפתחות שחלתית תקינה[2][18]. GATA4 יכול לווסת את ייצור הורמוני המין הסטרואידיים (Steroids) בשחלה דרך ויסות חלבון ה-stAR (steroid Acute Regulatory protein)[2][18]. לא ברור תפקידם באי ספיקה שחלתית מוקדמת.
GLP1
גן זה מקודד לחלבון הדומה ל-GATA ומכאן שמו:1 GATA-Like Protein, המבוטא בתאי Granulosa ומווסת את שעתוק ה-GATA[2][18].
גלקטוזמיה (Galactosemia)
הקשר בין גלקטוזמיה ואי ספיקה שחלתית מוקדמת ידוע מזה 30 שנים ויותר[6][7][18]. המחלה נובעת מחוסר באנזים (Enzyme) Galactose-l-phosphate uridyltransferase) GALT), שהוא בעל תפקיד במטבוליזם (Metabolism) של הגלקטוז, הבא מסוכר החלב. הגן המקודד לאנזים זה ממוקם על כרומוזום 9p13 ותוארו בו כמעט 200 מוטציות[7][18]. בנוסף להפרעות מוטוריות (Motor) וקוגניטיביות (Cognitive), סובלות החולות ההומוזיגוטיות במחלה גם מאי ספיקה שחלתית מוקדמת, כנראה עקב רעילות הגלקטוז או מטבוליטים (Metabolites) שלו, כגון: Galactitol ו-uDP-galactose, או, בנוסף, חוסר גלקטוזילציה (Galactosylation) של Glycoproteins ו-Glycolipids, עקה חמצונית ומוות תאי (Apoptosis) מואץ של הזקיקים השחלתיים[7][18]. עד לביטוי מלא של אי ספיקה שחלתית מוקדמת, ייתכן מצב זמני המוגדר כ-"Gonadotrophin-resistant ovary syndrome", שבו ייתכן היריון בעקבות טיפול במנות גבוהות של Gonadotropins ולעיתים נדירות אף היריון ספונטני. זהו מצב זמני, המגיע כמעט תמיד לאי ספיקה שחלתית מוקדמת, הדורש תרומת ביציות לצורך השגת הריון וטיפול הורמונלי תחליפי (HRT, Hormonal Replacement Therapy) למניעת Osteoporosis ויובש נרתיקי[7][18].
אטיולוגיה זיהומית
ידוע, כי דלקת אשכים הנגרמת על ידי נגיף החזרת (Mumps) עלולה לגרום ל-Azoospermia או Oligospermia קשה[1][4][9][18]. פחות ידוע כי נגיף זה עלול לפגוע גם בשחלות, והדבר מהווה סיבה לא נדירה כלל וכלל לאי ספיקה שחלתית מוקדמת[1][4][9][18]. בנשים עם אי ספיקה שחלתית מוקדמת, נמצאו נוגדנים כנגד נגיף החזרת בשכיחות גבוהה יותר מבאוכלוסייה הכללית באופן מובהק[1][4][9][18].
אטיולוגיה רעלנית
חומרים גונדוטוקסיים (Gonadotoxics), הגורמים לאי ספיקה שחלתית מוקדמת, הם בעיקר: כימותרפיה, גורמי אלקילציה (Alkylating agents), קרינה מייננת ועישון סיגריות[4][18]. למרות שרוב האוכלוסייה לא מודעת לאפקט הרסני זה של עישון, נמצא כי הסיכון לאי ספיקה שחלתית מוקדמת עולה פי 1.82 (3.23-1.03=CI, Confidence Interval) במעשנות[18][22]. מנגנון הפגיעה של חומרי הרעל שבעשן סיגריות הוא הפעלת הגן BAX, שהוא גן הגורם לאפופטוזיס בזקיקים השחלתיים[18][23][24]. מזהם סביבתי אחר, 4-Vinylcyclohexene, הנוצר בתעשיית הצמיגים, הדברת החרקים, תעשיית הפלסטיק ותעשיות אחרות הוא גונדוטוקסי גם הוא[18][24][25]. רעלנים סביבתיים ועישון מעכבים את ביטוי הגן PTEN ובעקבות כך את ביטוי הקינאזה (Kinase) P13 בביציות- דבר העלול לגרום לאבדן זקיקים מואץ ואי ספיקה שחלתית מוקדמת[18][24][25].
אטיולוגיה אוטואימונית
מחלות אוטואימוניות רבות קשורות לאי ספיקה שחלתית מוקדמת, המוכרות שבהן הן: Autoimmune thyroiditis ומחלת אדיסון (Addison's disease)[1][4]{הערה|שם=הערה10}}[18]. תוארו נוגדנים עצמיים כנגד אנטיגנים שחלתיים וכן נוגדנים כנגד הקולטנים ל-FSH[1][4][10][18]. אי ספיקה שחלתית מוקדמת אוטואימונית תוארה גם כחלק מתסמונת Polyglandular כמו: תת פעילות של בלוטת התריס, תת פעילות של בלוטת יותרת הכליה ופטרת העור והריריות[1][4][10][18]. מעריכים כי האטיולוגיה האוטואימונית אחראית לכ-30 עד 50 אחוזים ממקרי אי הספיקה השחלתית המוקדמת[1][4][18]. הקשר בין חיסון עצמי ואי ספיקה שחלתית מוקדמת תואר במאמרים רבים ובנוסף מוטציות בגן AIRE, הממוקם על כרומוזום 21q22.3, ואחראי לתסמונת APECED (Autoimmune Polyendocrinopathy Candidiasis Ectodermal Dystrophy), יכולות לגרום לאי ספיקה שחלתית מוקדמת[1][4][18]. מעל לשני שלישים מהחולות בתסמונת APECED סובלות מאי ספיקה שחלתית מוקדמת[1],[4][18]. למרות שמספר קבוצות מחקר טענו להוכחת נוגדנים כנגד שחלה, הסגוליות של נוגדנים אלה מוטלת בספק לאור מציאתם גם בנשים פוריות ואף ביולדות בסוף היריונן[1][4],[18].
קליניקה
פורסם[26] כי נוגדנים כנגד השחלה נמצאו ב-30 אחוזים מהנשים עם אי ספיקה שחלתית מוקדמת וב-26 אחוזים מהנשים שעברו הפריה חוץ גופית (IVF-ET, In Vitro Fertilization Pre-Embryo Transfer). בכ-2 עד 10 אחוזים מהנשים עם אי ספיקה שחלתית מוקדמת ניתן למצוא נוגדנים כנגד בלוטות יותרת הכליה, דבר היכול להופיע עד 10 שנים לפני אי ספיקת בלוטת יותרת הכליה, בעוד שבאוכלוסייה הכללית אי ספיקת בלוטות יותרת הכליה נדירה ביותר ושכיחותה בערך 1:10,000[1],[4][10][18]. היו השערות שגם נוגדנים כנגד קולטני ה-Gonadotropins יכולים לשחק תפקיד פתופיזיולוגי (Pathophysiology) באי ספיקה שחלתית מוקדמת, דבר שהשרה רופאים רבים לנסות שילוב של Glucocorticosteroids במינונים שונים, Estrogen או שילובי Estrogen-Progesterone, כדוגמת גלולות למניעת היריון או תכשירים הורמונליים כמו בגיל המעבר, אגוניסטים ל-GnRH ושילובי הנזכרים לעיל יחד עם Gonadotropins (בדרך כלל במינונים גבוהים כנהוג במקרי Resistant ovary syndrome), במטרה להשרות ביוץ והיריון בנשים עם אי ספיקה שחלתית מוקדמת וכרומוזומים תקינים[1],[4][10][18]. ההיגיון שמאחורי גישה טיפולית זו הוא שאם ה-Endogenous Gonadotropins שהם מוגברים אינם גורמים לתגובה שחלתית, סימן שאינם פעילים ו/או ייתכן נוגדנים כנגד הקולטנים החוסמים פעולת ה- Gonadotropins[10][18]. במטרה לשחרר את הקולטנים מתפיסתם על ידי ה- Endogenous Gonadotropins (שאינם פעילים), יש להוריד רמתם על ידי אגוניסטים ל-GnRH או גלולות למניעת היריון ובמקביל ה-Glucocorticoids עשויים להחליש את עוצמת הנוגדנים והתהליך האוטואימוני, ולאחר שחרור הקולטנים לGonadotropins מתפיסתם על ידי ה- Endogenous Gonadotropins, לתת Gonadotropins (FSH) חיצוניים פעילים, במטרה לגרות את הקולטנים בשחלות[10][18]. למרות מספר תיאורי מקרים של הצלחות לגרום לביוצים ואף הריונות, אין עבודות פרוספקטיביות מבוקרות שהוכיחו יעילות גישה זו[1][4][10][11][18]. במקרים בהם לא מושג היריון תוך שלושה מחזורי טיפול משולב כזה, מומלץ לא להמשיך בניסיונות אלו ולהמליץ על תרומת ביציות כאמצעי בדוק להשגת ההיריון הנכסף[1][4][10],[11][18]. למרות זאת, בעבודה מ-2007 [27]מתואר כי 58 נשים עם אי ספיקה שחלתית מוקדמת אידיופטית (Idiopathic) טופלו באגוניסט ל-GnRH ו-Gonadotropins עם Glucocorticoids או אינבו (Placebo). ביוץ הושג ב-20.7 אחוזים מהנשים שקיבלו Dexamethasone, לעומת 10.3 אחוזים בקבוצת האינבו; שני הריונות הושגו בקבוצת הטיפול ב-[27]Dexamethasone.
אבחנה
האבחנה של אטיולוגיה אוטואימונית לאי ספיקה שחלתית מוקדמת מתבססת על נוכחות נוגדנים כנגד רקמות שונות, כגון: נוגדנים כנגד בלוטת התריס (TPO) או נוגדנים מיקרוזומליים (Microsomal), נוגדנים כנגד גרעין (Anti Nuclear Antybodies, ANA), נוגדנים כנגד בלוטת יותרת הכליה, לבלב, תאים פריאטליים (Parietal), מיטוכונדריה (Mitochondria), שריר חלק, או נוכחות מחלות אוטואימוניות[1][4][10][18].
טיפול
כ-4 אחוזים מתוך מיליון וחצי מקרים חדשים של סרטן בארצות הברית בשנת 2007, היו בחולים הצעירים מגיל 35. בשנה הבאה, אחד מכל 250 מבוגרים יהיה ניצול של סרטן בגיל הילדות לפי הערכות אפידמיולוגיות[8][28][18][29][30]. הסיכון של כל אישה לחלות בסרטן בטרם הגיעה לגיל 35 הוא 2 אחוזים[8][28],[18][29][30]. לאור ריבוי מקרי הסרטן בנשים צעירות בתקופת הפריון, והודות לסיכוי הגבוה של 70–90 אחוזים מהן להבריא ממחלתן ולשרוד שנים ארוכות, עלו בעשור האחרון המודעות והצורך לתת מענה לפריון העתידי של נשים צעירות אלו, אשר עדיין לא מיצו את תוכנית המשפחה והילודה שלהן. ללא כל התערבות עלולות כמחצית, או יותר, מנשים צעירות אלו לסבול מכשל שחלתי מוקדם (מנופאוזה מוקדמת, Premature Ovarian Failure, POF) כתלות בגיל, מחלה והפרוטוקול הטיפולי- כימותרפויטי ורדיותרפויטי (סוג וכמות)[8],[28],[18][29][31].
לפיכך, מרכזים רפואיים רבים בעולם ובארץ מציעים לחולות אלו, לפני טיפול גונדוטוקסי, אפשרויות שונות לשמירת פוריותן לעתיד. בין האפשרויות המוזכרות: שאיבת ביציות לאחר גירוי שחלתי או אף ללא גירוי כלשהו, הפרייתן מחוץ לגוף והקפאת העוברים; הקפאת ביציות לא מופרות; הקפאת מקטעי שחלה (או אף שחלה שלמה) שהוצאו בלפרוסקופיה (Laparoscopy) וטיפול באגוניסטים להורמון המשחרר Gonadotropins.
האפשרות לטיפול לא פולשני העשוי למנוע את תופעות הלוואי הגונדוטוקסיות של הכימותרפיה קסמה לחוקרים רבים[8][28][18][32]: Glode et al בדקו בשנת 1981, במכרסמים, את יעילות האגוניסטים ל-GnRH והסיקו שהם מונעים את הנזק הגונדוטוקסי שנגרם על ידי Cyclophosphamide. הועלתה טענה ששחלות אנוש או אלו של פרימטים (Primates), מכילות ריכוזים נמוכים יותר של קולטנים ל-GnRH בהשוואה למכרסמים ולכן, לא ניתן להסיק שהתרופה תהיה יעילה באותה מידה בבני אדם. לפני למעלה מעשור בדקו Ataya et al[8][28][18][33] באופן פרוספקטיבי מבוקר את מספר הזקיקים שנותרו בשחלות של קופות רזוס (Rhezus), לאחר שטופלו במשך שנה וחצי ב-Cyclophosphamide, במקביל לטיפול באגוניסט או לאינבו (במקום האגוניסט). הטיפול באגוניסט הוריד את אבדן הזקיקים השחלתיים מ-65 אחוזים בקבוצת הביקורת (כימותרפיה ואינבו) ל-29 אחוזים בקבוצת האגוניסט ל-GnRH וכימותרפיה, ואת האבדן היומי של הזקיקים לפחות מחצי 0.01>P (ערך P מסמל מובהקות)[18],[33].
במחקר ארוך טווח של 15 שנות מעקב אחר 240 ילדים, שטופלו לפני גיל 15 בתשלובת הכימותרפית MOPP (Mechlorethamine hydrochloride, vincristine sulfate (Oncovin), Procarbazine hydrochloride, פרדניזון - Prednisone) בשל מחלת הודג'קין (Hodgkin's lymphoma), נמצא כי 83 אחוזים מהבנים שטופלו בילדותם סבלו מ-Azoospermia, בעוד שרק 13 אחוזים מהבנות סבלו מאי ספיקה שחלתית.
עבודה עדכנית יותר, של Sklar ועמיתיו, אוששה ממצאים אלה בכך שמצאה שיעור POF של 8 אחוזים ב-2,819 נשים, שטופלו בילדותן או לפני גיל 18 בכימותרפיה, לפני הגיען לגיל 40. היות שמרבית הילדות שטופלו ב-MOPP בילדותן חזרו לבייץ באופן מחזורי, לעומת רק כמחצית מהמבוגרות, היה הגיון רפואי בחיקוי הסביבה ההורמונלית הפנימית (Milieu) הקדם פוברטאלית (Prepubertal, טרם הבגרות המינית) על ידי הזרקת Analog ל-GnRH ארוך טווח, מדי חודש, טרם תחילת הטיפול הכימותרפי ועד סיומו, במשך 4–6 חודשים. חיקוי ה-Milieu הקדם-פוברטאלי נושא הגיון פתופיזיולוגי בנשים, אך לא בגברים- בהם לא נשא הגיל הצעיר יתרון במניעת Azoospermia. במטרה להתחיל את הטיפול הכימותרפי עם השגת מצב היפוגונדוטרופי (Hypogonadotropic), מומלץ להזריק את הזריקה הראשונה של ה-Analog ל-GnRH ארוך טווח 7–10 ימים לפני התחלת הכימותרפיה[8][28][18].
מאז 1990 המלצנו על קבלת זריקה חודשית של ה-Analog ל-GnRH (D-TRP6-GnRH-a, Decapeptyl C.R., 3.75 mg, Ferring) לכל אשה צעירה בגילאי 14–40, שהופנתה למרפאתנו לפני התחלת הכימותרפיה. בנוסף למחלות המטולוגיות (Hematology, כדוגמת: Lymphoma, Leukemia), סרטן השד או מחלות ממאירות אחרות, ניתן טיפול זה ליותר מ-30 נשים צעירות לפני ובמהלך טיפול פעימתי (Cyclophosphamide) או כימותרפיה אחרת מקבוצת: Alkylating Agents, עד לתקופה של שישה חודשים, במקרי Lupus Nephropathy או דלקת פקעיות הכליה (Glomerulonephritis) אוטואימוני[4][6],[8],[28][18][34]. התוצאות שהשגנו בחולות אלו מאוד מעודדות, בדומה לתוצאות קבוצות אחרות בארץ ובעולם: בארצות הברית, איטליה, ארגנטינה, צ'כיה, ספרד, הולנד ובאוסטרליה[4][6][8][28][18][33],[35]. אותן חולות שלא הופנו למרפאתנו לפני התחלת הטיפול, או שהופנו לאחר שכבר החלו לקבל את הטיפול הכימותרפי או שלא היו מעוניינות בטיפול ב-Analog ל-GnRH, שימשו כקבוצת ביקורת. בנוסף להקטנת שיעור המנופאוזה המוקדמת מ-37 אחוזים, בקבוצת הביקורת של חולות לימפומה מסוג הודג'קין, לפחות מ-4 אחוזים בקבוצת הטיפול ב-Analog ל-GnRH במטופלות שלנו, פרסמו מאירוב ועמיתיו בעבודה משותפת ממרכז שיבא בתל השומר והדסה עין-כרם, ירושלים, כי לטיפול ב-Analog ל-GnRH היה יתרון נוסף בכך שנמנעו הדימומים המוגברים במהלך הוסת (Menorrhagia) באותן חולות שחוו Thrombocytopenia משנית לכימותרפיה האלימה. לא היה הבדל מובהק בין קבוצת הטיפול וקבוצת הביקורת מבחינת הגיל, האבחנות, המנה המצטברת של כל תרופה כימותרפית בכלל (ובייחוד הכימותרפיה מקבוצת Alkylating Agents), שיעור החולות שקיבלו טיפול הקרנתי, מנת הקרינה המצטברת או כל משתנה אחר. ההבדל היחיד היה בשיעור ה-POF ושיעור החולות שחזרו לבייץ ולקבל וסת באופן עצמוני, לפי בדיקת רמות ההורמונים ה-Gonadotropins (Estrogen ו- Progesterone) ואולטרסאונד (Ultrasound) של הרחם והשחלות (זקיקים שחלתיים, גופיף צהוב, עובי רירית הרחם). הריונות הושגו באופן עצמוני בשתי הקבוצות בחולות שחזרו לבייץ, אך בעוד שבקבוצת הביקורת מרבית ההריונות הופיעו בניצולות המחלה שטופלו בגיל הצעיר מ-26 שנה, היו בקבוצת הטיפול מספר הריונות עצמוניים גם בחולות שטופלו בגיל 30 ומעלה; דהיינו, ייתכן והטיפול ב-Analog ל-GnRH עשוי להאריך את חלון הפוריות במספר שנים נוספות, בהשוואה לביקורת.
במקרים מיוחדים בהם נדרשת, עקב מצב החולה, התחלה מידית שאינה מאפשרת המתנה של שבוע, ניתן להתפשר ולהתחיל כימותרפיה מבלי להמתין להשגת דה-סנסיטיזציה היפופיזרית (Pituitary Desensitization), המונחת בבסיס ההיגיון הפיזיולוגי לטיפול זה. מניסיוננו המוקדם בלמעלה מ-180 נשים שטופלו ב-Analog ל-GnRH, לא מצאנו הבדל מובהק ביעילות הטיפול באותם מקרים בהם המרווח בין ה-Analog ל-GnRH ותחילת הכימותרפיה היה פחות מ-10 ימים. הטיפול ב-Analog ל-GnRH אינו מגן בפני נזק קרינתי אלא רק כימותרפי, כפי שהוכח בניסויים בקופות רזוס[4][8][28][18],[35]. פורסמו שתי עבודות פרוספקטיביות מבוקרות בנשים הצעירות מ-40 עם סרטן שד שקיבלו Analog ל-GnRH, לעומת נשים בקבוצת בקורת שלא קבלו את ה-Analog[18][36][33]. יתרה מזאת, מטא-אנאליזה (Meta-analysis) ממרץ 2009[33] מוכיחה באופן מובהק כי מתן ה-Analog ל-GnRH, במקביל לכימותרפיה, מעלה ב-68 אחוזים את הסיכוי למניעת אי ספיקה שחלתית מוקדמת וב-65 אחוזים את הסיכוי להרות בנשים צעירות אלו, ששרדו את מחלת הסרטן והטיפול בה[8][28][18][36][33].
תוצאות מעודדות חיוביות פורסמו על ידי חוקרים נוספים: Pereyra Pacheco ועמיתיה מארגנטינה, שדווחו על חזרת הפעילות השחלתית בכל 12 הנשים הצעירות בגילאי 16–20 בקבוצת ה-Analog ל-GnRH, לעומת כל ארבע המטופלות בכימותרפיה דומה, באותו גיל, בקבוצת הביקורת שסבלו כולן מ-POF. באופן דומה, דווחו Castelo-Branco ועמיתיו בברצלונה כי 77 אחוזים מהחולות ההמטולוגיות שלהם פיתחו POF בקבוצת הביקורת, לעומת 10 אחוזים בקבוצת הטיפול ב-Analog ל-Mardesic .GnRH וחבי מפראג, צ'כיה, השיגו תוצאות דומות בהגנה על התפקוד השחלתי ומניעת POF בטיפול משולב באנלוגים ל-GnRH אגוניסט ואנטגוניסט, וכן Stern ועמיתיה מאוסטרליה; Recchia ועמיתיו[37] באיטליה וכן Del Mastro [38] ועמיתיה, גם כן באיטליה, פרסמו תוצאות דומות של הגנה מרבית בפני POF בחולות סרטן השד שטופלו ב-Analog ל-GnRH, לעומת קבוצות הביקורת. בדומה, FOX ועמיתיו בארצות הברית הציגו חזרת תפקוד שחלתי בכל חולות סרטן השד שטופלו ב-Analog ל-GnRH[8][28][18][33]. לפחות ארבעה מחקרים PHASE II בסרטן השד הראו את יתרון הטיפול המשולב ב-Analog ל-GnRH, ב-83 עד 96 אחוזים; ישנם כעת לפחות שני מחקרים PHASE III אשר נתנו תשובה חד משמעית לגבי יעילות האגוניסטים[18][32][33].
בקרב האונקולוגים (Oncologists) רווח חשש תאורטי, שמא טיפול ב-Analog ל-GnRH עלול להפחית מיעילות הטיפול הכימותרפי ולהרע את שיעורי ההישרדות. עבודתם של Recchia ועמיתיו, שפורסמה ב-2006 על 100 חולות בסרטן השד שקיבלו גם Analog ל-GnRH בנוסף לכימותרפיה, הראתה שיעור הישרדות כללי של 96 אחוזים ו-91 אחוזים לאחר 5 ו-10 שנים, בהתאמה. בעיתון LANCET פורסמה מטא-אנאליזה של 16 עבודות, שכללו 11,906 חולות, של שימוש ב-Analog ל-GnRH בנשים צעירות עם סרטן שד מסוג חיובי ל-ER (Estrogen Receptor) ו-PR (Progesterone Receptor)[39],[40]. ממצאי מטא-אנאליזה זאת ומטא-אנאליזה נוספת מקבוצת ה-Cochrane[39][40], הראו ששימוש ב-Analog ל-GnRH בנוסף ל-Tamoxifen, כימותרפיה, או שניהם גם יחד, הביא לירידה בהישנות המחלה ב-12.7 אחוזים ולהורדת התמותה, במקרים בהם הייתה הישנות, ב-15.1 אחוזים. מאמרים חשובים אלה מפריכים בבירור ובאופן מוחלט את החששות התאורטיים והבלתי מבוססים דלעיל (0.03=1.8-26.7, P).
בדומה לתוצאותינו החיוביות ב-Analog ל-GnRH בחולות זאבת אדמנתית מערכתית (SLE, Systemic Lupus Erythematosus) המקבלות Cyclophosphamide בפעימות (Pulse cyclophosphamide therapy), מצאו Somers ועמיתיה שמתן Analog ל-GnRH הוריד באופן מובהק את הסיכון לפתח אי ספיקה שחלתית מוקדמת[8],[28],[18][35][41].
שימוש באנטגוניסט במקום באגוניסט ל-GnRH עשוי למנוע את הצורך בהמתנה של שבוע עד 10 ימים, הדרוש על מנת לעבור את ה-Flare Up Effect של האגוניסטים ולהגיע לדה-סנסיטיזציה היפופיזרית ול-Milieu היפוגונדוטרופי. בעוד שמאירוב ועמיתיו מצאו שבמכרסמים האנטגוניסט היה יעיל כמו האגוניסט במניעת הנזק הגונדוטוקסי של Cyclophosphamide, Danforth ועמיתיו פרסמו תוצאות הפוכות; לא רק ששני האנטגוניסטים שנבדקו על ידם לא היו יעילים במניעת הנזק הגונדוטוקסי, האגוניסטים כשלעצמם, אף ללא כימותרפיה, הפחיתו בכמעט 50 אחוזים את מספר הזקיקים ה-Primordial בשחלות העכברות שטופלו בהם. ממצאים אלה יכולים, אולי, להסביר את תוצאות השגת היריון במטופלות הפריה חוץ גופית, שהן ירודות יותר בשימוש באנטגוניסטים בהשוואה לאגוניסטים, לפי מספר לא מועט של עבודות מחקר.
הסברת אופן הפעולה של GnRH-a
בשל מגבלות מקום, לא ניתן לפרט את המידע הרב התומך בהגיון ובמנגנונים המציעים כיצד פועל האגוניסט ל-GnRH למניעת אי ספיקה שחלתית מוקדמת, למרות כימותרפיה. הוצעו חמישה מנגנונים אפשריים:
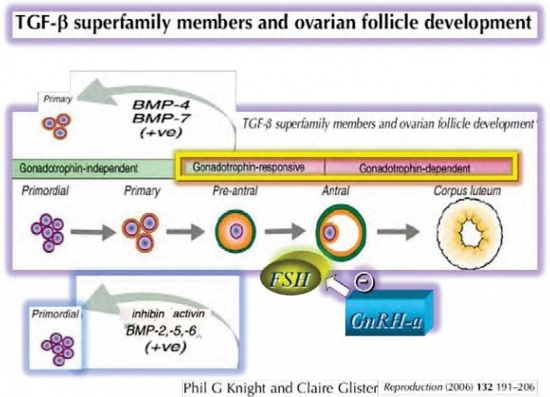
- חיקוי המערך ההורמונלי הפרה-פוברטאלי[8][28][18][35][41]: אמנם, שיעור האי ספיקה השחלתית המוקדמת בילדות ששרדו סרטן בילדות הוא 8 אחוזים[42][34], בדומה לשיעור אי ספיקה שחלתית מוקדמת בנשים בתקופת הפריון שטופלו באגוניסט, לעומת כ-40–50 אחוזים באלו שלא קיבלו אגוניסט במהלך הכימותרפיה[8][28][18],[35][41]. הורדת ריכוז FSH על ידי מתן האגוניסט ימנע מהזקיקים האנטראליים (Antral), התלויים ב- FSH, לשחרר פקטורי גדילה אשר גורמים, באופן פאראקריני, לזקיקים Primordial וראשוניים להיכנס למסלול החד כווני של פוליקולוגנזיס, שיביא להרס שלהם בשל הכימותרפיה[8][28][18][43] (תמונה מספר 1)
- אפקט ישיר של האגוניסט בשחלה: אכן, Imai ועמיתיו מצאו שאגוניסט ל-GnRH מנע In-Vitro נזק כימותרפי לתאי גרנולוזה[44]
- הקטנת זרימת הדם לשחלות, בשל הקטנת הפרשת הEstrogen, ולכן הקטנת הכמות המצטברת שהשחלות נחשפות לה[8][28][18]
- אפקט שחלתי אפשרי על מולקולה כגון ספינגוזין-1-פוספט (Sphingosine-1-phosphate), המונעת אפופטוזיס בשחלה[8][28][18]
- הגנה אפשרית על תא נבט, המאפשר יצירת זקיקים חדשים לאחר שהקודמים נהרסו על ידי הכימותרפיה[8],[28][18]. קיים ויכוח מדעי חריף ונוקב לגבי עצם קיום האפשרות ליצור זקיקים חדשים בשחלות יונקים, דבר הנוגד את התאוריה המקובלת מזה למעלה מחמישים שנים, על פיה כל הזקיקים שאי פעם יבייצו, נוצרו בזמן ההתפתחות העוברית ומאז ועד המנופאוזה יש דלדול מתמיד במספר הזקיקים ובעתודות השחלתיות. קצרה היריעה מלפרט כאן את הטענות של אומרי ההן או המתנגדים לתאוריה זו; נזכיר רק כי בשליש מהחולות שלנו שטופלו בכימותרפיה ובאגוניסט ל-GnRH, נצפו רמות גבוהות ואף מנופאוזליות של FSH בחודשים שלאחר גמר הטיפול, אף בכאלו שהרו ספונטנית לאחר מכן[8],[28][18]. לאחר כ-6–12 חודשים ירדו רמות ה-FSH לנורמה, הופיעו ביוצים ומחזורים סדירים וב-37 נשים אף 52 הריונות ספונטניים[8][28][18]. הדבר יכול, אולי, להצביע על הרס הזקיקים הקיימים, שהביא לרמות FSH גבוהות והזקיקים ה-Primordial (או תאי הגזע ה-Primordial) החלו להבשיל בהדרגה- תהליך שאורך בנשים בין 6 ל-12 חודשים ורק עם הפרשת הורמוני המין ו-Inhibin על ידי הזקיקים המתפתחים, חזרו רמות ה- FSH לנורמה[8][28][18]. דבר זה דורש הוכחה. הקהילה המדעית הופתעה מפרסום שנעשה על ידי קבוצה סינית, התומך בייצור זקיקים De-Novo לאחר הלידה בשחלות מכרסמים- דבר שהחזיר לאור הזרקורים את הוויכוח בעד ונגד אפשרות זו בבני אדם[45]. כנגד כל סיכוי סטטיסטי, הרתה אחת הנשים הצעירות וילדה ספונטנית שתי ילדות בריאות, למרות שתי השתלות מח עצם וכימותרפיה אלימה, תוך מתן מקביל של אגוניסט ל-GnRH[28][18][46]
העניין במניעת אי ספיקה שחלתית מוקדמת והטיפול בהשגת הריונות בנשים צעירות אלו, תופס מקום מרכזי בקהילייה המדעית העולמית וקבוצות רבות עובדות באופן נמרץ למצוא פתרון הולם[18]. שיפור טכנולוגיית ההקפאה על ידי זיגוג (Vitrification) ושיפור טכנולוגיית גידול זקיקים מחוץ לגוף באמצעות מצע תלת ממדי, מעניקים תקווה לאפשרות יישום קליני של טכנולוגיה חדשנית זו בשנים הקרובות. פורסם, כי מידת הנזק השחלתי הנגרם על ידי כימותרפיה תלוי לא רק בגיל ובסוג הכימותרפיה וכמותה[18], אלא גם בפולימורפיזם (Polymorphism) של האנזימים המפרקים תרופות ( Drug-Metabolizing Enzymes). עד אשר יימצא פתרון טוב וישים לכל הנשים העומדות בפני טיפול כימותרפי, חובה עלינו ליידע אותן ולהציע להן את כל האפשרויות הקיימות: הקפאת עוברים ו/או ביציות, הקפאת רקמת שחלה ובמקביל לכימותרפיה גם מתן מקביל של אגוניסט ל-GnRH, להקטנת מדת הנזק השחלתי[47][48],[49][50][51][52].
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 Hoek A, Schoemaker J, Drexhage HA. Premature ovarian failure and ovarian autoimmunity. Endocr Rev. 1997;18:107-34.
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 2.18 2.19 2.20 2.21 2.22 2.23 2.24 2.25 2.26 2.27 2.28 2.29 2.30 2.31 2.32 2.33 2.34 2.35 2.36 2.37 2.38 2.39 2.40 2.41 2.42 2.43 2.44 2.45 2.46 Skillern A, Rajkovic A. Recent developments in identifying genetic determinants of premature ovarian failure. Sex Dev. 2008;2(4-5):228-43.
- ↑ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 3.16 Simpson JL. Genetic and phenotypic heterogeneity in ovarian failure: overview of selected candidate genes. Ann N Y Acad Sci. 2008;1135: 146-54.
- ↑ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 4.20 Goswami D, Conway GS. Premature ovarian failure. Hum Reprod Update. 11(4): 391-410. 2005
- ↑ 5.0 5.1 Krauss CM, Turksoy RN, Atkins L, McLaughin C, Brown L, Page DC Familial premature ovarian failure due to an interstitial deletion of the long arm of the 3 chromosome. N Engl J Med 317:125-131. 1987
- ↑ 6.0 6.1 6.2 6.3 6.4 6.5 Chen YT, Mattison DR, Feigenbaum L, Fukui H, Schulman JD 1981 Reduction in oocyte number following prenatal exposure to a diet high in galactose. Science 214:1145-1147
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 Forges T, Monnier-Barbarino P, Leheup B, Jouvet P. Pathophysiology of impaired ovarian function in galactosaemia. Hum Reprod Update. 2006; 12(5):573-584.
- ↑ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 8.11 8.12 8.13 8.14 8.15 8.16 8.17 8.18 8.19 8.20 8.21 8.22 8.23 8.24 8.25 8.26 Blumenfeld Z, von Wolff M. GnRH-analogues and oral contraceptives for fertility preservation in women during chemotherapy. Hum Reprod Update. 2008 ;14: 543-52. Epub 2008 Sep 29.
- ↑ 9.0 9.1 9.2 9.3 Morrison JC, Givens JR, Wiser WL, Fish SA 1975 Mumps oophoritis: a cause of premature menopause. Fertil Steril 26:655-659
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7 10.8 10.9 Blumenfeld Z, Halachmi S, Peretz BA, et al. Premature ovarian failure-the prognostic application of autoimmunity on conception after ovulation induction. Fertil Steril. 1993;59: 750-5.
- ↑ 11.0 11.1 11.2 Van Kasteren YM, Hoek A, Schoemaker J. Ovulation induction in premature ovarian failure: a placebo-controlled randomized trial combining pituitary suppression with gonadotropin stimulation. Fertil Steril. 1995; 64: 273-8.
- ↑ 12.0 12.1 12.2 Bath LE, Wallace WH, Critchley HO. Late effects of the treatment of childhood cancer on the female reproductive system and the potential for fertility preservation. Br J Ob Gynaecol. 2002; 109:107-14.
- ↑ 13.0 13.1 13.2 13.3 Matzuk MM, Lamb DJ: Genetic dissection of mammalian fertility pathways. Nat Cell Biol. 4 Suppl: s41-s49 (2002).
- ↑ 14.00 14.01 14.02 14.03 14.04 14.05 14.06 14.07 14.08 14.09 14.10 14.11 Simpson JL, Rajkovic A: Ovarian differentiation and gonadal failure. Semin Med Genet 89: 186-200 (1999).
- ↑ Meduri G, Touraine P, Beau I, et al: Delayed puberty and primary amenorrhea associated with a novel mutation of the human follicle-stimulating hormone receptor: clinical, histological, and molecular studies. J Clin Endocrinol Metab 88: 3491-98 (2003).
- ↑ Ottolenghi C, Pelosi E, Tran J, et al: Loss of Wnt4 and Foxl2 leads to female-to-male sex reversal extending to germ cells. Hum Mol Genet 16: 2795- 2804 (2007).
- ↑ 17.0 17.1 Reddy P, Liu L, Adhikari D, et al: Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool. Science 319: 611-613 (2008).
- ↑ 18.00 18.01 18.02 18.03 18.04 18.05 18.06 18.07 18.08 18.09 18.10 18.11 18.12 18.13 18.14 18.15 18.16 18.17 18.18 18.19 18.20 18.21 18.22 18.23 18.24 18.25 18.26 18.27 18.28 18.29 18.30 18.31 18.32 18.33 18.34 18.35 18.36 18.37 18.38 18.39 18.40 18.41 18.42 18.43 18.44 18.45 18.46 18.47 18.48 18.49 18.50 18.51 18.52 18.53 18.54 18.55 18.56 18.57 18.58 18.59 18.60 18.61 18.62 18.63 18.64 18.65 18.66 18.67 18.68 18.69 18.70 18.71 18.72 18.73 Blumenfeld Z. Premature ovarian failure: etiology and possible prevention. Expert Review in Endocrinol Metabolism 4:173-181 (2009).
- ↑ 19.0 19.1 Ledig S, Ropke A, Haeusler G, Hinney B, Wieacker P: BMP15 mutations in XX gonadal dysgenesis and premature ovarian failure. Am J Obstet Gynecol 198: 84.e1-5 (2008).
- ↑ 20.0 20.1 Zhao H, Chen Z, Qin Y, Shi Y, Wang S, et al: Transcription factor FIGLA is mutated in patients with premature ovarian failure. Am J Hum Genet 82: 1342-1348 (2008).
- ↑ 21.0 21.1 Anderson RA, Fulton N, Cowan G, Coutts S, Saunders PT: Conserved and divergent patterns of expression of DAZL, VASA and OCT4 in the germ cells of the human fetal ovary and testis. BMC Dev Biol 18: 136 (2007).
- ↑ Chang SH, Kim CS, Lee KS, et al. Premenopausal factors influencing premature ovarian failure and early menopause. Maturitas. 2007 Sep 20;58(1):19-30.
- ↑ Matikainen T, Perez GI, Jurisicova A , et al. Aromatic hydrocarbon receptor-driven Bax gene expression is required for premature ovarian failure caused by biohazardous environmental chemicals. Nat Genet. 2001; 28: 355-60.
- ↑ 24.0 24.1 24.2 Hoyer PB, Devine PJ, Hu X, Thompson KE, Sipes IG. Ovarian toxicity of 4-vinylcyclohexene diepoxide: a mechanistic model. Toxicol Pathol. 2001; 29(1):91-9.
- ↑ 25.0 25.1 Crain DA, Janssen SJ, Edwards TM, et al. Female reproductive disorders: the roles of endocrine-disrupting compounds and developmental timing. Fertil Steril. 2008; 90(4):911-40.
- ↑ Pires ES, Meherji PK, Vaidya RR, Parikh FR, Ghosalkar MN, Khole VV. Specific and sensitive immunoassays detect multiple anti-ovarian antibodies in women with infertility. J Histochem Cytochem. 2007; 55:1181-90.
- ↑ 27.0 27.1 Badawy A, Goda H, Ragab A. Induction of ovulation in idiopathic premature ovarian failure: a randomized double-blind trial. Reprod Biomed Online. 2007; 15: 215-9.
- ↑ 28.00 28.01 28.02 28.03 28.04 28.05 28.06 28.07 28.08 28.09 28.10 28.11 28.12 28.13 28.14 28.15 28.16 28.17 28.18 28.19 28.20 28.21 Blumenfeld Z. GnRH-agonists in fertility preservation. Curr Opin Endocrinol Diabetes and Obesity. 2008;15: 523-8.
- ↑ 29.0 29.1 29.2 American cancer society. Cancer facts and figures 2005. Atlanta: American cancer society; 2005.
- ↑ 30.0 30.1 Nieman CL, Kazer R, Brannigan RE, et al. Cancer Survivors and Infertility: A Review of a New Problem and Novel Answers. J Support Oncol 2006;4:171-178
- ↑ Marhhom E, Cohen I. (2007) Fertility preservation options for women with malignancies. Obstet Gynecol Surv 62, 58-72.
- ↑ 32.0 32.1 Beck-Fruchter R, Weiss A, Shalev E. GnRH agonist therapy as ovarian protectants in female patients undergoing chemotherapy: a review of the clinical data. Hum Reprod Update. 2008; 14(6):553-61.
- ↑ 33.0 33.1 33.2 33.3 33.4 33.5 33.6 33.7 Clowse ME, Behera MA, Anders CK, et al. Ovarian preservation by GnRH agonists during chemotherapy: a meta-analysis. J Womens' Health (Larchmt). 2009; 18: 311-9.
- ↑ 34.0 34.1 Sklar CA, Mertens AC, Mitby P, Whitton J, Stovall M, Kasper C, et al. Premature menopause in survivors of childhood cancer: a report from the childhood cancer survivor study. J Natl Cancer Inst. 2006; 98: 890-6.
- ↑ 35.0 35.1 35.2 35.3 35.4 Blumenfeld Z., Avivi I, Eckman A, et al. Gonadotropin Releasing Hormone Agonist Decreases Chemotherapy Induced Gonadotoxicity and Premature Ovarian Failure in Young Female Patients With Hodgkin Lymphoma. Fertil Steril. 2008; 89:166-73. Epub 2007 Jun 28.
- ↑ 36.0 36.1 Badawy A, Elnashar A, El-Ashry M, Shahat M. Gonadotropin-releasing hormone agonists for prevention of chemotherapy-induced ovarian damage: prospective randomized study. Fertil Steril 2009;91:694-7.
- ↑ Recchia F, Saggio G, Amiconi G, et al. Gonadotropin-releasing hormone analogues added to adjuvant chemotherapy protect ovarian function and improve clinical outcomes in young women with early breast carcinoma. Cancer 2006; 106: 514-23.
- ↑ Del Mastro L, Catzeddu T, Boni L, et al: Prevention of chemotherapy-induced menopause by temporary ovarian suppression with goserelin in young early breast cancer patients. Ann Oncol 17:74-78, 2006.
- ↑ 39.0 39.1 Cuzick J, Ambroisine L, Davidson N et al.; LHRH-agonists in Early Breast Cancer Overview group. Use of luteinising-hormone-releasing hormone agonists as adjuvant treatment in premenopausal patients with hormone receptor-positive breast cancer: A meta-analysis of individual patient data from randomised adjuvant trials. Lancet 2007; 369:1711-23.
- ↑ 40.0 40.1 Sharma R, Hamilton A, Beith J. LHRH agonists for adjuvant therapy of early breast cancer in premenopausal women. Cochrane Database Syst Rev. 2008 Oct 8;(4): 2008 CD004562.
- ↑ 41.0 41.1 41.2 Blumenfeld Z. How to preserve fertility in young women exposed to chemotherapy? The role of GnRH agonist cotreatment in addition to cryopreservation of embrya, oocytes, or ovaries. The Oncologist. 2007; 12:1044-54.
- ↑ Edgar AB, Wallace WHB. Pregnancy in women who had cancer in childhood. European Journal of Cancer 2007; 43:1890 -94.
- ↑ Knight PG, Glister C. TGF-beta superfamily members and ovarian follicle development. Reproduction 132,191-206. (2006)
- ↑ Imai A, Sugiyama M, Furui T, Tamaya T, Ohno T. (2007) Direct Protection by a Gonadotropin-Releasing Hormone Analog from Doxorubicin-Induced Granulosa Cell. Damage. Gynecol Obstet Invest. 63,102-106.
- ↑ Tilly JL, Niikura Y, Rueda BR. The current status of evidence for and against postnatal oogenesis in mammals: a case of ovarian optimism versus pessimism? Biol Reprod. 2009; 80: 2-12.
- ↑ Blumenfeld Z, Benaroush M, Zuckerman T. Spontaneous pregnancy and normal delivery after repeated autologous bone marrow transplantation and GnRH agonist treatment. Hum Reprod 2007; 22:2346.
- ↑ Sklar CA, Mertens AC, Mitby P, et al. Premature menopause in survivors of childhood cancer: a report from the childhood cancer survivor study. J Natl Cancer Inst. 2006 Jul 5; 98:890-6.
- ↑ Kerr CL, Hill CM, Blumenthal PD, Gearhart JD: Expression of pluripotentic stem cell markers in the human fetal ovary. Hum Reprod 23: 589-599 (2008).
- ↑ Sverrisdottir A, Nystedt M, Johansson H, Fornander T. Adjuvant goserelin and ovarian preservation in chemotherapy treated patients with early breast cancer: results from a randomized trial. Breast Cancer Res Treat. Published online January 20, 2009.
- ↑ Ataya K, Rao LV, Laurence E, Kimmel R. (1995) Luteinizing hormone-releasing agonist inhibits cyclophosphamide induced ovarian follicular depletion in Rhesus monkeys. Biol Reprod 52, 365-372.
- ↑ Moore HCF. Ovarian Failure after Chemotherapy for Breast Cancer and the Role of Gonadotropin-releasing Hormone Analogs in Protection of Ovarian Function. ASCO Educational Book Spring 2008; 39 - 42.
- ↑ Su HI, Sammel MD, Velders L et al. Association of cyclophosphamide drug-metabolizing enzyme polymorphisms and chemotherapy-related ovarian failure in breast cancer survivors. Fertil Steril. 2009 Apr 17. [Epub ahead of print]
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ"ח זאב בלומנפלד, הפקולטה לרפואה, הטכניון והקריה הרפואית לבריאות האדם רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק