בירור וטיפול בחולים עם ברונכיאקטזיות שאינן סיסטיק פיברוזיס - נייר עמדה
|
| |
|---|---|
| בירור וטיפול בחולים עם ברונכיאקטזיות שאינן סיסטיק פיברוזיס | |
| האיגוד המפרסם | האיגוד הישראלי לרפואת ריאות האיגוד הישראלי לרפואת ריאות ילדים - חיפ"פ |
| קישור | באתר הר"י |
| תאריך פרסום | ינואר 2017 |
| יוצר הערך | ד"ר מיכל שטיינברג ד"ר אמיליה חרדאק |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
מבוא
מחלת הברונכיאקטזיות מוגדרת אנטומית על ידי התרחבות בלתי הפיכה של הסימפונות, וקלינית מאופיינית בשיעול ופליטת ליחה עם נטייה לזיהומים חיידקיים. בניגוד לאסתמה -COPD, בהן במשך שנים נאסף מידע אודות מאפיינים וכן יעילות טיפולים סגוליים, מחלת הברונכיאקטזיות לא נחקרה די. בשנים האחרונות זוכה מחלת הברונכיאקטזיות לתשומת לב מחודשת בקרב קהילת רופאי הריאות, והיא נושא למחקרים בסיסיים וקליניים רבים.
בישראל לא קיימים טיפולים רשומים במשרד הבריאות ובסל הבריאות למחלת הברונכיאקטזיות עובדה המקשה על הרופאים המטפלים לתת טיפול מיטבי לחולים. מטרת מסמך זה הינה לפרט את המלצות איגודי רופאי הריאות וריאות- ילדים לגבי בירור וטיפול בחולים עם ברונכיאקטזיות ריאתיות שאינן מסיסטיק פיברוזיס. סיכום ההמלצות מופיע בתחילת המסמך, פירוט הממצאים עבור כל סעיף מופיע בהמשך.
סיכום ההמלצות
- מאפיינים קליניים
- יש לחשוד בברונכיאקטזיות בחולים עם שיעול יצרני ממושך ו/או זיהומים חוזרים בריאות.
- יש לחשוד בברונכיאקטזיות גם בחולים עם מחלת ריאות חסימתית כרונית (COPD) עם המאפיינים לעיל.
- בירור ואבחון - בירור אטיולוגי של מחלה ברונכיאקטטית
- מטרת הבירור האטיולוגי הינה לזהות מחלות בעלות טיפול סגולי, או הניתנות לאבחון גנטי מוקדם אצל בני המשפחה.
- יש לבצע בדיקות סקר לבירור אטיולוגי לכלל החולים.
- בדיקות נוספות יבוצעו רק בחולים בעלי מאפיינים למחלות מסוימות כמו סיסטיק פיברוזיס, Primary Ciliary Dyskinesia, ובכל הילדים עם ברונכיאקטזיות.
- סיכום ההמלצות בטבלה 1 במסמך זה.
- התוויות לברונכוסקופיה
- בחולים עם ברונכיאקטזיס ממוקדות ברונכוסקופיה מומלצת לשלילת חסימה אנדוברונכיאלית או גוף זר.
- מומלץ לבצע ברונכוסקופיה עם שטיפות אם HRCT מעלה חשד לזיהום במיקובקטריה לא שחפתית (NTM) ותרבית כיח למיקובקטריה שלילית.
- במבוגרים יש לשקול ביצוע ברונכוסקופיה עם שטיפות לתרבית בהיעדר תגובה קלינית ובחולה תסמיני כאשר תרביות הכיח עקרות. אין מקום לברונכוסקופיה לצורך ביצוע תרבית כיח שגרתית בחולים מכייחים.
- בילדים, מומלץ לבצע ברונכוסקופיה ושטיפות ברונכו- אלבאולריות (BAL) עם ברונכיאקטזיות, כאשר לא ניתן לקבל דגימות כיח טובות או כאשר תרביות כיח, כולל בדיקת כיח מגורה עקרות.
- ניטור פעילות המחלה
תרבית ליחה
- בחולים עם ברונכאקטזיות נדרשת הערכה מיקרוביולוגית עם תרביות ליחה ובדיקת רגישות לתכשירים אנטיביוטיים לפתוגנים מהכיח.
- ממצא של סטפילוקוק זהוב, פסיאודומונס אאורגינוזה או המצאות של אספרגילוס פומיגטוס בצמיחות חוזרות מחייב בירור לכיוון CF או ABPA.
- מומלץ באבחנה, ובכל החמרה קלינית לשלוח תרבית ליחה. יש לעקוב באופן שגרתי אחר תרביות הכיח בכל מקרה של ברונכאקטזיות.
- יש לדאוג שדגימות הליחה יגיעו תוך 3 שעות מלקיחתם למעבדה[1].
- בחולים שאינם מכייחים בדיקת כיח מגורה יכולה להיות יעילה יותר מבדיקת כיח רגילה לצורך זיהוי פתוגנים.
- מיקנבקטריה שאינה שחפתית - Non Tuberculous Mycobacterium NTM
- יש לחשוד במחלת NTM פעילה בחולים עם תסמינים למרות טיפול, במיוחד כאשר קיימת ירידה במשקל.
- יש לקחת תרביות למיקובקטריה בעת האבחון, אחת לשנה וכאשר מתעורר חשד קליני למחלת NTM.
- צמיחה של NTM בתרבית ליחה אינה כשלעצמה מחייבת טיפול, בעיקר בזנים הפחות אלימים ויש לפעול לפי הקריטריונים של ה-ATS.
- תפקודי ריאות
- יש לבצע ספירומטריה בכל חולה עם אבחנה של ברונכיאקטזיות, ולבדוק תגובתיות למרחיבי סימפונות בעת האבחנה. יש לחזור על ספירומטריה לפחות פעם בשנה, ובילדים לפחות פעם בשלושה חודשים.
- חולה עם כשל חיסוני או PCD צריך לבצע ספירומטריה לפחות 4 פעמים בשנה. מומלץ לבצע בדיקת הפיכות בעיקר בצעירים בכדי לקבוע תגובה למרחיבי סימפונות.
- יש מקום לספירומטריה לפני ואחרי טיפול אנטיביוטי תוך ורידי (מדד אובייקטיבי לשיפור).
- מומלץ לבצע בדיקת ספירומטריה ונפחי ריאה בכל חולה לפני ואחרי מתן טיפול אנטיביוטי ממושך (באנהלציה או פומי).
- בתינוקות ניתן להעריך את תפקודי הריאה על ידי בדיקת baby box.
- הערכת החומרה של מחלה ברונכיאקטטית
- יש להעריך בכל חולה את החומרה של מחלת הברונכיאקטזיות על מנת לנבא את הסיכון לתמותה ולהתלקחויות ולהתאים טיפול (טבלה 2 ותמונה 1).
- טיפול בברונכיאקטזיות - הטיפול הכרוני
- כללי - חיסונים
- מומלץ כי חולים עם ברונכיאקטזיות יחוסנו כמקובל בחיסון כנגד שפעת וכנגד פנאומוקוק.
- ניקוז ריאתי - "פיזיותרפיה נשימתית"
- מומלץ כי הטיפול בחולי ברונכיאקטזיות יכלול הפניה לפיזיותרפיסט הבקי בשיטות ניקוז ריאתי ושיקום נשימתי לצורך ביצוע טיפולי פיזיותרפיה באופן סדיר.
- מומלץ כי חולים עם ברונכיאקטזיות ושיעול יצרני ילמדו טכניקות של ניקוז ריאתי.
- מומלץ כי חולים עם שיעול יצרני והתלקחויות תכופות יבצעו טכניקות ניקוז ריאתי מידי יום באופן סדיר.
- בתינוקות וילדים קטנים מומלץ שההורים יילמדו טכניקות וייבצעו את הפיזיותרפיה בבית, בקטנים לפחות 5ו דקות ליום ובגדולים 30 דקות.
- בהתאם לחומרה ניתן לשקול שילוב של תכשיר עזר לניקוז ריאתי כגון מכשיר לחץ חיובי סוף נשיפתי (Positive Expiratory Pressure - PEP) או oPEP) Oscillating - PEP) או (Intrapulmonary Percussive Ventilation (IPV או VEST.
- מכייחים
- חולי ברונכיאקטזיות עם שיעול ופליטת ליחה כרוניים יטופלו במכייח באופן קבוע. התכשירים היעילים יותר הם סליין היפרטוני ומניטול. בחולה שלא סובל תכשירים אלו ניתן לשקול מתן סליין איזוטוני.
- ניסיון לטיפול בסליין היפרטוני או במניטול יבוצע לראשונה במרפאה מחשש לתגובה של ברונכוספזם.
- מתן אנטיביוטיקה פומי באופן ארוך טווח
- אנו ממליצים על מתן כרוני של אזיתרומיצין בחולי non CF BE אשר חווים שתי החמרות ומעלה בשנה או הידרדרות מהירה בתפקודי הנשימה. ניתן לשקול מתן אזיתרומיצין גם בחולים עם פליטת כיח מרובה מידי יום גם בהיעדר התלקחויות חריפות. אנו ממליצים להוסיף מאקרולידים רק לאחר טיפול בניקוז ריאתי ובמכייחים למשך 3 חודשים ובאם טיפול זה לא הביא לשיפור מספק.
- בילדים מקובל לתת מאקרולידים כקו טיפולי ראשון כטיפול אנטי דלקתי.
- המינון המומלץ בחולים מבוגרים (פרט לחולי סיסטיק פיברוזיס) הוא 500-250 מ"ג 3 פעמים בשבוע או 250 מ"ג ליום. בילדים: 10 מג לק"ג בקטנים ו-250 בילדים גדולים יותר (מעל 25 ק"ג).
- על מנת להקטין את הסיכון לתופעות לוואי הכרוכות בטיפול ממושך באזיתרומיצין יש לבצע:
- אק"ג, כולל מדידת QT, וביצוע אק"ג לביקורת אחת לשנה.
- שלילת מחלת לב משמעותית (אי ספיקת לב סיסטולית, מחלה כלילית לא מטופלת) ומחלת כבד.
- נטילת תרבית כיח למיקובקטריה, על מנת לשלול נשאות או זיהום במיקובקטריה שאינה שחפתית, מצב המהווה התווית נגד לטיפול במאקרוליד כטיפול יחיד.
- יש לבצע בדיקת שמיעה בטרם טיפול וניטור שמיעה אחת לשנה.
- קיימות עדויות על תועלת בטיפול ארוך טווח במינון נמוך של אנטיביוטיקה שאינה מאקרוליד.
- אנטיביוטיקות בשאוף
- אנו ממליצים על טיפול באנטיביוטיקה בשאוף לחולים עם זיהום חדש או כרוני בפסאודומונס.
- בעת התחלת טיפול מומלץ לבצע את המתן הראשון תחת השגחה רפואית על מנת לצפות ולטפל בתופעת ברונכוספזם.
- טיפול באמצעות מרחיבי סמפונות, משאפי סטרואידים ובאופן משולב
- לאור הנתונים הקיימים אין מידע שתומך בטיפול גורף על ידי מרחיבי סמפונות, סטרואידים או טיפול משולב בחולים עם ברונכיאקטזיות.
- במידה ומדובר בשילוב של ברונכיאקטזיות ותגובתיות יתר של דרכי נשימה או אסטמה, לצורך שיפור קליני ניתן להשתמש בטיפול הכולל משאפים סטרואידלים.
- בשילוב עם מחלת COPD עם התלקחויות חוזרות ניתן לשקול תוספת משאף סטרואידלי.
- שיקום נשימתי
- אנו ממליצים לכלול חולי ברונכיאקטזיות אשר מציגים מוגבלות בפעילות גופנית בתכניות שיקום נשימתי אחת לשנה. זאת בנפרד מההמלצה על ניקוז נשימתי ("פיזיותרפיה נשימתית").
- טיפול ניתוחי בברונכיאקטזיות
- הטיפול מומלץ אך ורק בחולים עם ברונכיאקטזיות ממוקמות לסגמנט או אונה אחת.
- ניתוח להוצאת ברונכיאקטזיות הוא אחד מהטיפולים האפשריים רק לאחר שמוצו טיפולים תרופתיים לא פולשניים, אמבוליזציה ושיקום נשימתי.
- הפעולה כרוכה בסיבוכים גבוהים במיוחד אצל חולים מבוגרים עם ירידה בתפקודי ריאות ומחלות רקע ובנוכחות תהליך זיהומי פעיל.
- חולים צעירים סימפטומטיים (שיעול, כמויות גדולות של כיח) במצב בריאותי ותפקודי טוב ועם ברונכיאקטזיות ממוקדות, יכולים ליהנות מתוצאות הניתוח עם סיכון נמוך לתמותה ושיפור משמעותי באיכות החיים.
- הפעולה אמורה להתבצע לפי שיקול דעת ויכולת המנתח להוציא את האזור הפגוע בשלמותו.
- בחולים עם מחלה ידועה כמו CF, PCD או חסר חיסוני יש לשקול היטב את הפעולה מאחר והברונכייקטזיס עלול להופיע באזורים אחרים בריאה.
- השתלת ריאות היא טיפול בחולים עם מחלה מתקדמת לאחר כישלון יתר הטיפולים.
- התאמת הטיפול לחולה
- מומלץ כי בחירת הטיפול לחולה תתבסס על הערכה של חומרת מחלתו, על פי מדד חומרה מקובל וקיום זיהום כרוני בחיידקים בכיח (טבלה מס' 1 ותמונה מס' 1).
- מניעת העברת זיהומים
- יש לזהות את החולים עם זיהום כרוני בפסאודומונס בקרב מרפאות NCFBE.
- במידת האפשר יש לבודד חולים עם זיהום בפסאודומונס וחיידקים עמידים אחרים (,MRSA ESBL producing) מחולי ברונכיאקטזיות אחרים. שיטות אפשריות הם שעות מרפאה נפרדות, וקביעת תור בסוף יום מרפאה.
- מיגור זיהום חדש בפסאודומונס
- בחולים שלהם תרבית ליחה עם צמיחה של פסאודומונס ובנוכחות תרביות כיח קודמות ללא פסאודומונס אנו ממליצים על ניסיון לארדיקציה תוך פרק זמן קצר ככל האפשר.
- פרוטוקולים אפשריים הם ציפרופלוקסצין, 750 מ"ג פעמיים ביום (5ו מג לק"ג פעמיים ביום בילדים) למשך שבועיים, עם או ללא תוספת של אנטיביוטיקה נוגדת פסאודומונס בשאוף (בעיקר אמינוגליקוסידים כטוברמיצצין גנטמיצין ואמיקצין. במקרים בהם החיידק עמיד או כאשר חומרת המחלה קשה, יש לשקול טיפול באנטיביוטיקה אחת או שתיים כנגד פסאודומונס במתן תוך ורידי.
- מומלץ על ניסיון נוסף לחזור על ניסיון טיפולי במידה ולאחר הניסיון הראשון יש צמיחה חוזרת של פסאודומונס.
- טיפול בהתלקחויות של מחלה ברונכיאקטטית
- סימני התלקחות ריאתית כוללים עליה בכמות הליחה, שינוי בצבע הליחה, עליה בשיעול, קשיי נשימה, חום ועייפות.
- יש לזהות התלקחות של ברונכיאקטזיות ולקחת תרבית ליחה ותרבית מיקובקטריה בהתחלת ההתלקחות באם לא נלקחה בחצי השנה האחרונה.
- יש להגביר את טיפול הבסיס (ניקוז ריאתי, מכייחים וכד') בעת ההתלקחות החריפה.
- משך הטיפול האנטיביוטי המומלץ הוא לפרק זמן של לפחות שבועיים.
- הטיפול האנטיביוטי מכוון על פי רגישות של חיידק מתרביות כיח קודמות של המטופל, וניסיון טיפולים קודמים באותו מטופל.
- בהתקבל תשובת תרבית ורגישות של ההחרפה הנוכחית לשקול לשנות טיפול בהתאם לפרופיל הרגישות אם אין הטבה קלינית.
- אם לא נמצאה צמיחה בתרביות ליחה קודמות לתת טיפול בביתא - לקטאם, כמו אמוקסיצילין 500 מ"ג 3 X ליום (בילדים, במינון של 40-60 מג לק"ג מחולק ל 2 מנות), או אמוקסיצילין - קלוולנט, 875 מ"ג פעמיים ביום (בילדים, במינון של 40-60 מג לק"ג מחולק ל-2 מנות), או בקלינדמיצין או מאקרוליד, על פי השיקול הקליני.
- אם ידוע על זיהום בפסאודומונס בעבר לתת טיפול על פי רגישות- בקוינולונים או באנטיביוטיקה דרך הוריד, באשפוז או בבית המטופל אם ניתן.
מאפיינים קליניים
שכיחות ברונכיאקטזיות אינה ידועה. הערכות שונות נעות בין 50 ל-1,000 חולים ל-100,000[1], [2], ונמצא כי היא עולה בהדרגה בשכיחות של כתשעה אחוזים בשנה. מחקר בבריטניה מצא כי שכיחות מחלה ברונכיאקטטית היא כ-0.5% מהאוכלוסייה[3]. המחלה שכיחה יותר בקרב נשים ושכיחותה עולה עם הגיל. תסמיני המחלה הם שיעול ופליטת ליחה כרונית, ובמקרים מתקדמים - גם קוצר נשימה במאמץ. מקרים קלים של ברונכיאקטזיות עשויים להתגלות באופן אקראי ב-CT אולם להיות מחוסרי תסמינים לחלוטין. מהלך המחלה מתאפיין בהחמרה הדרגתית לאורך שנים, עם אירועים של החרפות זיהומיות. אירועים אלו מאופיינים על ידי התגברות השיעול, עליה בכמות הליחה ושינוי צבע הליחה. לעתים מביאה החמרה לזיהום מערכתי המתבטא בתסמינים מערכתיים כמו חולשה ועייפות, ולעתים (במיעוט המקרים) עליה בחום הגוף.
נמצא, כי בחולי COPD קיימות ברונכיאקטזיות בשיעור הנע בין 5 ל 50% על פי CT[4].
תחלואה מברונכיאקטזיות משתנה בין תחלואה קלה המתבטאת בשיעול בלבד, לבין מחלה מתקדמת המתאפיינת בהתלקחויות מרובות הדורשות אשפוזים תכופים.
- המלצות
- יש לחשוד בברונכיאקטזיות בחולים עם שיעול יצרני ממושך או זיהומים חוזרים בריאות.
- יש לחשוד בברונכיאקטזיות גם בחולים עם מחלת ריאות חסימתית כרונית (COPD) עם המאפיינים לעיל.
בירור ואבחון
אבחון רדיולוגי של ברונכיאקטזיות
טומוגרפיה ממוחשבת (CT) היא צורת הבדיקה המועדפת כיום לאבחון ברונכיאקטזיות. רמזים לקיום המחלה עשויים להתגלות בצילום חזה אולם הרגישות אינה גבוהה. מאפייני ברונכיאקטזיות ב-CT כוללים[5]:
- קוטר סמפון גדול מקוטר כלי הדם המלווה אותו
- היעדר היעלמות הדרגתית של סמפונות בהיקף הריאה
- הימצאות סמפונות בהיקף הריאה - ב-1 ס"מ ההיקפי של רקמת הריאה.
CT ברזולוציה גבוהה (High Resolution CT- HRCT) עם אבחון ברונכיאקטזיות מושגת גם ב-CT בקרינה נמוכה (low dose) ועל כן זוהי בדיקת סקירה מומלצת לגילוי מחלה ברונכיאקטטית.
בירור אטיולנגי של מחלה ברונכיאקטטית
ברונכיאקטזיות עשויות לנבוע ממגוון תהליכים הפוגמים בתגובה החיסונית או הדלקתית או בפינוי הכיח מדרכי הנשימה. בסדרות אשר סקרו סיבות לברונכיאקטזיות נמצא, כי בכמחצית מהמקרים לא ניתן לקבוע את סיבת המחלה (אידיופאתי), ובכרבע נוסף מיוחסת המחלה לזיהום עבר. יתר המקרים נחלקים בין מחלות כשל חיסוני, מחלות רקמת חיבור, מחלות דלקתיות ואחרות[6]. מטרת הבירור האטיולוגי היא לקבוע האם ישנו תהליך בעל משמעות טיפולית למטופל או למשפחה, או אם מדובר במחלה תורשתית הניתנת למניעה ואבחון מוקדם על ידי סקר גנטי בבני המשפחה.
בבירור האטיולוגיה, ממליצים קווים מנחים מ-2010 על בירור ראשוני לכלל החולים ובירור מעמיק יותר במקרים מיוחדים. על סמך הנחיות אלו ומחקרים נוספים אשר התפרסמו לאחר מכן, המלצותינו לבירור הן:
- בכל החולים - רמת נוגדנים IgA, IgG, IgM וגם תת קבוצות של IgG
- בכל החולים - רמת IgE. אם מוגברת (מעל 1000 במבוגרים, 500 בילדים) יש לבדוק קיום ABPA (Allergic Bronchopulmonary Aspergillosis) על ידי ביצוע תבחיני עור או RAST או Aspergillus specific IgE
- בחולים עם התייצגות מתחת גיל 40, היסטוריה של נישואי קרובים, מאפיינים חוץ ריאתיים של סיסטיק פיברוזיס (דלקות לבלב, סינוסיטיס, אי פוריות גברית) יש לשלול סיסטיק פיברוזיס. בדיקת סקירה היא תבחין זיעה, וגנטיקה ל CF. רמה גבוהה מ 60 מא"ק/ ליטר בשתי בדיקות בנוכחות קליניקה מתאימה אבחנתית ל CF. רמות כלוריד בין 30 ל 60 מא"ק/ ליטר בנוכחות קליניקה מתאימה מחייבות המשך בירור במרכז CF[7].
- בחולים בהם תפקוד הלבלב שמור תבחין הזיעה יכול להיות גבולי או אפילו תקין ולכן יש להשלים את הברור בכל מקרה באמצעות בדיקות נוספות כולל פוטנציאל רירית האף (NPD), שהיא פתולוגית בחולי CF וסקירת מוטציות ל CFTR השכיחות באוכלוסיה הישראלית. יש להביא בחשבון שחולי CF עם התייצגות אטיפית יכולים לשאת מוטציות נדירות שאינן נבדקות בפאנל הקיים ויש לשקול ריצוף גן ה CFTR ובדיקה לחסרים והכפלות במיוחד בחולים בהם נמצאה מוטציה אחת פתוגנית
- בחולים עם התייצגות מתחת גיל 40, היסטוריה של נישואי קרובים, היסטוריה של תחלואה נשימתית סב-לידתית, מאפיינים חוץ ריאתיים (נזלת כרונית, דלקות אוזניים פורולנטיות, היפוך איברים, סינוסיטיס, אי פוריות גברית) יש לחשוד ב- PCD) primary ciliary dyskinesia). בדיקת סקירה היא nasal NO, כאשר ערכים מתחת 77 200 ppB) nl/min) הם פתולוגיים[8]. ישנם מקרים של NASAL NO - FALSE NEGATIVE- לכן, במקרים מאוד חשודים לPCD, יש לשקול ביצוע בדיקות נוספות כגון ביופסייה ציליארית, הסתכלות במיקרוסקופ אור, בדיקה במיקרוסקופ אלקטרונים (EM) וגנטיקה (בדיקת אקסום מומלצת). בדיקות אלו מבוצעות במרכזים מעטים
- בקרב אוכלוסיית הילדים ובמקרים אחרים של חשד לכשל חיסוני (קומה נמוכה, עיוות תווי הפנים, היעדר תימוס בצעירים, פגמים בלב, זיהומים חוזרים, ו/או ספור משפחתי) יש להפנות לבדיקות מתקדמות של תפקוד מערכת החיסון גם במקרה שבדיקות הנוגדנים הן תקינות[9], [10]. כמו כן יש להפנות לבדיקת HIV אם מתעורר חשד למחלה זו
- בירור לחסר A1AT (Alpha 1 antitrypsin) בחולים בהם יש אמפיזמה ב CT או שיש בני משפחה עם חסר A1AT
- בחולים עם מאפיינים קליניים של מחלות רקמת חיבורANA, RF, SSA, SSB antibodies
- סיכום הבירור האבחנתי המומלץ - בטבלה מס' 1
- מטרת הבירור האטיולוגי היא לזהות מחלות בעלות טיפול סגולי, או הניתנות לאבחון גנטי מוקדם אצל בני המשפחה
- יש לבצע בדיקות סקר אצל כלל החולים
- בדיקות נוספות יבוצעו רק בחולים בעלי מאפיינים למחלות מסוימות כמו סיסטיק פיברוזיס, Primary Ciliary Dyskinesia, ובכל הילדים עם ברונכיאקטזיות
התוויות לברונכוסקופיה
לברונכוסקופיה בחולי ברונכיאקטזיות מס' התוויות: ראשית, בכל מקרה של ברונכיאקטזיות ממוקדת למקום אחד (Localised) נדרשת ברונכוסקופיה לשלילת גוף זר או ממצא אנדוברונכיאלי[6].
התוויה נוספת היא לצורך זיהוי פתוגנים בדרכי האוויר. מחקר אחד בלבד בדק את התועלת בברונכוסקופיה במבוגרים עם מחלה יציבה ובו נמצא כי אין כל יתרון לברונכוסקופיה על פני דגימת כיח לתרבית. מנגד, שטיפות ברונכיאליות יכולות לתת מענה איכותי יותר וכמותי בעיקר במדוכאי חיסון עם מחלה ברונכיאקטטית[11].
בנוסף, בחשד לחיידק מיקובקטריאלי (NTM) עפ"י סיטי חזה (כגורם לברונכאקטזיות) אם אין זיהוי מיקובקטריה בכיח, מומלץ לבצע ברונכוסקופיה עם שטיפות שהיא יעילה יותר מתרביות רגילות לכיח[12]. ביופסיות טרנס ברונכיאליות משפרות את יעילות האבחנה על ידי זיהוי גרנולומות[13].
בדיקה ציטולוגית מנוזל שטיפה מברונכוסקופיה יכול לאתר מאקרופגים עמוסי שומן ולרמז בכך על אספירציות כאטיולוגיה.
- המלצות
- בחולים עם ברונכיאקטזיס ממוקדות ברונכוסקופיה מומלצת לשלילת חסימה אנדוברונכיאלית או גוף זר.
- מומלץ לבצע ברונכוסקופיה עם שטיפות אם HRCT מעלה חשד לזיהום במיקובקטריה לא שחפתית (NTM) ותרבית כיח למיקובקטריה שלילית.
- במבוגרים יש לשקול ביצוע ברונכוסקופיה עם שטיפות לתרבית בהיעדר תגובה קלינית ובחולה תסמיני כאשר תרביות הכיח עקרות. אין מקום לברונכוסקופיה לצורך ביצוע תרבית כיח שגרתית בחולים מכייחים.
- בילדים, מומלץ לבצע ברונכוסקופיה ושטיפות ברונכו-אלבאולריות (BAL) עם ברונכיאקטזיות, כאשר לא ניתן לקבל דגימות כיח טובות או כאשר תרביות כיח, כולל בדיקת כיח מגורה עקרות.
ניטור פעילות המחלה
- תרבית ליחה
בין המחוללים הטיפוסיים הנמצאים בכיח של חולי ברונכיאקטזיות - ,H influenza, S aureus S pneumonia, P aeruginosa וכן מיקובקטריה שאינן שחפתיות[14], [15]. בגלל הרגישות השונה של אנטיביוטיקה במצבים הללו נדרשת תרבית ליחה. פתוגנית שכיחים נוספים כוללים סטרפ פנאומניה, סטפילוקוק אארוס ומיקופלסמה פנוימוניה. באחוזים בודדים ניתן למצוא אספרגילוס.
זיהום בסטפילוקוק זהוב קשור בשכיחות גבוהה לסיסטיק פיברוזיס ו- ABPA[16]. פסאודומנס נמצא בקורלציה עם מחלה יותר קשה קלינית, הידרדרות מהירה בתפקוד הריאה והחמרות תכופות[17].
צמיחה בתרבית ליחה אינה כשלעצמה מחייבת טיפול אנטיביוטי אם החולה אינו תסמיני, אולם עוזרת להתאים טיפול בהתלקחות עתידית. עם זאת, קיימים חיידקים אשר אם צומחים לראשונה יש חשיבות לניסיון למגרם, כמו פסאודומונס, MRSA.
- המלצות
- בחולים עם ברונכאקטזיות נדרשת הערכה מיקרוביולוגית עם תרביות ליחה ובדיקת רגישות לתכשירים אנטיביוטיים לפתוגנים מהכיח.
- ממצא של סטפילוקוק זהוב או פסאודומונס אאוריגינוסה או אספרגילוס פומיגטוס בצמיחות חוזרות מחייב בירור לכיוון CF או ABPA.
- מומלץ באבחנה, ובכל החמרה קלינית לשלוח תרבית ליחה (יש הממליצים גם כל חודשיים־ שלושה) גם בהיעדר תסמינים.
- יש לדאוג שדגימות הליחה יגיעו תוך 3 שעות מלקיחתם למעבדה[1].
- בדיקת כיח מגורה יכולה להיות יעילה יותר מבדיקת כיח רגילה לצורך זיהוי פתוגנים.
מיקובקטריה שאינה שחפתית - Non Tuberculous Mycobacterium - NTM
לאנשים עם ברונכאקטזיות סיכון גבוה פי 50-75 לפתח זיהומים מיקובקטריאליים. המאגר הגדול ביותר ל-NTM הוא סביבתי - מקורות מים, ולא הדבקה מאדם.
מיקובקטריה שאינה שחפתית - Non Tuberculous mycobacterium NTM - מחלה שכיחה בגילאים המבוגרים (שיא 65-85 שנים). שכיחות דומה בגברים ונשים עם NTM. הפתוגן הכי שכיח הוא MAC (כ-80% מהמקרים) ולאחריו MABSC־Mycobacterium Abscessus (מחלה קשה יותר). קיימים זנים רבים נוספים שאינם בהכרח גורמי מחלה.
אבחנת המחלה עפ"י קריטריוני ה-ATS[18]. התלונות אינן ספציפיות (שיעול ליחתי, גניחת דם, הזעת לילה, ירידה במשקל), וקיימת תמונה אופיינית ב-HRCT חזה הכוללת שינויים ברונכיאקטטים וציסטים (ללא תפליט או קשריות לרוב).
הטיפול המקובל - במשלב של שלוש תרופות לפחות, עם תגובה של 74% במחלה מחילתית ו-82% במחלה לא מחילתית. המשלב כולל קלריתרומיצין, אטמבוטול, ריפמפין ונדרשים 12־ חודשי טיפול לאחר קבלת תרבית שלילית. בשל משך הטיפול הארוך והסיכוי לסיבוכים, יש לשקול את נחיצות הטיפול מול הסיכון, ואין חובה לטפל כאשר הסיכון מסיבוכי הטיפול גדול מהסיכון מסיבוכי המחלה עצמה. במיוחד נכון הדבר לגבי זני מיקובקטריה בעלי פתוגניות נמוכה.
במקרים של מחלה ממוקדת ניתן לשקול טיפול כירורגי משלים. קיים סיכון של 10% להישנות לאחר טיפול. טיפול יעיל בברונכאקטזיות (כיוח אפקטיבי) מסייע לריפוי מ-NTM.
- המלצות
- יש לחשוד במחלת NTM פעילה בחולים עם תסמינים למרות טיפול, במיוחד כאשר קיימת ירידה במשקל .
- יש לקחת תרביות למיקובקטריה בעת האבחון, אחת לשנה וכאשר מתעורר חשד קליני למחלת NTM.
- צמיחה של NTM בתרבית ליחה אינה כשלעצמה מחייבת טיפול, בעיקר בזנים הפחות אלימים.
תפקודי ריאות
ההפרעה השכיחה ביותר בתפקודי ריאות היא הפרעה חסימתית, אולם בחלק מהחולים קיימת הפרעה רסטריקטיבית או משולבת חסימתית/רסטריקטיבית.
לרוב היחס RV/TLC מוגבר. DLCO יתכן שיהיה תקין או נמוך במחלה מתקדמת. קצב ההידרדרות ב-FEV1 נמצאת בקורלציה לדרגת קוצר הנשימה ולחומרה ב-HRCT. זיהום בפסאודומנס מנבא מחלה קשה יותר והידרדרות מהירה יותר בתפקוד הנשימה. בחולים מדוכאי חיסון (היפו גמא-גלובולינמיה) המטופל ב-IVIG נצפתה הטבה בתפקודי ריאות בעקבות הטיפול.
תגובתיות למרחיבי סימפונות נמצאה בכשליש מהחולים[19] אולם לא נבדק הקשר בינה לבין דרגת קוצר הנשימה.
מחקרים רבים הראו הטבה בתפקוד הריאות - FEV1 - בעקבות מתן טיפול אנטיביוטי קצר טווח במבוגרים וכן הטבה ב-FRC,TLC במקביל לירידה בכמות הליחה ובצבעה[20]. לא הושג שינוי ב DLCO בעקבות טיפול אנטיביוטי.
בחולים עם PCD) Primary Ciliary Dyskinesia) נצפתה התייצבות בתפקודי נשימה בעקבות טיפול אנטיביוטי [21].
- המלצות
- יש לבצע ספירומטריה בכל חולה עם אבחנה של ברונכיאקטזיות, ולבדוק תגובתיות למרחיבי סימפונות בעת האבחנה. יש לחזור על ספירומטריה לפחות פעם בשנה, ובילדים פעם בשלושה חודשים.
- חולה עם כשל חיסוני או PCD צריך לבצע ספירומטריה לפחות 4 פעמים בשנה. מומלץ לבצע בדיקת הפיכות בעיקר בצעירים בכדי לקבוע תגובה למרחיבי סימפונות.
- יש מקום לספירומטריה לפני ואחרי טיפול אנטיביוטי תוך ורידי (מדד אובייקטיבי לשיפור).
- מומלץ לבצע בדיקת ספירומטריה ונפחי ריאה בכל חולה לפני ואחרי מתן טיפול אנטיביוטי ממושך (באנהלציה או פומי).
- בתינוקות ניתן להעריך את תפקודי הריאה על ידי בדיקת baby box.
טבלה מס' 1. בירור אטיולוגי ובדיקות לאיפיון המומלצות לחולים עם מחלה ברונכיאקטטית
| בדיקות לכלל החולים | בדיקות לחלק מהחולים | מטרה | |
|---|---|---|---|
| מאפיינים דרושים לביצוע הבדיקה | הבדיקה/ות | ||
| רמת אימונוגלובולינים IgG, IgA, IgM ותת קבוצות של IgG | אימונוגלובולינים נמוכים או שקיימים מאפייני כשל חיסוני | נוגדנים להמופילוס, פנאומוקוק, בדיקות נוספות לתפקוד לימפוציטים | איפיון כשל חיסוני |
| רמת total IgE | IgE גבוה מ 1000 IU/ml | RAST לאספרגילוס, אאוזינופילים, תבחיני עור לאספרגילוס | אבחנת ABPA |
| גיל התייצגות צעיר, קרבת משפחה בין ההורים, תסמינים נזאליים, אי פוריות גברית (CBAVD)[22], תסמינים גסטרו אינטסטינליים | תבחיני זיעה, פוטנציאל פעולה ברירית האף, גנטיקה לסיסטיק פיברוזיס | איבחון סיסטיק פיברוזיס | |
| גיל התייצגות צעיר, קרבת משפחה בין ההורים, תסמינים נזאליים, דלקות אוזניים חוזרות, אי פוריות גברית (תנועתיות זרע), היפוך איברים | nasal NO או nasal brush לאלקטרון מיקרוסקופיה | Primary Cilary Dyskinesia | |
| ברונכיאקטזיות ממוקדות לאונה אחת | ברונכוסקופיה | חשד לממצא חוסם סימפון | |
| בחולים עם נפחת או בני משפחה עם חסר A1AT [23] | רמת A1AT | חסר A1AT | |
| ANA, RF, SSA, SSB antibodies | בחולים עם מאפיינים קליניים של מחלות רקמת חיבור | איבחון מחלות רקמת חיבור | |
| בדיקות לאיפיון וקביעת חומרה: | |||
| תרבית כיח אחת לשנה - אחת ל 3 חודשים ובעת התלקחות | זיהוי חיידק, טיפול אנטיביוטי
מניעתי | ||
| תרבית מיקובקטריה אחת לשנה | זיהוי מחלה מיקובקטריאלית | ||
| ספירומטריה אחת לשנה | מדד פרוגנוסטי, קביעת חומרה | ||
הערכת החומרה של מחלה ברונכיאקטטית
בעבודות שסקרו חולים עם מחלה ברונכיאקטטית, נמצאו מספר גורמים המנבאים תמותה והתלקחויות. החשובים בהם הינם גיל מבוגר, זיהום בפסאודומונס, תפקודי נשימה ירודים וקיום התלקחויות ואשפוזים בעבר [24]. על בסיס ממצאים אלו נוצר מדד חומרה של ברונכיאקטזיות (bronchiectasis severity index- BSI) (טבלה מס' 2). מדד זה נמצא כבעל יכולת ניבוי להתלקחויות, אשפוזים ותמותה. המדד לא אומת בילדים, ולמעשה בילדים אין מדד חומרה מקובל2.
- המלצה
יש להעריך בכל חולה את החומרה של מחלת הברונכיאקטזיות על מנת לנבא את הסיכון לתמותה ולהתלקחויות ולהתאים טיפול.
טבלה מס 2: מדד החומרה של ברונכיאקטזיס - Bronchiectasis Severity Index
| מדד | חומרה | ציון |
|---|---|---|
| גיל בשנים | ≤ 50 | 0 |
| 69-50 | 2 | |
| 79-70 | 4 | |
| ≥ 80 | 6 | |
| מדד מסת הגוף BMI [25] | <18.5 | 2 |
| ≥ 18.5 | 0 | |
| FEV1% מהמצופה | 80 < | 0 |
| 80-50 | 1 | |
| 49-30 | 2 | |
| <30 | 3 | |
| אשפוזים בשנתיים האחרונות?[26] | כן | 5 |
| לא | 0 | |
| מס' החרפות ב 12 החודשים האחרונים | 2-0 | 0 |
| 3 ≥ | 2 | |
| מדד קוצר הנשימה בסולם MRC | 3-1 | 0 |
| 4 | 2 | |
| 5 | 3 | |
| זיהום כרוני בחיידקים | Pseudomonas aeruginosa | 3 |
| אחרים | 1 | |
| ללא | 0 | |
| חומרה ב CT | 3 אונות ומעלה או שינויים ציסטיים | 1 |
| פחות מ 3 אונות והיעדר שינויים ציסטיים | 0 |
טיפול בברונכיאקטזיות
הטיפול הכרוני
- כללי- חיסונים
לא קיימים מחקרים אשר בדקו באופן מכוון יעילות של חיסונים אלו במניעת התלקחויות בחולי ברונכיאקטזיות. עם זאת, לאור הבטיחות והיעילות של חיסונים אלו במחלות אחרות, מומלץ לחסן חולי ברונכיאקטזיות כמו חולים במחלות ריאה כרוניות אחרות.
מומלץ כי חולים עם ברונכיאקטזיות יחוסנו כמקובל בחיסון כנגד שפעת וכנגד פנאומוקוק.
- ניקוז ריאתי - "פיזיותרפיה נשימתית"
- כללי: מטרת ניקוז נשימתי לסלק כיח מצטבר ובכך להביא להקלה תסמינית, ולמנוע התלקחויות זיהומיות. קיימות טכניקות שונות לביצוע ניקוז ריאתי, ביניהן: כיוח ידני, ACBT- active cycle breathing technique ושימוש בעזרים שונים, בהם IPPV- intermittent positive pressure ventilation.[27], [28], [29] בהמלצות BTS משנת 2010 מומלץ כי חולי ברונכיאקטזיות יכירו ויטופלו בטיפולי ניקוז ריאתיי.
- שיקום נשימתי נידון בפרק אחר בהמלצות אלו.
- המלצות
- מומלץ כי הטיפול בחולי ברונכיאקטזיות יכלול הפניה לפיזיותרפיסט הבקי בשיטות ניקוז ריאתי ושיקום נשימתי לצורך ביצוע טיפולי פיזיותרפיה באופן סדיר.
- מומלץ כי חולים עם ברונכיאקטזיות ושיעול יצרני ילמדו טכניקות של ניקוז ריאתי.
- מומלץ כי חולים עם שיעול יצרני והתלקחויות תכופות יבצעו טכניקות ניקוז ריאתי מידי יום באופן סדיר.
- בתינוקות וילדים קטנים מומלץ שההורים יילמדו טכניקות וייבצעו את הפיזיותרפיה בבית, בקטנים לפחות 15 דקות ליום ובגדולים 30 דקות.
- בהתאם לחומרה ניתן לשקול שילוב של תכשיר עזר לניקוז ריאתי כגון מכשיר לחץ חיובי סוף נשיפתי (Positive Expiratory Pressure- PEP) או oPEP) Oscillating - PEP) או (Intrapulmonary Percussive Ventilation (IPV או VEST.
מכייחים
כללי: מכייחים הם תכשירים פרמקולוגיים הניתנים בשאוף- דרך נבולייזר (מכשיר אינהלציה) או משאף, או במתן פומי. מתפקדים בהפיכת הכיח לדליל יותר, צמיג פחות, ובכך משפרים את ניקוזו.
מכייחים משתמשים כעזר לניקוז ריאתי [27], [29], [30].
- סוגי המכייחים הידועים
- סליין באינהלציה: סליין איזוטוני (0.9%) או היפרטוני - בדרך כלל בריכוזים בין 3% ל-7%, הניתן כתמיסה דרך נבולייזר כפעמיים- שלוש ביום. במידה וקיים ברונכוספזם ניתן לשלב עם מרחיבי סמפונות.
- מניטול - Mannitol - ניתן באבקה דרך משאף ייעודי במינון 400 מ"ג פעמיים ביום. מניטול הוא תכשיר אוסמוטי הפועל ככל הנראה על ידי משיכת מים אל הנוזל המצפה את הסימפונות (airway surface liquid) ובכך משפר את התכונות הויסקו- אלסטיות של הכיח.
- Acetyl Cysteine־N - ניתן כתמיסה באינהלציה או באופן פומי. אין מחקרים המבססים את יעילותו כמשפר כיוח אולם נזכר בסקירות כתכשיר בעל פוטנציאל ליעילות.
- המלצות
- חולי ברונכיאקטזיות עם שיעול ופליטת ליחה כרוניים יטופלו במכייח באופן קבוע. התכשירים היעילים יותר הם סליין היפרטוני ומניטול. בחולה שלא סובל תכשירים אלו ניתן לשקול מתן סליין איזוטוני.
- ניסיון לטיפול בסליין היפרטוני או במניטול יבוצע לראשונה במרפאה מחשש לתגובה של ברונכוספזם.
מתן אנטיביוטיקה פומית באופן ארוך טווח
למאקרולידים תכונות אימונו-מודולטוריות אשר מביאות לשיפור במחלות דלקתיות כרוניות של הריאות. פורסמה מטא-אנליזה של כלל המחקרים שבדקו טיפול ארוך טווח במאקרולידים ב-NCFBE. נמצא כי טיפול במאקרולידים הפחית את מספר ההתלקחויות (0.001>RR= 0.42 , P), שיפר את איכות החיים, ובמבוגרים - שיפר גם את תפקודי הריאה[31]. קווים מנחים לטיפול בברונכיאקטזיות אשר פורסמו בשנת 2010, לפני פרסום המחקרים אודות מאקרולידים[32], [33], [34] כוללים המלצה לטיפול במאקרולידים. תוצאות המחקרים שצוטטו כאן מבססים את ההמלצה. מאידך, טיפול ארוך טווח במאקרולידים טומן בחובו סכנות מוכחות ופוטנציאליות. טיפול באריתרומיצין כרוך ביותר תופעות לוואי מגבילות לעומת שאר המאקרולידים, בעיקר תסמינים הנובעים ממערכת העיכול, כדוגמת כאב בטן אך גם הארכת מקטע QT ואף מוות פתאומי[35].
מבין המאקרולידים הקיימים בארץ, אזיתרומיצין היא התרופה בעלת פרופיל הבטיחות המיטבי וזה אשר קיימות העדויות המרביות לגבי יעילותו.
קיימות עדויות על תועלת בטיפול ארוך טווח במינון נמוך של אנטיביוטיקה מסוגים אחרים - לא מאקרולידים בהפחתת התלקחויות. על כן זוהי חלופה אפשרית לטיפול במאקרולידים. עם זאת, יש להימנע ממתן מינונים גבוהים של אנטיביוטיקה על מנת להימנע מתופעות לוואי, ולהימנע משימוש ארוך טווח בקוינולונים. מינונים אפשריים לדוגמא הם אמוקסיצילין, 500 מ"ג פעמיים ביום במבוגרים.
- המלצות
- אנו ממליצים על מתן כרוני של אזיתרומיצין בחולי non CF BE אשר חווים שתי החמרות ומעלה בשנה או הידרדרות מהירה בתפקודי הנשימה. ניתן לשקול מתן אזיתרומיצין גם בחולים עם פליטת כיח מרובה מידי יום גם בהיעדר התלקחויות חריפות. אנו ממליצים להוסיף מאקרולידים רק לאחר טיפול בניקוז ריאתי ובמכייחים למשך 3 חודשים ובאם טיפול זה לא הביא לשיפור מספק. בילדים מקובל לתת מאקרולידים כקו טיפולי ראשון כטיפול אנטי דלקתי.
- המינון המומלץ בחולים מבוגרים (פרט לחולי סיסטיק פיברוזיס) הוא 500-250 מ"ג 3 פעמים בשבוע או 250 מ"ג ליום. בילדים: 10 מג לק"ג בקטנים 250-1 בילדים גדולים יותר (מעל 25 ק"ג).
- על מנת להקטין את הסיכון לתופעות לוואי הכרוכות בטיפול ממושך באזיתרומיצין יש לבצע:
- אק"ג, כולל מדידת QT וביצוע אק"ג לביקורת אחת לשנה.
- שלילת מחלת לב משמעותית (אי ספיקת לב סיסטולית, מחלה כלילית לא מטופלת) ומחלת כבד.
- נטילת תרבית כיח למיקובקטריה, על מנת לשלול נשאות או זיהום במיקובקטריה שאינה שחפתית, מצב המהווה התווית נגד לטיפול במאקרוליד כטיפול יחיד.
- יש לבצע בדיקת שמיעה בטרם טיפול וניטור שמיעה אחת לשנה.
- קיימות עדויות על תועלת בטיפול ארוך טווח במינון נמוך של אנטיביוטיקה שאינה מאקרוליד.
אנטיביוטיקות בשאוף
אנטיביוטיקות בשאוף נמצאות בשימוש נרחב בחולי סיסטיק פיברוזיס עם זיהום חדש או כרוני בכיח. תכשירים אלו נבדקו גם בחולי non CF BE שבהם יש זיהום כרוני בחיידקים בכיח - בעיקר פסאודומונס. נמצא, כי אנטיביוטיקה בשאוף יעילה יותר מפלצבו (או טיפול שמרני) בהפחתת כמות החיידקים בכיח, ארדיקציה של חיידקים מהכיח, ובהפחתת כמות ההתלקחויות אולם ללא בתפקודי הנשימה. לא היה שיפור במדדי איכות חיים במחקרים שבדקו זאת, וכן נצפה ברונכוספזם בשיעור של כ-10% מהנבדקים, בעיקר עם אמינוגליקוזידים אולם לא עם ציפרופלוקסצין. לא היה הבדל משמעותי בשיעור התפתחות זנים עמידים - 7.8% לעומת 3.5% בקבוצת הביקורת.
בין התכשירים הקיימים בשיאוף נמצאים אמינוגליקוזידים - גנטמיצין, טוברמיצין בתמיסה לאינהלציה או במשאף אבקה, אמיקצין - מסיס או ליפוזומלי, אזטראונם (Aztreonam- Cayston), קולירצין - Coliracin בתמיסה או במשאף עם אבקה, לבופלוקסצין וציפרופלוקסצין. משכי זמן הטיפול שנבדקו היה חודש עד ששה חודשים, במתן רציף או לסירוגין - חודש מתן וחודש הפסקה. זאת על מנת למזער את הסיכוי להופעת זנים עמידים של חיידקים.
קווים מנחים משנת 2010 לטיפול בברונכיאקטזיות[7] ממליצים על מתן ארוך טווח של אנטיביוטיקה בשאוף לחולים עם זיהום כרוני בפסאודומונס ושלוש ומעלה התלקחויות בשנה (או מספר קטן יותר של התלקחויות קשות). כמו כן מומלץ על ניסיון למיגור של פסאודומונס עם קולירצין בשאוף קצר-טווח אם ניסיון קודם בטיפול פומי נכשל. רבים מהמחקרים על אנטיביוטיקה בשאוף ב-non CF BE פורסמו לאחר פרסום הקווים המנחים.
- המלצות
- אנו ממליצים על טיפול באנטיביוטיקה בשאוף לחולים עם זיהום חדש או כרוני בפסאודומונס.
- בעת התחלת טיפול מומלץ לבצע את המתן הראשון תחת השגחה רפואית על מנת לצפות ולטפל בתופעת ברונכוספזם.
טיפול באמצעות מרחיבי סמפונות, משאפי סטרואידים ובאופן משולב
טיפול במרחיבי סמפונות בלבד - במסגרת חיפוש בספרות עלה כי ב-Cochrane reviews משנת 2003 לא נמצא מחקר ממנו ניתן להסיק מסקנות אודות יעילות טיפול באמצעות מרחיבי סמפונות קצרי פעילות בחולים עם ברונכיאקטזיות. בחולים עם מחלה חסימתית ניתן לשקול הוספת מרחיב סמפונות במשאף: אגוניסט ביתא - אדרנרגי או נוגד פעילות קולטן מוסקריני. כמו כן מקובל לתת טיפול מקדים במרחיבי סמפונות בחולים המטופלים בסליין היפרטוני על מנת למנוע ברונכוספזם.
טיפול במשאפי סטרואידים - נבדק במספר קטן של חולים, ונמצא כי יש הטבה במדדי דלקת ובחלק מהעבודות הטבה במדדים קליניים. נמצא מספר מאמרים מוגבל יחסית אשר במסגרתם נבדקה היעילות של משאפי סטרואידים בקרב חולים עם ברונכיאקטזיות. ב-2009 פורסמה אנליזת Cochrane אשר סיכמה שישה מחקרים בהם נבדק טיפול במשאפי סטרואידים בחולים מבוגרים עם ברונכיאקטזיות, ללא עדות לאסטמה. לא נמצא הבדל בין קבוצת הטיפול לעומת קבוצת פלצבו (לא היה שיפור בתפקודי ריאות בהחלמה מהתלקחויות או בכמות הכיח).
טיפול במשאפים משולבים - בהתקיים חילוקי דעות אודות הטיפול במשאפי סטרואידים בעיקר כטיפול סימפטומטי ולאור העובדה שטיפול משולב יותר יעיל כטיפול אנטי דלקתי לאסטמה, נעשו מחקרים אודות טיפול משולב זה בברונכיאקטזיות בהיעדר אסטמה.
ב-2014 רוכזו המאמרים שבודקים את השפעת טיפול משולב לחולים במצב יציב ובתקופת התלקחות במסגרת אנליזת Cochrane.
במסגרת המחקרים נבדקו המאפיינים הבאים:
- משך ההתלקחות, שכיחות ההתלקחויות והצורך באשפוזים בזמן התלקחות.
- איכות החיים של החולים, כמות הכיח, תמותה וקצב התדרדרות של תפקודי ריאות.
מתוך 51 מחקרים רק עבודה אחת עם 40 חולים ענתה לקריטריונים. במחקר זה נבדקו מינונים גבוהים של budesonide (1600 מיקרוגרם) לעומת טיפול משולב של budesonide with formoterol. לא נמצא הבדל באיכות החיים, כמות ההתלקחויות, האשפוזים ותפקודי הנשימה, אולם נמצא הבדל משמעותי בתדירות השיעול - 15.3 ימים ללא שיעול בקבוצת הטיפול המשולב ו-3 בקבוצת הסטרואידים בשאוף. בשל מספר החולים הקטן לא ניתן היה להסיק מסקנות כלליות. יש לציין כי לא קיימות עבודות הבודקות יעילות תכשירים אלו בילדים.
- המלצות
- לאור הנתונים הקיימים אין מידע שתומך בטיפול גורף על ידי מרחיבי סמפונות, סטרואידים או טיפול משולב בחולים עם ברונכיאקטזיות.
- במידה ומדובר בשילוב של ברונכיאקטזיות ותגובתיות יתר של דרכי נשימה או אסטמה, לצורך שיפור קליני ניתן להשתמש בטיפול הכולל משאפים סטרואידלים.
- בשילוב עם מחלת COPD עם התלקחויות חוזרות ניתן לשקול תוספת משאף סטרואידלי.
שיקום נשימתי
שיקום ריאות הוא אחד מהטיפולים החשובים ביותר המומלצים עבור חולים עם מחלת ריאות חסימתית כרונית (COPD) כבר בשלבים המוקדמים של המחלה. טיפול זה אושר גם בארץ ע"י משרד הבריאות ונכנס לסל התרופות. הטיפול מאושר בד"כ ל-12 שבועות ומטרתו לשפר את איכות החיים והכושר הגופני של המטופלים. חולים עם ברונכיאקטזיות בדומה לחולים עם COPD מפתחים אי סבילות לפעילות גופנית אשר גורמת לירידה באיכות החיים. ישנן עבודות רבות שבדקו השפעה של תוכנית השיקום בחולים עם ברונכיאקטזיות, אך אין הומוגניות מבחינת משך השיקום (טווח הזמנים נע בין 3 ל-8 שבועות). באמצעות שיקום הושג שיפור באיכות החיים ושיפור בכושר הגופני כמו גם הארכת הזמן עד להחרפה הבאה[20].
סיכוי לסיבוכים בשיקום ריאות קיימים בשיעור נמוך וכוללים חזה אוויר, הופעת היפוקסמיה, גניחת דם, הפרעות קצב, שברים אך התועלת מהטיפול גדולה מהסיכונים הכרוכים בו.
- המלצה
- אנו ממליצים לכלול חולי ברונכיאקטזיות אשר מציגים מוגבלות בפעילות גופנית בתכניות שיקום נשימתי אחת לשנה. זאת בנפרד מההמלצה על ניקוז נשימתי ("פיזיותרפיה נשימתית").
טיפול ניתוחי בברונכיאקטזיות
אחד הטיפולים למחלה ברונכיאקטטית הוא ניתוח כריתת אונה או ריאה נגועים. ההתוויות העיקריות לניתוחי כריתה הן:
- סיבוכים של המחלה כגון זיהומים חוזרים אשר אינם מגיבים לטיפולים אנטיבקטריאליים, מורסה או אמפימה.
- דימומים חוזרים אשר לא מגיבים לטיפול ע"י אמבוליזציה.
- סימפטומים עקשניים (שיעול וכמויות גדולות של כיח) חרף טיפול מקסימלי.
מטרת הניתוח היא לבצע כריתה שלמה של האזור הפגוע. לאורך שנים מחלה דיפוזית דו צדדית היוותה הוראת נגד לפעולה כירורגית עקב סיכון מוגבר לתמותה בזמן הפעולה וסיבוכים. בעשור האחרון הופיעו בספרות עבודות התומכות באפשרות לבצע ניתוח במחלה דו צדדית. רוב המאמרים מלמדים שקיימת החלמה באחוזים גבוהים (עד 70%) לאחר הניתוח.
מחקר שפורסם בשנת 2014 מתאר שיפור קליני לאחר ניתוחי כריתה. במסגרת המחקר סוכמו 86 חולים שעברו ניתוחי כריתת אונה או ריאה בין השנים 2000-2013, בשל חוסר תגובה לטיפול תרופתי. הגיל הממוצע של החולים היה סביב 40 שנה. לא נכללו חולים עם מעורבות דו צדדית. לפי התוצאות ב-90% מהחולים הצליחו להוציא את האזור הפגוע בשלמותו, סיבוכים הופיעו ב-15% ותמותה ב-1%. המעקב לאחר הניתוח נמשך בממוצע כ-5 שנים (החל מ-6 חודשים ועד 8.7 שנים). 82% מהחולים נשארו ללא סימפטומים ובקרב - 17% היה שיפור של הסימפטומים. לא הייתה חזרה של גניחת דם ולחלקם היה שיפור ב-FEV1. FEV1 פחות מ־60%, כריתה חלקית של האזור הפגוע וטיפול אנטיביוטי טרם הניתוח היו כרוכים בשכיחות גבוהה של סיבוכים לאחר ניתוח.
בספרות מתוארים סיבוכים בתר ניתוחיים בעד 30% מהמטופלים. לכן על מנת להקטין את הסיכון חשוב מאוד להקפיד על הקריטריונים הבאים:
- החולה המועמד לניתוח במצב בריאותי טוב יחסית ואינו מבוגר. בעבודה רטרוספקטיבית של 790 חולים נראה שגיל מתקדם (מעל 70) ואי ספיקת כליות מעלים את התמותה הסב ניתוחית.
- תפקודי ריאות שמורים טרם הניתוח - מעל 60% FEV1.
- שליטה במידת האפשר על התהליך הזיהומי בדרכי הנשימה.
- אפשרות להוציא בשלמות את האזור הפגוע, שכן השארת אזורים נגועים מעלה את הסיכון לסיבוכים.
השתלת ריאות במחלה ברונכיאקטטית מתקדמת מקובלת כיום. חולים מועמדים להשתלת ריאות הם חולים במחלה מתקדמת לאחר כישלון כל האפשרויות הטיפוליות. בדומה לחולי לייפת כיסתית, בחולים אלו מקובל לבצע השתלה של שתי ריאות ולא ריאה אחת, על מנת למנוע העברת זיהומים מהריאה הנגועה לריאה המושתלת לאחר ההשתלה.
- המלצות
הטיפול מומלץ אך ורק בחולים עם ברונכיאקטזיות ממוקמות לסגמנט או אונה אחת.
- ניתוח להוצאת ברונכיאקטזיות הינו אחד מהטיפולים האפשריים רק לאחר שמוצו טיפולים תרופתיים לא פולשניים, אמבוליזציה ושיקום נשימתי.
- הפעולה כרוכה בסיבוכים גבוהים במיוחד אצל חולים מבוגרים עם ירידה בתפקודי ריאות ומחלות רקע ובנוכחות תהליך זיהומי פעיל.
- חולים צעירים סימפטומטיים (שיעול, כמויות גדולות של כיח) במצב בריאותי ותפקודי טוב ועם ברונכיאקטזיות ממוקדות, יכולים ליהנות מתוצאות הניתוח עם סיכון נמוך לתמותה ושיפור משמעותי באיכות החיים.
- הפעולה אמורה להתבצע לפי שיקול דעת ויכולת המנתח להוציא את האזור הפגוע בשלמותו.
- בחולים עם מחלה ידועה כמו CF, PCD או חסר חיסוני יש לשקול היטב את הפעולה מאחר והברונכייקטזיס עלול להופיע באזורים אחרים בריאה.
- השתלת ריאות היא טיפול בחולים עם מחלה מתקדמת לאחר כישלון יתר הטיפולים.
התאמת הטיפול לחולה
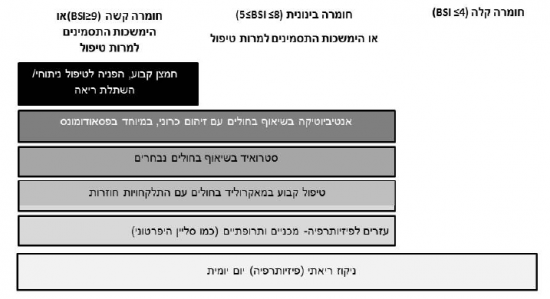
הטיפול בחולי ברונכיאקטזיות, לצד תועלת רבה, כרוך בהשקעה של זמן ומאמץ מצד המטופל ואף עלול להיות כרוך בסכנה לסיבוכים כפי שפורטו לעיל (מאקרולידים, אנטיביוטיקה בשאוף). על כן יש לבחור עבור כל מטופל את הטיפול על פי החומרה של מחלתו, ולהתחיל מטיפולים בסיסיים ובעלי סיכון נמוך. כאלו הם פיזיותרפיה נשימתית וניקוז ריאתי. למטופלים עם זיהום כרוני בחיידקים יש לשקול הוספת אנטיביוטיקה בשאוף או סיסטמית באופן קבוע. הצעה לטיפול מדורג התפרסמה ומובאת כאן (תמונה מס' 1) .
מומלץ כי בחירת הטיפול לחולה תתבסס על הערכה של חומרת מחלתו, על פי מדד חומרה מקובל וקיום זיהום כרוני בחיידקים בכיח (טבלה מס' 1 ותמונה מס' 1).
תמונה מס' 1: טיפול מדורג בחולי ברונכיאקטזיות מבוגרים[34]
- בכל המטופלים (ללא קשר לחומרה) מומלץ על
- חיסון נגד שפעת ופנאומוקוק
- זיהוי וטיפול מוקדם בהתלקחויות
- שיקום נשימתי ופעילות גופנית סדירה
- זיהוי וטיפול בגורם ספציפי
- זיהוי וטיפול בתחלואה נלווית
מניעת העברת זיהומים
בחולי ברונכיאקטזיות כמו בחולי CF נמצא, כי זיהום כרוני בחיידק פסאודומונס בדרכי הנשימה קשורה בהידרדרות מהירה יותר בתפקודי הנשימה, אשפוזים תכופים יותר ואיכות חיים ירודה[17], .[18], [19], [20], [21], [24] בחולי CF נהוגה הפרדה בין חולים מזוהמים בפסאודומונס לבין חולים ללא פסאודומונס בשל עדות להעברת החיידק בין החולים[28].
לגבי חולים עם NCFBE, העדויות אודות העברת חיידקים בין המטופלים אינן רבות. עבודה מ-1999 סקרה זני פסאודומונס של 16 חולי NCFBE. באמצעות זיהוי מולקולתי נמצא כי לא היה שיתוף של זנים בין החולים. נסקרו זני פסאודומונס בקרב חולי NCFBE שאושפזו במרכז ברונכיאקטזיות. מתוך 36 חולים, לרוב החולים היו זני פסאודומונס נפרדים אולם זוהו שלושה זוגות של חולים עם זנים דומים מאוד, בהם זוג אחד עם סבירות גבוהה לזן שעבר מחולה אחד לשני. מסקנת המחברים היא שהעברת זני פסאודומונס בין חולים אינה שכיחה, אולם אפשרית.
- המלצות
- יש לזהות את החולים עם זיהום כרוני בפסאודומונס בקרב מרפאות NCFBE
- במידת האפשר יש לבודד חולים עם זיהום בפסאודומונס וחיידקים עמידים אחרים (MRSA, ESBL producing) מחולי ברונכיאקטזיות אחרים. שיטות אפשריות הם שעות מרפאה נפרדות, וקביעת תור בסוף יום מרפאה.
מיגור זיהום חדש בפסאודומונס
קווים מנחים לטיפול בברונכיאקטזיות משנת 2010 ממליצים על ניסיון ארדיקציה בעת זיהוי ראשון של פסאודומונס, בהתבסס על הידוע אודות המשמעות הקלינית של זיהום בפסאודומונס בחולים אלו[1]. עם זאת, חסרים מחקרים אודות היעילות של ניסיון לארדיקציה של פסאודומונס ואודות המשטר הטיפולי היעיל ביותר.
המשטר הטיפולי המומלץ ב-BTS guidelines הוא טיפול במינון גבוה של ציפרופלוקסצין (750 מ"ג פעמיים ביום או 15 מ"ג לק"ג פעמיים ביום בילדים) למשך שבועיים. אם לאחר הטיפול עדיין קיים זיהום בפסאודומונס, מומלץ על ניסיון נוסף באחת מ-3 דרכים:
- טיפול באנטיביוטיקה נוגדת פסאודומונס תוך ורידית לשבועיים
- טיפול בציפרופלוקסצין 750 מ"ג פעמיים ביום למשך 4 שבועות נוספים והוספת קולירצין בשיאוף, 2 מיליון יח' פעמיים ביום, למשך 2 חודשים.
- מתן קולירצין בשיאוף, 2 מיליון יח' פעמיים ביום, למשך 3 חודשים[7].
עבודה רטרוספקטיבית סקרה הצלחת ניסיון ארדיקציה ב-30 חולים במרכז ברונכיאקטזיות יחיד. מחולים אלו טופלו באנטיביוטיקה תוך ורידית לשבועיים. ב-80% מהחולים הושגו תרביות ללא פסאודומונס לאחר הטיפול (24). אולם ב-13/24 נצפה זיהום מחודש בפסאודומונס לאחר פרק זמן ממוצע של 6 חודשים (טווח, 4-26 חודשים). לאחר הטיפול היו לחולים פחות התלקחויות (3.93 לשנה לעומת 2, 0.002 =p).
בחלק מהמחקרים שבוצעו אודות אנטיביוטיקה בשיאוף נמצא, כי בקבוצת המחקר הושגה היעלמות של פסאודומונס מהכיח. כך, בשימוש בטוברמיצין למשך חודש נעלם הפסאודומונס ב 35% מהחולים, ללא ממצא דומה בקבוצת הביקורת. כך גם עם גנטהמיצין, ציפרופלוקסצין באבקה ואזטראונם. אולם, מחקרים אלו בדקו פרקי זמן קצרים - עד שנה, ללא מעקב לאורך זמן ממושך אחרי הפסקת התרופה, כך שייתכן והיה דיכוי חלקי של הפסאודומונס עם צמיחה חוזרת לאחר מס' חודשים של הפסקת תרופה. מחקרים אלו מדגימים, כי לאנטיביוטיקה בשיאוף תפקיד אפשרי בפרוטוקולים של ארדיקציה של פסאודומונס, בדומה לחולים עם CF, אולם דרושים מחקרים מכוונים בשאלה זו.
- המלצות
- בחולים שלהם תרבית ליחה עם צמיחה של פסאודומונס ובנוכחות תרביות כיח קודמות ללא פסאודומונס אנו ממליצים על ניסיון לארדיקציה תוך פרק זמן קצר ככל האפשר.
- פרוטוקולים אפשריים הינם ציפרופלוקסצין, 750 מ"ג פעמיים ביום (15 מג לק"ג פעמיים ביום בילדים) למשך שבועיים, עם תוספת של אנטיביוטיקה נוגדת פסאודומונס בשאוף. במקרים בהם החיידק עמיד או כאשר חומרת המחלה קשה, יש לשקול טיפול באנטיביוטיקה אחת או שתיים כנגד פסאודומונס במתן תוך ורידי.
- מומלץ על ניסיון נוסף לחזור על ניסיון טיפולי במידה ולאחר הניסיון הראשון יש צמיחה חוזרת של פסאודומונס.
טיפול בהתלקחויות של מחלה ברונכיאקטטית
התלקחות מחלה ברונכיאקטטית מתאפיינת בהחמרה של תסמינים: שיעול, עייפות, ירידה בתאבון, קוצר נשימה, התגברות כמות הליחה, או שינוי צבע הליחה לכהה וירוק, ירידה בתפקודי ראה מעל ל10%. לעתים יכול להתלוות חום סיסטמי (בדרך כלל לא מעל 38.5) וגניחת דם37׳25׳23. מקובל להניח, כי לרוב ההתלקחויות יש גורם זיהומי, ובדרך כלל קיים מרכיב דלקתי.
טיפול בהתלקחויות מכוון על כן כנגד הפתוגניים הקיימים בכיח של החולה. על פי המלצות האיגוד הבריטי משנת 2010[27] מקובל לקחת תרבית ליחה ותרבית למיקובקטריה עם זיהוי ההתלקחות ולתת טיפול אנטיביוטי המכוון כנגד החיידק שקיים בכיח. בילדים, יש לשקול טיפול דרך הוריד באשפוז.
- המלצות
סימני התלקחות ריאתית כוללים עליה בכמות הליחה, שינוי בצבע הליחה, עליה בשענל, קשיי נשימה, חום ועייפות.
- יש לזהות התלקחות של ברונכיאקטזיות ולקחת תרבית ליחה ותרבית מיקובקטריה בהתחלת ההתלקחות.
- יש להגביר את טיפול הבסיס (ניקוז ריאתי, מכייחים וכד') בעת ההתלקחות החריפה.
- משך הטיפול האנטיביוטי המומלץ הוא לפרק זמן של שבועיים.
- הטיפול האנטיביוטי מכוון על פי רגישות של חיידק מתרביות כיח קודמות של המטופל, וניסיון טיפולים קודמים באותו מטופל.
- בהתקבל תשובת תרבית ורגישות של ההחרפה הנוכחית לשנות טיפול בהתאם לפרופיל הרגישות אם אין הטבה קלינית.
- אם לא נמצאה צמיחה בתרביות ליחה קודמות לתת טיפול בביתא - לקטאם, כמו אמוקסיצילין 500 מ"ג 3 X ליום (בילדים, במינון של 40-60 מג לק"ג מחולק ל 2 מנות), או אמוקסיצילין - קלוולנט, 875 מ"ג פעמיים ביום (בילדים, במינון של 40-60 מג לק"ג מחולק ל-2 מנות), או בקלינדמיצין או מאקרוליד, על פי השיקול הקליני.
- אם ידוע על זיהום בפסאודומונס בעבר לתת טיפול על פי רגישות - בקוינולונים או באנטיביוטיקה דרך הוריד, באשפוז או בבית המטופל אם ניתן.
רשם ומחקרים קליניים
ברונכיאקטזיות היא מחלה אשר המידע אודותיה לוקה בחסר. יש להסדיר רישום בארץ של טיפולים מותווים לברונכיאקטזיות, כגון מכייחים, אזיתרומיצין ואנטיביוטיקה בשאוף. כמו כן יש לעודד מחקרים קליניים אודות המחלה והתגובה לטיפול בה. בין היתר מומלץ על השתתפות ברשם אירופאי ורישום החולים במאגר נתונים זה.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 Pasteur MC, Bilton D, Hill AT, British Thoracic Society Bronchiectasis non־CF Guideline Group. British thoracic society guideline for non־CF bronchiectasis. Thorax. 2010;65 Suppl 1:i1-58.
- ↑ Metersky ML. The initial evaluation of adults with bronchiectasis. Clin Chest Med. 2012;33(2):219.
- ↑ שםהערה3
- ↑ Moore EH. Atypical mycobacterial infection in the lung: CT appearance. Radiology. 1993;187(3):777-782.
- ↑ Tanaka E, Amitani R, Niimi A, Suzuki K, Murayama T, Kuze F. Yield of computed tomography and bronchoscopy for the diagnosis of mycobacterium avium complex pulmonary disease. Am J Respir Crit Care Med. 1997;155(6):2041- 2046.
- ↑ 6.0 6.1 O’Donnell AE. Antimicrobial therapy for bronchiectasis. Clin Chest Med. 2012;33(2):381-386.
- ↑ 7.0 7.1 7.2 Pasteur MC, Helliwell SM, Houghton SJ, et al. An investigation into causative factors in patients with bronchiectasis. American journal of respiratory and critical care medicine. 2000;162(4):1277-1284.
- ↑ Cabello H, Torres A, Celis R, et al. Bacterial colonization of distal airways in healthy subjects and chronic lung disease: A bronchoscopic study. Eur Respir J. 1997;10(5):1137-1144.
- ↑ Chalmers JD, Goeminne P, Aliberti S, et al. The bronchiectasis severity index. an international derivation and validation study. Am J Respir Crit Care Med. 2014;189(5):576-585.
- ↑ Davies G, Wells AU, Doffman S, Watanabe S, Wilson R. The effect of pseudomonas aeruginosa on pulmonary function in patients with bronchiectasis. Eur Respir J. 2006;28(5):974-979.
- ↑ Bahous J, Cartier A, Pineau L, et al. Pulmonary function tests and airway responsiveness to methacholine in chronic bronchiectasis of the adult. Bull EurPhysiopathol Respir. 1984;20(4):375-380.
- ↑ Hill SL, Stockley RA. Effect of short and long term antibiotic response on lung function in bronchiectasis. Thorax. 1986;41(10):798-800.
- ↑ Ellerman A, Bisgaard H. Longitudinal study of lung function in a cohort of primary ciliary dyskinesia. Eur Respir J. 1997;10(10):2376-2379.
- ↑ Flude LJ, Agent P, Bilton D. Chest physiotherapy techniques in bronchiectasis. Clin Chest Med. 2012;33(2):351- 361.
- ↑ McShane PJ, Naureckas ET, Tino G, Strek ME. Non־Cystic fibrosis bronchiectasis. American journal of respiratory and critical care medicine. 2013;188(6):647-656.
- ↑ Pasteur MC, Bilton D, Hill AT, British Thoracic Society Bronchiectasis non־CF Guideline Group. British thoracic society guideline for non־CF bronchiectasis. Thorax. 2010;65 Suppl 1:i1-58.
- ↑ 17.0 17.1 Nair GB, Ilowite JS. Pharmacologic agents for mucus clearance in bronchiectasis. Clin Chest Med. 2012;33(2):363-370.
- ↑ 18.0 18.1 Gao YH, Guan WJ, Xu G, et al. Macrolide therapy in adults and children with non־cystic fibrosis bronchiectasis: A systematic review and meta־analysis. PLoS One. 2014;9(3):e90047.
- ↑ 19.0 19.1 Wong C, Jayaram L, Karalus N, et al. Azithromycin for prevention of exacerbations in non־cystic fibrosis bronchiectasis (EMBRACE): A randomised, double־blind, placebo־controlled trial. The Lancet. 2012;380(9842):660-667.
- ↑ 20.0 20.1 20.2 Altenburg J, de Graaff CS, Stienstra Y, et al. Effect of azithromycin maintenance treatment on infectious exacerbations among patients with non־cystic fibrosis bronchiectasis: The BAT randomized controlled trial. JAMA. 2013;309(12):1251-1259.
- ↑ 21.0 21.1 Serisier DJ, Martin ML, McGuckin MA, et al. Effect of long־term, low־dose erythromycin on pulmonary exacerbations among patients with non־cystic fibrosis bronchiectasis: The BLESS randomized controlled trial. JAMA. 2013;309(12):1260-1267.
- ↑ CBAVD - congenital bilateral absence of vas deferens
- ↑ Alpha 1 antitrypsin- A1AT
- ↑ 24.0 24.1 Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Azithromycin and the risk of cardiovascular death. N Engl J Med. 2012;366(20):1881-1890.
- ↑ מדד מסת הגוף Body Mass Index BMI = משקל בק"ג מחולק לגובה בס"מ2
- ↑ אשפוזים שסיבתם העיקרית החמרה של ברונכיאקטזיות.
הציון הכולל הינו סכום הציונים בסעיפים השונים. ציון 4-0 - סיכון נמוך לאשפוזים ולתמותה. 5—8 סיכון בינוני. 9 ומעלה- סיכון גבוה.
מתוך מובאה מסי 9 . - ↑ 27.0 27.1 27.2 Brodt AM, Stovold E, Zhang L. Inhaled antibiotics for stable non־cystic fibrosis bronchiectasis: A systematic review. Eur RespirJ. 2014;44(2):382-393.
- ↑ 28.0 28.1 Smyth AR, Bell SC, Bojcin S, et al. European cystic fibrosis society standards of care: Best practice guidelines. Journal of Cystic Fibrosis. 2014;13:S23־S42.
- ↑ 29.0 29.1 Pujana I, Gallego L, Martin G, Lopez F, Canduela J, Cisterna R. Epidemiological analysis of sequential pseudomonas aeruginosa isolates from chronic bronchiectasis patients without cystic fibrosis. J Clin Microbiol. 1999;37(6):2071-2073.
- ↑ De Soyza A, Perry A, Hall AJ, et al. Molecular epidemiological analysis suggests cross־infection with pseudomonas aeruginosa is rare in non־cystic fibrosis bronchiectasis. EurRespirJ. 2014;43(3):900-903.
- ↑ White L, Mirrani G, Grover M, Rollason J, Malin A, Suntharalingam J. Outcomes of< i> pseudomonas eradication therapy in patients with non־cystic fibrosis bronchiectasis. Respir Med. 2012;106(3):356-360.
- ↑ Barker AF, Couch L, Fiel SB, et al. Tobramycin solution for inhalation reduces sputum pseudomonas aeruginosa density in bronchiectasis. Am J Respir Crit Care Med. 2000;162(2 Pt 1):481-485.
- ↑ Chalmers JD, Aliberti S, Blasi F. State of the art review: Management of bronchiectasis in adults. Eur RespirJ. 2015.
- ↑ 34.0 34.1 Chalmers JD, Smith MP, McHugh BJ, Doherty C, Govan JR, Hill AT. Short- and long־term antibiotic treatment reduces airway and systemic inflammation in non־cystic fibrosis bronchiectasis. Am J Respir Crit Care Med. 2012;186(7):657-665.
- ↑ Brill SE, Patel AR, Singh R, Mackay AJ, Brown JS, Hurst JR. Lung function, symptoms and inflammation during exacerbations of non־cystic fibrosis bronchiectasis: A prospective observational cohort study. Respir Res. 2015;16(1):16-015-0167-9
המידע שבדף זה נכתב על ידי ד"ר מיכל שטיינברג, מכון ריאות ומרכז CF, מרכז רפואי כרמל. ד"ר אמיליה חרדאק, מכון ריאות, מרכז רפואי רמב"ם. ד"ר מתיו קוסלו, מכון ריאות, מרכז רפואי מאיר. ד"ר דריו פרייס, מכון הריאות, מרכז שניידר לרפואת ילדים. ד"ר מאלנה כהן- סימברקנו, יחידת ריאות ילדים, מרכז רפואי הדסה. ד"ר עדי דגן יחידת ריאות ילדים בית חולים לילדים ע"ש לילי ספרא בתל השומר. פרופ' דוד שטרית, מנהל מכון ריאות, מרכז רפואי מאיר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק