שימוש בקנאביס לטיפול בכאב - הנחיה קלינית
הופניתם מהדף כאב - שימוש בקנביס רפואי - Pain - use of medical cannabis לדף הנוכחי.
|
| ||
|---|---|---|
| שימוש בקנאביס לטיפול בכאב | ||

| ||
מיצוי נוזלי של קנאביס אינדיקה
| ||
| הוועדה המקצועית |
| |
| עריכה | ד"ר סילביו בריל ופרופ' אילון איזנברג | |
| קישור | באתר הר"י | |
| תאריך פרסום | יוני 2022 | |
| הנחיות קליניות מתפרסמות ככלי עזר לרופא/ה ואינן באות במקום שיקול דעתו/ה בכל מצב נתון | ||
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – כאב, קנאביס רפואי
הקדמה
לאורך ההיסטוריה, שימש צמח הקנאביס למטרות שונות - כמזון, מקור לסיבי טקסטיל וחומרי בנייה, למטרות רפואיות או כסם פסיכו-אקטיבי. במקור, קיימים שני זנים של הצמח - Cannabis indica, בעל השפעה סדטיבית, ו-Cannabis sativa, לו מיוחס אפקט ממריץ ומעורר, אך לאחר שנים רבות של גידולי הכלאה, נוצרו זנים חדשים רבים ולהם אפקט קליני משתנה[1][2]. במהלך המאה העשרים, בעקבות התפתחויות מחקריות שהובילו לזיהוי הנגזרות הפעילות של צמח הקנאביס והבנת השפעתן הפיזיולוגית, גבר העניין בפוטנציאל התרפויטי שלו ובפרט, בהשפעתו האנלגטית והשימוש בו למטרה זו הלך והתרחב[3][4][5].
המידע המדעי שנאסף באשר ליעילותו ובטיחותו של צמח הקנאביס בשימוש למטרות רפואיות ובפרט, כטיפול בכאב כרוני, הוא מוגבל. כמו כן, קנאביס אינו רשום כתרופה, ועל פי פקודת הסמים המסוכנים הוא מוגדר כ"סם מסוכן" ואסור לשימוש, אלא אם ניתן לכך רישיון כדין. עם זאת, קיימות עדויות לכך, שקנאביס עשוי להקל על סבל וסימפטומים נלווים במצבים רפואיים מסוימים, ובקרב מטופלים ומטפלים כאחד גוברת האמונה כי מדובר בטיפול יעיל ובטוח[2][6][7]. ייתכן, כי הפער בין התפיסות הרווחות לבין העדויות המדעיות נובע מכך, שהאפקט המיטיב שמטופלים חווים אינו מדיד בכלים בהם נעשה שימוש מחקרי למדידת יעילות הטיפול בכאב ובתסמינים הנלווים לו.
מטה-אנליזה נרחבת, שנערכה ביוזמת הארגון העולמי לחקר הכאב (IASP - International Association for the Study of Pain), הגיעה למסקנה כי העדויות הקיימות אינן מאפשרות לתמוך או לשלול את יעילותם ובטיחותם של תכשירים מבוססי קנאביס כטיפול בכאב[6]. מטה-אנליזה עדכנית נוספת מצאה כי ישנן עדויות ליתרון קל של קנבינואידים בהשוואה לפלצבו בשיפור כאב, איכות השינה ותפקוד[7].
למרות המחסור היחסי במחקרים איכותיים לצורך ביסוס מדעי, הניסיון הקליני מלמד כי הטיפול בקנאביס הוא בעל תועלת משמעותית עבור מטופלים מסוימים, ומדינות רבות ברחבי העולם מאמצות רפורמות לשימוש רפואי בקנאביס. הטמעת הקנאביס כטיפול רפואי היא מורכבת בעיקר, בשל היעדר הדירות בתהליכי הייצור, ושונות רחבה במאפיינים הפרמקולוגיים של תכשירים שונים[2]. קנאביס רפואי לא עבר את הליך הרישוי המקובל עבור תרופות, ובשנת 2019 פורסם חוזר לאומי מטעם משרד הבריאות, המפרט את המתווה הקליני לשימוש בקנאביס רפואי[2].
בפועל, שימוש בקאנביס רפואי לצורך שיכוך כאב הולך וגובר, ורופאי הכאב נאלצים להתמודד עם היעדר מידע מדעי באשר לאופן השימוש הנכון, יעילות הטיפול ובטיחותו. החוברת הבאה מסכמת את ההנחיות הקליניות המקובלות בישראל לשימוש בקנאביס רפואי כטיפול בכאב, מטרתה לשמש כלי פרקטי לקבלת החלטות ולשימוש נכון בקנאביס לצורך שיכוך כאב.
המערכת האנדוקנבינואידית
ה-Endocannabinoid system (ECS) היא מערכת הכוללת את ה-Endocannabinoids, נוירוטרנסמיטרים אנדוגניים הנקשרים אל ה-Cannabinoids receptors (CBRs), קבוצת רצפטורים הפזורים על גבי רקמות רבות בגוף. ה-ECS מעורבת ברגולציה רב מערכתית של מנגנונים פיזיולוגיים רבים, לרבות, תהליכים קוגניטיביים, התנהגותיים, אימונולוגיים ומטבוליים. ה-Exogenous cannabinoids הם חומרים ממקור צמחי או סינתטי היכולים להיקשר לרצפטורים קנבינואידים, להשפיע על מנגנונים ביולוגיים שונים ולייצר אפקט קליני רב מערכתי[8][9].
קולטנים לאנדוקנבינואידים - (Endocannabinoids receptors) ECRs
מוכרים מספר סוגי רצפטורים קנבינואידים. העיקריים בהם הם CB1 ו-CB2 - רצפטורים טרנס-ממברנליים מסוג G-protein[8][9].
- CB1 receptor: קולטנים הנמצאים על גבי קצוות פרה-סינפטיים של עצבים מרכזיים ופריפריים ומתווכים תהליכים קוגניטיביים כגון: זיכרון, תיאבון, כאב. בנוסף, ניתן למצוא קולטנים מסוג זה ברקמות פריפריות לרבות: תאי מערכת החיסון, מערכת הרבייה, בלוטת האדרנל, מערכת העיכול, המערכת הקרדיווסקולרית ומערכת הנשימה
- CB2 receptor: נמצאים בעיקר, על תאים של מערכת החיסון, בפרט על גבי B cells & NK cells. פזורים בכמות קטנה גם בתאי עצב ורקמות פריפריות. מיוחסות להם השפעות הקשורות בהתמכרות ובכאב, אם כי, תפקידם הפיזיולוגי אינו מובן במלואו
קנבינואידים אנדוגניים - Endogenous cannabinoid[8][9]
הקנבינואידים האנדוגניים הם ליגנדים הפועלים, בין היתר, על ידי קישור אל הרצפטורים הקנבינואידים, המרכזיים ביניהם הם ה-(AG-2) Arachidonoylglycerol-2 וה-(AEA) N-arachidonoyl-ethanolamine.
- (AEA) N-arachidonoyl-ethanolamine: מוכר גם כ-Anandamide. בעל זיקה גבוהה ל-CB1 receptor ובעל השפעה אגוניסטית חלקית עליו
- (AG-2) Arachidonoylglycerol-2: בעל זיקה נמוכה-בינונית זהה לשני הרצפטורים ובעל השפעה אגוניסטית על שניהם
Exogenous cannabinoids - קנבינואידים אקסוגניים[8][9]
צמח הקנאביס מכיל תרכובות כימיות מסוגים שונים, מתוכן, מוכרים למעלה מ-100 מרכיבים הנקשרים לרצפטורים הקנבינואידים, אלו נקראים Phytocannabinoids (קנבינואידים צמחיים). שני הקנבינואידים הצמחיים המרכזיים האחראיים על האפקט הקליני של הקנאביס הם ה-(THC) Tetrahydrocannabinol וה-(CBD) Cannabidiol.
ה-THC ו-CBD הם הרכיבים הנמצאים בשימוש פרמקולוגי, כל אחד לחוד או בפורמולציות משולבות, כאשר הם מופקים מהצמח עצמו או באופן סינתטי. קנבינואידים סינתטיים הם מולקולות המסונתזות במעבדה כתרכובות אנלוגיות לקנבינואידים ונקשרות באפיניות גבוהה לקולטנים CB1 & CB2.
- (Tetrahydrocannabinol (THC - המרכיב הפסיכואקטיבי העיקרי בצמח הקנאביס. אגוניסט חלקי לרצפטורים CB1 ו-CB2
- (Cannabidiol (CBD: בעל זיקה נמוכה לרצפטורים CB1&CB2. CBD נטול השפעה פסיכואקטיבית, אך מיוחסות לו מגוון השפעות פרמקולוגיות כנוגד דלקת, נוגד בחילות ואנטי-אוקסידנט
Entourage effect
צמח הקנאביס מכיל למעלה מ-400 תרכובות כימיות המסווגות לשלוש קבוצות עיקריות:
Cannabinoids, Terpenes & Flavonoids. ה-THC וה-CBD הם שני הקנבינואידים המרכזיים והם אחראיים, ככל הידוע, על מרבית האפקט התרפויטי כמו גם, על תופעות הלוואי של צמח הקנאביס. בנוסף אליהם, מכיל הצמח חומרים רבים נוספים בעלי יכולת השפעה ביולוגית וייתכן שהם סינרגיסטים לפעילות הקנבינואידים. חומרים אלו על פי חלק מן העדויות, מווסתים את האפקט הקליני של הקנאביס וכך, מייצרים שונות בהשפעתם של קנבינואידים ממקור צמחי אל מול קנבינואידים סינתטיים. תופעה זו מכונה ה- Entourage effect[10].
קנאביס רפואי[2]
יעדי הטיפול
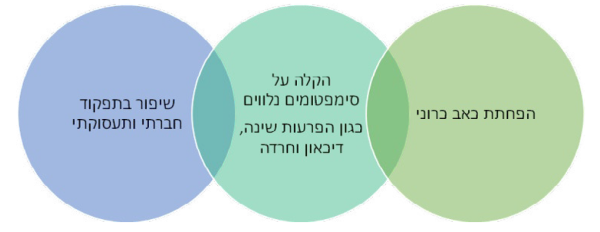
יעדי הטיפול בכאב כרוני אינם מסתכמים בהפחתת עוצמת הכאב, אלא בניסיון להפחית את עומס הסימפטומים הנלווים, על פי רוב, לכאב כרוני וביניהם: הפרעות שינה, דיכאון, חרדה, הימנעות מפעילות, ובכך, לשפר את התפקוד הפיזי, המנטלי, התעסוקתי והחברתי וכפועל יוצא, את איכות חיי המטופלים. לכן, בכל התערבות טיפולים בכאב כרוני, כולל בניסיון טיפול באמצעות קנבינואידים, נדרשת התייחסות לכלל המרכיבים שצוינו.
התוויות שימוש בקנאביס רפואי להקלה על כאב, על פי חוזר 106 של משרד הבריאות
- כאב כרוני:
- כאב ממקור אונקולוגי - על רקע מחלה נאופלסטית, או כתופעת לוואי של טיפול אנטי-נאופלסטי
- כאב נוירופתי
- כאב בחולים סופניים
- כאב בחולי פרקינסון וטרשת נפוצה
- כאב הנובע ממחלות מעי דלקתיות
- בפועל, מאושרות התוויות כאב ממקורות נוספים, לאחר מיצוי טיפולים מקובלים קודמים, ומעקב מרפאה מקצועית בתחום ממנו נובע הכאב (ראו “מקרים חריגים" בהמשך)
צורות שימוש
תכשירי הקנאביס נבדלים באופן הפקתם (סינתטי לעומת צמחי), בדרך המתן ובתכולת החומרים הפעילים בהם.
תרופות מבוססות קנאביס
תכשירים המכילים כמות ידועה ומבוקרת של THC ו-CBD.
בישראל, התכשיר Nabiximols (Sativex) מאושר להקלת כאב נוירופתי בחולי טרשת נפוצה ועשוי להיות יעיל להפחתת כאב בחולי סרטן. מאחר, ומדובר בתרופה לא יורחב עליה הדיבור במסמך זה.
קנבינואידים צמחיים
תכשירי קנאביס ממקור צמחי זמינים, בעיקר, בצורת תפרחת קנאביס או מיצוי קנאביס בשמן. חלק קטן מהמטופלים צורכים קנאביס באכילה על ידי שילובו במאכלים שונים (עוגיות, שוקולד), אך אופן שימוש זה אינו מומלץ, עקב שונות ניכרת בזמינות הביולוגית של החומרים הפעילים בדרך נטילה זו. בנוסף לכך, קיימים תכשירי קנאביס לשימוש מקומי כמשחות או שמנים למריחה אך הם אינם מאושרים לשימוש על ידי משרד הבריאות ואין עדויות ליעילותם.
| צורת מתן | אופן השימוש | ספיגה | יתרונות | חסרונות |
|---|---|---|---|---|
| תפרחות קנאביס מיובשות | עישון או אידוי(*) | ספיגה דרך ריריות דרכי הנשימה |
|
|
| מיצוי שמן קנאביס | מתן תת-לשוני | ספיגה דרך ריריות הפה |
|
תופעות לוואי כשמופיעות הן ממושכות |
| עוגיות קנאביס | ניתנות בבליעה | ספיגה דרך מערכת העיכול ומשם מעבר מטבוליזם כבדי לפני פיזור בסירקולציה |
|
|
(*) לא מומלץ, שימוש בעישון. מומלץ, שימוש במכשירי אידוי המאושרים על ידי משרד הבריאות
ריכוז החומרים פעילים
צמח הקנאביס מכיל עשרות רבות של מרכיבים בעלי פוטנציאל לפעילות ביולוגית, אך עיקר המידע המצוי בידינו מתייחס לשני המרכיבים הפעילים המוכרים ביותר: THC ו-CBD.
בתרופות מבוססות קנאביס, ידועים הריכוזים המדויקים של שני החומרים הפעילים, בדומה לכל תרופה אחרת. בתכשירי קנאביס ממקור צמחי, תפרחות או שמן, יש שונות בין ריכוזי החומרים הפעילים בין התכשירים, ואף בין אצוות שונות של אותו התכשיר. על אריזות תפרחת או שמני הקנאביס מצוינים אחוזי החומרים הפעילים, הנעים לרוב בין 20-1 אחוזים. משרד הבריאות מתיר סטייה של עד 4 אחוזים מן הערך הנקוב. לדוגמה, ריכוז 10 אחוזים=THC עשוי לנוע בין 6 אחוזים ל-14 אחוזים. התכשירים הקיימים מסווגים לשלוש קבוצות - THC-rich, CBD-rich ותכשירים מאוזנים.
| קטגוריה | THC:CBD | ריכוז THC | ריכוז CBD |
|---|---|---|---|
| THC-rich | T10:C2 | 10%
(6%-14%) |
2%
(0%-3.8%) |
| T15:C3 | 15%
(11%-19%) |
3%
(0%-5.5%) | |
| T20:C4 | 20%
(16%-24%) |
4%
(0%-7%) | |
| CBD-rich | T5:C10 | 5%
(2.5%-7.5%) |
10%
(6%-14%) |
| T3:C15 | 3%
(0.5%-5.5%) |
15%
(11%-19%) | |
| T1:C20 | 1%
(0.0%-2.5%) |
20%
(16%-24%) | |
| T0:C24 | 0%
(0.0%-0.5%) |
24%
(20%-28%) | |
| תכשירים מאוזנים | T5:C5 | 5%
(1%-9%) |
5%
(1%-9%) |
| T10:C10 | 10%
(6%-14%) |
10%
(6%-14%) |
פרמקוקינטיקה
מגוון רחב של תכשירים המכילים קנבינואידים פותחו לצורך שימוש קליני, אך המידע הקיים באשר למאפיינים הפרמקולוגיים שלהם הוא מוגבל.
- ספיגה: מהירות הספיגה והזמינות הביולוגית משתנים בהתאם לאופן הצריכה - שאיפה, מתן תת-לשוני או בליעה
- בשאיפה (עישון או אידוי) ריכוז הקנבינואידים בפלסמה מגיע לשיאו במהירות עם זמינות ביולוגית גבוהה יחסית, התלויה במאפייני השאיפה המשתנים בין שאיפה לשאיפה ובין מטופל למטופל (תדירות שאיפות, נפח השאיפה, משך הזמן בו מוחזק האוויר הנשאף בריאות ועוד)
- במתן תת-לשוני, בדומה לשאיפה, החומרים הפעילים אינם עוברים מטבוליזם ראשוני בכבד, ועל כן, מגיעים לשיא ריכוזם בדם תוך זמן קצר, אך במידה פחותה בהשוואה לשאיפה
- כאשר נספגים במערכת העיכול, עוברים הקנבינואידים מטבוליזם ראשוני בכבד, ולכן, ריכוזם מגיע לשיא באיטיות יחסית וזמינותם הביולוגית נמוכה בהשוואה לשאיפה או מתן תת-לשוני
- פיזור: הקנבינואידים הם מולקולות ליפופיליות ועל כן, הן חוצות את Blood brain barriers ומצטברות ברקמות שומן. הפיזור הראשוני של הקנבינואידים מהיר ברקמות וסקולריות כגון: הריאות, הלב, המוח והכבד. נפח הפיזור נאמד ב-3.4 ליטר לקילוגרם והוא משתנה בהתאם ליחס הרקמות בגוף (למשל: יהיה שונה בין מטופל שמן לבין מטופל עם דלדול של רקמת השומן בגוף). בשימוש ממושך, מצטברים הקנבינויאידים ברקמות השומן ומשתחררים באיטיות חזרה אל מחזור הדם, כתוצאה מכך, קטן קצב הפינוי שלהם מהגוף
- מטבוליזם:
חומר פעיל מטבוליזם מטבוליטים THC עובר מטבוליזם, בעיקר בכבד על ידי ציטוכרום CYP450 והאיזואנזימים CYP3A4, CYP2C19 & CYP2C9 - 11-Carboxy-THC: ללא פעילות פסיכואקטיבית, בעל השפעה אנלגטית ואנטי-דלקתית
- 11-Hydroxy-THC: בעל פעילות פרמקולוגית דומה ל-THC
CBD עובר מטבוליזם במעי ובכבד על ידי הציטוכרומים CYP3A4 & CYP2C19 תוצר הפירוק העיקרי הוא Hydroxy-Cannabidiol-7. למטבוליט זה מיוחסת השפעה פרמקולוגית נוגדת פרכוס.
- פינוי: תוך חמישה ימים 90-80 אחוזים מה-THC מתפנה מהגוף, כ-65 אחוזים מופרש בצואה וכ-20 אחוזים דרך השתן. זמן מחצית החיים (T1/2) הוא כ-24 שעות עבור THC וכ-24–30 שעות עבור CBD, אם כי הוא אינו אחיד ומושפע ממשתנים רבים. כך למשל, פינוי איטי יותר נמדד במטופלים המשתמשים בקביעות בכמויות גדולות של קנאביס זאת, קרוב לוודאי, עקב אגירה של החומרים הפעילים ברקמות שומן ושחרור מושהה מהן
קווים מנחים לטיפול
הצלחה או כישלון של טיפול תרופתי תלויים בהדרכה נכונה וליווי צמוד של המטופל, על אחת כמה וכמה כאשר מדובר בקנאביס זאת, מכיוון שהטיפול בו דורש התאמה אישית לכל מטופל מבחינת ההתוויה לשימוש, המינון, צורת המתן, ההרכב הספציפי וקצב הטיטרציה. מורכבות זו, מחייבת הדרכה טובה בתחילת טיפול אך לא פחות מכך מעקב וליווי מתמשכים.
הערכה לפני תחילת טיפול
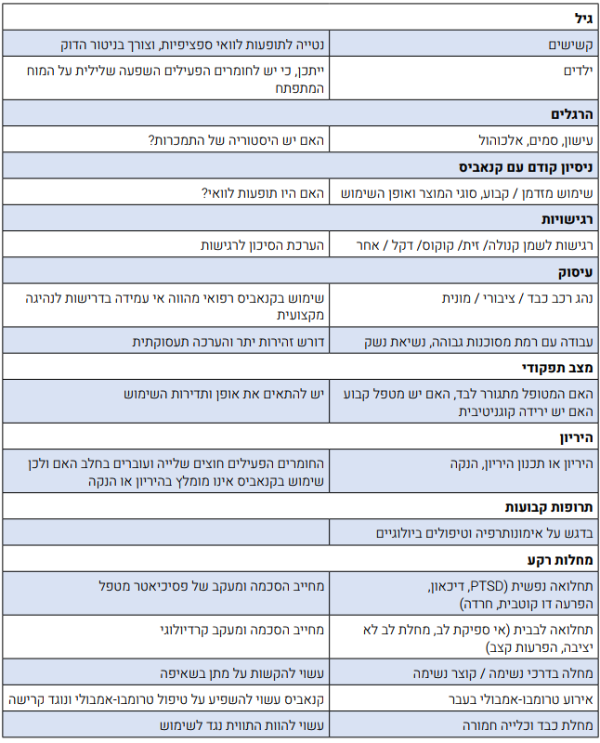
לפני תחילת הטיפול יש להתייחס לנקודות הבאות:
- האינדיקציה הרפואית למתן קנאביס
- האם ישנן התוויות נגד
- מהי מטרת הטיפול - תיאום ציפיות יחד עם המטופל (הפחתה בכאב, שיפור בשינה, הקלה על בחילות)
- מצבים הדורשים התייחסות מיוחדת, כמפורט בפרק "בטיחות הטיפול בקנאביס"
בחירת תכשיר
צורת המתן
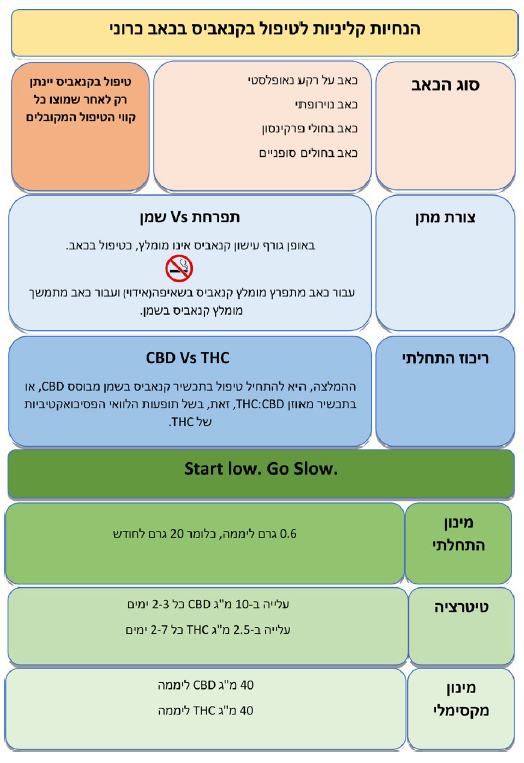
- קיימת הסכמה בינלאומית נרחבת לכך, שעישון קנאביס אינו מומלץ כדרך טיפול בכאב בגלל ההשלכות הבריאותיות השליליות של עישון. אנו מצטרפים להסכמה זו וממליצים, להימנע מתחילת טיפול בקנאביס בעישון. במידה, ונדרש בכל זאת שימוש בשאיפה מומלץ, לעשות זאת באמצעות מאייד. קיימים בארץ מכשירי איוד שונים. אנו ממליצים על שימוש במכשירים בעלי אישור אמ"ר
- בפועל, ובניגוד להמלצות הרשמיות, מרבית המטופלים בישראל צורכים קנאביס בשאיפה, ייתכן, כי מסיבות חברתיות, היסטוריות, הבדלים בפרופיל תופעות הלוואי ובשל אפקט פסיכוטרופי עוצמתי יותר (בשאיפה ה-״High״ מורגש יותר ותחושת ההקלה בכאב מהירה יותר)
- תזמון הכאב: עבור כאב רציף מומלץ, תכשיר מבוסס מיצוי שמן בעוד שעבור כאב מתפרץ תתאים יותר שאיפת תפרחת (הכוונה בשאיפה היא לאידוי הקנאביס ולא לעישון). לכאב משולב (מתמשך ומתפרץ) ניתן לשלב
ריכוזי החומרים הפעילים
עיקר המחקר הקליני מתמקד ב-THC. יש יותר עדויות התומכות ביעילות אפשרית של THC בהפחתת כאב בהשוואה ל- CBD. עם זאת, בשל תופעות הלוואי הפסיכוסומטיות של THC, ההמלצה הגורפת היא להתחיל טיפול בתכשיר קנאביס מבוסס CBD או בתכשיר מאוזן CBD:THC (ריכוז ה-TCH ומה לזה של ה-CBD) כפי שיפורט בהמשך, הבקשה לאישור קנאביס, הרישיון לשימוש בו, המרשמים והניפוק מבוצעים בגרם קנאביס לחודש, זאת, ללא קשר לצורת המתן או לריכוז החומרים הפעילים בכל גרם קנאביס. אלו יחידות שאנחנו כמטפלים איננו מורגלים בהן. אנו נדרשים לחשב את כמות החומרים הפעילים בכל מנה (לדוגמה מיליגרם THC למנה).
חישוב המינון
- אופן חישוב המינון: מרשמי הקנאביס הרפואי מציינים מינון חודשי (גרם לחודש של קנאביס) וריכוז חומרים פעילים, משרד הבריאות מאשר מינון בן 20 גרם לחודש לתחילת טיפול, דהיינו 0.6 גרם קנאביס ליום. ריכוזי החומרים הפעילם THC ו-CBD האפשריים נעים בין 1 אחוז לבין 20 אחוזים (ייתכנו תכשירי CBD בריכוז 24 אחוזים). משמעות הדבר היא שכל גרם קנאביס מכיל בין 10 מיליגרם (1 אחוז) לבין 200 מיליגרם (20 אחוזים) חומר פעיל. מתוך נתונים אלה מומלץ, לחשב את כמות החומרים הפעילים למנה, בדיוק כפי שנהוג לגבי תרופות אחרות. קל יותר לעשות זאת בשמני הקנאביס הזמינים בבקבוקים בני 10 מיליליטר המכילים, בקירוב, 10 גרם שמן קנאביס. על הבקבוק רשומים ריכוזי החומרים הפעילים, ומשקל הטיפה או מספר הטיפות לכל מיליליטר (כלומר, לכל גרם קנאביס). לעיתים, רשומה כמות החומר הפעיל בכל טיפה (לדוגמה 4.5 מיליגרם THC לטיפה). קשה הרבה יותר לעשות זאת עם תפרחת קנאביס הנצרכת באידוי, משום שכמויות התפרחת הנטענות במכשיר האידוי אינן מדויקות. יוצא מן הכלל בהקשר זה, הוא משאף Syqe בו כמות החומרים הפעילים מדויקת
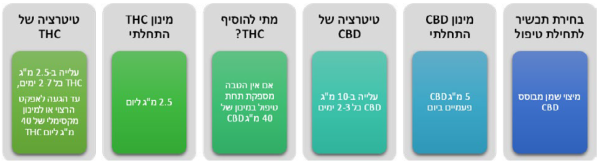
- על פי חלק מההמלצות הקליניות רצוי להתחיל טיפול בתכשיר המכיל רק או בעיקר CBD, בעיקר מטעמי בטיחות. מומלץ, להתחיל במינון יומי בן 5- מיליגרם של CBD
- טיטרציה: מומלץ, לעלות במינון ה-CBD בהדרגה עד מקסימום 40–50 מיליגרם CBD ליממה. אם לא מושגת הקלה מספקת בכאב יש לעבור לתכשירים המשלבים THC במינון יומי התחלתי של כ-2.5 מיליגרם. המינון המרבי המומלץ, לדעת חלק מן ההנחיות, הוא עד 40 מיליגרם THC ביממה (השקול לכ-7.5 גרם תפרחת T20 בחודש). מינון זה נמוך משמעותית ביחס למקובל בישראל
- מספר מנות יומיות: מומלצת, תחילת טיפול במנה אחת עד שתי מנות יומיות. בהתאם לאפקט האנלגטי ולקיומן של תופעות לוואי, ניתן לעלות במספר המנות ביממה לרוב עד 3–4 מנות ביממה. הוספת מנות צריכה להתחשב בתבנית פיזור הכאב לאורך היממה, ובפעילויות בהן מעורב המטופל (ובכללן, פעילויות הדורשות מיומנויות קוגניטיביות או מוטוריות). ככלל, יש להעדיף תכשירים דלי THC בשעות היום, ובמידת הצורך תכשירים עם ריכוזי THC גבוהים יותר בשעות הלילה
- אחד השיקולים בהגבלת המינון המרבי של THC הוא האפשרות כי הקשר בין מינון ה-THC והאפקט האנלגטי כשלעצמו אינו ליניארי: בריכוזים נמוכים עלייה במינון THC מביאה לאפקט אנלגטי רב יותר, בעוד במינונים גבוהים עלייה דומה אינה מביאה לתוספת אנלגזיה ואולי אף מביאה להגברת כאב
- המרה מעישון למיליגרם: במטופלים המעוניינים להפסיק לצרוך קנאביס בעישון ולעבור לטיפול במיצוי שמן, תידרשנה, קרוב לוודאי, כמויות THC ו-CBD (במיליגרם) קטנות בהרבה מאלה שנצרכו בעישון. לדוגמה: מטופל שצרך 200 מיליגרם THC ליממה (השווים לגרם קנאביס המכיל 20 אחוזים THC), ייתכן, ואף סביר, שיזדקק לכמות קטנה עד פי עשרה של THC במיצוי שמן (דהיינו כ-20 מיליגרם ליממה). מקור המידע מבוסס על נתוני צריכה בישראל של שמן קנאביס בהשוואה לעישון, אך אין בנמצא נוסחת המרה ברורה בין צורות הצריכה. לאור זאת מומלץ, במקרים בהם המרה כזו מתבקשת, להפסיק את הצריכה בעישון ולהתחיל בטיטרציה של המינון בדרך המתן החלופית
- הפסקת טיפול - במצבים, בהם התאמת מינון והחלפת אופן הנטילה אינן מביאות לאפקט קליני מספק או גורמות לתופעות לוואי משמעותיות, יש לשקול הפסקת הטיפול בקנאביס. יש לקחת בחשבון את האפשרות להתפתחות תלות, ולהפחית את המינון בהדרגה עד להפסקה מלאה
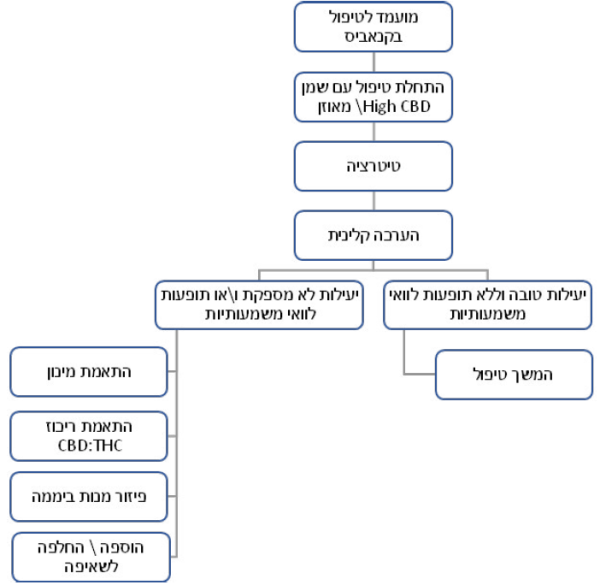
פרוטוקול בסיסי לטיפול בקנאביס[11]
דוגמאות קליניות לבחירת טיפול
מקרים חריגים
- עבור מטופלים שמצבם איננו בין ההתוויות המפורטות, ניתן להגיש בקשה לקנאביס רפואי עם המלצה מנומקת על ידי הרופא הכוללת: את הבסיס לסברה שקנאביס יסייע למטופל בצירוף אסמכתאות רפואיות ועם התחייבות למעקב סדיר והערכת יעילות הטיפול
- ככלל, לא תאושר בקשה של מטופל שאינו במעקב מרפאת כאב במשך שנה לפחות, אלא במקרים חריגים כאשר ישנה המלצה של מנהל המרפאה הכוללת: נימוק מפורט על הצורך באישור החריג
מעקב במהלך הטיפול
- במהלך הטיפול יש לקיים מעקב קליני הכולל הערכה של יעילותו ושל תופעות לוואי אפשריות. יעילות לא מספקת של הטיפול, או קיומן של תופעות לוואי משמעותיות יצריכו שינוי במספר המנות, המינון היומי ו/או בהרכב היחסי של החומרים הפעילים, או אף להפסקת הטיפול (ראו פירוט בהמשך)
- לאחר קבלת רישיון לראשונה, יש להגיע לביקורת מרפאה פרונטלית כעבור שלושה חודשים לכל היותר
- לאחר מכן, יש להקפיד על מעקב מרפאה פרונטלי אחת לשישה חודשים
חידוש רישיון
- את רישיון השימוש בקנאביס רשאי לחדש הרופא המטפל, או רופא אחר העובד באותה מסגרת רפואית, אם הרופא המטפל אינו זמין, ואין לדחות חידוש הרישיון בשל היעדרות הרופא.
- רישיון שהונפק על ידי רופא מטפל לא יחודש על ידי רופא מתחום מקצועי אחר, למעט במקרים של חולים פליאטיביים
- שנתיים לאחר תחילת השימוש בקנאביס רפואי, ובמידה, ונעשה ביקור מרפאה פרונטלי בחצי השנה שקדמה לכך, ניתן לחדש את הרישיון על סמך הערכה טלפונית בלבד
- בעת חידוש הרישיון יש לתעד את הבאים:
- שינויים בסטטוס האישי, משפחתי ותעסוקתי
- דיווח המטופל על מצב הרוח, תפקוד, שינה, תיאבון, השפעת הטיפול על עוד תחומי חיים, על איכות החיים
- משך השימוש ומועדי העלאת מינון
- אופן השימוש - צורת מתן, תדירות שימוש, פיזור במהלך יממה
- רשימת תרופות קבועות עדכנית
- במידה, ונמצא במעקב פסיכיאטרי/לבבי/אחר כתנאי לחידוש קנאביס, יש לקבל אישור אי התנגדות לחידוש הרישיון/סיכום מעקב מאת הרופא המומחה לתחום הרלוונטי
אלגוריתם לניהול הטיפול בקנאביס רפואי
בטיחות הטיפול בקנאביס
התוויות נגד על פי חוזר 106 של משרד הבריאות[12][13]
משרד הבריאות ממליץ, להעריך ולבחון בבחינה מיוחדת שימוש בקנאביס במצבים הבאים
- מחלת כבד או כליות
- מחלת לב וכלי דם חמורה כגון: תעוקת חזה, התקף לב בעבר, לחץ דם גבוה שאינו נשלט, או בעיה עם קצב הלב, או הדופק, או באם שינויים בדופק ובלחץ הדם נצפו לאחר תחילת הטיפול
איגוד הפסיכיאטריה בישראל והחברה הישראלית לרפואת התמכרויות ממליצים, לראות בהפרעה אפקטיבית ביפולארית אצל המטופל, או בקרב בן משפחה מיידי (משפחה גרעינית) ובהפרעת חרדה קשה ומגבילה - התוויות נגד לשימוש בקנאביס.
הפסקת טיפול
יש להפסיק את הטיפול במקרים הבאים:
- חשד לתגובה אלרגית
- היריון/הנקה - פרט למקרים חריגים במיוחד
- בכל מצב היפומאני/מאני/פסיכוטי חדש - הפסקה מיידית
- בכל ביטוי פסיכיאטרי חדש אחר - יש להפנות להערכה מיידית, במידת הניתן, קודם להחלטה על הפסקה ובכל מקרה, יש לבקש הערכה פסיכיאטרית כתנאי לחידוש
- עלייה במינון מקביל של משככי כאבים או תרופות נוירופסיכיאטריות, ללא הסבר אורגני מזוהה
- חוסר יעילות לאורך זמן למרות ניסיונות חוזרים ובמעקב רפואי סדיר
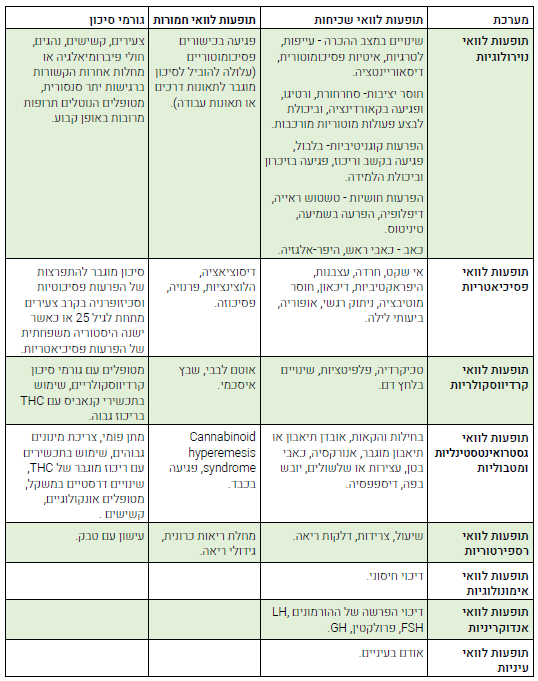
תופעות לוואי[6][14][15][16][17][18][19][20][21][22][23][24][25][26]
אינטראקציות בין תרופתיות
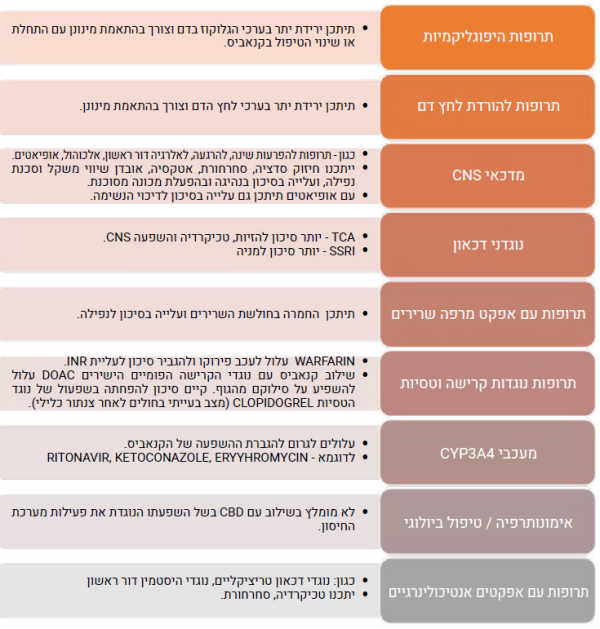
חולים הנוטלים קנאביס רפואי צורכים, לעיתים קרובות, תרופות נוספות לטיפול במצבם הרפואי. הדבר בולט בעיקר, באוכלוסייה הקשישה הסובלת לרוב ממחלות כרוניות ונזקקת, בדרך כלל, למספר רב של תרופות העשויות להשפיע על הקנבינואידים, או להיות מושפעות מהם. רשימת התרופות הללו מתעדכנת באופן תדיר על פי דיווחים המתפרסמים בספרות, אך דיווחים אלו אינם תמיד בעלי משמעות קלינית[2].
יש לנקוט זהירות יתר בשילוב קנאביס עם התרופות הבאות:
מצבים הדורשים התייחסות מיוחדת לפני תחילת טיפול:
הנחיות שימוש מיוחדות
קנאביס ונהיגה
הנחיות מטעם המרב"ד[27]
הנחיות המכון הרפואי לבטיחות בדרכים (מרב"ד) לנהיגה תחת שימוש מבוקר בקנאביס רפואי על פי דו"ח שפורסם ב-2015:
- על פי חוקי התעבורה חל איסור על נהיגה תחת השפעת קנאביס, באחריות הנהג לפעול על פי החוק
- נהיגה פרטית - הנחיות משרד הבריאות אינן מחייבות לדווח על שימוש בקנאביס רפואי למרב"ד
- נהיגה מקצועית - שימוש בקנאביס רפואי מהווה אי עמידה בדרישות לנהיגה מקצועית
נכון למועד כתיבת נייר זה, לא מאושר בישראל, לנהוג אם נוטלים באופן קבוע קנאביס רפואי. ייתכן שהדבר ישתנה כיוון שפותח מכשיר למדידת רמת THC ברוק וייתכן שינוי תקנות בנושא.
קנאביס בבעלי תפקידים רגישים
תשומת לב וזהירות יתר נדרשות עבור מטופלים בקנאביס רפואי העוסקים במקצועות רגישים, עם פוטנציאל לנזק עצמי או נזק לאחרים[28]. אין מידע זמין על הקשר בין שימוש בקנאביס רפואי לבין תאונות עבודה. ישנו מידע מוגבל על שימוש בקנאביס שאינו רפואי, לבין תאונות עבודה, והוא אינו מספק על מנת לתמוך או להפריך קשר מובהק ביניהם. על מנת לנקוט בזהירות יתר, ובשל תופעות הלוואי הפוטנציאליות של קנאביס, ארגון הכאב האירופאי ממליץ, על הערכה תעסוקתית עבור מטופלים בקנאביס רפואי המפעילים מכונות או עוסקים בתפקידים רגישים.
הוראות לטיסה אל מחוץ לישראל
חלק מן המטופלים המדווחים על שיפור בתפקוד עם שימוש בקנאביס מעוניינים לנסוע אל מחוץ לישראל. המלצתנו היא, להימנע מכך, בגלל סיכון למעצר, אישום הברחת סם וכיוצא בזה. צריך לברר באופן רשמי דרך פנייה לשגרירות (או לקונסוליה) של המדינה אליה מעוניינים לטוס, ולקבל מסמך רשמי מאותה מדינה המאשר זאת.
בטיחות השימוש ואחסון של תכשירי הקנאביס
יש להתייחס לקנאביס ומוצריו כתרופה/חומר מסוכן. כלומר, יש לאחסן את הקנאביס וכל ציוד נלווה במיקום גבוה ונעול, הרחק מהישג ידם של ילדים.
אוכלוסיות מיוחדות
קנאביס בקשישים
לצד עלייה כללית בשימוש בקנאביס בישראל, ישנה עלייה חדה בשימוש בקנאביס בקרב האוכלוסייה המבוגרת, בגילאי 65 ומעלה[29][30][31]. תחלואה אונקולוגית, וכאב כרוני נפוצים, במיוחד, בקרב אוכלוסייה זו ובנוסף, השכיחות של הפרעות שינה, תיאבון ירוד ושינויים במצב הרוח גבוהה בגילאים אלו. האיזון התרופתי של כאב בקשישים הוא מאתגר במיוחד, זאת, בשל נטייה מוגברת לתופעות לוואי, ריבוי תרופות קבועות וסבירות גבוהה לאינטראקציות בין תרופתיות המגבילות את סל הטיפולים הפוטנציאליים עבורם. קנאביס רפואי נותן מענה טיפולי במצבים רבים בהם: טיפול תרופתי אחר אינו נסבל, או נכשל ועל כן, מהווה טיפול רווח בקרב האוכלוסייה המבוגרת.
הפרמקוקינטיקה של קנאביס בקשישים היא ייחודית. ראשית, היא תלויה בתפקוד כבדי וכלייתי, אשר לרוב פוחתים בגיל המבוגר, ועל כן, גדל זמן מחצית החיים של הקנבינואידים בגופם של קשישים. שנית, אחוז מסת השומן בקרב קשישים לרוב גבוה יחסית, מה שמגדיל את נפח הפיזור של מולקולות מסיסות שומן כמו הקנבינואידים.
בהתאם לכך, הטיפול בקנאביס רפואי בקשישים דורש תשומת לב וניטור קפדני של תופעות הלוואי שכיחות באוכלוסייה זו, כמפורט בפרק ״תופעות לוואי״.
נקודה חשובה נוספת באשר לטיפול בקנאביס בקשישים היא האפשרות של הטיית החומר לטובת בן משפחה (diversion), לאור העובדה שקנאביס אינו ניתן לקנייה חוקית בישראל לצורכי הנאה, ובמיוחד, כאשר מדובר על קנאביס בתפרחת עם ריכוזי THC גבוהים.
צריכת קנאביס בשמן, עם ריכוזי CBD גבוהים וריכוזי THC נמוכים, היא השיטה המועדפת עבור קשישים. במקרים בהם יש צורך בטיפול לכאב מתפרץ יש לשקול קנאביס בשאיפה - בשימוש במכשיר אידוי. לפי הצורך, ניתן לשקול עלייה הדרגתית במינון הקנאביס, מספר הטיפות או השאיפות וכן, שינוי בריכוזים. יש לבצע, שינויים אלו בצורה איטית והדרגתית, ככל הניתן, במטופל הקשיש, על מנת להימנע מתופעות לוואי.
קנאביס בילדים
טיפול בקנאביס בילדים דורש התייחסות מיוחדת[32]. זאת, מכיוון שקיים מעט מאוד מחקר על קנאביס רפואי בילדים בכאב ובתחומים אחרים; מתחת לגיל 18 מערכת העצבים עדיין בשלבי התפתחות, ואין מספיק מידע באשר להשפעות הקנבינואידים על התפתחותה.
שימוש בקנאביס לצורכי פנאי במתבגרים (זנים המכילים בעיקר THC), כרוך בירידה בהישגים לימודיים ובסיכון מוגבר לתחלואה נוירופסיכיאטרית קשה ובפרט חרדה, פסיכוזה, הפרעות אפקטיביות, ירידה במוטיבציה והתמכרות. לכן, מומלץ להשתמש בילדים במוצרים המכילים כמות מינימלית או לחלוטין ללא THC. ההוכחות הראשוניות לבטיחות קנאביס בילדים מדברות על תכשירים עשירים ב-CBD, כך, שאם מותווה שימוש בקנאביס בילדים, מומלץ לבחור בתכשיר מבוסס CBD. יש לסייג מהמלצה זו מצבים בהם נדרש טיפול חמלה, בהם ניתן לשקול שימוש בתכשירים המכילים THC. זאת, בעיקר בילדים עם מחלת סרטן או מחלות סופניות אחרות.
היריון, הנקה ופוריות
קנבינואידים אקסוגניים הם חומרים ליפופיליים. על כן, הם חוצים שלייה ומתרכזים בחלב האם. מכאן, עולה החשש כי חשיפה לקנאביס במהלך היריון או הנקה עלולה להיות בעלת השפעות שליליות על מהלך תקין של היריון והתפתחות העובר והילוד[33][34][35][36][37].
היריון
מחקרים על חיות מעבדה הדגימו שחשיפה לקנבינואידים אקסוגניים בתקופה העוברית עשויה להפריע להתפתחות ותפקוד תקין של מוח העובר. מחקרים קליניים הראו קשר בין צריכת קנאביס במהלך ההיריון לבין משקל לידה נמוך, צורך מוגבר באשפוז ב-ICU (Intensive Care Unit) לאחר הלידה, והשפעות שליליות בטווח הארוך לרבות, פגיעה קוגניטיבית, הפרעות התנהגות בגילאי הבגרות, ואף סיכון מוגבר לאוטיזם. כמו כן, תועדו סיבוכים מיילדותיים בנשים הצורכות קנאביס במהלך ההיריון, כולל שכיחות גבוהה יותר של אנמיה אימהית, לידה מוקדמת וסיכון מוגבר ללידה שקטה. עם זאת, המחקר הקליני בנושא מבוסס בעיקר, על שימוש ׳פנאי׳ בקנאביס (כלומר, לא למטרות רפואיות), הוא דל יחסית והתוצאות במחקרים השונים סותרות ואינן חד משמעיות.
בשל חוסר הוודאות והחשש מסיבוכים לאם ולעובר, ממליץ ACOG (American college of Obstetricians and Gynecologists) להימנע משימוש בקנאביס רפואי בנשים המתכננות היריון ובמהלך ההיריון, ולהעדיף טיפול אלטרנטיבי בטוח לשימוש במהלך ההיריון.
הנקה
THC עובר לחלב האם ואף נוטה להצטבר בו, כך שבנשים הצורכות קנאביס בתדירות גבוהה, ריכוז ה-THC בחלב האם עשוי להיות גבוה, עד פי שמונה מריכוזו בדם האם. בדגימות צואה של ילודים היונקים מאם הצורכת קנאביס, נמצאו נגזרות פירוק של THC, מה שמעיד כי החומר נספג לדם הילוד ועובר מטבוליזם כבדי. אין די מידע על ההשלכות קצרות או ארוכות הטווח של צריכת קנאביס במהלך הנקה על הילוד.
בשל החשש מהשפעות שליליות פוטנציאליות, ה-ACOG ממליצים להימנע משימוש בקנאביס באם המניקה.
פוריות
ידוע, כי רכיבים של המערכת האנדוקנביאנואידית נמצאים באיברי הרבייה הזכריים, כולל האשכים ותאי זרע, ואף משתתפים ברגולציה של הפרשת טסטוסטרון. עם זאת, השפעתם על ספרמטוגנזה אינה ידועה, ונכון להיום, אין מידע קליני המאפשר לקבוע האם לצריכת קנאביס יש השפעה מזיקה על תפקוד מיני ופריון הגבר.
התמכרות ותלות
התמכרות לחומרים, כגון קנאביס, מוגדרת כשימוש כפייתי בחומר למרות נזקים נלווים משמעותיים.
קנאביס מוכר כחומר ממכר, כאשר ככל שריכוז THC, החומר הפסיכואקטיבי הפעיל המרכזי, גבוה יותר, וככל, שמינון הקנאביס הנצרך גבוה יותר, כך הסיכון להתמכרות עולה[38].
התמכרות מתאפיינת בתסמינים הבאים:
- גופניים - פיתוח סבילות (עלייה בדפוס השימוש בקנאביס לצורך קבלת השפעה דומה) או הופעת תסמיני גמילה כאשר לא נוטלים את הקנאביס
- פסיכולוגיים - עיסוק יתר כפייתי בשימוש בקנאביס, התמקדות בקנאביס על חשבון תחומי חיים אחרים אשר נזנחים
- התנהגותיים - שימוש במצבי סיכון, והמשך שימוש אינטנסיבי למרות נזקים נלווים משמעותיים (לדוגמה: בתחום התעסוקה, החברה, המשפחה)
תסמונת גמילה מקנאביס מוכרת כאבחנה ב-DSM, ומתאפיינת בכעס או איריטביליות; עצבנות או חרדה; הפרעות בשינה; ירידה בתיאבון; מצב רוח ירוד; אי שקט[39].
ככלל, מתוך צרכני הקנאביס כ-10 אחוזים מפתחים התמכרות, ומתוך הצרכנים היומיומיים כ-50 אחוזים מפתחים התמכרות. עם זאת, נתונים אלו, כמו גם הקריטריונים הרפואיים המקובלים לאבחון של התמכרות לקנאביס מבוססים על צרכני קנאביס לפנאי, ואינם בהכרח מתאימים לאבחון התמכרות לצרכני קנאביס רפואי לטיפול בכאב. על פי הידוע, כ-10 אחוזים מאלו הצורכים קנאביס רפואי לטיפול בכאב כרוני מפתחים התמכרות. על רקע ההבדלים בין מאפייני הצריכה של קנאביס לפנאי וקנאביס לצרכים רפואיים, ובהיעדר כלים המיועדים לאבחון התמכרות לקנאביס רפואי, מומלץ, להיעזר בהנחיות הקליניות מטה[40][41].
- קביעת המטרות התפקודיות של שימוש בקנאביס רפואי, מעבר להקלה סובייקטיבית בכאב. ככל שקיימת ירידה תפקודית (משפחה, פנאי, תעסוקה, לימודים) עם צריכת הקנאביס, כך גדל הסיכוי שהאדם מפתח התמכרות. מנגד, ככל שקיים שיפור תפקודי תחת צריכת קנאביס, כך קטן הסיכוי שהאדם מפתח התמכרות. על כן מומלץ, לקבוע מטרות תפקודיות ברורות ולעקוב אחר הקשר בין צריכת הקנאביס והשגתן
- מעקב אחר דפוס העלייה במינון הקנאביס הנצרך - לא קיים גבול מינון ברור אשר מצביע על התפתחותה של התמכרות ועל כן, יש לעקוב אחר דפוס העלייה במינון צריכת הקנאביס במהלך הטיפול. ככל שקיימת בקשה תכופה לעלייה במינון הקנאביס, בייחוד, במינונים העולים על 60 גרם לחודש (2 גרם ליממה) ובייחוד, בזני קנאביס המתאפיינים בריכוזי THC גבוהים (ובפרט אלו בגדר T15 ו-T20), כך עולה החשד להתפתחותה של התמכרות
- שאלות ייעודיות:
- האם אתה משתמש בקנאביס לצרכים שאינם הקלה על כאב (הפגת שעמום, שיפור מצב רוח, וכדומה)?
- האם השימוש בקנאביס פגע בתפקוד היומיומי או בביצוע מטלות חיים?
- האם ניסית להגביל או לצמצם את צריכת הקנאביס ללא הצלחה?
- האם דפוס השימוש שלך בקנאביס מהווה מקור מתח או ריבים עם הסביבה הקרובה?
- האם אתה משתמש בקנאביס במצבים העלולים להיות מסוכנים מבחינה גופנית (נהיגה, הפעלת מכשור כבד, וכדומה)?
- האם קיימות הפרעות פסיכיאטריות נוספות ברקע (דיכאון, חרדה, וכדומה)?
- האם קיימות התמכרויות אחרות ברקע?
שאלות אלו אינן מרכיבות שאלון מתוקף, והגם שקיימים שאלונים מתוקפים רבים לסקירה ואבחון של התמכרות לקנאביס, אלו מבוססים על צרכני קנאביס לפנאי ולא קנאביס רפואי לצורכי כאב. השאלות מעלה לקוחות בחלקן, משאלונים מתוקפים אלו, בחלקן, משאלונים ייעודיים להתמכרות למשככי כאב אופיואידיים ובחלקן ממוקדות בשימוש בקנאביס לצורכי כאב[42].
ככל שמספר התשובות החיוביות לשאלות אלה גבוה יותר, כך עולה החשד להתמכרות לקנאביס.
אם קיים חשש להתפתחות התמכרות לקנאביס, מומלץ, להפנות לייעוץ פסיכיאטר המתמחה בטיפול בהתמכרויות, לצורך אבחון ההתמכרות והפרעות פסיכיאטריות נלוות, וביצוע התערבות טיפולית בהתאם לצורך.
הטיפול בהתמכרות לקנאביס עשוי לכלול הפנייה לגמילה במסגרת אשפוז של משרד הבריאות, או לחלופין טיפול מרפאתי שיכלול טיפול תרופתי להפרעות הפסיכיאטריות הנלוות (לדוגמה: דיכאון וחרדה), טיפול פסיכותרפי פרטני וטיפול קבוצתי. לא קיים טיפול תרופתי ייעודי המאושר לטיפול בהתמכרות לקנאביס.
קנאביס לטיפול בכאב כרוני - ספרות עדכנית
השימוש בקנאביס רפואי כטיפול בכאב הולך וגובר, זאת, אף על פי שהמידע הקיים באשר להשפעותיו ובטיחותו מוגבל, אין די Evidence based data מהימן על יעילותו כטיפול בכאב כרוני, והספרות בנושא מורכבת ושנוייה במחלוקת.
אינספור מאמרי סקירה ומטה-אנליזות פורסמו, עם מסקנות חיוביות ושליליות כאחד, כאשר חלק נכבד מהם בעלי בעיות מתודולוגיות המגבילות את תוקפם ומהימנותם[43].
סקירה עדכנית ומקיפה שבחנה 57 מאמרי סקירה (overview of reviews) מ-20 השנים האחרונות, העוסקים ביעילות קנאביס כטיפול בכאב, קבעה כי איכותם מוטלת בספק, ולא ניתן להשתמש בהם כבסיס לקבלת החלטות קליניות[6].
סקירה נוספת, שפורסמה על ידי ה-IASP, הסיקה כי כלל הראיות המחקריות שהצטברו, אינן מספקות הוכחה מובהקת התומכת או מפריכה את יעילותם ובטיחותם של קנאביס, קנבינואידים או תרופות מבוססות קנאביס כטיפול בכאב[7].
למרות המחסור היחסי במחקרים איכותיים לצורך ביסוס מדעי, השימוש בקנאביס כטיפול בכאב הולך וגובר, כאשר חלק נכבד מהמטופלים עושים שימוש לא חוקי על דעת עצמם בקנאביס לצורך טיפול בכאב כרוני, ורבים מהם מדווחים על הקלה בסבלם ושיפור בכאב תחת השימוש.
בעקבות זאת, מדינות רבות ברחבי העולם מאמצות רפורמות לשימוש רפואי בקנאביס, זאת, למרות המורכבות הניכרת הנובעת מהיעדר הדירות בתהליכי הייצור וכתוצאה מכך, שונות גדולה במאפיינים הפרמקולוגיים של תכשירים שונים.
ה-NICE (National Institute for Health & Care Excellence) פרסם ב-2019 מסמך הנחיות רשמיות לטיפול במוצרי קנאביס, הכולל, בין היתר, התייחסות לכאב כרוני. הארגון קובע כי אין לטפל בכאב כרוני באמצעות מוצרי קנאביס, אלא רק כחלק ממחקר קליני, אז ניתן לטפל בתכשירים מבוססי CBD בלבד. הארגון מבסס את המלצותיו על כך שישנן ראיות לכך ש-CBD מפחית כאב, אך האפקט הוא מינורי (הפחתה של 0.4 בסולם מ-1–10). כמו כן, אין הוכחה לכך ששימוש בקנאביס מפחית צריכת אופיואידים[44].
ה-BMJ (British Medical Journal) פרסם המלצות קליניות לטיפול בכאב כרוני באמצעות קנאביס, המלצות אלו גובשו על ידי פאנל הכולל: רופאים מומחים מתחומים שונים, רוקחים, חוקרים ומטופלים. ההנחיות מתייחסות למטופלים הסובלים מכאב כרוני בינוני עד חמור, ללא תלות בסוג הכאב, לרבות, כאב נוירופתי, נוציצפטיבי, נוציפלסטי, וכאב הקשור במחלה ממאירה, אך הן אינן תקפות עבור מטופלים פליאטיביים. ההנחיות אינן כוללות שימוש בקנאביס בשאיפה, המהווה גורם סיכון לנזקים ריאתיים משמעותיים. הפאנל, שכלל בין היתר גם רופא ילדים ומומחה בהרדמה לילדים, סבור כי היעילות התרפויטית של קנאביס בהקלה על כאב תקפה גם עבור ילדים ומתבגרים. באשר לנזקים האפשריים באוכלוסייה זו, אמנם, ישנם מחקרים המראים קשר בין שימוש בקנאביס לבין תופעות לוואי נוירוקוגניטיביות לרבות, התקפים פסיכוטיים בקבוצת גיל זו, אך מחקרים אלו נעשו על משתמשי קנאביס לפנאי, הכולל ריכוזי THC גבוהים, שאינם ניתנים למטרות רפואיות. מנגד, ישנן עדויות עקיפות על בטיחות השימוש בתכשירים מבוססי CBD בילדים, ממחקרים שבחנו טיפול בקנאביס רפואי עבור חולי אפילפסיה. על כן, הפאנל ממליץ, שטיפול בילדים ומתבגרים יכלול תכשירים מבוססי CBD בלבד. באשר למינון, ההמלצה היא להתחיל במינון נמוך - 5 מיליגרם CBD פעמיים ביום עם עלייה ב-10 מיליגרם כל 2–3 ימים עד מינון מקסימלי של 40 מיליגרם. אם התגובה אינה מספקת, ועל בסיס שיקול קליני ניתן להוסיף 1-2.5 מיליגרם THC ליממה עם הוספה של 2.5-1 מיליגרם כל 2–7 ימים עד מינון מקסימלי של 40 מיליגרם THC.
European pain federations פרסם נייר עמדה המפרט את המלצות השימוש בקנאביס עבור סוגי כאב שונים. עבור כל סוגי הכאב, השימוש בתרופות מבוססות קנאביס הוא בגדר מחקר קליני אינדיבידואלי. עבור כאב הנלווה למחלה ממאירה, ניתן לשקול הוספת טיפול ב-Nabiximols כאשר אין הטבה מספקת תחת טיפול באופיואידים או תרופות לשיכוך כאב אחרות. עבור כאב נוירופתי, תרופות מבוססות קנאביס יכולות להינתן כקו טיפול שלישי. עבור סוגי כאב אחרים, שאינם קשורים במחלה ממארת ואינם על רקע נוירופתי, ניתן לשקול במקרים חריגים שימוש בתרופות מבוססות קנאביס לצורך טיפול, כאשר כל הניסיונות הטיפוליים הקודמים לכך כשלו. באשר לקנאביס בשאיפה או שמן קנאביס, הארגון ממליץ, על טיפול בהם כקו אחרון בלבד, רק אם כשלו ניסיונות הטיפול בתרופות מבוססות קנאביס ובכל מקרה, לא בעישון אלא באמצעות מאייד או מיצוי שמן[28].
נכון למועד כתיבת נייר זה, ה-FDA (Food and Drug Administration) טרם אישר שימוש בקנאביס כטיפול בכאב כרוני. תרופות מבוססות קנאביס אושרו לשימוש בהתוויות ספציפיות - Nabilone כטיפול ב-CINV, Dronabinol כטיפול ב-CINV (chemotherapy-induced nausea and vomiting) ובקכקסיה (Cachexia) בחולי AIDS ו-Cannabidiol (Epidiolex) כטיפול בפרכוסים הקשורים במחלות ספציפיות Lennox-Gastaut syndrome או Dravet syndrome או Tuberous sclerosis complex.
לסיכום, שימוש בקנאביס למטרות רפואיות ובפרט, כטיפול הוא מורכב, הן בשל שונות רבה בין תכשירים שונים והיעדר מכנה פרמקולוגי משותף, והן בשל מחסור במאמרים איכותיים לצורך ביסוס מדעי. בשל כך, ישנו קושי בקביעת הנחיות בינלאומיות רשמיות ואחידות לאופן הטיפול.
השתתפו בהכנת נייר העמדה
- ד"ר איתי גור אריה
- ד"ר אורי הוכברג
- ד"ר אופיר מורג
- פרופ' אליעד דוידסון
- ד"ר אמיר מינרבי
- גב' רונית מידן
- ד"ר חגי שרון
- ד"ר מלכה לזר
- מגר' יובל לנדשפט
- ד"ר טלי סחר
- ד"ר יעקב עצמון
- פרופ' שאולי לב-רן
- ד"ר רועי שיינפלד
ביבליוגרפיה
- ↑ Pisanti, S.; Bifulco, M. Medical Cannabis: A plurimillennial history of an evergreen. J. Cell. Physiol. 2019, 234, 8342-8351, doi:10.1002/jcp.27725.
- ↑ לקפוץ מעלה אל: 2.0 2.1 2.2 2.3 2.4 2.5 קנאביס רפואי - חוברת מידע ומדריך רפואי - חוזר משרד הבריאות
- ↑ McPartland, J.M.; Small, E. A classification of endangered high-THC cannabis )Cannabis sativa subsp. indica( domesticates and their wild relatives. PhytoKeys 2020, 144, 81-112, doi:10.3897/phytokeys.144.46700.
- ↑ McPartland, J.M. Cannabis Systematics at the Levels of Family, Genus, and Species. Cannabis Cannabinoid Res. 2018, 3, 203-212, doi:10.1089/can.2018.0039.
- ↑ Reimann-Philipp, U.; Speck, M.; Orser, C.; Johnson, S.; Hilyard, A.; Turner, H.; Stokes, A.J.; Small-Howard, A.L. Cannabis Chemovar Nomenclature Misrepresents Chemical and Genetic Diversity; Survey of Variations in Chemical Profiles and Genetic Markers in Nevada Medical Cannabis Samples. Cannabis Cannabinoid Res. 2020, 5, 215-230, doi:10.1089/can.2018.0063.
- ↑ לקפוץ מעלה אל: 6.0 6.1 6.2 6.3 Moore, R.A.; Fisher, E.; Finn, D.P.; Finnerup, N.B.; Gilron, I.; Haroutounian, S.; Krane, E.; Rice, A.S.C.; Rowbotham, M.; Wallace, M.; et al. Cannabinoids, cannabis, and cannabis-based medicines for pain management: an overview of systematic reviews. Pain 2020, Publish Ahead of Print, doi:10.1097/j.pain.0000000000001941.
- ↑ לקפוץ מעלה אל: 7.0 7.1 7.2 Haroutounian, Simon et al. International Association for the Study of Pain Presidential Task Force on Cannabis and Cannabinoid Analgesia: research agenda on the use of cannabinoids, cannabis, and cannabis¬based medicines for pain management. PAIN: July 2021 - Volume 162 - Issue - p S117-S124. doi: 10.1097/j. pain.0000000000002266
- ↑ לקפוץ מעלה אל: 8.0 8.1 8.2 8.3 THE ENDOCANNABINOID SYSTEM AND ITS THERAPEUTIC EXPLOITATION
- ↑ לקפוץ מעלה אל: 9.0 9.1 9.2 9.3 Cannabinoid Receptors and the Endocannabinoid System: Signaling and Function in the Central Nervous System
- ↑ Ben-Shabat, S.; Fride, E.; Sheskin, T.; Tamiri, T.; Rhee, M.-H.; Vogel, Z.; Bisogno, T.; De Petrocellis, L.; Di Marzo, V.; Mechoulam, R. An entourage effect: inactive endogenous fatty acid glycerol esters enhance 2-arachidonoyl- glycerol cannabinoid activity. Eur. J. Pharmacol. 1998, 353, 23-31, doi:10.1016/S0014-2999)98(00392-6.
- ↑ Consensus recommendations on dosing and administration of medical cannabis t**treat chronic pain: results of a modified Delphi process. Bhaskar et al. Journal of Cannabis Research (2021) 3:22. https://doi.org/10.1186/s42238-021-00073-1.
- ↑ National Academies of Sciences, E. The Health Effects of Cannabis and Cannabinoids: The Current State of Evidence and Recommendations for Research; 2017; ISBN 978-0-309-45304-2
- ↑ Sideli l, Trotta G, Spinazzola E, La Cascia C, Di Fort M. Adverse effects of heavy cannabis use: even plants can harm the brain; 2021 Pain 162, 7, sup 1
- ↑ Kalant, H.; Porath, A.J. Clearing the Smoke on Cannabis: Medical Use of Cannabis and Cannabinoids - An Update
- ↑ Moore, T.H.; Zammit, S.; Lingford-Hughes, A.; Barnes, T.R.; Jones, P.B.; Burke, M.; Lewis, G. Cannabis use and risk of psychotic or affective mental health outcomes: a systematic review. The Lancet 2007, 370, 319-328, doi:10.1016/S0140-6736)07(61162-3.
- ↑ Deshpande, A.; Mailis-Gagnon, A.; Zoheiry, N.; Lakha, S.F. Efficacy and adverse effects of medical marijuana for chronic noncancer pain. Can. Fam. Physician 2015, 61, e372-e381.
- ↑ Brown, J.D.; Winterstein, A.G. Potential Adverse Drug Events and Drug-Drug Interactions with Medical and Consumer Cannabidiol (CBD) Use. J. Clin. Med. 2019, 8, doi:10.3390/jcm8070989.
- ↑ Haroutounian, S.; zRazz, Y.; Ginosar, Y.; Furmanov, K.; Saifi, F.; Meidan, R.; Davidson, E. The Effect of Medicinal Cannabis on Pain and Quality-of-Life Outcomes in Chronic Pain: A Prospective Open-label Study. Clin. J. Pain 2016, 32, 1036-1043, doi:10.1097/AJP.0000000000000364.
- ↑ Wang, T.; Collet, J.-P.; Shapiro, S.; Ware, M.A. Adverse effects of medical cannabinoids: a systematic review. CMAJ Can. Med. Assoc. J. 2008, 178, 1669-1678, doi:10.1503/cmaj.071178.
- ↑ Dannon, P.N.; Lowengrub, K.; Amiaz, R.; Grunhaus, L.; Kotler, M. Comorbid cannabis use and panic disorder: short term and long term follow-up study. Hum. Psychopharmacol. 2004, 19, 97-101, doi:10.1002/hup.560.
- ↑ Minerbi, A.; Hauser, W.; Fitzcharles, M.-A. Medical Cannabis for Older Patients. Drugs Aging 2019, 36, 39-51, doi:10.1007/s40266-018-0616-5.
- ↑ Patel, R.S.; Manocha, P.; Patel, J.; Patel, R.; Tankersley, W.E. Cannabis Use Is an Independent Predictor for Acute Myocardial Infarction Related Hospitalization in Younger Population. J. Adolesc. Health Off. Publ. Soc. Adolesc. Med. 2020, 66, 79-85, doi:10.1016/j.jadohealth.2019.07.024.
- ↑ Goyal, H.; Awad, H.H.; Ghali, J.K. Role of cannabis in cardiovascular disorders. J. Thorac. Dis. 2017, 9, 2079¬2092, doi:10.21037/jtd.2017.06.104.
- ↑ Owen, K.P.; Sutter, M.E.; Albertson, T.E. Marijuana: Respiratory Tract Effects. Clin. Rev. Allergy Immunol. 2014, 46, 65-81, doi:10.1007/s12016-013-8374-y.
- ↑ Jackson, B.; Cleto, E.; Jeimy, S. An emerging allergen: Cannabis sativa allergy in a climate of recent legalization. Allergy Asthma Clin. Immunol. Off. J. Can. Soc. Allergy Clin. Immunol. 2020, 16, doi:10.1186/ s13223-020-00447-9.
- ↑ Moore, B.A.; Augustson, E.M.; Moser, R.P.; Budney, A.J. Respiratory effects of marijuana and tobacc**use in a U.S. sample. J. Gen. Intern. Med. 2005, 20, 33-37, doi:10.1111/j.1525-1497.2004.40081.x.
- ↑ תקנים והנחיות להתאמה רפואית לנהיגה מטעם המרב"ד
- ↑ לקפוץ מעלה אל: 28.0 28.1 Winfried Hauser et al. European Pain Federation )EFIC( position paper on appropriate use of cannabis¬based medicines and medical cannabis for chronic pain management. Eur J Pain. 2018;22:1547-1564. DOI: 10.1002/ejp.1297.
- ↑ Minerbi A, Hauser W, Fitzcharles MA. Medical Cannabis for Older Patients. Drugs Aging. 2019 Jan;36)1(:39- 51. doi: 10.1007/s40266-018-0616-5. PMID: 30488174.
- ↑ Ahmed AI, van den Elsen GA, Colbers A, van der Marck MA, Burger DM, Feuth TB, Rikkert MG, Kramers C. Safety and pharmacokinetics of oral delta-9-tetrahydrocannabinol in healthy older subjects: a randomized controlled trial. Eur Neuropsychopharmacol. 2014 Sep;24)9(:1475-82. doi: 10.1016/j.euroneuro.2014.06.007. Epub 2014 Jun 28. PMID: 25035121.
- ↑ van den Elsen GA, Ahmed AI, Lammers M, Kramers C, Verkes RJ, van der Marck MA, Rikkert MG. Efficacy and safety of medical cannabinoids in older subjects: a systematic review. Ageing Res Rev. 2014 Mar;14:56- 64. doi: 10.1016/j.arr.2014.01.007. Epub 2014 Feb 5. PMID: 24509411.
- ↑ Wong, S. S., & Wilens, T. E. )2017(. Medical cannabinoids in children and adolescents: A systematic review. Pediatrics, 140, pii: e20171818. https://doi.org/10.1542/peds.2017-1818
- ↑ Gunn JK, Rosales CB, Center KE, Nunez A, Gibson SJ, Christ C, Ehiri JE. Prenatal exposure tcannabis and maternal and child health outcomes: a systematic review and meta-analysis. BMJ Open. 2016 Apr 5;6)4(:e009986.
- ↑ Metz TD, Borgelt LM. Marijuana Use in Pregnancy and While Breastfeeding. Obstet Gynecol. 2018 Nov;132)5(:1198-1210. doi: 10.1097/AOG.0000000000002878. PMID: 30234728; PMCID: PMC6370295.An epidemiological, developmental and clinical overview of cannabis use during pregnancy
- ↑ Maccarrone M, Rapin**C, Francavilla F, Barbonetti A. Cannabinoid signalling and effects of cannabis on the male reproductive system. Nat Rev Urol. 2021 Jan;18)1(:19-32. doi: 10.1038/s41585-020-00391-8. Epub 2020 Nov 19. PMID: 33214706.
- ↑ Guillerm**A. Vega, Javier A. Davila. )2021( Use of non-psychoactive residual biomass from Cannabis sativa L. for obtaining phenolic rich-extracts with antioxidant capacity. Natural Product Research 0:0, pages 1-7. Medicinal cannabis in the treatment of chronic pain. AJGP Vol. 50, No. 10, October 2021
- ↑ Cannabis-based medicinal products. NICE guideline, Published: 11 November 2019. www.nice.org.uk/guidance/ng144
- ↑ Volkow ND, Baler RD, Compton WM, Weiss SR. Adverse health effects of marijuana use. N Engl J Med. 2014 Jun 5;370)23(:2219-27. doi: 10.1056/NEJMra1402309. PMID: 24897085; PMCID: PMC4827335.
- ↑ Feingold D, Goor-Aryeh I, Bril S, Delayahu Y, Lev-Ran S. Problematic Use of Prescription Opioids and Medicinal Cannabis Among Patients Suffering from Chronic Pain. Pain Med. 2017 Feb 1;18)2(:294-306. doi: 10.1093/ pm/pnw134. PMID: 28204792.
- ↑ Webster LR, Webster RM. Predicting aberrant behaviors in opioid-treated patients: preliminary validation of the Opioid Risk Tool. Pain Med. 2005 Nov-Dec;6)6(:432-42. doi: 10.1111/j.152
- ↑ Lopez-Pelayo, H., Batalla, A., Balcells, M., Colom, J., & Gual, A. )2015(. Assessment of cannabis use disorders: A systematic review of screening and diagnostic instruments. Psychological Medicine, 45)6(, 1121-1133. doi:10.1017/S0033291714002463
- ↑ Nielsen S, Gowing L, Sabioni P, Le Foll B. Pharmacotherapies for cannabis dependence. Cochrane Database Syst Rev. 2019 Jan 28;1)1(:CD008940. doi: 10.1002/14651858.CD008940.pub3. PMID: 30687936; PMCID: PMC6360924.
- ↑ FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol )CBD(. https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived- products-including-cannabidiol-cbd
- ↑ Schlag AK, Hindocha C, Zafar R, Nutt DJ, Curran HV. Cannabis based medicines and cannabis dependence: A critical review of issues and evidence. J Psychopharmacol. 2021 Jul;35)7(:773-785. doi: 10.1177/0269881120986393. Epub 2021 Feb 17. PMID: 33593117; PMCID: PMC8278552.
- MacCallum, C.A.; Russo, E.B. Practical considerations in medical cannabis administration and dosing. Eur. J. Intern. Med. 2018, 49, 12-19, doi:10.1016/j.ejim.2018.01.004.
- Clark, A.; Lynch, M.; Ware, M.; Beaulieu, P.; McGilveray, I.; Gourlay, D. Guidelines for the Use of Cannabinoid Compounds in Chronic Pain. Pain Res. Manag. 2005, 10, 44A-46A, doi:10.1155/2005/894781.
- Gieringer, D.; St. Laurent, J.; Goodrich, S. Cannabis vaporizer combines efficient delivery of THC with effective suppression of pyrolytic compounds. J. Cannabis Ther. 2004, 4, 7-27, doi:10.1300/J175v04n01_02.
- Kocis, P.T.; Vrana, K.E. Delta-9-Tetrahydrocannabinol and Cannabidiol Drug-Drug Interactions. Med. Cannabis Cannabinoids 2020, 3, 61-73, doi:10.1159/000507998.
- Allan, G.M.; Ramji, J.; Perry, D.; Ton, J.; Beahm, N.P.; Crisp, N.; Dockrill, B.; Dubin, R.E.; Findlay, T.; Kirkwood, J.; et al. Simplified guideline for prescribing medical cannabinoids in primary care. Can. Fam. Physician 2018, 64, 111-120.
- Kalant, H.; Porath, A.J. Clearing the Smoke on Cannabis: Medical Use of Cannabis and Cannabinoids - An Update | Canadian Centre on Substance Use and Addiction Available online: https://www.ccsa.ca/clearing- smoke-cannabis-medical-use-cannabis-and-cannabinoids-update )accessed on Nov 2, 2019(.
- MacCallum, C.A.; Russo, E.B. Practical considerations in medical cannabis administration and dosing. Eur. J. Intern. Med. 2018, 49, 12-19, doi:10.1016/j.ejim.2018.01.004.
- Benny Leeat A unique protocol - medical cannabis treatment for oncological patients. Isaerli J. Oncol. Nurs. 2017, 29, 13-18.
- Lucas, C.J.; Galettis, P.; Schneider, J. The pharmacokinetics and the pharmacodynamics of cannabinoids. Br. J. Clin. Pharmacol. 2018, 84, 2477-2482, doi:10.1111/bcp.13710.
- Jason W Busse et al. Medical cannabis or cannabinoids for chronic pain: a clinical practice guideline. BMJ 2021;374:n2040. http://dx.doi.org/10.1136/bmj.n2040
- Katz G, Lobel T, Tetelbaum A, Raskin S. Cannabis Withdrawal - A New Diagnostic Category in DSM-5. Isr J Psychiatry Relat Sci. 2014;51)4(:270-5. PMID: 25841223.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק