מיאלומה נפוצה - Multiple myeloma
| מיאלומה נפוצה | ||
|---|---|---|
| Multiple myeloma | ||
| 250px | ||
תאי מיאלומה מייצרים חלבונים חד שבטיים מסוגים שונים, לרוב אימונוגלובולינים (נוגדנים) ושרשראות קלות חופשיות. (תיאור תלת-מימדי)
| ||
| יוצר הערך | פרופסור מרב לייבה | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מיאלומה נפוצה
מיאלומה נפוצה היא מחלה אשר מקורה בתאי דם לבנים מסוג B בשלים אשר התמיינו לתאי פלזמה. המחלה מתאפיינת בשגשוג שבטי של תאי פלזמה במח העצם אשר מפרישים נוגדן חד שבטי (Monoclonal) הנמצא בדם ובשתן. המחלה פוגעת במח העצם, בעצמות, בכליות ובמערכת החיסון.
אפידמיולוגיה
מיאלומה נפוצה היא הממאירות השנייה בשכיחותה מבין הממאירויות ההמטולוגיות (Hematologic) (10 אחוזים מסך המחלות מסוג זה). בארצות המערביות היארעות המחלה היא 4–5 מקרים חדשים בשנה ל-100,000 אנשים. קיימת עליה בשכיחות מיאלומה נפוצה, כנראה בשל הגילוי המוקדם ועליית גיל האוכלוסייה. קיימת עליה חדה בשכיחות המחלה מעל גיל 50 ורוב החולים הם מעל גיל 70 (הגיל הממוצע בעת האבחנה הוא 62 שנים). המחלה מעט שכיחה יותר בגברים לעומת נשים.
אטיולוגיה
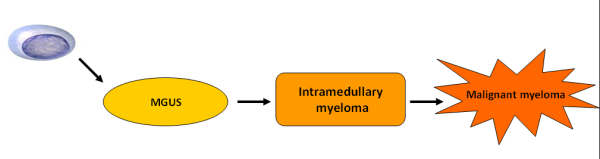
האטיולוגיה של המחלה אינה ידועה, הסברה הרווחת היא כי מיאלומה נפוצה מתפתחת ברוב המקרים ממצב טרום ממאיר (MGUS, Monoclonal Gammopathy of Undetermined Significant) אשר מתפתח למצב של מיאלומה רדומה (Smoldering Multiple Myeloma ,SMM) ולבסוף למיאלומה תסמינית (תמונה 1). שינויים גנטיים רב שלביים ושינויים בסביבה המקומית של תאי הפלזמה גורמים לתאי הפלזמה הטרום ממאירים לעבור ממצב טרום ממאיר למצב ממאיר.
בין הסיבות המוצעות כמעלות את הסיכון להופעת המחלה הן:
- חשיפה לקרינה מייננת (שכיחות גבוהה יותר בניצולי Hiroshima ו-Nagasaki)
- חשיפה לחומרי הדברה
- חשיפה ל-Benzen ומתכות בתעשייה
המחלה אינה גנטית אך ישנה שכיחות יתר במשפחות. (לקרוב משפחה מדרגה ראשונה יש סיכון יתר לפתח MM\MGUS או מחלה המטולוגית אחרת).
קליניקה
המחלה מתבטאת לעיתים קרובות על ידי כאבי עצמות (80 אחוזים מהחולים), Anemia (70 אחוזים מהחולים), אי ספיקת כליות (40-20 אחוזים מהחולים), עליה ברמות הסידן בדם (Hypercalcemia) (לא שכיח) וזיהומים חוזרים.
ישנם חולים א-תסמיניים אשר מתגלים באקראי בבדיקות הדם. בחולים אלו לרוב מדובר במחלה רדומה או במצב הטרום ממאיר (MGUS, SMM). MGUS הוא מצב טרום ממאיר אשר אינו מוגדר כמחלה ולרוב אינו מתפתח למצב ממאיר. קיים סיכון של אחוז אחד לשנה למעבר ממצב זה למיאלומה נפוצה פעילה. עיקר המעבר למיאלומה הוא בשלוש עד חמש שנים הראשונות מהאבחנה.
- בדיקות שיש לבצע בחשד למיאלומה נפוצה
- בדיקות דם ושתן:
- ספירת דם, כימיה מלאה כולל LDH (Lactate Dehydrognase), סך החלבון בדם (Total protein), Albumin, Globulin, תפקודי כליות, אלקטרופורזה של חלבוני דם (Plasma protein electrophoresis), Immune fixation, רמות נוגדנים בדם, שרשראות קלות חופשיות בדם, איסוף שתן של 24 שעות לחלבון ול-Bence Jones ו-Beta 2 Microglobulin
- הדמיות:
- כל מטופל עם חשד לMGUS\מיאלומה –צריך לעבור הדמית שלד: בדרך כלל CT כל גופי סקירת שלד או PET-CT. כאשר קיימים כאבים ממוקמים לאזור מסוים ו\או חשד לפלסמהציטומה יש להשלים תהודה מגנטית (Magnetic Resonance Image ,MRI) מכוון לאותו אזור או PET-CT
- בדיקות נוספות:
- ביופסיית מח עצם + משטח צביעות אימונוהסטוכמיות
- שאיבת מחט עדינה ובדיקת כרומוזומים עם FISH (Fluorescence In Situ Hybridization)
- FLOW CYTOMETRI ממח העצם לצורך בדיקת MRD
שלבי המחלה (International Staging System, ISS):
- שלב I- Beta 2 Microglobulin מתחת ל-3.5, Albumin מעל, LDH תקין, ללא הפרעות ציטוגנטיות בסיכון גבוה
- שלב II- Beta 2 Microglobulin מעל 3.5 או Albumin מתחת 3.5
- שלב III- Beta 2 Microglobulin מעל 5.5 או LDH מוגבר + הפרעה ציטוגנטית בסיכון גבוה (t(4;14), t(14;16),t(14;20), TP53/del17p, Amp 1q)
קיימים שינויים גנטיים תאיים (Cytogenetics) המשפיעים על התנהגות המחלה והתגובה לטיפול. הפרעות כגון: התקת (t(11;14 (Translocation), וכן היפרפלואידיות (Hyperploidy) קשורות עם סיכון נמוך יותר. בעוד שהפרעות כגון: התקות כרומאזומליות של (4;14), (14;16), (14;20) ,הפרעה בחלבון מדכא הגידולים p53 והשמטה של כרומוזום 17 (Deletion) קשורות עם סיכון גבוה יותר.
אבחנה
האבחנה של מיאלומה נעשית על ידי שילוב של בדיקות דם, צילומי ו/או הדמיות שלד וביופסיית מח העצם.
בכדי לאבחן מיאלומה דרושים שלושה תנאים:
- ביופסיית מח עצם אשר בה הודגם ריבוי תאי פלזמה חד שבטיים, מעל 10 אחוזים או מעל פלסמהציטומה אחת
- חלבון חד שבטי בדם או בשתן (מעל 500 מ"ג חלבון בנס ג'ונס)\או הפרעה ביחס ובמספר המוחלט של השרשרות הקלות החופשיות בדם
- קיימת פגיעה באחד מאברי המטרה המתבטאת כ-SLIM -CRAB: HyperCalcemia, Renal failure, Anemia, lytic Bone lesions, Clonal Plasma Cells≥60%, FLC ratio≥100, more than one lytic bone lesion on MRI
חולים אשר עונים לסעיפים 2+1, אך ללא אחד מהמאפיינים בסעיף 3 : SLIM –CRAB אינם מוגדרים כמיאלומה פעילה אלא כמיאלומה זוחלת ואינם זקוקים, על פי ההגדרות הנהוגות, לתחילת טיפול מיידי. מטופלים כנזכר למעלה עם מיאלומה זוחלת SMOLDERING MYELOMA זקוקים למעקב צמוד. במקרים מסוימים בהם מדובר במיאלומה זוחלת בסיכון גבוה נשקול להתחיל טיפול או להציע למטופל להיכנס למחקר קליני. קיימים מחקרים אשר בודקים האם טיפול מוקדם במצב של מיאלומה רדומה עם סימני סיכון גבוהים ובעידן התרופות החדשות הוא יעיל ומוצדק. אין תשובה לשאלה זו, לכן ההנחיות הבינלאומיות נשארו כפי שהיו בעבר.
טיפול
הטיפול מיועד רק לחולים אשר עונים להגדרה של מיאלומה נפוצה פעילה (SLIM- CRAB).
משנת 2004 לערך, הטיפול במיאלומה עבר שינוי מהותי, עם הופעת תרופות חדשות אשר שיפרו באופן ניכר את ההישרדות ללא מחלה ואת סך הישרדות חולי המיאלומה בהשוואה לטיפולים שניתנו לפני עידן התרופות החדשות. ההתקדמות שהושגה נזקפת בעיקר לפיתוח של התרופות חדשות, נוגדנים חד שבטיים, וגם נוגדנים דו ראשיים וטיפול תוך שימוש בטכנולוגיה CART.
Proteasome inhibitors
Bortezomib
טיפול קו ראשון כולל בדרך כלל Bortezomib (Velcade), שהוא טיפול מכוון אשר מעכב את ה-Proteasome (החלקיק התאי האחראי על פירוק החלבונים הלא תקינים בתא). Velcade ניתן בזריקה תת-עורית. הטיפול ניתן פעם-פעמיים בשבוע (במקרים בהם נדרשת תגובה מהירה). מחזור טיפולי מכיל ארבע מנות Velcade. תופעות לוואי עיקריות של Velcade הן חולשה, נוירופתיה (פגיעה בקצות העצב המתבטאת כנימול או דקירות, בכפות ידיים ורגליים), צבירת נוזלים ו-Thrombocytopenia (ירידה בטסיות הדם). התרופה דורשת טיפול מניעתי ב-acyclovir.
Carfilzomib
Carfilzomib (Kyprolis) - שייכת למשפחת מעכבי ה-Proteasome, היא מעכב בלתי הפיך של ה-Proteasome ובעל יעילות גבוהה מה-Bortezomib ופועלת גם בחולים שלא הגיבו בעבר או התקדמו תוך כדי הטיפול ב-Bortezomib.
Ixazomib
Ixazomib (Ninlaro) - מעכב פרוטאוזום פומי. ניתן פעם בשבוע. יעילות ופעילות דומה לזו של ה-Bortezomib.
Immunomodulators
Lenalidomide
Lenalidomide (Revlimid) היא תרופה ביולוגית השייכת גם היא למשפחת מווסתי התגובה החיסונית, עובדת דרך חלבון הצרבלון, ניתנת פומית ובעלת שיעור נמוך יותר של תופעות לוואי לעומת ה-Thalidomide. התרופה אינה גורמת לנוירופתיה, אך עלולה לגרום לירידה משמעותית בספירות הדם (Panctopenia) ובשל כך לדיכוי חיסוני. התרופה מעלה סיכון לקרישיות יתר ולכן יש לתת טיפול מניעתי על-ידי אספירין. במטופלים בסיכון גבוה ל DVT יש לתת קלקסן\ NOACs מניעתי בעיקר בחודשי הטיפול הראשוניים. בנוסף יש להתאים מינון התרופה במטופלים עם הפרעה בתפקודי כליות.
Pomalidomide
Pomalidomide (Imnovid) היא דור חדש של מווסתי התגובה החיסונית, הראתה יעילות גם בחולים אשר עמידים ללנלידומיד. ניתן לשלב עם Bortezomib, פרוטוקול PVD (הפרוטוקול נמצא בסל בקו שני) או עם תרופות אחרות. במטופלים בסיכון גבוה ל DVT יש לתת קלקסן\ NOACs מניעתי בעיקר בחודשי הטיפול הראשוניים.
Selinexor
Selinexor (Xpovio) אושרה בדצמבר 2020 על ידי FDA למיאלומה נפוצה עמידה לטיפולים או חוזרת.
שייכת למשפחת חומרים המהווים מעכבים סלקטיביים של ייצוא חלבונים מגרעין התא (משפחת SINE, קיצור של Selective Inhibitor of Nuclear Export). סלינקסור פועלת לחסימה של חלבון בשם XPO1, הקרוי גם CRM1 = 'אקספורטין 1' (Exportin 1).
מדובר בתרופה פומית הניתנת פעם בשבוע במינון 40–80 מ"ג בדרך כלל עד להתקדמות המחלה או התפתחות רעילות לתרופה. התרופה ניתנת בשילוב עם ולקייד \ אמנוביד וכן בשילוב עם סטרואידים.
תופעות הלוואי העיקריות: בחילות, עייפות, ירידה בתיאבון, שלשולים, נוירופתיה פריפרית, זיהומים בדרכי הנשימה העליונות, ירידה במשקל, הקאות, קטרקט, רמות נמוכות של טסיות דם (טרומבוציטופניה), רמות נמוכות של של תאי דם לבנים (לימפופניה), אנמיה (רמות נמוכות של ברזל), רמות נמוכות של זרחן (היפופוספטמיה), תת נתרן בדם וירידה במספר הנויטרופילים בדם (נויטרופניה).
Monoclonal antibodies
נוגדנים חד שבטיים מתחברים לחלבון על פני התא הממאיר ומשפעלים את מערכת החיסון כנגד התא הממאיר.
Daratumumab
Daratumumab (Darzalex) הוא נוגדן חד שבטי כנגד CD38- הנמצא על פני תאי המיאלומה. ניתן בזריקה תת-עורית פעם בשבוע למשך חודשיים (8 מנות) לאחר מכן פעם בשבועיים למשך 4 חודשים (8 מנות) ולאחר מכן אחת לחודש. התרופה ניתנת במשלבים שונים בשילוב עם Bortezomib ו\או Thalidomide\ Lenalidomide\ Pomalidomide\ Carfilzomib והראתה תוצאות מצוינות. ניתנת כבר בקו טיפול ראשון. דורשת טיפול מניעתי על ידי acyclovir .
Belantamab Mafodotin
Belantamab Mafodotin הוא נוגדן חד שבטי שמתחבר לקולטן הקרוי BCMA (קיצור של B Cell Maturation Antigen) המצוי על גבי תאי המיאלומה, ונושא רעלן (מפודוטין) שחודר באמצעות חיבור זה לתאי המיאלומה וגורם להשמדתם. התרופה ניתנת בעירוי לווריד הנמשך כחצי שעה במסגרת אשפוז יום. העירוי ניתן אחת לשלושה שבועות\חודש. אושר באוגוסט 2020 על ידי FDA כקו טיפול מתקדם לחולים עם מחלה חוזרת או עמידה, לאחר מיצוי ארבע תרופות קודמות.
Isatuximab
Isatuximab (Sarclisa) הוא נוגדן חד שבטי כנגד CD38 בדומה לDaratumumab, בשלבי מחקר מתקדמים.
Bispecific Antibodies BITs
Bispecific Antibodies BITs הוא נוגדן דו ראשי - חיבור של שני נוגדנים המחוברים ביניהם ומכוונים "לתפוס" שני אתרים :
- אתר על פני התא הממאיר (המיאלומה)
- אתר של מערכת החיסון המפעיל אותה, כך שמערכת החיסון תוכל לפעול כנגד תאי המיאלומה
Teclistamab
Tecvayli היא נוגדן דו ראשי המכוון כנגד BCMA (B Cell Maturation Antigen) – הנמצא על פני תא המיאלומה (חלבון שיש לו תפקיד בהישרדות של תאי המיאלומה) ובו זמנית מתחבר גם לחלבון CD3 בתאי T של המערכת החיסונית. בפעילות משולבת זו – הנוגדן מפעיל את מערכת החיסון כנגד תאי המיאלומה בדומה ל CART. התרופה הוכחה כיעילה בטיפול במיאלומה נפוצה עמידה לטיפולים הקיימים. ניתנת בזריקה עורית עד להתקדמות המחלה. בדרך כלל טיפול ראשון ניתן באשפוז ולאחר מס ימים באם אין תופעות לוואי ניתן להשתחרר ולקבל את המשך הטיפול באופן אמבולטורי.
אושרה באוקטובר 2022 על ידי FDA לטיפול במיאלומה נפוצה עמידה לטיפולים \או חוזרת בקו רביעי.
הטיפול כרוך בזיהומים, ולעיתים נדירות בתופעת סערת ציטוקינים בדומה ל CART אך פחות סוערת.
Talcetamab
Talquetamab הוא נוגדן דו ראשי כנגד GPRC5 הנמצא על פני תאי המילומה + ובדומה לTeclistamab מתחבר גם לתאי ה T של מערכת החיסון (CD 3). כך מפעיל את תאי מערכת החיסון כנגד תאי המיאלומה. נמצא בשלבי מחקר מתקדמים (פאזה 2–3 של מחקר) עם תוצאות מבטיחות.
Elranatamab
Elranatamab הוא נוגדן דו ראשי כנגד BCMA הנמצא על פני תא המיאלומה וכן מתחבר גם לחלבון CD3 בתאי T של המערכת החיסונית. בפעילות משולבת זו – הנוגדן מפעיל את מערכת החיסון כנגד תאי המיאלומה בדומה ל CART. נמצא בשלבי מחקר מתקדמים עם תוצאות מבטיחות.
CAR-T
תאי T של המערכת החיסונית של המטופל מוצאים מגופו של המטופל (איסוף תאים) ועוברים מחוץ לגופו של המטופל, בשיטות של הנדסה גנטית, תהליך שבו מוחדר חלבון בעל יכולת לזהות ולהיקשר לתאי המיאלומה. התאים מוחזרים לגוף על ידי עירוי לווריד ולאחר שמזהים את תאי המיאלומה מפעילים את מערכת החיסון כנגדם.
הטיפול הראשון מסוג זה שאושר על ידי ה-FDA הוא idecabtagene vicleucel.
הטיפול ניתן באשפוז (2–4 שבועות), כרוך במתן טיפול כימורתפי\ציטוטוקסי לפני עירוי התאים וכן וכרוך בדיכוי חיסוני, סערת ציטוקינים, רעילות למערכת העצבים, זיהומים, ציטופניה, עייפות, וכאבי שרירים.
פרוטוקול טיפולי
באופן קלאסי מקובל לתת טיפול השריה (אינדוקציה) של כ-4–6 מחזורי טיפול באחד מן המשלבים הנ"ל : DARA- VTD, DARA- VD, DARA- RD, DARA- VRD בחולים מתחת לגיל 65–70, אשר אינם סובלים ממחלות רקע קשות, החולים היו מועמדים לאיסוף תאי אב והשתלת מח עצם עצמית. כ 60 יום לאחר ההשתלה מקובל לחזור על טיפול האינדוקציה לכ-2 (קונסולידציה) ולאחר מכן טיפול אחזקה ( LENALIDOMIDE\VELCADE\DARA).
חולים מבוגרים או חולים הסובלים ממחלות רקע קשות ממשיכים טיפול אינדוקציה למשך כ-10–12 חודשים ואז עוברים לשלב האחזקה (LENALIDOMIDE\VELCADE\DARA).
הצורך בהשתלת מח עצם עצמית שנוי במחלוקת ומטופלים שאינם בסיכון גבוה ואשר מגיבים היטב לטיפול האינדוקציה יכולים לבחור לדחות את ההשתלה למועד מאוחר יותר במידת הצורך ולהמשיך באינדוקציה למשך 10–12 חודשים ואז לעבור לטיפול אחזקה.
מספר מחקרים הראו יתרון במתן טיפול אחזקה לאחר המיצוק, על ידי Lenalidomide בכדורים או לחלופין באמצעות Velcade, מנה אחת לשבועיים, עד להתקדמות המחלה. ישנם מחקרים הבודקים טיפול אחזקה על ידי Daratumumab +\- Lenalidomide.
חולים אשר חווים הישנות של המחלה בדרך כלל מטופלים באמצעות משלבי טיפול שונים בהתאם לטיפולים קודמים שקיבלו כגון: PVD ( פומלידומיד-וולקיד –דקסה), KPD (קרפילזומיב-פומלידומיד –דקסה), KRD. הטיפול בחולים בהישנות שלישית ורביעית כולל נוגדנים חד שבטיים כגון Belantamab או נוגדנים דו ראשיים (Ticlestamab, Elranatamab) או טיפול ב CART.
מתחילת שנות האלפיים חל שיפור ניכר באיכות החיים ובתוחלת החיים של חולי מיאלומה נפוצה. עקב הפיתוח המואץ של התרופות החדשות צפויה תוחלת החיים להמשיך ולעלות. מיאלומה נפוצה היא מחלה כרונית. יש הסבורים כי שילובן של התרופות החדשות והטכנולוגיות החדשות הנמצאות במחקר מתקדם עשוי לא רק להאט את קצב התקדמות המחלה אלא גם הביא לריפויה.
ביבליוגרפיה
- Palumbo, A. and K. Anderson, Multiple myeloma. N Engl J Med. 364(11): p. 1046-60.
- Vij R, W.M., Orlowski R et al., Initial results of PX-171-004, an open label, single arm, phase II study of carfilzomib(CFZ) in patient with rtelpased myeloma(MM). Blood, 2008. 112, (Abstr 865).
- Jagannath S, Vij R, Stewart AK, et al. Initial results of PX-171-003, an open-label, single arm, phase II study of carfilzomib(CFZ)in patients with relapsed refractory multiple myeloma(MM). Blood, 2008;. 112: 864
- Lacy MQ, Hayman SR, Gerttz MA, et al. Pomalidomide(CC4047) plus low dose Dexamethasone (pom/dex) is highly effective therapy in relapsed multiple myeloma. Blood 2008; 112: 866s
- Badros A, Philip S, Neisvisky R, et al. Phase I trial of suberoylanilide hydroxamic acid(SAHA) plus Bortezomib (Bort) in relapsed multiple myeloma(MM) patients. Blood 2007; 110:354A
- Weber DM, Jagannath S, Mazumder A, et al. Phase I trial of oral vorinostat (suberoylanilide hydroxyamic acid, SAHA) in combination with Bortezomib in patients with advanced multiple myeloma. Blood 2007; 110:335A
- Ponisch W, Rozanski M,Goldschmidt H, et al. Combined bendamustine, prednisolone and Thalidomide for refractory or relapsed multiple myeloma after autologous stem-cell transplantation or conventional chemotherapy: results of a Phase I clinical trial. Br J Haematol 2008;143:191-200
- Hidshima T, Catly I, Raje N, et al. Inhibition of AKT induces significant downregulation of surviving and cytotoxicity in human multiple myeloma. Br J Haematol. 2007; 138:783-91.
- Richardson PG, Lonial S, Jakubowiak A, et al. Perifosin (KRX-0401) plus low dose Dexamethasone is active in patients with relapsed and refractory multiple myeloma(MM): Perifosine MM Investigator Group phase II multicenter study update: Haematologica. 2007;92:155
- Richardson P, Chanan-Khan A, Lonial S, et al. A multicenter phase I clinical trial of tanespimycin(KOS-953)+ bortezomib(BZ): encouraging activity and manageable toxicity in heavily pre-treated patients with relapsed refractory multiple myeloma(MM). 2006 Annual Meeting of American Society of Hematology; Orlando, FL; December 2006.
- Tai UT, Dillon M, Song W, Leiba M, et al. Anti-CS1 humanized monoclonal antibody HuLuc63 inhibits myeloma cell adhesion and induces antibody dependent cellular cytotoxicity in bone marrow milieu. Blood. 2008;112: (1329-1337)
- Jakubowiak AJ, Don M Benson DM, Bensinger W, Siegel DS, et al. Elotuzumab In combination with Bortezomib In patient with Relapsed Refractory Multiple Myeloma: Updated Results of Phase 1 Study. Annual Meeting of American Society of Hematology; December 2010. II-203p
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופסור מרב לייבה, מנהלת מחלקה המטולוגית, בית החולים האוניברסיטאי אסותא אשדוד, הפקולטה למדעי הבריאות אוניברסיטת בן גוריון שבנגב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק