נויטרופניה בילדים - Neutropenia during childhood
| נויטרופניה בילדים | ||
|---|---|---|
| Neutropenia during childhood | ||
| 250px | ||
| יוצר הערך | פרופ' חיים קפלינסקי | |
| אחראי הערך | 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – נויטרופניה
נויטרופניה (Neutropenia), המוגדרת כמינימום 1,500 גרנולוצים לממ"ק, נגרמת ע"י מספר מנגנונים: הפרעה בייצור, הרס מוגבר והפרעה בשחרור. בירור של נויטרופניה כולל בין היתר אנמנזה מפורטת, בדיקה גופנית כללית, בדיקת משטח דם היקפי, שאיבה וביופסיית מוח עצם, ואיתור הפרעות מולקולריות. זיהום ממוקם או מפושט, כולל אלח דם (Sepsis), הוא איום על החולה הנויטרופני. לרוב בנויטרופניה אוטואימונית התחלואה אינה רצינית, וחולפת מאליה. בנויטרופניות המולדות, וכן באלה שבעקבות טיפול כימותרפי, מטפלים במינונים משתנים של G-CSF (Granulocyte colony-stimulating factor). קיים ויכוח לגבי מתן אנטיביוטיקה פרופילקטית.
ייצור תאי דם במח העצם (Myelopoiesis)
כבר ב-1914 תיאר ארנסט נוימן (Neumann), פרופסור לפתולוגיה באוניברסיטת קניגסברג, נוכחות של תאים אדומים מגורענים במוח עצם של ארנבות ואנשים, וטען כי בתקופה הפוסט-אמבריונית (Postembryonic period) מתפתח ייצור של תאים אדומים (Erythropoiesis) ושל תאים גראנולוציטים (Granulopoiesis). משיקולים עיוניים ותצפיות במוח עצם בגילאים שונים הוא זיהה תא משותף לכל התאים ההמטופויטיים (Hematopoietic cells). תא אב זה הוא בעל תכונות ייחודיות ובעיקר בעל יכולת לעבור התחדשות עצמית (Self renewal) אינסופית וגם הבשלה הדרגתית בארבעה שלבים: מתא גזע מולטיפוטנטי (Multipotent stem cell) לתא גזע פלוריפוטנטי (Pluripotent stem cell), לתא גזע מחויב (Committed stem cell) ולשלב האחרון של תא גזע ממוין (Differentiated stem cell).
תא האב אינו מרחף ומשייט בחלל מוח העצם, אלא נמצא מוגבל ומעוגן לנישה מיוחדת, נישת תאי הגזע ההמטופויטים (Hematopoietic stem cell niche), שתוארה לראשונה ע"י שופילד (Schofield) בשנת 1978 (1). זה האחרון טען כי תא האב מקובע ואינו עובר דיפרנציאציה (Differentiation) אלא פרוליפרציה (Proliferation) הנתמכת ע"י המיקרו-סביבה (Microenvironment). הנישה נמצאת במגע ישיר עם אוסטאובלסטים (Osteoblasts) וסטרומה (Stroma), מולקולות הדבקה וביות (Homing molecules), וכמובן תאי השומן עתירי האנרגיה (4-2). ברגע שתא אב עובר תהליך "ייחודיות" וייעוד סגולי להתמיין לתא מוגדר, הוא ממשיך שני תהליכים במקביל: הבשלה ושגשוג, וכן באופן מבוקר - מוות תאי מתוכנן (Apoptosis).
תא האב חייב לעבור גירוי בשלב הראשוני ע"י גורמי צמיחה רבים. כדי להבטיח שהפעולה אכן תמומש, הוא נמצא תחת מטרייה של מספר רב של גורמי צמיחה, מולקולות ותוצרים חלבוניים של גנים מפעילים או משתקים, בבחינת השקעה רבתי להבטחת העתיד. ברגע שהתא מבשיל, הוא נזקק לפחות גירויים כדי לשרוד ולהמשיך בהתפתחותו ומיתר מרבית גורמי הצמיחה שבהם הוא תלוי בשלבים הראשונים. התפתחות של תא גרנולוציט (Granulocyte cell) בשל בהשפעת גורמי צמיחה כרוכה בדיפרנציאציה (Differentiation) וביצירה של מולקולות חלבוניות קטנות על פני שטח תא וכן הופעת רכיבים גרנולריים בציטופלזמה (Cytoplasm), אלה המקנים לגרנולוציט הבשל את תפקודו.
כל תהליך ההבשלה בתוך מוח העצם אורך שבועיים, כאמור, בבקרה ובגירוי של גורמי הצמיחה GCSF (Granulocyte colony-stimulating factor), GMCSF (Granulocyte macrophage colony-stimulating factor),SCF (Stem cell factor), ו-FLT3 (5). גורמי הצמיחה נקשרים באופן סגולי לרצפטורים על פי התא, חלה דימריזציה (Dimerisation) של שתי השרשרות של הרצפטור, זרחון (Phosphorylation) ושפעול של חלבון RAS והעברת סיגנל מהציטופלזמה והפלזמה לגרעין. סיגנל זה יכול להפעיל את מעגל התא (Cell cycle) להקפיא את התהליך של הפרוליפרציה או לאתחל את מנגנון ההשמדה העצמית. במחצית הראשונה של השהיה במוח העצם הפרקורסורים המיאלואידיים (Myeloid precursors) עוברים חמש חלוקות, עם דיפרנציאציה ממיאלובלסטים דרך פרומיאלוציטים (Promyelocytes) למיאלוציטים (Myelocytes) בשלים. שינוי מורפולוגי זה מלווה גם שינוי תפקודי, כמיועד לנויטרופילים (Neutrophils). בתקופה זו התאים רוכשים ומאבדים מאפייני שטח תא כדוגמת CD34/CD33, CD1, ו-CD11b. התאים הבשלים משתחררים למאגר במחזור הדם המתחלף עם המאגר הרקמתי.
אפידמיולוגיה
אטיולוגיה
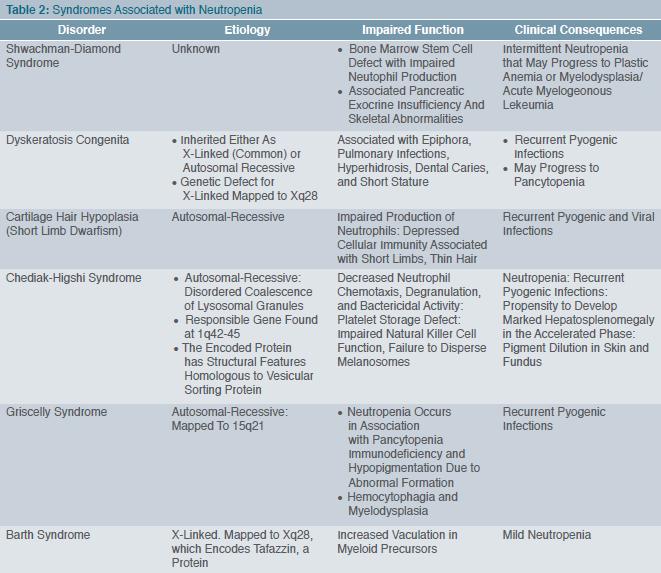
נויטרופניה, המוגדרת כמינימום 1,500 גרנולוצים לממ"ק, נגרמת ע"י מספר מנגנונים: הפרעה בייצור, הרס מוגבר והפרעה בשחרור. קיימות מספר צורות סיווג לנויטרופניה, אך המקובלת ביניהן היא זו המסתמכת על הפרעות אינטרינזיות לשגשוש ולהבשלה של השורה המיאלואידית, ועל סיבות משניות שאינן קשורות במוח העצם עצמו (טבלה 1). נוסף על כך, יש שורה של תסמונות הקשורות בנויטרופניה (טבלה 2).
נויטרופניה מולדת
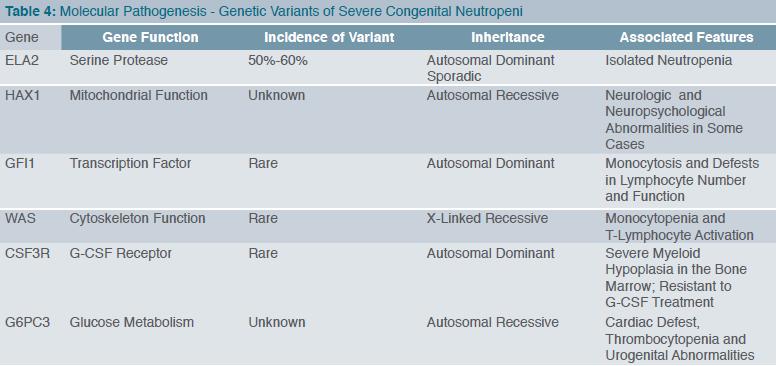
מדובר בעיקר בשתי צורות קליניות: תסמונת קוסטמן (Kostmann syndrome) ו-SCN (Severe congenital neutropenia). קוסטמן תיאר לראשונה משפחות עם נויטרופניה קשה מלידה או מעט מאוחר יותר, כאשר בדם ההיקפי לא זוהו גרנולוציטים בשלים, בעוד במוח העצם נראתה עצירה בהבשלה בשלב של פרומיאלוציטים (Promyelocytes) ומטהמיאלוציטים (Metamyelocytes) (Maturation Arrest) (6). צורת התורשה הייתה אוטוזומלית במרבית המשפחות, אך במיעוטן זוהתה תורשה דומיננטית. התמונה הקלינית והמעבדתית מגוונת (טבלה 3) ובעיקרה נטייה לזיהומים ממוקמים או סיסטמיים. הרקע המולקולרי הוא נוכחות מוטציה בגן HAX1 (HS-1 Associated Protein X), חלבון קריטי לשמירת הפוטנציאל התוך-מיטוכונדריאלי, המגן על התא המיאלואידי מאפופטוזיס (7). במיקרוסקופ אור ניתן לזהות את הגופים האפופטוטיים. בצורות האחרות של Severe congenital neutropenia ונויטרופניה ציקלית (Cyclic neutropenia) זוהתה מוטציה בגן ELANE (או בשמו הקודם ELA2) המקודד את החלבון אלסטאז נויטרופילי (Neutrophil elastase) (8), החלבון המופקד על ארגון והאריזה של שרשרות הדנ"א (DNA), כלומר על UPR (unfolded Protein response). קיפול ואריזה לא מדויקים מאתחלים את מנגנון האפופטוטיס (9). בנויטרופניה ציקלית זוהתה מוטציה ב-ELANE, אך התמונה הקלינית שונה בכך שיש אוסצילציה (Oscillation) מחזורית של 21 ימים בין זיזי הנויטרופניה. זוהו כאמור 6 מוטציות ודאיות (טבלה 4).
כזכור, אחד המנגנונים לנויטרופניה הוא שחרור לקוי של צורות מיאלואידיות בשלות למחזור הדם עם עצירה בהבשלה של פרקורסורים. זה מצב המזכיר מיאלוקתקסיס (Myelokathexis) שבו נצפית תמונה דומה במוח העצם, אם כי יש עיוות מורפולוגי של הפרקורסורים, ובבדיקה מולקולרית מודגמת התבטאות יתר של CXCR4, כמו שתואר גם בחסר 3G6PC, הפרעה נוספת עם נויטרופניה.
נויטרופניה בשל הרס מוגבר
אלה מצבים שבהם אין כל בעיה בייצור ובשחרור, אך מתקיים הרס ע"י נוגדנים (אלוגניים או עצמיים), קומפלקסים חיסוניים, טוקסינים ומצבים מכנים, כמו ביתר טחוליות (Hypersplenism). בנויטרופניה אלו-אימונית (Alloimmunic), נוצרים נוגדנים נגד אחד משבעת האלו-אנטיגנים (Alloantigens) הנמצאים על פני הגרנולוציט. בנויטרופניה אוטו-אימונית (Autoimmunic) נוצרים נוגדנים נגד אנטיגן ספציפי על פני פתוגן, שבמקרה נדיר נמצא גם על פני הנויטרופיל (Antigenic mimicry). בהגדרה, נויטרופניה אוטואימונית (Autoimmune neutropenia) היא מצב שבו זוהו נוגדנים נגד נויטרופילים בשתי דגימות דם נפרדות. יש קושי די ניכר לזהות נוגדנים סגוליים, ותמיד נשאלת השאלה עד כמה אידיופתי הוא אוטואימוני או עד כמה אוטואימוני מתווך בכלל על ידי נוגדנים.
פותחה שיטה לזיהוי נוגדנים בסרום של הנבדק בטכניקת GIFT (Indirect immunofluorescent test), ובמקום שימוש בנוגדנים חד-שבטיים יקרים, מודגר סרום הנבדק כנגד פאנל של גרנולוציטים שמקורם ב-20-10 תורמים אקראיים. ההנחה היא שהנבדק מייצג לפחות אלו-אנטיגן אחד. לאחר מכן מופעל נוגדן מארנבת נגד אימונוגלובולין אנושי פלואורסצנטי (FITC conjugated anti IgG/IgM anti-human rabbit antibody). הפלואורסצנציה נקראת בציטומטריה של זרימה ((FACS) Fluorescence-activated cell sorting) (10).
קליניקה
אבחנה
בירור של נוירופניה:
- אנמנזה מפורטת, רלוונטית לגיל, למוצא, לחשיפה, להקשר משפחתי ותורשתי.
- בדיקה גופנית כללית לאיתור תסמונות גנטיות (גוון עור, צבע שיער, צורת השלד, הגפיים והגולגולת, הזעת יתר (Hyperhydrosis) ועוד).
- בדיקת משטח דם היקפי (כימות וספירה, מורפולוגיה אבנורמלית).
- שאיבת וביופסיית מוח עצם למורפולוגיה ולהערכת צלולריות, כולל בדיקה ציטוגנטית, FISH (Fluorescence in situ hybridization), הפקת דנ"א (DNA), ובמקרים נדירים הערכת מושבות המטופויטיות.
- במקרה של עצירת הבשלה במוח העצם יש לאתר הפרעה מולקולרית בגנים הרלוונטיים (טבלה 4).
- להיערך להשתלת תאי אב, סיווג רקמות וחיפש תורמים פוטנציאליים.
טיפול
זיהום ממוקם או מפושט, כולל אלח דם (Sepsis), הוא איום על החולה הנויטרופני. אין לנויטרופניה לכשעצמה סיכון מיידי, שכן קיימים מנגנונים תחליפיים, ביניהם המערכת החיסונית התאית וההומורלית. לפיכך, לרקע הבסיסי חשיבות ואימפקט נכבדים על מצב הנויטרופניה, לדוגמה, נויטרופניה שלאחר טיפול כימותרפי או השתלת תא אב. לרוב בנויטרופניה אוטואימונית התחלואה אינה רצינית, וחולפת מאליה, אם כי תוך פרק זמן גמיש שבין 3 חודשים לשנתיים.
בנויטרוניות המולדות, וכן באלה שבעקבות טיפול כימותרפי, מטפלים במינונים משתנים של G-CSF (Granulocyte colony-stimulating factor), תוצר רקומביננטי מבוטא בחיידקי אי-קולי (E. coli), ומופק בצורתו החלבונית הנקייה או הקשורה לגליקוזיל (Glycosyl). קיים ויכוח לגבי מתן אנטיביוטיקה פרופילקטית.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- Schofield R. The relationship between the spleen colony-forming cell and the hematopoietic stem cell. Blood Cells 1978;4;7-25
- Calvi LM, Adams GB, Weibrecht KW, et al. Osteoblastic cells regulate the hematopoietic stem cell. Nature 2003;425:841-846
- Sugiyama T, Kohara H, Noda M, et al. Maintenance of the hematopoieticstem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niche. Immunity 2006;25;977-988
- Zhang J, Niu C, Ye L, et al. Identification of the hematopoietic stem cell niche and control of the niche size. Nature 2003;425;836-841
- Ottmann OG, Abboud M, Welte K, et al. stimulation of the hematopoietic progenitor cell proliferation and differentiation by recombinant interleukin-3. Exp Hematol 1989:17;191-197
- Kostmann R. Infantile genetic agranulocytosis. Acta Pediatrica Scandinavia 1956:45;1-78
- Klein C, Grudzien M, et al. HAX1 deficiency cause autosomal recessive severe congenital neutropenia (Kostmann disease). Nature Genetics 2007:39;86-92
- Horwitz MS, et al. Neutrophil elastase in cyclic neutropenia and severe congenital neutropenia. Blood 2007;109:1817-1824
- Xia J, Link DC. Severe congenital neutropenia and the onfolded protein response. Current Opinion in Hematology 2008;15:1-7
- Sella R, Flomenbuilt L, Goldstrin I, et al. Detection of antineutrophil antibodies in Autoimmune Neutropenia of infancy; a multicenter study. IMAJ 2010;12:78-83
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' חיים קפלינסקי, מחלקה להמטולוגיה–אונקולוגיה ילדים, בית החולים אדמונד ולילי ספרא לילדים, המרכז הרפואי ע"ש ח' שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק