שימוש מושכל באנטיביוטיקה בישראל - עדכון 2018 - נייר עמדה
|
| |
|---|---|
| עקרונות שימוש מושכל באנטיביוטיקה בישראל, פנינו לאן ב-2018 | |
| |
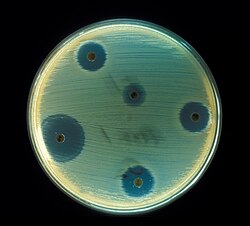
בדיקת רגישות לאנטיביוטיקה של Staphylococcus aureus באמצעות שיטת קירבי-באוור.
| |
| האיגוד המפרסם | האיגוד הישראלי למחלות זיהומיות |
| קישור | באתר הר"י |
| תאריך פרסום | יולי 2018 |
| יוצר הערך | ד"ר ליאור נשר; פרופ' יעקב סטרכילביץ |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – טיפול אנטיביוטי
- המסרים המרכזיים
שימוש מושכל באנטיביוטיקה הוא צורך חיוני, להטמעתו נדרשת הפניית משאבים ושיתוף פעולה. בכל מוסד יש להגדיר את הבעיות הייחודיות ולפיהן את היעדים ודרכי ההתערבות המתאימים. אין פתרון אחד שמתאים לכולם, שימוש באמצעים טכנולוגיים לסיוע בבחירת הטיפול הנכון, ניטור והיזון חוזר רציף ותקופתי מהותיים להפקת תמורה מרבית מהפעילויות של שימוש מושכל באנטיביוטיקה בבתי החולים.
הקדמה
שימוש מושכל באנטיביוטיקה מהווה מכלול אסטרטגיות והתערבויות שמטרתן היא השגה של טיפול מיטבי בחולים עם מחלה זיהומית תוך שימוש מדויק ונכון בתכשירים אנטיביוטיים ומיעוט חשיפת יתר. מעצם טיבו, השימוש המושכל באנטיביוטיקה הוא אחד מאבני היסוד של טיפול מיטבי בחולים, ודורש איזון מתמיד בין הבטחת איכות הטיפול בחולה הבודד והשפעת הטיפול על הכלל, במיוחד מניעת התפתחות עמידות לאנטיביוטיקה ושימור היעילות של התכשירים האנטיביוטיים הקיימים.
גילוי האנטיביוטיקה בתחילת המאה ה-20 גרם למהפכה ברפואה המודרנית, תרופות אלו הורידו בצורה דרמטית את התחלואה והתמותה ממחלות זיהומיות ואפשרו התקדמות בתחומים שונים כמו טיפולי סרטן והשתלות. בד בבד עם גילוי האנטיביוטיקה התגלתה העמידות לאנטיביוטיקה [1] ואנו ערים יותר לנזק הקולטרלי של חשיפה לאנטיביוטיקה אצל המטופל הבודד והכלל[2] עם זאת, להבדיל מטיפולים אחרים, כגון טיפולים לסרטן, אשר עלולים לגרום לנזק ולפיכך ניתנים תחת פיקוח של מומחים, השימוש באנטיביוטיקה הוא במידה רבה פרוץ ומרבית האנטיביוטיקה אינה ניתנת על ידי רופאים מומחים במחלות זיהומיות. מנגד, הפיתוח של תכשירי אנטיביוטיקה חדשים אינו מצליח לעמוד בקצב של התפתחות העמידויות והתפתחות העמידות מאיימת על אושיותיה של הרפואה המודרנית. התוצאה המיידית של זיהום עם חיידקים רב עמידים היא תחלואה קשה וממושכת, תמותה ועלויות אשפוז גבוהות. הצפי הוא כי ללא שינוי - במשוואה הקיימת, מיליוני אנשים ימותו מזיהומים עמידים לאנטיביוטיקה[3]. לפיכך, פיתוח מדיניות ארגונית ולאומית לשימוש מושכל באנטיביוטיקה הוא צורך חיוני. מטרת מדיניות שימוש מושכל באנטיביוטיקה כפולה, הגבלת השימוש באנטיביוטיקה ושימוש מיטבי בתכשירים הקיימים.
שימוש מושכל באנטיביוטיקה הוא בבסיס העשייה של המומחים למחלות זיהומיות ומתבצע הלכה למעשה בכל אספקט של פעילותם. אסטרטגיות מגוונות של שימוש מושכל באנטיביוטיקה מיושמות מזה שלושה עשורים ויותר במספר רב של בתי חולים בישראל, כחלק מתוכניות העבודה של המחלקות והיחידות למחלות זיהומיות והמעבדות למיקרוביולוגיה קלינית. לאור המשבר של התפתחות חיידקים עמידים לכל תרופה יש כעת צורך אמיתי בהעצמת התוכניות הקיימות והרחבת הפעילות שלהן.
מטרות השימוש המושכל באנטיביוטיקה
- התאמה מיטבית של הטיפול האנטיביוטי כנגד מחוללי הזיהום ברמת החולה הבודד
- מניעה של שימוש מיותר ולא נכון באנטיביוטיקה
- שיפור בטיחות החולים ותוצאות האשפוז
- מניעת הופעת עמידות לאנטיביוטיקה בחולה הבודד ובכלל האוכלוסייה
הפחתת שימוש באנטיביוטיקה בפני עצמה אינה מטרה.
המונח "שימוש מושכל באנטיביוטיקה" הוטמע בתחילה בהנחיות שעיקרן היה מניעת זיהומים [4] [5]. עם זאת, המטרות המוזכרות מעלה עומדות לעיתים בסתירה זו לזו מכיוון שכל טיפול אנטיביוטי, בין אם מוצדק ובין אם לאו, עלול להוביל לסלקציה של מחוללים עמידים. חלו התפתחויות בתחום השימוש המושכל באנטיביוטיקה והוא כולל היום מגוון שיטות ופעולות שמשלבות את כל המטרות הנזכרות למעלה ליישום בתוכניות מובנות של שימוש. ארגונים אקדמיים רבים, מוסדות בריאות ותוכניות ממשלתיות, מציעים מגוון של תוכניות טיפול מושכל באנטיביוטיקה [6] [7].
התחום של שימוש מושכל באנטיביוטיקה הוא חדש ודינאמי ולא ניתן להצביע על שיטה אחת מוצלחת יותר משאר השיטות וברוב התוכניות משתמשים במספר כלים ושיטות. עם זאת, בכל תוכנית קיימים המרכיבים היסודיים של קיום הנחיות מוסדיות לזיהומים שכיחים ונוהל פיקוח על מתן אנטיביוטיקה המותאם למוסד. להדגיש, שכדי תוכנית שימוש מושכל באנטיביוטיקה תהיה יעילה יש חשיבות רבה להטמעת אמצעים ליישום התוכנית באופן מותאם לצרכים ולמשאבים הקיימים במרכזים הרפואיים [6] [8] [9] [10].
בלב כל התוכניות לשימוש מושכל באנטיביוטיקה נמצאים הרופאים המומחים במחלות זיהומיות. יחד איתם מומלץ שתוכניות לשימוש מושכל באנטיביוטיקה תכלולנה צוותים רב תחומיים הכוללים רוקחים קליניים (להם תפקיד מרכזי בהטמעת שימוש נכון בתכשירים אנטיביוטיים במסגרת תוכניות שימוש מושכל באנטיביוטיקה בעולם), צוותי המעבדות למיקרוביולוגיה קלינית והעוסקים ברפואה בקהילה.
למומחים במחלות זיהומיות תפקיד מרכזי בתוכניות שימוש מושכל באנטיביוטיקה בראש ובראשונה בשל הידע הנרחב שלהם בהבנת התהליכים הזיהומיים, בהפעלת האמצעים האבחנתיים הנחוצים ובהתאמת הטיפול האנטיביוטי למצבים זיהומיים מורכבים[6] [11] [12]. מעורבות של מומחה למחלות זיהומיות בטיפול משפרת את האבחנה של התסמונת הזיהומית מובילה למתן טיפול אנטיביוטי הולם בזמן והוכחה כמצילה חיים [11]. לדוגמה: בחולים עם אלח דם כתוצאה מהחיידק סטאפילוקוקוס זהוב (Staphylococcus aureus), ייעוץ מומחה למחלות זיהומיות היה כרוך בהפחתת התמותה ב-50-40 אחוזים, קיצור זמן האשפוז ומנע חזרת הזיהום באחוזים ניכרים [13] [14] [15] [16]. מחקר שהתפרסם הראה שייעוץ מומחים למחלות זיהומיות בחולים הסובלים מזיהומים עם חיידקים אנטריים רב-עמידים הוריד את התמותה מזיהומים אלו בכ-50 אחוזים, לרבות בחולים עם דיכוי חיסוני משמעותי, והוריד את שיעור האשפוז החוזר מזיהומים בחיידקים אילו בעשרות אחוזים [17]. אפקט דומה הודגם לגבי ייעוץ מומחים במחלות זיהומיות בזיהומים בחולים מושתלי איברים [18], בחולים עם אלח דם עם Candida glabrata[19] ובחולים הסובלים מזיהום ב-Cryptococcus[20] - כולם מצבים הכרוכים בתמותה גבוהה במיוחד.
פרט לידע המעמיק בגישה לאבחנה וטיפול במצבים זיהומיים למומחים למחלות זיהומיות כישורים חשובים נוספים ההופכים אותם למתאימים ביותר בהובלת תוכניות לטיפול מושכל באנטיביוטיקה. אילו כוללים סמכות מקצועית העוזרת במגעים עם הרופא המטפל וביכולת להשפיע על מהלך הטיפול בחולים עם מחלות זיהומיות, ידע בהבנת מגמות עמידות ברמה המוסדית והלאומית, ניסיון בהובלת תהליכים לשיפור איכות ובטיחות הטיפול בחולה, ניסיון בכתיבת הנחיות מקצועיות והובלת התערבויות, וכן הבנת חידושים מדעיים והיכולת לישמם. בנוסף, למומחים למחלות זיהומיות ראיה מערכתית רחבה, ניסיון בייעוץ להנהלות המוסדות הרפואיים ולמקבלי החלטות ברמה הלאומית, וכן הידע והגישה לבעלי עניין נוספים [6] [11] [12]. כל אילו הופכים את המומחים למחלות זיהומיות למובילים הטבעיים של התוכניות לטיפול מושכל באנטיביוטיקה.
לאור השונות בסוג החולים, במבנה הארגוני, כולל הבדלים בכח האדם ובתשתיות בין מוסדות הבריאות השונים בישראל ובין בתי-החולים הכלליים, לא ניתן "לתפור" פתרון אחיד אחד לכולם ועל כל בית-חולים לבחור את המרכיבים המתאימים לו ביותר, כך שתוכנית השימוש המושכל באנטיביוטיקה תהיה ישימה. עם זאת ישנם מספר מרכיבי יסוד אשר הם חלק חיוני ובסיסי בכל תוכנית וכוללים קיום הנחיות מוסדיות לזיהומים שכיחים ונוהל פיקוח מוסדי על מתן אנטיביוטיקה בהתאם להנחיות המוסד. למרות ששימוש מושכל באנטיביוטיקה נמצא בבסיס העשייה של מומחים למחלות זיהומיות, הוא דורש ניטור ושיפור מתמידים תוך גיבוי של מנהלים רפואיים והקצאת משאבים מתאימה.
עקרונות מנחים לשימוש מושכל באנטיביוטיקה
העקרונות המנחים, שהם אבני היסוד של שימוש מושכל באנטיביוטיקה, מתייחסים לשלבים שלפני ההחלטה על הטיפול האנטיביוטי ובמהלכו (טבלה 1): התחלת טיפול אנטיביוטי רק כאשר יש עדות ברורה לזיהום בחיידקים או כאשר קיים חשד גבוה לזיהום כזה. אבחון מהיר של מחולל הזיהום ואפיון הרגישות שלו לאנטיביוטיקה חשובים מאוד לשיפור השימוש המושכל. קיימות בדיקות מתקדמות מולקולריות ואחרות שבפיתוח אשר עוזרות בשלבים אלו. בעת בחירת הטיפול יש חשיבות לנסות להבין ולהגדיר את התהליך הזיהומי ולתת טיפול מכוון. כך הטיפול יהיה יעיל תוך הפחתת הנזק הקולטרלי הנגרם מטיפול מיותר. תיעוד ההתוויה הזיהומית בעת התחלת טיפול אנטיביוטי וקביעת משכו ואופנו מלכתחילה עוזרים לעיתים מזומנות להגדיר את מטרת הטיפול. לעיתים ההתייצגות הראשונה של חולים אינה ברורה או חד משמעית ומשום כך צוותי הרפואה משתמשים באנטיביוטיקה לטיפול במספר אפשרויות במקביל. הקפדה על תיעוד יומי והערכה מחודשת של החולה מקטינה טיפולים מיותרים כאלו. בנוסף, יש חשיבות רבה לאנמנזה מדויקת של רגישות לאנטיביוטיקה. מחקרים רבים מראים שמעל 90 אחוזים מהאנשים אשר מתועדת להם רגישות לאנטיביוטיקה אינם נכונים (למשל: מדובר בפריחה מזיהום בנגיף בילדות או תופעת לוואי של כאבי בטן שאינה יתר רגישות). הימנעות מבירור היסטוריה רפואית זו מביאה לרוב לבחירת טיפול חליפי נחות [21] או לבחירת טיפול רחב-טווח מיותר. עקרונות דומים תקפים גם במתן טיפול אנטיביוטי מניעתי על פי נהלים, במועד הנכון ולמשך הזמן הנכון. מחקרים רבים מדגימים הן את חשיבות מתן הטיפול האנטיביוטי טרום התערבויות כירורגיות ובאותה מידה את היעדר היתרון בהמשך הטיפול לאחר סיום הניתוח [22].
ישנה חשיבות גדולה מאוד להערכה מחודשת של מצבו הקליני של החולה לאחר 72-48 שעות מהתחלת הטיפול. יש להעריך תוצאות של בדיקות ובירורים שבוצעו עד אז כדי לקבוע האם מדובר בזיהום, להגדיר אותו, להעריך תגובה קלינית ולשקול את הצורך בהמשך טיפול אנטיביוטי, התכשיר האופטימלי ומשך הטיפול. ככלל, יש להעדיף טיפול צר טווח אשר מתאים לחולה ולהימנע מהמשך טיפול אנטיביוטי רק מפני שמצב החולה השתפר בעת ההערכה המחודשת. במטופלים המתאימים, ככל שהתכשירים האנטיביוטיים מאפשרים זאת, יש להעביר לטיפול פומי בהקדם. כך ניתן להפחית סיבוכים של מתן תרופות דרך הוריד ולאפשר שחרור מוקדם בחולים המתאימים.
- טבלה 1. עקרונות מנחים לשימוש נכון באנטיביוטיקה
- התחלת טיפול אנטיביוטי רק בעדות לזיהום חיידקי
- טיפול אנטיביוטי בהתאם להנחיות המוסדיות
- תיעוד ההתוויה הזיהומית, דרך ומשך מתן (קביעת תוכנית מראש)
- לקיחת אנמנזה על יתר רגישות לאנטיביוטיקה
- נטילת דגימות וביצוע בדיקות אבחנתיות מהירות
- הימנעות ממתן טיפול אנטיביוטי מניעתי אלא במקרים מוגדרים על פי ההנחיות
- הערכה מחודשת 48–72 שעות לאחר התחלת טיפול אנטיביוטי, לשם:
- בחינת תגובת החולה לטיפול
- בירור והערכת תשובות התרביות/הבדיקות האבחנתיות
- הערכה חוזרת מהי התסמונת הזיהומית (או העדר זיהום)
- שקילה מחדש והתאמת הטיפול האנטיביוטי, כולל:
- הפסקת הטיפול בהיעדר זיהום
- התאמת הטיפול לאבחנה הקלינית ו/או תוצאות של תרביות
- צמצום, ככל שניתן, של טווח הטיפול
- הרחבת טווח הטיפול
- קביעה מחודשת של משך הטיפול
- שקילת מעבר לטיפול פומי
- שקילת שחרור לטיפול ביתי
מרכיבי התוכנית (טבלה 3)
- קביעת יעדים מקומיים לתוכנית:
- בכל בית חולים קיימות בעיות ייחודיות ויש צורך בהכרות מעמיקה עם המערכת המקומית על מנת לקבוע יעדים נבחרים. לכן, המטרות הן עיתיות וצפויות להשתנות בהתאם לצורכי המוסד. מומלץ לבחור יעדים בעלי השפעה רוחבית על כלל הפעילות הקלינית במוסד
- אמצעים להטמעת שימוש מושכל באנטיביוטיקה ולשינוי התנהגות רישום אנטיביוטיקה:
- מבחר אמצעים הוכיחו את עצמם כיעילים להטמעת השימוש המושכל באנטיביוטיקה ולשיפור התנהגות רישום האנטיביוטיקה. אין עדיפות לאמצעי אחד על פני השני. יש חשיבות בהתאמת האמצעי הנבחר לצורכי המוסד ולמשאבים העומדים לרשותו.
- פיקוח על מתן אנטיביוטיקה - פיתוח מערך לאישורי מתן אנטיביוטיקה. כתיבה, הפצה והטמעה של הנחיות מוסדיות לטיפול באנטיביוטיקה לפי תסמונות זיהומיות על כל מוסד לכתוב ולהפיץ בקרב הצוות הרפואי הנחיות מוסדיות הקשורות לשימוש מושכל באנטיביוטיקה (טבלה 2). הנחיות אלו צריכות להיות מושתתות על בסיס נתונים מקומיים של שכיחות מחוללים ורגישותם לאנטיביוטיקה. ההנחיות יכתבו לפי קריטריונים מקובלים הכוללים: מבוא, קריטריונים לאבחנה, ריבוד חולים אם רלוונטי, טיפול אנטיביוטי נבחר לפי מדרג, חלופות במצבים של יתר רגישות, מינון, משך וקריטריונים למעבר לטיפול פומי, קריטריונים של תגובה לטיפול. בנוסף יש חשיבות להגדיר מהם השיקולים הפרמקודינאמיים והפרמקוקינטיים לאופן מתן, קריטריונים של ניטור (אם רלוונטי), קריטריונים למעבר ממתן פרנטראלי למתן פומי וקביעת משך טיפול באשפוז ולאחר השחרור. חלק לא פחות חשוב הוא ההפצה בצורה שיטתית, הדרכת צוות חדש ופרסום הנהלים במקום נגיש לעבודת היום יום של הרופא
- פיתוח ממשקים לעבודה עם המעבדות למיקרוביולוגיה:
- חלק חשוב להצלחת תוכניות לטיפול אנטיביוטי מושכל הוא קיום שיתוף פעולה הדוק עם המעבדות למיקרוביולוגיה כולל בקטריולוגיה, מיקולוגיה, מיקובקטריולוגיה, וירולוגיה, פרזיטולוגיה
- התאמת תוכניות שימוש מושכל באנטיביוטיקה לבתי חולים - משאבים ודרישות:
- תנאי הכרחי למימוש כל תוכנית הוא קיום מערך של כח אדם (מומחים למחלות זיהומיות, רוקחים קליניים ומנהלי נתונים) ותשתית מיחשובית מתאימה [5] [6] [23] [24]. לפיכך, נדרשת מחויבות של הנהלת בית החולים לשימוש מושכל באנטיביוטיקה. יתרה מזאת, מעורבות רציפה של ההנהלה בתהליכים, הקצאת משאבים ושמירת נושא זה על סדר היום של כל צוות בית החולים מהווה תנאי הכרחי לישום יעיל של מתווה שימוש מושכל באנטיביוטיקה. הרופאים המומחים במחלות זיהומיות צריכים להיות בעלי הזמן והאפשרות להתערב בטיפול, הן ברמת החולה הבודד והן ברמה המערכתית של ניהול המשאבים
- בחירת היעדים:
- בכל מוסד יש לבחור, על פי אופיו, את היעדים המתאימים, יעד אחד או שניים בלבד בשנה. התערבות רוחבית בו-זמנית במספר רב של יעדים צפויה להיכשל. מומלץ להתחיל ביעד אשר הוא בעל חשיבות קלינית גבוהה, אשר מהווה בעיה מרכזית ברורה לכל הצוות הרפואי באותו מוסד ובעל סיכויי הצלחה גבוהים באמצעים העומדים לרשות הצוות. הצלחה ביעד פשוט אחד תעצים את התוכנית, תגביר שיתוף פעולה ותאפשר בהמשך להתקדם ליעדים קשים יותר להשגה. חשוב להבהיר שתוכניות שימוש מושכל באנטיביוטיקה מתבססות על אסטרטגיות שנבדקו במחקרים ייעודיים. מטרת התוכנית אינה לבדוק את תקפותן
- ניטור תוצאי תוכניות לשימוש מושכל באנטיביוטיקה:
- בקרה של קיום תוכניות שימוש מושכל באנטיביוטיקה ומימוש תוכניות אלו בבתי חולים, מוסדות אשפוז אחרים ובקהילה, יחד עם ביצוע משוב למבצעי התוכניות, הכרחיים למימוש הצלחה ארוכת טווח של תוכניות לשימוש מושכל באנטיביוטיקה[25]. בעת הגדרת יעדים להתערבות יש להגדיר באותו זמן את האמצעי המדיד אותו מבקשים לשנות בעקבות ההתערבות. יעד כוללני של הפחתת שימוש באנטיביוטיקה אינו מספק ובמקומו יש להגדיר מדדים מדויקים ומפורטים. כל בית חולים המנהל תוכנית לשימוש מושכל באנטיביוטיקה יקבע תוכנית עבודה הכוללת יעדים שנתיים, אמצעים להטמעת התוכנית וניטורה. תוצאות הניטור ישמשו לקביעת המדיניות לתקופה העוקבת, ידווחו לגורמים הרלוונטיים בבית החולים ויופצו כמשוב.
- קיימת חשיבות רבה בדיוק במדידה. כאשר התיק הרפואי ממוחשב, אנו ממליצים לחשב את החשיפה לאנטיביוטיקה (בניגוד למינון התרופה) בשיטת מספר ימים תחת טיפול ל-100 ימי אשפוז (Days of therapy per 100 hospital days). המידע שנאסף מהרשומה הרפואית האלקטרונית משקף את הטיפול בפועל, מתאים לילדים ואינו תלוי ברשימות מלאי [26]. בהיעדר תיק אלקטרוני, המדידה לפי ימי אשפוז (DDD/Defined daily dose למאה ימי אשפוז) היא המקובלת. מדד זה בעייתי לאור צורת החישוב. המונה של ערך הניפוק מושפע ממלאי התרופה ללא התאמה לטיפול בחולה. בנוסף, מדד זה אינו מתאים להערכת הטיפול בילדים מחד ולחולים בעלי משקל גוף גדול מאידך. מכיוון שהפחתת שימוש בתכשיר אחד יכולה לגרום לעליית הצריכה בתכשירים אחרים, יש לבצע ניטור רציף DOT של כלל התרופות האנטיביוטיות, או לפחות את אלו שיכולות לשמש חלופה לתרופה הנמדדת
- מערכות מחשב והיזון חוזר:
- למערכות מחשב יש מקום מרכזי בניטור תוכניות לשימוש מושכל באנטיביוטיקה. מטרת הדווחים היא לאתר את נקודות התורפה בהן נדרשת התערבות של המומחים למחלות זיהומיות. לכן, מומלץ להעביר את איסוף המידע לביצוע אוטומטי ממוחשב באופן אשר ייתר השקעה במשאבי אנוש ויאפשר ניהול, תחקור ואבטחת מידע מיטביים [27][28].
- בנוסף לדוחות, מומלץ להתאים את הגיליון הרפואי הממוחשב. עם המעבר לגיליון הרפואי הממוחשב, יש עומס רב במידע הרפואי הזמין לכל רופא, פעמים רבות מידע זה אינו מסודר בצורה נוחה והגיונית כך שלרופא יהיה את כל המידע הרפואי הנחוץ בעת קבלת החלטות לטיפול אנטיביוטי [29]
- טבלה 2. הנחיות חיוניות למוסדות רפואיים (דוגמאות)
- פעולות קדם אנליטיות (אופן נטילת תרביות דם)
- טיפול בזיהומים שכיחים (דלקת ריאות, זיהום בדרכי השתן)
- טיפול בזיהומים נדירים אשר דורשים ניהול מוסדר (זיהום עובשי חודר)
- זיהומים שמסכנים מאושפזים אחרים (אבחנה, טיפול, בידוד ומניעה של זיהום ב-Clostridium difficile)
- טיפול במצבים מיוחדים (מניעת זיהום בפטריה בחולים עם סרטן)
- מניעת זיהום בפצע ניתוח (הגדרת סוג תכשיר, משך מתן על פי סוג הניתוח)
- מתן אופטימלי של טיפול אנטיביוטי (מינון וניטור אמינוגליקוזידים, אופן מתן β-lactam בחולים/זיהומים מורכבים)
- טבלה 3
- מרכיבי תוכנית לשימוש מושכל באנטיביוטיקה:
| א. קביעת יעדים מקומיים לתוכנית | * בכל מוסד יקבעו יעדים ספציפיים, על ידי הוועדה לשימוש מושכל באנטיביוטיקה ומנהל התוכנית לשימוש מושכל באנטיביוטיקה, יוצגו למנהל המוסד ויקבלו את אישורו. | |
| ב. אמצעים להטמעת שימוש מושכל באנטיביוטיקה ולשינוי התנהגות רישום אנטיביוטיקה | 1. פיקוח על מתן אנטיביוטיקה - פיתוח מערך לאישורי מתן אנטיביוטיקה |
|
| 2. כתיבה, הפצה והטמעה של הנחיות מוסדיות לטיפול באנטיביוטיקה לפי תסמונות זיהומיות | * על כל מוסד לכתוב ולהפיץ בקרב הצוות הרפואי הנחיות מוסדיות הקשורות לשימוש מושכל באנטיביוטיקה (ראו טבלה 2). | |
| ג. פיתוח ממשקים לעבודה עם המעבדות למיקרוביולוגיה |
| |
| ד. התאמת תוכניות שימוש מושכל באנטיביוטיקה לבתי חולים: משאבים ודרישות | הקצאת מערך כח אדם (מומחים למחלות זיהומיות, רוקחים קליניים ומנהלי נתונים) ותשתית מחשובי מתאימה | |
| ה. בחירת היעדים |
| |
| ו. ניטור תוצאי תוכניות לשימוש מושכל באנטיביוטיקה | בעת הגדרת יעדים להתערבות יש להגדיר באותו זמן את האמצעי המדיד אותו מבקשים לשנות בעקבות ההתערבות. יעד כוללני של הפחתת שימוש באנטיביוטיקה אינו מספק ובמקומו יש להגדיר מדדים מדויקים ומפורטים | |
| ז. מערכות מחשב והיזון חוזר | דוגמאות של דווחים יומיים. מומלץ להטמיע נושאים אלו בהדרגה ובהתאם לאופי בית החולים, יכולתיו והיעדים שנקבעו:
| |
דיווח למשרד הבריאות
תוצאות הניטור בבתי החולים השונים ישמשו גם לדיווח למשרד הבריאות, בהתאם לחוזר מנהל רפואה "תוכנית לאומית לשימוש מושכל באנטיביוטיקה" מספר 16/12, 2012. מטרת הדווח היא זיהוי פערים כך שתאפשר הפנייה לאומית נכונה של משאבים.
תפקיד האיגוד הישראלי למחלות זיהומיות
האיגוד הישראלי למחלות זיהומיות מאגד מבחינה פרופסיונלית את המומחיות הרפואית בתחומי המחלות הזיהומיות והמיקרוביולוגיה הקלינית, ומרבית המומחים בתחומים אלה בישראל חברים באיגוד. האיגוד פועל בתוך ומטעם ההסתדרות הרפואית לרבות בכתיבה והפצה של ניירות עמדה וקוים מנחים. מתוקף כך האיגוד הישראלי למחלות זיהומיות מפתח המלצות מקצועיות שנועדו לכוון את פעילותם של חברי האיגוד ולסייע לגיבוש עמדות מקצועיות, לרבות בתחום השימוש הנאות באנטיביוטיקה. האיגוד יזהה מגמות וצרכים המחייבים הערכות והקצאת משאבים ברמה הלאומית ותאום מדיניות ניהול אנטיביוטיקה בין המוסדות הרפואיים השונים.
סיכום
יש צורך אמתי ודחוף במדינת ישראל בהעלאת המודעות לנושא של שימוש מושכל באנטיביוטיקה, הקצאת משאבים מתאימים, התאמת מערכות המיחשוב וביצוע התערבויות נקודתיות ורוחביות. לאור השונות הרבה הקיימת במערכות הבריאות בישראל אין פתרון אחד אשר מתאים לכולם. יש צורך בהתאמה מקומית והשגת אותם היעדים בדרכים המתאימות לכל מוסד ומוסד. דבר זה יתממש רק על בסיס שיתוף פעולה, היענות והבנת חשיבות הנושא על ידי כל הנוגעים בדבר, הרופאים המטפלים, הרופאים למחלות זיהומיות, מנהלי בתי החולים ומשרד הבריאות.
ביבליוגרפיה
- ↑ Abraham EP, Chain E. An enzyme from bacteria able to destroy penicillin. 1940. Reviews of infectious diseases. 1988;10(4):677-8.
- ↑ Blaser MJ. Antibiotic use and its consequences for the normal microbiome. Science. 2016;352(6285):544-5.
- ↑ Global Action Plan on Antimicrobial Resistance. World Health Organization, 2015.
- ↑ Shlaes DM, Gerding DN, John JF, Jr., Craig WA, Bornstein DL, Duncan RA, et al. Society for Healthcare Epidemiology of America and Infectious Diseases Society of America Joint Committee on the Prevention of Antimicrobial Resistance: guidelines for the prevention of antimicrobial resistance in hospitals. Infect Control Hosp Epidemiol. 1997;18(4):275-91.
- ↑ 5.0 5.1 Pollack LA, Plachouras D, Sinkowitz-Cochran R, Gruhler H, Monnet DL, Weber JT, et al. A Concise Set of Structure and Process Indicators to Assess and Compare Antimicrobial Stewardship Programs Among EU and US Hospitals: Results From a Multinational Expert Panel. Infect Control Hosp Epidemiol. 2016;37(10):1201-11.
- ↑ 6.0 6.1 6.2 6.3 6.4 Barlam TF, Cosgrove SE, Abbo LM, MacDougall C, Schuetz AN, Septimus EJ, et al. Implementing an Antibiotic Stewardship Program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis. 2016;62(10):e51-77.
- ↑ Schuts EC, Hulscher ME, Mouton JW, Verduin CM, Stuart JW, Overdiek HW, et al. Current evidence on hospital antimicrobial stewardship objectives: a systematic review and meta-analysis. Lancet Infect Dis. 2016;16(7):847-56.
- ↑ Tamma PD, Avdic E, Keenan JF, Zhao Y, Anand G, Cooper J, et al. What Is the More Effective Antibiotic Stewardship Intervention: Preprescription Authorization or Postprescription Review With Feedback? Clin Infect Dis. 2017;64(5):537-43.
- ↑ Li DX, Cosgrove SE. Antimicrobial Stewardship: Efficacy and Implementation of Strategies to Address Antimicrobial Overuse and Resistance. In: Pulcini C, Ergbnul O, Can F, Beovic B, editors. Developments in Emerging and Existing Infectious Diseases Antimicrobial Stewardship. 1. London: Elsevier Inc.; 2017. p. 13-28.
- ↑ Septimus EJ, Owens RC, Jr. Need and potential of antimicrobial stewardship in community hospitals. Clin Infect Dis. 2011;53 Suppl 1:S8-S14.
- ↑ 11.0 11.1 11.2 Rieg S, Kupper MF. Infectious diseases consultations can make the difference: a brief review and a plea for more infectious diseases specialists in Germany. Infection. 2016;44(2):159-66.
- ↑ 12.0 12.1 Ostrowsky B, Banerjee R, Bonomo RA, Cosgrove SE, Davidson L, Doron S, et al. Infectious Diseases Physicians: Leading the Way in Antimicrobial Stewardship. Clin Infect Dis. 2018;66(7):995-1003.
- ↑ Tissot F, Calandra T, Prod'hom G, Taffe P, Zanetti G, Greub G, et al. Mandatory infectious diseases consultation for MRSA bacteremia is associated with reduced mortality. J Infect. 2014;69(3):226-34.
- ↑ Buehrle K, Pisano J, Han Z, Pettit NN. Guideline compliance and clinical outcomes among patients with Staphylococcus aureus bacteremia with infectious diseases consultation in addition to antimicrobial stewardship-directed review. Am J Infect Control. 2017;45(7):713-6.
- ↑ Paulsen J, Solligard E, Damas JK, DeWan A, Asvold BO, Bracken MB. The Impact of Infectious Disease Specialist Consultation for Staphylococcus aureus Bloodstream Infections: A Systematic Review. Open forum infectious diseases. 2016;3(2):ofw048.
- ↑ Vogel M, Schmitz RP, Hagel S, Pletz MW, Gagelmann N, Scherag A, et al. Infectious disease consultation for Staphylococcus aureus bacteremia - A systematic review and meta-analysis. J Infect. 2016;72(1):19-28.
- ↑ Burnham JP, Olsen MA, Stwalley D, Kwon JH, Babcock HM, Kollef MH. Infectious Diseases Consultation Reduces 30-Day and 1-Year All-Cause Mortality for Multidrug-Resistant Organism Infections. Open forum infectious diseases. 2018;5(3):ofy026.
- ↑ Hamandi B, Husain S, Humar A, Papadimitropoulos EA. Impact of infectious disease consultation on the clinical and economic outcomes of solid organ transplant recipients admitted for infectious complications. Clin Infect Dis. 2014;59(8):1074-82.
- ↑ Farmakiotis D, Kyvernitakis A, Tarrand JJ, Kontoyiannis DP. Early initiation of appropriate treatment is associated with increased survival in cancer patients with Candida glabrata fungaemia: a potential beneit from infectious disease consultation. Clin Microbiol Infect. 2015;21(1):79-86.
- ↑ Spec A, Olsen MA, Raval K, Powderly WG. Impact of Infectious Diseases Consultation on Mortality of Cryptococcal infection in Patients without HIV. Clin Infect Dis. 2017;64(5):558-64.
- ↑ Trubiano JA, Thursky KA, Stewardson AJ, Urbancic K, Worth LJ, Jackson C, et al. Impact of an Integrated Antibiotic Allergy Testing Program on Antimicrobial Stewardship: A Multicenter Evaluation. Clin Infect Dis. 2017;65(1):166-74.
- ↑ Bratzler DW, Dellinger EP, Olsen KM, Perl TM, Auwaerter PG, Bolon MK, et al. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Surg Infect (Larchmt). 2013;14(1):73-156.
- ↑ NICE. Antimicrobial stewardship: systems and processes for effective antimicrobial medicine use. National Institute For Health and Clinical Excellence, 2015.
- ↑ Dickstein Y, Nir-Paz R, Pulcini C, Cookson B, Beovic B, Tacconelli E, et al. Stafing for infectious diseases, clinical microbiology and infection control in hospitals in 2015: results of an ESCMID member survey. Clin Microbiol Infect. 2016;22(9):812 e9- e17.
- ↑ Moehring RW, Anderson DJ, Cochran RL, Hicks LA, Srinivasan A, Dodds Ashley ES, et al. Expert Consensus on Metrics t:*Assess the Impact of Patient-Level Antimicrobial Stewardship Interventions in Acute-Care Settings. Clin Infect Dis. 2017;64(3):377-83.
- ↑ Morris AM. Antimicrobial Stewardship Programs: Appropriate Measures and Metrics t:*Study their Impact. Current treatment options in infectious diseases. 2014;6(2):101-12.
- ↑ McGregor JC, Weekes E, Forrest GN, Standiford HC, Perencevich EN, Furun:*JP, et al. Impact of a computerized clinical decision support system on reducing inappropriate antimicrobial use: a randomized controlled trial. J Am Med Inform Assoc 2006;13:378-84. doi:10.1197/jamia.M2049
- ↑ Nachtigall I, Tafelski S, Deja M, Halle E, Grebe MC, Tamarkin A, et al. Long-term effect of computer-assisted decision support for antibiotic treatment in critically ill patients: a prospective 'before/after' cohort study. BMJ Open 2014;4:e005370. doi:10.1136/bmjopen-2014-005370.
- ↑ Buising KL, Thursky KA, Robertson MB, Black JF, Street AC, Richards MJ, et al. Electronic antibiotic stewardship--reduced consumption of broad-spectrum antibiotics using a computerized antimicrobial approval system in a hospital setting. J Antimicrob Chemother 2008;62:608-16. doi:10.1093/jac/dkn218.
המידע שבדף זה נכתב על ידי ד"ר ליאור נשר - המכון למחלות זיהומיות במרכז הרפואי האוניברסיטאי סורוקה, מסונף לפקולטה למדעי הבריאות, אוניברסיטת בן גוריון בנגב. ופרופ' יעקב סטרכילביץ - המחלקה למיקרוביולוגיה קלינית ומחלות זיהומיות, הדסה-האוניברסיטה העברית.
יועצים (לפי סדר א',ב'):
ד"ר רונן בן עמי - היחידה למחלות זיהומיות, מרכז רפואי תל-אביב (איכילוב), ת"א; ד"ר בת שבע גוטסמן - האיגוד הישראלי למחלות זיהומיות, היחידה למחלות זיהומיות, מרכז רפואי מאיר, כפר-סבא; פרופ' מרים וינברגר - יו"ר האיגוד הישראלי למחלות זיהומיות, היחידה למחלות זיהומיות, המרכז הרפואי אסף הרופא (שמיר); ד"ר ביביאנה חזן - היחידה למחלות זיהומיות, מרכז רפואי העמק, עפולה; ד"ר יסמין מאור- היחידה למחלות זיהומיות ולמניעת זיהומים, מרכז רפואי וולפסון, חולון; פרופ' שלמה מעיין - היחידה למחלות זיהומיות, מרכז רפואי ברזילי, אשדוד; ד"ר יצחק לוי - היחידה למחלות זיהומיות ילדים, מרכז רפואי שניידר לילדים, פ"ת; ד"ר אלונה פז - היחידה למחלות זיהומיות, מרכז רפואי בני-ציון, חיפה; פרופ' אורן צמחוני - היחידה למחלות זיהומיות, מרכז רפואי קפלן, רחובות; פרופ' גליה רהב - היחידה למחלות זיהומיות, מרכז רפואי שיבא, תל השומר; ד"ר מיכל שטיין - היחידה למחלות זיהומיות, מרכז רפואי הילל יפה, חדרה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק