כולציסטוקינין - Cholecystokinin
הופניתם מהדף Cholecystokinin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| כולציסטוקינין | |
|---|---|
| Cholecystokinin | |
| שמות אחרים | CCK או CCK-PZ וכן pancreozymin |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | וויסות תחושות רעב ושובע |
| טווח ערכים תקין | פחות מ-80 מיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
- מטרת הבדיקה
הערכה של שיבושים בהפרשת CCK הרלוונטיים למצבי הפרעות באכילה.
בסיס פיזיולוגי של פעילות CCK
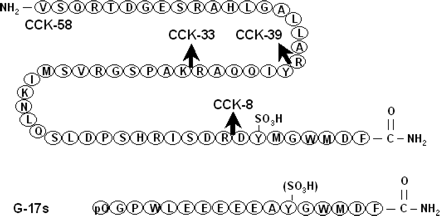
CCK הוא פפטיד בעל 33 חומצות אמינו הדומה מאוד במבנהו לגסטרין, כאשר שני פפטידים אלה הם בעלי רצף זהה של 5 חומצות אמינו בקצה ה-C טרמינאלי שלהם. CCK מופיע הן במערכת העיכול וגם במערכת העצבים המרכזית במספר צורות השונות בגודלן, וכך זוהו סוגי ההורמון הבאים: CCK-58, ,CCK-39 CCK-33, CCK-12, CCK-22 , CCK-8 , CCK-5 ו-CCK-83 על בסיס מספר חומצות האמינו שלהן, כאשר כל הצורות הללו מקורן בפפטיד קודמן (Pre-Pro-CCK) בעל 95 חומצות אמינו (Rhefeld ב-Clin Chem משנת 1998). המספר השונה של חומצות אמינו של האיזופורמים השונים של CCK, תלוי ב-post-translation modification של הגן של CCK. במוח האדם CCK-8 היא הצורה הדומיננטית, ואילו במעי ובצירקולציה, נמצא בכמויות משמעותיות את CCK-33,CCK-58 ,CCK-22 ו-CCK-8 (עפ"י Eberlein וחב' ב-Peptides משנת 1988, ו-Rhefeld וחב' ב-J Clin Endocrinol Metabol משנת 2001 שדיווחו על כך ששתי הצורות השכיחות ביותר בצירקולציה הן CCK-22 ו-CCK-33). גם האוקטפפטיד CCK-8 שומר על הפעילות המלאה של CCK-33.
CCK הוא הורמון פפטידי של מערכת העיכול, האחראי לעידוד העיכול של שומנים וחלבונים. CCK מסונתז על ידי תאי-I של האפיתל הרירי במעי הדק, ומופרש על ידי התריסריון, ובכך משרה שחרור של אנזימים מעכלים מבלוטת הלבלב ואת נוזל המרה (bile).CCK פועל גם כמדכא תחושת רעב. נתונים עדכניים מרמזים לכך ש-CCK משחק תפקיד בהשריית עמידות לאופיואידים דוגמת morphine והרואין. יחד עם זאת CCK נכרך באופן חלקי בתופעות של רגישות-יתר לכאב בתקופות של גמילה מאופיואידים.
הפרשת CCK מושפעת על ידי LCRF או luminal CCK-releasing factor, המופרש מאנטרוציטים ברירית התריסריון, ומתאי בלוטת הלבלב (Miyasaka וחב' ב-Am J Physiol Gastrointest Liver Physiol משנת 1989). עירוי לתוך התריסריון של LCRF מגדיל את רמות CCK בפלזמה (Spannagel וחב' ב-Regul Pept משנת 1998). מייד לאחר ארוחה, פריטי המזון המגיעים למעי הדק, מגרים עלייה ברמות CCK בפלזמה, מ-1pM עד ל-5-8pM, כאשר ריכוזי CCK עולים תוך 15 דקות ודועכים תוך 3-5 שעות (Liddle וחב' ב-J Clin Invest משנת 1985).
CCK נמצא בשפע בעצבים היקפיים של מערכת העיכול המעצבבים את המעי הגס, האילאום, את הפלקסוס המזנטרי ואת הפלקסוס התת-רירי. במערכת העיכול מאוחסן CCK בעיקר בתאי "I" בתריסריון וברירית ה-jejunum, בעיקר בתגובה לשומנים ולחלבונים במזון (Larsson ו-Rhefeld ב-Histochemistry משנת 1978, ו-Lieverse וחב' ב-Gut משנת 1994), אך גם בתגובה לגלוקוזה במזון (Parker וחב' ב-Clin Endocrinol משנת 2005). מתן אקסוגני של CCK מעכב הפרשה אנדוגנית של הורמון זה (MacIntosh וחב' ב-J Clin Endocrinol Metabol משנת 2001).
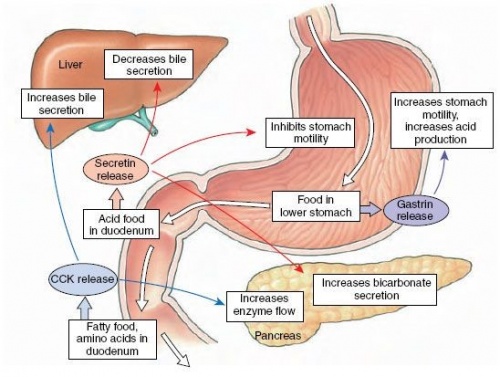
CCK משתתף במספר תהליכים פיזיולוגיים כולל עיכול ושובע במעי, כולל גירוי של כיווץ כיס המרה, גירוי הפרשה של מרה והפרשות הלבלב, עיכוב הפרשת חומצת קיבה (Chen וחב' ב-Gastroenterology משנת 2004), האטת התרוקנות הקיבה (Liddle וחב' ב-J Clun Invest משנת 1986), מודולציה של תנועת המעי הדק והגס (Meyer וחב' ב-Lancet משנת 1989), ודיכוי צריכת מזון (Kissileff וחב' ב-Am J Clin Nutr משנת 1981(.
מחקרים מוקדמים על CCK
CCK הוא ההורמון העיקרי האחראי לכיווץ כיס המרה והפרשת אנזימים מבלוטת הלבלב. כמו הורמונים אחרים במערכת העיכול, CCK מיוצר בתאים אנדוקריניים מיוחדים הממוקמים ברירית המעי הדק (Polak וחב' ב-Lancet משנת 1975). הגילוי המקורי של CCK היה בשנת 1928 עם התצפית שחומר מסוים המופיע בתמצית מהמעיים עודד את כיווץ כיס המרה בכלבים. בשנת 1943 תמצית דומה שכונתה pancreozymin נמצאה מעודדת הפרשת אנזימים מהלבלב, אך ריצוף חומצות האמינו של התמצית משני מקורות אלו, גילה שמדובר באותו הורמון (Jorpes ו-Mutt ב-Acta Physiol Scand משנת 1966). בהמשך התברר שבאדם התפקידים הפיזיולוגיים כוללים כיווץ כיס המרה, הגברת הפרשת אנזימים מהלבלב, עיכוב התרוקנות הקיבה, עידוד הפרשת אינסולין, וויסות צריכת מזון בעת הארוחה. בנוסף CCK מווסת את תנועת המעי, והשפעה מעודדת על גידול בלוטת הלבלב בחיות מסוימות (Mutt ב-Gastrointest Hormones משנת 1988).
הקולטנים של CCK ומיקומם האנטומי
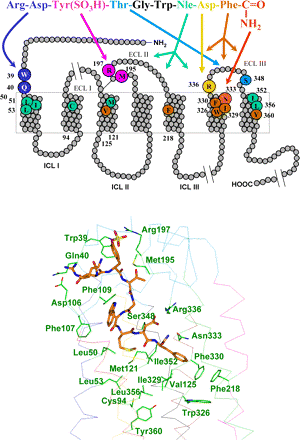
קולטנים ל-CCK במערכת העיכול זוהו בלבלב, בכיס המרה, בקיבה, בספינקטר התחתון של הוושט, ב-ileum, ובמעי הגס. קולטנים ל-CCK נמצאו בשפע במוח ועל מספר עצבים היקפיים. עד כה זוהו 2 קולטנים ל-CCK: כינויי הקולטנים הם CCK1 (בעבר כונו CCK-A או Alimentary typeׂ ו-CCK2 (בעבר כונה CCK-B או Brain type) על בסיס מיקומם האנטומי (Moran וחב' ב-Brain Res משנת 1986, ו-Wank וחב' ב-Proc Natl. Acad. Sci USA משנת 1992). נמצאה חפיפה חלקית במיקום האנטומי של 2 סוגי הקולטנים, מה שהביא לשינוי בכינוי של 2 סוגי הקולטנים ל-CCK1 ו-CCK2, בהתאמה. שני סוגי הקולטנים מקודדים על ידי גנים שונים.
הקולטן CCK1 קושר ספציפית את צורות ההורמון בהן שייר טירוזין בעמדה 7 עבר סולפציה, כאשר קולטן זה נמצא בריכוז גבוה ברקמות היקפיות, כולל התאים האצינאריים של הלבלב, כיס המרה, השריר החלק של שער הקיבה, ועצבי הואגוס האֲפרנטיים במעי (Smith וחב' ב-Am J Physiol Regul Intger Comp Physiol משנת 1984). קולטני CCK1 ממוקמים גם ב-CNS, בעיקר באזורי מוח הקשורים בוויסות צריכת מזון, כולל ה-ה-NTS או nucleus tractus solitarius, ה-AP או area postrema, וההיפותלאמוס המדיאלי-דורזאלי (Hill וחב' ב-J Neurosci משנת 1989).
הקולטן CCK1 הוא בעל אזורי קישור בזיקה חזקה וחלשה (Pandya ןחב' ב-Biocem Biophys Acta משנת 1994). האזורים בעל זיקת הקישור הגבוהה, מותאמים להגיב לריכוזים נמוכים של CCK, בתחומי ריכוז של pM, ואילו אזורי הקישור בעלי הזיקה הנמוכה קושרים CCK בריכוזים גבוהים של ננומולר. בחולדות, נמצא שההשפעה המעכבת של CCK אקסוגני על צריכת מזון, נעשית על ידי שפעול של אותם האזורים בעלי זיקת הקישור הנמוכה של הקולטן CCK1 (עפ"י Weatherford וחב' ב-Am J Physiol Regul Intger Comp Physiol משנת 1993).
הקולטן CCK2 זהה לקולטן של gasrrin, ונמצא בקיבה ובמוח, כולל קליפת המוח וההיפותלאמוס כמו גם הסעיפים האפרנטיים של הוואגוס וכן ברירית הקיבה (Wank וחב' ב-Ann NY Acad Sci משנת 1994, ו-Gaudreau וחב' ב-Peptides משנת 1983). לקולטן CCK2 יש זיקת קישור גבוהה לגסטרין כמו גם לצורות הקצרות יותר של CCK, כמו צורות CCK-5 ו-CCK-8 שעברו סולפציה (Baldewin וחב' ב-Prog Neurobiol משנת 1998). ל-2 סוגי הקולטנים, יש 7 מקטעים (domains) טרנס-ממברנאליים האופייניים לקולטנים הקשורים לחלבוני G (Kopin וחב' ב- Proc Natl. Acad. Sci USA משנת 1992).
הפיתוח של אנטגוניסטים ל-2 הקולטנים של CCK היה שימושי להגדרת התכונות הביולוגיות של CCK. ארבעה סוגים של אנטגוניסטים כאלה שימשו במחקרים פרמקולוגיים ופיזיולוגיים, אנטגוניסטים אלה כללו אנאלוגים של נוקלאוטידים ציקליים (לדוגמה dibutyryl cGMP), נגזרות של חומצות אמינו (לדוגמה loxiglumide), אנאלוגים של הקצה הקרבוקסי טרמינאלי של CCK, ובנזודיאזפינים משוחלפים (לדוגמה devazepide). האנטגוניסטים של קולטני CCK מעכבים את פעילות CCK, ואת הכיווץ של כיס המרה המושרה בעת ארוחה, והם בעלי השפעה על התרוקנות הקיבה ותחושת השובע. בדומה, Beltinger וחב' דווחו ב-Eur J Clin Invest משנת 1999 על ההשפעה של spiroglumide (אנטגוניסט נוסף של הקולטן ל-CCK) על הפרשת חומצת קיבה.
בנוסף לחקר תפקוד הקולטנים ל-CCK בגישה של התערבות פרמקולוגית, נחקרו מספר מודלים בחיות החסרות את הקולטנים הללו. בזןOLETF של חולדות בהן יש פגיעה קשה בקולטן CCK1, התפתחה החולדות אלו היפרגליקמיה, היפר-אינסולינמיה והשמנת-יתר, מה שהצביע על חשיבות פעילות CCK בתהליכים מטבוליים אלה (Takigichi וחב' ב-Gene משנת 1997). במחקרים אחרים, שיבוט של הקולטנים CCK1 ו-CCK2 הפך לאפשרי את ההשמטה של הגנים המקודדים לקולטנים אלה בחיות ניסוי. חיות החסרות את הקולטן CCK1 שמרו על משקל גוף תקין, למרות שתגובות השובע למתן אקסוגני של CCK היו משובשות. השמטה של הקולטן CCK2 (שהוא גם הקולטן לגסטרין) בעכברים, גרמה ליצירה מופחתת של חומצת קיבה, לעלייה ברמות גסטרין בפלזמה, ולמספר קטן יותר של תאי ECL ותאים פּריטאליים (parietal) בקיבה, מה שמצביע על החשיבות של הקולטנים ל-CCK2 בשמירה על המורפולוגיה של הקיבה והפרשה חומצת הקיבה (Langhans וחב' ב-Gastroenterology משנת 1997).
[[
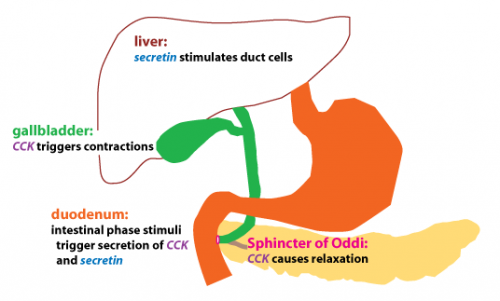
השפעת CCK על כיס המרה והפרשות הלבלב
בשנת 1927 דיווחו Ivy ו-Goldberg ב-Proc Soc Exp Biol Med, שעירוי של ליפידים לתוך המעי הדק של בעלי חיים עודד הפרשת חומר שהשרה התכווצות כיס המרה, והציעו לכן שחומר זה ייקרא cholecystokinin, שכן "הוא מגרה את כיס המרה". בהמשך תואר על ידי Harper ו-Raper ב-J Physiol משנת 1943, חומר מרירית המעי הדק שעודד בהזרקתו לווריד הפרשה של אנזימים מעכלים פנקראטיים, ולכן כונה על ידם pancreozymin. בשנת 1971, מיצו וניקו Jorpes ו-Mutt CCK מהמעי הדק של חזירים, והודיעו בActa Physiol Scand שהוא מכיל 33 חומצות אמינו, וקבעו ש-CCK זהה ל-pancreozymin. התפקיד הפיזיולוגי של CCK בוויסות כיווץ כיס המרה והפרשת מרה באדם, הוכח בהמשך על ידי שימוש ב-devazepide או MK-329, שהוא אנטגוניסט ספציפי של קישור CCK לקולטן שלו. תכשיר זה אמנם מנע באופן תלוי-ריכוז השפעה של CCK או זו של אכילה, על כיווץ כיס המרה (Liddle וחב' ב-J Clin Invest משנת 1989). בדומה, האנטגוניסט הספציפי של קישור CCK לקולטנו, loxiglumide, מעכב את הפרשת האנזימים הפנקראטיים הן על ידי CCK כמו גם על ידי צריכת מזון (Fried וחב' ב-Gastroenterology משנת 1991).
השפעת CCK על התפקוד המוטורי של הקיבה והמעי
החדרה אקסוגנית של CCK מביאה להאטה בהתרוקנות הקיבה (Yamagishi וחב' ב- Am J Physiol Endocrinol Metabol משנת 1978, ו-Liddle וחב' ב-J Clin Invest משנת 1986), מה שכרוך בהרפיה קריבנית (פרוקסימאלית) של הקיבה (Ludtke וחב' ב-Digestion משנת 1988), בדיכוי של גלי התנועתיות באנטרוּם של הקיבה ובתריסריון, ובעידוד של לחץ הפאזי והטוני הפילורי (Fraser וחב' ב-Gut משנת 1993 ו-Rayner וחב' ב-Am J Physiol Gastrointest Liver Physiol משנת 2000). כמו כן, הראו Kellow וחב' ב- Am J Physiol Gastrointest Liver Physiol משנת 1987), ש-CCK מעודד תנועתיות של ה-jejunun, ומדכא תנועתיות של המעי הגס. ההשפעה המעכבת על התרוקנות הקיבה של ליפידים, הוחלשה על ידי החדרת האנטגוניסט לקישור CCK לקולטן שלו (loxiglumide) מה שמוכיח שהשפעת ליפידים על התרוקנות הקיבה מתבצעת דרך CCK. השפעות CCK על התרוקנות הקיבה, ועל התנועתיות של התריסריון, רלוונטית לדיכוי התיאבון על ידי CCK (עפ"י Brennan וחב' ב-Am J Physiol Regul Intger Comp Physiol משנת 2005).
השפעות של CCK אקסוגני על תיאבון ואכילה
ידוע שמתן אקסוגני של CCK מדכא את התיאבון. בניסוי ההיסטורי שלהם, Gibbs וחב' דיווחו על כך שהחדרה תוך-צפקית של CCK, דיכאה באופן תלוי-מינון צריכה של מזון סולידי ונוזלי בחולדות ( J Comp Physiol Psychol משנת 1973). נמצא ש-CCK-8 הפחית בחולדות הן את כמות המזון שצרכו וכן את משך האכילה (Antin וחב' באותו כתב עת משנת 1975). בעקבות ממצאים אלה, הניחו Gibbs וחב' ש-CCK אנדוגני, הוא התווך הפיזיולוגי של צריכת אנרגיה בבעלי חיים, מה שסיפק את הרציונל לתהליך דומה באדם. אכן, עירוי תוך ורידי באדם של CCK-8 ושל CCK-33, הגדיל במטופלים את תחושת המְלֵאוּת, הפחית בהם את הרעב ואת כמויות המזון שצרכו (Lieverse וחב' ב-Gastroenterlogy משנת 1994).
Kissileff וחב' משנת 1981 ב-Am J Clin Nutr, היו הראשונים בהדגמה שלאחר צריכה מקדימה של 216 קילו-קלוריות, עירוי תוך ורידי של CCK-8 במינון של 4 ננוגרם/ק"ג משקל גוף/דקה למשך 10 דקות, גרם לירידה של 19% בצריכת המזון, והפחית גם את משך האכילה בהשוואה לפלצבו. כיוון שבתנאים פיזיולוגיים CCK פועל באופן פאראקריני על הסעיפים האפרנטיים של הוואגוס, ולאחר הפרשתו הוא נכנס לצירקולציה השערית (פורטאלית) ועובר דרך הכבד לפני שהוא מתגלה בפלזמה, יש להכיר בכך שכמויות גדולות יחסית של CCK המופרשות במעי אינן בהכרח באות לביטוי ברמה גבוהה שלו בפלזמה, בגלל פירוק מסיבי שלו בעת מעברו לצירקולציה.
אינטראקציה בין CCK לבין גירויים גסטרואנטראליים אחרים:
רוב המחקרים שבחנו את ההשפעות של החדרה אקסוגנית של CCK על צריכת אנרגיה נקטו במתכונת של "preload" להגביר את ההשפעה של CCK (עפ"י Lieverse וחב' ב-Gut משנת 1995, ו-Muurahainen וחב' ב- Am J Physiol Regul Intger Comp Physiol משנת 1991) מתוך הנחה שמתן מקדים של ההורמון מניב גירוי כבר ברמת הקיבה.
בליעת מזון כרוכה גם כן בהפרשת מספר גדול של פפטידים מלבד CCK, שלהם השפעה על צריכת האנרגיה, כגון פפטיד דמוי גלוקגון או GLP-1, פפטיד YY, ואינסולין. כמו גם על דיכוי של ghrelin (עפ"י Overduin וחב' ב-Endocrinology משנת 1995). סביר להניח שהאינטראקציות עם CCK, מחישות את ההשפעה המעכבת שלו על צריכת אנרגיה. לדוגמה, בחולדות ההשפעות המדכאות החריפות של הזרקת CCK אקסוגני על צריכת אנרגיה, מוחשות על ידי נוכחות של איתותים קצרי-טווח על צריכת מזון, הכוללים גלוקגון, GLP-1, ו-amylin, כמו גם איתותים ארוכי-טווח על צריכת מזון כמו אלה של אינסולין ו-leptin (עפ"י Matson וחב' ב-Am J Physiol Regul Integr Comp Physiol משנת 2000, וכן Riedy וחב' ב-Physiol Behav משנת 1995 ו-Bhavsar וחב' באותו כתב עת משנת 1998).
שלא בדומה ל-CCK, הריכוזים בפלזמה של פפטידים אחרים, כמו PYY המופרש מהמעי הדק הדיסטאלי, עולים בהדרגה משך 2-3 שעות לאחר הארוחה (Lin וחב' ב-Peptides משנת 2000). לכן, חשיפה מוגברת של המעי הדק למזון המעוכל, עם גירוי בו-זמני של פפטידים כ-PYY, יכול להאריך באופן פוטנציאלי את השפעת CCK על צריכת המזון. האינטראקציה של CCK עם איתותים ארוכי טווח על השמנה, כמו אלה של אינסולין ולפטין, נמצאה גם כן משפיעה על פעיליות שני פפטידים אלה על צריכת מזון ועל השמנה. לדוגמה, בחולדות ההשפעות האנורקסיות של החדרה תוך-צפקית של CCK-8 במינון של 4 מיליגרם לק"ג, הוחשו על ידי הזרקה של אינסולין (mU0.1) לתוך חדרי המוח קודם לארוחה. בדומה, החדרה יומיומית תוך-צפקית של CK-8, בשילוב עם הזרקה תוך-מוחית של לפטין, גרמה לאיבוד משקל גדול יותר מאשר הזרקה בלעדית של לפטין. תצפיות אלו הביאו להשערה שאינטראקציות של מספר פפטידים גסטרו-אנטראליים ואחרים תורמים לעיכוב של צריכת אנרגיה על ידי CCK.
גורם אחר שעשוי לתרום להשפעה של CCK אקסוגני על צריכת מזון, היא הבחילה שמופיעה לעתים קרובות בעת מתן תוך ורידי של CCK (עפ"י Greenough וחב' ב-Physiol Behav משנת 1998). לכן, ניתן להניח שעיכוב צריכת מזון בעירוי ורידי של CCK, גורמת לתחושת קבס בלתי-ספציפית. כתמיכה בהשערה זו, נמצא שעירוי ורידי של CCK, הגדיל בתלות במינון הפפטיד את הפרשתו של AVP או arginine vasopressin ממרכזי ההקאה במערכת העצבים המרכזית, וכן נמצא שחומרת הבחילה תלויה בריכוזי AVP (עפ"י Miaskiewics וחב' ב-J Clin Endocrinol Metabol משנת 1989). נראה אם כן שההפחתה בצריכת מזון על ידי מתן אקסוגני של CCK, מושפעת באופן מוחלט על יצירת השריית בחילה, אם כי מחקרים נוספים נדרשים להבהרת נקודה זו.
בנוסף, הפרשה של אצטילכולין על ידי סיבי עצב פארא-סימפתטיים של עצב ה-vagus, מעוודים אף הם הפרשת CCK. הנוכחות של חומצות שומן ו/או חומצות אמינו אחדות בתוך בליל המזון המעוכל בחלקו (chyme) הנכנס לתריסריון הוא הגריין הבולט ביותר של הפרשת CCK. כאשר דועכת רמת החומרים המעודדים הפרשת CCK, רמתו של הורמון זה קטנה בהתאם. הפרשת CCK מעוכבת גם על ידי somatostatin. טריפסין, האנזים הפרוטאוליטי המופררש על ידי תאים אצינארים בבלוטת הלבלב, גורם להידרוליזה של ה-CCK-releasing peptide, ובכך תורם את חלקו להפחתת ההפרשה של CCK.
כמו כן, CCK גורם לייצור מוגבר של מיץ מרה בכבד, ומעודד את כיווץ כיס המרה ולהרפיית ה-sphincter of Oddi, מה שמסייע למעבר המרה לתוך התריסריון, שם מלחי המרה יוצרים מיצלות אמפיפתיות לצורך תחלוב (emulsification) של שומנים במזון, וסיוע לעיכולם ולספיגתם במעי הדק.
נמצא ש-CCK יכול להגיב גם עם calcineurin בבלוטת הלבלב, כאשר תפקידו של האחרון הוא לשפעל את גורמי השעתוק NFAT 1-3 או Nuclear Factor activated T-cells , המגבירים בין השאר היפרטרופיה והגדלת הלבלב. CKK נמצא מגיב גם עם נוירונים אורקסוגנים.
שני תרשימים המדגימים את הפרשת CCK והשפעתה על איברי מערכת העיכול
הנוירוביולוגיה של CCK
נוכחות של CCK הודגמה גם בנוירונים האֲפרנטיים של עצב הוואגוס במעי, שם הוא משמש כנוירוטרנמיטר (Larsson ו-Rhefeld ב-Brain Res משנת 1979). ב-CNS נמצא CCK בריכוז גבוה בקליפת המוח (Rhefeld ב-J Biol Chem משנת 1978), אך גם בתלאמוס, בהיפותלאמוס ובגנגליונים הבזאליים ובחלק המוח האחורי (Moran ו-Kinzig ב-Am J Physiol Gastrointest Liver Physiol משנת 2004) שם הם משמשים כנוירוטרנסמיטרים (Crawley ו-Corwin משנת 1994 ב-Peptides). נמצא ש-CCK ממוקם בנוירונים המכילים דופאמין (Meyer ו-Protopapas ב-Ann NY Acad Sci משנת 1985), נוירונים המשפיעים על ה-limbic forebrain כמו גם על ההיפותלמוס הוֶנטרוֹ-מדיאלי שעשויים לתפקד בוויסות צריכת המזון והשובע (Kopin וחב' ב-J Clin Invest משנת 1999). הזרקת CCK לחדרי המוח השרתה שובע בחיות מעבדה.
כהורמון פפטידי, CCK מתווך ביצירת תחושת שובע תוך פעולתו על קולטנים המפוזרים באופן נרחב במערכת העצבים המרכזית. ל-CCK יש גם השפעה סטימולטרית על העצב התועה (vagus). השפעה הניתנת לעיכוב על ידי capsaicin. ההשפעה המעודדת האחרונה של CCK, מנוגדת לזו של ghrelin, שידוע כמעכב את העצב התועה. המקטע הטטרה-פפטידי של CCK, Trp-Met-Asp-Phe-NH2, גורם לתחושת דאגנות בהזרקתו לאדם, והוא משמש בעיקר במחקרים קליניים להשרות התקפי תבהלה (פאניקה) כדי לבחון תכשירים מדכאי-חרדה חדשים. CCK נמצא גם מגיב עם נוירונים המייצרים orexin, המפקחים על תחושות תיאבון ועוררות (wakefulness). ל-CCK יש גם השפעות בלתי ישירות על וויסות השינה, ואם כי מולקולת CCK אינה יכולה לעבור את מחסום דם-מוח (BBB), אך מספר חלקים של ההיפותלמוס ושל גזע המוח אינם מוגנים על ידי מחסום זה. על פי Crawley ו-Corwin בסקירתם משנת 1994 ב-Peptides, יש ל-CCK השפעה על כושר הלימוד והזיכרון, אם כי מנגנון השפעה זו אינו ברור.
מעורבות קלינית
רמות נמוכות במיוחד של CCK נמצאו במטופלים מאובחנים עם bulimia nervosa (Geracioti ו-Riddle ב-N Eng J Med משנת 1988), במחלת צליאק (Calam וחב' ב-J Clin Invest משנת 1982), וכן בתרחישים בהם יש עיכוב של התרוקנות הקיבה (Keel וחב' ב- Arch Gen Psychiatry משנת 2007).
פולימורפיזמים גנטיים בהם היה ביטוי מופחת של הקולטן של CCK1 בכיס המרה, דווחו במחלת כיס המרה (Srivastava וחב' ב- J Gastroenterol Hepatol משנת 2008, ו-Miller וחב' ב-Gastroenterology משנת 1995). ביטוי מופחת של הקולטן ל-CCK1 צפוי לפגוע ביכולת של CCK לעודד כיווץ כיס המרה, מה שיגרן לעימדון (stasis) של המרה, שהוא גורם קובע ביצירת אבני מרה.
פולימורפיזמים גנטיים נמצאו באזור ה-promoter של הקולטן ל- CCK1 במספר אנשים שמנים במיוחד (Miyasaka וחב' ב-Curr Top Med Chem משנת 2007). הועלתה סברה שפולימורפיזמים אלה משנים את האותות של CCK הקשורים לשובע, ובכך הם תורמים לבקרה בלתי תקינה של משקל הגוף, אך המכניזם המולקולארי של פולימופיזמים אלה עדיין לא הובהר. איבוד משקל כרוך ברמות של CCK בצירקולציה ושל הורמונים נוספים הקשורים לרגולציה הֶמוֹסטתית של משקל הגוף (Sumithran וחב' ב-N Eng J Med משנת 2011). יתכן שרמות נמוכות של CCK מעודדות עלייה במשקל לאחר תקופה של הפחתה במשקל.
שיקולים מעבדתיים לגבי השיטה למדידת CCK
מדידות בעבר של CCK היו מבוססות על היכולת של דם או מיצוי מהדם לעודד כיווץ של כיס המרה או הפרשה אקסוקרינית של הלבלב. מבחנים ביולוגיים אלה בוצעו בכלבים, חזירים או במכרסמים. השימושיות של מבחנים אלה הייתה מוגבלת שכן השיטות היו מסורבלות, ופירוש התוצאות היה מסובך על ידי בעיות של השפעת הורמונים אחרים או בגלל השפעות עצביות. הכנסת שיטת RIA הביאה למדידה ישירה של רמת הורמונים, אם כי ה-RIA של CCK היה מורכב במיוחד ממספר סיבות:
ראשית, מציאות של מגוון צורות מולקולאריות של CCK החל מ-CCK-4 ועד CCK-83, מופיעות בדם, ואם כי נראה שצורת CCK-58 היא הצורה הדומיננטית של הורמון זה, צורות אחרות יכולות לתרום לפעילות ההורמון.
שנית, CCK דומה במבנהו ל-gastrin, כאשר לשניהם יש פנטפפטיד זהה בקצה ה-C טרמינאלי. לכן, כדי להימנע מ-Cross-reativity, השיטה חייבת להיות מסוגלת לזהות את אותם אפיטופים ב-CCK השונים מאלה שמוצאים בגסטרין.
שלישית, CCK עובר צירקולציה בדם בריכוזים נמוכים בהרבה (פי 10-100) בהשוואה לגסטרין.
רביעית, צורות מולקולאריות גדולות של CCK (דוגמת CCK-58) שעשויות לשמש כסטנדרט בבדיקות אלו, אינן זמינות בשגרת המעבדה.
חמישית, סימון איזוטופי של CCK מסובך לביצוע.
ששית, ל-CCK יש חומצות אמינו שעברו מודיפיקציה posttranslational, כגון sulfated tyrosine החשובים לפעילות ההורמון. ידוע שכדי שפעילות ההורמון תהיה מלאה, צריכה להתרחש סולפציה בשייר הנמצא בעמדה 7 מהקצה ה-C טרמינאלי, וש-methionine בעמדה 3 יישאר במצבו המחוזר.
נראה אם כן שמגוון הבעיות הפוטנציאליות המוזכרות, הביא לדחייה בפיתוח של שיטה הדירה, רגישה וספציפית של RIA למדידת CCK.
שיטות אמינות למדידת CCK חייבות להיות מסוגלות לזיהוי ההורמון בריכוזים נמוכים, ולהיות מסוגלות להבדיל בינו לבין גסטרין. משמעות תנאי זה הוא שבבדיקת RIA נוגדנים חייבים לזהות את שלושת חומצות האמינו המשותפות לכל צורות CCK (דהיינו CCK-8 וגדולות ממנו) אך שאינן נמצאות בגסטרין. על מנת למדוד CCK פעיל ביולוגית, הנוגדנים צריכים גם להבדיל בין CCK שעבר סולפציה לבין CCK שלא עבר סולפציה. לבסוף, ההכנה של CCK מסומן רדיואקטיבית חייבת להתבצע בתנאים לא חריפים, שעלולים לחמצן את המולקולה. על מנת להימנע מהמכשולים הכרוכים במבדק RIA של CCK, פותח bio-assay רגיש וספציפי של CCK תוך שימוש בפרפרט שהוכן מתאים אצינריים בלבלב. מבדק זה התאפשר בגלל הרגישות של קולטן CCK1 הנמצא בתאי לבלב אלה במכרסמים, והזיקה הגבוהה בין קולטן זה לבין CCK בהשוואה לגסטרין.
הוראות לביצוע הבדיקה
הנבדק צריך להיות בצום של 10-12 שעות לפני נטילת הדם. אם הדבר אפשרי, ב-48 השעות לפני נטילת הדם יש להפסיק שימוש בתרופות antacid ובתכשירים משלשלים או כאלה האמורים להשפיע על תנועתיות המעיים. את הדם יש ליטול במבחנת ספירת-דם (EDTA, פקק סגלגל הכוללת חומר משמר). יש לסרכז מיידית, ולהקפיא את הפלזמה ללא שיהוי. יש להדגיש את חשיבות המבחנות מסוג G.I. preservative לאיסוף הדם לצורך בדיקה זו. יש לשלוח את הדם למעבדה רק כפלזמה קפואה. הדגימה יציבה למשך 6 חודשים כדם קפוא, ואין לקבל דגימות בטמפרטורת החדר או מקוררות. שיטת המדידה על ידי radioimmunoassay.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - מפגעים הורמונאליים
- בדיקות מעבדה - סטטוס תזונתי
- בדיקות מעבדה - תפקודי כבד ודרכי מרה
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק