הבדלים בין גרסאות בדף "תסמונת רעד ואטקסיה הקשורים לאיקס שביר - Fragile x associated tremor and ataxia syndrome"
| שורה 32: | שורה 32: | ||
על-אף שמספר החזרות המוגדר כפרה-מוטציה הוא 200-55 התסמונת נדירה ביותר בנשאים עם מספר חזרות נמוך מ-70 בשל חדירות פחותה. מספר החזרות הנמוך ביותר שתואר בתסמונת הוא 47{{כ}}{{הערה|שם=הערה8|Hall D, Tassone F, Klepitskaya O et al. Mov Disord, 2012; 27,296.}} אך כאמור, זהו מקרה נדיר. | על-אף שמספר החזרות המוגדר כפרה-מוטציה הוא 200-55 התסמונת נדירה ביותר בנשאים עם מספר חזרות נמוך מ-70 בשל חדירות פחותה. מספר החזרות הנמוך ביותר שתואר בתסמונת הוא 47{{כ}}{{הערה|שם=הערה8|Hall D, Tassone F, Klepitskaya O et al. Mov Disord, 2012; 27,296.}} אך כאמור, זהו מקרה נדיר. | ||
| + | |||
| + | ===מנגנון המחלה=== | ||
| + | |||
| + | מוטציה בגן FMR1 מובילה לשתי תסמונות נוירולוגיות שונות באופיין. כאשר מספר חזרות CGGS עולה על 200 ישנה השתקה, חלקית או מלאה, של הגן ברמת שיעתוק mRNAs וכתוצאה מכך רמת החלבון ירודה{{הערה|שם=הערה12|Hagerman PJ and Hagerman RJ. Am J Hum Genet; 2004; 74,805.}}. לעומת זאת, כאשר מספר החזרות הוא בתחום הפרה-מוטציה אין השתקה של הגן, רמת החלבון תקינה או מופחתת קלות, ולעומת זאת השיעתוק מוגבר ורמת ה-mRNA גבוהה מהנורמה. התיאוריה הרווחת כיום היא שהנזק התאי נגרם כתוצאה מרמות גבוהות של RNAS המצטבר בתא. מנגנון דומה הוצע עבור דיסטרופיה מיוטונית. | ||
| + | |||
| + | בבדיקות פתולוגיות לאחר המוות מוצאים אטרופיה כללית וגופיפים אאוזינופילים בתוך גרעיני הנוירונים והאסטרוציטים באזורי מוח רבים, בעיקר בהיפוקמפוס ובאונות המצח (frontal lobes){{כ}}{{הערה|שם=הערה13|Greco CM, Hagerman RJ, Tassone F et al. Brain 2002; 125,1760.}}. גופיפים אלה אינם מכילים alpha-synuclein או tau אך נצבעים בנוגדנים ל-ubiquitin. | ||
===חדירות המוטציה=== | ===חדירות המוטציה=== | ||
| שורה 59: | שורה 65: | ||
* כל המטופלים דיווחו גם על [[אין אונות]] שהעידה על מעורבות המערכת האוטונומית | * כל המטופלים דיווחו גם על [[אין אונות]] שהעידה על מעורבות המערכת האוטונומית | ||
| − | + | ==אבחנה== | |
| − | |||
| − | |||
| − | |||
| + | ===אבחנה קלינית=== | ||
על סמך הממצאים הקליניים והרדיולוגיים בחולים שזיהויים התבסס על בדיקה מולקולרית בבני משפחה של הלוקים בפיגור שכלי על רקע תסמונת X שביר ולאחר הרחבת הסדרה ל-26 מקרים, כולם גברים, גובשו קריטריונים לאבחנת FXTAS בדרגות ודאות שונות{{הערה|שם=הערה3|Jacquemont S, Hagerman RJ, Leehey M et al. Am J Hum Genet, 2003; 72,869.}}, המפורטים בטבלה{{הערה|שם=הערה1}}. חשוב לציין כי בכל דרגות הוודאות נדרש האבחון המולקולרי של מספר החזרות בתחום הפרה-מוטציה (בין 200-55 חזרות). | על סמך הממצאים הקליניים והרדיולוגיים בחולים שזיהויים התבסס על בדיקה מולקולרית בבני משפחה של הלוקים בפיגור שכלי על רקע תסמונת X שביר ולאחר הרחבת הסדרה ל-26 מקרים, כולם גברים, גובשו קריטריונים לאבחנת FXTAS בדרגות ודאות שונות{{הערה|שם=הערה3|Jacquemont S, Hagerman RJ, Leehey M et al. Am J Hum Genet, 2003; 72,869.}}, המפורטים בטבלה{{הערה|שם=הערה1}}. חשוב לציין כי בכל דרגות הוודאות נדרש האבחון המולקולרי של מספר החזרות בתחום הפרה-מוטציה (בין 200-55 חזרות). | ||
| שורה 102: | שורה 106: | ||
מאז פרסום הקריטריונים הנ"ל הצטברו נתונים חדשים המעידים על מגוון אפידמיולוגי וקליני רחב יותר מזה שתואר קודם. סדרה של 22 מטופלים שפורסמה לאחרונה{{הערה|שם=הערה4|Apartis E, Blancher A, Meissner WG et al. Neurology, 2012 ;79,1898.}} מלמדת כי 18% מהמאובחנים ב-FXTAS הן נשים וכי רק ל-57% מהמטופלים הייתה היסטוריה משפחתית של פיגור שכלי. גיל הופעת הסימנים הנוירולוגים בחלק מהמטופלים היה פחות מ-50 (טווח 69-35 שנים), לרבע מהם לא היה רעד אופייני בזמן תנועה וכעשירית מהם לא סבלו מאטקסיה. בנוסף, נוירופתיה תחושתית דווחה כממצא שכיח והודגמה בבדיקת הולכה עצבית ב-81%, אם כי רק ב-10% מהמקרים הייתה ארפלקסיה כללית בבדיקה. ב-MRI הודגמו אזורים בעלי עוצמת יתר ב-MCP רק ב-64% מהמטופלים, כולם גברים, וב-50% נמצאו בבדיקת DaTscAN המדגימה את צפיפות הטרנספורטר לדופאמין בסטריאטום שינויים המבטאים ניוון אקסונים דופאמינרגים. | מאז פרסום הקריטריונים הנ"ל הצטברו נתונים חדשים המעידים על מגוון אפידמיולוגי וקליני רחב יותר מזה שתואר קודם. סדרה של 22 מטופלים שפורסמה לאחרונה{{הערה|שם=הערה4|Apartis E, Blancher A, Meissner WG et al. Neurology, 2012 ;79,1898.}} מלמדת כי 18% מהמאובחנים ב-FXTAS הן נשים וכי רק ל-57% מהמטופלים הייתה היסטוריה משפחתית של פיגור שכלי. גיל הופעת הסימנים הנוירולוגים בחלק מהמטופלים היה פחות מ-50 (טווח 69-35 שנים), לרבע מהם לא היה רעד אופייני בזמן תנועה וכעשירית מהם לא סבלו מאטקסיה. בנוסף, נוירופתיה תחושתית דווחה כממצא שכיח והודגמה בבדיקת הולכה עצבית ב-81%, אם כי רק ב-10% מהמקרים הייתה ארפלקסיה כללית בבדיקה. ב-MRI הודגמו אזורים בעלי עוצמת יתר ב-MCP רק ב-64% מהמטופלים, כולם גברים, וב-50% נמצאו בבדיקת DaTscAN המדגימה את צפיפות הטרנספורטר לדופאמין בסטריאטום שינויים המבטאים ניוון אקסונים דופאמינרגים. | ||
| + | ===ממצאים הדמייתיים=== | ||
| − | + | הממצאים האופייניים בהדמית תהודה מגנטית (MRI) פורסמו מאוחר יותר ע"י אותה קבוצה{{הערה|שם=הערה2|Brunberg JA, Jacquemont S, Hagerman RJ et al. AJNR, 2002; 23,1757.}} וכללו את את הממצאים הבאים: | |
| − | + | * אות בעל עוצמת יתר (Hyperintense) ב-T2 ב-MCP {{כ}}(Middle Cerebellar Peduncle), שהוא הסימן ההדמייתי המזוהה ביותר עם FXTAS | |
| − | + | * ברוב המקרים הודגמו גם אזורים בעלי עוצמת יתר ב-T2 סביב חדרי המוח וכן אזורים פחותי-עוצמה (hypointense) {{כ}} ב-T1 בגרעינים העמוקים של הצרבלום. | |
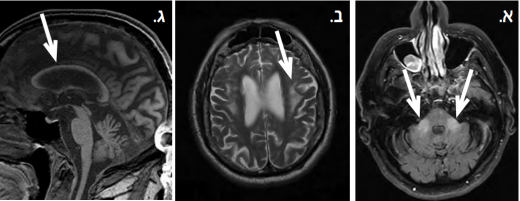
| − | + | * ממצאים חשובים נוספים היו אטרופיה כללית של קליפת המוח וכן של הצרבלום וה-pons עם הרחבת חדרים משנית והידקקות של הקורפוס קלוסום (תמונה מסי 1). | |
| − | |||
| − | |||
| − | |||
[[קובץ:FXTAS.png|ממוזער|מרכז|520 פיקסלים|תמונה 1. ממצאים ב-MRI בתסמונת FXTAS{{ש}}א. אות בעל עוצמת יתר בסדרת FLAIR מודגם ב-MCP{{ש}}ב. אזורים של אות בעוצמת יתר בחומר הלבן מסביב לחדרים מודגמים בסדרת T2{{ש}}ג. אטרופיה כללית של הקורפוס קולוסום בסדרת T1{{ש}}התמונות באדיבות פרופ׳ ניר גלעדי, המרכז הרפואי ת"א]] | [[קובץ:FXTAS.png|ממוזער|מרכז|520 פיקסלים|תמונה 1. ממצאים ב-MRI בתסמונת FXTAS{{ש}}א. אות בעל עוצמת יתר בסדרת FLAIR מודגם ב-MCP{{ש}}ב. אזורים של אות בעוצמת יתר בחומר הלבן מסביב לחדרים מודגמים בסדרת T2{{ש}}ג. אטרופיה כללית של הקורפוס קולוסום בסדרת T1{{ש}}התמונות באדיבות פרופ׳ ניר גלעדי, המרכז הרפואי ת"א]] | ||
| + | ===בדיקות סקר גנטיות=== | ||
בנוסף לאבחנת המחלה בחולה מוגדר, לאבחון תסמונת ה-FXTAS יש חשיבות משפחתית. לפני ביצוע הבדיקה המולקולרית נדרש יעוץ גנטי פורמאלי הכולל התייחסות להשלכות משפחתיות רחבות. יעוץ מרפאת פוריות נדרש לנשים נשאיות בשל האפשרות לכשל שחלתי מוקדם ולטיפולים כגון הקפאת ביציות או עוברים. ההמלצות של הקונסורציום האמריקני ל-FXTAS קוראות לביצוע בדיקות גנטיות לאוכלוסיות הבאות{{הערה|שם=הערה14|www.fxtas.org}}: | בנוסף לאבחנת המחלה בחולה מוגדר, לאבחון תסמונת ה-FXTAS יש חשיבות משפחתית. לפני ביצוע הבדיקה המולקולרית נדרש יעוץ גנטי פורמאלי הכולל התייחסות להשלכות משפחתיות רחבות. יעוץ מרפאת פוריות נדרש לנשים נשאיות בשל האפשרות לכשל שחלתי מוקדם ולטיפולים כגון הקפאת ביציות או עוברים. ההמלצות של הקונסורציום האמריקני ל-FXTAS קוראות לביצוע בדיקות גנטיות לאוכלוסיות הבאות{{הערה|שם=הערה14|www.fxtas.org}}: | ||
| שורה 119: | שורה 122: | ||
#מטופלים עם תסמונת נוירולוגית ואזורי צפיפות יתר ב-MCP בהדמיה מגנטית או היסטוריה משפחתית כגון בעיות פוריות, כשל שחלתי מוקדם (פחות מגיל 40) או בעיות נוירולוגיות העשויות לרמוז על מוטציה ב-FMR1. | #מטופלים עם תסמונת נוירולוגית ואזורי צפיפות יתר ב-MCP בהדמיה מגנטית או היסטוריה משפחתית כגון בעיות פוריות, כשל שחלתי מוקדם (פחות מגיל 40) או בעיות נוירולוגיות העשויות לרמוז על מוטציה ב-FMR1. | ||
#מטופלים עם הצורה הצרבלארית של Multiple System Atrophy. יש לציין כי המלצות אלו כוללות מטופלים ומטופלות כאחד משום שכפי שצויין לעיל, בשעה שחדירות הגן ככל הנראה מופחתת בנשים הרי ששכיחות המוטציה המוקדמת גבוהה יותר. למטופלים המאובחנים אין כיום טיפול המכוון לתסמונת אך ככל הנראה סימנים פרקינסונים ישתפרו בחלק מהמטופלים עם מתן תכשירים דופאמינרגיים ורעד בזמן תנועה עשוי להשתפר חלקית תחת טיפול מקובל - חוסי ביתא או פרימידון. | #מטופלים עם הצורה הצרבלארית של Multiple System Atrophy. יש לציין כי המלצות אלו כוללות מטופלים ומטופלות כאחד משום שכפי שצויין לעיל, בשעה שחדירות הגן ככל הנראה מופחתת בנשים הרי ששכיחות המוטציה המוקדמת גבוהה יותר. למטופלים המאובחנים אין כיום טיפול המכוון לתסמונת אך ככל הנראה סימנים פרקינסונים ישתפרו בחלק מהמטופלים עם מתן תכשירים דופאמינרגיים ורעד בזמן תנועה עשוי להשתפר חלקית תחת טיפול מקובל - חוסי ביתא או פרימידון. | ||
| + | |||
| + | ==פתוגניזה ופתולוגיה== | ||
| + | |||
| + | |||
| + | |||
| + | ==טיפול== | ||
| + | |||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
גרסה מ־23:28, 30 בדצמבר 2014
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונת רעד ואטקסיה הקשורים לאיקס שביר | ||
|---|---|---|
| Fragile x associated tremor and ataxia syndrome | ||
| יוצר הערך | ד"ר דוד ארקדיר, ד"ר פנינה פונגר, ד"ר ישראלה לרר ופרופ׳ אלכסנדר לוסוס | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תסמונת האיקס השביר
תסמונת רעד ואטקסיה הקשורים לאיקס שביר FXTAS (Fragile X Associated Tremor and Ataxia Syndrome) היא תסמונת גנטית הקיימת בבני משפחה של חולים הסובלים מתסמונת X שביר. התסמונת מלווה בהידרדרות עצבית נרחבת שמתרחשת בגיל הבוגר והיא תוצאה של "קדם-מוטציה" בגן Fragile X Mental Retardation 1ׁ)-FMR1).
אפידמיולוגיה
שכיחות הקדם-מוטציה באוכלוסיה הכללית היא 1:813 בגברים[1] ו-1:259 בנשים[2] אך נצפו הבדלים בשכיחויות באוכלוסיות שונות. בסקר באוכלוסיה שבוצע בנשים בגיל הפריון בארץ נמצאה שכיחות של עד 1:113,[3] שכיחות הגבוהה מזו שתוארה בצפון אמריקה.
אטיולוגיה
תסמונת X שביר ו-FXTAS נובעות מהרחבה של מספר החזרות ברצף הבסיסים CGG)n) המצוי באקסון הראשון של הגן Fragile X Mental Retardation 1ׁ)-FMR1). מספר החזרות CGG)n) מחלק את האנשים לשלוש קבוצות:
- מספר חזרות 58-5, נמצא באנשים בריאים. רוב המקרים קיימת יציבות של מספר החזרות
- מספר חזרות 200-58 נמצא בחולים בתסמונת FXTAS ההרחבה נקראת קדם-מוטציה (Premutation)
- מספר חזרות מעל 200 נמצא בחולים בתסמונת X השביר, המוטציה נקראת מוטציה מלאה
בתחום הפרה-מוטציה קיימת אי יציבות במספר החזרות, במיוחד בהעברה בין-דורית. בזכרים קיים שינוי במספר החזרות אך אין מעבר מפרה-מוטציה למוטציה מלאה ואילו בנקבות עם פרה-מוטציה יש סיכון להרחבה לטווח של המוטציה המלאה.
שכיחות הפרה-מוטציה עולה כאשר נבדקות קבוצות של חולים עם הסתמנויות נוירולוגיות הדומות ל-FXTAS. לדוגמא, בבדיקת 76 חולים עם הצורה הצרבלארית של Multiple System Atrophy נמצאו 3 מטופלים עם המוטציה[4]. התקדמות המחלה במטופלים אלה הייתה איטית יחסית למטופלים אחרים עם Multiple System Atrophy ובכולם הודגמה מעורבות אוטונומית (הפרעה במתן שתן או צניחת ערכי לחץ הדם בעמידה). שכיחות המוטציה במטופלים עם הצורה הפרקינסונית של Multiple System Atrophy הייתה נמוכה בהרבה ונמצאה במטופל בודד מתוך 147 מטופלים. במטא-אנליזה אכן הודגמה שכיחות מוטציה זניחה במטופלים עם תסמונות פרקינסונית אטיפית, מחלת פרקינסון אידיופתית ורעד ראשוני אך השכיחות בבני 50 ומעלה עם תסמונת צרבלארית אידיופטית עשויה להגיע ל-2%.[5]
על-אף שמספר החזרות המוגדר כפרה-מוטציה הוא 200-55 התסמונת נדירה ביותר בנשאים עם מספר חזרות נמוך מ-70 בשל חדירות פחותה. מספר החזרות הנמוך ביותר שתואר בתסמונת הוא 47[6] אך כאמור, זהו מקרה נדיר.
מנגנון המחלה
מוטציה בגן FMR1 מובילה לשתי תסמונות נוירולוגיות שונות באופיין. כאשר מספר חזרות CGGS עולה על 200 ישנה השתקה, חלקית או מלאה, של הגן ברמת שיעתוק mRNAs וכתוצאה מכך רמת החלבון ירודה[7]. לעומת זאת, כאשר מספר החזרות הוא בתחום הפרה-מוטציה אין השתקה של הגן, רמת החלבון תקינה או מופחתת קלות, ולעומת זאת השיעתוק מוגבר ורמת ה-mRNA גבוהה מהנורמה. התיאוריה הרווחת כיום היא שהנזק התאי נגרם כתוצאה מרמות גבוהות של RNAS המצטבר בתא. מנגנון דומה הוצע עבור דיסטרופיה מיוטונית.
בבדיקות פתולוגיות לאחר המוות מוצאים אטרופיה כללית וגופיפים אאוזינופילים בתוך גרעיני הנוירונים והאסטרוציטים באזורי מוח רבים, בעיקר בהיפוקמפוס ובאונות המצח (frontal lobes)[8]. גופיפים אלה אינם מכילים alpha-synuclein או tau אך נצבעים בנוגדנים ל-ubiquitin.
חדירות המוטציה
חדירות המוטציה בגברים היא כ-17% בעשור השישי לחיים (גילאי 50-59) אך מטפסת ועולה בהדרגה עד 75% בגברים מעל גיל 80, אם כי ערך זה מבוסס על מספר נמוך של נבדקים[9]. סה"כ חדירות המוטציה בגברים מעל גיל 50 קרובה ל-30%. נתוני חדירות המוטציה בנשים מוגבלים אך ככל הנראה החדירות נמוכה מזו שבגברים ועומדת על פחות מ-20%. יחד עם זאת, בשל שכיחותה הגבוהה יותר של המוטציה בנשים ותוחלת חיים גבוהה יותר, יתכן כי כמחצית הסובלים מהתסמונת הן נשים. שכיחותה הכוללת של התסמונת מוערכת בכ-1 מתוך 9,000-3,000 גברים[5].
קליניקה
עבודה שנעשתה לאיתור תסמיני המחלה
עבודה שנעשתה בשנת 2001 ניסתה לחקור את התסמונת. בעבודה נבדקו חמישה גברים, סבים לנכדים זכרים עם פיגור שכלי על רקע תסמונת X שביר[10]. החמישה סבלו מהידרדרות עצבית מתקדמת שהחלה בשנות החמישים לחייהם והתבטאה בעיקר בתסמינים הבאים סימנים נוירולוגים אחרים בדרגות חומרה שונות המעידים על מעורבות עצבית מפושטת יותר:
- תסמינים של המוח הקטן:
- אטקסיה, ברמות חומרה שונות, החל מקושי בהליכת עקב-בצד-אגודל בלבד וכלה בחוסר יכולת ללכת
- רעד- הרעד היה בעיקרו רעד בעת פעולה (Action tremor) ובדומה לרעד צרבלארי התגבר בסופה של תנועה מכוונת (Intention tremor). הרעד שתדירותו האופיינית 6-4 הרץ החל באופן חד צידי אך התפשט והתקדם בחומרתו
- סימנים פרקינסוניים (שלעתים אף הגיבו לטיפול בלבודופא) כללו:
- רעד בזמן מנוחה
- מיעוט הבעות פנים
- איטיות תנועה
- טונוס נוקשה
- סימני נוירופתיה היקפית (בעיקר תחושתית) כללו:
- הפחתה בעוצמת החזרים גידיים או העדרם
- ירידה בתחושת רטט
- הפרעות נפשיות כדיכאון וחרדה
- ירידה קוגניטיבית, בעיקר בתפקודים ניהוליים (Executive functions), שהחמירה עד כדי שיטיון (Dementia) בחלק מהמטופלים בשלבי מחלה מתקדמים
- כל המטופלים דיווחו גם על אין אונות שהעידה על מעורבות המערכת האוטונומית
אבחנה
אבחנה קלינית
על סמך הממצאים הקליניים והרדיולוגיים בחולים שזיהויים התבסס על בדיקה מולקולרית בבני משפחה של הלוקים בפיגור שכלי על רקע תסמונת X שביר ולאחר הרחבת הסדרה ל-26 מקרים, כולם גברים, גובשו קריטריונים לאבחנת FXTAS בדרגות ודאות שונות[11], המפורטים בטבלה[10]. חשוב לציין כי בכל דרגות הוודאות נדרש האבחון המולקולרי של מספר החזרות בתחום הפרה-מוטציה (בין 200-55 חזרות).
| קריטריונים עיקריים | קריטריונים משניים | |
| קליניים |
|
|
| הדמיתיים |
|
|
ממצאים קליניים חשובים נוספים העשויים לכוון לאבחנה של FXTAS כוללים
- הפרעות אוטונומיות:
- הפרעת סוגרים
- אורטוסטטיזם
- נוירופתיה היקפית
כשל שחלתי מוקדם (גיל הפסקת המחזור החודשי נמוך מ-40) זוהה ב-20% מהנשים הנשאיות של המוטציה המוקדמת ואינו קשור בהכרח להתפתחות תסמונת נוירולוגית בגיל מבוגר יותר, אם כי הנושא לא נחקר לעומקו בכלים אפידמיולוגיים. יחד עם זאת, כשל שחלתי עשוי לכוון לאבחנת FXTAS בבן משפחה עם תסמונת נוירולוגית מתאימה.
מאז פרסום הקריטריונים הנ"ל הצטברו נתונים חדשים המעידים על מגוון אפידמיולוגי וקליני רחב יותר מזה שתואר קודם. סדרה של 22 מטופלים שפורסמה לאחרונה[12] מלמדת כי 18% מהמאובחנים ב-FXTAS הן נשים וכי רק ל-57% מהמטופלים הייתה היסטוריה משפחתית של פיגור שכלי. גיל הופעת הסימנים הנוירולוגים בחלק מהמטופלים היה פחות מ-50 (טווח 69-35 שנים), לרבע מהם לא היה רעד אופייני בזמן תנועה וכעשירית מהם לא סבלו מאטקסיה. בנוסף, נוירופתיה תחושתית דווחה כממצא שכיח והודגמה בבדיקת הולכה עצבית ב-81%, אם כי רק ב-10% מהמקרים הייתה ארפלקסיה כללית בבדיקה. ב-MRI הודגמו אזורים בעלי עוצמת יתר ב-MCP רק ב-64% מהמטופלים, כולם גברים, וב-50% נמצאו בבדיקת DaTscAN המדגימה את צפיפות הטרנספורטר לדופאמין בסטריאטום שינויים המבטאים ניוון אקסונים דופאמינרגים.
ממצאים הדמייתיים
הממצאים האופייניים בהדמית תהודה מגנטית (MRI) פורסמו מאוחר יותר ע"י אותה קבוצה[13] וכללו את את הממצאים הבאים:
- אות בעל עוצמת יתר (Hyperintense) ב-T2 ב-MCP (Middle Cerebellar Peduncle), שהוא הסימן ההדמייתי המזוהה ביותר עם FXTAS
- ברוב המקרים הודגמו גם אזורים בעלי עוצמת יתר ב-T2 סביב חדרי המוח וכן אזורים פחותי-עוצמה (hypointense) ב-T1 בגרעינים העמוקים של הצרבלום.
- ממצאים חשובים נוספים היו אטרופיה כללית של קליפת המוח וכן של הצרבלום וה-pons עם הרחבת חדרים משנית והידקקות של הקורפוס קלוסום (תמונה מסי 1).
בדיקות סקר גנטיות
בנוסף לאבחנת המחלה בחולה מוגדר, לאבחון תסמונת ה-FXTAS יש חשיבות משפחתית. לפני ביצוע הבדיקה המולקולרית נדרש יעוץ גנטי פורמאלי הכולל התייחסות להשלכות משפחתיות רחבות. יעוץ מרפאת פוריות נדרש לנשים נשאיות בשל האפשרות לכשל שחלתי מוקדם ולטיפולים כגון הקפאת ביציות או עוברים. ההמלצות של הקונסורציום האמריקני ל-FXTAS קוראות לביצוע בדיקות גנטיות לאוכלוסיות הבאות[14]:
- מטופלים עם אטקסיה צרבלארית אידיופתית בני 50 ומעלה.
- מטופלים בני 50 ומעלה עם רעד בזמן תנועה בשילוב אטקסיה צרבלארית, פרקינסוניזם או דמנציה.
- מטופלים עם תסמונת נוירולוגית ואזורי צפיפות יתר ב-MCP בהדמיה מגנטית או היסטוריה משפחתית כגון בעיות פוריות, כשל שחלתי מוקדם (פחות מגיל 40) או בעיות נוירולוגיות העשויות לרמוז על מוטציה ב-FMR1.
- מטופלים עם הצורה הצרבלארית של Multiple System Atrophy. יש לציין כי המלצות אלו כוללות מטופלים ומטופלות כאחד משום שכפי שצויין לעיל, בשעה שחדירות הגן ככל הנראה מופחתת בנשים הרי ששכיחות המוטציה המוקדמת גבוהה יותר. למטופלים המאובחנים אין כיום טיפול המכוון לתסמונת אך ככל הנראה סימנים פרקינסונים ישתפרו בחלק מהמטופלים עם מתן תכשירים דופאמינרגיים ורעד בזמן תנועה עשוי להשתפר חלקית תחת טיפול מקובל - חוסי ביתא או פרימידון.
פתוגניזה ופתולוגיה
טיפול
ביבליוגרפיה
- ↑ Dombrowski C, Levesque S, Morel ML et al. Hum Mol Genet, 2002; 11,371.
- ↑ Rousseau F, Rouillard P, Morel ML et al. Am J Hum Genet, 1995; 57,1006.
- ↑ Berkenstadt M, Ries-Levavi L, Cuckle H, et al. Prenat Diagn, 2007; 27,991.
- ↑ Kamm C, Healy DG, Quinn NP et al. Brain, 2005; 128,1855.
- ↑ 5.0 5.1 Jacquemont S, Leehey M, Hagerman RJ et al. J Med Genet,2006: 43,804.
- ↑ Hall D, Tassone F, Klepitskaya O et al. Mov Disord, 2012; 27,296.
- ↑ Hagerman PJ and Hagerman RJ. Am J Hum Genet; 2004; 74,805.
- ↑ Greco CM, Hagerman RJ, Tassone F et al. Brain 2002; 125,1760.
- ↑ Jacquemont S, Randi J, Hagerman RJ et al. JAMA; 2004; 291,460.
- ↑ 10.0 10.1 Hagerman RJ, Leehey M, Heinrichs W et al. Neurology, 2001; 57,127.
- ↑ Jacquemont S, Hagerman RJ, Leehey M et al. Am J Hum Genet, 2003; 72,869.
- ↑ Apartis E, Blancher A, Meissner WG et al. Neurology, 2012 ;79,1898.
- ↑ Brunberg JA, Jacquemont S, Hagerman RJ et al. AJNR, 2002; 23,1757.
- ↑ www.fxtas.org
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר דוד ארקדיר, ד"ר פנינה פונגר, ד"ר ישראלה לרר ופרופ׳ אלכסנדר לוסוס, המחלקה לנוירולוגיה, המרכז הרפואי אוניברסיטאי הדסה עין כרם, ירושלים
דוד ארקדיר שוהה כעת בהתמחות עמיתים בהפרעות תנועה בתמיכת Parkinson's disease foundation באוניברסיטת קולומביה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק