הבדלים בין גרסאות בדף "Low-density lipoprotein receptor-related protein 4"
| שורה 44: | שורה 44: | ||
==נוכחות נוגדנים כנגד LRP-4 ו-MuSK ב-MG== | ==נוכחות נוגדנים כנגד LRP-4 ו-MuSK ב-MG== | ||
| + | בערך ב-10% של המטופלים עם MG לא ניתן למצוא נוגדנים כנגד MuSK או כנגד AChR בשיטות השגרתיות ( Vincentוחב' ב- Annals of NY Academy of Sciences משנת 2008). עד 66% ממטופלים אלה מכילים בדמם נוגדנים בזיקה נמוכה כנגד AChR, שניתן לגלותם רק בשיטה תאית תוך שימוש בתאי HEK שעברו טרנספקציה עם תת-יחידות של AChR אנושי, על מנת להשרות קיבוץ של קולטנים אלה על פני תאיר השריר (Leite וחב' ב- Brain משנת 2008). ההופעה וההתפתחות של המחלה באלה שם שליליים לנוכחות נוגדנים מאוד דומה למאפייני המחלה באלה שם חיוביים מבחינת נוכחות נוגדנים כנגד AChR וכנגד MuSK אם כי ישנם הבדלים זעירים בגל בו מופיעה המחלה, במעורבות של התימוס, ובמהות השרירים בהם מופיעה החולשה (Leite וחב' ב- Annals in Neurologyמשנת 2005, ו-Romi וחב' ב-Lancet משנת 2005). | ||
גרסה מ־06:35, 4 באוקטובר 2019
| מדריך בדיקות מעבדה | |
| Low-density lipoprotein receptor-related protein 4 | |
|---|---|
| שמות אחרים | LRP4; multiple epidermal growth factor-like domains 7 (MEGF7) |
| מעבדה | כימיה בדם ובנוזל השדרה |
| תחום | זיהוי נוגדנים כנגד LRP-4 במקרי חשד ל-myasthenia gravis. |
| טווח ערכים תקין | טיטר שלילי של נוגדנים כנגד LRP-4. |
| יוצר הערך | פרופ' בן-עמי סלע |
מיאסטניה גראביס
ב-myasthenia gravis (להלן MG) נוגדנים עצמיים פתוגניים מכוונים כנגד חלבוני-יעד חוץ-ממברנליים בתר-סינפטיים בצומת עצב-שריר. כאשר נוגדנים אלה תוקפים נפגע מעבר האיתות בין העצב לשריר, שהוא נקודת הציון הקלינית של המחלה, המתבטאת בחולשת שרירים.
זוהו שלושה נוגדנים פתוגניים: האחד כנגד הקולטן לאצטילכולין (AChR), השני כנגד האנזים קינאז הספציפי כנגד שריר (MuSK), והשלישי כנגד LRP-4 (low-density lipoprotein-related protein (Zisimopoulou וחב' ב-Autoimmunity Review משנת 2013, ו-Meriggioli ו-Sanders ב-Expert Review in Clinical Immunology משנת 2012). נוגדנים כנגד החלבון agrin המופרש מתאי עצב התגלו בחולי MG (Zhang וחב' ב-PLos One משנת 2014, Gasperi וחב' ב-Neurology משנת 2014). למרות שהנוגדנים כנגד agrin נמצאו מפחיתים צברים של AChR ב-myotubes, הם לא הוכחו כפתוגנים במודלים של חיות (Drachman ו-Kaminski ב-Neurology משנת 2014).
Myasthenia gravis היא מפגע אוטו-אימוני המאופיין על ידי ptosis חולשת שרירים כללית, כתוצאה מפגם בהעברת איתות בסינפסה בצומת עצב-שריר (Romi וחב' ב-Acta Neurol Scand משנת 2006, Newsom-Davis ב- Acta Myologia משנת 2007, ו-Farrugia ו-Vincent ב-Curr Opin Neurol משנת 2010). בערך ב-80% מאלה עם MG, המחלה מתפתחת בתיווך של נוגדנים כנגד הקולטן של אצטילכולין (להלן AChR) (Lindström וחב' ב-J Exp Med משנת 1976). נוגדנים אלה מפחיתים את מספר הקולטנים המתפקדים ב-endplate של סיבי השריר (Drachman וחב' ב-Ann NY Acad Sci משנת 1987), משרים נזק בתיווך משלים (complement) (Engel ב-Prog Brain Res משנת 1979) וחוסמים את הקישור של אצטילכולין לקולטניו (Burger וחב' ב-Muscle Nerve משנת 1990). עד 50% בין בעלי נוגדנים אלה עם MG ללא נוגדנים עצמיים כנגד AChR, נתגלו נוגדנים כנגד LRP-4 (Hoch וחב' ב-Nature Med משנת 2001, McConville וחב' ב-Ann Neurol משנת 2004, ו-Guptill וחב' ב-Muscle Nerve משנת 2011).
נוגדנים כנגד AChR מוצאים ב-90% מהמטופלים עם MG מפושטת, ובערך ב-50% באלה עם תסמינים עיניים מבודדים. נוגדנים אלה הם בעיקר מהסוג IgG1 ו-IgG3 , והנזק הנגרם על ידי נוגדנים אלה מסתייע על ידי הרס בתיווך משלים (complement) של הממברנה הבתר-סינפטית על ידי צימות של קולטנים שכנים (Verschuuren וחב' ב-Autoimmunity Reviews משנת 2013). שינויים קדם-סינפטיים , כגון הגברת הפרשה של אצטילכולין כתגובה לדה-פולריזציה עצבית, מפצים באופן חלקי על ההפחתה ב-AChR (Plomp וחב' ב-Annals in Neurology משנת 1995). MG הכרוכה בנוגדנים כנגד AChR, מראה את כל המאפיינים הטיפוסיים של המחלה, כגון ptosis, המאפיין הדו-מודאלי של התפרצות המחלה (בגילים 20-40 שנה בקרב נשים, ובגילים 50-70 שנה בקרב גברים), במגוון הרחב של תסמינים ובאסוציאציה השכיחה עם פתולוגיה של בלוטת התימוס.
החלבון LRP-4
החלבון LRP-4 הוא חבר במשפחת הקולטנים low-density lipoprotein (או LDL), והוא מורכב מחלק חוץ-ממברנלי המכיל 8 מקטעי LDL class a (או LDLa), מקטע דמוי-EGF, ארבעה מקטעי β-propeller, סליל טרנסממברנלי ואזור ציטופלזמי. כפי שהראו מספר מחקרים, המקטע החוץ-ממברנלי של LRP-4 מספיק לשפעול של MuSK, ובמיוחד זוהה המקטע הקושר-agrin כקטע ה-N טרמינלי של LRP-4, המכיל את החוליות 6-8 של של LDLa, את שני המקטעים הראשונים דמויי-EGF, והמקטע הראשון של β-propeller (Zhang וחב' ב-J Biol Chem משנת 2011). מקטע חוץ-ממברנלי גדול יותר של LRP-4, המכיל את חוליות 4-8 של LDLa, ואת שלושת מקטעי β-propeller כמו גם מקטע דמוי-EGF, נדרש להתקשרות של LPR-4 למקטע הראשון דמוי-אימוגלובולין של MuSK. בנוסף לתפקיד הקריטי של LRP-4 בשפעול של MuSK, פועל LRP-4 באופן דו-כיווני המספק איתותים רטרוגרדים הנחוצים להתמיינות (דיפרנציאציה) מוקדמת בקדם-סינפסיה (Yumoto וחב' ב-Nature משנת 2012).
הקשר בין הימצאות נוגדנים כנגד LRP-4 ל-amyotrophic lateral sclerosis: תסמינים מיאסטניים יכולים להופיע בחולי ALS. תסמינים אלה נחשבים ככאלה הנגרמים על ידי ניוון של הנוירונים המוטוריים הדיסטליים, והניוון של הצומת העצבית-שרירית. מחקרים עדכניים רמזו לאפשרות שנוגדנים כנגד LRP-4 הם הגורם הפתוגני הגורם ל-MG, אך נוגדנים אלה נמצאו גם בחולי ALS. אך למרות שהשערות רבות הועלו בדבר המנגנון הנוירו-דגנרטיבי כולל אקסיטו-טוקסיות בתיווך גלוטמאט, אגרגציה של חלבונים, אפופטוזיס, פגיעה בתפקוד אסטרוציטים, פגיעה בתפקוד מיטוכונדריאלי, הגברה של עקה חמצונית ופגיעה בתפקוד של תעלות יונים באקסונים, המנגנון של פגיעה אוטו-אימונית הוא השולט (Kieman וחב' ב-Lancet משנת 2011). חולים ב-ALS מזוהים לעתים על ידי תסמינים מיאסטניים כעייפות שריר, תסמינים דמויי אלה המופיעים ב-MG מיוחסים לפגיעה בתפקוד של צומת עצב-שריר כתוצאה מתהליך branching קו-לטרלי דיסטלי, לאחר נזק אקסונלי (Stalberg וחב' ב-J Neurol Sci משנת 1975, ו-Clark וחב' ב-J Chem Neuroanat משנת 2016). באשר ל-ALS דווח שנוגדנים כנגד LRP-4 התגלו בנסיוב ובנוזל השדרה (CSF) של מאובחנים עם ALS, מה שחיזק את ההשערה שנוגדנים אלה עלולים להיות קשורים במחלה זו עם נזק לרקמות המבטאות LRP-4 כגון נוירונים מוטוריים וצומת עצב-שריר (Tzartos וחב' ב-Ann Clin Transl Neurol משנת 2014).
במחקר של Tzartos וחב' נבדקה רמת LRP-4 בשיטת RIA וכן בשיטה אימונופלואורסצנטית המבוססת על תאי HEK293 שעברו טרנספקציה עם LRP-4 אנושי, לנוכחות נוגדנים בנסיוב ובנוזל השדרה של 104 חולים עם ALS מיוון ומאיטליה. נוגדנים כנגד LRP-4 ב-24 מתוך 104 הנבדקים (23.4%), כאשר בין היוונים נמצאו נוגדנים אלה ב-12 מתוך 51 נבדקים (23.5%), ובחולים האיטלקים נמצאו נוגדנים אלה ב-12 מתך 53 נבדקים (22.6%). לעומת זאת, נוגדנים כנגד LRP-4 נמצאו רק ב-5 מתוך 138 נבדקים עם מחלות נוירולוגיות אחרות (3.6%), ואילו בקרב 40 נבדקים בריאים לא נמצא אף לא מקרה אחד עם נוגדנים אלה. נוכחות נוגדנים אלה ב-5 מתוך 6 חולים עם ALS, הייתה יציבה לתקופה של לפחות 10 חודשים. דגימות CSF של 6 מתוך 7 מטופלים עם נוגדנים אלה בנסיוב, נמצאו חיוביות לנוכחות הנוגדנים הללו ב-CSF. בכל חולי ALS שנבדקו לא נמצאו כלל נוגדנים עצמיים כנגד AChR או כנגד MuSK, עם זאת לא נמצאו הבדלים במאפיינים הקליניים של ALS בין אלה עם נוגדנים עצמיים כנגד LRP-4 לבין אלה ללא נוגדנים אלה.
החלבון LRP-4 חבר במשפחת חלבונים ממברנליים, בעלי תפקידי מפתח בהתפתחות נוירונלית וסינפטית. LRP-4 ו-MuSK ביחד עם הקולטן לאצטילכולין יוצרים התקבצויות (clusters) בצומת הנוירו-שרירית, בהן מתרחשת דה-פולריזציה בתגובה לגירוי עצבי. נוגדנים כנגד LRP-4 זוהו במטופלים עם MG שהיו שליליים לשני הנוגדנים האחרים, כנגד הקולטן לאצטילכולין וכנגד MuSK (מה שנהוג לכנות doubly negative) (על פי Zouvelou וחב' ב-Neuromuscular Disorders משנת 2013, ו-Pevzner וחב' ב-Journal of Neurology משנת 2012). השכיחות של הנוגדנים כנגד LRP-4 בחולי MG נקבעה כ-18.7% במחקר בינלאומי גדול שכלל 635 מטופלים, אם כי טווח אחוז השכיחות נע בין 7-32.7% באוכלוסיות שונות, מגוון שכיחויות זה לא ניתן לייחוס לאזורים גאוגרפיים שונים. מטופלים חיוביים לנוגדן כנגד LRP-4 מגיבים לאסטרטגיה של טיפולים דומים בדומה לתגובה של מטופלים חיוביים לנוגדנים כנגד הקולטן לאצטילכולין. ישנם גם חולים עם MG שהם חיוביים "כפולים" לנוכחות נוגדנים כנגד הקולטן לאצטילכולין ול-LRP-4, וישנם גם מטופלים עם MG החיוביים כנגד MuSK ו-LRP-4. מטופלים עם MG שהם "חיוביים כפולים" כנגד שניים משלושת המולקולות האמורות, הם בדרך כלל בעלי תסמינים קליניים יותר חמורים.
בשנת 2008 זוהה LRP-4 או low-density lipoprotein receptor-related protein-4 כקולטן של agrin בתאי שריר (Zhang וחב' ב-Neuron, ו-Kim וחב' ב-Cell). כיוון ש-LRP-4 מרוכז בצומת עצב-שריר, נקשר ל-agrin, מגיב עם MuSK וחיוני ליצירת של מאפיינים סינפטיים בצומת עצב-שריר, הוא הופך להיות מועמד לפעילות של נוגדנים עצמיים ב-MG , שהוא שלילי כנגד 2 החלבונים האחרים. בהסכמה עם השערה זו, זוהו נוגדנים כנגד הקטע החוץ-תאי של LRP-4 ב-9 מתוך 300 חולי MG שליליים בנוכחות נוגדנים כנגד AChR ו-MuSK (Higuchi וחב' ב-Annals of Neurology משנת 2011). Pevzner וחב' דיווחו ב-Annals of Neurology משנת 2012, שבערך 50% מאלה עם MG שהם שליליים באופן כפול כנגד שני החלבונים האחרונים, מכילים נוגדנים כנגד LRP-4. יתרה מכך, כיוון ש-LRP-4 זוהה כקולטן של agrin, ובממברנה של הצומת עצב-שריר. הקישור ל-agrin גורם ליצירת רוב אם לא כל המאפיינים הבתר-סינפטיים, כולל אגרגטים המכילים את הקולטן של אצטילכולין, בצומת עצב-שריר.
במחקר המצוטט של Pevzner וחב' נמצא שמתוך 13 דגימות נסיוב של מאובחנים עם MG ללא נוגדנים כנגד AChR וכנגד MuSK , ב-12 מתוכם נמצאו נוגדנים שנקשרו לתאי HEK293 של עכבר שעברו טרנספקציה עם LRP-4 ממקור אדם. התוצאות מצביעות על כך ש-LRP-4 הוא יעד לנוגדנים עצמיים ב-MG ולפיכך הוא יכול להיות סמן אבחוני בחולי MG נטולי נוגדנים כנגד שני החלבונים האחרים.
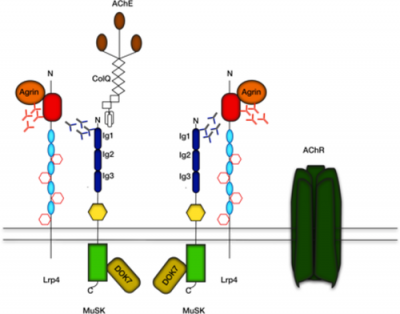
החלבון MuSK
MuSK הוא חלבון בעל משקל מולקולרי של 110,000 דלטון, שבודד לראשונה משריר שלד של חולדה. בשרירי שלד, MuSK מרוכז בצומת הנוירו-שרירית ומשחק תפקיד מפתח ביצירה, בתחזוק וברגנרציה של פעילויות בתר-סינפטיות כולל האיגור (aggregation) של AChR וחלבונים רבים אחרים, כל זאת בתיווך של החלבון agrin (Apel וחב' ב-Neuron משנת 1997, Glass וחב' ב-Cold Spring Harbour Symposium on Quantitative Biology משנת 1996, ו-Valenzuela וחב' ב-Neuron משנת 1995). הספקטרום של תסמינים קליניים ב-MG עם נוגדנים עצמיים כנגד AChR דומה, אך אינו זהה, לתסמינים של אלה עם נוגדנים עצמיים כנגד MuSK (Sanders ו-Juel ב-Journal of Neuroimmunology משנת 2008, ו-Cenacchi וחב' ב-Journal of Neurology משנת 2011). יתרה מכך, נוגדנים עצמיים כנגד MuSK בחולי MG מעכבים את האיגור בתיווך agrin של הביטוי של AChR בתאי C2C12 בתנאי in vitro, אך גם בתאי שריר in vivo, כמו גם בתאי TE671 בתנאי in vitro, מה שמצביע על אטרופיה של תאי השריר (Benveniste וחב' ב-Journal of Neuroimmunology משנת 2005, Boneva וחב' באותו כתב עת משנת 2006, ו-Parugia וחב' באותו כתב-עת משנת 2007). תוצאות אלה מרמזות לכך שהנוגדנים כנגד MuSK יכולים לשנות את ההתקבצות של AChR ויכולים להסביר את חולשת השרירים הכללית הנצפית המופיעה בחולי MG עם נוגדנים כנגד MuSK.
מחקר רב-מוסדי ברחבי ארה"ב בקרב חולים עם myasthenia gravis, נועד לבחון את המשמעות של נוגדן עצמי כנגד LRP-4 בפתולוגיה של MG. צוות חוקרים בראשותו של Lin Mei מ-22 מרכזים רפואיים המתמחים ב-MG, שהיא המפגע השכיח ביותר בתחום הקומוניקציה של בין מוח ושריר, בחנו את המטופלים לקביעת האחוז מתוכם שהכילו בדמם נוגדנים כנגד LRP-4. ד"ר Mei הוא ראש המחלקה למדעי העצב ורפואה רגנרטיבית במרכז הרפואי של אוניברסיטת אוגוסטה בג'ורג'יה.
מבצעים בדיקה לנוכחות הנוגדנים כנגד LRP-4 וכנגד החלבון agrin, בנוסף לבדיקה הקלאסית לנוכחות נוגדנים עצמיים כנגד הקולטן לאצטילכולין. נוגדנים כנגד LRP-4 וכנגד agrin כבר זוהו במטופלים אחדים, ונוגדנים כנגד LRP-4 נמצאו גורמים לתסמינים דמויי-MG כאשר הוזרקו לחיות מעבדה. בשנת 2008 מעבדתו של Mei מצאה קשר בין agrin ו-LRP-4, ובשנת 2013 דיווחה מעבדה זו על חשיבות מציאות נוגדנים כנגד agrin בפתוגנזה של MG. בעת ההתפתחות העוברית, agrin מופרש על ידי נוירונים מוטוריים לסייע ליצירה של מגע בין נוירון-שריר בסינפסה, ואילו האנזים MuSK (או muscle specific kinase) הממוקם על פני תאי-שריר, מסייע להתקבצות (clustering) של קולטנים, המשופעלים על ידי אצטילכולין. כאשר agrin ו-MuSK פועלים ביחד, הם אינם "מתקשרים" אחד עם השני ישירות. אך כאן נכנס לתמונה LRP-4 . צוותו של Mei הראה ש-agrin מתקשר עם LRP-4 על פני תאי השריר, ואז הוא מגייס את MuSK להצטרף להתקשרות זו. LRP-4 ו-MuSK הופכים למרכיבים עיקריים של הקולטן הנחוץ לתא שריר לקלוט את המסר ש-agrin משגר במהלך החיים. Mei ואנשיו זיהו לראשונה את הנוגדנים ל-agrin ול-LRP-4 בדמם של חלק מהחולים עם MG. למעשה ב-900 מתוך 4,500 נבדקים עם MG לא נמצאו נוגדנים ל-agrin ול-LRP-4.
נוכחות נוגדנים כנגד LRP-4 ו-MuSK ב-MG
בערך ב-10% של המטופלים עם MG לא ניתן למצוא נוגדנים כנגד MuSK או כנגד AChR בשיטות השגרתיות ( Vincentוחב' ב- Annals of NY Academy of Sciences משנת 2008). עד 66% ממטופלים אלה מכילים בדמם נוגדנים בזיקה נמוכה כנגד AChR, שניתן לגלותם רק בשיטה תאית תוך שימוש בתאי HEK שעברו טרנספקציה עם תת-יחידות של AChR אנושי, על מנת להשרות קיבוץ של קולטנים אלה על פני תאיר השריר (Leite וחב' ב- Brain משנת 2008). ההופעה וההתפתחות של המחלה באלה שם שליליים לנוכחות נוגדנים מאוד דומה למאפייני המחלה באלה שם חיוביים מבחינת נוכחות נוגדנים כנגד AChR וכנגד MuSK אם כי ישנם הבדלים זעירים בגל בו מופיעה המחלה, במעורבות של התימוס, ובמהות השרירים בהם מופיעה החולשה (Leite וחב' ב- Annals in Neurologyמשנת 2005, ו-Romi וחב' ב-Lancet משנת 2005).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 