הבדלים בין גרסאות בדף "אוסטאוקלצין - Osteocalcin"
(←ראו גם) |
|||
| (2 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 28: | שורה 28: | ||
==משמעות השינויים ברמות אוסטאטוקלצין== | ==משמעות השינויים ברמות אוסטאטוקלצין== | ||
| − | רמות אוסאטוקלצין מוגברות בנערים ונערות בגיל צמיחה יחסית מהירה של עצמות השלד; במחלות מטבוליות של העצם עם יצירה מוגברת של תאים אוסטאואידים, כולל אוסטאופורוזיס, osteomalachia, רככת העצמות, מחלת Paget, היפר-פארא-תירואידיזם, בהיפותירואידיזם ראשונית או שניונית, באי ספיקה כרונית של הכליות או ב-renal osteodystrophy, אקרומגליה, thyrotoxicosis, ובאלה עם שברים וגרורות לעצם. על ידי מדידת רמת אוסטאוקלצין, אפשרי לנטר טיפולים עם תכשירים נוגדי ספיגת-עצם כגון ביפוספונאטים, או טיפול הורמונאלי חלופי (HRT), כמו לדוגמה במטופלים עם אוסטאופורוזיס או עם היפר-קלצמיה (Chen וחב' ב-J Bone Miner Res משנת 1996). | + | רמות אוסאטוקלצין מוגברות בנערים ונערות בגיל צמיחה יחסית מהירה של עצמות השלד; במחלות מטבוליות של העצם עם יצירה מוגברת של תאים אוסטאואידים, כולל [[אוסטאופורוזיס]], [[osteomalachia]], [[רככת העצמות]], [[מחלת Paget]], היפר-פארא-תירואידיזם, בהיפותירואידיזם ראשונית או שניונית, באי ספיקה כרונית של הכליות או ב-renal osteodystrophy, אקרומגליה, thyrotoxicosis, ובאלה עם שברים וגרורות לעצם. על ידי מדידת רמת אוסטאוקלצין, אפשרי לנטר טיפולים עם תכשירים נוגדי ספיגת-עצם כגון ביפוספונאטים, או טיפול הורמונאלי חלופי (HRT), כמו לדוגמה במטופלים עם אוסטאופורוזיס או עם היפר-קלצמיה (Chen וחב' ב-J Bone Miner Res משנת 1996). |
ירידה ברמת אוסטאוקלצין נצפית במספר מפגעים כגון היפו-פארא-תירואידיזם, היפו-תירואידיזם, בנשים הרות, באלה עם צמקת ראשונית של דרכי המרה, נשים המטופלות במינונים גבוהים של קורטיקוסטרואידים, ובמצבי חוסר בהורמון גדילה, כמו גם חסר בוויטמיןD וסידן, וכן בתסמונת Cushing. | ירידה ברמת אוסטאוקלצין נצפית במספר מפגעים כגון היפו-פארא-תירואידיזם, היפו-תירואידיזם, בנשים הרות, באלה עם צמקת ראשונית של דרכי המרה, נשים המטופלות במינונים גבוהים של קורטיקוסטרואידים, ובמצבי חוסר בהורמון גדילה, כמו גם חסר בוויטמיןD וסידן, וכן בתסמונת Cushing. | ||
| שורה 34: | שורה 34: | ||
תרופות ותכשירים המעלים רמת אוסטאוקלצים בדם: נוגדי פרכוסים, אסטרוגנים וקלציטריול (1,25 דיהידרוקסיויטמין D). לעומת זאת גלוקו-קוטיקוסטרואידים מפחיתים רמת אוסטאוקלצין. | תרופות ותכשירים המעלים רמת אוסטאוקלצים בדם: נוגדי פרכוסים, אסטרוגנים וקלציטריול (1,25 דיהידרוקסיויטמין D). לעומת זאת גלוקו-קוטיקוסטרואידים מפחיתים רמת אוסטאוקלצין. | ||
| − | מחקרים אימונו-כימיים וכרומטוגרפיים הראו הטרוגניות משמעותית בריכוזים של אוסטאוקלצין בנסיוב באנשים בריאים כמו גם במטופלים עם אוסטאופורוזיס, כשל כליות כרוני, ומחלת פאג'ט. ניתן למצוא בצירקולציה את מולקולת אוסטאוקלצין השלימה (חומצות אמינו 1-49) כמו גם את המקטע הגדול המכיל את חומצות האמינו של הקצה ה-N טרמינאלי וכן את האזור המרכזי (N-MID) המכיל את חומצות אמינו 1-43. מולקולת אוסטאוקלצין השלימה אינה יציבה כתוצאה מביקוע פרוטאוליטי בין חומצות אמינו 43-44. מקטע ה-N-MID המתקבל כתוצאה מביקוע זה יציב הרבה יותר. במבדק בשיטת Electro-chemiluminescence Immunoassay מזהים ומודדים את שתי צורות החלבון, 1-49 ו-1-43. | + | מחקרים אימונו-כימיים וכרומטוגרפיים הראו הטרוגניות משמעותית בריכוזים של אוסטאוקלצין בנסיוב באנשים בריאים כמו גם במטופלים עם אוסטאופורוזיס, כשל כליות כרוני, ומחלת פאג'ט. ניתן למצוא בצירקולציה את מולקולת אוסטאוקלצין השלימה (חומצות אמינו 1-49) כמו גם את המקטע הגדול המכיל את חומצות האמינו של הקצה ה-N טרמינאלי וכן את האזור המרכזי (N-MID) המכיל את חומצות אמינו 1-43. מולקולת אוסטאוקלצין השלימה אינה יציבה כתוצאה מביקוע פרוטאוליטי בין חומצות אמינו 43-44. מקטע ה-N-MID המתקבל כתוצאה מביקוע זה יציב הרבה יותר. במבדק בשיטת Electro-chemiluminescence Immunoassay מזהים ומודדים את שתי צורות החלבון, 1-49 ו-1-43. |
==תפקידו של אוסטאוקלצין במטבוליזם של רקמת העצם== | ==תפקידו של אוסטאוקלצין במטבוליזם של רקמת העצם== | ||
| שורה 43: | שורה 43: | ||
כאמור, אוסטאוקלצין המופרש מאוסטאובלבטים, חודר אל המשתית החוץ-תאיץ בעצם, ומשם מופרש לצירקולציה בתרחיש של ספיגת עצם, ולכן ראוי יותר לראות בו סמן של turnover של העצם, מאשר סמן ספציפי של בניית עצם. לכן מדידת רמות אוסטאוקלצין מאפשרת לנטר טיפול תרופתי עם תכשירים מונעי-ספיגת עצם כמו ביפוספונאטים או טיפולים הורמונאליים חלופיים בנשים עם אוסטאופורוזיס או היפר-קלצמיה. במטופלים האחרונים, ירידה תוך 3-6 חודשים של מעל 20% ברמת אוסטאוקלצין מרמת הבסיס שלו לפני תחילת הטיפולים, עשויה להעיד על יעילות הטיפול. | כאמור, אוסטאוקלצין המופרש מאוסטאובלבטים, חודר אל המשתית החוץ-תאיץ בעצם, ומשם מופרש לצירקולציה בתרחיש של ספיגת עצם, ולכן ראוי יותר לראות בו סמן של turnover של העצם, מאשר סמן ספציפי של בניית עצם. לכן מדידת רמות אוסטאוקלצין מאפשרת לנטר טיפול תרופתי עם תכשירים מונעי-ספיגת עצם כמו ביפוספונאטים או טיפולים הורמונאליים חלופיים בנשים עם אוסטאופורוזיס או היפר-קלצמיה. במטופלים האחרונים, ירידה תוך 3-6 חודשים של מעל 20% ברמת אוסטאוקלצין מרמת הבסיס שלו לפני תחילת הטיפולים, עשויה להעיד על יעילות הטיפול. | ||
| − | [[קובץ:Osteocalcin1.png|ממוזער|מרכז|550 פיקסלים|מקרא: השפעות סיסטמיות ומקומיות של אוסטאוקלצין קושרות באופן פוטנציאלי תהליכי remodeling של העצם, הסתיידות כלי-דם ומטבוליזם של אנרגיה. אוסטאוקלצין הנובע מתאי שריר חלק של כלי-דם (VSMCs) או מהצירקולציה, משרה שפעולו של HIF-1α או hypoxia inducible factor 1α. שפעולו של HIF-1α מעודד שינויים מטבוליים לכיוון גליקוליזה, כמו גם התמיינות (דיפרנציאציה) אוסטאו-כונדרוגנית של VSMCs, מה שמגביר הסתיידות כלי דם. אם אוסטאוקלצין בצירקולציה יכול להשפיע על המינרליזציה של VSMCs, כי אז ה-remodeling של רקמת העצם עשוי לעודד את תהליכי ההסתיידות של VSMC המושרים על ידי HIF-1α. | + | [[קובץ:Osteocalcin1.png|ממוזער|מרכז|550 פיקסלים|מקרא: השפעות סיסטמיות ומקומיות של אוסטאוקלצין קושרות באופן פוטנציאלי תהליכי remodeling של העצם, הסתיידות כלי-דם ומטבוליזם של אנרגיה. אוסטאוקלצין הנובע מתאי שריר חלק של כלי-דם (VSMCs) או מהצירקולציה, משרה שפעולו של [[HIF-1α]] או hypoxia inducible factor 1α. שפעולו של HIF-1α מעודד שינויים מטבוליים לכיוון גליקוליזה, כמו גם התמיינות (דיפרנציאציה) אוסטאו-כונדרוגנית של VSMCs, מה שמגביר הסתיידות כלי דם. אם אוסטאוקלצין בצירקולציה יכול להשפיע על המינרליזציה של VSMCs, כי אז ה-remodeling של רקמת העצם עשוי לעודד את תהליכי ההסתיידות של VSMC המושרים על ידי HIF-1α. |
{{ש}} | {{ש}} | ||
מקרא למונחים המופיעים בתרשים:{{ש}} | מקרא למונחים המופיעים בתרשים:{{ש}} | ||
| שורה 75: | שורה 75: | ||
במחקר של Idelevich וחב' הם טיפלו בחולדות בוויטמין D להשרות מינרליזציה של כלי דם. הם הדגימו שטיפול זה הביא לשדרוג של יצירת mRNA של אוסטאוקלצין, במקביל לדיפרנציאציה של אוסטאו-כונדרוציטית של VSMC, וכן להצטברות של אוסטאוקלצין בדופן כלי דם מסוידים. חוקרים אלה בחנו גם את הביטוי וההפרשה של אוסטאוקלצין בשורת תאי VSMC בעכברים, שהושרה בהם תהליך הסתיידות על ידי טיפול עם β-glycerophosphate. גם כאן הם מצאו שדרוג משמעותי של אוסטאוקלצין במקביל למינרליזציה מוגברת עם ביטוי מוגבר של Runx2 ו-Sox9, כאשר Runx2 הוא גורם שעתוק מרכזי הקושר לדיפרנציאציה של אוסטאובלסטים, ואילו SOX9 הוא גורם שעתוק הקשור לדיפרנציאציה של כונדרוציטים. תצפיות אלו הביאו את החוקרים להשערה שאוסטאוקלצין מתווך של דיפרנציאציה אוסטאו-כונדרוגנית של VSMCs. | במחקר של Idelevich וחב' הם טיפלו בחולדות בוויטמין D להשרות מינרליזציה של כלי דם. הם הדגימו שטיפול זה הביא לשדרוג של יצירת mRNA של אוסטאוקלצין, במקביל לדיפרנציאציה של אוסטאו-כונדרוציטית של VSMC, וכן להצטברות של אוסטאוקלצין בדופן כלי דם מסוידים. חוקרים אלה בחנו גם את הביטוי וההפרשה של אוסטאוקלצין בשורת תאי VSMC בעכברים, שהושרה בהם תהליך הסתיידות על ידי טיפול עם β-glycerophosphate. גם כאן הם מצאו שדרוג משמעותי של אוסטאוקלצין במקביל למינרליזציה מוגברת עם ביטוי מוגבר של Runx2 ו-Sox9, כאשר Runx2 הוא גורם שעתוק מרכזי הקושר לדיפרנציאציה של אוסטאובלסטים, ואילו SOX9 הוא גורם שעתוק הקשור לדיפרנציאציה של כונדרוציטים. תצפיות אלו הביאו את החוקרים להשערה שאוסטאוקלצין מתווך של דיפרנציאציה אוסטאו-כונדרוגנית של VSMCs. | ||
| − | במהלך ניסוי זה הבחינו חוקרים אלה בשינוי חשוב בגוון של נוזל תרבית התאים מה ששיקף עלייה בפעילות המטבולית של התאים. ממצא זה הביא אותם לבדוק האם אוסטאוקלצין מסוגל לגרום להשפעות מטבוליות בתאים וסקולאריים. ניסויים נוספים in vitro גילו שביטוי-יתר של אוסטאוקלצין, גרם לשפעול של קליטת גלוקוזה והסיט את תהליכי יצירת האנרגיה לכיוון של פירוק גליקוליטי מוגבר של גלוקוזה, שהיה מלווה על ידי שגשוג VSMCs. הצעד הבא היה לקבוע איזה גורמים עשויים להניע את השינויים המטבוליים המושרים על ידי אוסטאוקלצין. הם העריכו ש-HIF-1α הוא מועמד ראוי לבחון, על בסיס היותו משופעל בעת התפתחות העצם האנדוכונדראלית (התוך סחוסית) ואחראי לדיפרנציאציה של תאים אוסטאובלסטים, כמו גם לשדרוג אנזימים גליקוליטיים בכונדרוציטים (מה שמאפשר את הישרדותם בתנאי היפוקסיה השוררים בפלאטת הגדילה (על פי Schipani וחב' ב-Genes Dev משנת 2001), וכן לעידוד תהליך אנגיוגני במהלך האוסטאוגנזה (Wang וחב' ב-J Clin Invest משנת 2007). | + | במהלך ניסוי זה הבחינו חוקרים אלה בשינוי חשוב בגוון של נוזל תרבית התאים מה ששיקף עלייה בפעילות המטבולית של התאים. ממצא זה הביא אותם לבדוק האם אוסטאוקלצין מסוגל לגרום להשפעות מטבוליות בתאים וסקולאריים. ניסויים נוספים in vitro גילו שביטוי-יתר של אוסטאוקלצין, גרם לשפעול של קליטת גלוקוזה והסיט את תהליכי יצירת האנרגיה לכיוון של פירוק גליקוליטי מוגבר של גלוקוזה, שהיה מלווה על ידי שגשוג VSMCs. הצעד הבא היה לקבוע איזה גורמים עשויים להניע את השינויים המטבוליים המושרים על ידי אוסטאוקלצין. הם העריכו ש-[[HIF-1α]] הוא מועמד ראוי לבחון, על בסיס היותו משופעל בעת התפתחות העצם האנדוכונדראלית (התוך סחוסית) ואחראי לדיפרנציאציה של תאים אוסטאובלסטים, כמו גם לשדרוג אנזימים גליקוליטיים בכונדרוציטים (מה שמאפשר את הישרדותם בתנאי היפוקסיה השוררים בפלאטת הגדילה (על פי Schipani וחב' ב-Genes Dev משנת 2001), וכן לעידוד תהליך אנגיוגני במהלך האוסטאוגנזה (Wang וחב' ב-J Clin Invest משנת 2007). |
בהתאם, הראו חוקרים אלה ש-HIF-1α משודרג בתאים וסקולאריים של עכבר בעת תהליך ההסתיידות, וכן ששדרוג זה התרחש במקביל לביטוי-יתר של אוסטאוקלצין. הוספה אקסוגנית של אוסטאוקלצין לתאי עכבר אלה, השרתה שפעול מהיר של HIF-1α, כמו כן לביטוי מוחש של טרנספורטרים של גלוקוזה ולפעילות מוגברת של אנזימים גליקוליטיים. חשוב לציין שההשפעות של אוסטאוקלצין אקסוגני, לא נמצאו בעכברים החסרים פעילות של HIF-1α, שהושגה על ידי שימוש ב-siRNA (או small interfering RNA). נמצא שביטויו של HIF-1α, מגביר באבי העורקים של חולדות מינרליזציה לאחר טיפול בוויטמין D. כמו כן, השתקת אוסטאוקלצין in vivo על ידי איסטרטגיה של siRNA, הפחיתה את היציבות של HIF-1α, מנעה את העלייה של Sox9 ובפעילות pyruvate dehydrogenase kinase 1, וכן עיכבה את המינרליזציה הווסקולארית בתגובה לוויטמין D. יחד עם זאת, פקטורים אחרים כמו Runx2 ואנזימים גליקוליטיים לא הושפעו על ידי השתקת אוסטאוקלצין. החוקרים Idelevich וחב' הסיקו מניסויים אלה, ש-HIF-1α יכול להיות משופעל על ידי אוסטאקלצין שמעודד בסופו של דבר תהליכי הסתיידות של כלי דם. יהיה מעניין לבחון האם knockdown סיסטמי של אוסטאוקלצין על ידי siRNA, משפיע על remodeling של העצם בחולדות, ועל תהליכי הסתיידות כלי-דם בחיות אלו. | בהתאם, הראו חוקרים אלה ש-HIF-1α משודרג בתאים וסקולאריים של עכבר בעת תהליך ההסתיידות, וכן ששדרוג זה התרחש במקביל לביטוי-יתר של אוסטאוקלצין. הוספה אקסוגנית של אוסטאוקלצין לתאי עכבר אלה, השרתה שפעול מהיר של HIF-1α, כמו כן לביטוי מוחש של טרנספורטרים של גלוקוזה ולפעילות מוגברת של אנזימים גליקוליטיים. חשוב לציין שההשפעות של אוסטאוקלצין אקסוגני, לא נמצאו בעכברים החסרים פעילות של HIF-1α, שהושגה על ידי שימוש ב-siRNA (או small interfering RNA). נמצא שביטויו של HIF-1α, מגביר באבי העורקים של חולדות מינרליזציה לאחר טיפול בוויטמין D. כמו כן, השתקת אוסטאוקלצין in vivo על ידי איסטרטגיה של siRNA, הפחיתה את היציבות של HIF-1α, מנעה את העלייה של Sox9 ובפעילות pyruvate dehydrogenase kinase 1, וכן עיכבה את המינרליזציה הווסקולארית בתגובה לוויטמין D. יחד עם זאת, פקטורים אחרים כמו Runx2 ואנזימים גליקוליטיים לא הושפעו על ידי השתקת אוסטאוקלצין. החוקרים Idelevich וחב' הסיקו מניסויים אלה, ש-HIF-1α יכול להיות משופעל על ידי אוסטאקלצין שמעודד בסופו של דבר תהליכי הסתיידות של כלי דם. יהיה מעניין לבחון האם knockdown סיסטמי של אוסטאוקלצין על ידי siRNA, משפיע על remodeling של העצם בחולדות, ועל תהליכי הסתיידות כלי-דם בחיות אלו. | ||
| − | חשוב לציין שנכון למחצית שנת 2015, ניסויים קליניים לא מצאו קשר ברור בין הרמות בצירקולציה של undercarboxylated אוסטאוקלצין, ותהליכי הסתיידות ואסקולארית: בחולים עם סוכרת type 2, רמות אוסטאוקלצין בנסיוב נמצאות במתאם הפוך עם brachial-ankle pulse wave velocity (על פי Kanazawa וחב' ב- J Clin Endocrinol Metab משנת 2009), אך יחד עם זאת לא נמצא כל קשר בין רמות אוסטאוקלצין לבין הסתיידות אבי העורקים הבטני על ידי Parker וחב' ב-Calcif Tissue Int משנת 2010. | + | חשוב לציין שנכון למחצית שנת 2015, ניסויים קליניים לא מצאו קשר ברור בין הרמות בצירקולציה של undercarboxylated אוסטאוקלצין, ותהליכי הסתיידות ואסקולארית: בחולים עם סוכרת type 2, רמות אוסטאוקלצין בנסיוב נמצאות במתאם הפוך עם brachial-ankle pulse wave velocity (על פי Kanazawa וחב' ב- J Clin Endocrinol Metab משנת 2009), אך יחד עם זאת לא נמצא כל קשר בין רמות אוסטאוקלצין לבין הסתיידות אבי העורקים הבטני על ידי Parker וחב' ב-Calcif Tissue Int משנת 2010. |
==השפעת אוסטאוקלצין על תפקוד האשכים ועל נושאי פוריות== | ==השפעת אוסטאוקלצין על תפקוד האשכים ועל נושאי פוריות== | ||
גרסה אחרונה מ־08:15, 25 בספטמבר 2020
| מדריך בדיקות מעבדה | |
| אוסטאוקלצין | |
|---|---|
| Osteocalcin | |
| שמות אחרים | bone gamma-carboxyglutamic acid-containing protein או BGLAP, OSCAL, Bone g1a protein |
| מעבדה | כימיה בדם, אנדוקרינולוגיה בדם |
| טווח ערכים תקין | גברים מעל גיל 18 שנה-3-13 ננוגרם/מ"ל; נשים בגיל הפריון-0.8-6.5 ננוגרם/מ"ל; נשים בגיל חידלון הווסת-1.5-11.0 ננוגרם/מ"ל; ילדים בגיל בין 2-17 שנים-2.8-41.0 ננוגרם/מ"ל; יילודים-20-40 ננוגרם/מ"ל. נתןנים אלה עפ"י Tietz ב: Clinical Guide to Laboratory Tests, . W. B. Saunders, Philadelphia, PA, 1995. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
ניטור והערכה של יעילות טיפול נוגד ספיגת עצם במטופלות בתקופת חידלון הווסת עם אוסטאופורוזיס, ובמטופלים עם osteopenia, מחלת פאג'ט, או מפגעים אחרים בהם רמות אוסטאוקלצין מוגברות. מדידת אוסטאוקלצין בנסיוב מסייעת באבחון של תרחישים קליניים בהם יש אי-סדירות בבניית עצם או turnover מוגבר של העצם, כולל מחלת פאג'ט, ממאירות עם גרורות לעצם, היפר-פארא-תירואידיזם ראשוני, osteitis fibrosa ו-osteodystrophy של הכליות. תרחיש אחר בו בדיקת אוסטאוקלצין יכולה לסייע, הוא במקרים של שברי עצם בלתי צפויים או כתוצאה מטראומות קלות לעצם.
בסיס פיזיולוגי של אוסטאוקלצין
בשנת 1972 התגלתה חומצת אמינו שעברה מודיפיקציה אנזימטית, -carboxyglutamic acidγ או Gla, באופן המגביר זיקתה לסידן, והתברר הקשר שלה בשפעול מנגנון הקרישה בעזרת פקטורי קרישה התלויים בוויטמין K. תגלית זו עוררה סקרנות בקרב חוקרים שעסקו בחקר חלבונים קושרי-סידן שעשויים להשתתף בתהליכי מינרליזציה ברקמת עצם לדוגמה. שנתיים לאחר מכן, שתי קבוצות מחקר בודדו באופן בלתי תלוי חלבון קטן מרקמת עצם, שהכיל 3 שיירי Gla מושרים על ידי ויטמין K, שקיבל את השם osteocalcin (על פי Hauschka וחב' ב-Proc Natl Acad Sci USA משנת 1975, ו-Price וחב' באותו כתב-עת משנת 1976). אוסטאוקלצין היה החלבון הראשון שזוהה כספציפי לרקמת עצם, בהיותו מסונתז על ידי אוסטאובלסטים, התאים בוני העצם, ובהיותו מצטבר במשתית החוץ-תאית (matrix) של העצם קשור למינראלים.
הזיהוי של כמויות קטנות של אוסטאוקלצין בצירקולציה היווה פריצת דרך משמעותית בתחום הקליני של העצם, בהיבט של מצבי turnover מוגברים של העצם, כמו גם במחלות מטבוליות של רקמה זו (Gundberg ב-J Clin Ligand Assay משנת 1998). אך למרות מחקרים רבים ב-4 העשורים האחרונים, התפקיד הספציפי של אוסטאוקלצין נותר מעורפל.
כידוע, השלד הגרום של הגוף עובר תהליך של עיצוב מתחדש (remodeling או turnover) בו מתקיימת הרחקה של רקמת עצם ישנה על ידי אוסטאוקלסטים, ומילוי מקומה על ידי רקמת עצם חדשה על ידי אוסטאובלסטים. במצב של steady state, יחסי הגומלין בין יצירת עצם וספיגתה משמרים את מסת העצם, המכילה פרט לתאים גם מינראלים, חלבונים, ומקרומולקולות נוספות כגון פחמימות וליפידים. הפאזה המינראלית של העצם מורכבת בעיקר ה-hydroxyapatite גבישי, המהווה 60-70% ממשקל העצם. הפאזה האורגנית של העצם, מורכבת מקולאגן (90%) וממספר חלבוני משתית קטנים יותר כמו גליקופרוטאינים ופרוטאוגליקנים (Calvo וחב' ב-Endocr Rev משנת 1996).
תכונות ביו-פיזיקליות של אוסטאוקלצין
אוסטאוקלצין הוא אחד מחלבוני המשתית המצויים ביותר בעצם, וייחודו בהיותו החלבון היחיד המסונתז באופן בלעדי ברקמה זו ( Hauschka וחב' ב-Physiol Rev משנת 1989). אוסטאוקלצין הוא חלבון לא-קולאגני שנמצא בעצם ובדנטין. כיוון שהוא מכיל עד 3 שיירים של γ-carboxyglutamic acid, הסינתזה שלו תלויה בוויטמין K. כאשר חומצה גלוטמית זו עברה שלב אנזימאטי של קרבוקסילציה התלויה בוויטמין K באדם, ותהליך זה מזורז על ידי D dihydroxy vitamin ,251. אוסטאוקלצין מקודד על ידי הגן BGLAP (על פי Cancela וחב' ב-J Biol Chem משנת 1990 ו- Puchaczוחב' ב-Endocrinology משנת 1989). הקולטן של אוסטאוקלצין הוא GPRC6A על פי Pi וחב' ב-J Bone Mineral Res משנת 2011.
אוסטאוקלצין הוא חלבון בעל 49 חומצות אמינו (Nielsen-March וחב' ב-Proc Natl Acad Sci USA משנת 2005), ומשקל מולקולארי של 5,800 דלטון, העשיר בחומצה גלוטמית. אוסטאוקלצין מיוצר על ידי אוסטאובלסטים, משתרבב לתוך משתית (matrix) העצם, ומופרש לצירקולציה ממשתית העצם במהלך ספיגת עצם, ולכן הוא נחשב סמן לשינויים במאזן בניה-ספיגה בעצם, ולאו דווקא סמן ספציפי של ספיגת או בניית עצם (Puchaczet וחב' ב-Endocrinology משנת 1989). אוסטאוקלצין נחשב לחלבון הלא-קולאגני החשוב ביותר במשתית העצם. ומהווה בערך 1% מכלל החלבון ברקמת העצם באדם. למרות שתפקידו במאזן הבניה-ספיגה של רקמת העצם אינו ברור לחלוטין יש הסבורים שאוסטאוקלצין יכול לשמש כאתר שקיעה של גבישי hydroxyapatite , והוא יכול אף להשפיע על המטבוליזם האנרגטי דרך היצירה והפעולה של אינסולין. אוסטאוקלצין מתפנה במהירות על ידי הכליות, ובמידה פחותה יותר על ידי הכבד, ובצירקולציה זמן מחצית החיים של אוסטאוקלצין הוא בערך 5 דקות.
משמעות השינויים ברמות אוסטאטוקלצין
רמות אוסאטוקלצין מוגברות בנערים ונערות בגיל צמיחה יחסית מהירה של עצמות השלד; במחלות מטבוליות של העצם עם יצירה מוגברת של תאים אוסטאואידים, כולל אוסטאופורוזיס, osteomalachia, רככת העצמות, מחלת Paget, היפר-פארא-תירואידיזם, בהיפותירואידיזם ראשונית או שניונית, באי ספיקה כרונית של הכליות או ב-renal osteodystrophy, אקרומגליה, thyrotoxicosis, ובאלה עם שברים וגרורות לעצם. על ידי מדידת רמת אוסטאוקלצין, אפשרי לנטר טיפולים עם תכשירים נוגדי ספיגת-עצם כגון ביפוספונאטים, או טיפול הורמונאלי חלופי (HRT), כמו לדוגמה במטופלים עם אוסטאופורוזיס או עם היפר-קלצמיה (Chen וחב' ב-J Bone Miner Res משנת 1996).
ירידה ברמת אוסטאוקלצין נצפית במספר מפגעים כגון היפו-פארא-תירואידיזם, היפו-תירואידיזם, בנשים הרות, באלה עם צמקת ראשונית של דרכי המרה, נשים המטופלות במינונים גבוהים של קורטיקוסטרואידים, ובמצבי חוסר בהורמון גדילה, כמו גם חסר בוויטמיןD וסידן, וכן בתסמונת Cushing.
תרופות ותכשירים המעלים רמת אוסטאוקלצים בדם: נוגדי פרכוסים, אסטרוגנים וקלציטריול (1,25 דיהידרוקסיויטמין D). לעומת זאת גלוקו-קוטיקוסטרואידים מפחיתים רמת אוסטאוקלצין.
מחקרים אימונו-כימיים וכרומטוגרפיים הראו הטרוגניות משמעותית בריכוזים של אוסטאוקלצין בנסיוב באנשים בריאים כמו גם במטופלים עם אוסטאופורוזיס, כשל כליות כרוני, ומחלת פאג'ט. ניתן למצוא בצירקולציה את מולקולת אוסטאוקלצין השלימה (חומצות אמינו 1-49) כמו גם את המקטע הגדול המכיל את חומצות האמינו של הקצה ה-N טרמינאלי וכן את האזור המרכזי (N-MID) המכיל את חומצות אמינו 1-43. מולקולת אוסטאוקלצין השלימה אינה יציבה כתוצאה מביקוע פרוטאוליטי בין חומצות אמינו 43-44. מקטע ה-N-MID המתקבל כתוצאה מביקוע זה יציב הרבה יותר. במבדק בשיטת Electro-chemiluminescence Immunoassay מזהים ומודדים את שתי צורות החלבון, 1-49 ו-1-43.
תפקידו של אוסטאוקלצין במטבוליזם של רקמת העצם
חלבון זה מופרש בלעדית על ידי אוסטאובלסטים וייחסו לו תפקיד בוויסות המטבולי של הגוף, והוא בעל חשיבות פרו-אוסטאובלסטית, או בונת עצם ( Lee וחב' ב-Cell משנת 2007). לאוסטאוקלצין יש כנראה גם תפקיד משמעותי במינרליזציה של העצם ובההומאוסטאזיס של יוני סידן. אוסטאוקלצין פועל כהורמון בגוף, וגורם לתאי בטא בפנקריאס להפריש יותר אינסולין, ובאותו זמן לכוון תאי שומן להפריש את ההורמון אדיפונקטין, המגביר את הרגישות לאינסולין. אוסטאוקלצין פועל גם על תאי Leydig באשכים ומעודד בהם יצירת טסטוסטרון, ועל ידי כך משפיע על פריון הגבר (Karsenty ו-Oury ב-Mol Cell Endocrinol משנת 2014).
כיוון שאוסטאוקלצין מיוצר על ידי פיברובלסטים משתמשים בו לעתים קרובות כסמן לתהליך בניית העצם. נמצא שרמות גבוהות של אוסטאוקלצין בנסיוב תואמות היטב באופן יחסי לעלייה בצפיפות העצם (BMD) במהלך טיפול עם תכשירים אנאבוליים בוני עצם כגון teriparatide. במחקרים אחדים שימש אוסטאוקלצין סמן מוקדם ליעילות הטיפול בתכשיר בונה עצם. לדוגמה, Bharadwaj וחב' במחקרם משנת 2009 ב- Osteoporosis Int על השפעת לקטופרין על בנית עצם בנשים בגיל חידלון הווסת, אוסטאקלצין שימש כמדד לפעילות האוסטאובלסטים.
כאמור, אוסטאוקלצין המופרש מאוסטאובלבטים, חודר אל המשתית החוץ-תאיץ בעצם, ומשם מופרש לצירקולציה בתרחיש של ספיגת עצם, ולכן ראוי יותר לראות בו סמן של turnover של העצם, מאשר סמן ספציפי של בניית עצם. לכן מדידת רמות אוסטאוקלצין מאפשרת לנטר טיפול תרופתי עם תכשירים מונעי-ספיגת עצם כמו ביפוספונאטים או טיפולים הורמונאליים חלופיים בנשים עם אוסטאופורוזיס או היפר-קלצמיה. במטופלים האחרונים, ירידה תוך 3-6 חודשים של מעל 20% ברמת אוסטאוקלצין מרמת הבסיס שלו לפני תחילת הטיפולים, עשויה להעיד על יעילות הטיפול.
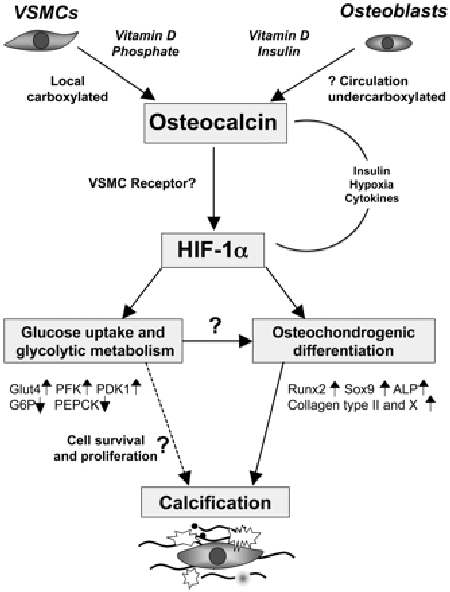
מקרא למונחים המופיעים בתרשים:
PFK או phosphofructokinase 1; פוספטאזה בסיסית מבוטאת על ידי ALP;
האנזים glucose-6-phosphatase מופיע כ-G6P;
האנזים pyruvate dehydrogenase kinase 1 מסומן כ-PDK1;
האנזים phosphoenolpyruvate carboxykinase מופיע כ-PEPCK,
Glut4 מבטא glucose transporter isoform 4.
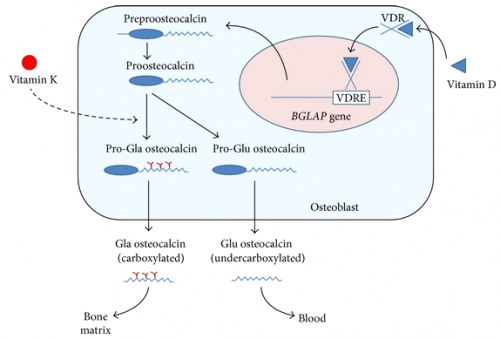
היבטים מבניים של אוסטאוקלצין
התכונה המציינת בעיקר את אוסטאוקלצין, היא קיומם של שלושה שיירי Gla. מדידות של NMR דו-ממדי וקריסטלוגרפיה בקרני X, מצביעים על מבנה תלת ממדי של החלבון המכיל שלושה אזורים סלילניים (helical), ליבה C טרמינאלית הידרופובית, וקצה N טרמינאלי משתנה. כל שלושת השיירים של Gla נמצאים במבנה הסלילני הראשון, והם מגיבים עם הסידן התוך-גרמי הנמצא בקשר עם הידרוקסי-אפטיט. הקצה ה-C טרמינאלי מתפשט כלפי חוץ, והוא זמין לאינטראקציה עם תאים סמוכים, כמו גם לפעילות פרוטאוליטית אנזימאטית (Dawd וחב' ב-Biochemistry משנת 2003, וכן Hauschka ו-Carr ב-Biochemistry משנת 1982 ו-Hoang וחב' ב- Nature משנת 2003).
צורת החלבון שעברה קרבוקסילציה מלאה היא זו הקושרת הידרוקסי-אפטיט ומצויה בשפע במשתית החוץ-תאית של העצם. לעומת זאת, צורת החלבון שעברה רק קרבוקסילציה חלקית, היא הצורה המופיעה בצירקולציה ומייחסים לה תכונות של הורמון המשתתף בוויסות ההומאוסטאזיס של גלוקוזה. אוסטאוקלצין מבוטא גם בתאי שריר חלק בדופן כלי הדם (VSMCs), למרות שמשמעות ממצא זה לא ידועה. בשנת 2011 פרסמו Idelevich וחב' ב-Artheriosclr Thromb Vasc Biol, שאוסטאוקלצין משמש כנראה כמווסת של התמיינות אוסטאו-כונדרוגנית של תאי שריר חלק המביאים למינרליזציה במצבים פתולוגיים. חוקרים אלה מצאו שבתנאי היפוקסיה, מושרה איתות של factor 1α, הגורם לאוסטאוקלצין לעודד ביטוי של גורמי שעתוק (transcription factors) ב-VSMCs כמו גם שינוי במטבוליזם התאי לכיוון של גליקוליזה. מחקר זה מספק את ההוכחה הראשונה שאוסטאוקלצין הוא גורם מרכזי בתהליך הסתיידות כלי-דם, תוך שהוא משפעל מסלולים המעודדים מינרליזציה.
הפעילות ההורמונאלית של אוסטאוקלצין
לגבי תפקידו של אוסטאוקלצין בצירקולציה, פריצת הדרך בהבנתנו את תפקיד חלבון זה מחוץ לרקמת העצם, הייתה בשנת 2007 כאשר מעבדתו של Gerard Karsenty דווחה שעכברי knock-out לאוסטאוקלצין היו שמנים, עם רמות גבוהות של גלוקוזה וליפידים, כמו גם עם רמות אינסולין נמוכות ונמצאה בהם סבילות (tolerance) לגלוקוזה. חוקרים אלה הוכיחו שלמולקולה שהיא undercarboxylated של אוסטאוקלצין יש השפעה חיובית על המטבוליזם של גלוקוזה (Lee וחב' ב-Cell משנת 2007). השפעה זו על חילוף חומרים אנרגטי, מסתייעת על ידי שדרוג של הפרשת אינסולין על ידי תאי β בלבלב ועל ידי יצירת אדיפונקטין ברקמת השומן, תהליכים המעודדים קליטת גלוקוזה בתאי רקמות רבות וניצולו ליצירת אנרגיה. שפעולם של מסלולים לאור איתות אינסולין, משרה "דו-שיח" בין אוסטאובלסטים ואוסטאוקלסטים, מה שמוביל לשפעול של תהליכי ספיגת עצם, ומעודד הפרשה נוספת של אוסטאוקלצין בצורתו ה- undercarboxylated (על פי Ferron וחב' ב-Cell משנת 2010).
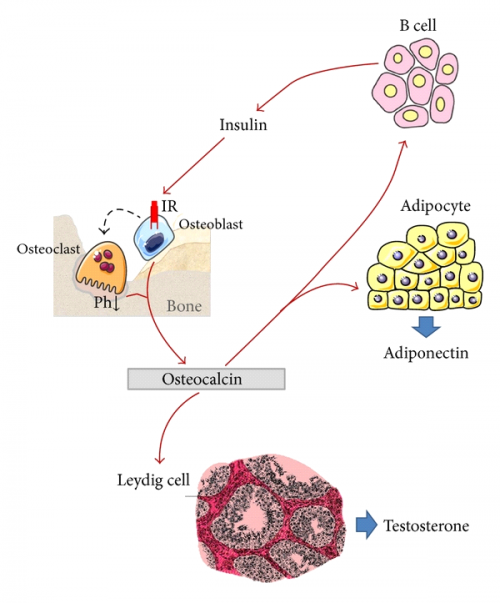
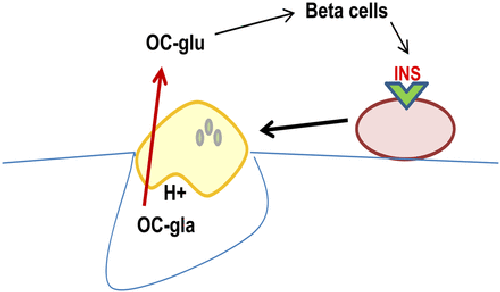
היה ידוע קודם לכן שאוסטאובלסטים מגיבים למספר גירויים הורמונאליים באופן שתאים אלה מפרישים פקטורים המשפיעים על אוכלוסיות תאים שונות בתוך העצם ובאיברים אחרים. לכן הוצעה פרדיגמה חדשה בדבר לולאה אנדוקרינית בתיווך אוסטאוקלצין הקושרת אוסטאובלסטים עם תאי β בלבלב ולאדיפוציטים (Ferron וחב' ב-Proc Natl Acad Sci USA משנת 2009). מה שהפתיע הייתה העובדה שהצורה ההורמונאלית של אוסטאוקלצין הייתה דווקא צורתו ה-undercarboxylated, כאשר צורתו עם קרבוסילציה מלאה לא הייתה פעילה הורמונאלית. בהמשך נמצא שהאנזים OST-PTP או osteotesticular protein tyrosine phosphatase קשור לשפעול של אוסטאוקלצין, וכן התברר שהאנזים הזה על ידי שהוא גורם לדה-פוספורילציה של הקולטן לאינסולין באוסטאובסטים, מעכב את פעילות אינסולין בתאים אלה. כמו כן, הראו Karsenty וחב' שהאיתותים של אינסולין באוסטאובלסטים מגבילים את יצירת osteoprotegrin, המעכב את הבשלתם של אוסטאוקלסטים.
הממצא האחרון מעודד ספיגת עצם על ידי אוסטאוקלסטים, באופן שמייצר מיקרו-סביבה חומצית, המאפשרת דה-קרבוקסילציה ועל ידי כך משפעלת את האוסטאוקלסטים.
מחקרים על השפעה כונדרוציטית של אוסטאוקלצין וכן השפעה על הסתיידות כלי-דם
במחקר של Idelevich וחב' הם טיפלו בחולדות בוויטמין D להשרות מינרליזציה של כלי דם. הם הדגימו שטיפול זה הביא לשדרוג של יצירת mRNA של אוסטאוקלצין, במקביל לדיפרנציאציה של אוסטאו-כונדרוציטית של VSMC, וכן להצטברות של אוסטאוקלצין בדופן כלי דם מסוידים. חוקרים אלה בחנו גם את הביטוי וההפרשה של אוסטאוקלצין בשורת תאי VSMC בעכברים, שהושרה בהם תהליך הסתיידות על ידי טיפול עם β-glycerophosphate. גם כאן הם מצאו שדרוג משמעותי של אוסטאוקלצין במקביל למינרליזציה מוגברת עם ביטוי מוגבר של Runx2 ו-Sox9, כאשר Runx2 הוא גורם שעתוק מרכזי הקושר לדיפרנציאציה של אוסטאובלסטים, ואילו SOX9 הוא גורם שעתוק הקשור לדיפרנציאציה של כונדרוציטים. תצפיות אלו הביאו את החוקרים להשערה שאוסטאוקלצין מתווך של דיפרנציאציה אוסטאו-כונדרוגנית של VSMCs.
במהלך ניסוי זה הבחינו חוקרים אלה בשינוי חשוב בגוון של נוזל תרבית התאים מה ששיקף עלייה בפעילות המטבולית של התאים. ממצא זה הביא אותם לבדוק האם אוסטאוקלצין מסוגל לגרום להשפעות מטבוליות בתאים וסקולאריים. ניסויים נוספים in vitro גילו שביטוי-יתר של אוסטאוקלצין, גרם לשפעול של קליטת גלוקוזה והסיט את תהליכי יצירת האנרגיה לכיוון של פירוק גליקוליטי מוגבר של גלוקוזה, שהיה מלווה על ידי שגשוג VSMCs. הצעד הבא היה לקבוע איזה גורמים עשויים להניע את השינויים המטבוליים המושרים על ידי אוסטאוקלצין. הם העריכו ש-HIF-1α הוא מועמד ראוי לבחון, על בסיס היותו משופעל בעת התפתחות העצם האנדוכונדראלית (התוך סחוסית) ואחראי לדיפרנציאציה של תאים אוסטאובלסטים, כמו גם לשדרוג אנזימים גליקוליטיים בכונדרוציטים (מה שמאפשר את הישרדותם בתנאי היפוקסיה השוררים בפלאטת הגדילה (על פי Schipani וחב' ב-Genes Dev משנת 2001), וכן לעידוד תהליך אנגיוגני במהלך האוסטאוגנזה (Wang וחב' ב-J Clin Invest משנת 2007).
בהתאם, הראו חוקרים אלה ש-HIF-1α משודרג בתאים וסקולאריים של עכבר בעת תהליך ההסתיידות, וכן ששדרוג זה התרחש במקביל לביטוי-יתר של אוסטאוקלצין. הוספה אקסוגנית של אוסטאוקלצין לתאי עכבר אלה, השרתה שפעול מהיר של HIF-1α, כמו כן לביטוי מוחש של טרנספורטרים של גלוקוזה ולפעילות מוגברת של אנזימים גליקוליטיים. חשוב לציין שההשפעות של אוסטאוקלצין אקסוגני, לא נמצאו בעכברים החסרים פעילות של HIF-1α, שהושגה על ידי שימוש ב-siRNA (או small interfering RNA). נמצא שביטויו של HIF-1α, מגביר באבי העורקים של חולדות מינרליזציה לאחר טיפול בוויטמין D. כמו כן, השתקת אוסטאוקלצין in vivo על ידי איסטרטגיה של siRNA, הפחיתה את היציבות של HIF-1α, מנעה את העלייה של Sox9 ובפעילות pyruvate dehydrogenase kinase 1, וכן עיכבה את המינרליזציה הווסקולארית בתגובה לוויטמין D. יחד עם זאת, פקטורים אחרים כמו Runx2 ואנזימים גליקוליטיים לא הושפעו על ידי השתקת אוסטאוקלצין. החוקרים Idelevich וחב' הסיקו מניסויים אלה, ש-HIF-1α יכול להיות משופעל על ידי אוסטאקלצין שמעודד בסופו של דבר תהליכי הסתיידות של כלי דם. יהיה מעניין לבחון האם knockdown סיסטמי של אוסטאוקלצין על ידי siRNA, משפיע על remodeling של העצם בחולדות, ועל תהליכי הסתיידות כלי-דם בחיות אלו.
חשוב לציין שנכון למחצית שנת 2015, ניסויים קליניים לא מצאו קשר ברור בין הרמות בצירקולציה של undercarboxylated אוסטאוקלצין, ותהליכי הסתיידות ואסקולארית: בחולים עם סוכרת type 2, רמות אוסטאוקלצין בנסיוב נמצאות במתאם הפוך עם brachial-ankle pulse wave velocity (על פי Kanazawa וחב' ב- J Clin Endocrinol Metab משנת 2009), אך יחד עם זאת לא נמצא כל קשר בין רמות אוסטאוקלצין לבין הסתיידות אבי העורקים הבטני על ידי Parker וחב' ב-Calcif Tissue Int משנת 2010.
השפעת אוסטאוקלצין על תפקוד האשכים ועל נושאי פוריות
ההדגמה שאוסטאוקלצין הוא בעל השפעה פיזיולוגית על האשכים דרך הוויסות של יצירת אנדרוגנים, נעשתה בניסויים עם עכברים הומוזיגוטיים -/- Esp וכן -/-Ocn המאופיינים על ידי חסר רציני או על ידי היעדר מוחלט של אוסטאוקלצין (Oury וחב' ב-Cell משנת 2011). למעשה, כאשר נקבות של עכברים הלוקות בחסר אוסטאוקלצין, שמרו על פוריותן ולא נמצא בהן כל אנומליה באיברי הרבייה, עכברים זכרים עם אותו פגם היו בעלי יכולת פריון מוגבלת, שהתבטאה בנפח מוקטן של האשכים, של יותרת האשכים (אפידידימיס) וכן בנפח מוקטן של בלוטות הזרע. בעכברים פגומים אלה נרשמה גם ירידה של 50% בספירת הזרע. לעומת זאת, בעכברים זכרים הומוזיגוטים רק ל -/-Esp, נמצאה הגדלה של נפח האשכים, ועלייה של 30% בספירת הזרע.
אף לא אחד מהפרמטרים הללו הושפע על ידי חסר ספציפי של הגן לאוסטאוקלצין בתאי Leydig בלבד, מה שמרמז שיצירת אוסטאוקלצין על ידי השלד, קשורה ישירות לוויסות האנדוקריני של תהליכי הרבייה הזכרית. יתרה מכך, מודלים אלה בעכברים הדגימו שחסר אוסטאוקלצין פוגע בהבשלה של תאי Leydig, ומפחית את סינתזת טסטוסטרון על ידי תאים אלה. למעשה, רמות האנדרוגנים בצירקולציה הופחתו באופן משמעותי בעכברים הומוזיגוטים -/-Ocn, והוגברו בעכברים הומוזיגוטים -/-Esp. ממצאים אלה תאמו לתוצאות ניסויים בתאים ex vivo, המראים שישנו גורם המופרש על ידי אוסטאובלסטים, אך לא על ידי תאים אחרים ממקור מזודרמאלי, שמסוגל להגביר את ייצור טסטוסטרון בפיסות רקמה (explants) הלקוחות מהאשכים או בתאי Leydig ראשוניים, אך לא מפיסות רקמה הנלקחות מהשחלות.
כאשר מוסיפים לתאי Leydig בתרבית החסרים אוסטאוקלצין, נוזל תרבית בה גידלו אוסטאובלסטים wild-type המכילים אוסטאוקלצין, הגבירו את הבשלתם של התאים המטופלים ואת ייצור טסטוסטרון בתאים אלה. השפעה זו לא נמצאה בשורות תאים אחרות. באותה סדרת ניסוים, בחינת היכולת של אוסטאוקלצין להגביר יצירת cAMP בתאי Leydig, הביאה לזיהוי של Gprc6a, שהוא קולטן טרנס-ממברנאלי הקשור לחלבוני-G, כקולטן פוטנציאלי של אוסטאוקלצין. קולטן זה מבוטא בתאי Leydig באדם ובעכברים, אך לא בתאי שחלה, מה שמספק בסיס מולקולארי להשפעה השונה מבחינה מגדרית, מה שמסביר את השפעת אוסטאוקלצין על פוריות הגבר.
בהתאם להשערה האחרונה, ביטול מוחלט של הגן Gprc6a בתאי Leydig גרם לירידה של ממש ברמת טסטוסטרון ובפריון של עכברים. ניתוח נוסף של נתונים, הראה שעל ידי קישור ל-Gprc6a, אוסטאוקלצין מווסת באופן התלוי ב-CREB את ביטוי האנזימים המשתתפים בסינתזה של טסטוסטרון בתאי Leydig. כדאי להזכיר ש-CREB או cAMP response element-binding protein, הוא גורם שעתוק תאי הנקשר למספר רצפים של DNA הידועים כ-CRE או cAMP response elements, ובכך מגביר או מפחית את שעתוקם של גנים שונים.
שאלה מרכזית המתעוררת בעקבות התצפיות האחרונות, היא האם השלד מווסת אף הוא את יצירת טסטוסטרון ואת הפריון הזכרי באדם. למרות שהמידע הקליני מוגבל בהקשר זה, התפרסמו לאחרונה 3 ניסויים שתומכים כנראה בהיפותזה של תפקיד של אוסטאוקלצין על בלוטות הרבייה הזכריות באדם. הניסוי הראשון שנערך בנערים צעירים במהלך צמיחת השלד שלהם, הראה שאוסטאוקלצין כרוך משמעותית ברמת טסטוסטרון בצירקולציה, שהיה גורם מרכזי בהיקף שכבת מסב העצם (periosteal circumference) שנקבעה בשיטת CT כמותית על עצם הרדיוס בשורש כף היד (Kirmani וחב' ב-J Bone Mineral Res משנת 2011). ממצאים אלה היו בולטים בעיקר בקבוצת הגיל של 11-14 שנה שאז צמיחת העצם והשלד היא בממוצע הנמרצת ביותר. לפיכך, בקבוצת גיל זו, הגברה של רמות אוסטאוקלצין כתוצאה מעלייה מהירה בצמיחת העצם, עשויה לעודד ביתר שאת את סינתזת טסטוסטרון באשכים, מה שכשלעצמו מעודד גידול במסת העצם. ממצא זה עשוי לפחות חלקית להסביר את העובדה שבסיום פאזת צמיחת השלד בגברים ממדי השלד גדולים מאלה של נשים למרות שצפיפות העצם בשני המינים דומה (Seeman ב-Lancet משנת 2002).
בניסוי אחר, שהתבצע במדגם של חולים בסוכרת type 2, נמצא מתאם טוב בין הרמות של undercarboxylated osteocalcin בצירקולציה לבין רמת טסטוסטרון חופשי (גם לאחר תיקון והתאמה לרמות FSH ו-LH), ולעומת זאת היה מתאם שלילי עם רמות HbA1C (על פי Kanazawa וחב' ב-Oseoporosis Int משנת 2012). ניסוי זה סיפק אישור נוסף למציאות של פעולה ישירה של אוסטאוקלצין על יצירת טסטוסטרון באשכים באדם, וסיפק הסבר פוטנציאלי לרמות הנמוכות של טסטוסטרון שמוצאים לעתים קרובות בחולי סוכרת (Corona וחב' ב-Int J Andrology משנת 2011). מתאם דומה בין רמות אוסטאוקלצין וטסטוסטרון, נמצא באוכלוסייה של 1,338 גברים (בגיל שבין 25 ל-86 שנה) באופן בלתי תלוי בסטאטוס הסוכרת שלהם, וכן במדגם קטן יותר של גברים על בעיות שלד או מפגעי עצם (Hannemann וחב' ב-Andrology משנת 2013).
רוב המידע על תפקידו של אוסטאוקלצין בצירקולציה ובפרט של המקטע ה-undercarboxylated על מאזן האנרגיה והוויסות של הפרשת אינסולין, נובע ממחקרים במודלים של עכברים בהם יצירת אוסטאוקלצין דוכאה או תוגברה. הניסוי המכונן הראשון של Lee וחב' שהתפרסם ב-Cell בשנת 2007, עשה שימוש במודל של עכברי knock-out, עם חסר הומוזיגוטי של הגן Esp, עכברים הידועים כ-Esp-/-KO. גן זה מקודד לאנזים tyrosine phosphatase חוץ-תאי, הידוע כ-osteoarticular protein tyrosine phosphatase או OST-PTP, אנזים המבוטא באופן בררני על ידי אוסטאובלסטים, כמו גם על ידי תאי גזע, ותאי Sertoli (על פי Mauro וחב' ב-J Biol Chem משנת 1994, ו-Dacquin וחב' ב-Develop Dynamics משנת 2004). פגיעה מכוונת בגן של אוסטאוקלצין בעכברים גורמת לעמידות לאינסולין, ולעומת זאת הוספה של חלבון זה מגבירה את הפרשת אינסולין מתאי β, והתבטאות אדיפונקטין באדיפוציטים (Yeap ב-Expert Review of Endocrinology & Metabolism משנת 2011).
ברקמת העצם, הגן האחרון עובר שדרוג בשלב ההתמיינות של אוסטאובלסטים ושקיעת משתית העצם אך הוא מדוכא בשלב המינראליזציה של אוסטאובלסטים. במודל חיות זה חסר של הגן Esp היה כרוך ברמות גבוהות של אדיפונקטין, וכן ברמות גבוהות של מקטע ה-undercarboxylated osteocalcin, וכן בהפרעה למטבוליזם של גלוקוזה. בעכברי -/-Esp נמצאה צריכת אנרגיה מוגברת, , הכרוכה בירידה בשומני הגוף, וברמות נמוכות של טריגליצרידים ושל חומצות שומן חופשיות. יצוין שבמודל עכברים זה ביטויו של הגן לאוסטאוקלצין לא השתנה, מה שמרמז לכך שהעלייה ברמת המקטע ה-undercarboxylated הייתה בלתי תלויה במנגנוני שעתוק.
רצף חומצות האמינו של אוסטאוקלצין בבעלי חוליות במהלך האבולוציה, מכיל כאמור את החלק המרכזי של החלבון המכיל את שלושת שיירי Gla. לאחר שלב השעתוק, אוסטאוקלצין עובר שלב של שינויי מבנה בתוך האוסטאובלסט, לפני שהוא מופרש מהתא. שינויים אלה כוללים פרוטאוליזה של ה-prepropeptide, וקרבוקסילציה של שלושה שיירי חומצה גלוטמית בעמדות 17, 21 ו-24 (על פי Hauschka וחב' ב-Physiol Rev משנת 1989). ויטמין D מעודד ישירות את תהליך השעתוק של אוסטאוקלצין, ואילו ויטמין K מווסת את תהליכי הקרבוקסילציה. בנוסף, גורמי גדילה אחדים, הורמונים או ציטוקינים משתתפים במודולציה של יצירת אוסטאוקלצין, על ידי שהם משפיעים על הגן BGLAP המקודד לאוסטאוקלצין, וממוקם בכרומוזום 1 בעמדה 1q25-q21 (על פי Vullafan-Bernal וחב' ב-Int J Mol Med משנת 2011).
גן זה בדרך כלל מדוכא בשעת השגשוג של אוסטאובלסטים, ועובר שעתוק במהלך הדיפרנציאציה של אוסטאובלסטים. למרות שאוסטאוקלצין מופרש על ידי אוסטאובלסטים בעת יצירת עצם ונקשר למשתית העצם העתירה במינראלים, תפקידו המדויק של חלבון זה במטבוליזם של העצם אינו ברור לחלוטין. גישות ניסוייות שונות, הדגימו שאוסטאוקלצין מעודד את הגיוס של וההתמיינות של מונוציטים וקודמנים (precursors) של אוסטאוקלסטים מהצירקולציה, מה שמצביע על תפקידו של חלבון זה באינטראקציה בין אוסטאובלסטים ואוסטאוקלסטים ותהליכי ספיגת עצם (Mundy ו-Poser ב-Calcified Tissue International משנת 1983, ו-Glowacki ו-Lian ב-Cell Differentiation משנת 1987). בהקשר לתצפיות אלה, הניסוי של Glowacki ו-Lian הראה שאוסטאוקלסטים מתקשים לספוג אזורי עצם החסרים אוסטאוקלצין.
במפתיע ובניגוד מוחלט לממצאים האחרונים שהושגו במערכות in vitro, נמצא בעכברים טרנסגניים בהם דוכא הגן לאוסטאוקלצין, שעכברים אלה לא סבלו מפגיעות שלד, ואף נמצאה בהם צפיפות עצם מוגברת ללא כל שינוי בספיגת עצם או במינרליזציה שלו (Ducy וחב' ב-Nature משנת 1996). לאחרונה, ניסויים במודלים של עכברים בהם הושרה ביטוי מוגבר של אוסטאובלסטים, או יצירה מופחתת של אוסטאוקלסטים, הראו שחלבון זה עשוי להיות תפקיד אנדוקריני חשוב, מחוץ לרקמת העצם, על ידי רגולציה של ההומאוסטאזיס של גלוקוזה ושל ליפידים, וכן השפעה על יצירת טסטוסטרון באשכים (Ng ב-Clin Endocrinol משנת 2011, וכן Ducy ב-Diabetologia משנת 2011 ו-Karsenty ו-Ferron ב-Nature משנת 2012).
מחקרים באדם
אוסטאוקלצין-חולייה מקשרת בין מטבוליזם של עצם וגלוקוזה
בשנים האחרונות התגברה תשומת הלב ליחסי הגומלין בין סוכרת למסת העצם. נמצא שמסת העצם בדרך כלל נמוכה יותר במטופלים עם סוכרת type 1, אך גבוהה יותר בחולים עם סוכרת type 2, בעיקר בקרב אלה שהם כבדי משקל. אי הקפדה על רמת גלוקוזה בסוכרתיים, רמות נמוכות של אינסולין ושל insulin like growth factor-1, יצירת עצם נמוכה ושינויים במטבוליזם של ויטמין D, כל אלה נכרכו בפתוגנזה של שינויים במסת העצם, ושל סכנת שברים בחולי סוכרת ( Schwartz ב-Calcif Tissue Int משנת 2003, ו-Vestergaard ב- Osteoporos Int משנת 2007). פקטורי עצם פעילים אחדים מבוטאים הן באדיפוציטים וכן בתאי-β (על פי Reid ב-Osteoporos Int משנת 2008), ואינסולין הוא גורם אנאבולי מאוד יעיל כלפי רקמת עצם, עם השפעה מיטוגנית ישירה על אוסטאובלסטים (Ogata וחב' ב-J Clin Invest משנת 2000).
מחקרים עדכניים במערכות תאי אדם, מצביעות על קשר בין אוסטאוקלצין בצירקולציה לבין פעילות אינסולין, אם רוב המחקרים אינם מודדים גורמים בוני עצם אחרים כגון propeptide of type I collagen, על מנת לבחון את תפקידם של אוסטאובלסטים בתיווך פעילות אינסולין ברקמת העצם. כך למשל מחקרים עד כה לא בחנו את כל הצורות של אוסטאוקלצין (undercarboxylated OC בהשוואה ל-carboxylated OC, מבחינת השפעתם על פעילות אינסולין (Fernandez-Real וחב' ב-J Clin Endocrinol Metab משנת 2009 ו-Shea וחב' ב-Am J Clin Nutr באותה שנה). רמות נמוכות של אוסטאוקלצין כרוכות בעמידות לאינסולין באדם, לסוכרת ולתסמונת מטבולית, בניסויים תצפיתיים.
נתוני קרבוקסילציה אלה חיוניים בהערכת התפקיד של ויטמין K בבקרה של סוכרת, ואמנם נתוני מחקרים שונים מצביעים על תפקידו של ויטמין זה בהיבט של תנגודת לאינסולין. Beulens וחב' ב-Diabetes Care משנת 2010 ו-Yoshida וחב' ב-Am J Clin Nutr משנת 2008, הראו שצריכה מוגברת של מזון עתיר בוויטמין K הפחיתה את התנגודת לאינסולין ואת הסיכון לסוכרת type 2. יתרה מכך, אספקה למשך שבוע של ויטמין K שיפרה את התגובה של הפרשת אינסולין לאחר העמסה פומית של גלוקוזה, באנשים צעירים עם רמת ויטמין K נמוכה בבסיס הניסוי (Sakamoto וחב' ב-Clin Nutr משנת 2000). יחד עם זאת, נרשמו תוצאות סותרות בניסויים של חוקרים שונים: אספקה משלימה של ויטמין K למשך 3 שנים הראתה השפעה חיובית על תנגודת לאינסולין בגברים מבוגרים (Yoshida וחב' ב-Diabetes Care משנת 2008), ולעומת זאת לא נמצאה כל השפעה של מתן ויטמין K משך שנה (Kumar וחב' ב-Am J Clin Nutr משנת 2010). האנזים carboxylase התלוי לפעילותו בוויטמין K נמצא מבוטא בבלוטת הלבלב, אך ייתכן שלוויטמין זה יש פונקציות נוספות פרט לתפקידו הקלאסי כקו-פקטור של gamma-carboxylation.
סמני מטבוליזם של רקמת העצם
איגוד האוסטאופורוזיס הבינלאומי (IOF) והפדרציה הבינלאומית לכימיה קלינית ( IFCC) ממליצים על 2 סמנים להערכת turnover של העצם:
- C-telopeptide הידוע גם כ-CTX או C-terminal telopeptide of type 1 collagen, שהוא סמן של ספיגת עצם. זהו מקטע פפטידי מהקצה הקרבוקסי-טרמינאלי של המשתית (matrix) החלבונית שנמצא בשימוש לניטור תרפיה נוגדת ספיגת עצם כמו בי-פוספונאטים ו-HRT בנשים בגיל חידלון הווסת, או באנשים עם מסת עצם ירודה (osteopenia) .
- P1NP או procollagen type 1 N-terminal propeptide שהוא סמן לצירת עצם הנוצר באוסטאובלסטים, ומשקף את קצב יצירת קולאגן ועצם.
סמנים אחרים בדם ובשתן המשמשים פחות לספיגת עצם כוללים: N-telopeptide או NTX וכן N-terminal telopeptide of type 1 collagen, שהוא מקטע פפטידי מהקצה ה-N טרמינאלי של המשתית החלבונית, שאף היא משמשת לניטור טיפולים; DPD או deoxypyridinoline שהוא תוצר פירוק של קולאגן עם מבנה טבעתי; קשרי צילוב של pyridinium-תוצרי פירוק של קולאגן הכוללים DPD ו-PYD או pyridolline, שמשמש לניטור טיפולי אך אינו ספציפי לקולאגן העצם באותה מידה כמו ה-telopeptides; הווריאנט של האנזים פוספטאז חומצי (acid phosphatase ) הרגיש לחומצה טרטארית , המיוצר על ידי תאים אוסטאוקלסטים, אם כי מבדק זה נחשב מיושן ואינו בשימוש כיום.
סמנים נוספים המשמשים לעתים להערכה של בניית עצם הם:
- איזואנזים ספציפי לעצם של האנזים פוספטאז בסיסית (ALP) שמשחק כנראה תפקיד במינרליזציה של העצם.
- אוסטאוקלצין המבטא את הקצב של יצירת העצם, והוא גם אינדיקטור שימושי להערכת תפקוד אוסטאובלסטים.
בגברים יש תנודות יומיות (circadian variations) לאורך היממה בסדר גודל של 5-10 ננוגרם/מ"ל ברמות אוסטאוקלצין (Gundberg וחב' ב-J Clin Endocrinol Metab משנת 1985). הרמות הנמוכות ביותר בנסיוב נמדדות בשעות אחר הצהריים המאוחרות, ואילו הרמות הגבוהות ביותר נמדדות בחצי הלילה (Gundberg וחב' ב-Methods Enzymol משנת 1984). יש לקחת בחשבון שאכילה רבה במיוחד של ירקות עתירי ויטמין K יכולה לתת תוצאות מוגברת של החלבון הנמדד.
שיטות מדידת אוסטאוקלצין
מקובל במעבדות רבות למדוד חלבון זה במכשיר Cobas 6000 E601, של חברת Roche. הערכה של Roche פועלת על בסיס העיקרון של 2-site immunometric (sandwich) assay, עם גלאי של electrochemiluminescence. עיקרון השיטה הוא כדלקמן: דגימת נסיוב של הנבדק, נוגדן חד-שבטי מסומן בביוטין המכוון כנגד N-MID osteoclalcin, ונוגדן חד-שבטי מסומן עם rhutenium המכוון כנגד N-MID osteocalcin המגיב ליצירת קופלקס. תערובת זו מוספת למיקרו-חלקיקים מצופים ב-streptavidin המשמשים כ-solid phase אליו נקשר הקומפלקס בגין הזיקה הגבוהה בין ביוטין ל-avidin. לאחר פרק זמן של הדגרה, מועבר מתח חשמלי דרך אלקטרודה המשרה פליטה (emission) של chemiluminescence מה-ruthenium, הנמדדת כנגד עקומת כיול לקבוע את רמת אוסטאוקלצין בדגימה הנבדקת.
כיוון שנוגדנים שונים מזהים מקטעים שונים באוסטאוקלצין לא קיים נכון להיום סטנדרט למדידת רמת חלבון זה בפלזמת הדם. נוגדנים המזהים גם את המולקולה השלימה וגם את המקטע הגדול N-MID) ) המכיל את חומצות אמינו 1-43, מספקים מידע עדיף. ערכות מסחריות למדידת אוסטאוקלצין בנסיוב, לוקות בחסר סטנדרטיזציה שכן נוגדנים חד-שבטיים שונים מזהים מקטעים שונים על פני החלבון (Watts ב-Clin Chem משנת 1999, ו-Diaz Diego ב-Clin Chem משנת 1994). רמות אוסטאוקלצין שנמדדו באותה דגימת נסיוב על ידי 6 מעבדות שונות, הניבה מגוון תוצאות שהשוני ביניהן הגיע עד הבדלים של פי-4. תוצאות יותר הדירות יכולות להתקבל אם רמת אוסטאוקלצין מבוטאת כאחוז של רמת חלבון זה בדגימות של אנשים בריאים (Delmas וחב' ב-J Bone Miner Res משנת 1990).
הוראות לביצוע הבדיקה
יש להיות בצום של 12 שעות (Garnero וחב' ב-J Bone Miner Res משנת 2003, ו-Bauer וחב' ב- J Bone Miner Res 1999 משנת 1999). יש ליטול את הדם במבחנה כימית (פקק אדום או צהוב). יש לפסול דגימה המוליטית מאוד, אך ניתן להשתמש בדגימה עם המוליזה קלה. הדגימה ניתנת לשימוש גם אם היא ליפמית מאוד. יציבות הבדיקה 14 יום כדגימה קפואה (מועדפת), או עד 72 שעות בקירור רגיל. מטופלים במינונים גבוהים של ביוטין (מעל 5 מיליגרם ליום) חייבים להמתין לפחות 8 שעות מאז נטילת בּיוטין האחרונה לפני לקיחת דם לצורך מדידת אוסטאוקלצין על מנת למנוע השפעת הוויטמין על רמת אוסטאוקלצין הנמדדת.
כיוון שאוסטאוקלצין מתפנה על ידי הכליות, בנבדקים עם פעילות כליות לא אופטימאלית יכולה להתקבל רמה מוגברת של לחלבון זה, אף ללא turnover מוגבר של העצם. כמו כן רמות אוסטאוקלצין בנסיוב עלולות לא לשקף יצירת עצם במטופלים עם 1,25 dihydroxy vitD, כיוון שהורמון זה מווסת על ידי ויטמין זה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 