הבדלים בין גרסאות בדף "אי התאמת RH והידרופס עוברי אימוני - RH incompatibility and immune hydrops fetalis"
| (201 גרסאות ביניים של 3 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=RHtest.jpg |
|כיתוב תמונה= | |כיתוב תמונה= | ||
|שם עברי= אי התאמת RH והידרופס עוברי אימוני | |שם עברי= אי התאמת RH והידרופס עוברי אימוני | ||
| שורה 10: | שורה 8: | ||
|ICD-9= | |ICD-9= | ||
|MeSH= | |MeSH= | ||
| − | |יוצר הערך= דר' מאור ממן | + | |יוצר הערך= דר' מאור ממן |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| + | {{הרחבה|ערכים=[[הידרופס עוברי]], [[אי התאמת RH]]}} | ||
| + | הסיבה ל[[הידרופס עוברי]] מוגדרת לרוב לפי 2 קבוצות- חיסוני ו[[הידרופס עוברי לא אימוני - Non-immune hydrops fetalis|לא חיסוני]]. במהלך כל ההריונות כמות קטנה מאוד של דם עוברי מגיעה לרווחים בין הסיסים (Intervillous spaces) והדבר יכול לגרום ל[[איזואימוניזציה]] (Isoimmunization). נוגדן נגד D{{כ}} (Anti-D) {{כ}}הוא הכי שכיח. לאור מתן [[Anti-D immunoglobulins]] מניעתי, חלק גדול יותר של מקרי מחלת [[תמס דם]] (Hemolysis) בעובר נגרמים מאנגדים (Antigens) פחות שכיחים. ניהול המקרה מבוסס על מעקב אחר כייל הנוגדנים האימהי, מעקב [[על-שמע]] אחר זרימת שיא סיסטולית בעורק מוח תיכון (MCA-PSV{{כ}} ,Peak Velocity of Systolic Blood Flow in the MCA), הערכת רמת [[בילירובין]] ב[[מי השפיר]] ו[[דגימת דם עוברי]] (Cordocentesis). אחד הסימנים ל[[אנמיה]] חמורה הוא רישום סינוסואידלי (Sinusoidal) של [[מוניטור עובר|דופק העובר]]. עם אבחנת אנמיה, [[הגדלת כבד]], הידרופס או הפרעה בניטור עוברי, הניהול יתקדם לפי שבוע ההיריון. סמוך למועד יש ליילד, לפני המועד יש לקחת דגימת דם עוברית ולתת [[עירוי דם]] לפי הצורך. | ||
| + | ==אפידמיולוגיה== | ||
| − | + | מס' מחקרים גדולים הראו נוגדנים נגד כדוריות דם אדומות ב- 1% מההריונות. 40-60% מתוכם מכוונים נגד אנגדים CDE.{{כ}} נוגדן נוגד-D הוא הכי שכיח ואחריו c ,E ו-C. נוגדנים נוגדי-Kell שכיחים גם הם. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ==אטיולוגיה== | |
| − | + | ===[[הידרופס עוברי]] חיסוני=== | |
| − | [[ | + | לא ברור לגמרי מנגנון התפתחות ההידרופס, ייתכן ונובע מ[[אי-ספיקת לב]], מאנמיה, מיעוט חמצן (Hypoxia), {{כ}}[[יתר-לחץ-דם פורטלי]], והפחתה בלחץ הקולואיד-אונקוטי (Colloid osmotic pressure) מ[[אי ספיקת כבד]] ותת-[[חלבון בדם]] (Hypoproteinemia). |
| + | מס' מחקרים הראו כי הגורם העיקרי המשפיע על חומרת ה[[מיימת]] הוא דרגת משך האנמיה. גורמים נוספים: תת-חלבון בדם מאי ספיקת כבד ודלף אנדותליאלי (Endothelial leak), כתוצאה ממיעוט חמצן רקמתי. שני האחרונים גורמים לאיבוד חלבונים וירידה בלחץ קולואיד-אונקוטי המחמיר את ההידרופס. ניקוליידס נטל דגימת דם מהעורק הטבורי העוברי ב-17 עוברים עם איזואימוניזציה חמורה בשבועות 18-25 ומצא רמת [[ספירת דם - Complete blood count|המוגלובין]] (Hemoglobin) נמוכה מ- g/dL{{כ}} 3.8 בכל העוברים עם הידרופס וריכוז חלבונים בפלזמה (Plasma) נמוך ביותר משתי סטיות תקין. לחלופין, אף עובר עם המוגלובין גבוה מ- g/dL{{כ}} 4 לא היה הידרופי. | ||
| − | + | תמס דם ממושך גורם לאנמיה, המביאה לייצור יתר של השורה האריתרואידית (Erythroid hyperplasia) במח העצם ולייצור תאי דם אדומים (Erythropoiesis) חוץ-לשדי בטחול ובכבד, שיובילו בסוף לאי-ספיקת כבד. | |
| − | + | ;[[אנמיה]] | |
| − | + | לאחר שבוע 35, ההמוגלובין העוברי הממוצע עומד על g/dL{{כ}} 17 וערך נמוך מ-g/dL{{כ}} 14 נחשב לא תקין. לאחר הלידה ההמוגלובין של הילוד יכול לעלות עד 20% מערכו כתוצאה מזרימת דם מהשליה. | |
| − | + | McDonald ו-Middleton {{כ}} (2008) פרסמו סקירה של 11 עבודות עם 3,000 לידות, שהשוו סגירה (Clamping) מוקדמת מול סגירה מאוחרת של חבל הטבור. סגירה מאוחרת היתה קשורה לעליה של g/dL{{כ}} 2.2 בהמוגלובין, דבר שהכפיל את רמת ה[[צהבת הילוד – Neonatal jaundice|היפרבילירובינמיה]] (Hyperbilirubinemias) שהצריכה [[טיפול באור]] (Phototherapy). | |
| − | + | לחלופין, במקרים של [[היפרדות שליה]], התנקבות/ קרע של כלי דם עוברי או כשהתינוק מוחזק מעל גובה השליה לפני קשירת חבל הטבור, ההמוגלובין יכול לרדת. | |
| − | |||
| − | [[ | ||
| + | ===[[איזואימוניזציה]]=== | ||
| − | אם | + | קיימות 29 קבוצות דם ויותר מ-600 אנגדים על כדוריות הדם האדומות. רובם נדירים וחסרי משמעות קלינית. כל אדם שחסר את אחד האנגדים יכול לפתח נוגדנים אם ייחשף לאנגד. הנוגדנים יכולים לגרום נזק לאחר קבלת מנת דם, או לעבור לעובר בהריון. |
| + | * '''[[דימום מהעובר לאם]]''' (Fetal-to-maternal hemorrhage)- במהלך כל ההריונות כמות קטנה מאוד של דם עוברי מגיעה לרווחים בין הסיסים. הדבר יכול לגרום לאיזואימוניזציה. Choavaratana וחב' (1997) ביצעו [[בדיקת KB|בדיקות KB]]{{כ}} (Kleihauer-Betke) ב- 2,000 נשים הרות ומצאו שלמרות שכיחות גבוהה בכל שליש של דימום מהעובר לאם, נפח הדם שעבר היה קטן מאוד. לא ברור באיזו שכיחות יש מעבר של יותר מ-30 מ"ל. יש שהראו שכיחות של 4% גם בלידה רגילה וגם ב[[ניתוח קיסרי]]. הטבלה הבאה מסכמת גורמים לדימום מעובר לאם שיכול לגרות איזואימוניזציה: | ||
| − | + | * '''דימום מהאם לעובר''' (Maternal-to-fetal hemorrhage)- ידוע כיום כי כמעט בכל ההריונות, כמות קטנה של דם אימהי נכנסת למחזור הדם העוברי. הדבר לרוב חסר משמעות. לעתים נדירות עובר D שלילי נחשף לאנגד D ועובר ריגוש. כאשר עוברית כזאת מגיעה לבגרות, היא תייצר נוגדנים נוגדי-D מוקדם בהריונה הראשון (ואולי אף לפניו). מנגנון זה של איזואימוניזציה נקרא: "תורת הסבתא" (The grandmother theory), מאחר והעובר נמצא בסכנה מנוגדנים שנוצרו מחשיפה לתאי דם של הסבתא שלו. | |
| − | === | + | ====פתופיזיולוגיה==== |
| − | + | לרוב האנשים לפחות אנגד אחד שקיבלו מהאבא וחסר אצל האמא. עם זאת שיעור איזואימוניזציה נמוך מאחר ו- | |
| + | #שכיחות נמוכה של חוסר התאמה אנגדית. | ||
| + | #מעבר שלייתי לא מספיק של נוגדנים אימהיים או של תאי דם עובריים. | ||
| + | # [[אי התאמת ABO|חוסר התאמה בקבוצות ABO]] בין אם לעובר (Maternal-fetal ABO incompatibility) מביא להרס הכדוריות העובריות שעברו לאם, עוד בטרם הן מעוררות תגובה חיסונית. | ||
| + | # חלק מהאנגדים מעוררים תגובה מזערית. | ||
| − | [[ | + | לפיכך, לכל הנשים בהריון סיכון של 1% בלבד לפתח איזואימוניזציה של D {{כ}}(D-isoimmunization) עד 6 חודשים לאחר הלידה ובכל מקרה, לא כל איזואימוניזציה גורמת ל[[אריתרובלסטוזיס עוברי]] (Erythroblastosis fetalis) . לאמא D-שלילית{{כ}} (D-negative) היולדת עובר D-חיובי{{כ}} (D-positive) ללא אי התאמת ABO, סיכון של 16% לפתח איזואימוניזציה. ל-2% יהיו נוגדנים בלידה, ל-7% יהיו נוגדנים עד 6 חודשים לאחר הלידה ו-7% יוגדרו "ניתנות לריגוש" ("Sensibilized") עם רמת נוגדנים נמוכה, שלא ניתנת לזיהוי במהלך או לאחר ההריון הנוכחי ונזהה אותן מוקדם בהריון הבא, לאחר ריגוש חדש מעובר חדש שהוא D-חיובי. |
| − | + | ;[[אי התאמת ABO|ABO]] | |
| − | + | חוסר התאמה בקבוצות הדם B,A הינו הגורם השכיח ביותר למחלת תמס דם של הילוד, האנמיה לרוב קלה. כ- 20% מהעוברים הם חסרי התאמת ABO, רק 5% נפגעים קלינית. קיימים מס' הבדלים מ[[חוסר התאמה הקשורה ל-D]]: | |
| − | + | *חוסר התאמת ABO נראה לרוב בילוד הראשון, מאחר ולרוב הנשים עם סוג דם O יש נוגדנים Anti-A ו-Anti-B, שהופיעו מחשיפה לחיידקים הנושאים את אותם הגנים. | |
| − | + | *רוב הנוגדנים Anti-A ו-Anti-B הם [[אימונוגלובולין M]]{{כ}} (IgM,{{כ}}Immunoglobulin) , שאינם יכולים לעבור שליה ובנוסף, כדוריות דם אדומות עובריות מבטאות פחות אנגדים A ו-B, בהשוואה למבוגר ולכן, הן פחות מעוררות תגובה חיסונית. לפיכך, אין צורך ב[[מעקב הריון]] מיוחד או ב[[השראת לידה|יילוד מוקדם]]. | |
| − | + | *המחלה קלה יותר בהשוואה לאיזואימוניזציה-D ונדיר שתגרום לאנמיה. עוברים שנפגעו לא יפתחו אריתרובלסטוזיס עוברי אלא [[אנמיה של הילוד]] (Neonatal anemia) ו[[צהבת הילוד|צהבת]] שתטופל בטיפול באור. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | חוסר התאמה בקבוצות הדם B,A הינו הגורם השכיח ביותר | ||
| − | *חוסר | ||
| − | *רוב הנוגדנים | ||
| − | *המחלה קלה יותר בהשוואה לאיזואימוניזציה-D ונדיר שתגרום לאנמיה. עוברים שנפגעו לא יפתחו | ||
*בהריונות הבאים, בניגוד למחלת CDE, אין מחלה מתקדמת. | *בהריונות הבאים, בניגוד למחלת CDE, אין מחלה מתקדמת. | ||
| − | |||
חוסר התאמת ABO נחשבת מחלה בטיפול רופאי הילדים ואינה בעיה מיילדותית. | חוסר התאמת ABO נחשבת מחלה בטיפול רופאי הילדים ואינה בעיה מיילדותית. | ||
| − | + | ;[[אי התאמת RH{{כ}}|Rhesus) CDE)]] | |
| + | חמישה אנגדים: e ,E ,D ,c ,C (אין Rh- .(d מתייחס להעדר אנגד D. האנגדים הללו חשובים כי רוב האנשים מפתחים נוגדנים לאחר חשיפה בודדת. קיימים שני גנים: D ו-CE הממוקמים בכרומוזום 1 ומועברים יחד בתורשה ללא קשר לקבוצות הדם האחרות. שכיחות האנגדים משתנה בין גזעים, למשל - 99% מהאינדיאנים והסינים הם D חיובים, לעומת 93% מהאפרו-אמריקאים ו-87% מהלבנים. בקרב הבסקים נרשמה השכיחות הגבוהה ביותר (34%) של D שלילי. | ||
| − | + | החיסוניות של : e ,E ,c ,C נמוכה מזאת של D אך עדיין יכולה לגרום לאריתרובלסטוזיס עוברי. יש לבדוק את כל הנשים ההרות להימצאות אנגד D ונוכחות נוגדנים בנסיוב. בנשים D חיוביות מספיקה בדיקה אחת בכל הריון. | |
| − | + | ;קבוצות דם אחרות | |
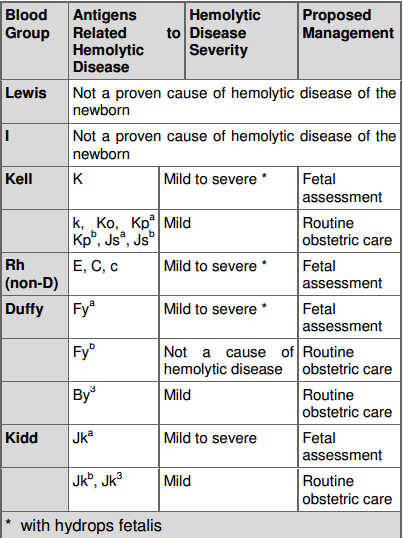
| − | + | לאור מתן [[Anti-D immunoglobulins]] מניעתי, חלק גדול יותר של מקרי מחלת תמס דם בעובר נגרמים מאנגדים פחות שכיחים. החשד עולה עם מציאת נוגדנים ב[[בדיקת קומבס]] לא ישיר (Indirect coombs). בטבלה הבאה מופיעים חלק מהאנגדים והקשר שלהם למחלת תמס דם. | |
| − | + | [[קובץ:המוליט2.png|500px|מרכז]] | |
| − | |||
| − | + | בנוסף, רבע מכל הנוגדנים מכוונים כנגד מערכת לואיס (Lewis system) והם אינם גורמים לתמס דם מאחר ואנגדים מסוג לואיס אינם מתפתחים על תאי הדם העובריים ויופיעו רק מספר שבועות לאחר הלידה. | |
| − | + | ;[[אי התאמת Kell|אנגד Kell]] | |
| − | + | 90% מהלבנים הם Kell-שליליים, ונוכחות האנגד אינה נבדקת באופן שגרתי. 90% ממקרי הריגוש עם נוגדן נגד Kell נגרמים בעקבות מתן מנות דם. בדומה ל-CDE, ריגוש מ-Kell יכול להיגרם מחוסר התאמה בין אם לעובר. | |
| − | + | המחלה יכולה להיות קשה יותר מאחר והנוגדנים נוגדי-Kell נקשרים גם לתחילנים (Precursors) של כדוריות הדם האדומות במח העצם ומונעים תגובה של ייצור תאי דם אדומים באנמיה. האנמיה תהיה מהירה יותר בהופעתה וחמורה יותר מבאי התאמת RH. במקרה כזה מיוצרות פחות כדוריות אדומות ויש פחות בילירובין במי השפיר. כתוצאה מכך, לא ניתן לצפות אנמיה עוברית על סמך כייל הנוגדנים האימהיים נוגדי-Kell או רמת בילירובין במי השפיר. לכן, יש המציעים לבצע הערכה כבר כאשר הכייל האימהי של נוגדי-Kell מגיע ל-1:8 ולבצע הערכה המבוססת על דגימת דם עוברי ולא דיקור מי שפיר להערכת רמת בילירובין. | |
| − | + | Van Wamelen ושות' (2007) דיווחו על 41 נשים והסיקו, כי יש לבצע מעקב מעקב קפדני אחר סימני אנמיה לפי בדיקת זרימת שיא סיסטולית בעורק המח התיכוני החל משבוע 16-17, החל מכייל נוגדי-Kell של 1:2 . | |
| − | + | ==קליניקה== | |
| − | + | אם העובר מפתח אנמיה קשה, יופיע דופק סינוסואידלי, אשר אינו ייחודי רק לאנמיה עוברית, אך מחייב ברור מיידי. אנמיה המתפתחת באופן הדרגתי וכרוני נסבלת טוב יותר ע"י העובר בהשוואה לאנמיה חריפה, הגורמת להפרעות עצביות עקב ירידה בהזלפה (Perfusion) המוחית, איסכמיה (Ischemia) ונמק. אנמיה כרונית לא בהכרח תגרום לשינויים בדופק העוברי עד לשלב בו העובר נוטה למות. De Alemida ו-Bowman {{כ}}(1994) תיארו 27 מקרים של דימום עוברי גדול מ-80 מ"ל. למרות טיפול נאות, כמחצית מהילודים מתו או פיתחו [[שיתוק מוחין|שיתוק דו-צידי עוויתי]] (Spastic diplegia). עפ"י Samadi וחבריו (1996), דימום חמור מהעובר לאם גרם ל-5% ממקרי [[לידת מת]]. | |
| − | + | הצטברות של נוזל ביותר ממדור אחד בגוף, כמו למשל מיימת, ו[[תפליט אדרי]] (Pleural effusion), מוגדרים כהידרופס עוברי . תיתכן הגדלה של הלב ו[[דימום ריאתי]]. הנוזלים מצטברים בבית החזה, בחלל הבטן או בעור. השליה בצקתית ומוגדלת, מכילה פסיגים (Cotyledon) בולטים וסיסים (Villus) בצקתיים. הנוזל האדרי יכול להפריע להתפתחות הריאות. מיימת והגדלת הכבד ו[[טחול מוגדל|הטחול]] יכולים לגרום להפרעה בהתפתחות הלידה. עוברים הידרופים יכולים למות ברחם מאנמיה ו[[אי ספיקת לב]]. | |
| − | + | השינויים ההידרופים בשליה, הגורמים להגדלת השליה, יכולים לגרום לקדם-[[רעלת ההריון]] (Preeclampsia). האם עם קדם-רעלת ההריון יכולה לפתח [[בצקת|בצקות]] קשות המחקות את העובר - מה שמכונה תסמונת מראה (Mirror syndrome). | |
| − | + | ==אבחנה== | |
| − | ( | + | ===דימום מהעובר לאם=== |
| + | ניתן לזהות תאי דם אדומים של העובר במחזור הדם האימהי באמצעות '''[[בדיקת KB|תבחין ה-KB]]'''. כדוריות הדם העובריות מכילות המוגלובין F אשר עמיד יותר לפרוק בחומצה בהשוואה להמוגלובין A. לאחר חשיפה לחומצה רק המוגלובין עוברי שורד, כך שניתן לזהות תאי דם אדומים עובריים במשטח הקפי אימהי עם צביעה מתאימה. המבחן לרוב מדויק, אלא אם כן לאמא יש [[המוגלובינופתיה]] (Hemoglobinopathy) המעלה את שיעור ההמוגלובין F שלה. בתמונה ניתן לראות את תאי הדם האדומים העובריים הנצבעים כהה לעומת התאים האימהיים הבהירים עם כמות קטנה של המוגלובין F: | ||
| − | + | בנוסף, ניתן להשתמש בתאים העובריים הללו לסקר ל[[אנאפלואידיה]] (Aneuploidy). ידוע כי תאים עוברים מסוג תאי גזע או לימפוציטים (Lymphocytes) יכולים לשרוד ברקמות אימהיות שונות (Maternal-fetal hybridization/ microchimerism) זמן רב ולגרום לתגובה אוטואימונית (Autoimmune), [[זאבת]], [[טרשת רב-מערכתית]] ו[[דלקת בלוטת התריס]]. | |
| − | + | ניתן להעריך את נפח הדמם העוברי לפי תוצאות תבחין KB תוך שימוש בנוסחה הבאה: | |
| − | + | [[קובץ:Fblood.png|500px]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | כך למשל באישה ממוצעת עם נפח דם של 5,000 מ"ל, [[המטוקריט]] (Hematocrit){{כ}} 35% ותוצאה של 1.7% תאים חיוביים ב-KB , כאשר המטוקריט העובר 50% נקבל: | |
| − | + | X 0.35 X 0.017 / 0.5 = 60 {{כ}}5000 =נפח דם עוברי | |
| − | = | + | כלומר העובר איבד 60 מ"ל של דם מלא = 30 מ"ל תאי דם עוברי. |
| − | + | ניתן לזהות תאי דם אדומים שהם D-חיוביים בדם של אמא שהיא D-שלילית באמצעות '''[[מבחן שושנת]]''' (Rosette test): כדוריות דם אימהיות מעורבבות עם נוגדנים נוגדי-D, אשר יצפו כל כדורית דם עוברית D-חיובית, שנמצאת בדגימה. בהמשך מוסיפים כדוריות דם הנושאות את האנגד D {{כ}} (Indicator red cells) ונוצרות שושנות של כדוריות אדומות, הנקשרות סביב הכדורית העוברית באמצעות הנוגדנים. הימצאות שושנות מעידה כי קיימים תאי דם עובריים D-חיוביים. המגבלה היא שיעיל רק בנשים שהן O-. | |
| − | === | + | ===זיהוי [[איזואימוניזציה]] במהלך ה[[היריון]]=== |
| − | + | בביקור הראשון בהיריון נבצע בדיקה לסוג דם ובדיקת נוגדנים קומבס לא ישירה-2. אם הקומבס חיובי נזהה את סוג הנוגדנים, IgM או [[אימונוגלובולין G]]{{כ}} (IgG, {{כ}}Immunoglobulin G). רק IgG מחייבים בירור. אם נוגדני ה- IgG מכוונים כנגד אחד מהאנגדים הגורמים לאנמיה מתמס דם, נמדוד את הכייל שלהם. הכייל המכריע, המחייב הערכה נוספת, משתנה מאנגד לאנגד. למשל, הכייל המכריע לנוגדי-D הוא 1:16. גם הכייל המכריע של רוב הנוגדנים האחרים הוא 1:16. הכייל הקובע של נוגדי-Kell הוא 1:8. | |
| − | |||
| − | |||
| − | |||
| − | קביעת | + | ;קביעת מערך הגנים העוברי |
| + | נוכחות נוגדנים נוגדי-D אימהיים אינם אומרים בהכרח שהעובר ייפגע ואפילו לא קובעים שהעובר D-חיובי: | ||
| + | *באישה מרוגשת מההיריון הקודם, או המוגדרת ניתנת לריגוש, כייל הנוגדנים יכול לעלות בהיריון הבא גם אם העובר הוא D-שלילי, מה שנקרא תגובה השכחון (The amnestic response) . | ||
| + | *חצי מכל העוברים לאבא לבן, שהוא D-חיובי, הם D-שליליים מאחר ומחצית מהגברים הלבנים ה-D-חיוביים הם שוני אללים (Heterozygotes). | ||
| + | *נשים רבות הופכות מרוגשות מאנגדים שאינם D לאחר קבלת מנת דם והאנגד לא יימצא כלל אצל האב, למשל קבוצת CE ו-Kell . | ||
| − | אם האב | + | קביעת האללים של האב יכולה לסייע. אם האב שווה אללים (Homozygote) ל-D, העובר יהיה חיובי ב-100% מהמקרים ואין צורך לבדוק את מערך הגנים של העובר. |
| − | יש | + | אם האב שונה אללים, או שלא ניתן לבצע בדיקה של האב, יש לבדוק את מערך הגנים של העובר על ידי [[דגימת סיסי שלייה]] או דיקור מי שפיר. |
| − | + | יש מרכזים המצליחים לקבוע את מערך הגנים העוברי תוך שימוש בדנ"א עוברי חופשי (Cell-free fetal DNA) בפלזמה האימהית. השיטה מדוייקת ב-85-95% כשמדובר באנגד D. אין כרגע ערכה, המבוססת על שיטה זאת ומאושרת על ידי מנהל התרופות והמזון האמריקאי. | |
| + | ===מעקב=== | ||
ניהול המקרה מבוסס על: | ניהול המקרה מבוסס על: | ||
| − | *מעקב אחר | + | *מעקב אחר כייל הנוגדנים האימהי |
| − | *מעקב | + | *מעקב על-שמע אחר זרימת שיא סיסטולית בעורק מוח תיכון |
| − | *הערכת רמת בילירובין במי השפיר | + | *הערכת רמת בילירובין במי השפיר |
| − | *דגימת דם עוברי | + | *דגימת דם עוברי |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | חשוב לקבוע תיארוך מדויק של ההיריון. חשוב לדעת באיזה שלב בהיריון הקודם הופיעה אנמיה, מאחר והאנמיה נוטה להופיע בשלבים מוקדמים יותר בהיריון הבא ובדרגה חמורה יותר. | ||
| − | + | בהיריון הראשון עם ריגוש, יש לעקוב אחר כייל הנוגדנים עד הגעה לכייל המכריע, לרוב פעם בחודש. עם הגעה לכייל המכריע אין צורך במעקב כיילים נוסף ויש לבצע הערכה עוברית. אם זהו לא ההיריון המרוגש הראשון, ההיריון נחשב בסיכון וכייל הנוגדנים האימהי אינו מדד אמין. | |
| + | ====בדיקת זרימת שיא סיסטולית בעורק מח תיכון==== | ||
| + | ברוב המחקרים, מעקב אחר זרימות בעורק מח תיכון החליף את הצורך בדיקור מי שפיר. מיקומו האנטומי הייחודי של העורק והמרפס הפתוח מאפשרים את הערכת הזרימה בו, כך שכיוון הזרימה הוא אל המתמר. | ||
| − | כאשר יש אנמיה עוברית, העובר מעביר דם | + | כאשר יש אנמיה עוברית, העובר מעביר דם מהקצוות למוח לשמירה על חמצון. המהירות שיא של הזרימה מוגברת עקב עליה בתפוקת הלב וירידה בצמיגות הדם. בעבודה של Mari {{כ}}(1995) ביצעו מדידה של מהירות הזרימה בעורק מח תיכון של 135 עוברים תקינים ו-39 עוברים עם [[אלואימוניזציה]]. הם הראו שלעוברים עם אנמיה יש מהירות זרימה סיסטולית מעל לממוצע. במחקר רב מחקרי המשכי של Mari וחבריו (2000), נבדקו 111 עוברים בסיכון ו-265 עוברים בריאים והחוקרים קבעו סף של 1.5 MoM {{כ}}(Multiples Of the Median), בו אבחנו את כל העוברים עם אנמיה בינונית-חמורה עם רגישות של 100%. שיעור החיוביים הכוזבים (False positive) היה 12%. עבודות אחרות הראו תוצאות דומות. |
| + | עבודה של Oepkes {{כ}}(2006) השוותה [[דופלר]] (Doppler) לבילירובין במי שפיר ומצאה רגישות של 88% עם דיוק של 85% בדופלר לעומת רגישות של 76%, סגוליות של 77% ו-76% דיוק בבדיקת בילירובין במי השפיר. | ||
| − | + | הגרף מתאר את המהירות זרימת השיא בעורק המח התיכון ב-165 עוברים בסיכון לאנמיה חמורה. הקו הכחול (התחתון) מתאר את מהירות זרימת השיא בעוברים בריאים והקו האדום העליון מייצג 1.5 MoM{{כ}} (Oepkes D, NEJM 2006). כאשר מהירויות זרימת השיא בעורק המח התיכון גבוה מ- 1.5 MoM, כנראה שהעובר אנמי ויש צורך בנטילת דגימת דם עוברית כדי לקבוע אם יש צורך בעירוי דם. | |
| − | |||
| − | |||
| − | [[ | + | ====ניתוח ספקטרי של [[מי שפיר]] (Amnionic fluid spectral analysis) ==== |
| − | + | Liley תאר ב-1961 את השימוש בניתוח ספקטרי של מי השפיר כדי למדוד את רמת הבילירובין לצורך הערכת חומרת תמס הדם ובאופן עקיף את חומרת האנמיה. השיטה פחות בשימוש כיום, אך הומלץ להשתמש בה במרכזים בהם אין יכולת/ ניסיון למדוד זרימות בעורק מח תיכון. מאחר ורמות הבילירובין במי השפיר נמוכות, השיטה מבוססת על מדידת שינויים בספיגת אור באורך גל של nm{{כ}} 450 באמצעות ספקטרופוטומטר (Spectrophotometer). הפרש זה מכונה AOD<small>450</small>. | |
| − | + | הסיכוי לאנמיה העוברית נקבע ע"י מיקום שהתקבל בתרשים המחולק למס' אזורים (Zones). עקומת Liley המקורית מתייחסת לשבועות 27-42 ומחולקת לשלושה איזורים. | |
| + | * אזור 1 מתייחס לעובר D-שלילי או עובר עם מחלה קלה. | ||
| + | * אזור 2 קובע שקיימת אנמיה. בחלק התחתון של אזור 2 צפוי המוגלובין של g/dL{{כ}} 11-13.9 | ||
| + | * אזור 3 מצביע על אנמיה קשה עם המוגלובין נמוך מ-g/dL{{כ}} 8 . | ||
| − | + | לאחרונה, Pasman ושות' (2008) הראו התאמה טובה יותר בין האנמיה העוברית ובין היחס בילירובין/[[אלבומין]] בהשוואה לעקומות Liley או Queenan. | |
| − | + | שימוש בעקומת Liley אפשר קבלת החלטה על המשך ניהול. בזמנו האפשרויות היו [[עירוי דם תוך-צפקי]] או יילוד מוקדם. עקומות Liley עברו התחדשות ע"י Queenan ב-1993 (AJOG), לאחר בדיקת 845 דגימות מי שפיר מ-75 עוברים מרוגשים ו-520 הריונות תקינים, שהתאימו אותן החל משבוע 14. | |
| + | ניתן לראות שיש שיעור גבוה של בילירובין באמצע ההריון, כך שנוצר אזור ביניים גדול, בו ריכוז הבילירובין אינו מנבא היטב את רמת ההמוגלובין. לכן, כאשר יש רושם לאנמיה קשה או הידרופס לפני שבוע 25, רוב המחברים מוותרים על דיקור מי שפיר ומבצעים דגימת דם עוברי. | ||
| − | + | ==טיפול== | |
| − | + | ===[[Anti-D immunoglobulins]]=== | |
| − | |||
| − | |||
| − | |||
| − | + | {{הפניה לערך מורחב|מניעת אלואימוניזציה על רקע אי התאמת Prevention of alloimmunization due to RH incompatibility - RH}} | |
| − | [[ | + | מנה מקובלת הניתנת בזריקה לשריר מכילה µg {{כ}}300 של נוגדנים נוגדי-D. הטיפול ניתן לאמא לא מרוגשת, לצורך מניעת ריגוש, במצבים בהם יש סיכון לדימום מהעובר לאם. ריגוש אפשרי גם לאחר [[הפלה]] מוקדמת, [[הפלה טבעית|טבעית]] או [[הפסקת הריון|יזומה]], אם כי לא ברור מה יהיה שיעור הריגוש. במצבים כאלה ניתן לתת מינון מוקטן של µg{{כ}} 50, אם כי ברוב המרכזים לא מחזיקים נוגדי-D במינון כזה ולרוב ניתן µg{{כ}} 300. כל מנה של µg{{כ}} 300 נוגדי-D צפויה להגן מפני דימום של 15 מ"ל תאי דם אדומים עובריים או 30 מ"ל דם מלא. |
| − | + | מנה אחת של µg{{כ}} 300 ניתן מניעתית לכל הנשים ה-D-שלילות בשבוע 28. ללא טיפול מניעתי זה, 1.8% מהנשים צפויות לעבור ריגוש מהדימום השקט מהעובר לאם. עם טיפול מניעתי השיעור יורד ל- 0.07. MacKenzie דיווח ב-2006 כי השיעור האמיתי של ריגוש בעולם עומד על 0.4%. למרות המנה בשבוע 28, מנה נוספת ניתנת לאחר הלידה אם הילוד נמצא D-חיובי. הסיבה היא זמן מחצית החיים של הנוגדנים, שהינו 24 ימים ורמות מגינות שנשארות בדם כ-6 שבועות בלבד. בנוסף, דימום מהעובר לאם צפוי להתרחש במהלך הלידה. | |
| − | + | המינון הראשוני של µg{{כ}} 300 יגרום לכייל חיובי חלש אצל האם 1:1 עד 1:4 בקומבס לא ישיר. כאשר מדד מסת הגוף (BMI, {{כ}}Body Mass Index) גבוה מ-27-40 ק"ג/מ"ר, רמת הנוגדנים בנסיוב יורדת ב-30-40%. לעיתים נדירות, כמות קטנה של נוגדנים חוצה את השליה וגורמת לקומבס ישיר חיובי חלש בדם העובר ולתמס דם עוברי זניח. מתן מוצרי דם לאישה D-שלילית יכול לגרום לריגוש. [[עירוי טסיות]] ו[[סינון פלזמה]] (Plasmapheresis) יכול "לספק" מספיק אנגדי D שיגרמו לריגוש. ניתן למנוע את הריגוש ע"י מתן נוגדי-D. | |
| − | |||
| − | + | בכל מקרה שקיים ספק לגבי מתן נוגדי-D יש לתת, שלא יגרם נזק. | |
| + | כאשר מדובר בדימום גדול מעובר לאם, יתכן ומנה אחת של נוגדי-D לא תספיק. ככל הנראה מדובר ב-1% מהנשים, שיקבלו מינון לא מספיק. מס' מחברים הראו כי אם נתייחס לנשים עם גורמי סיכון לדימום גדול ([[חבלה בטנית]], [[שליית פתח]], [[הריון מרובה עוברים]] או הפרדה ידנית של השליה), ב-50% מהן נפספס מתן מנה נוספת. לכן, האגודה האמריקאית של בנקי הדם (American association of blood banks) המליצה לבצע לכל הנשים ה-D-שליליות בדיקת KB או בדיקת שושנת לאחר הלידה. מינון של נוגדי-D יחושב לפי הערכת כמות הדימום שחושבה בבדיקת KB. כאמור, יש לתת מנה של µg{{כ}} 300 של נוגדי-D על כל 30 מ"ל דם מלא בדימום. ניתן להעריך אם המינון היה מספק באמצעות ביצוע קומבס לא ישיר. תוצאה חיובית מראה שיש עודף של נוגדי-D בדם האם, כלומר המינון היה מספק. | ||
| − | + | אנגד Du זהו סוג של האנגד D. בבדיקה נקבל D "חיובי חלש". נשים עם האנגד Du הן D-חיוביות ואינן זקוקות לנוגדנים. אם אישה D-שלילית יולדת ילד שהוא Du חיובי, היא זקוקה לנוגדי-D. | |
===עירוי דם לעובר=== | ===עירוי דם לעובר=== | ||
| + | עם אבחנת אנמיה, הגדלת כבד, הידרופס או הפרעה בניטור עוברי, הניהול יתקדם לפי שבוע ההיריון: סמוך למועד יש ליילד, לפני המועד יש לקחת דגימת דם עוברית ולתת עירוי דם לפי הצורך. במידה והעובר לא נפגע עדיין, יש לבדוק את רמת ההמוגלובין, ההמטוקריט, מס' הרטיקולוציטים (Reticulocytes) וכייל קומבס לא ישיר, כדי לנסות להעריך מתי תופיע האנמיה. ניקוליידס המליץ על מתן דם, כשההמוגלובין נמוך ב-g/dL{{כ}} 2 מההמוגלובין הממוצע הצפוי בשבוע ההיריון. אחרים המליצו על מתן דם כאשר ההמטוקריט נמוך מ-30% או 2 סטיות תקן מהממוצע לשבוע ההיריון. | ||
| − | + | ניתן לתת [[עירוי לחבל הטבור]] או לתוך ה[[עירוי לצפק העוברי|צפק העוברי]]. כאשר מדובר במחלה חמורה מוקדמת, יתכן קושי טכני בדיקור חבל הטבור ולכן ניתן עירוי תוך-צפקי. בעוברים מבוגרים וגדולים יותר, הרוב יעדיפו עירוי לחבל הטבור. שיעור ההישרדות המדווח בסדרות שונות הוא טוב, עד 89%. רוב העוברים שלא ישרדו, ימותו כתוצאה מההליך עצמו. יש הנותנים עירוי דם ישירות ללב העובר. | |
| − | + | Scheier {{כ}}(2006) ו-Klumper {{כ}} (2009) דיווחו כי מדידת שיא זרימה סיסטולית בעורק מח תיכון, פחות מדויק בניבוי אנמיה לאחר עירוי דם עוברי ואף מדויק פחות לאחר 2 עירויים. ככלל, ניתן לחשב את מועד העירוי הבא לפי העובדה כי ההמטוקריט העוברי ירד ב-1% בכל יום. | |
| − | + | טיפולים אחרים שנוסו ללא הצלחה כללו סינון פלזמה, מתן [[Promethazine]] ודיכוי חיסוני באמצעות [[סטרואידים]]. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
===יילוד=== | ===יילוד=== | ||
| + | מטרת הניהול היא ל[[השראת לידה|יילד]] תינוק בריא ובשל. כאשר הניהול מבוסס על מדידות חוזרות של AOD<small>450</small> במי השפיר או עירויי דם חוזרים, ניתן להעריך במקביל בשלות עוברית. לרוב ניתן להימנע מיילוד מוקדם באופן קיצוני. יש המציעים, שהעירוי האחרון לעוברים שנפגעו קשה יהיה בשבועות 30-32 ואח"כ ניתן סטרואידים בשבועות 32-34. יש הממשיכים עירויי דם עד שבוע 36. לאחר הלידה יש לקחת דגימת דם מחבל הטבור להערכת ההמוגלובין ולבצע קומבס ישיר. | ||
| − | + | ==פרוגנוזה== | |
| − | + | התמותה סביב הלידה (Perinatal mortality), הנגרמת ממחלת תמס דם כתוצאה מאיזואימוניזציה ל-D ירדה עם השימוש ב-[[Anti-D immunoglobulins]]. השימוש בעירוי דם תוך רחמי שיפר את ההישרדות עד כדי 90% באנמיה קשה בלבד וב-70% אם התפתח הידרופס. רוב העוברים שקיבלו עירויי דם מתפתחים באופן תקין. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ==דגלים אדומים== | |
| + | ==ביבליוגרפיה== | ||
| − | == | + | ==קישורים חיצוניים== |
| − | + | ==ראו גם== | |
| − | + | * לנושא הבא: [[מניעת אלואימוניזציה על רקע אי התאמת Prevention of alloimmunization due to RH incompatibility - RH]] | |
| + | {{ייחוס| ד"ר מאור ממן, מרכז רפואי רבין, בילינסון-השרון}} | ||
| שורה 292: | שורה 210: | ||
[[קטגוריה:ילדים]] | [[קטגוריה:ילדים]] | ||
[[קטגוריה:מיילדות]] | [[קטגוריה:מיילדות]] | ||
| − | |||
גרסה אחרונה מ־17:03, 1 בנובמבר 2020
| אי התאמת RH והידרופס עוברי אימוני | ||
|---|---|---|
| RH incompatibility and immune hydrops fetalis | ||

| ||
| יוצר הערך | דר' מאור ממן | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – הידרופס עוברי, אי התאמת RH
הסיבה להידרופס עוברי מוגדרת לרוב לפי 2 קבוצות- חיסוני ולא חיסוני. במהלך כל ההריונות כמות קטנה מאוד של דם עוברי מגיעה לרווחים בין הסיסים (Intervillous spaces) והדבר יכול לגרום לאיזואימוניזציה (Isoimmunization). נוגדן נגד D (Anti-D) הוא הכי שכיח. לאור מתן Anti-D immunoglobulins מניעתי, חלק גדול יותר של מקרי מחלת תמס דם (Hemolysis) בעובר נגרמים מאנגדים (Antigens) פחות שכיחים. ניהול המקרה מבוסס על מעקב אחר כייל הנוגדנים האימהי, מעקב על-שמע אחר זרימת שיא סיסטולית בעורק מוח תיכון (MCA-PSV ,Peak Velocity of Systolic Blood Flow in the MCA), הערכת רמת בילירובין במי השפיר ודגימת דם עוברי (Cordocentesis). אחד הסימנים לאנמיה חמורה הוא רישום סינוסואידלי (Sinusoidal) של דופק העובר. עם אבחנת אנמיה, הגדלת כבד, הידרופס או הפרעה בניטור עוברי, הניהול יתקדם לפי שבוע ההיריון. סמוך למועד יש ליילד, לפני המועד יש לקחת דגימת דם עוברית ולתת עירוי דם לפי הצורך.
אפידמיולוגיה
מס' מחקרים גדולים הראו נוגדנים נגד כדוריות דם אדומות ב- 1% מההריונות. 40-60% מתוכם מכוונים נגד אנגדים CDE. נוגדן נוגד-D הוא הכי שכיח ואחריו c ,E ו-C. נוגדנים נוגדי-Kell שכיחים גם הם.
אטיולוגיה
הידרופס עוברי חיסוני
לא ברור לגמרי מנגנון התפתחות ההידרופס, ייתכן ונובע מאי-ספיקת לב, מאנמיה, מיעוט חמצן (Hypoxia), יתר-לחץ-דם פורטלי, והפחתה בלחץ הקולואיד-אונקוטי (Colloid osmotic pressure) מאי ספיקת כבד ותת-חלבון בדם (Hypoproteinemia).
מס' מחקרים הראו כי הגורם העיקרי המשפיע על חומרת המיימת הוא דרגת משך האנמיה. גורמים נוספים: תת-חלבון בדם מאי ספיקת כבד ודלף אנדותליאלי (Endothelial leak), כתוצאה ממיעוט חמצן רקמתי. שני האחרונים גורמים לאיבוד חלבונים וירידה בלחץ קולואיד-אונקוטי המחמיר את ההידרופס. ניקוליידס נטל דגימת דם מהעורק הטבורי העוברי ב-17 עוברים עם איזואימוניזציה חמורה בשבועות 18-25 ומצא רמת המוגלובין (Hemoglobin) נמוכה מ- g/dL 3.8 בכל העוברים עם הידרופס וריכוז חלבונים בפלזמה (Plasma) נמוך ביותר משתי סטיות תקין. לחלופין, אף עובר עם המוגלובין גבוה מ- g/dL 4 לא היה הידרופי.
תמס דם ממושך גורם לאנמיה, המביאה לייצור יתר של השורה האריתרואידית (Erythroid hyperplasia) במח העצם ולייצור תאי דם אדומים (Erythropoiesis) חוץ-לשדי בטחול ובכבד, שיובילו בסוף לאי-ספיקת כבד.
לאחר שבוע 35, ההמוגלובין העוברי הממוצע עומד על g/dL 17 וערך נמוך מ-g/dL 14 נחשב לא תקין. לאחר הלידה ההמוגלובין של הילוד יכול לעלות עד 20% מערכו כתוצאה מזרימת דם מהשליה.
McDonald ו-Middleton (2008) פרסמו סקירה של 11 עבודות עם 3,000 לידות, שהשוו סגירה (Clamping) מוקדמת מול סגירה מאוחרת של חבל הטבור. סגירה מאוחרת היתה קשורה לעליה של g/dL 2.2 בהמוגלובין, דבר שהכפיל את רמת ההיפרבילירובינמיה (Hyperbilirubinemias) שהצריכה טיפול באור (Phototherapy).
לחלופין, במקרים של היפרדות שליה, התנקבות/ קרע של כלי דם עוברי או כשהתינוק מוחזק מעל גובה השליה לפני קשירת חבל הטבור, ההמוגלובין יכול לרדת.
איזואימוניזציה
קיימות 29 קבוצות דם ויותר מ-600 אנגדים על כדוריות הדם האדומות. רובם נדירים וחסרי משמעות קלינית. כל אדם שחסר את אחד האנגדים יכול לפתח נוגדנים אם ייחשף לאנגד. הנוגדנים יכולים לגרום נזק לאחר קבלת מנת דם, או לעבור לעובר בהריון.
- דימום מהעובר לאם (Fetal-to-maternal hemorrhage)- במהלך כל ההריונות כמות קטנה מאוד של דם עוברי מגיעה לרווחים בין הסיסים. הדבר יכול לגרום לאיזואימוניזציה. Choavaratana וחב' (1997) ביצעו בדיקות KB (Kleihauer-Betke) ב- 2,000 נשים הרות ומצאו שלמרות שכיחות גבוהה בכל שליש של דימום מהעובר לאם, נפח הדם שעבר היה קטן מאוד. לא ברור באיזו שכיחות יש מעבר של יותר מ-30 מ"ל. יש שהראו שכיחות של 4% גם בלידה רגילה וגם בניתוח קיסרי. הטבלה הבאה מסכמת גורמים לדימום מעובר לאם שיכול לגרות איזואימוניזציה:
- דימום מהאם לעובר (Maternal-to-fetal hemorrhage)- ידוע כיום כי כמעט בכל ההריונות, כמות קטנה של דם אימהי נכנסת למחזור הדם העוברי. הדבר לרוב חסר משמעות. לעתים נדירות עובר D שלילי נחשף לאנגד D ועובר ריגוש. כאשר עוברית כזאת מגיעה לבגרות, היא תייצר נוגדנים נוגדי-D מוקדם בהריונה הראשון (ואולי אף לפניו). מנגנון זה של איזואימוניזציה נקרא: "תורת הסבתא" (The grandmother theory), מאחר והעובר נמצא בסכנה מנוגדנים שנוצרו מחשיפה לתאי דם של הסבתא שלו.
פתופיזיולוגיה
לרוב האנשים לפחות אנגד אחד שקיבלו מהאבא וחסר אצל האמא. עם זאת שיעור איזואימוניזציה נמוך מאחר ו-
- שכיחות נמוכה של חוסר התאמה אנגדית.
- מעבר שלייתי לא מספיק של נוגדנים אימהיים או של תאי דם עובריים.
- חוסר התאמה בקבוצות ABO בין אם לעובר (Maternal-fetal ABO incompatibility) מביא להרס הכדוריות העובריות שעברו לאם, עוד בטרם הן מעוררות תגובה חיסונית.
- חלק מהאנגדים מעוררים תגובה מזערית.
לפיכך, לכל הנשים בהריון סיכון של 1% בלבד לפתח איזואימוניזציה של D (D-isoimmunization) עד 6 חודשים לאחר הלידה ובכל מקרה, לא כל איזואימוניזציה גורמת לאריתרובלסטוזיס עוברי (Erythroblastosis fetalis) . לאמא D-שלילית (D-negative) היולדת עובר D-חיובי (D-positive) ללא אי התאמת ABO, סיכון של 16% לפתח איזואימוניזציה. ל-2% יהיו נוגדנים בלידה, ל-7% יהיו נוגדנים עד 6 חודשים לאחר הלידה ו-7% יוגדרו "ניתנות לריגוש" ("Sensibilized") עם רמת נוגדנים נמוכה, שלא ניתנת לזיהוי במהלך או לאחר ההריון הנוכחי ונזהה אותן מוקדם בהריון הבא, לאחר ריגוש חדש מעובר חדש שהוא D-חיובי.
חוסר התאמה בקבוצות הדם B,A הינו הגורם השכיח ביותר למחלת תמס דם של הילוד, האנמיה לרוב קלה. כ- 20% מהעוברים הם חסרי התאמת ABO, רק 5% נפגעים קלינית. קיימים מס' הבדלים מחוסר התאמה הקשורה ל-D:
- חוסר התאמת ABO נראה לרוב בילוד הראשון, מאחר ולרוב הנשים עם סוג דם O יש נוגדנים Anti-A ו-Anti-B, שהופיעו מחשיפה לחיידקים הנושאים את אותם הגנים.
- רוב הנוגדנים Anti-A ו-Anti-B הם אימונוגלובולין M (IgM,Immunoglobulin) , שאינם יכולים לעבור שליה ובנוסף, כדוריות דם אדומות עובריות מבטאות פחות אנגדים A ו-B, בהשוואה למבוגר ולכן, הן פחות מעוררות תגובה חיסונית. לפיכך, אין צורך במעקב הריון מיוחד או ביילוד מוקדם.
- המחלה קלה יותר בהשוואה לאיזואימוניזציה-D ונדיר שתגרום לאנמיה. עוברים שנפגעו לא יפתחו אריתרובלסטוזיס עוברי אלא אנמיה של הילוד (Neonatal anemia) וצהבת שתטופל בטיפול באור.
- בהריונות הבאים, בניגוד למחלת CDE, אין מחלה מתקדמת.
חוסר התאמת ABO נחשבת מחלה בטיפול רופאי הילדים ואינה בעיה מיילדותית.
חמישה אנגדים: e ,E ,D ,c ,C (אין Rh- .(d מתייחס להעדר אנגד D. האנגדים הללו חשובים כי רוב האנשים מפתחים נוגדנים לאחר חשיפה בודדת. קיימים שני גנים: D ו-CE הממוקמים בכרומוזום 1 ומועברים יחד בתורשה ללא קשר לקבוצות הדם האחרות. שכיחות האנגדים משתנה בין גזעים, למשל - 99% מהאינדיאנים והסינים הם D חיובים, לעומת 93% מהאפרו-אמריקאים ו-87% מהלבנים. בקרב הבסקים נרשמה השכיחות הגבוהה ביותר (34%) של D שלילי.
החיסוניות של : e ,E ,c ,C נמוכה מזאת של D אך עדיין יכולה לגרום לאריתרובלסטוזיס עוברי. יש לבדוק את כל הנשים ההרות להימצאות אנגד D ונוכחות נוגדנים בנסיוב. בנשים D חיוביות מספיקה בדיקה אחת בכל הריון.
- קבוצות דם אחרות
לאור מתן Anti-D immunoglobulins מניעתי, חלק גדול יותר של מקרי מחלת תמס דם בעובר נגרמים מאנגדים פחות שכיחים. החשד עולה עם מציאת נוגדנים בבדיקת קומבס לא ישיר (Indirect coombs). בטבלה הבאה מופיעים חלק מהאנגדים והקשר שלהם למחלת תמס דם.
בנוסף, רבע מכל הנוגדנים מכוונים כנגד מערכת לואיס (Lewis system) והם אינם גורמים לתמס דם מאחר ואנגדים מסוג לואיס אינם מתפתחים על תאי הדם העובריים ויופיעו רק מספר שבועות לאחר הלידה.
90% מהלבנים הם Kell-שליליים, ונוכחות האנגד אינה נבדקת באופן שגרתי. 90% ממקרי הריגוש עם נוגדן נגד Kell נגרמים בעקבות מתן מנות דם. בדומה ל-CDE, ריגוש מ-Kell יכול להיגרם מחוסר התאמה בין אם לעובר.
המחלה יכולה להיות קשה יותר מאחר והנוגדנים נוגדי-Kell נקשרים גם לתחילנים (Precursors) של כדוריות הדם האדומות במח העצם ומונעים תגובה של ייצור תאי דם אדומים באנמיה. האנמיה תהיה מהירה יותר בהופעתה וחמורה יותר מבאי התאמת RH. במקרה כזה מיוצרות פחות כדוריות אדומות ויש פחות בילירובין במי השפיר. כתוצאה מכך, לא ניתן לצפות אנמיה עוברית על סמך כייל הנוגדנים האימהיים נוגדי-Kell או רמת בילירובין במי השפיר. לכן, יש המציעים לבצע הערכה כבר כאשר הכייל האימהי של נוגדי-Kell מגיע ל-1:8 ולבצע הערכה המבוססת על דגימת דם עוברי ולא דיקור מי שפיר להערכת רמת בילירובין.
Van Wamelen ושות' (2007) דיווחו על 41 נשים והסיקו, כי יש לבצע מעקב מעקב קפדני אחר סימני אנמיה לפי בדיקת זרימת שיא סיסטולית בעורק המח התיכוני החל משבוע 16-17, החל מכייל נוגדי-Kell של 1:2 .
קליניקה
אם העובר מפתח אנמיה קשה, יופיע דופק סינוסואידלי, אשר אינו ייחודי רק לאנמיה עוברית, אך מחייב ברור מיידי. אנמיה המתפתחת באופן הדרגתי וכרוני נסבלת טוב יותר ע"י העובר בהשוואה לאנמיה חריפה, הגורמת להפרעות עצביות עקב ירידה בהזלפה (Perfusion) המוחית, איסכמיה (Ischemia) ונמק. אנמיה כרונית לא בהכרח תגרום לשינויים בדופק העוברי עד לשלב בו העובר נוטה למות. De Alemida ו-Bowman (1994) תיארו 27 מקרים של דימום עוברי גדול מ-80 מ"ל. למרות טיפול נאות, כמחצית מהילודים מתו או פיתחו שיתוק דו-צידי עוויתי (Spastic diplegia). עפ"י Samadi וחבריו (1996), דימום חמור מהעובר לאם גרם ל-5% ממקרי לידת מת.
הצטברות של נוזל ביותר ממדור אחד בגוף, כמו למשל מיימת, ותפליט אדרי (Pleural effusion), מוגדרים כהידרופס עוברי . תיתכן הגדלה של הלב ודימום ריאתי. הנוזלים מצטברים בבית החזה, בחלל הבטן או בעור. השליה בצקתית ומוגדלת, מכילה פסיגים (Cotyledon) בולטים וסיסים (Villus) בצקתיים. הנוזל האדרי יכול להפריע להתפתחות הריאות. מיימת והגדלת הכבד והטחול יכולים לגרום להפרעה בהתפתחות הלידה. עוברים הידרופים יכולים למות ברחם מאנמיה ואי ספיקת לב.
השינויים ההידרופים בשליה, הגורמים להגדלת השליה, יכולים לגרום לקדם-רעלת ההריון (Preeclampsia). האם עם קדם-רעלת ההריון יכולה לפתח בצקות קשות המחקות את העובר - מה שמכונה תסמונת מראה (Mirror syndrome).
אבחנה
דימום מהעובר לאם
ניתן לזהות תאי דם אדומים של העובר במחזור הדם האימהי באמצעות תבחין ה-KB. כדוריות הדם העובריות מכילות המוגלובין F אשר עמיד יותר לפרוק בחומצה בהשוואה להמוגלובין A. לאחר חשיפה לחומצה רק המוגלובין עוברי שורד, כך שניתן לזהות תאי דם אדומים עובריים במשטח הקפי אימהי עם צביעה מתאימה. המבחן לרוב מדויק, אלא אם כן לאמא יש המוגלובינופתיה (Hemoglobinopathy) המעלה את שיעור ההמוגלובין F שלה. בתמונה ניתן לראות את תאי הדם האדומים העובריים הנצבעים כהה לעומת התאים האימהיים הבהירים עם כמות קטנה של המוגלובין F:
בנוסף, ניתן להשתמש בתאים העובריים הללו לסקר לאנאפלואידיה (Aneuploidy). ידוע כי תאים עוברים מסוג תאי גזע או לימפוציטים (Lymphocytes) יכולים לשרוד ברקמות אימהיות שונות (Maternal-fetal hybridization/ microchimerism) זמן רב ולגרום לתגובה אוטואימונית (Autoimmune), זאבת, טרשת רב-מערכתית ודלקת בלוטת התריס.
ניתן להעריך את נפח הדמם העוברי לפי תוצאות תבחין KB תוך שימוש בנוסחה הבאה:
כך למשל באישה ממוצעת עם נפח דם של 5,000 מ"ל, המטוקריט (Hematocrit) 35% ותוצאה של 1.7% תאים חיוביים ב-KB , כאשר המטוקריט העובר 50% נקבל:
X 0.35 X 0.017 / 0.5 = 60 5000 =נפח דם עוברי
כלומר העובר איבד 60 מ"ל של דם מלא = 30 מ"ל תאי דם עוברי.
ניתן לזהות תאי דם אדומים שהם D-חיוביים בדם של אמא שהיא D-שלילית באמצעות מבחן שושנת (Rosette test): כדוריות דם אימהיות מעורבבות עם נוגדנים נוגדי-D, אשר יצפו כל כדורית דם עוברית D-חיובית, שנמצאת בדגימה. בהמשך מוסיפים כדוריות דם הנושאות את האנגד D (Indicator red cells) ונוצרות שושנות של כדוריות אדומות, הנקשרות סביב הכדורית העוברית באמצעות הנוגדנים. הימצאות שושנות מעידה כי קיימים תאי דם עובריים D-חיוביים. המגבלה היא שיעיל רק בנשים שהן O-.
זיהוי איזואימוניזציה במהלך ההיריון
בביקור הראשון בהיריון נבצע בדיקה לסוג דם ובדיקת נוגדנים קומבס לא ישירה-2. אם הקומבס חיובי נזהה את סוג הנוגדנים, IgM או אימונוגלובולין G (IgG, Immunoglobulin G). רק IgG מחייבים בירור. אם נוגדני ה- IgG מכוונים כנגד אחד מהאנגדים הגורמים לאנמיה מתמס דם, נמדוד את הכייל שלהם. הכייל המכריע, המחייב הערכה נוספת, משתנה מאנגד לאנגד. למשל, הכייל המכריע לנוגדי-D הוא 1:16. גם הכייל המכריע של רוב הנוגדנים האחרים הוא 1:16. הכייל הקובע של נוגדי-Kell הוא 1:8.
- קביעת מערך הגנים העוברי
נוכחות נוגדנים נוגדי-D אימהיים אינם אומרים בהכרח שהעובר ייפגע ואפילו לא קובעים שהעובר D-חיובי:
- באישה מרוגשת מההיריון הקודם, או המוגדרת ניתנת לריגוש, כייל הנוגדנים יכול לעלות בהיריון הבא גם אם העובר הוא D-שלילי, מה שנקרא תגובה השכחון (The amnestic response) .
- חצי מכל העוברים לאבא לבן, שהוא D-חיובי, הם D-שליליים מאחר ומחצית מהגברים הלבנים ה-D-חיוביים הם שוני אללים (Heterozygotes).
- נשים רבות הופכות מרוגשות מאנגדים שאינם D לאחר קבלת מנת דם והאנגד לא יימצא כלל אצל האב, למשל קבוצת CE ו-Kell .
קביעת האללים של האב יכולה לסייע. אם האב שווה אללים (Homozygote) ל-D, העובר יהיה חיובי ב-100% מהמקרים ואין צורך לבדוק את מערך הגנים של העובר.
אם האב שונה אללים, או שלא ניתן לבצע בדיקה של האב, יש לבדוק את מערך הגנים של העובר על ידי דגימת סיסי שלייה או דיקור מי שפיר.
יש מרכזים המצליחים לקבוע את מערך הגנים העוברי תוך שימוש בדנ"א עוברי חופשי (Cell-free fetal DNA) בפלזמה האימהית. השיטה מדוייקת ב-85-95% כשמדובר באנגד D. אין כרגע ערכה, המבוססת על שיטה זאת ומאושרת על ידי מנהל התרופות והמזון האמריקאי.
מעקב
ניהול המקרה מבוסס על:
- מעקב אחר כייל הנוגדנים האימהי
- מעקב על-שמע אחר זרימת שיא סיסטולית בעורק מוח תיכון
- הערכת רמת בילירובין במי השפיר
- דגימת דם עוברי
חשוב לקבוע תיארוך מדויק של ההיריון. חשוב לדעת באיזה שלב בהיריון הקודם הופיעה אנמיה, מאחר והאנמיה נוטה להופיע בשלבים מוקדמים יותר בהיריון הבא ובדרגה חמורה יותר.
בהיריון הראשון עם ריגוש, יש לעקוב אחר כייל הנוגדנים עד הגעה לכייל המכריע, לרוב פעם בחודש. עם הגעה לכייל המכריע אין צורך במעקב כיילים נוסף ויש לבצע הערכה עוברית. אם זהו לא ההיריון המרוגש הראשון, ההיריון נחשב בסיכון וכייל הנוגדנים האימהי אינו מדד אמין.
בדיקת זרימת שיא סיסטולית בעורק מח תיכון
ברוב המחקרים, מעקב אחר זרימות בעורק מח תיכון החליף את הצורך בדיקור מי שפיר. מיקומו האנטומי הייחודי של העורק והמרפס הפתוח מאפשרים את הערכת הזרימה בו, כך שכיוון הזרימה הוא אל המתמר.
כאשר יש אנמיה עוברית, העובר מעביר דם מהקצוות למוח לשמירה על חמצון. המהירות שיא של הזרימה מוגברת עקב עליה בתפוקת הלב וירידה בצמיגות הדם. בעבודה של Mari (1995) ביצעו מדידה של מהירות הזרימה בעורק מח תיכון של 135 עוברים תקינים ו-39 עוברים עם אלואימוניזציה. הם הראו שלעוברים עם אנמיה יש מהירות זרימה סיסטולית מעל לממוצע. במחקר רב מחקרי המשכי של Mari וחבריו (2000), נבדקו 111 עוברים בסיכון ו-265 עוברים בריאים והחוקרים קבעו סף של 1.5 MoM (Multiples Of the Median), בו אבחנו את כל העוברים עם אנמיה בינונית-חמורה עם רגישות של 100%. שיעור החיוביים הכוזבים (False positive) היה 12%. עבודות אחרות הראו תוצאות דומות.
עבודה של Oepkes (2006) השוותה דופלר (Doppler) לבילירובין במי שפיר ומצאה רגישות של 88% עם דיוק של 85% בדופלר לעומת רגישות של 76%, סגוליות של 77% ו-76% דיוק בבדיקת בילירובין במי השפיר.
הגרף מתאר את המהירות זרימת השיא בעורק המח התיכון ב-165 עוברים בסיכון לאנמיה חמורה. הקו הכחול (התחתון) מתאר את מהירות זרימת השיא בעוברים בריאים והקו האדום העליון מייצג 1.5 MoM (Oepkes D, NEJM 2006). כאשר מהירויות זרימת השיא בעורק המח התיכון גבוה מ- 1.5 MoM, כנראה שהעובר אנמי ויש צורך בנטילת דגימת דם עוברית כדי לקבוע אם יש צורך בעירוי דם.
ניתוח ספקטרי של מי שפיר (Amnionic fluid spectral analysis)
Liley תאר ב-1961 את השימוש בניתוח ספקטרי של מי השפיר כדי למדוד את רמת הבילירובין לצורך הערכת חומרת תמס הדם ובאופן עקיף את חומרת האנמיה. השיטה פחות בשימוש כיום, אך הומלץ להשתמש בה במרכזים בהם אין יכולת/ ניסיון למדוד זרימות בעורק מח תיכון. מאחר ורמות הבילירובין במי השפיר נמוכות, השיטה מבוססת על מדידת שינויים בספיגת אור באורך גל של nm 450 באמצעות ספקטרופוטומטר (Spectrophotometer). הפרש זה מכונה AOD450.
הסיכוי לאנמיה העוברית נקבע ע"י מיקום שהתקבל בתרשים המחולק למס' אזורים (Zones). עקומת Liley המקורית מתייחסת לשבועות 27-42 ומחולקת לשלושה איזורים.
- אזור 1 מתייחס לעובר D-שלילי או עובר עם מחלה קלה.
- אזור 2 קובע שקיימת אנמיה. בחלק התחתון של אזור 2 צפוי המוגלובין של g/dL 11-13.9
- אזור 3 מצביע על אנמיה קשה עם המוגלובין נמוך מ-g/dL 8 .
לאחרונה, Pasman ושות' (2008) הראו התאמה טובה יותר בין האנמיה העוברית ובין היחס בילירובין/אלבומין בהשוואה לעקומות Liley או Queenan.
שימוש בעקומת Liley אפשר קבלת החלטה על המשך ניהול. בזמנו האפשרויות היו עירוי דם תוך-צפקי או יילוד מוקדם. עקומות Liley עברו התחדשות ע"י Queenan ב-1993 (AJOG), לאחר בדיקת 845 דגימות מי שפיר מ-75 עוברים מרוגשים ו-520 הריונות תקינים, שהתאימו אותן החל משבוע 14.
ניתן לראות שיש שיעור גבוה של בילירובין באמצע ההריון, כך שנוצר אזור ביניים גדול, בו ריכוז הבילירובין אינו מנבא היטב את רמת ההמוגלובין. לכן, כאשר יש רושם לאנמיה קשה או הידרופס לפני שבוע 25, רוב המחברים מוותרים על דיקור מי שפיר ומבצעים דגימת דם עוברי.
טיפול
Anti-D immunoglobulins
ערך מורחב – מניעת אלואימוניזציה על רקע אי התאמת Prevention of alloimmunization due to RH incompatibility - RH
מנה מקובלת הניתנת בזריקה לשריר מכילה µg 300 של נוגדנים נוגדי-D. הטיפול ניתן לאמא לא מרוגשת, לצורך מניעת ריגוש, במצבים בהם יש סיכון לדימום מהעובר לאם. ריגוש אפשרי גם לאחר הפלה מוקדמת, טבעית או יזומה, אם כי לא ברור מה יהיה שיעור הריגוש. במצבים כאלה ניתן לתת מינון מוקטן של µg 50, אם כי ברוב המרכזים לא מחזיקים נוגדי-D במינון כזה ולרוב ניתן µg 300. כל מנה של µg 300 נוגדי-D צפויה להגן מפני דימום של 15 מ"ל תאי דם אדומים עובריים או 30 מ"ל דם מלא.
מנה אחת של µg 300 ניתן מניעתית לכל הנשים ה-D-שלילות בשבוע 28. ללא טיפול מניעתי זה, 1.8% מהנשים צפויות לעבור ריגוש מהדימום השקט מהעובר לאם. עם טיפול מניעתי השיעור יורד ל- 0.07. MacKenzie דיווח ב-2006 כי השיעור האמיתי של ריגוש בעולם עומד על 0.4%. למרות המנה בשבוע 28, מנה נוספת ניתנת לאחר הלידה אם הילוד נמצא D-חיובי. הסיבה היא זמן מחצית החיים של הנוגדנים, שהינו 24 ימים ורמות מגינות שנשארות בדם כ-6 שבועות בלבד. בנוסף, דימום מהעובר לאם צפוי להתרחש במהלך הלידה.
המינון הראשוני של µg 300 יגרום לכייל חיובי חלש אצל האם 1:1 עד 1:4 בקומבס לא ישיר. כאשר מדד מסת הגוף (BMI, Body Mass Index) גבוה מ-27-40 ק"ג/מ"ר, רמת הנוגדנים בנסיוב יורדת ב-30-40%. לעיתים נדירות, כמות קטנה של נוגדנים חוצה את השליה וגורמת לקומבס ישיר חיובי חלש בדם העובר ולתמס דם עוברי זניח. מתן מוצרי דם לאישה D-שלילית יכול לגרום לריגוש. עירוי טסיות וסינון פלזמה (Plasmapheresis) יכול "לספק" מספיק אנגדי D שיגרמו לריגוש. ניתן למנוע את הריגוש ע"י מתן נוגדי-D.
בכל מקרה שקיים ספק לגבי מתן נוגדי-D יש לתת, שלא יגרם נזק.
כאשר מדובר בדימום גדול מעובר לאם, יתכן ומנה אחת של נוגדי-D לא תספיק. ככל הנראה מדובר ב-1% מהנשים, שיקבלו מינון לא מספיק. מס' מחברים הראו כי אם נתייחס לנשים עם גורמי סיכון לדימום גדול (חבלה בטנית, שליית פתח, הריון מרובה עוברים או הפרדה ידנית של השליה), ב-50% מהן נפספס מתן מנה נוספת. לכן, האגודה האמריקאית של בנקי הדם (American association of blood banks) המליצה לבצע לכל הנשים ה-D-שליליות בדיקת KB או בדיקת שושנת לאחר הלידה. מינון של נוגדי-D יחושב לפי הערכת כמות הדימום שחושבה בבדיקת KB. כאמור, יש לתת מנה של µg 300 של נוגדי-D על כל 30 מ"ל דם מלא בדימום. ניתן להעריך אם המינון היה מספק באמצעות ביצוע קומבס לא ישיר. תוצאה חיובית מראה שיש עודף של נוגדי-D בדם האם, כלומר המינון היה מספק.
אנגד Du זהו סוג של האנגד D. בבדיקה נקבל D "חיובי חלש". נשים עם האנגד Du הן D-חיוביות ואינן זקוקות לנוגדנים. אם אישה D-שלילית יולדת ילד שהוא Du חיובי, היא זקוקה לנוגדי-D.
עירוי דם לעובר
עם אבחנת אנמיה, הגדלת כבד, הידרופס או הפרעה בניטור עוברי, הניהול יתקדם לפי שבוע ההיריון: סמוך למועד יש ליילד, לפני המועד יש לקחת דגימת דם עוברית ולתת עירוי דם לפי הצורך. במידה והעובר לא נפגע עדיין, יש לבדוק את רמת ההמוגלובין, ההמטוקריט, מס' הרטיקולוציטים (Reticulocytes) וכייל קומבס לא ישיר, כדי לנסות להעריך מתי תופיע האנמיה. ניקוליידס המליץ על מתן דם, כשההמוגלובין נמוך ב-g/dL 2 מההמוגלובין הממוצע הצפוי בשבוע ההיריון. אחרים המליצו על מתן דם כאשר ההמטוקריט נמוך מ-30% או 2 סטיות תקן מהממוצע לשבוע ההיריון.
ניתן לתת עירוי לחבל הטבור או לתוך הצפק העוברי. כאשר מדובר במחלה חמורה מוקדמת, יתכן קושי טכני בדיקור חבל הטבור ולכן ניתן עירוי תוך-צפקי. בעוברים מבוגרים וגדולים יותר, הרוב יעדיפו עירוי לחבל הטבור. שיעור ההישרדות המדווח בסדרות שונות הוא טוב, עד 89%. רוב העוברים שלא ישרדו, ימותו כתוצאה מההליך עצמו. יש הנותנים עירוי דם ישירות ללב העובר.
Scheier (2006) ו-Klumper (2009) דיווחו כי מדידת שיא זרימה סיסטולית בעורק מח תיכון, פחות מדויק בניבוי אנמיה לאחר עירוי דם עוברי ואף מדויק פחות לאחר 2 עירויים. ככלל, ניתן לחשב את מועד העירוי הבא לפי העובדה כי ההמטוקריט העוברי ירד ב-1% בכל יום.
טיפולים אחרים שנוסו ללא הצלחה כללו סינון פלזמה, מתן Promethazine ודיכוי חיסוני באמצעות סטרואידים.
יילוד
מטרת הניהול היא ליילד תינוק בריא ובשל. כאשר הניהול מבוסס על מדידות חוזרות של AOD450 במי השפיר או עירויי דם חוזרים, ניתן להעריך במקביל בשלות עוברית. לרוב ניתן להימנע מיילוד מוקדם באופן קיצוני. יש המציעים, שהעירוי האחרון לעוברים שנפגעו קשה יהיה בשבועות 30-32 ואח"כ ניתן סטרואידים בשבועות 32-34. יש הממשיכים עירויי דם עד שבוע 36. לאחר הלידה יש לקחת דגימת דם מחבל הטבור להערכת ההמוגלובין ולבצע קומבס ישיר.
פרוגנוזה
התמותה סביב הלידה (Perinatal mortality), הנגרמת ממחלת תמס דם כתוצאה מאיזואימוניזציה ל-D ירדה עם השימוש ב-Anti-D immunoglobulins. השימוש בעירוי דם תוך רחמי שיפר את ההישרדות עד כדי 90% באנמיה קשה בלבד וב-70% אם התפתח הידרופס. רוב העוברים שקיבלו עירויי דם מתפתחים באופן תקין.
דגלים אדומים
ביבליוגרפיה
קישורים חיצוניים
ראו גם
- לנושא הבא: מניעת אלואימוניזציה על רקע אי התאמת Prevention of alloimmunization due to RH incompatibility - RH
המידע שבדף זה נכתב על ידי ד"ר מאור ממן, מרכז רפואי רבין, בילינסון-השרון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק