הבדלים בין גרסאות בדף "כאב נוירופתי - תפקידן של תעלות נתרן תלויות מתח - The role of voltage-gated sodium channels in neuropathic pain"
מ (added Category:כאב using HotCat) |
|||
| (107 גרסאות ביניים של 4 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה= | |תמונה= | ||
| שורה 14: | שורה 12: | ||
}} | }} | ||
{{הרחבה|כאב נוירופתי}} | {{הרחבה|כאב נוירופתי}} | ||
| − | '''כאב | + | '''כאב נוירופתי''' הוא [[כאב]] הנגרם כתוצאה מ[[מחלות עצב]] מסוגים שונים. מחלות העצב גורמות לשינוי בתכונות ההולכה של התעלות היוניות בממברנת העצבים ההיקפיים, ירידת סף פוטנציאל הפעולה (Action potential) ויצירת מוקדים חשמליים אקטופיים (Ectopic). |
| + | |||
| + | עם זאת, לעיתים קיים פער בין עוצמת [[כאב נוירופתי|הכאב הנוירופתי]] לבין העדות למחלת עצב, קרי רמת ההרס של האקסונים. כלומר, ישנם מצבים בהם ישנו כאב נוירופתי בעוצמה גבוהה ללא עדות לאיבוד אקסונלי. | ||
| + | דוגמה למצב כזה היא [[Small fiber neuropathy|מחלת עצב של סיבי העצב הקטנים]] (SFN{{כ}}, Small Fiber Neuropathy) אשר אינם ניתנים להערכה ב[[בדיקות הולכת עצב|בדיקות ההולכה]] השגרתיות. הערכת העצבים הקטנים כוללת: הערכה קלינית, [[ביופסיית עור]], מבחן תחושתי כמותי ומבחנים של מערכת העצבים הבלתי-רצונית. הערכה זו לעיתים אינה מעידה על פגיעה בעצבים למרות נוכחות כאב נוירופתי. | ||
| + | דוגמאות נוספות לכאב נוירופתי ללא עדות של מחלת עצב הן תסמונות כגון: | ||
| + | * [[תסמונת כפות הרגליים השורפות]] (Burning feet syndrome) | ||
| + | * [[תסמונת הפה השורף]] (Burning mouth syndrome) | ||
| + | * [[וולוודיניה|כאב באזור איבר המין]] (Vulvodynia, burning vagina syndrome) | ||
| + | |||
| + | כאב נוירופתי ללא עדות של מחלת עצב כולל קשת רחבה של הסתמנויות. ניתן להסיק מכך שקיימים מצבים בהם יש ליקוי תפקודי בהולכה החשמלית בעצבים ההיקפיים אשר אינו גורם להרס שלהם. הסברה היא כי במצבים של כאב ללא עדות של מחלת עצב, תעלות יוניות הן האחראיות לליקוי התפקודי בהולכה החשמלית הגורם לכאב זה. | ||
| + | |||
| + | אף על פי שהמונח "מחלת עצב" מתאר לרוב תהליכים הגורמים לנזק עצבי, ניתן להתייחס לתסמונות הנובעות מחוסר תפקוד של ההולכה החשמלית העצבית כסוג של מחלת עצב. | ||
| + | |||
| + | ידוע כי פגמים גנטיים בתעלות היוניות אחראים לקשת של מחלות אשר רובן מתבטאות באירועים של הפרעה בפעילות הרקמה המעוררת. המחלה הראשונה שנמצאה כנגרמת על ידי פגם בתעלות היוניות היא [[Hyperkalemic periodic paralysis|שיתוק התקפי היפרקלמי]] ׁ(Hyperkalemic periodic paralysis). מחלה זו נגרמת עקב מוטציה בתעלת ה[[נתרן]] תלוית מתח מסוג Na<sub>v</sub>1.4 המבוטאת בממברנת סיבי השריר המשורטט (Skeletal muscle). מאז התגלו מחלות נוספות הקשורות לתעלות המערבות את מערכת העצבים ההיקפית והמרכזית. במערכת העצבים ההיקפית ההסתמנות היא לרוב של התקפי [[שיתוק]] או מיוטוניה (Myotonia). | ||
| + | |||
| + | הפרעה תפקודית של התעלות היוניות כסיבה ראשונית לכאב נוירופתי לא זכתה להתייחסות מחקרית רבה. מתבקש, אם כן, היה לחקור את תפקוד התעלות היוניות בעצבים ההיקפיים במקרים של כאבים נוירופתיים בלתי מוסברים. התפרסמו מספר עבודות, אשר הראו כי מוטציות בתעלת הנתרן מסוג Na<sub>v</sub>1.7, המבוטאת בממברנת העצבים ההיקפיים, גורמות לתסמונות של כאבים נוירופתיים התקפיים או היעדר תחושת כאב. עבודות אלו מראות למעשה את קצה הקרחון בכל הנוגע לקשר שבין כאב נוירופתי והפרעות תחושה אחרות ובין ליקוי בתפקוד התעלות היוניות בממברנת העצבים ההיקפיים. | ||
| + | |||
| + | מוטציות בתעלת הנתרן Na<sub>v</sub>1.7 תוארו כקשורות ל[[תסמונות כאב]]: מוטציות הגורמות לאיבוד תפקוד (L-O-F{{כ}}, Loss Of Function) גורמות לחוסר יכולת סלקטיבית לחוש כאב. מוטציות הגורמות לתפקוד יתר (G-O-F{{כ}}, Gain Of Function) דווחו כקשורות לשתי תסמונות: [[PEPD|כאב התקפי קיצוני]] (PEPD{{כ}}, Paroxysmal Extreme Pain Syndrome) ו[[IEM|אריתרומללגיה תורשתית]] (IEM{{כ}}, Inherited Erythromelalgia). שתיהן מאופיינות בהתקפים של כאב קשה והיפראקסיטביליות (Hyperexcitability) אוטונומית. תוארו גם מוטציות ב-Na<sub>v</sub>1.7 במספר לא מבוטל יחסית של חולים עם מחלות עצב של הסיבים הקטנים. | ||
| + | |||
| + | עדיין נותר כר רחב למחקר בנוגע לתפקיד של תעלות נתרן ותעלות יוניות אחרות בפתופיזיולוגיה של תסמונות כאב. זיהוי מוטציות בתעלות היוניות כסיבה לתסמונות כאב עשוי להביא לפיתוח [[תרופות]] סלקטיביות בעלות אפקטיביות רבה ועם פחות תופעות לוואי, אשר יספקו טיפול יעיל יותר מהטיפולים הקיימים. | ||
| + | |||
| + | ==תעלות נתרן תלויות מתח (VGSC, {{כ}}Voltage-Gated Sodium Channels)== | ||
| + | ===סוגים=== | ||
| + | ל[[תעלות נתרן תלויות מתח]] תפקיד מרכזי ביצירת פוטנציאלי הפעולה בתאי עצב המוליכים כאב. {{ש}}מספר סוגים של תעלות נתרן תלויות מתח מבוטאים בתאי העצב החישתיים ובתאי העצב של מערכת העצבים הבלתי-רצונית. | ||
| + | |||
| + | זוהו תשעה סוגים של תעלות נתרן תלויות מתח ביונקים (Na<sub>v</sub>1.1 - Na<sub>v</sub>1.9), אשר מקודדות על ידי הגנים: SCNIA{{כ}}, SCN5A ו-SCNSA-SCNIIA{{כ}}{{הערה|שם=הערה1|Dib-Hajj SD, Cummins TR, Black JA, Waxman SG, Annu Rev Neurosci, 2010; 33,325}}. התעלות מהסוגים השונים זהות ב-50 אחוזים{{כ}} לפחות ברצף חומצות האמינו שלהן, אך הן שונות בקינטיקה שלהן, ברגישותן למתח הממברנה וברגישותן לחסימה על ידי [[Tetradotoxin]]) TTX). מספר גנים מקודדים לקבוצות שונות של תעלות נתרן הדומות זו לזו: | ||
| + | * תעלות Na<sub>v</sub>1.7, Na<sub>v</sub>1.1 ,Na<sub>v</sub>1.2 ,Na<sub>v</sub>1.3 מבטאות דמיון רב ביניהן - כולן רגישות לחסימה על ידי TTX, הן מבוטאות בתאי עצב והגן שמקודד להן ממוקם בכרומוזום 2 (מתואר בשפה הגנטית 2q23-24) | ||
| + | * תעלות Na<sub>v</sub>1.5 ,Na<sub>v</sub>1.8 ,Na<sub>v</sub>1.9 זהות ב-{{כ}}64 אחוזים ברצף חומצות האמינו שלהן, הן עמידות לחסימה על ידי TTX, מבוטאות בלב וב-Dorsal Root Ganglia) DRG) והגן שמקודד להן ממוקם בכרומוזום 3 (מתואר בשפה הגנטית 3p21-14) | ||
| + | * תעלת Na<sub>v</sub>1.4 מבוטאת בשריר משורטט ו-Na<sub>v</sub>1.6 מבוטאת בעיקר במערכת העצבים המרכזית (טבלה 1){{כ}}{{הערה|שם=הערה1}}{{הערה|שם=הערה2|Catterall WA, Neuron 2000; 26,13}} | ||
| + | |||
| + | ===מבנה=== | ||
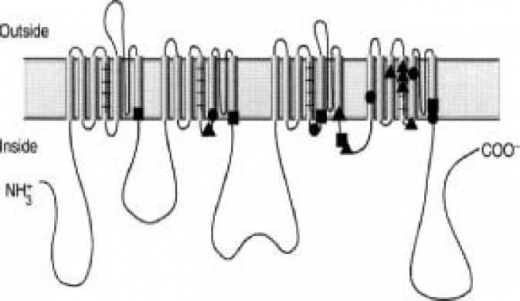
| + | תעלות הנתרן מורכבות משתי יחידות: α ו-β, אשר עוברות שינוי במבנה המרחבי שלהן כתוצאה מדפולריזציה (Depolarization) של ממברנת התא. יחידת α מרכיבה את החלק העיקרי של התעלה ויוצרת את ה-Pore (הנקב שדרכו חודר יון הנתרן דרך הממברנה). התעלה מורכבת מארבעה אזורים (Domains) תוך-ממברנליים, כאשר כל אחד מהם מורכב משישה מקטעים (S1-S6). מקטעים S5 ו-S6 והשרשראות המקשרות ביניהם יוצרים את הנקב. בכל התעלות מקטע S4 מהווה את חיישן המתח (Voltage sensor) והוא עשיר בחומצות אמינו חיוביות (ארגינין וליזין) המופיעות בכל מקום שלישי ברצף{{הערה|שם=הערה2}}{{הערה|שם=הערה3|Duclohier H, Biochim Biophys Acta, 2009; 1788,2374}}{{הערה|שם=הערה4|Fozzard HA, Hanck DA, Physiol Rev, 1996; 76,887}}. הוכח כי שינוי במתח הממברנה גורם לשינוי במבנה המרחבי של S4 הגורם לסגירה או לפתיחה של התעלה. מוטציות ב-S4 גורמות להפרעות תפקודיות של התעלה ולמחלות כגון [[Paramyotonia congenita]]. | ||
| + | |||
| + | [[קובץ:תעלת נתרן1.png|ממוזער|מרכז|520 פיקסלים|תמונה 1. איור סכמטי של תעלת נתרן רגישת מתח. התעלה היא למעשה חלבון ארוך המתפתל משני צידי הממברנה, ויוצר חלקים אינטרה, אקסטרה וטרנס-ממברנליים. התעלה מורכבת מארבעה Domains, כאשר כל Domain מורכב משישה סגמנטים α-הליקליים (מספרים 1–6). סגמנט 4 בכל Domain הוא הרגיש למתח (Voltage sensor), וסגמנטים 5 ו-6 יוצרים את קירות הנקב (Pore)]] | ||
| + | |||
| + | ===פיזור בתאי הגוף=== | ||
| + | תעלות נתרן תלויות מתח מבוטאות באופן נרחב על פני העצבים ההיקפיים היות שהן בעלות תפקיד מרכזי ביצירת פוטנציאל הפעולה בתא עצב. תאי העצב ב-DRG מבטאים סוגים שונים של תעלות נתרן תלויות מתח, בפרט Na<sub>v</sub>1.8, Na<sub>v</sub>1.7 ו-Na<sub>v</sub>1.9. תעלת Na<sub>v</sub>1.7 מבוטאת למעשה בכל תאי העצב של ה-DRG; {{כ}}Na<sub>v</sub>1.8 ו-Na<sub>v</sub>1.9 מבוטאות בעיקר בתאי העצב הקטנים, כולל תאי העצב המוליכים תחושה של כאב. <br /> | ||
| + | |||
| + | טבלה 1. הביטוי של תעלות נתרן תלויות מתח ברקמות השונות | ||
| + | |||
| + | {| class="wikitable" dir="ltr" | ||
| + | |- | ||
| + | |Isoform type | ||
| + | |Distribution | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.1 | ||
| + | |CNS neurons (primarily in cell bodies); cardiac myocytes | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.2 | ||
| + | |CNS neurons (primarily unmyelinated and premyelinated axons) | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.3 | ||
| + | |CNS - normally expressed during embryogenesis.{{ש}} | ||
| + | Continues to be expressed in sympathetic neurons in adults.{{ש}} | ||
| + | Upregulated in DRG neurons after injury | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.4 | ||
| + | ||Skeletal muscle | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.5 | ||
| + | |Cardiac myocytes; immature and denervated skeletal muscles | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.6 | ||
| + | |CNS neurons (cerebellum, cerebral cortex, hippocampus, brainstem, spinal cord); astrocytes; Schwann cells; DRG; sensory and motor axons in the PNS; node of Ranvier in the CNS and PNS | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.7 | ||
| + | |DRG neurons (all type of neurons); sympathetic neurons; Schwann cells and neuroendocrine cells | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.8 | ||
| + | |DRG neurons (small and medium-sized neurons) | ||
| + | |- | ||
| + | |Na<sub>v</sub>1.9 | ||
| + | |DRG neurons (small-sized nociceptive neurons); trigeminal neurons | ||
| + | |} | ||
| + | CNS - Central Nervous System{{כ}}, PNS - Peripheral Nervous System{{כ}}, DRG - Dorsal Root Ganglia | ||
| + | |||
| + | ==הקשר בין תעלות נתרן תלויות מתח ל[[כאב נוירופתי]]== | ||
| + | |||
| + | מספר עבודות הדגימו את תפקידן של תעלות Na<sub>v</sub>1.8 ,Na<sub>v</sub>1.7 ו-Na<sub>v</sub>1.9 בקליטה והולכת כאב. עבודות בנושא זה הדגימו את הממצאים הבאים: | ||
| + | * עכברים חסרי תעלת Na<sub>v</sub>1.8 הראו הפרעה בקליטה של גירוי כאב שמקורו מטמפרטורה גבוהה וכאב ממקור וִיסְצֶרָלִי (Visceralׂ){{הערה|שם=הערה5|Akopian AN, Souslova V, England S, et al., Nat Neurosci, 1999; 2,541}} | ||
| + | * נמצא כי ל-Na<sub>v</sub>1.9 תפקיד חשוב בכאב [[דלקת - Inflammation|דלקתי]] ובכאב כתוצאה מ[[נוירופתיה סוכרתית]] | ||
| + | * נמצא ביטוי גבוה של תעלת Na<sub>v</sub>1.7 בתאי עצב של ה-DRG המעצבבים אזורי דלקת וכן באקסונים של [[נוירומות]] כואבות{{הערה|שם=הערה6|Strickland IT, Martindale JC, Woodhams PL, et al., Eur J Pain, 2008; 12,564}} | ||
| + | * נמצא כי חוסר מוחלט של Na<sub>v</sub>1.7 בעכברים (Knocked out mice) גורם ל[[תמותה נאונטלית]]{{הערה|שם=הערה7|Nassar MA, Stirling LC, Forlani G, et al., Proc Natl Acad Sci USA, 2004; 101,12706}} | ||
| + | |||
| + | מספר תסמונות כאב בבני אדם תוארו כתוצאה ממוטציות בתעלת Na<sub>v</sub>1.7. תעלה זו מקודדת על ידי הגן SCN9A המצוי בזרוע הארוכה של כרומוזום 2. התעלה מבוטאת ברמה גבוהה בעצבים התחושתיים ההיקפיים, בתאי העצב של ה-DRG, כולל העצבים המוליכים כאב (Nociceptive) וכן בעצבים של המערכת הבלתי-רצונית בפלקסוסים הסימפטטים. תעלה זו אחראית על שלב הדפולריזציה של פוטנציאל הפעולה בתאים הניתנים לעירור (Excitable cells). צביעות אימונוהיסטוכימיות (Immunohistochemistryׂ) מדגימות כי התעלה נמצאת בטרמינלים העצביים ולכן סביר שיש לה תפקיד בתחילת יצירת פוטנציאל הפעולה. | ||
| + | |||
| + | ==מוטציות בתעלת הנתרן Na<sub>v</sub>1.7 ותסמונות כאב== | ||
| + | מספר מוטציות בגנים המקודדים לתעלות נתרן תלויות מתח עלולות לגרום לתסמונת המאופיינות בהפרעה בחישת כאב בשני מנגנונים: | ||
| + | * מוטציות הגורמות לתפקוד יתר של התעלה עלולות להתבטא בתסמונות המאופיינות בכאב נוירופתי: | ||
| + | ** אריתרומללגיה תורשתית | ||
| + | ** כאב התקפי קיצוני | ||
| + | ** מחלת עצב של הסיבים הדקים | ||
| + | * מוטציות הגורמות לאיבוד תפקוד של תעלות נתרן תלויות מתח מתבטאות ב[[Congenital Insensitivity to Pain|תסמונת חוסר מולד של תחושת הכאב]] (CIP{{כ}}, Congenital Insensitivity to Pain) | ||
| + | {{ש}}מכאן, שטווח ההסתמנות של מוטציות של תעלת Na<sub>v</sub>1.7 רחב מאוד. הדבר מעלה את השאלה בנוגע לצורך לבדיקת הגן SCN9A בקרב חולים עם מחלת עצב אידיופתית של סיבי העצב הקטנים וכאב נוירופתי לא מוסבר. | ||
| + | |||
| + | להלן טבלה המסכמת את תסמונות כאב הנגרמות על ידי מוטציות בתעלת הנתרן Na<sub>v</sub>1.7: | ||
| + | {| class="wikitable" dir="ltr" | ||
| + | |- | ||
| + | |Pain Syndrome | ||
| + | |Type of mutation | ||
| + | |Onset | ||
| + | |Clinical features | ||
| + | |- | ||
| + | |IEM | ||
| + | |G-O-F | ||
| + | |Childhood, adolescence. | ||
| + | |Attacks of severe neuropathic pain, erythema, swelling and skin warmth. feet > hands Paroxysmal course | ||
| + | |- | ||
| + | |PEPD | ||
| + | |G-O-F | ||
| + | |Infancy, childhood | ||
| + | |Attacks of severe neuropathic pain and skin flushing. | ||
| + | Initially affecting perirectal areas, later affecting ocular, maxillary | ||
| + | and submandibular areas Paroxysmal course | ||
| + | |- | ||
| + | |Mixed IEM-PEPD | ||
| + | |G-O-F | ||
| + | |Infancy | ||
| + | |Mixed IEM-PEPD phenotype Paroxysmal course | ||
| + | |- | ||
| + | |SFN Chronic pain | ||
| + | |G-O-F | ||
| + | |Adolescence, adulthood | ||
| + | |Neuropathic pain usually begins distally, often generalized with time, autonomic symptoms are common. Continuous course | ||
| + | |- | ||
| + | |CIP | ||
| + | |L-O-F | ||
| + | |Birth | ||
| + | |Inability to experience any sort of pain | ||
| + | |} | ||
| + | |||
| + | ===מוטציות הגורמות לתפקוד יתר של התעלה=== | ||
| + | ====אריתרומללגיה==== | ||
| + | [[אריתרומללגיה]] היא תסמונת נדירה המאופיינת בהתקפי [[אנגיואדמה|בצקת]], [[כאבים]] קשים, אודם ו[[חום - Fever|חום]] בחלקים הדיסטלים של הגפיים{{הערה|שם=הערה8|Mitchell S.W, Am J Med Sci, 1878; 76.17}}. התסמונת תוארה לראשונה בשנת 1878 על ידי הנוירולוג האמריקאי ד"ר מיטשל אשר טבע את שמה Erythros) Erythromelalgia - אדום, Melos - גפה, Algos - כאב). | ||
| + | ניתן להבדיל בין שני סוגים של אריתרומללגיה: | ||
| + | * אריתרומללגיה ראשונית (Primary erythromelalgia) או אריתרומללגיה תורשתית - תסמונת גנטית אשר לרוב מועברת בתורשה אוטוזומלית דומיננטית (Autosomal dominant) ומופיעה ללא קשר למחלות אחרות | ||
| + | * אריתרומללגיה נרכשת המשנית למחלות שונות, כגון: | ||
| + | ** מחלות [[מיאלופרוליפרטיביות]] (Myeloproliferative disorders) | ||
| + | ** [[פוליציטמיה]] (Polycythemia) | ||
| + | ** [[תרומבוציטופניה]] (Thrombocytopenia) | ||
| + | ** [[מחלות אוטואימוניות]] ודלקתיות | ||
| + | ** [[Vasculitis|דלקת של כלי הדם]] (Vasculitis) | ||
| + | ** [[סוכרת]] | ||
| + | ** [[יתר לחץ דם]] | ||
| + | ** מחלת עצב | ||
| + | ** סיבוך של טיפול תרופתי | ||
| + | |||
| + | ====אטיולוגיה==== | ||
| + | המקור לאריתרומללגיה תורשתית הוא מוטציות בגן SCN9A אשר גורמות לשינוי בקינטיקה של תעלת הנתרן תלוית מתח Na<sub>v</sub>1.7. הערכה ביופיזיקלית של התעלות המוטנטיות באריתרומללגיה תורשתית הראתה ירידה בסף הפתיחה של התעלה ועיכוב בחוסר-הפעלה. שינויים אלה מסבירים היטב את הקליניקה הנובעת מפעילות יתר של התעלות. | ||
| + | בשנת 2004 תיאר Yang לראשונה שתי משפחות סיניות עם המחלה אשר נמצאו בהן מוטציות מסוג L858H ,I848T) Missense) באזורים שמורים של הגן SCN9A המקודד לתעלת הנתרן תלוית מתח Na<sub>v</sub>1.7{{כ}}{{הערה|שם=הערה10|Yang Y, Wang Y, Li S, et al., J Med Gen, 2004; 41,171}}. בהמשך תוארו משפחות נוספות מארצות הברית וממקומות אחרים בעולם. | ||
| + | |||
| + | ====קליניקה==== | ||
| + | אריתרומללגיה תורשתית (IEM{{כ}}, Inherited Erythromelalgia) מתבטאת לרוב בעשור הראשון לחיים ואף תוארו חולים בהם המחלה פרצה כבר בשנה הראשונה לחיים. | ||
| + | חולי אריתרומללגיה תורשתית סובלים מהתסמינים והסימנים הבאים: | ||
| + | * התקפים סוערים של כאבים נוירופתיים שורפים וקשים בגפיים המלווים באודם ונפיחות בגפה המעורבת. כפות הרגליים מעורבות לעיתים קרובות, אך ההתקפים מופיעים בשכיחות פחותה גם בגפיים העליונות | ||
| + | * [[אלודיניה]] (Allodynia) ניכרת, המתבטאת בהתפרצות של כאבים עזים המושרים על ידי גירויים קלים, כגון מגע בגד וכולי | ||
| + | קירור הגפה מקל לרוב על הכאב. | ||
| + | ההתקפים עלולים להיות תכופים עד כדי מספר פעמים ביום והם גורמים לפגיעה משמעותית באיכות החיים{{הערה|שם=הערה9|Waxman SG, Neurology, 2007;69,505}}. | ||
| + | |||
| + | ====טיפול==== | ||
| + | המחלה עמידה לרוב הטיפולים התרופתיים. פורסמו דיווחים על חולים בודדים שהגיבו לתרופות הבאות: | ||
| + | * [[Carbamazepine]] | ||
| + | * [[Oxcarbazepine]] | ||
| + | * [[Gabapentin]] | ||
| + | * [[Mexiletine]] | ||
| + | * הזלפות של [[Lidocaine]] | ||
| + | |||
| + | ====כאב התקפי קיצוני==== | ||
| + | תסמונת זו ידועה גם בשמה הישן - [[Familial rectal pain syndrome]], עקב השכיחות הגבוהה של התקפי הכאב באזור הרקטום אף על פי שאזורים אחרים בגוף מעורבים אף הם. | ||
| + | התיאור הראשון של משפחה הסובלת מתסמונת זו התפרסם לראשונה בשנת 1959. בני המשפחה הנגועים סבלו מהתקפים קצרים של כאב עז באזור הרקטום, העיניים והלסת התחתונה המלווה בהסמקה של העור באזורים הכואבים. בעבודה שפורסמה ב-Neurology{{כ}} (2007) על ידי Fertleman וחברים, נאספו הנתונים מכל המשפחות הידועות בעולם שניתן היה להשיגן. בסך הכל נכללו 77 חולים מתוך 15 משפחות, כאשר שני מקרים היו ספורדיים{{הערה|שם=הערה11|Fertleman CR, Ferrie CD, Aicardi J, et al., Neurology, 2007; 69,586}}. | ||
| + | |||
| + | ====אטיולוגיה==== | ||
| + | התסמונת היא תוצאה של מוטציות בגן SCN9A המצוי על כרומוזום 2 ומקודד לתעלת הנתרן Na<sub>v</sub>1.7. המחלה עוברת בתורשה דומיננטית של תפקוד יתר, כלומר מוטציה הקיימת באלל בודד גורמת לעודף תפקוד של התעלה ולפתיחה מוקדמת וממושכת יותר שלה. שינויים אלה בתכונות ההולכה של התעלה מסבירים את ההסתמנות הקלינית של התסמונת. | ||
| + | במחקר גנטי שפורסם ב-Neuron בדצמבר 2006 והתבסס על טכניקות של Linkage analysis אותר הגן SCN9A האחראי למחלה{{הערה|שם=הערה12|Fertleman CR, Baker MD, Parker KA, et al., Neuron, 2006; 52,767}} ונמצאו 8 מוטציות, כולן מסוג Missense mutations ב-8 מתוך 13 משפחות שנבדקו. | ||
| + | בדיקה אלקטרופיזיולוגית In vitro של התעלות Na<sub>v</sub>1.7 המוטנטיות הראתה שינוי בתכונות ההולכה של התעלות, אשר התבטא בהשבתה (Inactivation) לא שלמה של התעלות ובעלייה ברגישות לדפולריזציה. שינויים אלה גורמים ליצירה מוקדמת של פוטנציאל הפעולה. | ||
| + | |||
| + | ====קליניקה==== | ||
| + | התסמינים של המחלה מתחילים כבר בינקות ובילדות מוקדמת, ייתכן אף בתקופה העוברית, זאת לנוכח התקפים של [[ברדיקרדיה|דופק איטי]] (Bradycardia) שנצפים בעוברים ואופייניים למחלת כאב התקפי קיצוני. התסמונת מאופיינת בסימנים הבאים: | ||
| + | * התקפי כאב עז בדרך כלל באזור הרקטום, העיניים והלסתות (Submaxillary or submandibular). הכאב יכול להתפשט לאזורים הסמוכים, לאזור שסביב העין ולחיץ בין הנקבים. בהתקפים חזקים החולים דיווחו על כאב בכל הגוף. החולים מתארים את הכאב כעמוק וחזק ביותר (הכאב החזק ביותר שהם חוו). הילדים נראים מבועתים בעת ההתקף, ולא ניתן להרגיעם | ||
| + | * באופן טיפוסי בעת ההתקף מופיע שינוי צבע, [[אריתמה]] (Erythema) של העור באזור הכואב. לעיתים הסומק חורג לאזורים נרחבים יותר, למשל לפנים, אזור הישבן והירכיים ומדמה צורת ליצן (Harlequin). המחלה נמשכת לאורך כל החיים, אך תדירות ההתקפים המרבית היא בגיל הילדות הצעירה. עם ההתבגרות קיימת ירידה בתדירות ההתקפים, והם נעשים נסבלים יותר | ||
| + | * במבוגרים הסומק והכאב מערבים לעיתים קרובות את אברי המין וההתקפים יכולים להיות מזורזים על ידי גורמים כגון יחסי מין ומתן שתן{{הערה|שם=הערה9}} | ||
| + | * בקרב ילדים צעירים שכיחים [[התקפים טונים]] (Tonic) לא [[אפילפסיה|אפילפטיים]], בעוד שהם נדירים במבוגרים. ההתקפים מלווים בכאבים חזקים במיוחד ומאופיינים בסימנים הבאים: תנוחה טונית, [[נוקשות שרירים]], [[דום נשימה]] (Apnea), דופק איטי והסמקה ללא בכי. עם סיום ההתקף הנוקשות משתחררת והנשימה חוזרת | ||
| + | * גורמים המזרזים את הופעת ההתקף יכולים להיות: | ||
| + | ** ניגוב הישבן | ||
| + | ** יציאות | ||
| + | ** החדרת מד-חום לפי הטבעת (Anus) | ||
| + | ** אכילה | ||
| − | + | ====טיפול==== | |
| + | החולים במחלה מגיבים טוב יותר לטיפול בהשוואה לחולי אריתרומללגיה: Carbamazepine נמצא יעיל באופן חלקי בהורדת עוצמת ומספר ההתקפים. [[אופיואידים]] ו-[[t:Elatrol|Elatrol]] {{כ}}(Amitriptyline) לא הראו יעילות. | ||
| − | + | ====תסמונת מעורבת - אריתרומללגיה תורשתית וכאב התקפי קיצוני==== | |
| + | שתי תסמונת הכאב, אריתרומללגיה תורשתית וכאב התקפי קיצוני, אשר אינן חופפות, נגרמות על ידי שתי קבוצות שונות של מוטציות הגורמות לתפקוד יתר בתעלת הנתרן Na<sub>v</sub>1.7. בכאב התקפי קיצוני המוטציות פוגעות בהשבתה של התעלה וגורמות ליצירת זרמים קבועים דרך התעלה. באריתרומללגיה תורשתית המוטציות גורמות לתזוזה בסף השפעול לכיוון היפרפולריזציה (Hyperpolarization) והאטה של הדאקטיבציה (Deactivation). ככל הנראה השוני בתכונות ההולכה של תעלת הנתרן בין שתי התסמונות אחראי לשוני הפנוטיפי. | ||
| − | + | בשנת 2008,{{כ}} Estacion וחברים תיארו מוטציה חדשה ב-Na<sub>v</sub>1.7 {{כ}}(A1632E) בחולה עם הסתמנות קלינית ייחודית שכללה מאפיינים של כאב התקפי קיצוני ואריתרומללגיה תורשתית{{הערה|שם=הערה13|Estacion M, Dib-Hajj SD, Benke PJ, J Neurosci, 2008; 28,11079}}. החולה המתואר סבל מהסימנים הקליניים הבאים: | |
| + | * התקפי דופק אטי קיצוני מ[[לידה]] שהצריכו ביצוע [[החייאת לב-ריאה]] מספר פעמים והשתלת [[קוצב לב]] בגיל 18 חודשים | ||
| + | * בהמשך הופיעו התקפים של כאב קשה ואודם באזור הרקטלי (אופייני לכאב התקפי קיצוני) | ||
| + | * בגיל 3 סבל החולה מהתקפים תכופים של כאב ואריתמה באזור הרקטלי, סביב העין והלסת (Harlequin appearance) וכן מהתקפים טיפוסיים של אריתרומללגיה תורשתית שהתאפיינו באודם, בצקת וכאבים קשים בכפות הרגליים והידיים | ||
| − | + | בשימוש בשיטות רישום Voltage clamp הראו שהתעלה המוטנטית (A1632E) הראתה תכונות אלקטרופיזיולוגיות המשותפות לשתי התסמונות. נראה לפיכך, שהמוטציה A1632E היא החוליה המקשרת בין כאב התקפי קיצוני לאריתרומללגיה תורשתית וייתכן כי שתי התסמונות מהוות למעשה רצף פיזיולוגי. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ====כאב נוירופתי כרוני ומחלת עצב של הסיבים הדקים==== | |
| − | + | שתי עבודות שהתפרסמו ב-2011 ו-2012 דיווחו על מוטציות ב-Na<sub>v</sub>1.7 בחולים עם כאב נוירופתי כרוני{{הערה|שם=הערה14|Dabby R, Sadeh M, Gilad R, et al, J Neurol Sci, 2011; 301,90}} ונוירופתיה של סיבי העצב הקטנים. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | שתי עבודות שהתפרסמו | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Dabby וחברים תיארו מוטציה חדשה ב-W1550R) Na<sub>v</sub>1.7) בחולה עם כאב נוירופתי אידיופתי קשה ומתמשך. החולה, אישה בת 69, החלה לסבול מכאב שורף בכפות הרגליים בגיל 56. הכאב הנוירופתי התפשט בהדרגה לחלקי גוף נרחבים: גפיים עליונות ותחתונות, בטן, בית החזה והגב והיה עמיד למגוון רב של טיפולים תרופתיים. | |
| − | |||
| + | הכאב היה מייסר עד כדי כך שגרם לחולה למחשבות [[אובדנות|אובדניות]]. בדיקות אלקטרופיזיולוגיות, QST {{כ}}(Quantitative Sensory Testing) וביופסית עור היו תקינות. המוטציה W1550R גורמת להחלפה של חומצת האמינו טריפטופן, בסגמנט טרנסממברנלי S2 באזור IV של התעלה. חומצת האמינו טריפטופן שמורה באזור זה היטב לאורך האבולוציה והחלפתה גורמת לשינוי במטען החלבון והפיכתו למסיס בשומן. | ||
| + | Farber וחברים זיהו מוטציות חדשות ב-Na<sub>v</sub>1.7 בשמונה מתוך 28 חולים (28.6 אחוז) עם מחלת עצב אידיופתית של סיבי העצב הקטנים{{הערה|שם=הערה15|Farber CG, Hoeijmakers JC, Ahn HS, et al., Ann Neurol, 2012 ;71,26}}. גיל החולים נע בין 14 ל-68 שנים, כאשר ברובם התסמינים הראשונים התבטאו בכאבים שורפים בכפות הרגליים. בשלושה חולים הכאב הנוירופתי החל באופן מפושט לפני שעירב את החלקים הדיסטלים. באמצעות טכניקת Voltage clamp הראו החוקרים, כי כל המוטציות היו מוטציות הגורמות לתפקוד יתר, ובכל המקרים התכונות האלקטרופיזיולוגיות של Na<sub>v</sub>1.7 היו שונות מאלה של כאב התקפי קיצוני ואריתרומללגיה תורשתית. | ||
| − | + | ===מוטציות הגורמות לחוסר תפקוד של התעלה=== | |
| − | + | ====[[Congenital Insensitivity to Pain|חוסר מולד של תחושת הכאב]]==== | |
| − | + | כאב הוא חוש בסיסי, אשר התפתח במהלך האבולוציה על מנת להגן מפני נזק רקמתי. בניגוד לחסר מולד של חושים אחרים כגון [[לקות שמיעה|שמיעה]] או [[לקות ראייה|ראיה]] אשר שכיחים יחסית, הרי שחסר מולד של חוש הכאב הוא נדיר ביותר. המקרה הראשון של חסר מולד בתחושת כאב תואר כבר בתחילת המאה העשרים. תוארו קומץ חולים, אשר סווגו כסובלים מ-Congenital indifference to pain או Congenital insensitivity to pain (הידועה גם כנוירופתיה תורשתית חישתית אוטונומית מסוג HSAN-V). מבחינה היסטורית שני המצבים נבדלים בהיעדר מחלת עצב או קיומה. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ====אטיולוגיה==== | |
| − | + | זוהי מחלה אוטוזומלית רצסיבית (Autosomal recessive), כלומר יש צורך בקיום המוטציה בשני האללים של הגן SCN9A על מנת שיהיה ביטוי של המחלה. רוב המחלות הרצסיביות מתאפיינות באיבוד פונקציה של תוצר הגן וזאת משום שאין ייצור חלבון תקין על ידי אף לא אחד מן האללים. בניגוד לשתי המחלות הקודמות - שאופיינו בפעילות יתר של התעלה היונית - הרי שהמחלה של חוסר מולד של תחושת הכאב מאופיינת בחוסר פעילות של תעלת הנתרן Na<sub>v</sub>1.7. בכל שלוש המשפחות שתוארו נמצאה מוטציות הומוזיגוטיות (Homozygous) שונות מסוג Nonsense mutations בגן SCN9A, באקסונים 10, 13, 15: שתי מוטציות גרמו ליצירת חלבון קטוע (Truncated protein) ואחת הייתה מסוג Frame shift mutation. | |
| − | |||
| − | 13 | ||
| − | |||
| − | 15. | ||
| − | |||
| + | ====קליניקה==== | ||
| + | חוסר מולד של תחושת הכאב נחקר בעבודה שפורסמה ב-Nature בשנת 2006. | ||
| + | בעבודה זו תוארו חולים משלוש משפחות אשר סבלו מתופעה ייחודית של חוסר יכולת לחוש כאב מכל סוג שהוא{{הערה|שם=הערה16|Cox JJ, Reimann F, Nicholas AK, et al., Nature, 2006; 444,894}}. כל יתר סוגי התחושה היו תקינים לחלוטין. כמו כן, מערכות העצבים המרכזית וההיקפית היו תקינות. <br /> | ||
| + | החולה הידוע הראשון בעבודה זו היה ילד בן 10 מצפון פקיסטן אשר עסק לפרנסתו במופעי רחוב. ילד זה היה מוכר לשירות הרפואי עקב היעדר תחושת כאב. בהופעותיו היה מחדיר סכינים לגופו ומהלך על גחלים בוערות ללא כל כאב. סופו שנהרג לרוע המזל, כאשר קפץ מגג של בית. נחמה פורתא היא שלא סבל במותו. | ||
| + | בעבודה נחקרו שלוש משפחות בעלות קרבת דם לילד המתואר, כולן משבט קורשי שבצפון פקיסטן. בסהך הכל נמצאו 6 פרטים אשר היו נעדרי תחושת כאב. העבודה מצאה בחולים אלו את התמונה הקלינית והמעבדתית הבאה: | ||
| + | * חוסר תחושת כאב מלידה, למעשה עוד בחיים העובריים. רוב המשפחות שמו לב לקיומו כבר בשלבים הראשונים של הילדות | ||
| + | * במהלך הילדות הופיעו בחולים פציעות בשפתיים ובלשון עקב נשיכות עצמיות | ||
| + | * הילדים היו ללא תחושת כאב גם במצבים הבאים: | ||
| + | ** במשחק כדורגל | ||
| + | ** לאחר [[שברים]] | ||
| + | ** [[דלקת עצם]] (Osteomyelitis) | ||
| + | ** חתכים | ||
| + | ** [[כוויות]] ועוד | ||
| + | * כל הילדים היו בעלי אינטליגנציה תקינה כפי שהעידו הוריהם, מוריהם והרופאים המטפלים | ||
| + | * הבדיקה העצבית בקרב כל הילדים הייתה תקינה לחלוטין, למעט היעדר תחושת כאב. הילדים חשו היטב מגע, קור, חום, תחושת מצב, דגדוג ולחץ (לא כואב). הם הבדילו ללא קושי בין משקאות קרים וחמים, אך סבלו מכוויות חום משום שלא חשו את הכאב. הילדים החולים לא סבלו מתסמינים או סימנים של מערכת העצבים הבלתי רצונית, עובדה מפתיעה ולא מוסברת כשלעצמה, וזאת לנוכח הימצאות תעלת Na<sub>v</sub>1.7 בעצבים האוטונומיים | ||
| + | * בחלק מהילדים בוצעו בדיקת [[MRI|דימות תהודה מגנטית]] (MRI{{כ}}, Magnetic Resonance Imaging) של המוח וביופסית העצב הסורלי (Sural nerve biopsy) אשר היו תקינות | ||
| + | ==ביבליוגרפיה== | ||
| + | <blockquote> | ||
| + | <div style="text-align: left; direction: ltr"> | ||
| + | {{הערות שוליים|יישור=שמאל}} | ||
| + | </div> | ||
| + | </blockquote> | ||
| − | תעלות נתרן וכאב נוירופאתי | + | ==קישורים חיצוניים== |
| + | * [http://www.israel-neurology.co.il/journal/june_10.pdf תעלות נתרן וכאב נוירופאתי] | ||
| − | ד"ר רון דבי, המרפאה למחלות נוירומוסקולריות -EMG, המחלקה לנוירולוגיה, המרכז הרפואי ע"ש וולפסון, חולון | + | {{ייחוס|ד"ר רון דבי, המרפאה למחלות נוירומוסקולריות -EMG, המחלקה לנוירולוגיה, המרכז הרפואי ע"ש וולפסון, חולון}} |
| + | <center>'''פורסם בכתב העת "נוירולוגיה", כתב העת של האיגוד הנוירולוגי בישראל, יוני 2012, גיליון מסי 10'''</center> | ||
| − | + | [[קטגוריה:נוירולוגיה]] | |
| + | [[קטגוריה:כאב]] | ||
גרסה אחרונה מ־06:53, 21 באפריל 2023
| כאב נוירופתי - תפקידן של תעלות נתרן תלויות מתח | ||
|---|---|---|
| The role of voltage-gated sodium channels in neuropathic pain | ||
| יוצר הערך | ד"ר רון דבי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב נוירופתי
כאב נוירופתי הוא כאב הנגרם כתוצאה ממחלות עצב מסוגים שונים. מחלות העצב גורמות לשינוי בתכונות ההולכה של התעלות היוניות בממברנת העצבים ההיקפיים, ירידת סף פוטנציאל הפעולה (Action potential) ויצירת מוקדים חשמליים אקטופיים (Ectopic).
עם זאת, לעיתים קיים פער בין עוצמת הכאב הנוירופתי לבין העדות למחלת עצב, קרי רמת ההרס של האקסונים. כלומר, ישנם מצבים בהם ישנו כאב נוירופתי בעוצמה גבוהה ללא עדות לאיבוד אקסונלי. דוגמה למצב כזה היא מחלת עצב של סיבי העצב הקטנים (SFN, Small Fiber Neuropathy) אשר אינם ניתנים להערכה בבדיקות ההולכה השגרתיות. הערכת העצבים הקטנים כוללת: הערכה קלינית, ביופסיית עור, מבחן תחושתי כמותי ומבחנים של מערכת העצבים הבלתי-רצונית. הערכה זו לעיתים אינה מעידה על פגיעה בעצבים למרות נוכחות כאב נוירופתי. דוגמאות נוספות לכאב נוירופתי ללא עדות של מחלת עצב הן תסמונות כגון:
- תסמונת כפות הרגליים השורפות (Burning feet syndrome)
- תסמונת הפה השורף (Burning mouth syndrome)
- כאב באזור איבר המין (Vulvodynia, burning vagina syndrome)
כאב נוירופתי ללא עדות של מחלת עצב כולל קשת רחבה של הסתמנויות. ניתן להסיק מכך שקיימים מצבים בהם יש ליקוי תפקודי בהולכה החשמלית בעצבים ההיקפיים אשר אינו גורם להרס שלהם. הסברה היא כי במצבים של כאב ללא עדות של מחלת עצב, תעלות יוניות הן האחראיות לליקוי התפקודי בהולכה החשמלית הגורם לכאב זה.
אף על פי שהמונח "מחלת עצב" מתאר לרוב תהליכים הגורמים לנזק עצבי, ניתן להתייחס לתסמונות הנובעות מחוסר תפקוד של ההולכה החשמלית העצבית כסוג של מחלת עצב.
ידוע כי פגמים גנטיים בתעלות היוניות אחראים לקשת של מחלות אשר רובן מתבטאות באירועים של הפרעה בפעילות הרקמה המעוררת. המחלה הראשונה שנמצאה כנגרמת על ידי פגם בתעלות היוניות היא שיתוק התקפי היפרקלמי ׁ(Hyperkalemic periodic paralysis). מחלה זו נגרמת עקב מוטציה בתעלת הנתרן תלוית מתח מסוג Nav1.4 המבוטאת בממברנת סיבי השריר המשורטט (Skeletal muscle). מאז התגלו מחלות נוספות הקשורות לתעלות המערבות את מערכת העצבים ההיקפית והמרכזית. במערכת העצבים ההיקפית ההסתמנות היא לרוב של התקפי שיתוק או מיוטוניה (Myotonia).
הפרעה תפקודית של התעלות היוניות כסיבה ראשונית לכאב נוירופתי לא זכתה להתייחסות מחקרית רבה. מתבקש, אם כן, היה לחקור את תפקוד התעלות היוניות בעצבים ההיקפיים במקרים של כאבים נוירופתיים בלתי מוסברים. התפרסמו מספר עבודות, אשר הראו כי מוטציות בתעלת הנתרן מסוג Nav1.7, המבוטאת בממברנת העצבים ההיקפיים, גורמות לתסמונות של כאבים נוירופתיים התקפיים או היעדר תחושת כאב. עבודות אלו מראות למעשה את קצה הקרחון בכל הנוגע לקשר שבין כאב נוירופתי והפרעות תחושה אחרות ובין ליקוי בתפקוד התעלות היוניות בממברנת העצבים ההיקפיים.
מוטציות בתעלת הנתרן Nav1.7 תוארו כקשורות לתסמונות כאב: מוטציות הגורמות לאיבוד תפקוד (L-O-F, Loss Of Function) גורמות לחוסר יכולת סלקטיבית לחוש כאב. מוטציות הגורמות לתפקוד יתר (G-O-F, Gain Of Function) דווחו כקשורות לשתי תסמונות: כאב התקפי קיצוני (PEPD, Paroxysmal Extreme Pain Syndrome) ואריתרומללגיה תורשתית (IEM, Inherited Erythromelalgia). שתיהן מאופיינות בהתקפים של כאב קשה והיפראקסיטביליות (Hyperexcitability) אוטונומית. תוארו גם מוטציות ב-Nav1.7 במספר לא מבוטל יחסית של חולים עם מחלות עצב של הסיבים הקטנים.
עדיין נותר כר רחב למחקר בנוגע לתפקיד של תעלות נתרן ותעלות יוניות אחרות בפתופיזיולוגיה של תסמונות כאב. זיהוי מוטציות בתעלות היוניות כסיבה לתסמונות כאב עשוי להביא לפיתוח תרופות סלקטיביות בעלות אפקטיביות רבה ועם פחות תופעות לוואי, אשר יספקו טיפול יעיל יותר מהטיפולים הקיימים.
תעלות נתרן תלויות מתח (VGSC, Voltage-Gated Sodium Channels)
סוגים
לתעלות נתרן תלויות מתח תפקיד מרכזי ביצירת פוטנציאלי הפעולה בתאי עצב המוליכים כאב.
מספר סוגים של תעלות נתרן תלויות מתח מבוטאים בתאי העצב החישתיים ובתאי העצב של מערכת העצבים הבלתי-רצונית.
זוהו תשעה סוגים של תעלות נתרן תלויות מתח ביונקים (Nav1.1 - Nav1.9), אשר מקודדות על ידי הגנים: SCNIA, SCN5A ו-SCNSA-SCNIIA[1]. התעלות מהסוגים השונים זהות ב-50 אחוזים לפחות ברצף חומצות האמינו שלהן, אך הן שונות בקינטיקה שלהן, ברגישותן למתח הממברנה וברגישותן לחסימה על ידי Tetradotoxin) TTX). מספר גנים מקודדים לקבוצות שונות של תעלות נתרן הדומות זו לזו:
- תעלות Nav1.7, Nav1.1 ,Nav1.2 ,Nav1.3 מבטאות דמיון רב ביניהן - כולן רגישות לחסימה על ידי TTX, הן מבוטאות בתאי עצב והגן שמקודד להן ממוקם בכרומוזום 2 (מתואר בשפה הגנטית 2q23-24)
- תעלות Nav1.5 ,Nav1.8 ,Nav1.9 זהות ב-64 אחוזים ברצף חומצות האמינו שלהן, הן עמידות לחסימה על ידי TTX, מבוטאות בלב וב-Dorsal Root Ganglia) DRG) והגן שמקודד להן ממוקם בכרומוזום 3 (מתואר בשפה הגנטית 3p21-14)
- תעלת Nav1.4 מבוטאת בשריר משורטט ו-Nav1.6 מבוטאת בעיקר במערכת העצבים המרכזית (טבלה 1)[1][2]
מבנה
תעלות הנתרן מורכבות משתי יחידות: α ו-β, אשר עוברות שינוי במבנה המרחבי שלהן כתוצאה מדפולריזציה (Depolarization) של ממברנת התא. יחידת α מרכיבה את החלק העיקרי של התעלה ויוצרת את ה-Pore (הנקב שדרכו חודר יון הנתרן דרך הממברנה). התעלה מורכבת מארבעה אזורים (Domains) תוך-ממברנליים, כאשר כל אחד מהם מורכב משישה מקטעים (S1-S6). מקטעים S5 ו-S6 והשרשראות המקשרות ביניהם יוצרים את הנקב. בכל התעלות מקטע S4 מהווה את חיישן המתח (Voltage sensor) והוא עשיר בחומצות אמינו חיוביות (ארגינין וליזין) המופיעות בכל מקום שלישי ברצף[2][3][4]. הוכח כי שינוי במתח הממברנה גורם לשינוי במבנה המרחבי של S4 הגורם לסגירה או לפתיחה של התעלה. מוטציות ב-S4 גורמות להפרעות תפקודיות של התעלה ולמחלות כגון Paramyotonia congenita.
פיזור בתאי הגוף
תעלות נתרן תלויות מתח מבוטאות באופן נרחב על פני העצבים ההיקפיים היות שהן בעלות תפקיד מרכזי ביצירת פוטנציאל הפעולה בתא עצב. תאי העצב ב-DRG מבטאים סוגים שונים של תעלות נתרן תלויות מתח, בפרט Nav1.8, Nav1.7 ו-Nav1.9. תעלת Nav1.7 מבוטאת למעשה בכל תאי העצב של ה-DRG; Nav1.8 ו-Nav1.9 מבוטאות בעיקר בתאי העצב הקטנים, כולל תאי העצב המוליכים תחושה של כאב.
טבלה 1. הביטוי של תעלות נתרן תלויות מתח ברקמות השונות
| Isoform type | Distribution |
| Nav1.1 | CNS neurons (primarily in cell bodies); cardiac myocytes |
| Nav1.2 | CNS neurons (primarily unmyelinated and premyelinated axons) |
| Nav1.3 | CNS - normally expressed during embryogenesis. Continues to be expressed in sympathetic neurons in adults. |
| Nav1.4 | Skeletal muscle |
| Nav1.5 | Cardiac myocytes; immature and denervated skeletal muscles |
| Nav1.6 | CNS neurons (cerebellum, cerebral cortex, hippocampus, brainstem, spinal cord); astrocytes; Schwann cells; DRG; sensory and motor axons in the PNS; node of Ranvier in the CNS and PNS |
| Nav1.7 | DRG neurons (all type of neurons); sympathetic neurons; Schwann cells and neuroendocrine cells |
| Nav1.8 | DRG neurons (small and medium-sized neurons) |
| Nav1.9 | DRG neurons (small-sized nociceptive neurons); trigeminal neurons |
CNS - Central Nervous System, PNS - Peripheral Nervous System, DRG - Dorsal Root Ganglia
הקשר בין תעלות נתרן תלויות מתח לכאב נוירופתי
מספר עבודות הדגימו את תפקידן של תעלות Nav1.8 ,Nav1.7 ו-Nav1.9 בקליטה והולכת כאב. עבודות בנושא זה הדגימו את הממצאים הבאים:
- עכברים חסרי תעלת Nav1.8 הראו הפרעה בקליטה של גירוי כאב שמקורו מטמפרטורה גבוהה וכאב ממקור וִיסְצֶרָלִי (Visceralׂ)[5]
- נמצא כי ל-Nav1.9 תפקיד חשוב בכאב דלקתי ובכאב כתוצאה מנוירופתיה סוכרתית
- נמצא ביטוי גבוה של תעלת Nav1.7 בתאי עצב של ה-DRG המעצבבים אזורי דלקת וכן באקסונים של נוירומות כואבות[6]
- נמצא כי חוסר מוחלט של Nav1.7 בעכברים (Knocked out mice) גורם לתמותה נאונטלית[7]
מספר תסמונות כאב בבני אדם תוארו כתוצאה ממוטציות בתעלת Nav1.7. תעלה זו מקודדת על ידי הגן SCN9A המצוי בזרוע הארוכה של כרומוזום 2. התעלה מבוטאת ברמה גבוהה בעצבים התחושתיים ההיקפיים, בתאי העצב של ה-DRG, כולל העצבים המוליכים כאב (Nociceptive) וכן בעצבים של המערכת הבלתי-רצונית בפלקסוסים הסימפטטים. תעלה זו אחראית על שלב הדפולריזציה של פוטנציאל הפעולה בתאים הניתנים לעירור (Excitable cells). צביעות אימונוהיסטוכימיות (Immunohistochemistryׂ) מדגימות כי התעלה נמצאת בטרמינלים העצביים ולכן סביר שיש לה תפקיד בתחילת יצירת פוטנציאל הפעולה.
מספר מוטציות בגנים המקודדים לתעלות נתרן תלויות מתח עלולות לגרום לתסמונת המאופיינות בהפרעה בחישת כאב בשני מנגנונים:
- מוטציות הגורמות לתפקוד יתר של התעלה עלולות להתבטא בתסמונות המאופיינות בכאב נוירופתי:
- אריתרומללגיה תורשתית
- כאב התקפי קיצוני
- מחלת עצב של הסיבים הדקים
- מוטציות הגורמות לאיבוד תפקוד של תעלות נתרן תלויות מתח מתבטאות בתסמונת חוסר מולד של תחושת הכאב (CIP, Congenital Insensitivity to Pain)
מכאן, שטווח ההסתמנות של מוטציות של תעלת Nav1.7 רחב מאוד. הדבר מעלה את השאלה בנוגע לצורך לבדיקת הגן SCN9A בקרב חולים עם מחלת עצב אידיופתית של סיבי העצב הקטנים וכאב נוירופתי לא מוסבר.
להלן טבלה המסכמת את תסמונות כאב הנגרמות על ידי מוטציות בתעלת הנתרן Nav1.7:
| Pain Syndrome | Type of mutation | Onset | Clinical features |
| IEM | G-O-F | Childhood, adolescence. | Attacks of severe neuropathic pain, erythema, swelling and skin warmth. feet > hands Paroxysmal course |
| PEPD | G-O-F | Infancy, childhood | Attacks of severe neuropathic pain and skin flushing.
Initially affecting perirectal areas, later affecting ocular, maxillary and submandibular areas Paroxysmal course |
| Mixed IEM-PEPD | G-O-F | Infancy | Mixed IEM-PEPD phenotype Paroxysmal course |
| SFN Chronic pain | G-O-F | Adolescence, adulthood | Neuropathic pain usually begins distally, often generalized with time, autonomic symptoms are common. Continuous course |
| CIP | L-O-F | Birth | Inability to experience any sort of pain |
מוטציות הגורמות לתפקוד יתר של התעלה
אריתרומללגיה
אריתרומללגיה היא תסמונת נדירה המאופיינת בהתקפי בצקת, כאבים קשים, אודם וחום בחלקים הדיסטלים של הגפיים[8]. התסמונת תוארה לראשונה בשנת 1878 על ידי הנוירולוג האמריקאי ד"ר מיטשל אשר טבע את שמה Erythros) Erythromelalgia - אדום, Melos - גפה, Algos - כאב). ניתן להבדיל בין שני סוגים של אריתרומללגיה:
- אריתרומללגיה ראשונית (Primary erythromelalgia) או אריתרומללגיה תורשתית - תסמונת גנטית אשר לרוב מועברת בתורשה אוטוזומלית דומיננטית (Autosomal dominant) ומופיעה ללא קשר למחלות אחרות
- אריתרומללגיה נרכשת המשנית למחלות שונות, כגון:
- מחלות מיאלופרוליפרטיביות (Myeloproliferative disorders)
- פוליציטמיה (Polycythemia)
- תרומבוציטופניה (Thrombocytopenia)
- מחלות אוטואימוניות ודלקתיות
- דלקת של כלי הדם (Vasculitis)
- סוכרת
- יתר לחץ דם
- מחלת עצב
- סיבוך של טיפול תרופתי
אטיולוגיה
המקור לאריתרומללגיה תורשתית הוא מוטציות בגן SCN9A אשר גורמות לשינוי בקינטיקה של תעלת הנתרן תלוית מתח Nav1.7. הערכה ביופיזיקלית של התעלות המוטנטיות באריתרומללגיה תורשתית הראתה ירידה בסף הפתיחה של התעלה ועיכוב בחוסר-הפעלה. שינויים אלה מסבירים היטב את הקליניקה הנובעת מפעילות יתר של התעלות. בשנת 2004 תיאר Yang לראשונה שתי משפחות סיניות עם המחלה אשר נמצאו בהן מוטציות מסוג L858H ,I848T) Missense) באזורים שמורים של הגן SCN9A המקודד לתעלת הנתרן תלוית מתח Nav1.7[9]. בהמשך תוארו משפחות נוספות מארצות הברית וממקומות אחרים בעולם.
קליניקה
אריתרומללגיה תורשתית (IEM, Inherited Erythromelalgia) מתבטאת לרוב בעשור הראשון לחיים ואף תוארו חולים בהם המחלה פרצה כבר בשנה הראשונה לחיים. חולי אריתרומללגיה תורשתית סובלים מהתסמינים והסימנים הבאים:
- התקפים סוערים של כאבים נוירופתיים שורפים וקשים בגפיים המלווים באודם ונפיחות בגפה המעורבת. כפות הרגליים מעורבות לעיתים קרובות, אך ההתקפים מופיעים בשכיחות פחותה גם בגפיים העליונות
- אלודיניה (Allodynia) ניכרת, המתבטאת בהתפרצות של כאבים עזים המושרים על ידי גירויים קלים, כגון מגע בגד וכולי
קירור הגפה מקל לרוב על הכאב. ההתקפים עלולים להיות תכופים עד כדי מספר פעמים ביום והם גורמים לפגיעה משמעותית באיכות החיים[10].
טיפול
המחלה עמידה לרוב הטיפולים התרופתיים. פורסמו דיווחים על חולים בודדים שהגיבו לתרופות הבאות:
- Carbamazepine
- Oxcarbazepine
- Gabapentin
- Mexiletine
- הזלפות של Lidocaine
כאב התקפי קיצוני
תסמונת זו ידועה גם בשמה הישן - Familial rectal pain syndrome, עקב השכיחות הגבוהה של התקפי הכאב באזור הרקטום אף על פי שאזורים אחרים בגוף מעורבים אף הם. התיאור הראשון של משפחה הסובלת מתסמונת זו התפרסם לראשונה בשנת 1959. בני המשפחה הנגועים סבלו מהתקפים קצרים של כאב עז באזור הרקטום, העיניים והלסת התחתונה המלווה בהסמקה של העור באזורים הכואבים. בעבודה שפורסמה ב-Neurology (2007) על ידי Fertleman וחברים, נאספו הנתונים מכל המשפחות הידועות בעולם שניתן היה להשיגן. בסך הכל נכללו 77 חולים מתוך 15 משפחות, כאשר שני מקרים היו ספורדיים[11].
אטיולוגיה
התסמונת היא תוצאה של מוטציות בגן SCN9A המצוי על כרומוזום 2 ומקודד לתעלת הנתרן Nav1.7. המחלה עוברת בתורשה דומיננטית של תפקוד יתר, כלומר מוטציה הקיימת באלל בודד גורמת לעודף תפקוד של התעלה ולפתיחה מוקדמת וממושכת יותר שלה. שינויים אלה בתכונות ההולכה של התעלה מסבירים את ההסתמנות הקלינית של התסמונת. במחקר גנטי שפורסם ב-Neuron בדצמבר 2006 והתבסס על טכניקות של Linkage analysis אותר הגן SCN9A האחראי למחלה[12] ונמצאו 8 מוטציות, כולן מסוג Missense mutations ב-8 מתוך 13 משפחות שנבדקו. בדיקה אלקטרופיזיולוגית In vitro של התעלות Nav1.7 המוטנטיות הראתה שינוי בתכונות ההולכה של התעלות, אשר התבטא בהשבתה (Inactivation) לא שלמה של התעלות ובעלייה ברגישות לדפולריזציה. שינויים אלה גורמים ליצירה מוקדמת של פוטנציאל הפעולה.
קליניקה
התסמינים של המחלה מתחילים כבר בינקות ובילדות מוקדמת, ייתכן אף בתקופה העוברית, זאת לנוכח התקפים של דופק איטי (Bradycardia) שנצפים בעוברים ואופייניים למחלת כאב התקפי קיצוני. התסמונת מאופיינת בסימנים הבאים:
- התקפי כאב עז בדרך כלל באזור הרקטום, העיניים והלסתות (Submaxillary or submandibular). הכאב יכול להתפשט לאזורים הסמוכים, לאזור שסביב העין ולחיץ בין הנקבים. בהתקפים חזקים החולים דיווחו על כאב בכל הגוף. החולים מתארים את הכאב כעמוק וחזק ביותר (הכאב החזק ביותר שהם חוו). הילדים נראים מבועתים בעת ההתקף, ולא ניתן להרגיעם
- באופן טיפוסי בעת ההתקף מופיע שינוי צבע, אריתמה (Erythema) של העור באזור הכואב. לעיתים הסומק חורג לאזורים נרחבים יותר, למשל לפנים, אזור הישבן והירכיים ומדמה צורת ליצן (Harlequin). המחלה נמשכת לאורך כל החיים, אך תדירות ההתקפים המרבית היא בגיל הילדות הצעירה. עם ההתבגרות קיימת ירידה בתדירות ההתקפים, והם נעשים נסבלים יותר
- במבוגרים הסומק והכאב מערבים לעיתים קרובות את אברי המין וההתקפים יכולים להיות מזורזים על ידי גורמים כגון יחסי מין ומתן שתן[10]
- בקרב ילדים צעירים שכיחים התקפים טונים (Tonic) לא אפילפטיים, בעוד שהם נדירים במבוגרים. ההתקפים מלווים בכאבים חזקים במיוחד ומאופיינים בסימנים הבאים: תנוחה טונית, נוקשות שרירים, דום נשימה (Apnea), דופק איטי והסמקה ללא בכי. עם סיום ההתקף הנוקשות משתחררת והנשימה חוזרת
- גורמים המזרזים את הופעת ההתקף יכולים להיות:
- ניגוב הישבן
- יציאות
- החדרת מד-חום לפי הטבעת (Anus)
- אכילה
טיפול
החולים במחלה מגיבים טוב יותר לטיפול בהשוואה לחולי אריתרומללגיה: Carbamazepine נמצא יעיל באופן חלקי בהורדת עוצמת ומספר ההתקפים. אופיואידים ו-Elatrol (Amitriptyline) לא הראו יעילות.
תסמונת מעורבת - אריתרומללגיה תורשתית וכאב התקפי קיצוני
שתי תסמונת הכאב, אריתרומללגיה תורשתית וכאב התקפי קיצוני, אשר אינן חופפות, נגרמות על ידי שתי קבוצות שונות של מוטציות הגורמות לתפקוד יתר בתעלת הנתרן Nav1.7. בכאב התקפי קיצוני המוטציות פוגעות בהשבתה של התעלה וגורמות ליצירת זרמים קבועים דרך התעלה. באריתרומללגיה תורשתית המוטציות גורמות לתזוזה בסף השפעול לכיוון היפרפולריזציה (Hyperpolarization) והאטה של הדאקטיבציה (Deactivation). ככל הנראה השוני בתכונות ההולכה של תעלת הנתרן בין שתי התסמונות אחראי לשוני הפנוטיפי.
בשנת 2008, Estacion וחברים תיארו מוטציה חדשה ב-Nav1.7 (A1632E) בחולה עם הסתמנות קלינית ייחודית שכללה מאפיינים של כאב התקפי קיצוני ואריתרומללגיה תורשתית[13]. החולה המתואר סבל מהסימנים הקליניים הבאים:
- התקפי דופק אטי קיצוני מלידה שהצריכו ביצוע החייאת לב-ריאה מספר פעמים והשתלת קוצב לב בגיל 18 חודשים
- בהמשך הופיעו התקפים של כאב קשה ואודם באזור הרקטלי (אופייני לכאב התקפי קיצוני)
- בגיל 3 סבל החולה מהתקפים תכופים של כאב ואריתמה באזור הרקטלי, סביב העין והלסת (Harlequin appearance) וכן מהתקפים טיפוסיים של אריתרומללגיה תורשתית שהתאפיינו באודם, בצקת וכאבים קשים בכפות הרגליים והידיים
בשימוש בשיטות רישום Voltage clamp הראו שהתעלה המוטנטית (A1632E) הראתה תכונות אלקטרופיזיולוגיות המשותפות לשתי התסמונות. נראה לפיכך, שהמוטציה A1632E היא החוליה המקשרת בין כאב התקפי קיצוני לאריתרומללגיה תורשתית וייתכן כי שתי התסמונות מהוות למעשה רצף פיזיולוגי.
כאב נוירופתי כרוני ומחלת עצב של הסיבים הדקים
שתי עבודות שהתפרסמו ב-2011 ו-2012 דיווחו על מוטציות ב-Nav1.7 בחולים עם כאב נוירופתי כרוני[14] ונוירופתיה של סיבי העצב הקטנים.
Dabby וחברים תיארו מוטציה חדשה ב-W1550R) Nav1.7) בחולה עם כאב נוירופתי אידיופתי קשה ומתמשך. החולה, אישה בת 69, החלה לסבול מכאב שורף בכפות הרגליים בגיל 56. הכאב הנוירופתי התפשט בהדרגה לחלקי גוף נרחבים: גפיים עליונות ותחתונות, בטן, בית החזה והגב והיה עמיד למגוון רב של טיפולים תרופתיים.
הכאב היה מייסר עד כדי כך שגרם לחולה למחשבות אובדניות. בדיקות אלקטרופיזיולוגיות, QST (Quantitative Sensory Testing) וביופסית עור היו תקינות. המוטציה W1550R גורמת להחלפה של חומצת האמינו טריפטופן, בסגמנט טרנסממברנלי S2 באזור IV של התעלה. חומצת האמינו טריפטופן שמורה באזור זה היטב לאורך האבולוציה והחלפתה גורמת לשינוי במטען החלבון והפיכתו למסיס בשומן.
Farber וחברים זיהו מוטציות חדשות ב-Nav1.7 בשמונה מתוך 28 חולים (28.6 אחוז) עם מחלת עצב אידיופתית של סיבי העצב הקטנים[15]. גיל החולים נע בין 14 ל-68 שנים, כאשר ברובם התסמינים הראשונים התבטאו בכאבים שורפים בכפות הרגליים. בשלושה חולים הכאב הנוירופתי החל באופן מפושט לפני שעירב את החלקים הדיסטלים. באמצעות טכניקת Voltage clamp הראו החוקרים, כי כל המוטציות היו מוטציות הגורמות לתפקוד יתר, ובכל המקרים התכונות האלקטרופיזיולוגיות של Nav1.7 היו שונות מאלה של כאב התקפי קיצוני ואריתרומללגיה תורשתית.
מוטציות הגורמות לחוסר תפקוד של התעלה
חוסר מולד של תחושת הכאב
כאב הוא חוש בסיסי, אשר התפתח במהלך האבולוציה על מנת להגן מפני נזק רקמתי. בניגוד לחסר מולד של חושים אחרים כגון שמיעה או ראיה אשר שכיחים יחסית, הרי שחסר מולד של חוש הכאב הוא נדיר ביותר. המקרה הראשון של חסר מולד בתחושת כאב תואר כבר בתחילת המאה העשרים. תוארו קומץ חולים, אשר סווגו כסובלים מ-Congenital indifference to pain או Congenital insensitivity to pain (הידועה גם כנוירופתיה תורשתית חישתית אוטונומית מסוג HSAN-V). מבחינה היסטורית שני המצבים נבדלים בהיעדר מחלת עצב או קיומה.
אטיולוגיה
זוהי מחלה אוטוזומלית רצסיבית (Autosomal recessive), כלומר יש צורך בקיום המוטציה בשני האללים של הגן SCN9A על מנת שיהיה ביטוי של המחלה. רוב המחלות הרצסיביות מתאפיינות באיבוד פונקציה של תוצר הגן וזאת משום שאין ייצור חלבון תקין על ידי אף לא אחד מן האללים. בניגוד לשתי המחלות הקודמות - שאופיינו בפעילות יתר של התעלה היונית - הרי שהמחלה של חוסר מולד של תחושת הכאב מאופיינת בחוסר פעילות של תעלת הנתרן Nav1.7. בכל שלוש המשפחות שתוארו נמצאה מוטציות הומוזיגוטיות (Homozygous) שונות מסוג Nonsense mutations בגן SCN9A, באקסונים 10, 13, 15: שתי מוטציות גרמו ליצירת חלבון קטוע (Truncated protein) ואחת הייתה מסוג Frame shift mutation.
קליניקה
חוסר מולד של תחושת הכאב נחקר בעבודה שפורסמה ב-Nature בשנת 2006.
בעבודה זו תוארו חולים משלוש משפחות אשר סבלו מתופעה ייחודית של חוסר יכולת לחוש כאב מכל סוג שהוא[16]. כל יתר סוגי התחושה היו תקינים לחלוטין. כמו כן, מערכות העצבים המרכזית וההיקפית היו תקינות.
החולה הידוע הראשון בעבודה זו היה ילד בן 10 מצפון פקיסטן אשר עסק לפרנסתו במופעי רחוב. ילד זה היה מוכר לשירות הרפואי עקב היעדר תחושת כאב. בהופעותיו היה מחדיר סכינים לגופו ומהלך על גחלים בוערות ללא כל כאב. סופו שנהרג לרוע המזל, כאשר קפץ מגג של בית. נחמה פורתא היא שלא סבל במותו.
בעבודה נחקרו שלוש משפחות בעלות קרבת דם לילד המתואר, כולן משבט קורשי שבצפון פקיסטן. בסהך הכל נמצאו 6 פרטים אשר היו נעדרי תחושת כאב. העבודה מצאה בחולים אלו את התמונה הקלינית והמעבדתית הבאה:
- חוסר תחושת כאב מלידה, למעשה עוד בחיים העובריים. רוב המשפחות שמו לב לקיומו כבר בשלבים הראשונים של הילדות
- במהלך הילדות הופיעו בחולים פציעות בשפתיים ובלשון עקב נשיכות עצמיות
- הילדים היו ללא תחושת כאב גם במצבים הבאים:
- כל הילדים היו בעלי אינטליגנציה תקינה כפי שהעידו הוריהם, מוריהם והרופאים המטפלים
- הבדיקה העצבית בקרב כל הילדים הייתה תקינה לחלוטין, למעט היעדר תחושת כאב. הילדים חשו היטב מגע, קור, חום, תחושת מצב, דגדוג ולחץ (לא כואב). הם הבדילו ללא קושי בין משקאות קרים וחמים, אך סבלו מכוויות חום משום שלא חשו את הכאב. הילדים החולים לא סבלו מתסמינים או סימנים של מערכת העצבים הבלתי רצונית, עובדה מפתיעה ולא מוסברת כשלעצמה, וזאת לנוכח הימצאות תעלת Nav1.7 בעצבים האוטונומיים
- בחלק מהילדים בוצעו בדיקת דימות תהודה מגנטית (MRI, Magnetic Resonance Imaging) של המוח וביופסית העצב הסורלי (Sural nerve biopsy) אשר היו תקינות
ביבליוגרפיה
- ↑ 1.0 1.1 Dib-Hajj SD, Cummins TR, Black JA, Waxman SG, Annu Rev Neurosci, 2010; 33,325
- ↑ 2.0 2.1 Catterall WA, Neuron 2000; 26,13
- ↑ Duclohier H, Biochim Biophys Acta, 2009; 1788,2374
- ↑ Fozzard HA, Hanck DA, Physiol Rev, 1996; 76,887
- ↑ Akopian AN, Souslova V, England S, et al., Nat Neurosci, 1999; 2,541
- ↑ Strickland IT, Martindale JC, Woodhams PL, et al., Eur J Pain, 2008; 12,564
- ↑ Nassar MA, Stirling LC, Forlani G, et al., Proc Natl Acad Sci USA, 2004; 101,12706
- ↑ Mitchell S.W, Am J Med Sci, 1878; 76.17
- ↑ Yang Y, Wang Y, Li S, et al., J Med Gen, 2004; 41,171
- ↑ 10.0 10.1 Waxman SG, Neurology, 2007;69,505
- ↑ Fertleman CR, Ferrie CD, Aicardi J, et al., Neurology, 2007; 69,586
- ↑ Fertleman CR, Baker MD, Parker KA, et al., Neuron, 2006; 52,767
- ↑ Estacion M, Dib-Hajj SD, Benke PJ, J Neurosci, 2008; 28,11079
- ↑ Dabby R, Sadeh M, Gilad R, et al, J Neurol Sci, 2011; 301,90
- ↑ Farber CG, Hoeijmakers JC, Ahn HS, et al., Ann Neurol, 2012 ;71,26
- ↑ Cox JJ, Reimann F, Nicholas AK, et al., Nature, 2006; 444,894
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר רון דבי, המרפאה למחלות נוירומוסקולריות -EMG, המחלקה לנוירולוגיה, המרכז הרפואי ע"ש וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק