הבדלים בין גרסאות בדף "17alpha-Hydroxyprogesterone"
| (5 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 55: | שורה 55: | ||
==אבחון מבדיל== | ==אבחון מבדיל== | ||
| − | CAH כתוצאה מחסר של 11β-hydroxylase, CAH כתוצאה מחסר | + | CAH כתוצאה מחסר של 11β-hydroxylase,{{כ}} CAH כתוצאה מחסר של 3β-hydroxysteroid dehydrogenase,{{כ}} CAH כתוצאה מחסר של α-reductase{{כ}}5, CAH כתוצאה מהיפופלזיה של האדרנל; CAH כתוצאה מאי-ספיקה של האדרנל; פגמים בסינתזה של טסטוסטרון; שטף-דם דו-צדדי של האדרנל; תסמונת פוליציסטית של השחלות; אי-סדירות בהתפתחות המגדרית; אורופתיה חסימתית; חסר משפחתי של גלוקו-קורטיקואיד; תסמונת אי-רגישות לאנדרוגן. סיבות אחרות להיפרקלמיה/היפונתרמיה; מצב של היצרות היפרטרופית פילורית; תסמונת Denys-Drash (מחלה תורשתית אוטוזומלית רצסיבית נדירה, לרוב עם תסמונת משולשת): מחלת כליות פרוגרסיבית עם ביטוי של [[גידול Wilms]] מוקדם לרוב דו צדדי ([[נפרובלסטומה]]); טרשת מזנגיאלית מפוזרת (תאי רקמת חיבור מתפשטים בגופי הכליה); אנומליות באיברי המין (פסאודו-המפרודידיזם גברי). |
| − | פרוגנוזה | + | ==פרוגנוזה== |
| + | ילדים המאובחנים עם CAH הם לרוב גבוהים בשנות הילדות הראשונות, אך הם לרוב נמוכים בבגרותם (כ-10 ס"מ נמוכים יותר מהוריהם). בנוסף, טיפול של CAH עם גלוקו-קורטיקואידים עלול לדכא גדילה, באופן הגורם לקומה נמוכה. טיפול עם הורמון גדילה (GH) או עם אנלוג הורמונלי המשחרר את ההורמון LH, גורמים לתוספת גדילה ממוצעת של 7.3 ס"מ (Bachelot וחב' ב-Eur J Endocrinol משנת 2017, Khattab וחב' ב-J Steroid Biochem Mol Biol משנת 2017, ו-King וחב' ב-Clin Endocrinol משנת 2016). רוב הילדים עם CAH הם בעלי התפתחות נוירו-פסיכולוגית נורמלית. יתרה מכך, למרות הנטייה למגדר הזכרי, רוב הילדות עם CAH מפגינות העדפה הטרוסקסואלית. זכרים ונקבות עם CAH שומרים על פוריותם עם כי בדרגה פחותה יותר מהפוריות של אנשים בריאים. זאת כתוצאה של מגורמים ביולוגיים, פסיכולוגיים וסוציאליים. | ||
| − | + | ==מדידת hydroxyprogesterone{{כ}}-17 בדם== | |
| + | הרמות של hydroxyprogesterone{{כ}}-17 בדם משתנות לאורך היום. בנשים, הן משתנות גם בשלבים השונים של המחזור החודשי. אין צורך בהכנה ספציפית כגון צום לפני ביצוע הבדיקה. למדידה של hydroxyprogesterone{{כ}}-17 ביילודים נלקחת טיפת דם מעקב היילוד 48 שעות לאחר הלידה. רמה הגבוהה מ-5,000 ננוגרם/דציליטר היא סימן מובהק להיפר-פלזיה של האדרנל (CAH). מעבר לנבדקים בתקופת הימים הראשונים לחייהם, הדרך הטובה ביותר היא ליטול דם בשעות הבוקר המוקדמות, להימנע מהשפעת ה-circadian rhythm. בנשים בגיל הפריון יש ליטול את דגימת הדם בפאזה הפוליקולרית של המחזור. את הסמן הזה ניתן למדוד בנסיוב (נטילת הדם למבחנה כימית (פקק צהוב או אדום), או בפלזמה (נטילת הדם למבחנת ספירת דם המכילה EDTA או K2EDTA (בפקק בצבע סגלגל), או במבחנת סודיום הפארין או ליתיום הפארין, (פקק בצבע ירוק)). לאחר נטילת הדם וסרכוז המבחנה יש להפריד את הנסיוב או את הפלזמה מהתאים במשקע, ולהעביר 0.5 מ"ל של הנוזל למבחנת טרנספורט סטנדרטית. היציבות של הדגימות בטמפרטורת החדר היא למשך 48 שעות, בקירור למשך שבוע, ובהקפאה למשך 6 עד 24 חודשים. יש לפסול דגימות מאוד המוליטיות או כאלה שהגיעו למעבדה בטמפרטורת החדר. לפיכך הדגימות חייבות להגיע למעבדה בקירור או כשהן מוקפאות. המדידה של 17α-hydroxyprogesterone מתבצעת בשיטות של liquid chromatography-tandem mass spectrometry (LC-MS) או (GLC) gas liquid chromatography. בעבר בוצעה מדידה זו בשיטות של radioimmunoassay או בשיטת IRMA (או immunoradiometric assay) אך אלה יכלו להיות בעייתיות בשל פעילות צולבת של הנוגדן עם תרכובות סטרואידיות עם מבנה דומה (de Hora וחב' ב-Int J Neonat Screen משנת 2020, ו-Bialk וחב' באותו כתב-על משנת 2019). | ||
| − | מדידת - | + | מדידת 17-hydroxyprogesterone בדם יכולה לשמש גם לאבחון של late-onset CAH בנשים עם שעירות-יתר (hirsutism) במקרים של מחזור לא סדיר. אם תוצאת המדידה של hydroxyprogesterone{{כ}}-17 מתקבלת לא נורמלית, יש לדרוש ביצוע בדיקת corticotropin-stimulation לאישור החשד ל-CAH . במקרים של ספק לגבי מין התינוק/תינוקת, בדיקת קריוטיפ צריכה להתבצע לאתר אי-סדירות בכרומוזומים, על מנת לקבוע את מין היילוד. |
| − | + | רמת 17-hydroxyprogesterone מוגברת כאשר 2 אנזימים המשתתפים בסינתזה של קורטיזול פגומים או חסרים, 21-hydroxylase ו-11β ydroxylase, מה שגורם ל-CAH. מדידת 17-hydroxyprogesterone נדרשת בשגרה כחלק מבדיקות סקר יילודים על מנת לגלות CAH. בלמעלה מ-90% מהמקרים, CAH נגרם ממוטציות הומוזיגוטיות או ממוטציות compound heterozygous (דהיינו מוטציות במקומות שונים על פני שני האללים של הגן) בגן בציטוכרום P-450 C21 המקודד ל-CYP21A2, מה שגורם לחסר של hydroxylase-21. אבחון של חסר זה בעוּבר במהלך היריון אפשרי בדגימה של סיסי שלייה (chorionic villous). | |
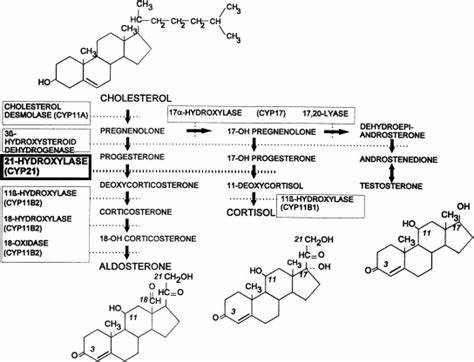
| − | + | [[קובץ:Hydroxylase21.png|ממוזער|מרכז|600 פיקסלים|מסלולי ביוסינתזה של סטרואידיפ בקורטקס של האדרנל.]] | |
| − | |||
| − | + | ==ראו גם== | |
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[מפגעים הורמונאליים|בדיקות מעבדה - מפגעים הורמונאליים]] | ||
| + | {{שש}} | ||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה: אנדוקרינולוגיה]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
| + | [[קטגוריה:בדיקות מעבדה - מפגעים הורמונאליים]] | ||
גרסה אחרונה מ־16:04, 26 באוגוסט 2023
| מדריך בדיקות מעבדה | |
| 17α-Hydroxyprogesterone | |
|---|---|
| שמות אחרים | 17α-Hydroxyprogesterone 17α-OHP OH progesterone-17 17α-Hydroxypregn-4-ene-3,20-dione Hydroxyprogesterone 17α-OHPG 17-hydroxyprogesterone hyarogesterone 17 hydroxy 4 pregnene 3,20 dione 4 pregnen17alpha ole 3,20 dione |
| 250 פיקסלים | |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | אבחון של היפרפלזיה של האדרנל (CAH) |
| טווח ערכים תקין | תחום הריכוזים בנסיוב של -OHPGα17: דם טבורי (cord blood): 1,000-3,000ננוגרם/דציליטר. ביילודים: פחות מ-630 ננוגרם/דציליטר. בפגים ניתן למצוא ריכוזי 17-OHPG מעל 630 ננוגרם/דציליטר אך לא מעל 1,000 ננוגרם/דציליטר. בזכרים לפני ההתבגרות המינית- פחות מ-110 ננוגרם/דציליטר. בזכרים בוגרים - פחות מ-220 ננוגרם/דציליטר. בנקבות לפני ההתבגרות המינית - פחות מ-100 ננוגרם/דציליטר. בנקבות בוגרות בפאזה הפוליקולרית של המחזור- פחות מ-80 ננוגרם/דציליטר, בנקבות בוגרות בפאזה הלוטאלית של המחזור -פחות מ-285 ננוגרם/דציליטר. בנשים בגיל המעבר - פחות מ-51 ננוגרם/דציליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
פיזיולוגיה ופרמקולוגיה של 17α-OHP
17α-hydroxyprogesterone הוא הורמון סטרואיד פרוגסטוגן אנדוגני הקשור לפרוגסטרון (Morton ו-Hall ב-Int Drug Directory משנת 2012, ו-Attardi וחב' ב- Am J Obstet Gynecol משנת 2007). הוא מהווה גם תוצר ביניים בביוסינתזה של סטרואידים אנדוגניים רבים אחרים, כולל אנדרוגנים, אסטרוגנים, גלוקו-קורטיקואידים, מינלו-קורטיקואידים ונוירוסטרואידים. אסטרים של 17α-OHP כגון hydroxyprogesterone caproate, ובמידה פחותה בהרבה hydroxyprogesterone acetate ו-hydroxyprogesteron heptanoate שימשו ברפואה כפרוגסטינים. תרכובת זו היא למעשה pregnane steroid, עם קבוצות ketone בעמדות C3 ו-C20, קבוצת הידרוקסיל בעמדת C17α וקשר כפול בין עמדות C4 ו-C5. חשיבות 17α-OHP בכך שהיא תרכובת-אם של קבוצה של פרוגסטינים המוגדרים כנגזרות של 17α-hydroxyprogesterone1 (Smith ב-Introduct Priciples Drug Design משנת 1983). בין השאר קבוצת פרוגסטינים זו כוללת chlormadinone acetate, cyproterone acetate,medroxdroxyprogesterone caproate ו-megestrol acetate.
היפרפלזיה מולדת של האדרנל (להלן CAH) היא קבוצת מפגעים המשפיעים על סטאורידוגנזה בבלוטת האדרנל. השכיחות של CAH קלאסית נעה בין 1 ל-10,000-15,000 לידות-חי ברוב האוכלוסיות ה-Caucasian. בערך ב-95% מהמקרים CAH נגרם כתוצאה מחסר hydroxylase-21 הגורם לפגיעה בסינתזה של קורטיזול באדרנל. חסר קורטיזול מגרה עלייה בהפרשת ACTH מההיפופיזה המובילה להצטברות של קודמני סטרואידים באדרנל, ולהגברת היצירה של אנדרוגנים באדרנל. האנזים hydroxylase-21 הופך hydroxygesterone-17 ל-11deoxycortiso שהוא שלב אחד לפני השלב הסופי בסינתזת קורטיזול. לפיכך, יש הצטברות של OHP17 והוא משמש מדד לחסר של hydroxylase-21. מדובר במפגע המועבר בהורשה אוטוזומלית-רצסיבית (Tajima ב- Clin Pediatr Endocrinol משנת 2018, McCann-Crosby וחב' ב-Pediatr Endocrinol Rev משנת 2018, ו-Nasir וחב' ב-Pediatr Endocrinol Rev משנת 2018).
CAH קלאסי לרוב מתחלק ל-2 צורות, זו של איבוד מלח וזו של ויריליזציה, בתלות בפעילות האנזימטית השארית, מטופלים עם חסר מוחלט של פעילות hydroxylase-21, מה שגורם לאיבוד מסיבי של מלח כבר לאחר שבוע החיים הראשון, או לויריליזציה של איברי המין הנשיים החיצוניים כבר בשלב העוברי. מטופלים עם צורת הויריליזציה של CAH הם בעלי פעילות אנזימטית שארית של 1 עד 2%, ויש בהם יצירה מספקת של אלדוסטרון המונעת איבוד מסיבי של מלח, אם כי הסינתזה של גלוקו-קורטיקואידים נפגעת מאוד. בשתי צורות אלה של CAH העלייה ברמת האנדרוגנים באדרנל גורמת לויריליזציה בעובר, ולעודף אנדרוגנים בשני המגדרים לאחר הלידה. תינוקות וילדים עם CAH שאינ מטופלים או שאינם נמצאים בפיקוח מוקפד, מאופיינים על ידי רמות מוגברות של קודמנים של הורמונים סטרואידים, הכוללים פרוגסטרון ו-17OHP וכן אנדרוגנים כגון androstenedione, וטסטוסטרון. הודגם שפרוגסטרון ו-17OHP הם בעלי השפעה אנטגוניסטיות על הקולטנים של מינרלו-קורטיקואידים, ולכן הם תורמים לחסר של מינרלו-קורטיקואידים במטופלים עם CAH קלאסי.
האבחון הקדם-לידתי והטיפול בעוברים נקביים חיוניים להפחית ויריליזציה של איברי המין. כיוון שחסר של hydroxylase-21 מוחמץ לעיתים קרובות ביילודים זכרים עד לזיהוי של חסר אדרנלי חמור, בכל מדינות ארצות הברית ובמדינות רבות בעולם מקפידים על סקר יילודים המודד ריכוזי hydroxyprogesterone-17. סקר יילודים עשוי לגלות כמעט את כל היילודים עם CAH קלאסי כמו גם מספר נבדקים עם CAH לא-קלאסי. אף על פי שתוצאות false negative אינן שכיחות, תוצאות false-positive בדרך כלל מופיעות בפגים, לכן מומלץ לבצע בפגים מדידות סדרתיות של 17-hydroxyprogesterone, ובמקרה של תוצאה חיובית בסקר יילודים יש חובה לחזור על הבדיקה ל-17-hydroxyprogesterone בדגימת פלזמה אחרת, וכן יש למדוד רמת אלקטרוליטים בנסיוב.
האנדוקרינולוגיה של 17-hydroxyprogesterone
17-OHPG מיוצר בקורטקס של האדרנל, בשלייה, ובגונדות (האשכים וה-corpus luteum של השחלות). הוא מהווה תוצר ביניים בסינתזה של קורטיזול ושל אנדרוגנים. ברוב מהלך ההיריון המקור העיקרי של פרוגסטרון היא השלייה; אך בשבועות-6-10 של ההיריון המקור העיקרי של פרוגסטרון הוא ה-corpus calosum. פרוגסטרון מסונתז בשלייה בעיקר מהכולסטרול בצירקולציה של האם. בסוף ההיריון, השלייה מייצרת פרוגסטרון בכמות של 250 מיליגרם ליום, כאשר רמתו בצירקולציה של האם היא 130-150 ננוגרם/מ"ל. לשם השוואה, פרוגסטרון מיוצר בפאזה הפוליקולרית בשיעור של 2.5 מיליגרם/יום, ובפאזה הלוטאלית פרוגסטרון מיוצר בשיעור של 25 מיליגרם ליום. רוב הפרוגסטרון בצירקולציה של האם עובר מטבוליזם והופך ל-pregnanediol ומופרש בשתן כ-glucuronide. במהלך 6 השבועות הראשונים של ההיריון, 17α-hydroxyprogesterone מוגבר בצירקולציה של האם לרמות ברות-השוואה לאלו של פרוגסטרון. לאחר ששת השבועות הראשונים של ההיריון רמות 17α-hydroxyprogesterone יורדות בהדרגה והופכות בלתי ניתנות לגילוי בטרימסטר ההיריון השני, בעוד שרמות פרוגסטרון פוחתות באופן זמני בין שבועות 8–10 להיריון, ומתחילות לעלות מכאן ואילך. הירידה ברמות 17α-hydroxyprogesterone והעלייה השיפועית ברמות פרוגסטרון, משקפות את המעבר של הפרשת פרוגסטרון מה-corpus calosum לשלייה. ההפרשה של 17α-hydroxyprogesterone במהלך הטרימסטר השלישי להיריון מתרחשת בעיקר מהיחידה העוברית-שלייתית.
סטרואידו-גנזה שחלתית
בוצעה השוואה של תכולת ההורמון הסטרואידי הקולח בווריד השחלה, וזו שבוורידי הדם ההיקפי, כדי להבדיל בן הסטרואידים המופרשים על ידי השחלה מאלה המופרשים על ידי האדרנל, או מיוצרים הסבה היקפית של קודמני הסטרואידים. מחקרים הראו שהשחלות מפרישות pregnelolone, פרוגסטרון, 17α-hydroxyprogesterone, dehydroepiandrosterone (להלן DHEA), androstenedione, טסטוסטרון, estrone ו-estradiol. אף על פי שמדידות אלו מספקות מידע על המסלולים הסטראוגניים, הם אינם מזהים את תאי השחלה הכרוכים ביצירת ההורמון הסטרואידי. ניסויים בהם בוצעה מיקרו-דיסקציה של זקיקי שחלה בשלב קדם-ביוץ, זיהו estrone ו-estradiol כתוצרים הסטרואידיים העיקריים. פרוגסטרון ו-17α-hydroxyprogesterone זוהו כתוצרים העיקריים של ה-corpus luteum.
סטרואידי השחלה הפעילים ביולוגית הם estradiol ופרוגסטרון. התוצר סטרואיד C19 העיקרי של השחלה, androstenedione, אינו פעיל ביולוגית, אך הוא פועל כקודמן ותורם לרמות של estrone ושל טסטוסטרון בצירקולציה על ידי הסבה ברקמות השומן והעור. סביר ש-estrone החלש כסטרואיד מוסב בהמשך לאסטרוגן הפוטנטי estradiol, וכן שטסטוסטרון מוסב לאנדרוגן האנדוגני הפוטנטי ביותר, dihydrotestosterone (להלן DHT) באופן מקומי ברקמות היעד כגון המוח, רקמת השד, בלוטת הערמונית, והעור הגניטלי, וכתוצאה מכך מפגין השפעות ביולוגיות פוטנטיות. רעיון זה נתמך על ידי הנוכחות של רקמות רבות בהן חלבונים רבים עם פעילויות אנזימטיות חופפות המקטלזות את ההסבות המתוארות (כגון 17βHSD מחזר, ו-5α-reductase). הזקיק בשלב הקדם-מבייץ מפריש estradiol במהלך המחצית הראשונה של המחזור החודשי, וה-corpus luteum מפריש estradiol וקדם-פרוגסטרון במהלך המחצית השנייה של המחזור החודשי. היצירה של שני סטרואידיפ פעילים ביולוגית אלה מתואמת בזקיק וב-corpus luteum תחת הבקרה של LH ושל FSH. סטרואידים המיוצרים על ידי השחלות ועל ידי אברונים מייצרי סטרואידים מתחילים דרכם במסלול הסינתטי מכולסטרול.
מספר מקורות של כולסטרול יכולים לספק לשחלות מצעים לתהליך הסטראידוגנזה, כולל ליפופרוטאינים של כולסטרול בפלזמה, כולסטרול המסונתז de novo בתוך השחלות, וכולסטרול מהמאגרים התוך-תאיים של כולסטרול-אסטר הנמצאים בתא בטיפות ליפידיות. בשחלות האישה, LDL cholesterol מהווה מקור חשוב של כולסטרול המשמש לסטרואידוגנזה. LH מעודד את הפעילות של האנזים adenylyl cyclase להגברת היצירה של cAMP המשמש כ-messenger שני להגברת LDL receptor mRNA, להגברת הקישור והקליטה של LDL cholesterol ויצירת אסטרים של כולסטרול.
אטיולוגיה
כאמור, הפעילות של 21-hydoxylase מתווכת על ידי cytochrome p450c21 הנמצא ברטיקולום האנדופלזמי (Speiser וחב' ב-J Clin Endocrinol Metab משנת 2018, Nour וחב' ב-Int J Pediatr Endocrinol מאותה שנה, ו-Dörr וחב' ב-J Clin Res Pediatr Endocrinol משנת 2019). הגן CYP21 המקודד ל-21-hydroxylase ממוקם באזור class III של הקומפלקס human major histocompatibility על כרומוזום 6. מבנה הגן CYP21 מכיל את הגן הפעיל CYP21 ואת הפסבדוגן CYP21P. למעלה מ-90% מהמוטציות הגורמות לחסר של -hydroxylase21 הן רקומבינציה בין CYP21 ו-CYP21P. אותרו מספר פגמים בגן זה: חלק מהמוטציות מונעות לחלוטין את הסינתזה של חלבון האנזים, בעוד שמוטציות missense אחרות מאפשרות סינתזה של אנזים עם 1 עד 50% של הפעילות הנורמלית. מאובחנים עם צורת מחלה של איבוד מלח בדרך כלל נושאים מוטציות על שני האללים ההורסים את הפעילות האנזימטית. בדיקה מולקולרית של הגן CYP21 זמינה, ועשויה לגלות מוטציות רגילות ושמטים (deletions) בגדלים שונים ב-95% מהילדים הפגועים. בערך 70% מכל התינוקות המאובחנים עם CAH הם בעלי צורת איבוד המלח, ואילו 30% מתוכם בעלי צורת הויריליזציה (Daae וחב' ב-Endocrine משנת 2018, ו-Rama Chandran ו-Loh ב-Gynecol Endocrinol משנת 2019). הצורה הלא-קלאסית של CAH היא בעלת שכיחות של 1 ל-1,000 לידות-חי באוכלוסייה הכללית, היא שכיחה יותר בקרב קבוצות אתניות ספציפיות כגן יהודים-אשכנזים והיספאנים.
כיוון שאלדוסטרון מווסת את ההומאוסטאזיס של נתרן, מאובחנים בלתי מטופלים מאבדים כמות ניכרת של נתרן בהפרשה בשתן מה שיגרום ל-hypovolemia ול-hyperreninemia. מטופלים אלה אינם מסוגלים להפריש אשלגן בצורה מספקת ובהם תתקבל היפר-קלמיה בעיקר בשנות הילדות המוקדמות. בנוסף, הצטברות של קודמנים של סטרואיד יכולה להיות בעלת השפעה אנטגוניסטית ישירה על הקולטן של מינרלו-קורטיקואיד ולהחמיר את החסר במינרלו-קורטיקואיד, במיוחד באלה שאינם מטופלים. פרוגסטרון ידוע היטב כבעל השפעות אנטי-מינרלוקורטיקואידיות. חסר קורטיזול תורם לתפקוד לבבי חלש, לתגובה וסקולרית חלשה לקטכולאמין, לקצב סינון מופחת (GFR) בפקעיות הכליה, ולהפרשה מוגברת של ADH. חסר הדדי של קורטיזול ושל אלדוסטרון, גורם לדהידרציה היפונתרמית ועלולה לגרום הלם במאובחנים לא מטופלים. עוברי נקבות חשופים לרמות סיסטמיות גבוהות של אנדרוגנים מהאדרנל החל משבוע ההיריון השביעי, לפיכך מצג איברי המין שלהם בלידה שָׁנוּי בְּמַחֲלֹקֶת.
הצורה הלא-קלאסית של חסר 21-hydroxylase (הצורה המתונה)
שעירות-יתר היא התסמין השכיח ביותר בהופעת CAH לא-קלאסית, תלווה על ידי חטטת הפנים (acne) ו-oligomenorrhea (נדירות וסת או וסת קלה ביותר). לפיכך, חסר לא-קלאסי של 21-hydroxylase ותסמונת שחלות פוליציסטית יכולות להופיע באופן דומה.
ההערכה האבחונית של CAH בסקר יילודים אמורה לכלול
- מדידת הפעילות של 21hydroxylase
- רמת 17-hydroxyprogesterone תהיה גבוהה מאוד (בדרך כלל מעל 1,000 ננוגרם/דציליטר), בנבדק עם צורת המחלה הקלאסית
- היפרקלמיה, היפונתרמיה, רמת אלדוסטרון נמוכה, ורמה גבוהה של renin בפלזמה שהם סמנים של סינתזה פגומה של מינרלו-קורטיקואידים
- בתינוקת עם מצג שנוי במחלוקת של איברי המין, יש לבצע בדיקת קריוטיפ, לבסס את מין התינוק
- בדיקת אולטרה-סאונד של האגן, צריכה להתבצע לגילוי אנומליות של הרחם והכליות
- בדיקת גיל העצמות מסייעת בנבדקים עם צמיחת שיער מוקדמת במבושים
- במטופלים עם סימנים של כשל חריף של האדרנל, יש לבצע בדיקת CT על מנת לשלול שטף-דם באדרנל
- יש לבצע בדיקת ACTH stimulation להערכת פעילות האדרנל, ולהבדיל בין כל הפגמים האנזימטיים הפוטנציאליים. טיפול עם 0.25 מיליגרם cosyntropin שהוא ACTH סינתטי גורם לגירוי פרמקולוגי של בלוטות האדרנל, ומביא למקסימום את הפרשת ההורמון
- יש לבצע פרופיל שלם של האדרנל, הכולל מדידת hydroxyprogesterone-17, קורטיזול, deoxycorticosterone-11, deoxycortisone 11-hydroxypregnenolone, DHEA או dehydroepiandrosterone ו-androstenedione מיד לפני ו-60 דקות אחרי מתן cosyntropin.
מינרלו-קורטיקואידים
בתינוקות הנולדים עם צורת איבוד המלח של OHD-21, נדרש טיפול עם מינרלו-קורטיקואידים. יש לטפל במתן fludrocortisone בדרך כלל במינון של 0.1 עד 0.2 מיליגרם ליום, אך לעיתים עד 0.4 מיליגרם ליום, וכן NaCl במינון של 1–2 גרם ליום, שכן תכולת הנתרן בחלב האם בהנקה, או תכולת הנתרן בפורמולות השונות (בערך 8 מילי-אקוויוולנט לליטר) אינה מספיקה לפצות על איבוד נתרן בתינוקות אלו. רמות פעילות renin בפלזמה, יכולות לשמש לניטור היעילות של מתן מינרלו-קורטיקואידים ומתן NaCl. לחץ-דם נמוך, היפרקלמיה ורמות מוגברות של renin מצביעים על הצורך להגביר את המינון של מינרלו-קורטיקואידים ו-NaCl, ואילו יתר לחץ-דם, טכיקרדיה, ורמה מופחתת של פעילות renin מצביעים של מינון מופרז של שני האחרונים. כמו כן, מינון מוגבר יתר על המידה של fludrocortisone עלול לעכב גדילה.
אבחון מבדיל
CAH כתוצאה מחסר של 11β-hydroxylase, CAH כתוצאה מחסר של 3β-hydroxysteroid dehydrogenase, CAH כתוצאה מחסר של α-reductase5, CAH כתוצאה מהיפופלזיה של האדרנל; CAH כתוצאה מאי-ספיקה של האדרנל; פגמים בסינתזה של טסטוסטרון; שטף-דם דו-צדדי של האדרנל; תסמונת פוליציסטית של השחלות; אי-סדירות בהתפתחות המגדרית; אורופתיה חסימתית; חסר משפחתי של גלוקו-קורטיקואיד; תסמונת אי-רגישות לאנדרוגן. סיבות אחרות להיפרקלמיה/היפונתרמיה; מצב של היצרות היפרטרופית פילורית; תסמונת Denys-Drash (מחלה תורשתית אוטוזומלית רצסיבית נדירה, לרוב עם תסמונת משולשת): מחלת כליות פרוגרסיבית עם ביטוי של גידול Wilms מוקדם לרוב דו צדדי (נפרובלסטומה); טרשת מזנגיאלית מפוזרת (תאי רקמת חיבור מתפשטים בגופי הכליה); אנומליות באיברי המין (פסאודו-המפרודידיזם גברי).
פרוגנוזה
ילדים המאובחנים עם CAH הם לרוב גבוהים בשנות הילדות הראשונות, אך הם לרוב נמוכים בבגרותם (כ-10 ס"מ נמוכים יותר מהוריהם). בנוסף, טיפול של CAH עם גלוקו-קורטיקואידים עלול לדכא גדילה, באופן הגורם לקומה נמוכה. טיפול עם הורמון גדילה (GH) או עם אנלוג הורמונלי המשחרר את ההורמון LH, גורמים לתוספת גדילה ממוצעת של 7.3 ס"מ (Bachelot וחב' ב-Eur J Endocrinol משנת 2017, Khattab וחב' ב-J Steroid Biochem Mol Biol משנת 2017, ו-King וחב' ב-Clin Endocrinol משנת 2016). רוב הילדים עם CAH הם בעלי התפתחות נוירו-פסיכולוגית נורמלית. יתרה מכך, למרות הנטייה למגדר הזכרי, רוב הילדות עם CAH מפגינות העדפה הטרוסקסואלית. זכרים ונקבות עם CAH שומרים על פוריותם עם כי בדרגה פחותה יותר מהפוריות של אנשים בריאים. זאת כתוצאה של מגורמים ביולוגיים, פסיכולוגיים וסוציאליים.
מדידת hydroxyprogesterone-17 בדם
הרמות של hydroxyprogesterone-17 בדם משתנות לאורך היום. בנשים, הן משתנות גם בשלבים השונים של המחזור החודשי. אין צורך בהכנה ספציפית כגון צום לפני ביצוע הבדיקה. למדידה של hydroxyprogesterone-17 ביילודים נלקחת טיפת דם מעקב היילוד 48 שעות לאחר הלידה. רמה הגבוהה מ-5,000 ננוגרם/דציליטר היא סימן מובהק להיפר-פלזיה של האדרנל (CAH). מעבר לנבדקים בתקופת הימים הראשונים לחייהם, הדרך הטובה ביותר היא ליטול דם בשעות הבוקר המוקדמות, להימנע מהשפעת ה-circadian rhythm. בנשים בגיל הפריון יש ליטול את דגימת הדם בפאזה הפוליקולרית של המחזור. את הסמן הזה ניתן למדוד בנסיוב (נטילת הדם למבחנה כימית (פקק צהוב או אדום), או בפלזמה (נטילת הדם למבחנת ספירת דם המכילה EDTA או K2EDTA (בפקק בצבע סגלגל), או במבחנת סודיום הפארין או ליתיום הפארין, (פקק בצבע ירוק)). לאחר נטילת הדם וסרכוז המבחנה יש להפריד את הנסיוב או את הפלזמה מהתאים במשקע, ולהעביר 0.5 מ"ל של הנוזל למבחנת טרנספורט סטנדרטית. היציבות של הדגימות בטמפרטורת החדר היא למשך 48 שעות, בקירור למשך שבוע, ובהקפאה למשך 6 עד 24 חודשים. יש לפסול דגימות מאוד המוליטיות או כאלה שהגיעו למעבדה בטמפרטורת החדר. לפיכך הדגימות חייבות להגיע למעבדה בקירור או כשהן מוקפאות. המדידה של 17α-hydroxyprogesterone מתבצעת בשיטות של liquid chromatography-tandem mass spectrometry (LC-MS) או (GLC) gas liquid chromatography. בעבר בוצעה מדידה זו בשיטות של radioimmunoassay או בשיטת IRMA (או immunoradiometric assay) אך אלה יכלו להיות בעייתיות בשל פעילות צולבת של הנוגדן עם תרכובות סטרואידיות עם מבנה דומה (de Hora וחב' ב-Int J Neonat Screen משנת 2020, ו-Bialk וחב' באותו כתב-על משנת 2019).
מדידת 17-hydroxyprogesterone בדם יכולה לשמש גם לאבחון של late-onset CAH בנשים עם שעירות-יתר (hirsutism) במקרים של מחזור לא סדיר. אם תוצאת המדידה של hydroxyprogesterone-17 מתקבלת לא נורמלית, יש לדרוש ביצוע בדיקת corticotropin-stimulation לאישור החשד ל-CAH . במקרים של ספק לגבי מין התינוק/תינוקת, בדיקת קריוטיפ צריכה להתבצע לאתר אי-סדירות בכרומוזומים, על מנת לקבוע את מין היילוד.
רמת 17-hydroxyprogesterone מוגברת כאשר 2 אנזימים המשתתפים בסינתזה של קורטיזול פגומים או חסרים, 21-hydroxylase ו-11β ydroxylase, מה שגורם ל-CAH. מדידת 17-hydroxyprogesterone נדרשת בשגרה כחלק מבדיקות סקר יילודים על מנת לגלות CAH. בלמעלה מ-90% מהמקרים, CAH נגרם ממוטציות הומוזיגוטיות או ממוטציות compound heterozygous (דהיינו מוטציות במקומות שונים על פני שני האללים של הגן) בגן בציטוכרום P-450 C21 המקודד ל-CYP21A2, מה שגורם לחסר של hydroxylase-21. אבחון של חסר זה בעוּבר במהלך היריון אפשרי בדגימה של סיסי שלייה (chorionic villous).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק