הבדלים בין גרסאות בדף "איברוטיניב לטיפול בלויקמיה לימפוציטית כרונית - Ibrutinib for the treatment of chronic lymphocytic leukemia - CLL"
| (74 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=Chronic lymphocytic leukemia.jpg |
| − | |כיתוב תמונה= | + | |כיתוב תמונה=Peripheral blood smear showing CLL cells |
|שם עברי=איברוטיניב לטיפול בלויקמיה לימפוציטית כרונית - CLL | |שם עברי=איברוטיניב לטיפול בלויקמיה לימפוציטית כרונית - CLL | ||
|שם לועזי=Ibrutinib for the treatment of chronic lymphocytic leukemia | |שם לועזי=Ibrutinib for the treatment of chronic lymphocytic leukemia | ||
| − | |שמות נוספים=צעד חשוב בטיפול ב - CLL | + | |שמות נוספים=איברוטיניב – מתרופה פורצת דרך לטיפול סטנדרטי{{ש}}שינוי פרדיגמה בטיפול בלוקמיה לימפטית כרונית{{ש}}צעד חשוב בטיפול ב - CLL |
|ICD-10={{ICD10|C|91|1|c|81}} | |ICD-10={{ICD10|C|91|1|c|81}} | ||
|ICD-9={{ICD9|204.1 V10.60}} | |ICD-9={{ICD9|204.1 V10.60}} | ||
|MeSH=D015451 | |MeSH=D015451 | ||
| − | |יוצר הערך=ד"ר | + | |יוצר הערך=ד"ר אוהד בנימיני |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | {{הרחבה|ערכים=[[איברוטיניב]] , [[לוקמיה לימפוציטית כרונית]]}} | + | {{הרחבה|ערכים=[[איברוטיניב]], [[לוקמיה לימפוציטית כרונית]]}} |
| + | [[לויקמיה לימפוציטית כרונית]] (CLL{{כ}}, Chronic Lymphocytic Leukemia) היא ה[[לויקמיה]] השכיחה ביותר בעולם המערבי. מהלך המחלה לרוב איטי אך יחד עם זאת שונה מאוד מחולה לחולה. ההישרדות יכולה להיות רבת שנים אך בחלק מהחולים תוחלת החיים קצרה עם מהלך של חודשים. המחלה נחשבת לחשוכת מרפא עם פוטנציאל ריפוי על ידי [[השתלת מח עצם|השתלה אלוגנאית]] בקבוצה מצומצמת של חולים{{הערה|שם=הערה1|Chiorazzi N, Rai KR, Ferrarini M, Chronic lymphocytic leukemia. N Engl J Med 2005352:804-15.}}. חלה התקדמות ממשית בטיפול בלויקמיה לימפוציטית כרונית על ידי כימואימונותרפיה הכוללת שילוב של כימותרפיה עם נוגדן מונוקלונלי ל-[[CD20]], שהביא לתגובה ממושכת ללא מחלה ולהארכת חיים בחולים צעירים. הטיפול הסטנדרטי בחולים צעירים עד גיל 65 הוא משלב FCR{{כ}} [{{כ}}[[t:Fludarabine|Fludarabine]], {{כ}}[[t:Cyclophosphamide|Cyclophosphamide]]{{כ}} (Endoxan) ו-[[t:Rituximab|Rituximab]]{{כ}} (Mabthera){{כ}}]{{הערה|שם=הערה2|Keating MJ, O'Brien S, Albitar M, etal. Early results of a chemoimmunotherapy reg¬imen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005;23:4079-88.}}. | ||
| + | חולים מבוגרים יותר שיכולים לעמוד בטיפול אינטנסיבי משיגים תוצאות דומות במשלב BR{{כ}} [{{כ}}[[t:Bendamustine hydrochloride|Bendamustine]]{{כ}} (Ribomustin){{כ}} ו-Rituximab]{{כ}}{{הערה|שם=הערה3|Eichhorst B, Fink AM, Busch R, et al. Frontline Chemoimmunotherapy with Fluda-rabine (F), Cyclophosphamide (C], and Rituximab (R) (FCR) Shows Superior Efficacy in Comparison to Bendamustine (B) and Rituximab (BR) in Previously Untreated and Physically Fit Patients (pts) with Advanced Chronic .2014.}}. חולים עם מחלות נלוות או חולים מבוגרים יותר לרוב אינם יכולים לעמוד בכימואימונותרפיה אינטנסיבית והם מטופלים בכימותרפיה קלה יותר, [[t:Chlorambucil|Chlorambucil]] בשילוב נוגדנים מונוקלונלים חדשים ל-CD20{{כ}}{{הערה|שם=הערה4|Goede V, Fischer K, Engelke A, etal. Obinutuzumabas frontline treatment of chron¬ic lymphocytic leukemia: updated results of the CLL11 study. Leukemia 2015:29:1602¬4.}},{{הערה|שם=הערה5|Hillmen P, RobakT,Janssens A, etal. Chlorambucil plus ofatumumab versus chlo-rambucil alone in previously untreated patients with chronic lymphocytic leukae¬mia (COMPLEMENT l):a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385:1873-83.}}. שילוב Chlorambucil עם [[t:Gazyva|Gazyva]] {{כ}}(Obinutuzumab) הביא להארכת חיים לעומת טיפול עם Chlorambucil בלבד והאריך בכשנה את משך הזמן ללא מחלה (PFS{{כ}}, Progression-free Survival) לעומת חולים שטופלו ב-Chlorambucil עם הנוגדן Rituximab{{הערה|שם=הערה5}}. | ||
| + | |||
| + | על אף התוצאות המרשימות, במרבית החולים המחלה תתקדם תוך חודשים או שנים לאחר הטיפול הראשון והתגובה לטיפול חוזר קצרה ומוגבלת. מדדים פרוגנוסטים חדשים שיפרו את היכולת לנבא עמידות לטיפול ולזהות חולים שמחלתם תתקדם מוקדם יותר. מדדים אלו כוללים זיהוי שינויים ידועים בכרומוזומים על ידי בדיקת [[FISH]]{{כ}} (Fluorescence In Situ Hybridization), סטטוס המוטציה ב-IgV<sub>H</sub>{{כ}} (Immunoglobulin heavy-chain Variable-region){{כ}} ZAP70, CD38, CD49d ו-[[בתא-2-מיקרוגלובולין - Beta-2-microglobulin|{{כ}}microglobulin-{{כ}}β2]]{{כ}}{{הערה|שם=הערה6|Wierda WG, O'Brien S, Wang X, etal. Multivariate model for time to first treatment in patients with chronic lymphocytic leukemia. J Clin Oncol 2011;29:4088-95.}}. | ||
| + | |||
| + | פיתוח טיפולים חדשים מתמקד במציאת מענה טוב יותר לשתי אוכלוסיות חולים בעיקר: | ||
| + | #חולים מבוגרים או חולים עם מחלות נלוות אשר אינם יכולים לעמוד בטיפול כימואימונותרפי סטנדרטי | ||
| + | #חולים עם גורמים פרוגנוסטים רעים וסמנים גנטים וביולוגים המנבאים עמידות או חזרה מוקדמת של המחלה לאחר כימואימונותרפיה. תת הקבוצה של חולים עם חסר הזרוע הקצרה של כרומוזום 17 (del17p) או מוטציה ב-TP53{{כ}} (Tumor Suppressor Gene) מתאפיינת בהתקדמות המחלה עם עמידות לכימותרפיה. קבוצה זו מהווה פחות מ-10% מחולי CLL באבחנה אך כשליש מהחולים שמחלתם נשנית{{הערה|שם=הערה7|ZenzT, Gribben JG, Hallek M, Dohner H, Keating MJ, Stilgenbauer 5. Risk categories and refractory CLL in the era of chemoimmunotherapy. Blood 2012;119:4101-7.}} | ||
| + | |||
| + | הטיפול בלויקמיה לימפוציטית כרונית עובר שינויים דרמטיים. מגוון הטיפולים החדשים יאפשר בעתיד הקרוב טיפול אינדיבידואלי ומתאים לפי רמת סיכון התלויה בגורמים פרוגנוסטים ותחלואה נלווית. | ||
| + | |||
| + | [[t:Imbruvica|Imbruvica]]{{כ}} (Ibrutinib - איברוטיניב) היא הראשונה מבין התרופות החדשות להיכנס לארסנל הטיפול בלויקמיה לימפוציטית כרונית. Ibrutinib הפכה בחמש שנים מתרופת מחקר לטיפול סטנדרטי בחולים בסיכון גבוה ולחולים עם מחלה חוזרת או עמידה. התרופה מאושרת בארץ לטיפול ב-CLL עבור חולים שמחלתם חזרה (Relapsed) או הייתה עמידה (Refractory) לטיפול קודם. תוצאות הטיפולים החדשים מבשרות כי בשנים הקרובות המחקר הקליני ב-CLL יתמקד בטיפולים ללא כימותרפיה ושילוב תרופות עם מנגנונים סינרגיסטים עם מיעוט תופעות לוואי במטרה לשפר הישרדות ואיכות חיים בדרך לריפוי המחלה. | ||
| + | |||
| + | ==תהליכים ביולוגים שהביאו לפיתוח תרופות== | ||
| + | |||
| + | הבנה טובה יותר של תהליכים בביולוגיה של המחלה הביאה לגילויים ולפיתוח מולקולות ממוקדות מטרה לתהליכים ספציפיים המעורבים בפתגונזה של המחלה. חלק מהמולקולות הגיעו לכדי פיתוח תרופות המיושמות בקליניקה ומתמקדות בעיכוב אנזימים המעבירים אותות מהקולטן לתאי B{{כ}} (BCR{{כ}}, B-cell Receptor). שתי תרופות עם יעדים שונים בעיכוב האותות מהקולטן לתאי B הן Ibrutinib, מעכב של BTK{{כ}} (Bruton Thyrosin Kinase) ו-[[t:Zydelig|Zydelig]] {{כ}}(Idelalisib), מעכב PI3Kδ{{כ}} (Phosphatidylinositol-3-kinaseδ). מנגנון נוסף הוא השראת אפופטוזיס על ידי עיכוב החלבון 2-Bcl עם מולקולה קטנה וסלקטיבית, [[t:Venetoclax|Venetoclax]]. היעילות המרשימה ומיעוט תופעות הלוואי של התרופות הללו הביאו לאישורן לשימוש בקליניקה על ידי הרשויות בארצות הברית ובאירופה. | ||
| + | |||
| + | ==הקולטן לתאי B - מנגנון פעולה== | ||
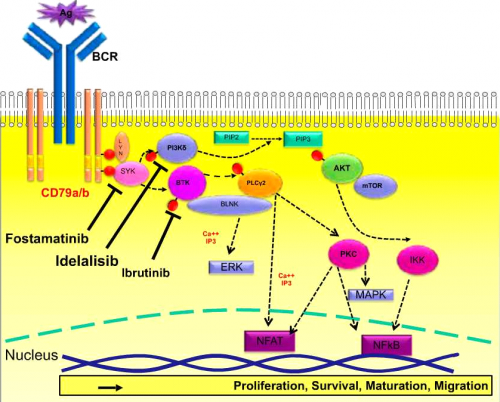
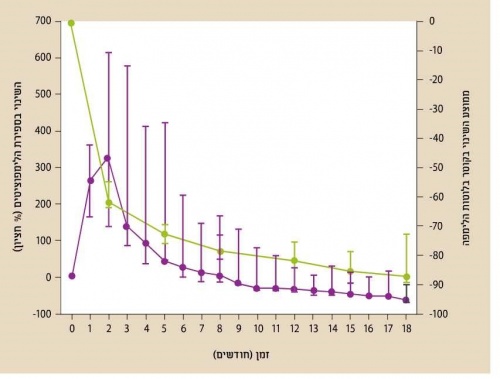
| + | הקולטן לתאי B הוא קומפלקס טרנסממברנלי מורכב הכולל שרשרת [[אימונוגלובולין]]. קישור ליגנד לקולטן תאי B גורם להפעלה של מספר תהליכים החיוניים להתפתחות תאי B המשפיעים על פרוליפרציה, התמיינות, הבשלה, אפופטוזיס ונדידה של התאים. הקשר בין הפעלת הקולטן על ידי אנטיגן וקבלת תגובה תוך תאית תלוי במעבר אותות והפעלת קסקדה של חלבונים ומולקולות מתאמות{{הערה|שם=הערה8|Pleyer L, Egle A, Hartmann TN, Greil R. Molecular and cellular mechanisms of CLL: novel therapeutic approaches. Nat Rev Clin Oncol 2009;6:405-18,}},{{הערה|שם=הערה9|Burger JA, Chiorazzi N. B cell receptor signaling in chronic lymphocytic leukemia. Trends Immunol 2013;34:592-601.}}. האנזימים PI3Kδ {{כ}}, SYK {{כ}}(Spleen Tyrosin Kinases) ו-BTK{{כ}} (Bruton's Tyrosin Kinase) חיוניים להעברת האותות ב-BCR ועיכוב שלהם מביא לפגיעה בהבשלה ושגשוג התאים, לאחר מפגש האנטיגן עם תא B המתרחש בעיקר בבלוטות לימפה{{הערה|שם=הערה10|Herishanu Y, Perez-Galan P, Liu D, et al.The lymph node microenvironment promotes B-cell receptor signaling, NF-kappaB activation, and tumor proliferation in chronic lymphocytic leukemia. Blood 2011;117:563-74.}},{{הערה|שם=הערה11|Cheng S, Ma J, Guo A, etal. BTK inhibition targets in vivo CLL proliferation through its effects on B-cell receptor signaling activity. Leukemia 2014;28:649-57.}}. ידוע שגורמים בסביבת תא CLL שמקורם בתאי משתית (Stroma) ומונוציטים, בהם "Nurse like cells" חיוניים ומשפיעים על השרדותו דרך אותות המועברים על ידי הקולטן{{הערה|שם=הערה12| Burger JA. The CLL cell microenvironment. Adv Exp Med Biol 2013;792:25-45.}},{{הערה|שם=הערה13|Burger JA, Ghia P, Rosenwald A, Caligaris-Cappio F. The microenvironment in ma¬ture B-cell malignancies: a target for new treatment strategies. Blood 2009:114:3367¬75.}}. עד היום פותחו מספר מולקולות קטנות שנמצאו יעילות בעיכוב BTK ,PI3K ,SYK - קינאזות חיוניות למעבר האותות ב-BCR - שהביאו לפגיעה בהפעלתו ופגיעה בפרוליפרציה של תאי המחלה (תרשים 1). בחולים, התגובה שנצפית בטיפול בכל אחת ואחת מהמולקולות הללו (Class effect) היא שיפור בסימפטומים של המחלה והצטמקות מהירה של בלוטות הלימפה בד בבד עם עלייה בספירה האבסולוטית של לימפוציטים בדם פריפרי. העלייה בספירת הלימפוציטים בדם היא זמנית ומתרחשת תוך כדי שיפור במדדים הקליניים של המחלה. לאחר שיא בספירת הלימפוציטים שמופיע תוך שבוע-שבועיים מתהילת הטיפול חלה ירידה הדרגתית שמתחילה לאחר כחודשיים (תרשים 2). אף שהעלייה בספירת הלימפוציטים משתנה בין החולים ויכולה להימשך חודשים רבים, היא אינה מבשרת על כשלון טיפולי. הלימפוציטוזיס נובע מיציאה של לימפוציטים ממדורי מח העצם ובלוטות הלימפה לדם כתוצאה מהשפעה של מעכבי הקינאזות על נדידה ואינטראקציה של תאי CLL וללא גדילה בכמות הלימפוציטים. נמצא שבשלב זה מתרחשת ירידה בפרוליפרציה של הלימפוציטים{{הערה|שם=הערה14|Herman SE, Niemann CU, Farooqui M, et al. Ibrutinib-induced lymphocytosis in patients with chronic lymphocytic leukemia: correlative analyses from a phase II study. Leukemia 2014;28:2188-96.}}. | ||
| + | |||
| + | |||
| + | [[קובץ:BCR1.png|ממוזער|מרכז|500 פיקסלים|תרשים 1: הפעלה של קולטן תאי B Cell Receptor (BCR) B ומעבר אותות אל פקטורי שעתוק גורמים לפרוליפרציה, דיפרנציאציה, השרדות ונדידה של לימפוציטים. מולקולות קטנות שנקשרות ל-Tyrosine kinases מעכבות את פעולת האנזימים SYK, {{כ}}BTK ו-PI3Kδ באופן יעיל ובלתי הפיך]] | ||
| + | |||
| + | |||
| + | [[קובץ:BCR2.jpg|ממוזער|מרכז|500 פיקסלים|תרשים 2. התגובה ל-Ibrutinib לאורך זמן בחולים עם מחלה חוזרת או רפקרקטורית. בצבע סגול ספירת לימפוציטים בדם, בירוק השינוי בקוטר בלוטות הלימפה. על פי 2014 Byrd et al. NEJM]] | ||
| + | |||
| + | ==עיכוב הקולטן לתאי B על ידי Ibrutinib== | ||
| + | |||
| + | Ibrutinib היא מולקולה קטנה הנקשרת בקשר קובלנטי בלתי הפיך לציסטאין (Cys481) שבאתר הפעיל של האנזים BTK, ותוך שעות גורמת לעיכוב מוחלט של פעילותו בריכוזים נמוכים. האנזים הציטופלסמטי BTK הוא Tyrosin kinase, שלוקח חלק חשוב במעבר אותות דרך קולטניי תאי B וגורם להפעלה של מסלול NFkB ,MAP kinase ומסלולים נוספים{{הערה|שם=הערה11}}. מוטציה גנטית ב-BTK מבטלת את פעילותו, חוסמת את הבשלת תאי B בשלב pre-B וגורמת ל-[[X-linked agammaglobulinemia]]. המחלה, הנקראת גם Bruton's agammaglobulinemia, גורמת לחסר מוחלט של תאי B בשלים וחסר באימונוגלובולינים ומתבטאת בזיהומים חיידקיים חוזרים{{הערה|שם=הערה15|Bruton OC. Agammaglobulinemia. Pediatrics 1952;9:722-8.}}. Ibrutinib מעכב BTK ופוגע במעבר האותות ב-BCR לפקטורי שיעתוק בגרעין התא וכתוצאה מכך גורם לפגיעה בשגשוג תאי המחלה. | ||
| + | |||
| + | Ibrutinib ניתנת כטיפול פומי, ויתרון נוסף של החרופה הוא הפרופיל הבטיחותי. בניגוד לכימותרפיה, התרופה אינה גורמת לדיכוי מח העצם ואינה מדכאת יצור אימונוגלובולינים. ציטופניות מדרגה 3-5 קיימות בכ-15% מהחולים לעומת 85% בטיפול כימואימונותרפי סטנדרטי. מרבית תופעות הלוואי שאינן המטולוגיות הן מדרגה 1-2. קיים סיכון מוגבר לאירועי דמם בעיקר קלים המתבטאים כהמטומות או [[אכימוזות]] בעור. התרופה אינה ניתנת בשילוב עם [[נוגדי קרישה|אנטיקואגולציה]] מסוג [[t:Coumadin|Coumadin]]{{כ}} (Warfarin) בשל הסיכון לאירועי דמם קשים. Ibrutinib הוגדרה כתרופה פורצת דרך ועברה אישור על ידי ה-FDA{{כ}} (Food and Drug Administration) בפברואר 2014 לטיפול בלויקמיה לימפוציטית כרונית עמידה או במחלה חוזרת ולאחר מכן גם בטיפול קו ראשון בחולים עם del17p. | ||
| + | |||
| + | ==מחקרים עם Ibrutinib כטיפול יחיד בלויקמיה לימפוציטית כרונית== | ||
| + | |||
| + | במחקרים הראשונים בשלב I נמצאה תפוסה מלאה של Ibrutinib לאתרי הקישור לאנזים כבר במינון 2.5 מ"ג/ק"ג (מיליגרם/קילוגרם) ללא הגעה למינון מירבי נסבל (MTD{{כ}}, Maximal Tolerated Dose). המינון המקובל עם מיעוט תופעות לוואי בלויקמיה לימפוציטית כרונית הוא 420 מ"ג ליום. התקבל שיעור תגובה כוללת (ORR{{כ}}, Overall Response Rate) ב־70% מהחולים ובעוד 20% מהחולים התרחשו תגובה חלקית ולימפוציטוזיס{{הערה|שם=הערה16| Advani RH, Buggy JJ, Sharman JP, et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/relractory B-cell malig¬nancies. J Clin Oncol 2013;31:88-94.}}. כבר במחקרים הראשונים ניתן היה לראות שיעילות הטיפול ב-Ibrutinib לא תלויה בגורמים פרוגנוסטים קלינים או ביולוגיים כמו שלב מחלה מתקדם, מספר קווי טיפול קודמים ונוכחות del17p. סיכום של 132 חולים במשך מעקב חציוני של 3 שנים הראה שהתגובה לטיפול ממושכת. רק ב-25 חולים בתקופת המעקב המחלה התקדמה{{הערה|שם=הערה17|Byrd JC, Furman RR, Coutre SE, et al. Three-year follow-up of treatment-naive and previously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood 2015;125:2497-506.}}. על בסיס נתונים אלה אושר בפברואר 2014 הטיפול ב-Ibrutinib על ידי ה-FDA לטיפול בחולי לויקמיה לימפוציטית כרונית עם הישנות המחלה. יעילות ובטיחות Ibrutinib נבדקה ונמצאה זהה במחקר פאזה Ib גם כקו טיפול ראשון בחולים מבוגרים (מגיל 65 ומעלה){{הערה|שם=הערה18| O'Brien S, Furman RR, Coutre SE, etal. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol 204,15:48-58.}}. | ||
| + | |||
| + | ב-2014 התפרסמו תוצאות מחקר אקראי שלב III{{כ}} (RESONATE) שהשווה טיפול ב-Ibrutinib לנוגדן מונוקלונלי ל-CD20 {{כ}}[[t:Arzerra|Arzerra]]{{כ}} (Ofatumumab) ב-391 חולים עם מחלה עמידה או חוזרת{{הערה|שם=הערה19|Byrd JC, Brown JR, O'Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014;371:213-23.}}. החולים שנכללו לא היו מתאימים לטיפול בכימותרפיה עם אנאלוגים של פורינים (Purine analogues) בשל חזרת מחלתם זמן קצר לאחר כימואימונותרפיה. נכללו גם חולים עם מחלות נלוות, חולים מבוגרים (גיל 70 ויותר) או חולים עם del17p. התגובה הכוללת הייתה טובה יותר משמעותית בקבוצת החולים שטופלו ב-Ibrutinib{{כ}}: 42.6% ועוד 20% עם תגובה חלקית ולימפוציטוזיס לעומת 4.1% בקבוצת Arzerra. לאחר מעקב של 9.4 חודשים החולים שטופלו ב-Ibrutinib לא הגיעו למשך הזמן החציוני ללא מחלה (PFS) לעומת 8.4 חודשים בחולים שטופלו ב-Arzerra. הטיפול ב-Ibrutinib השפיע באופן חיובי גם על הישרדות החולים. אפקט בסדר גודל דומה נצפה גם בתת קבוצת חולים עם del17p וחולים עם מחלה עמידה לאנאלוגים של פורינים{{הערה|שם=הערה19|}}. יעילות Ibrutinib בחולים עם del17p נבדקה במחקר פאזה II על 51 חולים עם del17p כקו ראשון או בחזרת מחלה. אחרי שנתיים מעקב נצפתה תגובה ב-97% מהחולים וב-80% מהחולים במחלה עמידה או חוזרת{{הערה|שם=הערה20|Farooqui MZ, Valdez J, Martyr S, etal. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukaemia with TP53 aberrations: a phase 2, single-arm trial. Lancet Oncol 2015:16:169-76.}}. בעקבות מחקר זה, הרחיב ה-FDA את ההתוויה לטיפול ב-Ibrutinib לחולים עם del17p גם כקו טיפול ראשוני. | ||
| + | |||
| + | ==טיפול ב-Ibrutinib במִשְׁלבים== | ||
| + | |||
| + | במטרה לבטל את הלימפוציטוזיס בעקבות טיפול ב-Ibrutinib, ולשפר עוד יותר את התגובה לטיפול, נבדק Ibrutinib במשלבים. במחקר פאזה II על 40 חולים עם מחלה בסיכון גבוה, החולים טופלו ב-Ibrutinib ונוגדן מונוקלונלי ל-CD20, {{כ}}Rituximab. החולים שהוגדרו בסיכון גבוה כללו del17p/TP53 mutation, התקדמות מחלה תוך פחות מ-36 חודשים לאחר כימואימונותרפיה בקו ראשון או חולים עם del11q שמחלתם נשתנה. שיעור התגובה הכוללת היה 95% עם 8% תגובה מלאה (CR{{כ}}, Complete Response) ו-90% תגובה ב-20 החולים עם del17p/TP53 mutation{{כ}}{{הערה|שם=הערה21|Burger J A, Keating MJ, Wierda WG, et al. Safety and activity of ibrutinib plus ritux-imabfor patients with high-risk chronic lymphocytic leukaemia: a single-arm, phase 2 study. Lancet Oncol 2014;15:1090-9.}}. | ||
| + | |||
| + | השילוב האולטימטיבי של Ibrutinib עם כימואימונותרפיה נבדק תחילה על 33 חולים במחקר פאזה Ib וניתן עם BR או FCR. שיעור התגובה הכוללת של BR-Ibrutinib היה 93.3% עם 16.7% תגובה מלאה שהשתפרה במהלך המעקב ל-40%. לאחר 36 חודשים 70% מהחולים המשיכו טיפול ללא התקדמות המחלה. תופעות הלוואי שנצפו במחקר זה היו דומות לאלו שנצפו בחולים המטופלים ב-Ibrutinib או BR בנפרד. תוצאות מחקר זה הראו ש-Ibrutinib מגבירה יעילות כימואימונותרפיה ללא תוספת רעילות{{הערה|שם=הערה22|Brown JR, Barrientos JC, Barr PM, etal. Ibrutinib In Combination With Bendamus-tine and Rituximab Is Active and Tolerable In Patients With Relapsed/Refractory CLL/ SLL: Final Results Of a Phase lb Study2013.}}. | ||
| + | |||
| + | מחקר HELIOS המתקיים כעת הוא מחקר רב מרכזי אקראי כפול סמיות שלב III בעל פוטנציאל לשינוי היסטורי בטיפול בלויקמיה לימפוציטית כרונית. תוצאות ביניים של מחקר זה פורסמו במפגש החברה האמריקאית לאונקולוגיה (ASCO 2015) והציגו שיפור של 80% במשך התגובה ללא מחלה כאשר Ibrutinib שולב עם כימואימונותרפיה. המחקר כולל 578 חולי CLL/SLL שטופלו ב-BR בשילוב אינבו (289=n) או 420 מ"ג ליום Ibrutinib {{כ}}(289=n). את 6 מחזורי הטיפול המתוכנן עם BR השלימו 83% ו-78% מהחולים בזרוע אינבו וה-Ibrutinib, בהתאמה. בשלב תוצאות הביניים 31% (90=n) מהחולים בקבוצת ה-BR ואינבו התקדמו והועברו לזרוע Ibrutinib. שיעור התגובה הכולל היה 82.7% בזרוע Ibrutinib לעומת 67.8% בקבוצת הביקורת (0.0001=p), עם תגובה מלאה ב-10.4% לעומת 2.8% בקבוצה Ibrutinib ואינבו, בהתאמה. לאחר מעקב חציוני של 17.2 חודשים, בזרוע BR עם Ibrutinib לא הגיע להתקדמות ללא מחלה לעומת 13.3 חודשים בחולים שקיבלו BR בלבד (0.0001>p {{כ}},0.150-0.276{{כ}} CI {{כ}}95%{{כ}} ,0.203 HR). תועלת זו נצפתה גם בתת קבוצת החולים בסיכון גבוה{{הערה|שם=הערה23|Chanan-Khan AAA, Cramer P, Demirkan F, et al. Ibrutinib combined with benda-mustine and rituximab (BR) in previously treated chronic lymphocytic leukemia/small lymphocytic lymphoma (CLL/SLL): First results from a randomized, double-blind, placebo-controlled, phase III study. ASCO Meeting Abstracts 2015;33:LBA7005.}}. | ||
==דגלים אדומים== | ==דגלים אדומים== | ||
| שורה 28: | שורה 73: | ||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
| − | * [ | + | * [https://cloud.3dissue.com/414/590/940/sal2016/index.html?r=14 שינוי פרדיגמה בטיפול בלוקמיה לימפטית כרונית], איברוטיניב – מתרופה פורצת דרך לטיפול סטנדרטי{{כ}} TheMEDICAL, עמוד 44 |
| − | |||
| + | {{ייחוס|ד"ר אוהד בנימיני, רופא בכיר, מכון המטואונקולוגי, המרכז הרפואי ע"ש שיבא, תל השומר}} | ||
גרסה אחרונה מ־15:02, 20 בפברואר 2023
| איברוטיניב לטיפול בלויקמיה לימפוציטית כרונית - CLL | ||
|---|---|---|
| Ibrutinib for the treatment of chronic lymphocytic leukemia | ||

| ||
Peripheral blood smear showing CLL cells
| ||
| שמות נוספים | איברוטיניב – מתרופה פורצת דרך לטיפול סטנדרטי שינוי פרדיגמה בטיפול בלוקמיה לימפטית כרונית צעד חשוב בטיפול ב - CLL |
|
| ICD-10 | Chapter C 91.1 | |
| ICD-9 | V10.60 204.1 V10.60 | |
| MeSH | D015451 | |
| יוצר הערך | ד"ר אוהד בנימיני | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – איברוטיניב, לוקמיה לימפוציטית כרונית
לויקמיה לימפוציטית כרונית (CLL, Chronic Lymphocytic Leukemia) היא הלויקמיה השכיחה ביותר בעולם המערבי. מהלך המחלה לרוב איטי אך יחד עם זאת שונה מאוד מחולה לחולה. ההישרדות יכולה להיות רבת שנים אך בחלק מהחולים תוחלת החיים קצרה עם מהלך של חודשים. המחלה נחשבת לחשוכת מרפא עם פוטנציאל ריפוי על ידי השתלה אלוגנאית בקבוצה מצומצמת של חולים[1]. חלה התקדמות ממשית בטיפול בלויקמיה לימפוציטית כרונית על ידי כימואימונותרפיה הכוללת שילוב של כימותרפיה עם נוגדן מונוקלונלי ל-CD20, שהביא לתגובה ממושכת ללא מחלה ולהארכת חיים בחולים צעירים. הטיפול הסטנדרטי בחולים צעירים עד גיל 65 הוא משלב FCR [Fludarabine, Cyclophosphamide (Endoxan) ו-Rituximab (Mabthera)][2].
חולים מבוגרים יותר שיכולים לעמוד בטיפול אינטנסיבי משיגים תוצאות דומות במשלב BR [Bendamustine (Ribomustin) ו-Rituximab][3]. חולים עם מחלות נלוות או חולים מבוגרים יותר לרוב אינם יכולים לעמוד בכימואימונותרפיה אינטנסיבית והם מטופלים בכימותרפיה קלה יותר, Chlorambucil בשילוב נוגדנים מונוקלונלים חדשים ל-CD20[4],[5]. שילוב Chlorambucil עם Gazyva (Obinutuzumab) הביא להארכת חיים לעומת טיפול עם Chlorambucil בלבד והאריך בכשנה את משך הזמן ללא מחלה (PFS, Progression-free Survival) לעומת חולים שטופלו ב-Chlorambucil עם הנוגדן Rituximab[5].
על אף התוצאות המרשימות, במרבית החולים המחלה תתקדם תוך חודשים או שנים לאחר הטיפול הראשון והתגובה לטיפול חוזר קצרה ומוגבלת. מדדים פרוגנוסטים חדשים שיפרו את היכולת לנבא עמידות לטיפול ולזהות חולים שמחלתם תתקדם מוקדם יותר. מדדים אלו כוללים זיהוי שינויים ידועים בכרומוזומים על ידי בדיקת FISH (Fluorescence In Situ Hybridization), סטטוס המוטציה ב-IgVH (Immunoglobulin heavy-chain Variable-region) ZAP70, CD38, CD49d ו-microglobulin-β2[6].
פיתוח טיפולים חדשים מתמקד במציאת מענה טוב יותר לשתי אוכלוסיות חולים בעיקר:
- חולים מבוגרים או חולים עם מחלות נלוות אשר אינם יכולים לעמוד בטיפול כימואימונותרפי סטנדרטי
- חולים עם גורמים פרוגנוסטים רעים וסמנים גנטים וביולוגים המנבאים עמידות או חזרה מוקדמת של המחלה לאחר כימואימונותרפיה. תת הקבוצה של חולים עם חסר הזרוע הקצרה של כרומוזום 17 (del17p) או מוטציה ב-TP53 (Tumor Suppressor Gene) מתאפיינת בהתקדמות המחלה עם עמידות לכימותרפיה. קבוצה זו מהווה פחות מ-10% מחולי CLL באבחנה אך כשליש מהחולים שמחלתם נשנית[7]
הטיפול בלויקמיה לימפוציטית כרונית עובר שינויים דרמטיים. מגוון הטיפולים החדשים יאפשר בעתיד הקרוב טיפול אינדיבידואלי ומתאים לפי רמת סיכון התלויה בגורמים פרוגנוסטים ותחלואה נלווית.
Imbruvica (Ibrutinib - איברוטיניב) היא הראשונה מבין התרופות החדשות להיכנס לארסנל הטיפול בלויקמיה לימפוציטית כרונית. Ibrutinib הפכה בחמש שנים מתרופת מחקר לטיפול סטנדרטי בחולים בסיכון גבוה ולחולים עם מחלה חוזרת או עמידה. התרופה מאושרת בארץ לטיפול ב-CLL עבור חולים שמחלתם חזרה (Relapsed) או הייתה עמידה (Refractory) לטיפול קודם. תוצאות הטיפולים החדשים מבשרות כי בשנים הקרובות המחקר הקליני ב-CLL יתמקד בטיפולים ללא כימותרפיה ושילוב תרופות עם מנגנונים סינרגיסטים עם מיעוט תופעות לוואי במטרה לשפר הישרדות ואיכות חיים בדרך לריפוי המחלה.
תהליכים ביולוגים שהביאו לפיתוח תרופות
הבנה טובה יותר של תהליכים בביולוגיה של המחלה הביאה לגילויים ולפיתוח מולקולות ממוקדות מטרה לתהליכים ספציפיים המעורבים בפתגונזה של המחלה. חלק מהמולקולות הגיעו לכדי פיתוח תרופות המיושמות בקליניקה ומתמקדות בעיכוב אנזימים המעבירים אותות מהקולטן לתאי B (BCR, B-cell Receptor). שתי תרופות עם יעדים שונים בעיכוב האותות מהקולטן לתאי B הן Ibrutinib, מעכב של BTK (Bruton Thyrosin Kinase) ו-Zydelig (Idelalisib), מעכב PI3Kδ (Phosphatidylinositol-3-kinaseδ). מנגנון נוסף הוא השראת אפופטוזיס על ידי עיכוב החלבון 2-Bcl עם מולקולה קטנה וסלקטיבית, Venetoclax. היעילות המרשימה ומיעוט תופעות הלוואי של התרופות הללו הביאו לאישורן לשימוש בקליניקה על ידי הרשויות בארצות הברית ובאירופה.
הקולטן לתאי B - מנגנון פעולה
הקולטן לתאי B הוא קומפלקס טרנסממברנלי מורכב הכולל שרשרת אימונוגלובולין. קישור ליגנד לקולטן תאי B גורם להפעלה של מספר תהליכים החיוניים להתפתחות תאי B המשפיעים על פרוליפרציה, התמיינות, הבשלה, אפופטוזיס ונדידה של התאים. הקשר בין הפעלת הקולטן על ידי אנטיגן וקבלת תגובה תוך תאית תלוי במעבר אותות והפעלת קסקדה של חלבונים ומולקולות מתאמות[8],[9]. האנזימים PI3Kδ , SYK (Spleen Tyrosin Kinases) ו-BTK (Bruton's Tyrosin Kinase) חיוניים להעברת האותות ב-BCR ועיכוב שלהם מביא לפגיעה בהבשלה ושגשוג התאים, לאחר מפגש האנטיגן עם תא B המתרחש בעיקר בבלוטות לימפה[10],[11]. ידוע שגורמים בסביבת תא CLL שמקורם בתאי משתית (Stroma) ומונוציטים, בהם "Nurse like cells" חיוניים ומשפיעים על השרדותו דרך אותות המועברים על ידי הקולטן[12],[13]. עד היום פותחו מספר מולקולות קטנות שנמצאו יעילות בעיכוב BTK ,PI3K ,SYK - קינאזות חיוניות למעבר האותות ב-BCR - שהביאו לפגיעה בהפעלתו ופגיעה בפרוליפרציה של תאי המחלה (תרשים 1). בחולים, התגובה שנצפית בטיפול בכל אחת ואחת מהמולקולות הללו (Class effect) היא שיפור בסימפטומים של המחלה והצטמקות מהירה של בלוטות הלימפה בד בבד עם עלייה בספירה האבסולוטית של לימפוציטים בדם פריפרי. העלייה בספירת הלימפוציטים בדם היא זמנית ומתרחשת תוך כדי שיפור במדדים הקליניים של המחלה. לאחר שיא בספירת הלימפוציטים שמופיע תוך שבוע-שבועיים מתהילת הטיפול חלה ירידה הדרגתית שמתחילה לאחר כחודשיים (תרשים 2). אף שהעלייה בספירת הלימפוציטים משתנה בין החולים ויכולה להימשך חודשים רבים, היא אינה מבשרת על כשלון טיפולי. הלימפוציטוזיס נובע מיציאה של לימפוציטים ממדורי מח העצם ובלוטות הלימפה לדם כתוצאה מהשפעה של מעכבי הקינאזות על נדידה ואינטראקציה של תאי CLL וללא גדילה בכמות הלימפוציטים. נמצא שבשלב זה מתרחשת ירידה בפרוליפרציה של הלימפוציטים[14].
עיכוב הקולטן לתאי B על ידי Ibrutinib
Ibrutinib היא מולקולה קטנה הנקשרת בקשר קובלנטי בלתי הפיך לציסטאין (Cys481) שבאתר הפעיל של האנזים BTK, ותוך שעות גורמת לעיכוב מוחלט של פעילותו בריכוזים נמוכים. האנזים הציטופלסמטי BTK הוא Tyrosin kinase, שלוקח חלק חשוב במעבר אותות דרך קולטניי תאי B וגורם להפעלה של מסלול NFkB ,MAP kinase ומסלולים נוספים[11]. מוטציה גנטית ב-BTK מבטלת את פעילותו, חוסמת את הבשלת תאי B בשלב pre-B וגורמת ל-X-linked agammaglobulinemia. המחלה, הנקראת גם Bruton's agammaglobulinemia, גורמת לחסר מוחלט של תאי B בשלים וחסר באימונוגלובולינים ומתבטאת בזיהומים חיידקיים חוזרים[15]. Ibrutinib מעכב BTK ופוגע במעבר האותות ב-BCR לפקטורי שיעתוק בגרעין התא וכתוצאה מכך גורם לפגיעה בשגשוג תאי המחלה.
Ibrutinib ניתנת כטיפול פומי, ויתרון נוסף של החרופה הוא הפרופיל הבטיחותי. בניגוד לכימותרפיה, התרופה אינה גורמת לדיכוי מח העצם ואינה מדכאת יצור אימונוגלובולינים. ציטופניות מדרגה 3-5 קיימות בכ-15% מהחולים לעומת 85% בטיפול כימואימונותרפי סטנדרטי. מרבית תופעות הלוואי שאינן המטולוגיות הן מדרגה 1-2. קיים סיכון מוגבר לאירועי דמם בעיקר קלים המתבטאים כהמטומות או אכימוזות בעור. התרופה אינה ניתנת בשילוב עם אנטיקואגולציה מסוג Coumadin (Warfarin) בשל הסיכון לאירועי דמם קשים. Ibrutinib הוגדרה כתרופה פורצת דרך ועברה אישור על ידי ה-FDA (Food and Drug Administration) בפברואר 2014 לטיפול בלויקמיה לימפוציטית כרונית עמידה או במחלה חוזרת ולאחר מכן גם בטיפול קו ראשון בחולים עם del17p.
מחקרים עם Ibrutinib כטיפול יחיד בלויקמיה לימפוציטית כרונית
במחקרים הראשונים בשלב I נמצאה תפוסה מלאה של Ibrutinib לאתרי הקישור לאנזים כבר במינון 2.5 מ"ג/ק"ג (מיליגרם/קילוגרם) ללא הגעה למינון מירבי נסבל (MTD, Maximal Tolerated Dose). המינון המקובל עם מיעוט תופעות לוואי בלויקמיה לימפוציטית כרונית הוא 420 מ"ג ליום. התקבל שיעור תגובה כוללת (ORR, Overall Response Rate) ב־70% מהחולים ובעוד 20% מהחולים התרחשו תגובה חלקית ולימפוציטוזיס[16]. כבר במחקרים הראשונים ניתן היה לראות שיעילות הטיפול ב-Ibrutinib לא תלויה בגורמים פרוגנוסטים קלינים או ביולוגיים כמו שלב מחלה מתקדם, מספר קווי טיפול קודמים ונוכחות del17p. סיכום של 132 חולים במשך מעקב חציוני של 3 שנים הראה שהתגובה לטיפול ממושכת. רק ב-25 חולים בתקופת המעקב המחלה התקדמה[17]. על בסיס נתונים אלה אושר בפברואר 2014 הטיפול ב-Ibrutinib על ידי ה-FDA לטיפול בחולי לויקמיה לימפוציטית כרונית עם הישנות המחלה. יעילות ובטיחות Ibrutinib נבדקה ונמצאה זהה במחקר פאזה Ib גם כקו טיפול ראשון בחולים מבוגרים (מגיל 65 ומעלה)[18].
ב-2014 התפרסמו תוצאות מחקר אקראי שלב III (RESONATE) שהשווה טיפול ב-Ibrutinib לנוגדן מונוקלונלי ל-CD20 Arzerra (Ofatumumab) ב-391 חולים עם מחלה עמידה או חוזרת[19]. החולים שנכללו לא היו מתאימים לטיפול בכימותרפיה עם אנאלוגים של פורינים (Purine analogues) בשל חזרת מחלתם זמן קצר לאחר כימואימונותרפיה. נכללו גם חולים עם מחלות נלוות, חולים מבוגרים (גיל 70 ויותר) או חולים עם del17p. התגובה הכוללת הייתה טובה יותר משמעותית בקבוצת החולים שטופלו ב-Ibrutinib: 42.6% ועוד 20% עם תגובה חלקית ולימפוציטוזיס לעומת 4.1% בקבוצת Arzerra. לאחר מעקב של 9.4 חודשים החולים שטופלו ב-Ibrutinib לא הגיעו למשך הזמן החציוני ללא מחלה (PFS) לעומת 8.4 חודשים בחולים שטופלו ב-Arzerra. הטיפול ב-Ibrutinib השפיע באופן חיובי גם על הישרדות החולים. אפקט בסדר גודל דומה נצפה גם בתת קבוצת חולים עם del17p וחולים עם מחלה עמידה לאנאלוגים של פורינים[19]. יעילות Ibrutinib בחולים עם del17p נבדקה במחקר פאזה II על 51 חולים עם del17p כקו ראשון או בחזרת מחלה. אחרי שנתיים מעקב נצפתה תגובה ב-97% מהחולים וב-80% מהחולים במחלה עמידה או חוזרת[20]. בעקבות מחקר זה, הרחיב ה-FDA את ההתוויה לטיפול ב-Ibrutinib לחולים עם del17p גם כקו טיפול ראשוני.
טיפול ב-Ibrutinib במִשְׁלבים
במטרה לבטל את הלימפוציטוזיס בעקבות טיפול ב-Ibrutinib, ולשפר עוד יותר את התגובה לטיפול, נבדק Ibrutinib במשלבים. במחקר פאזה II על 40 חולים עם מחלה בסיכון גבוה, החולים טופלו ב-Ibrutinib ונוגדן מונוקלונלי ל-CD20, Rituximab. החולים שהוגדרו בסיכון גבוה כללו del17p/TP53 mutation, התקדמות מחלה תוך פחות מ-36 חודשים לאחר כימואימונותרפיה בקו ראשון או חולים עם del11q שמחלתם נשתנה. שיעור התגובה הכוללת היה 95% עם 8% תגובה מלאה (CR, Complete Response) ו-90% תגובה ב-20 החולים עם del17p/TP53 mutation[21].
השילוב האולטימטיבי של Ibrutinib עם כימואימונותרפיה נבדק תחילה על 33 חולים במחקר פאזה Ib וניתן עם BR או FCR. שיעור התגובה הכוללת של BR-Ibrutinib היה 93.3% עם 16.7% תגובה מלאה שהשתפרה במהלך המעקב ל-40%. לאחר 36 חודשים 70% מהחולים המשיכו טיפול ללא התקדמות המחלה. תופעות הלוואי שנצפו במחקר זה היו דומות לאלו שנצפו בחולים המטופלים ב-Ibrutinib או BR בנפרד. תוצאות מחקר זה הראו ש-Ibrutinib מגבירה יעילות כימואימונותרפיה ללא תוספת רעילות[22].
מחקר HELIOS המתקיים כעת הוא מחקר רב מרכזי אקראי כפול סמיות שלב III בעל פוטנציאל לשינוי היסטורי בטיפול בלויקמיה לימפוציטית כרונית. תוצאות ביניים של מחקר זה פורסמו במפגש החברה האמריקאית לאונקולוגיה (ASCO 2015) והציגו שיפור של 80% במשך התגובה ללא מחלה כאשר Ibrutinib שולב עם כימואימונותרפיה. המחקר כולל 578 חולי CLL/SLL שטופלו ב-BR בשילוב אינבו (289=n) או 420 מ"ג ליום Ibrutinib (289=n). את 6 מחזורי הטיפול המתוכנן עם BR השלימו 83% ו-78% מהחולים בזרוע אינבו וה-Ibrutinib, בהתאמה. בשלב תוצאות הביניים 31% (90=n) מהחולים בקבוצת ה-BR ואינבו התקדמו והועברו לזרוע Ibrutinib. שיעור התגובה הכולל היה 82.7% בזרוע Ibrutinib לעומת 67.8% בקבוצת הביקורת (0.0001=p), עם תגובה מלאה ב-10.4% לעומת 2.8% בקבוצה Ibrutinib ואינבו, בהתאמה. לאחר מעקב חציוני של 17.2 חודשים, בזרוע BR עם Ibrutinib לא הגיע להתקדמות ללא מחלה לעומת 13.3 חודשים בחולים שקיבלו BR בלבד (0.0001>p ,0.150-0.276 CI 95% ,0.203 HR). תועלת זו נצפתה גם בתת קבוצת החולים בסיכון גבוה[23].
דגלים אדומים
ביבליוגרפיה
- ↑ Chiorazzi N, Rai KR, Ferrarini M, Chronic lymphocytic leukemia. N Engl J Med 2005352:804-15.
- ↑ Keating MJ, O'Brien S, Albitar M, etal. Early results of a chemoimmunotherapy reg¬imen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005;23:4079-88.
- ↑ Eichhorst B, Fink AM, Busch R, et al. Frontline Chemoimmunotherapy with Fluda-rabine (F), Cyclophosphamide (C], and Rituximab (R) (FCR) Shows Superior Efficacy in Comparison to Bendamustine (B) and Rituximab (BR) in Previously Untreated and Physically Fit Patients (pts) with Advanced Chronic .2014.
- ↑ Goede V, Fischer K, Engelke A, etal. Obinutuzumabas frontline treatment of chron¬ic lymphocytic leukemia: updated results of the CLL11 study. Leukemia 2015:29:1602¬4.
- ↑ 5.0 5.1 Hillmen P, RobakT,Janssens A, etal. Chlorambucil plus ofatumumab versus chlo-rambucil alone in previously untreated patients with chronic lymphocytic leukae¬mia (COMPLEMENT l):a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385:1873-83.
- ↑ Wierda WG, O'Brien S, Wang X, etal. Multivariate model for time to first treatment in patients with chronic lymphocytic leukemia. J Clin Oncol 2011;29:4088-95.
- ↑ ZenzT, Gribben JG, Hallek M, Dohner H, Keating MJ, Stilgenbauer 5. Risk categories and refractory CLL in the era of chemoimmunotherapy. Blood 2012;119:4101-7.
- ↑ Pleyer L, Egle A, Hartmann TN, Greil R. Molecular and cellular mechanisms of CLL: novel therapeutic approaches. Nat Rev Clin Oncol 2009;6:405-18,
- ↑ Burger JA, Chiorazzi N. B cell receptor signaling in chronic lymphocytic leukemia. Trends Immunol 2013;34:592-601.
- ↑ Herishanu Y, Perez-Galan P, Liu D, et al.The lymph node microenvironment promotes B-cell receptor signaling, NF-kappaB activation, and tumor proliferation in chronic lymphocytic leukemia. Blood 2011;117:563-74.
- ↑ 11.0 11.1 Cheng S, Ma J, Guo A, etal. BTK inhibition targets in vivo CLL proliferation through its effects on B-cell receptor signaling activity. Leukemia 2014;28:649-57.
- ↑ Burger JA. The CLL cell microenvironment. Adv Exp Med Biol 2013;792:25-45.
- ↑ Burger JA, Ghia P, Rosenwald A, Caligaris-Cappio F. The microenvironment in ma¬ture B-cell malignancies: a target for new treatment strategies. Blood 2009:114:3367¬75.
- ↑ Herman SE, Niemann CU, Farooqui M, et al. Ibrutinib-induced lymphocytosis in patients with chronic lymphocytic leukemia: correlative analyses from a phase II study. Leukemia 2014;28:2188-96.
- ↑ Bruton OC. Agammaglobulinemia. Pediatrics 1952;9:722-8.
- ↑ Advani RH, Buggy JJ, Sharman JP, et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/relractory B-cell malig¬nancies. J Clin Oncol 2013;31:88-94.
- ↑ Byrd JC, Furman RR, Coutre SE, et al. Three-year follow-up of treatment-naive and previously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood 2015;125:2497-506.
- ↑ O'Brien S, Furman RR, Coutre SE, etal. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol 204,15:48-58.
- ↑ 19.0 19.1 Byrd JC, Brown JR, O'Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014;371:213-23.
- ↑ Farooqui MZ, Valdez J, Martyr S, etal. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukaemia with TP53 aberrations: a phase 2, single-arm trial. Lancet Oncol 2015:16:169-76.
- ↑ Burger J A, Keating MJ, Wierda WG, et al. Safety and activity of ibrutinib plus ritux-imabfor patients with high-risk chronic lymphocytic leukaemia: a single-arm, phase 2 study. Lancet Oncol 2014;15:1090-9.
- ↑ Brown JR, Barrientos JC, Barr PM, etal. Ibrutinib In Combination With Bendamus-tine and Rituximab Is Active and Tolerable In Patients With Relapsed/Refractory CLL/ SLL: Final Results Of a Phase lb Study2013.
- ↑ Chanan-Khan AAA, Cramer P, Demirkan F, et al. Ibrutinib combined with benda-mustine and rituximab (BR) in previously treated chronic lymphocytic leukemia/small lymphocytic lymphoma (CLL/SLL): First results from a randomized, double-blind, placebo-controlled, phase III study. ASCO Meeting Abstracts 2015;33:LBA7005.
קישורים חיצוניים
- שינוי פרדיגמה בטיפול בלוקמיה לימפטית כרונית, איברוטיניב – מתרופה פורצת דרך לטיפול סטנדרטי TheMEDICAL, עמוד 44
המידע שבדף זה נכתב על ידי ד"ר אוהד בנימיני, רופא בכיר, מכון המטואונקולוגי, המרכז הרפואי ע"ש שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק