הבדלים בין גרסאות בדף "Cardiac myosin binding protein C"
(←ראו גם) |
|||
| (2 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 69: | שורה 69: | ||
==הקשר בין אי-סדירויות במבנה של cMyBP-C לבין FHC{{כ}} (familial hypertrophic cardiomyopathy)== | ==הקשר בין אי-סדירויות במבנה של cMyBP-C לבין FHC{{כ}} (familial hypertrophic cardiomyopathy)== | ||
מוטציות ב-cMyBP-C כרוכות באופן הדוק עם מחלת הלב FHC. בה בשעה שאזורים אחדים של מולקולת cMyBP-C נקשרו לרגולציה של התכווצות השריר, האינטראקציה עם חלקים שונים במיוזין ועם חלבוני הסרקומר, מיוזין ו-titin נותרה בלתי ברורה. בנוסף, זוהתה אינטראקציה בין מקטעים אחדים ב-cMyBP-C עם מולקולות cMyBP-C סמוכות. למרות שפוענח המבנה הבסיסי של cMyBP-C (סדרה של מקטעים של אימונוגלובולין ושל פיברונקטין), אין עדיין תמימות דעים באשר להתכנסות של cMyBP-C בתוך הסקרומר. התגברות העניין המתמקד ב-cMyBP-C נובעת מההכרה שמספר מוטציות בחלבון זה גורמות ל-FHC, שהוא מפגע חמור עיקר בילדים ומבוגרים צעירים. | מוטציות ב-cMyBP-C כרוכות באופן הדוק עם מחלת הלב FHC. בה בשעה שאזורים אחדים של מולקולת cMyBP-C נקשרו לרגולציה של התכווצות השריר, האינטראקציה עם חלקים שונים במיוזין ועם חלבוני הסרקומר, מיוזין ו-titin נותרה בלתי ברורה. בנוסף, זוהתה אינטראקציה בין מקטעים אחדים ב-cMyBP-C עם מולקולות cMyBP-C סמוכות. למרות שפוענח המבנה הבסיסי של cMyBP-C (סדרה של מקטעים של אימונוגלובולין ושל פיברונקטין), אין עדיין תמימות דעים באשר להתכנסות של cMyBP-C בתוך הסקרומר. התגברות העניין המתמקד ב-cMyBP-C נובעת מההכרה שמספר מוטציות בחלבון זה גורמות ל-FHC, שהוא מפגע חמור עיקר בילדים ומבוגרים צעירים. | ||
| + | |||
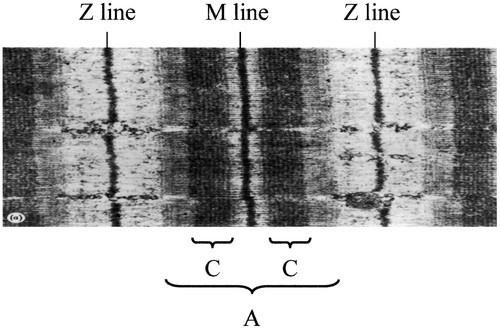
החלבון cMyBP-C הוא פוליפפטיד מודולרי השייך למשפחת-על של אימונוגלובולינים הנמצא בסרקומר בפילמנטים העבים של שריר משורטט. ה-cMyBP-C ממוקם באזור המרכזי של ה-A-band, הידוע כ- C-zone (Craig ו-Offer ב-Proc R Soc London משנת 1976(. בשריר של יונקים, 7-9 מתוך 11 רצועות אלכסוניות סדירות של ה-C-zone מכילים cMyBP-C (Bennet וחב' ב-Cell Motil משנת 1986). המרווח של 43 ננומטר בין רצועות אלו, מכתיב שרק בערך כל שכבה שלישית של קצוות מיוזין ב-C-zone קשורה למולקולות cMyBP-C(Gruen וחב' ב-FEBS lett משנת 1999). | החלבון cMyBP-C הוא פוליפפטיד מודולרי השייך למשפחת-על של אימונוגלובולינים הנמצא בסרקומר בפילמנטים העבים של שריר משורטט. ה-cMyBP-C ממוקם באזור המרכזי של ה-A-band, הידוע כ- C-zone (Craig ו-Offer ב-Proc R Soc London משנת 1976(. בשריר של יונקים, 7-9 מתוך 11 רצועות אלכסוניות סדירות של ה-C-zone מכילים cMyBP-C (Bennet וחב' ב-Cell Motil משנת 1986). המרווח של 43 ננומטר בין רצועות אלו, מכתיב שרק בערך כל שכבה שלישית של קצוות מיוזין ב-C-zone קשורה למולקולות cMyBP-C(Gruen וחב' ב-FEBS lett משנת 1999). | ||
| − | + | ||
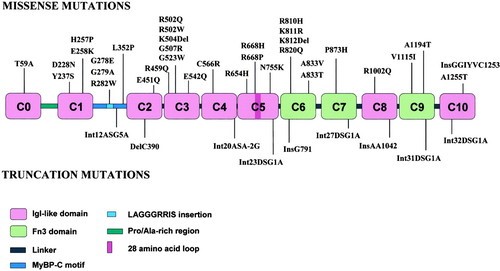
| − | מוטציות missense בחלבון MyBP-C אנושי, הידועות ככאלה הגורמות ל-HCM ומבחר של מוטציות truncation. Ins מצביע על insertion של חומצת אמינו ונוקלאוטיד; del מצביע על שמט ((deletion של נוקלאוטיד. מוטציות splice site מתוארות במושגים של מספר ה-intron (Int), מלווה על ידי אתר ה-donor (DS) או על ידי אתר ה-acceptor (AS), והשינוי בנוקלאוטיד בנוסף למיקומו על רצף הקונצנזוס. | + | [[קובץ:CMyBP-C-3.jpg|ממוזער|מרכז|600 פיקסלים|מוטציות missense בחלבון MyBP-C אנושי, הידועות ככאלה הגורמות ל-HCM ומבחר של מוטציות truncation. Ins מצביע על insertion של חומצת אמינו ונוקלאוטיד; del מצביע על שמט ((deletion של נוקלאוטיד. מוטציות splice site מתוארות במושגים של מספר ה-intron (Int), מלווה על ידי אתר ה-donor (DS) או על ידי אתר ה-acceptor (AS), והשינוי בנוקלאוטיד בנוסף למיקומו על רצף הקונצנזוס.]] |
| + | |||
| + | ==ראו גם== | ||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[בדיקות ביוכימיות|בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| + | * [[תחלואת לב וכלי-דם|בדיקות מעבדה - תחלואת לב וכלי-דם]] | ||
| + | |||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה - בדיקות ביוכימיות]] | ||
| + | [[קטגוריה: בדיקות מעבדה - לב וכלי-דם]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
גרסה אחרונה מ־12:18, 28 ביולי 2018
| מדריך בדיקות מעבדה | |
| Cardiac myosin binding protein C | |
|---|---|
| שמות אחרים | MyBP-C ,cMyC |
| מעבדה | כימיה בדם |
| תחום | סמן של התקפי-לב |
| טווח ערכים תקין | 22.3±2.4 נוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אבחון מוקדם ככל האפשר של התקף לב, באותו פרק זמן קצר לאחר תחילת ההתקף, בו "מדדי הזהב" המקובל כיום בחדרי מיון, טרופונין I או טרופונין T , עלולים להחמיץ אבחון זה בגין תגובתם היחסית מאוחרת.
על התרומה האבחונית של cMyBP-C בתחום התקפי הלב
מחלת-לב היא עדיין הסיבה המובילה למוות, ואכן שיעורי התמותה מסיבות קרדיאליות עלו בארה"ב בין השנים 2014 ל-2015 (על פי Xu וחב' ב-Data Brief משנת 2015). מוות לבבי פתאומי (SCD) מתרחש בשיעורים מוערכים של 76-110.8 מקרים לכל 100,000 איש בשנה (Mozaffarian וחב' ב-Circulation משנת 2016). מחלת עורקים כליליים (CAD), הפרעות קצב ו-dilated cardiomyopathy הם הסיבות העיקריות למוות לבבי פתאומי. בערך 60% מהנפטרים מסיבה זו, לא חוו היסטוריה של מחלת לב כלילית (Ni וחב' ב-Am Heart J משנת 2009). גם שבץ-מוחי שמהווה את הסיבה החמישית במעלה של תמותה, נמצא בקו-עלייה בארה"ב בין השנים 2014-15. לכן, חיוני לאבחן מחלות קרדיו-וסקולאריות חמורות אם כי לא תסמיניות.
בארה"ב יש מדי שנה 130 מיליון פניות לחדרי מיון בבתי חולים בארה"ב, מתוכם 7 מיליון (6%) בגלל כאבים חדים בחזה, הבירור והטיפול של פונים לחדר מיון מקבוצת הנחשדים להתקפי-לב נעשים מורכבים במיוחד שכן כיום רק באחוז קטן מאלה עם AMI מוצאים את השינוי האבחוני ב-א.ק.ג. דהיינו השינוי ברמת מקטע ST (על פי McManus וחב' ב-Am J Med משנת 2011). כתוצאה מכך הזיהוי של התקף-לב הפך להיות תלוי לחלוטין במדידת רמת טרופונין I או טרופונין T. אך שני סמנים אלה מופרשים משריר הלב הפגוע באטיות יחסית (Katus וחב' ב-Circulation משנת 1991). כדי להתגבר על מגבלה זו, פותחו ערכות טרופונין רגישות במיוחד (hs), כדי לאפשר קבלת תוצאה מדויקת ואמינה יותר וטיפול מוחש (Amsterdam וחב' ב-Am J Coll Cardiol משנת 2014, ו-Roffi וחב' ב-Eur Heart J משנת 2016). עם זאת, ברבים מהפונים לדר מיון עם כאבים בחזה, נמדדות רמות טרופונין גבוליות, כאשר בחולים אלה נאלצים לבצע מדידה שנייה או שלישית של טרופונין לאחר פרקי זמן, ולבחון את השינוי ברמת מדד זה בהשוואה למדידה הקודמת (Reichlin וחב' ב-Am Heart J משנת 2013, ו-Boeddinghaus וחב' ב-Clin Chem משנת 2016).
הנחיות אירופיות אינן תומכות בהתייחסות מהירה לתוצאה ראשונה של מדידת hs-troponin, באלה הפונים ליחידה טיפול נמרץ סמוך מדי להופעת הכאבים בחזה, כאשר 3 שעות הוא פרק הזמן המינימלי שצריך לחלוף מאז תחילת כאבים אלה. מגבלת זמן זו עלולה לעכב את מסקנת רופאי היחידה באשר לסיבת הכאבים, וזמן יקר עלול לחלוף עד להתחלת טיפול דחוף ומיטבי.
מבנה החלבון הקושר מיוזין בשריר הלב
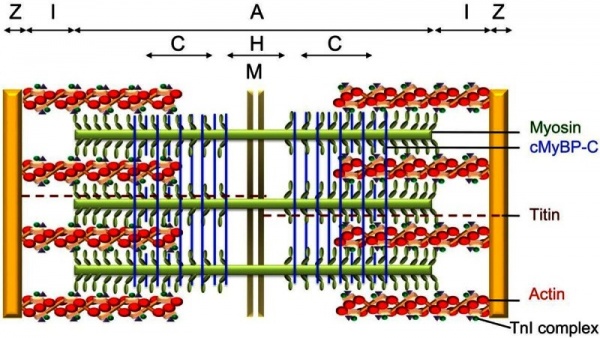
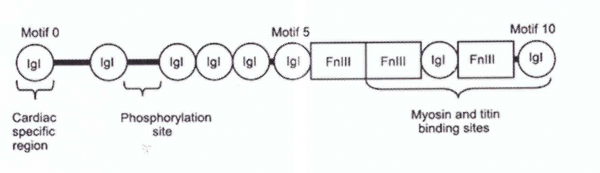
הגן המקודד ל-cMyBP-C ידוע כ-MYBPC3, והוא ממוקם על הזרוע הקצרה של כרומוזום 11 בעמדה 11p11.2 (Gautel וחב' ב-EMBO J משנת 1995). האיזופורם הלבבי זוהה במהלך מחקרים על הפוספורילציה של תמצית שריר הלב (Jeacocke ו-England ב-FEBS let משנת 1980). כאשר הרצף של MyBP-C נקבע באדם, בתרנגולת ובעכבר, נמצא שיש לחלבון האמור משלושת המינים שנחקרו, ארגון דומה של המקטעים (domains), כזה של MyPB-C של 2 האיזופורמים של השלד, אם כי לחלבון הקושר את המיוזין הלבבי יש תכונות אופייניות רק לו: למקטע דמוי-IgI בקצה ה-N-טרמינלי (המכונה C0), יש את רצף חומצות האמינו LAGGGRRIS בתוך ה-MyBP-C motif, וקטע של 28 חומצות אמינו המוחדר (insertion) למקטע C5.
התפקיד של cMyBP-C ברגולציה של התכווצות שריר הלב
cMyBP-C הוא אחד המרכיבים הסרקומריים, ביחד עם phospholamban וטרופונין (I Wolska וחב' ב-Circ Res משנת 2002), שיכולים להיות מזורחנים בתגובה לאגוניסטים β-אדרנרגיים כגון אדרנלין, דרך PKA אוprotein kinase cAMP-dependent (Lim ו-Walsh ב-Arch Biochem Cell Biol משנת 1986, ו-Hartzell ו-Titus ב-J Biol Chem משנת 1982). נמצא ש-cMyBP-C עובר זרחון על ידי קינאזה אנדוגנית התלויה לפעולתה בסידן/calmodulin (Hartzell ו-Glass ב- J Biol Chem משנת 1984, ו-Schlender ו-Bean באותו כתב עת משנת 1990).
Gautel וחב' מצאו ש-PKA יכול לזרחן את cMyBP-C בשיעור של 3 מול' למולקולת חלבון ואילו הקינאזה התלויה בסידן / calmodulin יכולה לזרחן את cMyBP-C בשיעור של 1 מול' למולקולת חלבון. זוהו ארבעה אתרים פוטנציאליים לזרחון, וכולם בתוך ה-motif השמור של cMyBP-C בין 1C ו-C2. אתרים אלה נקראים באדם אתרים A עד D, עם הרצפים הבאים המוּעדים לזרחון: A- או RRTS (חומצות אמינו 273-276), B- אוRRIS (חומצות אמינו 282-285), C או KRDS (חומצות אמינו 301-304), D- או KKST (חומצות אמינו 360-363). מחקרים מוטגניים הראו שלמעשה אתר D אינו מזורחן, כנראה בגלל מגבלות סטריות הנגרמות על ידי מקטע C2.
דה-פוספורילציה של cMyBP-C מתרחשת בתגובה לאגוניסטים כולינרגיים כמו אצטילכולין. מחקרים in vitro בתרנגולת הראו שדה-פוספורילציה מתרחשת בעיקר על ידי האנזים protein phosphatase 2A (Schlender וחב' ב-Biochim Biophys Acta משנת 1987), שהוא אנזים המעורב גם בדה-פוספורילציה של חלבוני סרקומר אחרים (Mumby וחב' ב-J Biol Chem משנת 1987, ו-Chisholm ו-Cohen ב- Biochim Biophys Acta משנת 1988).
הסמן cardiac myosin binding protein-C, הוא חלבון במשקל מולקולרי של 140 אלף דלטון הממוקם על הפילמנט העבה של שריר הלב (Luther וחב' ב-J Mol Biol משנת 2008). כאשר חלבון זה מזורחן, הוא מסייע לפעילות הדיאסטולית (Rosas וחב' ב-Heart Fail משנת 2015), מתווך בקצב ההתכווצות של שריר הלב (inotropy) על פי Tong וחב' ב-Heart Fail משנת 2015, ומגן על הלב בעת איסכמיה (Sadayappan וחב' ב-Proc Natl Acad Sci USA משנת 2006).
התקף-לב ופגיעה איסכמית יגרמו להפרשת cMyBP-C לדם (Govindan וחב' ב-J Mol Cell Cardiol משנת 2012, Kuster וחב' ב-Am J Physiol Heart Circ Physiol משנת 2014, ו- Kaier וחב' ב-Clin Chem משנת 2016). עם זאת, cMyBP-C נמצא בצירקולציה בכל הגילים ללא קשר לפגיעה איסכמית, וההשערה היא שרמות מוגברות של cMyBP-C יכולות לנבא אירועים קרדיו-וסקולאריים עתידיים (Baker וחב' ב-Basic Res Cardiol משנת 2015, ו-El Amrousi וחב' ב-Pediatr Cardiol משנת 2016). כדי לבחון את האפשרות ש- cMyBP-C הוא סמן רגיש של עקה והתרחשות קרדיו-וסקולארית סמויה, גייסו Tong וחב' 75 גברים ו-83 נשים בגיל דומה, למחקר פרוספקטיבי (Am J Cardiol משנת 2017). משתתפי המחקר בדיקות אֶקוֹ לפני ואחרי פעילות גופנית מאומצת, ולפני ואחרי פעילות זו נמדדו אצלם רמות cMyBP-C בנסיוב. משתתפי המחקר היו במעקב משך 1-1.5 שנה.
נמצא שעקת הפעילות הגופנית המאומצת העלתה בנסיוב את רמת החלבון האמור בכל משתתפי הניסוי. פעילות זו גרמה בקרב הנבדקים ל-27 אירועים ראשוניים דוגמת מוות, התקף-לב, הצורך ב-re-vascularization, פרוצדורה קרדיו-וסקולארית חודרנית, או אשפוז כתוצאה מאירוע קרדיו-וסקולארי. כמו כן נגרמו 7 אירועים קריטיים דוגמת מוות, התקף-לב, שבץ-מוחי או תסחיף ריאתי (PE). לאחר התאמה לגיל או לרמת גורמי הסיכון הקרדיו-וסקולאריים ברגרסיית Cox רב-משתנית, נמצא ש-cMyBP-C היה בעל HR של 8.1 לגבי אירוע ראשוני (0.041p<). ששה מתוך 7 משתתפים עם אירועים קרדיו-וסקולאריים, היו בעלי מקטע פליטה (EF) תקין במבחני אקו. רמות cMyBP-C לפני מאמץ הפיקו שטת מתחת עקומת ROC של 0.91, ו-HR של 13.8 (עם משמעות סטטיסטית של 0.000472p<) לאירוע קרדיו-וסקולארי. בנוסך לרגישותו הרבה, cMyBP-C הוא בעל פוטנציאל כסמן לבדיקות סריקה למציאות של מחלה קרדיו-וסקולארית חמורה.
הפוטנציאל של cMyBP-C להיות סמן מוקדם של AMI
- יכולת הניבוי של MyBP-C בהשוואה ל-hs-cardiac troponin I באבחון מוקדם של אוטם חריף של שריר הלב
Kaier ןחב' פרסמו ב-Circulation בשנת 2017 תוצאות מחקרם בנידון, בו הושווה cMyBP-C לטרופונין I רגיש ביותר (hs), ולטרופונין ברגישות סטנדרטית. ההשוואה בוצעה ב-1,954 מטופלים שהוזעקו ליחידת טיפול נמרץ עם תסמינים המחשידים להתקף-לב. תוצאות המחקר הם כדלקמן: ב-340 מתוך המדגם הכולל (17%), אובחן התקף לב. הריכוזים של cMyBP-C היו גבוהים משמעותית באלה עם התקף בהשוואה לאלה ללא התקף (ערך חציוני של 237 ננוגרם/ליטר לעומת 13 ננוגרם/ליטר, בהתאמה, 0.001p<). פוטנציאל ההבדלה לגבי AMI, כפי שנמדד על ידי השטח שמתחת לעקומת ROC (או AUC), היה זהה כמעט בין CMyBP-C שנקבע כ-0.924, לבין hs-TnT עם AUC של 0.927, או hs-cTnI עם AUC של 0.922. שילוב של CMyBP-C עם hs-cTnT או עם s-cTnI הביא בהתאמה להגברת ה-AUC ל-0.931 (עם מובהקות של 0.0001p<), ול-AUC של 0.926 (עם מובהקות של 0.003p<).
באלה שהגיעו לחדר-מיון מוקדם עם חשש להתקף-לב יכולת הקביעה על משמעות התסמינים של cMyBP-C הייתה גבוהה יותר בהשוואה עם hs-cTnT או עם hs-cTnI. בנוסף, cMyBP-C היה עדיף על hs-cTnI ועל s-cTnI (מובהקות של 0.05p<) והוא נמצא דומה בביצועיו ל-hs-cTnT בניבוי מוות תוך 3 שנים. אחת ממסקנות מחקר זה היא שמדידת cMyPB-C יעילה במיון הראשוני בהערכת מצבו של המתאשפז, ומקלה על ההחלטה לשחרורו לביתו.
cMyBP-C התגלה לראשונה על ידי Offer וחב' בשנת 1973 ופורסם ב-J Mol Biol. החלבון מכיל שלושה איזופורמים הספציפיים לשריר שלד אטי, שריר שלד מהיר ולשריר הלב, כאשר האיזופורם האחרון מופיע באופן בלעדי בלב כבר במהלך ההתפתחות העוברית ובאדם הבוגר (Fougerousse וחב' ב-Circ Res משנת 1998). מחקרים רבים זיהו cMyBP-C כסמן מועמד לבטא נזק לבבי ( Kuster וחב' ב- J Vis Exp משנת 2013, Kuster וחב' ב-Am J Physiol Heart Circ Physiol משנת 2014, Lynch ו-Sadayappan ב-Prot Clin Appl משנת 2014, Govindan וחב' ב-Am J Cardivasc Dis משנת 2013 ו-Baker וחב' ב-Basic Res Cardiol בשנת 2015). אמנם cMyBP-C דוגמת cTnT ו-cTnI מבוטא רק בלב, אך הוא מופיע בלב בריכוז גדול יותר (Jacquet וחב' ב-Mol Cell Proteomics משנת 2009). יתרה מכך, הריכוז בדם של cMyBP-C עולה מהר יותר בצירקולציה מאשר hs-Tn לאחר AMI יאטרוגני, ייתכן כתוצאה מריכוזו הגבוה יותר בשריר הלב (Marjot וחב' ב-Clin Chem משנת 2017). תוך שימוש במבחן רגיש ביותר שפותח, נמצא שאמנם חלבון זה שנבדק ב-26 מטופלים שהגיעו ליחידת טיפול נמרץ, מוקדם יחסית, מופיע בדם מוקדם יותר מאשר hs-cTnT (Kaier וחב' ב-Clin Chem משנת 2016).
העובדה שטרופונינים מופרשים לדם באופן איטי יחסית לאחר התקף-לב, ומונעים אבחון מוקדם במיוחד של האירוע, הביאו את Baker וחב' (Basic Res Cardiol משנת 2015) לבחינה מדוקדקת של יתרונות אפשריים של cMyBP-C בהקשר זה. חוקרים אלה השתמשו בנוגדנים חדשניים הספציפיים לקצה ה-N-טרמינלי של cMyBP-C. לצורך קבלת נוגדנים אלה חיסנו עכברי Balb/C עם מקטעי C0C2 של cMyBP-C, או עם ארבעה פפטידים החופפים את הרצף של C0, או עם המקטע הריקומביננטי C5 של cMyBP-C. במכרסמים, הדגימו חוקרים אלה הפרשה מהירה של c-MyBP-C תוך שימוש במודלים in vivo ו-in vitro של אוטפ חריף של שריר הלב. ב-20 מטופלים אנושיים, עם MI מסוג STEMI שעברו תהליך צריבה (ablation) של התעבות המחיצה הבין-חדרית (להלן TASH), ו-20 מטופלים שעברו ניתוח מעקפים של העורקים הכליליים (להלן CABG), נאספו דגימות נסיוב באופן פרוספקטיבי ותכוף.
בהשוואה לנתוני המדידה של cTnT תוך שימוש בערכה המאוד רגישה (hs) של מדד זה, נמצא ש-cMyBP-C מגיעה לשיאו בנסיוב מוקדם יותר (9.3±3.1 שעות מתחילת הכאבים בחזה לעומת 11.8±3.4 שעות, p<0.007) בתרחיש של STEMI, כאשר לאחר TASH גם כן הפרשת cMyBP-C לנסיוב מהירה יותר (9.7±1.4 שעות, לעומת 21.6±1.4 שעות במדידת cTnT, p<0.0001). כמו כן נמצא שרמת ההצטברות של cMyBP-C בנסיוב במהלך 4 השעות הראשונות לאחר TASH גבוהה משמעותית בהשוואה ל-cTnT, (25.8±1.9 ננוגרם/ליטר/שעה, לעומת 4.0±0.4 ננוגרם/ליטר/ שעה, p<0.0001). כמו כן נמצא ש-cMyBP-C נעלם מהר יותר לאחר CABG בהשוואה לטרופונין, כאשר חציון זמן הדעיכה בנסיוב של cMyBP-C נקבע כ-5.5±0.8 שעות, לעומת 22±5 שעות לגבי cTnT, p<0.0001). תוצאות אלו מוכיחות שלאחר פציעה של רקמת הלב, העלייה והנפילה בנסיוב של cMyBP-C מהירות משמעותית בהשוואה לאלו עם cTnT.
הגברה של רמות cMyBP-C בנסיוב הוא סמן רגיש וספציפי של אוטם שריר הלב
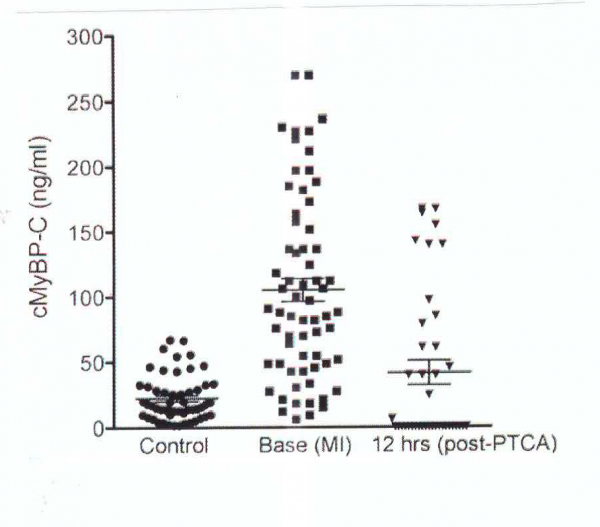
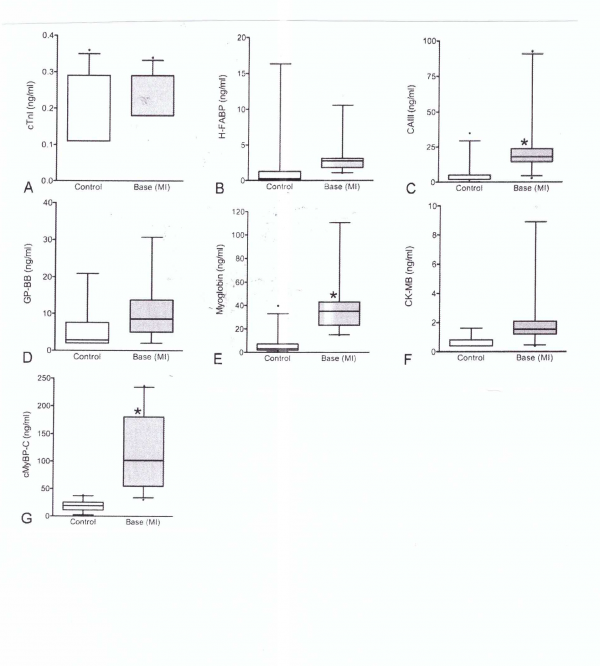
Govindan וחב' בחנו בשיטת ELISA רמות בנסיוב של cMyBP-C ושל עוד 6 סמנים ידועים של MI במטופלים עם MI ובמטופלי ביקורת בריאים (Am J Cardiol משנת 2013). בהשוואה לאנשים בריאים (n=54) בהם רמת cMyBP-C בנסיוב נקבעה כ-22.3±2.4 נוגרם/מ"ל, רמות מדד זה היו מוגברות משמעותית ב-65 נבדקים עם MI שנקבעו כ-105.1±8.8 ננוגרם/מ"ל, p<0.001). מתוך 65 המטופלים, ב-24 נמצאו רמות גבוהות במיוחד של 116.5±13.3 ננוגרם/מ"ל, מה שמצביע על הסתברות גבוהה של התרחשות MI. רמות cMyBP-C היו מופחתות משמעותית ב-40 נבדקים 12 שעות לאחר פרוצדורה של PTCA או Percutaneous Transcoronary Angioplasty, כאשר רמת cMyBP-C הממוצעת פחתה ל-41.2±9.3 ננוגרם/מ"ל, p<0.001) בהשוואה לנבדקים עם MI.
אנליזת ROC מצאה שרמת cMyBP-C בפלזמה של 68.1 ננוגרם/מ"ל סיפקה רגישות של 66.2% וספציפיות של 100%. כמו כן, באותם נבדקים עם רמות מוגברות שלcMyBP-C , נמצאו רמות מוגברות של מדדים נוספים להתקף לב כגון מיוגלובין, CPK-MB ו-carbonic anhydrase III. לעומת זאת, הרמות של cTnI, של glycogen phosphorylase isoform BB ושל heart-type fatty acid binding protein, לא היו מוגברות משמעותית עם הגעתם של אלה עם כאבים בחזה לחדר מיון זמן קצר יחסי לאחר תחילת הכאבים בחזה.
הקשר בין אי-סדירויות במבנה של cMyBP-C לבין FHC (familial hypertrophic cardiomyopathy)
מוטציות ב-cMyBP-C כרוכות באופן הדוק עם מחלת הלב FHC. בה בשעה שאזורים אחדים של מולקולת cMyBP-C נקשרו לרגולציה של התכווצות השריר, האינטראקציה עם חלקים שונים במיוזין ועם חלבוני הסרקומר, מיוזין ו-titin נותרה בלתי ברורה. בנוסף, זוהתה אינטראקציה בין מקטעים אחדים ב-cMyBP-C עם מולקולות cMyBP-C סמוכות. למרות שפוענח המבנה הבסיסי של cMyBP-C (סדרה של מקטעים של אימונוגלובולין ושל פיברונקטין), אין עדיין תמימות דעים באשר להתכנסות של cMyBP-C בתוך הסקרומר. התגברות העניין המתמקד ב-cMyBP-C נובעת מההכרה שמספר מוטציות בחלבון זה גורמות ל-FHC, שהוא מפגע חמור עיקר בילדים ומבוגרים צעירים.
החלבון cMyBP-C הוא פוליפפטיד מודולרי השייך למשפחת-על של אימונוגלובולינים הנמצא בסרקומר בפילמנטים העבים של שריר משורטט. ה-cMyBP-C ממוקם באזור המרכזי של ה-A-band, הידוע כ- C-zone (Craig ו-Offer ב-Proc R Soc London משנת 1976(. בשריר של יונקים, 7-9 מתוך 11 רצועות אלכסוניות סדירות של ה-C-zone מכילים cMyBP-C (Bennet וחב' ב-Cell Motil משנת 1986). המרווח של 43 ננומטר בין רצועות אלו, מכתיב שרק בערך כל שכבה שלישית של קצוות מיוזין ב-C-zone קשורה למולקולות cMyBP-C(Gruen וחב' ב-FEBS lett משנת 1999).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק