הבדלים בין גרסאות בדף "המלצות תזונתיות לתסמונת מעי רגיש - נייר עמדה - Nutritional recommendations for Irritable bowel syndrome"
מ (הפעיל הגנה על הדף "המלצות תזונתיות לתסמונת מעי רגיש - נייר עמדה - Nutritional recommendations for Irritable bowel syndrome" ([עריכה=רק מפעילי מערכת מורשים] (בלתי מוגבלת בזמן) [העברה=רק מפעילי מערכת מורשים] (בלתי מוגבלת בזמן))) |
|||
| (2 גרסאות ביניים של אותו משתמש אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
{{נייר עמדה | {{נייר עמדה | ||
|שם נייר העמדה=המלצות תזונתיות לתסמונת מעי רגיש | |שם נייר העמדה=המלצות תזונתיות לתסמונת מעי רגיש | ||
| שורה 51: | שורה 50: | ||
*שינויים בפלורת (Flora) חיידקי המעי | *שינויים בפלורת (Flora) חיידקי המעי | ||
| − | + | הספרות מייחסת חשיבות לתזונה בתמ"ר שכן רגישות ו/או אי סבילות לרכיבי מזון שונים עשויות יכולים להסביר חלק מהפתוגנזה, ומכאן הצורך בטיפול תזונתי במטופלים הסובלים מהתסמונת{{הערה|שם=הערה1-5| Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783}}{{הערה|שם=הערה1-6|McKenzie YA, Thompson J, Gulia P, Lomer MCE. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):576-592.}}{{הערה|שם=הערה1-7|Spiller R. Impact of diet on symptoms of the irritable bowel syndrome. Nutrients. 2021;13(2):1-19.}}. | |
תמ"ר אינה מלווה בהפרעה הניתנת להדגמה בבדיקה גופנית, כגון בדיקת דם, הדמיה, ביופסיות, בדיקות אנדוסקופיות או פעולות אחרות. הקריטריונים המשמשים לצורך אבחון ההפרעה מכונים קריטריוני רומא (Rome IV){{כ}}{{הערה|שם=הערה1-8|Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology. 2016;150(6):1393-1407.e5.}}. קריטריונים אלו עודכנו בשנת 2016 והם כוללים: כאבי בטן חוזרים מעל יום אחד בשבוע, לפחות ב-3 חודשים האחרונים, ותסמינים שהחלו לפני מעל חצי שנה. כאב הבטן קשור לפחות לשניים מהגורמים האלה: | תמ"ר אינה מלווה בהפרעה הניתנת להדגמה בבדיקה גופנית, כגון בדיקת דם, הדמיה, ביופסיות, בדיקות אנדוסקופיות או פעולות אחרות. הקריטריונים המשמשים לצורך אבחון ההפרעה מכונים קריטריוני רומא (Rome IV){{כ}}{{הערה|שם=הערה1-8|Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology. 2016;150(6):1393-1407.e5.}}. קריטריונים אלו עודכנו בשנת 2016 והם כוללים: כאבי בטן חוזרים מעל יום אחד בשבוע, לפחות ב-3 חודשים האחרונים, ותסמינים שהחלו לפני מעל חצי שנה. כאב הבטן קשור לפחות לשניים מהגורמים האלה: | ||
| שורה 58: | שורה 57: | ||
#שינוי בתדירות היציאות | #שינוי בתדירות היציאות | ||
| − | + | אפשר לסווג את תמ"ר לארבעה תתי סוגים על בסיס מרקם ואופי היציאות: | |
#תמ"ר-D {{כ}}(Diarrhea-predominant) | #תמ"ר-D {{כ}}(Diarrhea-predominant) | ||
#תמ"ר-C{{כ}} (Constipation-predominant) | #תמ"ר-C{{כ}} (Constipation-predominant) | ||
| שורה 64: | שורה 63: | ||
#תמ"ר-U{{כ}} (Unspecified) | #תמ"ר-U{{כ}} (Unspecified) | ||
| − | + | הטיפול בתמ"ר הוא רב תחומי וכולל-{{הערה|שם=הערה1-3}}{{הערה|שם=הערה1-9|Black CJ, Ford AC. Best management of irritable bowel syndrome. Frontline Gastroenterol. 2021;12(4):303-315.}}{{הערה|שם=הערה1-10|Ford AC, Lacy BE, Talley NJ. Irritable bowel syndrome. N Engl J Med. 2017;376(26):2566-2578.}} | |
*רופא גסטרואנטרולוג | *רופא גסטרואנטרולוג | ||
*דיאטנית ייעודית בתחום הגסטרואנטרולוגיה | *דיאטנית ייעודית בתחום הגסטרואנטרולוגיה | ||
| שורה 70: | שורה 69: | ||
*טיפול ב-(CAM) Complementary Alternative Medicine | *טיפול ב-(CAM) Complementary Alternative Medicine | ||
| − | + | הטיפולים התרופתיים מפורטים בטבלה בנספח 1{{כ}}{{הערה|שם=הערה1-10}}. הטיפול התזונתי הוא חלק בלתי נפרד מהטיפול ויכול להיות קו ראשון, בייחוד בגישה של שינוי הרגלי אכילה ואורח חיים{{הערה|שם=הערה1-6}}{{הערה|שם=הערה1-11|Lacy BE, Pimentel M, Brenner DM, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44.}}. | |
לפני תחילת טיפול תזונתי חשוב לוודא כי אין תמרורי אזהרה היכולים לאותת שישנה מחלה המחייבת פנייה לרופא: | לפני תחילת טיפול תזונתי חשוב לוודא כי אין תמרורי אזהרה היכולים לאותת שישנה מחלה המחייבת פנייה לרופא: | ||
| שורה 157: | שורה 156: | ||
#Personalization – שלב ההסתגלות, חזרה לאכילת דיאטה מגוונת עד כמה שניתן, בהתאמה אישית למטופל ובהתאם לסבילותו | #Personalization – שלב ההסתגלות, חזרה לאכילת דיאטה מגוונת עד כמה שניתן, בהתאמה אישית למטופל ובהתאם לסבילותו | ||
| − | + | מרבית המחקרים עוסקים בהתערבות תזונתית של שלב ה-Restriction, נדרשים מחקרים נוספים לביסוס הנחיות לשלב ההסתגלות וההתאמה האישית (Personalization){{כ}}{{הערה|שם=הערה3-9}}. | |
| − | כאמור, מהעדויות 50 אחוזים עד 70 אחוזים מהמטופלים יגיבו לדיאטה דלת FODMAP ויראו שיפור בתסמינים. במחקרים אחדים נעשה ניסיון לבחון את יעילות התגובה של מטופלים לדיאטת FODMAP על ידי בחינת פרופיל המיקרוביום (Microbiome) בדגימות הצואה שלהם ובכך לנבא לאיזה מטופל כדאי להמליץ על דיאטה זו. נושא זה דורש מחקר נוסף שיביא לביסוס העדויות ואת ההמלצות ליישום{{הערה|שם=הערה3-9}}{{הערה|שם=הערה3-10}}. | + | כאמור, מהעדויות 50 אחוזים עד 70 אחוזים מהמטופלים יגיבו לדיאטה דלת FODMAP ויראו שיפור בתסמינים. במחקרים אחדים נעשה ניסיון לבחון את יעילות התגובה של מטופלים לדיאטת FODMAP על ידי בחינת פרופיל המיקרוביום (Microbiome) בדגימות הצואה שלהם ובכך לנבא לאיזה מטופל כדאי להמליץ על דיאטה זו. נושא זה דורש מחקר נוסף שיביא לביסוס העדויות ואת ההמלצות ליישום{{הערה|שם=הערה3-9}}{{הערה|שם=הערה3-10}}. |
[[קובץ:FODMAP1.png|מרכז|600 פיקסלים]] | [[קובץ:FODMAP1.png|מרכז|600 פיקסלים]] | ||
| שורה 352: | שורה 351: | ||
נהוג לחלק את הסיבים לקטגוריות על בסיס תכונותיהם הפיזיקליות, ולסיבים מסיסים ובלתי מסיסים על פי יכולת החזקת המים שלהם{{הערה|שם=הערה5-1}}: | נהוג לחלק את הסיבים לקטגוריות על בסיס תכונותיהם הפיזיקליות, ולסיבים מסיסים ובלתי מסיסים על פי יכולת החזקת המים שלהם{{הערה|שם=הערה5-1}}: | ||
#סיבים מסיסים – בעלי יכולת החזקה של מים, הם מתחלקים לסיבים צמיגיים ולאלו שאינם צמיגיים, ועוברים תסיסה (פרמנטציה, fermentation) על ידי חיידקי המעי | #סיבים מסיסים – בעלי יכולת החזקה של מים, הם מתחלקים לסיבים צמיגיים ולאלו שאינם צמיגיים, ועוברים תסיסה (פרמנטציה, fermentation) על ידי חיידקי המעי | ||
| − | #סיבים בלתי מסיסים – אינם בעלי יכולת החזקה של מים, רובם אינם עוברים תסיסה במעי והם אינם צמיגיים | + | #סיבים בלתי מסיסים – אינם בעלי יכולת החזקה של מים, רובם אינם עוברים תסיסה במעי והם אינם צמיגיים |
| − | סיווג הסיבים על פי מאפיינים פיזיו־כימיים: צמיגות, מסיסות ויכולת התססה. כל התכונות יחד קובעות את התפקוד של כל סיב במערכת העיכול. | + | סיווג הסיבים על פי מאפיינים פיזיו־כימיים: צמיגות, מסיסות ויכולת התססה. כל התכונות יחד קובעות את התפקוד של כל סיב במערכת העיכול. |
[[קובץ:Dietary fibre.png|ממוזער|מרכז|500 פיקסלים|'''איור מתוך המאמר Dietary fiber in gastrointestinal health and disease'''{{כ}}{{הערה|שם=הערה5-1}}.]] | [[קובץ:Dietary fibre.png|ממוזער|מרכז|500 פיקסלים|'''איור מתוך המאמר Dietary fiber in gastrointestinal health and disease'''{{כ}}{{הערה|שם=הערה5-1}}.]] | ||
| − | + | הקשר בין תמ"ר לצריכת סיבים תזונתיים מתבסס על תכונותיהם והשפעתם של אלה על תהליכי העיכול (נפח ומרקם צואה, זמן מעבר מזון במעי ותנועתיות המעי), הרכב המיקרוביום ופעילות מערכת החיסון במערכת העיכול{{הערה|שם=הערה5-2|Vanhauwaert E, Matthys C, Verdonck L, de Preter V. Low-residue and low-fiber diets in gastrointestinal disease management. Adv Nutr. 2015;6(6):820-827. doi:10.3945/AN.115.009688}}. | |
לצריכת סיבים תזונתיים יש השפעה ישירה על הרכב המיקרוביום, שייתכן ומשפיע על תסמיני תמ"ר. צריכת סיבים תזונתיים משפיעה על פעילות מערכת החיסון במעי ב-Peyer's patches וב-Lamina propria, ואלו מופעלים בחשיפה לרכיבי תזונה מסוימים או למיקרוביום. נמצא בעכברים כי תזונה דלה בסיבים תזונתיים מביאה לירידה בכמות תאי חיסון מסוג B ועלייה בתאי חיסון מסוג T{{כ}}{{הערה|שם=הערה5-3|Valdés-Ramos R, Martnez-Carrillo BE, Aranda-González II, et al. Diet, exercise and gut mucosal immunity. Proc Nutr Soc. 2010;69(4):644-650. doi:10.1017/S0029665110002533}}, עלייה בביטוי תאי T ואימונוגלובולינים (Immunoglobulins) לאורך מערכת העיכול{{הערה|שם=הערה5-4|Zhang C, Björkman A, Cai K, et al. Impact of a 3-Months Vegetarian Diet on the Gut Microbiota and Immune Repertoire. Front Immunol. 2018;9(APR). doi:10.3389/FIMMU.2018.00908}} ודיכוי אפופטוזיס במודל של חיות מעבדה{{הערה|שם=הערה5-5| Zimmerman MA, Singh N, Martin PM, et al. Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells. Am J Physiol Gastrointest Liver Physiol. 2012;302(12). doi:10.1152/AJPGI.00543.2011}}. נוסף על כך, מחקרים מראים השפעה של הרכב המזון, ובייחוד הרכב הסיבים במזון, על פעילות תאי מאסט (MAST) במערכת העיכול{{הערה|שם=הערה5-6|Folkerts J, Stadhouders R, Redegeld FA, et al. Effect of Dietary Fiber and Metabolites on Mast Cell Activation and Mast Cell-Associated Diseases. Front Immunol. 2018;9(MAY). doi:10.3389/FIMMU.2018.01067}}. תאי מאסט הם בעלי תפקיד מרכזי באתחול תהליכי דלקת ושימורם, בייחוד על רקע אלרגי. | לצריכת סיבים תזונתיים יש השפעה ישירה על הרכב המיקרוביום, שייתכן ומשפיע על תסמיני תמ"ר. צריכת סיבים תזונתיים משפיעה על פעילות מערכת החיסון במעי ב-Peyer's patches וב-Lamina propria, ואלו מופעלים בחשיפה לרכיבי תזונה מסוימים או למיקרוביום. נמצא בעכברים כי תזונה דלה בסיבים תזונתיים מביאה לירידה בכמות תאי חיסון מסוג B ועלייה בתאי חיסון מסוג T{{כ}}{{הערה|שם=הערה5-3|Valdés-Ramos R, Martnez-Carrillo BE, Aranda-González II, et al. Diet, exercise and gut mucosal immunity. Proc Nutr Soc. 2010;69(4):644-650. doi:10.1017/S0029665110002533}}, עלייה בביטוי תאי T ואימונוגלובולינים (Immunoglobulins) לאורך מערכת העיכול{{הערה|שם=הערה5-4|Zhang C, Björkman A, Cai K, et al. Impact of a 3-Months Vegetarian Diet on the Gut Microbiota and Immune Repertoire. Front Immunol. 2018;9(APR). doi:10.3389/FIMMU.2018.00908}} ודיכוי אפופטוזיס במודל של חיות מעבדה{{הערה|שם=הערה5-5| Zimmerman MA, Singh N, Martin PM, et al. Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells. Am J Physiol Gastrointest Liver Physiol. 2012;302(12). doi:10.1152/AJPGI.00543.2011}}. נוסף על כך, מחקרים מראים השפעה של הרכב המזון, ובייחוד הרכב הסיבים במזון, על פעילות תאי מאסט (MAST) במערכת העיכול{{הערה|שם=הערה5-6|Folkerts J, Stadhouders R, Redegeld FA, et al. Effect of Dietary Fiber and Metabolites on Mast Cell Activation and Mast Cell-Associated Diseases. Front Immunol. 2018;9(MAY). doi:10.3389/FIMMU.2018.01067}}. תאי מאסט הם בעלי תפקיד מרכזי באתחול תהליכי דלקת ושימורם, בייחוד על רקע אלרגי. | ||
| שורה 411: | שורה 410: | ||
אפשר לסכם ולומר שאין הוכחה חד משמעית ליעילות במתן פרוביוטיקה לטיפול בתסמיני תמ"ר אך על סמך הניסיון הקליני אפשר לשקול טיפול בפרוביוטיקה בקרב מטופלי תמ"ר, אך לא כקו טיפול ראשון. | אפשר לסכם ולומר שאין הוכחה חד משמעית ליעילות במתן פרוביוטיקה לטיפול בתסמיני תמ"ר אך על סמך הניסיון הקליני אפשר לשקול טיפול בפרוביוטיקה בקרב מטופלי תמ"ר, אך לא כקו טיפול ראשון. | ||
| − | |||
{| class="wikitable" | {| class="wikitable" | ||
| שורה 436: | שורה 434: | ||
#[[אלפא גלקטוזידאז]] – אפשר לצרוך לשם עיכול רכיבי תא צמחי הקיים, בין היתר, בקטניות. תוסף זה עשוי לעזור למטופלים שמתקשים לאכול ארוחות המכילות כמות גדולה של ירקות וקטניות (כגון: תכשירים בשם Beano, זים גז){{הערה|שם=הערה7-15|Tuck CJ, Taylor KM, Gibson PR, Barrett JS, Muir JG. Increasing Symptoms in Irritable Bowel Symptoms With Ingestion of Galacto-Oligosaccharides Are Mitigated by α-Galactosidase Treatment. Am J Gastroenterol. 2018;113(1):124-134. doi:10.1038/AJG.2017.245}} | #[[אלפא גלקטוזידאז]] – אפשר לצרוך לשם עיכול רכיבי תא צמחי הקיים, בין היתר, בקטניות. תוסף זה עשוי לעזור למטופלים שמתקשים לאכול ארוחות המכילות כמות גדולה של ירקות וקטניות (כגון: תכשירים בשם Beano, זים גז){{הערה|שם=הערה7-15|Tuck CJ, Taylor KM, Gibson PR, Barrett JS, Muir JG. Increasing Symptoms in Irritable Bowel Symptoms With Ingestion of Galacto-Oligosaccharides Are Mitigated by α-Galactosidase Treatment. Am J Gastroenterol. 2018;113(1):124-134. doi:10.1038/AJG.2017.245}} | ||
| − | + | '''לסיכום''', לא ניתן להסיק שתוספת אנזימי עיכול פנקראטיים יעילה בטיפול בתסמיני תמ"ר. עם זאת, אם אנמנזה ומידע רפואי מעלים חשד לקשיים בעיכול עם תסמינים אפיגסטריים/שלשול כרוני אפשר לשקול בירור נוסף וניסיון לתיסוף פומי{{הערה|שם=הערה7-16|Moayyedi P, Andrews CN, MacQueen G, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29. doi:10.1093/JCAG/GWY071}}{{הערה|שם=הערה7-17|Gwee KA, Gonlachanvit S, Ghoshal UC, et al. Second Asian Consensus on Irritable Bowel Syndrome. J Neurogastroenterol Motil. 2019;25(3):343-362. doi:10.5056/JNM19041}}{{הערה|שם=הערה7-18|Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783.}}. | |
{| class="wikitable" | {| class="wikitable" | ||
| שורה 475: | שורה 473: | ||
==נספח 1: טיפולים תרופתיים לתסמונת המעי הרגיש== | ==נספח 1: טיפולים תרופתיים לתסמונת המעי הרגיש== | ||
| − | מתוך תקציר נייר עמדה לטיפול בתסמונת המעי הרגיש, מאת החוג הישראלי לנוירוגסטרואנטרולוגיה ולתנועתיות מערכת העיכול, באדיבות פרופ׳ רם דיקמן | + | מתוך תקציר נייר עמדה לטיפול בתסמונת המעי הרגיש, מאת החוג הישראלי לנוירוגסטרואנטרולוגיה ולתנועתיות מערכת העיכול, באדיבות פרופ׳ רם דיקמן |
[[קובץ:תמר-טבלה-1.PNG|מרכז|600 פיקסלים]] | [[קובץ:תמר-טבלה-1.PNG|מרכז|600 פיקסלים]] | ||
גרסה אחרונה מ־09:53, 22 בינואר 2023
|
| |
|---|---|
| המלצות תזונתיות לתסמונת מעי רגיש | |
| תחום | תזונה |
| 250px | |
Drawing of the pain of IBS
| |
| האיגוד המפרסם | עמותת עתיד – עמותת הדיאטנים והתזונאים של ישראל
בהובלת פורום גסטרואנטרולוגיה של עמותת עתיד |
| קישור | באתר עמותת עתיד |
| תאריך פרסום | דצמבר 2022 |
| יוצר הערך | רוני ברוך, תמר פפר גיק ושאר צוות כתיבת נייר העמדה |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תסמונת המעי הרגיז
שיטת ציון ההמלצה
על מנת להדגיש את חוזקה של כל המלצה ועד כמה היא מבוססת על עובדות מחקריות, השתמשנו בהגדרות הבאות המבוססות על השיטה הנהוגה במסמכי הנחיות של גופים בינלאומיים מוכרים[1]:
| חוזק ההמלצה | הגדרה | המלצה לאופן ניסוח |
|---|---|---|
| דרגה I | קיימת הוכחה ו/או הסכמה כללית שהטיפול יעיל ומומלץ | מומלץ |
| דרגה II | נתונים סותרים ו/או דעות שונות לגבי יעילות הטיפול | |
| IIa | רוב הדעות/הוכחות נוטות לתמוך בטיפול | רצוי לשקול |
| IIb | יעילות הטיפול פחות מבוססת במחקרים ו/או דעת מומחים | ניתן לשקול |
| דרגה III | קיימות הוכחות ו/או הסכמה כללית שהטיפול אינו יעיל | לא מומלץ |
| דרגה A | המידע מבוסס על מחקרים התערבותיים מבוקרים מרובים ו/או מטה-אנליזות (Meta-analysis) של מחקרי התערבות |
| דרגה B | המידע מבוסס על מחקרי עוקבה תצפיתיים גדולים ו/או על מיעוט מחקרי התערבות מבוקרים |
| דרגה C | קיימת תמימות דעים של מומחים ו/או מחקרים קטנים, מחקרי תצפית |
פרק 1 - מבוא
תסמונת מעי רגיש (להלן תמ"ר) או Irritable Bowel Syndrome (IBS), היא הפרעה תפקודית כרונית במערכת העיכול. שכיחותה במדינות המערב עומדת על כ-4 אחוזים. בהשוואה בין נשים לגברים, נמצא כי שכיחות הדיווח על תסמיני תמ"ר גבוהה פי 1.5 עד 3 בנשים יותר מאשר בגברים. תמ"ר מופיעה בכל קבוצות הגיל, כולל ילדים וקשישים. עם זאת, כ-50 אחוז מהמטופלים מדווחים שהתסמינים החלו להופיע לפני גיל 35. פחות ממחצית מהמטופלים הסובלים מתמ"ר פונים לייעוץ רפואי, אך התסמונת עדיין אחראית לכ-12 אחוזים מכלל הביקורים אצל רופאי משפחה ולכ-28 אחוזים מהביקורים אצל גסטרואנטרולוג[2]. בישראל, שכיחות תמ"ר עומדת על כ-3 אחוזים[3]. בשל השוני בין קריטריוני Rome IV ל-Rome III, נוצר פער בנתונים שפורסמו, תוך ירידה בשיעור המטופלים שעונים על הקריטריונים[4].
על פי הקריטריונים, תמ"ר מתאפיינת בכאבי בטן חוזרים הקשורים לתהליך ההתרוקנות, למרקם היציאות ומספרן. לרוב יתווספו גם נפיחות ותפיחות ופגיעה קשה באיכות החיים. רוב המטופלים משייכים את התסמינים שבגינם הם סובלים למזון שהם צורכים, ומדווחים שהדיאטה היא הגורם העיקרי המשפיע על איכות חייהם ועל התסמינים שהם חווים. למזון יש תפקיד חשוב בהשפעה על תמ"ר ונמצא שיותר מ-60 אחוזים מהמטופלים מדווחים על החמרה בתסמינים אחרי ארוחות. בקרב כ-28 אחוזים מהמטופלים, ההחמרה מורגשת במהלך 15 דקות מסיום הארוחה ואצל כ-93 אחוזים מהמטופלים ההחמרה מורגשת במהלך כ-3 שעות מסיום הארוחה[5]. לכן רבים נמנעים ממגוון מזונות, מצב שמביא לירידה באיכות החיים, סכנה לחוסרים תזונתיים והתנהגות אכילה לקויה.
ישנם גורמים אחדים המעורבים בפתוגנזה של תמ"ר:
- הפרעה בציר מוח־מעי
- הפרעה בתנועתיות המעי
- דלקת תת-קלינית של רירית המעי ועלייה בחדירות המעי
- שינויים בפלורת (Flora) חיידקי המעי
הספרות מייחסת חשיבות לתזונה בתמ"ר שכן רגישות ו/או אי סבילות לרכיבי מזון שונים עשויות יכולים להסביר חלק מהפתוגנזה, ומכאן הצורך בטיפול תזונתי במטופלים הסובלים מהתסמונת[6][7][8].
תמ"ר אינה מלווה בהפרעה הניתנת להדגמה בבדיקה גופנית, כגון בדיקת דם, הדמיה, ביופסיות, בדיקות אנדוסקופיות או פעולות אחרות. הקריטריונים המשמשים לצורך אבחון ההפרעה מכונים קריטריוני רומא (Rome IV)[9]. קריטריונים אלו עודכנו בשנת 2016 והם כוללים: כאבי בטן חוזרים מעל יום אחד בשבוע, לפחות ב-3 חודשים האחרונים, ותסמינים שהחלו לפני מעל חצי שנה. כאב הבטן קשור לפחות לשניים מהגורמים האלה:
- תהליך ההתרוקנות
- שינוי במרקם היציאות
- שינוי בתדירות היציאות
אפשר לסווג את תמ"ר לארבעה תתי סוגים על בסיס מרקם ואופי היציאות:
- תמ"ר-D (Diarrhea-predominant)
- תמ"ר-C (Constipation-predominant)
- תמ"ר-M (Diarrhea and Constipation)
- תמ"ר-U (Unspecified)
הטיפול בתמ"ר הוא רב תחומי וכולל-[4][10][11]
- רופא גסטרואנטרולוג
- דיאטנית ייעודית בתחום הגסטרואנטרולוגיה
- טיפול קוגניטיבי התנהגותי על ידי פסיכותרפיסט ייעודי
- טיפול ב-(CAM) Complementary Alternative Medicine
הטיפולים התרופתיים מפורטים בטבלה בנספח 1[11]. הטיפול התזונתי הוא חלק בלתי נפרד מהטיפול ויכול להיות קו ראשון, בייחוד בגישה של שינוי הרגלי אכילה ואורח חיים[7][12].
לפני תחילת טיפול תזונתי חשוב לוודא כי אין תמרורי אזהרה היכולים לאותת שישנה מחלה המחייבת פנייה לרופא:
- גיל המטופל מעל 50 וללא בדיקת סקר לסרטן מעי גס
- שינוי חדש בהרגלי היציאות
- עדות לדימום ממערכת העיכול
- כאבי בטן ויציאות ליליות
- ירידה לא רצונית במשקל
- היסטוריה משפחתית של סרטן מעי גס או מחלות מעי דלקתיות
- אנמיה מחסר בברזל
- בדיקה חיובית לדם סמוי בצואה
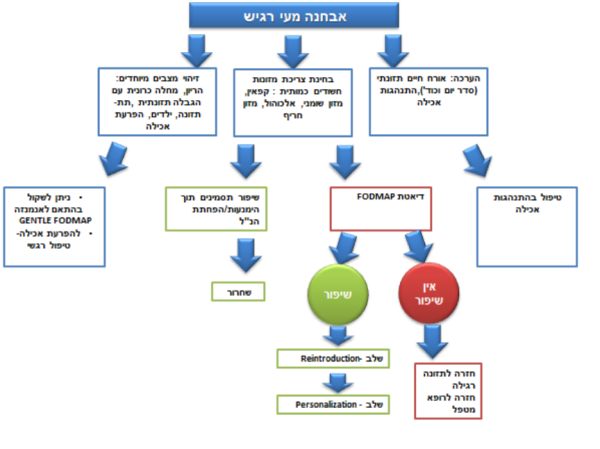
פרק 2 - הערכה תזונתית במטופלים הסובלים מתסמונת מעי רגיש
השלב הראשון בכל טיפול תזונתי הוא ביצוע הערכה תזונתית. במטופל הסובל מתמ"ר ישנה חשיבות גדולה לביצוע הערכה זאת מאחר שחשוב לשלול תחלואה נלווית ולקבל היסטוריה מפורטת: רפואית, תזונתית והתנהגותית, על מנת לגבש תוכנית טיפול מתאימה[13].
אבחנה:
- רצוי שרופא מומחה בגסטרואנטרולוגיה יאבחן תמ"ר
- חשוב לוודא שנשללה תחלואה עם תסמינים דומים[14], כגון מחלת מעי דלקתית, צליאק, ממאירות של מערכת העיכול ואנדומטריוזיס בנשים
- יש לוודא שאין כל הפרעה אחרת בציר מוח־מעי, לרבות דיספפסיה תפקודית, כאב בטן כרוני, עצירות תפקודית
- יש לבצע תשאול מלא לגבי תסמיני מערכת העיכול ולתעדם על מנת לקבל אומדן מדיד גם בהמשך. מומלץ לתעד מספר יציאות, מרקם על פי סקאלת Bristol Stool Scale, תדירות כאבי בטן, עוצמת כאבי הבטן
אנתרופומטריה (Anthropometry): היסטוריה של משקל ושינויים במשקל בתקופה האחרונה יכולים לתת הערכה עקיפה לחומרת התסמינים, היסטוריה זו של המטופל משמשת למעקב תזונתי.
היסטוריה רפואית:
- מחלות רקע נוספות, ניתוחים במערכת העיכול, ניתוחים גניקולוגיים בנשים, הפרעות אכילה
- טיפול תרופתי מכוון לתמ"ר – ניסיונות עם קווי טיפול שונים ומה הייתה התגובה
- נטילת תוספי תזונה (ויטמינים, מינרלים, סיבים תזונתיים, פרוביוטיקה וכדומה)
- טיפולים לא־תרופתיים לתמ"ר – היפנוזה רפואית, טיפול קוגניטיבי התנהגותי (Cognitive Behavioral Therapy ,CBT)
אורחות חיים:
- היכרות עם סדר יומו ואורח חייו התזונתי של המטופל
- תעסוקה: מקצוע, היקף שעות העבודה
- שינה: זמני ערות ושינה (יש משמעות לעבודה במשמרות)
- מצב משפחתי
התנהגות אכילה:
- מה הם דפוסי האכילה של המטופל: שעות אכילה וסדר יום תזונתי
- בישול ביתי או מזון קנוי
- אכילה בהיסח דעת (לדוגמה: מול מסכים)
פעילות גופנית – סוג הפעילות והתדירות שבה מתבצעת
מתח ואירועי קיצון רגשיים – לברר אם יש או היו אירועים המתאפיינים בדחק רב
הערכת אכילה[15]:
- על מנת לקבל תמונה רחבה ככל האפשר מומלץ להיעזר ביומן אכילה של שלושה ימים. אם אי אפשר, מומלץ להשתמש ב-24 hour recall
- שאלון תדירות אכילת מזונות Food Frequency Questionnaire (FFQ) – יכול לתת תמונה מקיפה יותר של דפוס האכילה (קיים FFQ ייעודי לאיתור מזונות המכילים Fermentable Oligo di Monosaccharides and Polyols (FODMAP), אך הוא לא עבר תיקוף לעברית ולשימוש באוכלוסייה בישראל, ולכן בשלב זה איננו מומלץ לשימוש במסגרת טיפול במרפאה)
- באנמנזה עצמה יש לשאוף להעריך אם הצריכה התזונתית מאופיינת במזונות עתירים ב-FODMAP, אם יש שימוש בממתיקים מלאכותיים ואם יש הימנעות מקבוצות מזון (כגון קטניות, חלב, חיטה)
- שתייה – מה היא מידת השתייה ואיכותה: מים או שתייה ממותקת, חליטות תה שונות, קפה ותחליפיו, אלכוהול, שתייה מוגזת. יש לברר אם המטופל שותה במהלך הארוחה
- היסטוריה תזונתית – לבדוק אם נעשו ניסיונות להתערבות תזונתית בעזרת גורם מלווה או עצמאי, ואם זו הייתה חוויית הצלחה או כישלון
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| מומלצת אבחנה מבוססת מגסטרואנטרולוג.ית של תסמונת מעי רגיש | I | C |
| מומלץ לבצע תיעוד של התסמינים הגסטרואינטסטינאליים | I | C |
| מומלץ להיעזר ביומן אכילה על מנת ללמוד על דפוסי התנהגות והרגלי אכילה | I | C |
פרק 3 - התערבויות תזונתיות לטיפול בתסמונת מעי רגיש
רבים מהמטופלים הסובלים מתמ"ר מדווחים על קשר בין אכילה לתסמינים ואכן נצבר ידע רב המבסס שימוש בהתערבויות תזונתיות בטיפול בתמ"ר.
דיאטה דלה ב-FODMAP
דיאטה זו מבוססת על הימנעות/הפחתה במזונות העשירים ברכיבים מקבוצת הפחמימות אשר אינם מפורקים ונספגים ביעילות במעי הדק, או הפחתה שלהם. רכיבי מזון אלו מפורקים על ידי מיקרואורגניזמים (Microorganisms) במעי וגורמים להחמרה בתסמינים שעשויים להתרחש באמצעות עלייה באוסמולריות (osmolarity) שבחלל המעי הדק, המובילה לעלייה בתכולת המים במעי הגס וייצור עודף של גזים המלווים בשלשולים, כאב, נפיחות ותחושת לחץ[16][17].
מחקר פורץ דרך בנושא כלל מטופלים הסובלים מתמ"ר שקיבלו תחילה דיאטה אוסטרלית סטנדרטית ובהמשך דיאטה דלה ב-FODMAP (cross over). כל דיאטה ניתנה לתקופה של שלושה שבועות ובין הדיאטות בוצעה תקופת Wash out של שלושה שבועות. 70 אחוזים מהמשתתפים דיווחו על שיפור משמעותי בתסמינים רק תחת דיאטה דלה ב-FODMAP[18]. מחקרים רבים בחנו דיאטה זו ובמטא־אנליזות שפורסמו ב-2017 וב-2021 נמצא כי דיאטה דלת FODMAP הביאה לשיפור בתסמיני מערכת העיכול. במטא־אנליזה מ-2021 נמצא שיפור גם באיכות חייהם של המשתתפים[19][20][21], ובמטא־אנליזה נוספת נמצא כי דיאטה דלה ב-FODMAP עולה ביעילותה על פני התערבויות תזונתיות אחרות[22].
בסקירה שפרסמו דיאטניות האיגוד הבריטי לתזונה (British Dietetic Association ,BDA) בשנת 2016, צוין כי דיאטה דלת FODMAP למשך 3–6 שבועות משפרת תסמיני IBS-D ו-IBS-M אך לא יעילה ב-IBS-C[23].
לאור הממצאים לעיל ניתן להתרשם כי דיאטה דלה ב-FODMAP יעילה בטיפול בתמ"ר ומומלצת למטופלים הסובלים מ-IBS-D ו-IBS-M לטווח הקצר.
כאמור, קיימות גם עדויות ליעילות בטווח הרחוק אך נדרשים מחקרים נוספים להוכחת יעילותה ובטיחותה בשימוש לאורך זמן. הדיאטה במהותה מגבילה צריכה של קבוצות מזון ותיתכן השפעה על הסטטוס התזונתי של המטופל. זאת ועוד, לדיאטה זו יש השלכות על הרכב המיקרוביום של המעי, ובמחקרים שונים נצפתה ירידה בזנים נוגדי דלקת, כגון Bifidobacterium, Faecalibacterium prausnitzii[24].
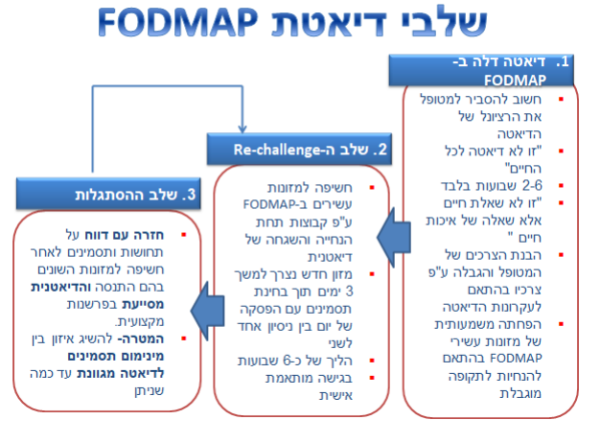
לדיאטה דלה ב-FODMAP כמה שלבים עיקריים[25]:
- Restriction – מומלצת הימנעות ממזונות עשירים ב-FODMAP למשך תקופה של 2–6 שבועות
- Re-Challenge – החזרה הדרגתית של מזונות עשירים ב-FODMAP, בהתאמה אישית למטופל ובהתאם לסבילותו
- Personalization – שלב ההסתגלות, חזרה לאכילת דיאטה מגוונת עד כמה שניתן, בהתאמה אישית למטופל ובהתאם לסבילותו
מרבית המחקרים עוסקים בהתערבות תזונתית של שלב ה-Restriction, נדרשים מחקרים נוספים לביסוס הנחיות לשלב ההסתגלות וההתאמה האישית (Personalization)[22].
כאמור, מהעדויות 50 אחוזים עד 70 אחוזים מהמטופלים יגיבו לדיאטה דלת FODMAP ויראו שיפור בתסמינים. במחקרים אחדים נעשה ניסיון לבחון את יעילות התגובה של מטופלים לדיאטת FODMAP על ידי בחינת פרופיל המיקרוביום (Microbiome) בדגימות הצואה שלהם ובכך לנבא לאיזה מטופל כדאי להמליץ על דיאטה זו. נושא זה דורש מחקר נוסף שיביא לביסוס העדויות ואת ההמלצות ליישום[22][25].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| מומלצת דיאטה דלת FODMAP למשך 6–8 שבועות להפחתת התסמינים ב-IBS-D | I | A |
| ניתן לשקול דיאטה דלת FODMAP ב-IBS-M | IIb | B |
| רצוי לשקול החזרת מזונות עשירים ב-FODMAP בהתאם לסבילות המטופל, ובהתאמה אישית על מנת לשמר את השיפור בתסמינים | IIa | C |
וריאציות לדיאטה דלה ב-FODMAP:
לאחר ביסוס יעילותה של דיאטה דלה ב-FODMAP עלה הצורך להגמיש אותה. 2 קבוצות הציגו גישות אלו[26][27]:
- Top Up לעומת Top Down:
- בסקירה שפרסמו ב-2019 קבוצת חוקרים קנדיים, הומלץ להתייחס לדיאטה בשני אופנים[26]:
- Top Up – הגבלה תזונתית "רופפת" הכוללת מעקב אחר תסמיני המטופל ועלייה במגבלות התזונתיות עד הגעה, במידת הצורך, לדיאטה דלה ב-FODMAP קלאסית
- Top Down – תחילת ההתערבות באמצעות דיאטת FODMAP קלאסית והחזרת מזונות בהדרגה בהתאם לתסמיני המטופל (כמתואר בתחילת הפרק)
- Gentle FODMAP:
- דיאטת FODMAP היא דיאטה מגבילה ומאחר וישנן אוכלוסיות בעלות צרכים ייחודים כגון: נשים הרות, ילדים, מטופלים עם הפרעות אכילה או רקע רפואי מגביל תזונתית, עלה הצורך בגישה מגבילה פחות. הקבוצה האוסטרלית שפיתחה את הדיאטה[27] מציעה להימנע מהמזונות המפורטים להלן או להגבילם (בהתאמה אישית למטופל)[27]:
- דגנים: חיטה ושיפון
- ירקות: בצל, שומר, כרוביים ופטריות
- פירות: תפוח, אגס, פירות יבשים, אבטיח, נקטרינה ואפרסק
- מוצרי חלב: מוצרי חלב ניגר עתירי לקטוז
- קטניות
מצבים שבהם מוצע להשתמש בגישה של Gentle FODMAP הם: תת-תזונה, בעיה רפואית המחייבת מגבלה תזונתית כמו מחלות מעי דלקתיות, תקופות חיים שבהן ייתכנו שינויים תזונתיים כגון: ילדות, היריון, הגיל השלישי, וכאשר המטופל מגלה קושי בביצוע שינוי תזונתי. כשמאובחנת הפרעת אכילה – לא מומלץ טיפול תזונתי שכרוך בהימנעות והגבלה מכל סוג שהוא.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול לתת דיאטת Gentle FODMAP במצבים אלה: תת-תזונה, תחלואה נלווית שעלולה להשפיע כגון: מחלות מעי דלקתיות ומחלה ממארת, ילדים, נשים בהיריון, אנשים בגיל השלישי, מוטיבציה טיפולית נמוכה או אי הבנת הטיפול התזונתי | IIb | C |
| לא מומלצת דיאטה דלה ב-FODMAP או Gentle FODMAP במצבים של הפרעות אכילה | III | C |
תזונה ים תיכונית בטיפול בתסמונת מעי רגיש
תזונה ים תיכונית היא תזונה עשירה בפירות, ירקות, דגנים מלאים, קטניות, דגים, אגוזים ושמן זית. היא הוכחה כבעלת יתרונות בריאותיים רבים ומסייעת בטיפול במרבית המחלות הכרוניות ביניהן: השמנה, מחלות לב, סוכרת ומחלות נוירודגנרטיביות (Neurodegenerative), וכן נמצאת בקשר עם הפחתת הסיכון לתמותה ולתחלואה נלווית ממחלות ממאירות[28].
דפוס תזונה זה ורכיביו קשור בהרכב מיטיב של המיקרוביום האנושי ומתבטא בעלייה בעושר ובמגוון החיידקים[29] ובשכיחות גבוהה יותר של חיידקים המייצרים חומצות שומן קצרות שרשרת[30][31]. לצד זה, דיאטה דלה ב-FODMAP כרוכה בשינוי הרכב המיקרוביום וגורמת לירידה בשכיחות החיידקים המייצרים חומצות שומן קצרות שרשרת, תוצר המסייע במניעת תהליכים מעוררי דלקת[30]. לכן אנו ממליצות שבנוכחות תפיחות, ריבוי גזים ויציאות מרובות יש להיוועץ עם דיאטנית ייעודית ולהפחית חלק מהמזונות הנכללים ומומלצים בתזונה ים תיכונית. לאחר שיפור בתסמינים, היעד הוא לחזור ולצרוך בהדרגתיות את מגוון המזונות המומלצים בתזונה זו על פי סבילות אישית.
על פי הספרות הרפואית, אין עדות ליעילות תזונה ים תיכונית בטיפול בתמ"ר, ובמחקרים תצפיתיים אחדים אף נמצא קשר בין תזונה זאת לנוכחות תמ"ר. כמו כן, במחקרי מקרה־ביקורת ובמחקרי חתך נמצאה היענות נמוכה לדפוס תזונה ים תיכונית בגילאים הצעירים, ייתכן בשל החמרה בתסמיני מערכת העיכול הנגרמים מרכיבי תזונה זו[32][33][34].
לסיכום, לאור יתרונותיה הרבים של תזונה ים תיכונית יש לשקול להמליץ למטופלים הסובלים מתמ"ר לשלב עקרונות של תזונה זו כגון: צריכה מועדפת של שמן זית, דגים, ירקות ופירות דלים ב-FODMAP, יוגורט דל/נטול לקטוז ודגנים מלאים המתאימים לדיאטה זו. על מנת לבסס המלצות חד משמעיות בנושא, נדרשים מחקרי התערבות איכותיים המעריכים את השפעת התזונה הים תיכונית על תסמיני מערכת העיכול לאורך זמן.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול דפוס תזונה ים תיכונית כמודל לתזונה בריאה במטופלים הסובלים מתסמונת מעי רגיש כתלות בסבילות ובתסמיני המטופל | IIb | C |
מזון מעובד ומזון אולטרה-מעובד
מזון מעובד ואולטרה־מעובד (ultra processed) מוגדר כמזון המכיל רכיבים שאינם ייעודיים לצורך קולינארי וכולל חומרים מוספים, כגון חומרי צבע, טעם, ממתיקים, מתחלבים, מייצבים וחומרים משמרים. נכללים בו: שתייה מתוקה, ממתקים וחטיפים מלוחים, סוגי מזון קפוא, בשר מעובד, סוגי מאפים קנויים, ממרחים ורטבים מוכנים. מזון מעובד ואולטרה-מעובד עשיר בשומן, סוכר ומלח, דחוס קלורית ודל בסיבים תזונתיים, חלבון, ומיקרונוטריאנטים (micronutrients) חיוניים אחרים[31].
שני מחקרים ניתחו את נתוני מחקר העוקבה הצרפתי NutriNet-Santé. באנליזה הראשונה, 5.5 אחוזים מתוך 44,350 מהמשתתפים אובחנו עם תמ"ר. נמצא כי קיים סיכון גבוה יותר לפתח תמ"ר בקרב משתתפים מהחמישון העליון של צריכת מזון מערבי לעומת החמישון התחתון של אלו הצורכים דפוס תזונה מערבי. תזונה מערבית הוגדרה במחקר זה כתזונה העשירה בבשר מעובד, עוגות, ממתקים וחטיפים מלוחים[32]. באנליזה השנייה על נתוני מחקר העוקבה הצרפתי NutriNet-Santé השתמשו בסיווג מזון אולטרה־מעובד על פי NOVA ונמצאה תמ"ר בקרב 10.5 אחוז מתוך 33,343 משתתפים. בהשוואה בין הרבעון העליון לרבעון התחתון של צריכת מזון אולטרה־מעובד, נמצאה מגמת עלייה בשכיחות תמ"ר עם העלייה בצריכת מזון אולטרה־מעובד[33][35][36][37].
קיימות עדויות ברורות לקשר בין מצבי דיסביוזיס (Dysbiosis) לצריכת מזון אולטרה־מעובד ותוספי מזון המאפיינים אותו כגון: עלייה בחדירות המעי ופעילות חיסונית מקומית גבוהה אשר מעודדים דלקת ברקמת האפיתל. תהליכים אלו מצויים בבסיס הפתופזיולוגיה של מעי רגיש[34]. זאת ועוד, מזון אולטרה־מעובד עשיר בפרוקטוז (Fructose) ממקור סירופ תירס, אוליגוסכרידים (Oligosaccharides) וממתיקים אלכוהוליים השייכים לקבוצת ה-FODMAP וידועים כתורמים לתסמיני תמ"ר כמתואר.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול הפחתת צריכת מזון מעובד ואולטרה־מעובד במטופלי מעי רגיש | IIb | C |
פרק 4 - רכיבי מזון והשפעתם על תסמונת מעי רגיש
גלוטן (Gluten)
מזונות המבוססים על חיטה הם מרכיב משמעותי בתזונה היומית, והצריכה הקלורית מהם עומדת על כ-50 אחוז מסך התזונה היומית[38]. בעשור השני של המאה ה-21 אנו עדים לעלייה הולכת וגדלה של הימנעות מגלוטן (חיטה) וההערכה היא שכ-20 אחוז מאוכלוסיית העולם המערבי מקפידה על דיאטה ללא גלוטן[39].
ישנן שלוש הפרעות הנגרמות מחשיפה לגלוטן:
- מחלת צליאק (Celiac) – מאפייניה הם אנטרופתיה (Enteropathy) של המעי הדק בעקבות נטייה גנטית על רקע חשיפה לגלוטן, אגב תגובה מתווכת של מערכת החיסון
- אלרגיה לחיטה שמתווכת על ידי IgE
- רגישות לגלוטן שאינה צליאק – Non Celiac Gluten Sensitivity (NCGS). זוהי פתולוגיה חדשה יחסית ללא מכניזם (מנגנון) פתופיזיולוגי ברור [40][41]
החוקרים Ellis ושותפים פרסמו לראשונה את המונח NCGS ב-1978 בתיאור מקרה שבו הימנעות מגלוטן הביאה להיעלמות תסמינים מתמשכים במערכת העיכול, ללא אבחנה של צליאק[42]. בפתולוגיה זו אפשר לזהות תסמינים המאפיינים תמ"ר, "IBS-like", במערכת העיכול ומחוצה לה[43][44][45][46]. המנגנון שאחראי על האינדוקציה של התסמינים אינו ברור אך ההשערה היא שגלוטן אינו עובר דגרדציה (Degradation) מספקת על ידי פרוטאזות (Proteases), עובדה שמעוררת את תגובת מערכת החיסון לחלבון[47].
ניסויים מבוקרים אקראיים (Randomized Controlled Trial ,RCT) הוכיחו את יתרונה של דיאטה ללא גלוטן (Gluten Free Diet ,GFD). לדוגמה, במחקר שכלל 45 מטופלי IBS-D קיבלו המטופלים דיאטה ללא גלוטן ודיאטה המכילה גלוטן למשך 4 שבועות והוכחה עלייה בתנועתיות המעי בדיאטה המכילה גלוטן, תוך עלייה בחדירות המעי. העלייה בחדירות המעי הייתה גבוהה יחסית בקרב מטופלים עם HLA DQ2/8 חיובי. עובדה זו מעלה את ההשערה שנוכחות הגן בקרב מטופלים עשויה להוות את הגורם לבעיה. נוכחות הגן קיימת ב-98 אחוז מחולי צליאק וב-25 אחוז באוכלוסייה בריאה[48][49].
לא נמצאו ביומרקרים לאבחון רגישות לגלוטן. במהלך השנים 2011–2016 התכנסו ועדות אחדות שעסקו בנושא, והקריטריונים שנקבעו בוועדת ה"מומחים בסלרנו" (Salerno) הם המקובלים. נקבעה דרישה למבחן כפול סמיות ואקראי שבו ניתנת למטופלים המעידים על עצמם כסובלים מ-NCGS כמות של לפחות 8 גרם גלוטן (שווה ערך ל-2 פרוסות לחם), והאבחנה ניתנה למטופל שסבל מהחמרה של 30 אחוזים לפחות בתסמינים כגון: נפיחות, כאבי בטן, שינויים ביציאות. מכאן, האבחנה של NCGS אפשרית במסגרת מחקרית בלבד כמתואר לעיל [46].
אפשר לזהות חפיפה בין תסמיני תמ"ר ל-NCGS. מספר מחקרים בדקו הימנעות מגלוטן כטיפול בתמ"ר אולם התוצאות שהתקבלו סותרות ולא־אחידות. במחקר אחד בלבד הייתה לחוקרים שליטה על המשתנים מההיבט התזונתי[50]|[51]. כאשר מפחיתים את צריכת הגלוטן בדיאטה, יורדת גם צריכת הפרוקטנים (ששייכים לקבוצת ה-FODMAP) Amylase Trypsin Inhibitors (ATIs) ואגלוטינינים, שהם חלבונים אשר עשויים לעורר תסמינים במערכת העיכול [52][53].
במטה־אנליזה שפורסמה ב-2017 נמצאה רגישות לגלוטן בקרב 16 אחוז מהמעידים על עצמם כסובלים מ-NCGS ואילו ב-40 אחוז נמצאו תסמינים דמויי פלצבו[54]. יתר על כן, במחקר נוסף נמצא שהפחתת צריכת פרוקטנים היא זו שהביאה לשיפור התסמינים בקרב מטופלי NCGS שקיבלו דיאטה ללא גלוטן[55]. הימנעות מגלוטן בקרב בריאים ללא צליאק אינה מומלצת כיוון שהיא עשויה לגרום לשינויים במיקרוביום באופן לא רצוי[56][57]. מחקר שהשווה בין דיאטה דלה ב-FODMAP לדיאטה ללא גלוטן לשיפור תסמיני תמ"ר מצא שדיאטה דלה ב-FODMAP שיפרה את התסמינים אך דיאטה ללא גלוטן לא גרמה להשפעה דומה[58].
לסיכום, רכיבים אחדים בחיטה עשויים לעורר תסמינים במערכת העיכול בקרב מטופלים המעידים על עצמם כסובלים מ-NCGS עם תמ"ר. אף על פי שהמנגנון אינו ברור, מתקבל על הדעת שקיימת קבוצת מטופלים שעשויה ליהנות מתזונה ללא גלוטן. יש צורך במחקרים נוספים במטופלי תמ"ר ורגישות לגלוטן שאינה צליאק, כולל חיפוש אחר ביומרקרים קליניים או ביוכימיים שניתן להשתמש בהם כחלק מאסטרטגיה טיפולית תזונתית.
אם מטופל מבקש לעקוב אחרי דיאטה ללא גלוטן יש ליידע אותו על הראיות המחקריות שאינן תומכות בה. לתת הנחיות שעומדות בהלימה לתזונה בריאה שכן מחד גיסא לא ידועות ההשלכות לטווח הארוך של תזונה ללא גלוטן, ומאידך גיסא ידוע לנו שתזונה ללא גלוטן פוגעת באיכות חייהם של חולי צליאק[59][60].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| לא מומלצת דיאטה נטולת גלוטן למטופלי מעי רגיש | III | B |
מזון חריף
קפסאיצין (Capsaicin) הוא רכיב פעיל הנמצא בפלפל חריף. רכיב זה אחראי על עלייה בשפעול קולטנים מסוג Transient Receptor Potential Vanilloid-1 (TRPV). שפעול של TRPV באנשים בריאים גורם לעלייה בכאבי בטן ותחושת בערה. באנשים עם רגישות ויסצראלית (Visceral) נמצאה רמה גבוהה יותר של קולטני TRPV, עובדה שעשויה להסביר את השפעתו של קפסאיצין על מטופלי תמ"ר[61][62][63].
נמצאו עבודות אחדות העוסקות בהשפעתו של מזון מתובל חריף, כגון טבסקו, צ'ילי ופלפל אדום, על מטופלי תמ"ר שבו כמות הקפסאיצין נעה בין 1.87 ל-14 מיליגרמים. במחקר שבו צריכת אבקת צ'ילי הייתה גבוהה נמצא קשר ישיר לסף כאבי הבטן, בעוד שמחקרים אחרים שבדקו מטופלים שצרכו מינון נמוך יותר של קפסאיצין הראו תוצאות הפוכות[64][65][66].
אפשר לסכם ולומר שמזון חריף עשוי לגרום לתסמיני תמ"ר בכלל ובגברים וב-IBS-D בפרט[66].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול הימנעות ממזון חריף במטופלי מעי רגיש, בהתאם לתסמיני המטופל | IIb | C |
דיאטת אלימינציה על פי נוגדני IgG4
גישה זו נחקרה בכמה עבודות והתבססה על נוכחות נוגדני IgG4 למזונות שונים.
במחקר התערבות שבו נעשה שימוש בגישה זו נבדקו רמות נוגדנים לפריטי מזון, ובהמשך חולקו המטופלים חלוקה אקראית לשתי קבוצות. באחת הקבוצות נמנעו מאותם מזונות שנתגלתה בהם רמת נוגדנים גבוהה, והקבוצה השנייה קיבלה תפריט אלימינציה שיקרי (sham diet) שלא כלל הימנעות ממזונות שלהם הייתה רמת נוגדנים גבוהה. לאחר 3 חודשים של מעקב נצפתה ירידה של יותר מ-10 אחוז מהתסמינים בקבוצת הניסוי[67]. למרות מחקרים נוספים שנעשו בנושא ונראו מבטיחים[68][69], השימוש הקליני בגישה זו מוגבל.
לא נמצא מִתְאָם בין חומרת התסמינים הקשורים לתמ"ר (כאב בטן, נפיחות בטנית, תדירות יציאות, דחיפות יציאות ותחושת חוסר התרוקנות) ובין רמות IgG4 שנמדדו בנחקרים. מסקנת החוקרים היא שרמות IgG4 הן תגובה פיזיולוגית של מערכת החיסון של המעי בחשיפה לרכיבים אנטיגנים במזון ומשינוי זמני בחדירות המעי, מצב שעשוי להעלות את ה"עומס האנטיגני". עלייה בתגובתיות נוגדני IgG4 היא תופעה שניונית ומייצגת פיזיולוגיה תקינה, ומסקנתם הייתה שחומרת התסמינים האופייניים לאוכלוסייה זו מושפעת ממרכיבים רגשיים ותרבותיים[70].
נדרשים מחקרים נוספים כדי להעריך את הרלוונטיות של נוגדני IgG4 למזון כגישה טיפולית במטופלי תמ"ר[69] ובשלב זה אין להמליץ על בדיקה זו לצורך אבחון רגישות למזון[71].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| לא מומלץ לבצע אלימינציה של מזונות על פי בדיקת נוגדנים מסוג IgG4 במטופלי מעי רגיש | III | B |
אלכוהול
לאלכוהול יש השפעה על תנועתיות, ספיגה וחדירות המעי וצריכתו עשויה להשפיע על תסמיני תמ"ר. בעבודות תצפיתיות אחדות נמצא קשר בין צריכת אלכוהול בכמות של 4 מנות ויותר להתפתחות כאבי בטן, בחילה ויציאות רכות עד שלשוליות, בעוד שלשתייה מתונה לא נמצא קשר להתפתחות תסמינים כמתואר. הממצאים היו בולטים יותר בקרב נשים[72][73]. בעבודה נוספת שבה השוו בין קבוצת מטופלי תמ"ר לקבוצת ביקורת, צריכת אלכוהול עוררה אי סבילות ניכרת בקבוצת המטופלים בהשוואה לקבוצת הביקורת[74]. הממצאים מעידים על הצורך במחקרים אקראיים כפולי סמיות על מנת להעריך את השפעתו של אלכוהול על תסמיני תמ"ר.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול המלצה להימנע מצריכת אלכוהול במטופלי מעי רגיש | IIb | C |
קפאין
לקפאין יש יכולת להגביר פעילות מוטורית של המעי הגס ולעורר פעילות רקטו-סיגמואידית (Rectosigmoid) אגב יצירת אפקט משלשל. מטופלים רבים הסובלים מ-IBS-D מעידים על שיפור בתסמינים עם הפחתת צריכת קפאין.
במחקר מקרה־ביקורת מצאו שמטופלים הסובלים מתמ"ר אינם צורכים קפה יותר מאוכלוסייה בריאה[75]. בעבודות נוספות נמצא קשר בין שתיית קפה לתסמינים בקרב מטופלים הסובלים מתמ"ר[73][74][76].
אפשר לסכם שיש להעריך את צריכת הקפאין ואם נמצא קשר בינה ובין תסמיני תמ"ר יש לשקול להפחית את צריכתו.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול הפחתת צריכת קפאין במטופלי מעי רגיש בהתאם לתסמינים | IIb | C |
מרכיב השומן
מחקרים תצפיתיים מדווחים על החמרה בתסמיני תמ"ר בעת צריכה גבוהה של שומן בקרב מטופלים הסובלים מתמ"ר, בהשוואה לקבוצות ביקורת[73][74][77][78].
בעבודה שבה הוזלפה לתריסריון תמיסת שומן, נצפו שינויים בתנועתיות המעי שהביאו במטופלי תמ"ר להחמרת תסמינים, כגון נפיחות, לחץ תוך בטני וקושי בפליטת גזים כלואים. במחקר RCT אחד הוזלפו 6.7 גרם שומן במשך שעתיים, ובאחר הוזלפו 20 גרם שומן במשך שעה, כשתסמינים התפתחו משמעותית בקרב מטופלי תמ"ר בהשוואה לקבוצת הביקורת[79][80].
במחקרים אלו ניתן שומן טהור, ללא רכיב מזון נוסף, עובדה שאינה משקפת את צריכת השומן בתזונה היומית. לכן אי אפשר להמליץ על סמך תוצאות מחקרים אלה על תזונה דלת שומן.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול צריכה מתונה של שומן במטופלי מעי רגיש במהלך ארוחה, בהתאם לתסמינים | IIb | C |
פרק 5 - צריכת סיבים תזונתיים בטיפול בתסמונת מעי רגיש
הקשר בין סיבים תזונתיים ובין הפתוגנזה של תסמונת מעי רגיש
סיבים תזונתיים מוגדרים כפולימרים של פחמימות בעלי דרגת פולימריות (polymer) 3 ומעלה אשר אינם מתעכלים או נספגים במעי הדק. הם נמצאים באופן טבעי במזון כפי שהוא נאכל, או מופקים מחומר גלם צמחי בתהליך אנזימטי או כימי, אך הם אינם סינתטיים[81].
נהוג לחלק את הסיבים לקטגוריות על בסיס תכונותיהם הפיזיקליות, ולסיבים מסיסים ובלתי מסיסים על פי יכולת החזקת המים שלהם[81]:
- סיבים מסיסים – בעלי יכולת החזקה של מים, הם מתחלקים לסיבים צמיגיים ולאלו שאינם צמיגיים, ועוברים תסיסה (פרמנטציה, fermentation) על ידי חיידקי המעי
- סיבים בלתי מסיסים – אינם בעלי יכולת החזקה של מים, רובם אינם עוברים תסיסה במעי והם אינם צמיגיים
סיווג הסיבים על פי מאפיינים פיזיו־כימיים: צמיגות, מסיסות ויכולת התססה. כל התכונות יחד קובעות את התפקוד של כל סיב במערכת העיכול.
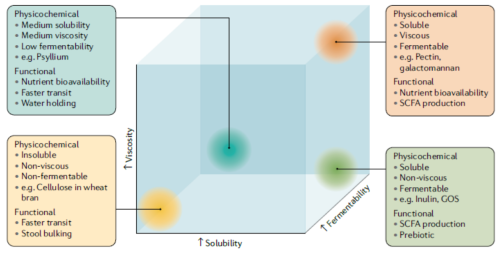
הקשר בין תמ"ר לצריכת סיבים תזונתיים מתבסס על תכונותיהם והשפעתם של אלה על תהליכי העיכול (נפח ומרקם צואה, זמן מעבר מזון במעי ותנועתיות המעי), הרכב המיקרוביום ופעילות מערכת החיסון במערכת העיכול[82].
לצריכת סיבים תזונתיים יש השפעה ישירה על הרכב המיקרוביום, שייתכן ומשפיע על תסמיני תמ"ר. צריכת סיבים תזונתיים משפיעה על פעילות מערכת החיסון במעי ב-Peyer's patches וב-Lamina propria, ואלו מופעלים בחשיפה לרכיבי תזונה מסוימים או למיקרוביום. נמצא בעכברים כי תזונה דלה בסיבים תזונתיים מביאה לירידה בכמות תאי חיסון מסוג B ועלייה בתאי חיסון מסוג T[83], עלייה בביטוי תאי T ואימונוגלובולינים (Immunoglobulins) לאורך מערכת העיכול[84] ודיכוי אפופטוזיס במודל של חיות מעבדה[85]. נוסף על כך, מחקרים מראים השפעה של הרכב המזון, ובייחוד הרכב הסיבים במזון, על פעילות תאי מאסט (MAST) במערכת העיכול[86]. תאי מאסט הם בעלי תפקיד מרכזי באתחול תהליכי דלקת ושימורם, בייחוד על רקע אלרגי.
נחקרת השפעת המיקרוביום על פעילות המערכת הנוירו־אנדוקרינית (Neuroendocrine) שבמערכת העיכול, בה מערכת העצבים (האנטרית, Enteric) מווסתת את התנועתיות, ההפרשה, הספיגה ואת הפעילות החיסונית של מערכת העיכול בהתאם לאיתותים אנדוקריניים אלו[87][88]. לשינוי בהרכב הסיבים בתזונת מטופלי תמ"ר יש השפעה על ריכוזם ופעילותם של תאים אנדוקריניים לאורך מערכת העיכול[89][90][91]. כמו כן, חומצות שומן קצרות שרשרת במעי נראו כבעלות השפעה חיובית על הפרשות peptide YY (PYY) ו-glucagon-like peptide-1 (GLP-1)[92][93] שבתורם מעודדים ספיגה של נוזלים ואת מעבר המזון בין המעי הדק למעי הגס[94][95].
השפעתה של צריכת סיבים תזונתיים על תסמיני מעי רגיש
העשרת התזונה בסיבים תזונתיים כאמצעי לטיפול בתמ"ר נראית בטוחה, אך לא ברורה יעילותה בהפחתת התסמינים. בסקירה ספרותית בנושא המבוססת על 17 מחקרים התערבותיים בקרב מטופלי תמ"ר, נבדקו העשרות בסיבים תזונתיים לעומת טיפול סטנדרטי. העשרת התזונה בסיבים לא הראתה יעילות גורפת לטיפול, אם כי הנתונים נותחו ללא הבחנה בין סוגי תמ"ר, וללא ריבוד לתסמינים שונים[96]. מחד גיסא, העשרת הדיאטה בסיבים תזונתיים מסיסים או בלתי מסיסים[97] או בתוסף פרה־ביוטי[98][99] לא הראתה יעילות מובהקת בטיפול בתסמינים של תמ"ר. מאידך גיסא, שתי סקירות ספרותיות ומטא־אנליזות המבוססות על 14 מחקרים התערבותיים מבוקרים באחת ועל 22 מחקרים בשנייה, מצאו יתרון לשימוש בסיבים תזונתיים מסיסים בשיפור התסמינים של תמ"ר. יתרון זה נראה גם עבור מטופלים הסובלים מ-IBS-C ומ-IBS-D. נמצאו מעט מקורות התומכים בטיפול בסיבים בלתי מסיסים במעי רגיש. בחלק מהם הטיפול נמצא לא יעיל ואף עלול להחמיר תסמינים של שלשול[100][101].
מומלצת צריכה של סיבים תזונתיים בקרב מטופלי תמ"ר בכמות התואמת את ההמלצה עבור האוכלוסייה הכללית, 20–30 גרם ליום. מומלץ כי מקור הסיבים יהיה בעיקר מסיבים מסיסים ולא מסיבים בלתי מסיסים (כגון: סובין חיטה)[102][103][104]. איגודים מקצועיים לגסטרואנטרולוגיה מביעים עמדות שונות לגבי תיסוף סוגים שונים של סיבים (כגון: פסיליום, סובין חיטה) לטיפול בהפרעות תפקודיות של מערכת העיכול כולל תמ"ר, ואין תמימות דעים בנושא[98][105][106][107][108]. עם זאת, ישנה המלצת מומחים לתיסוף בסיבים, בייחוד סיבים מסיסים כגון פסיליום כטיפול אפשרי ב-IBS-D[98][108][108][109]. אין לעודד חולים לתסף סובין חיטה (סיבים בלתי מסיסים) נוסף על צריכתם הרגילה מהמזון[110][111].
העלאת צריכת סיבים, בתוסף או ממקורות תזונתיים, עלולה להיות מלווה בהחמרת תסמינים של אי נוחות בטנית וכאבי בטן. תסמינים אלו צפויים לחלוף עם התרוקנות תקינה של המעי ועם הסתגלות לצריכת סיבים גבוהה יותר, וההמלצה היא להעלות בהדרגה את צריכת הסיבים בקרב מטופלים שתזונת הבסיס שלהם דלה מאוד בסיבים תזונתיים. אופן העלייה: תוספת של 3–4 גרם ליום למשך שבוע אחד ועלייה הדרגתית עד לתוספת של 10–15 גרם ליום במשך שבועות מספר[112]. זאת ועוד, במקרים שבהם ישנם תסמינים של נפיחות וגזים, מומלץ להפחית צריכה של סיבים תזונתיים מותססים (fermentable) שמקורם בעיקר מדגנים[113].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| לא מומלצת דיאטה דלה או עשירה בסיבים תזונתיים או בתוספי סיבים תזונתיים לטיפול במעי רגיש | III | C |
| ניתן לשקול תוספת הדרגתית של סיבים תזונתיים מהמזון ובהתאמה אישית לסבילות המטופל, במקרה שבו צריכת הסיבים מהמזון נמוכה מההמלצה לאוכלוסייה הכללית | IIb | C |
| רצוי לשקול שימוש בתוסף סיבים מסיסים כאסטרטגיה טיפולית, ובהתאמה אישית לסבילות המטופל | IIa | B |
| לא מומלץ שימוש בסיבים בלתי מסיסים כגון סובין חיטה למטופלי מעי רגיש | III | B |
פרק 6 - התנהגות אכילה בטיפול בתסמונת מעי רגיש
התנהגות אכילה - מונח שבו נהוג לכנות מאפיינים שאינם קשורים להרכב המזון אלא לאופן שבו הוא נאכל. משך הארוחה וגודלה, תדירות הארוחות במהלך היום, קצב האכילה והסחות דעת במהלכה, שתייה בזמן האכילה, אופן הלעיסה ואכילה בלילה הם מאפיינים שאליהם מתייחסת הספרות המקצועית[114].
מהמחקרים המעטים שבחנו את השפעת התנהגות האכילה במטופלים הסובלים מתמ"ר עולה דיווח על אי נוחות בטנית בארוחות בהשוואה למי שאינו סובל ממעי רגיש. הוצע כי מרכיב התנהגותי זה עשוי להשפיע על תנועתיות המעי, והיא בתורה עשויה להשפיע על תסמיני תמ"ר[115][116]. בנשים הסובלות מעודף משקל ושפיתחו דפוס אכילה בולמוסי, ישנו סיכון גבוה של פי 2–4 לסבול מתסמיני תמ"ר בהשוואה לנשים ללא דפוס זה, וייתכן שהגורם המשפיע על הופעת התסמינים הוא גודל הארוחה הרווח בדפוס זה[117].
למרות מיעוט במחקרים, איגוד הדיאטניות הבריטי (British Dietetic Association ,BDA) והנחיות ה-NICE (The National Institute for Health and Care Excellence) ממליצים על אכילה של ארוחות מסודרות ומגוונות לאורך היום, בדגש על אכילה נינוחה, בישיבה, לעיסה מיטבית, הימנעות מארוחות גדולות ומאכילה בשעות המאוחרות של הלילה. כמו כן, מומלץ להימנע מדילוג על ארוחות, מפערים גדולים בין הארוחות ולהקפיד על שתיית מים מרובה לאורך היום[118][119].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול להמליץ למטופלי מעי רגיש על דפוסי האכילה הבאים: חלוקת ארוחות לאורך היום, אכילה נינוחה בישיבה, לעיסה טובה והימנעות מארוחות גדולות ומארוחות בשעות המאוחרות של הלילה | IIb | C |
פרק 7 - שימוש בתוספי תזונה בטיפול בתסמונת מעי רגיש
פרוביוטיקה
ממחקרים עולה שמטופלי תמ"ר הם בעלי פרופיל מיקרוביאלי שונה מאלו שאינם סובלים ממעי רגיש. נשאלת השאלה האם טיפול בתסמיני תמ"ר בתוסף תזונה המכיל פרוביוטיקה יעיל.
ישנן כמה מטא־אנליזות שלא הראו יעילות חד משמעית בשימוש בפרוביוטיקה לטיפול בתסמיני תמ"ר. הקושי העיקרי הוא חוסר אחידות בסוגי הזנים שניתנו ובמינון הפרוביוטיקה שניתן בכל מחקר. הזנים הנחקרים ביותר במחקר בכלל ובמטא־אנליזות אלו בפרט הם Lactobacillus ו-Bifidobacterium[120][121].
אף על פי שאין תמימות דעים בנוגע לתועלת בשימוש בפרוביוטיקה – ישנו יתרון ברור לשימוש בתוספים המכילים תערובת של זנים על פני שימוש בפרוביוטיקה המכילה זן אחד. ייתכן שההשפעה המיטיבה של התערובות נובעת מהמרכיב הכמותי (כמות גדולה של מיקרואורגניזמים) וממגוון גדול של זנים פרוביוטיים[120].
מחקר ישראלי בחן את ההשפעה של תוסף פרוביוטיקה מסוג Bio-25 במשך 8 שבועות בקרב נשים הסובלות מ-IBS-D ומצא שיפור מובהק בתסמינים (נפיחות, כאב בטן, תדירות ותכיפות היציאות) בקבוצת ההתערבות ובקבוצת הביקורת[122].
הפרוביוטיקה הנחקרת ביותר בישראל לטיפול בתסמיני תמ"ר נקראת Vivomixx, המופיעה במחקרים בשם VSL#3. במטא־אנליזה משנת 2018 שסיכמה את כלל המחקרים שבחנו את השפעת פרוביוטיקה זו על תסמיני תמ"ר, לא נמצא הבדל מובהק לעומת טיפול סטנדרטי[123]. מכאן עולה השאלה האם מתן פרוביוטיקה למטופלי תמ"ר יעיל בהקלת התסמינים?
לדיאטה דלת FODMAP (ראו פרק 2) יש תועלת קלינית במקרים מסוימים אך היא משנה את הרכב המיקרוביום לרעה בכלל ומצמצמת את כמות ה-Bifidobacterium בפרט[124][125][126]. עבודה שבחנה את היעילות של שימוש משולב בדיאטה דלה ב-FODMAP ובפרוביוטיקה מסוג Vivomixx מצאה כי שילוב זה מנע את הירידה במגוון המיקרוביום שנצפתה בדיאטה דלה ב-FODMAP כמתואר[127].
אפשר לסכם ולומר שאין הוכחה חד משמעית ליעילות במתן פרוביוטיקה לטיפול בתסמיני תמ"ר אך על סמך הניסיון הקליני אפשר לשקול טיפול בפרוביוטיקה בקרב מטופלי תמ"ר, אך לא כקו טיפול ראשון.
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול שימוש בתכשיר פרוביוטיקה המכיל תערובת של זנים לצורך שיפור תסמיני מעי רגיש מסוג IBS-D | IIb | A |
| ניתן לשקול שימוש בפרוביוטיקה מסוג Bio-25 במינון של 2 קפסולות, בוקר וערב, לטיפול בתסמיני מעי רגיש | IIb | B |
| ניתן לשקול שימוש בפרוביוטיקה מסוג Vivomixx על מנת לטפל בתסמיני מעי רגיש | IIb | A |
| ניתן לשקול שימוש רציף במשך 4 שבועות של פרוביוטיקה על מנת לברר אם שימוש בתוסף יעיל להקלה על תסמיני מעי רגיש | IIb | B |
תוסף תזונה של אנזימי עיכול לטיפול בתסמונת מעי רגיש
אנזימי עיכול המופרשים במערכת העיכול או קיימים על גבי תאי המעי מסייעים לתהליך העיכול על ידי פירוק שרשראות המזון ליחידות קטנות. בכך הם מאפשרים ספיגה של רכיבי המזון.
תוספת פומית של אנזימי עיכול פנקראטיים מיועדת לטיפול במקרים של אי ספיקת לבלב – Pancreatic Exocrine Insufficiency (PEI) למטופלים הסובלים מסוכרת ארוכת שנים שעשויים לפתח PEI. המלצת הגופים המקצועיים היא לתסף באנזימי עיכול כאשר קיימת אבחנה המתבססת על בדיקה רפואית[128][129]. התוסף Creon מכיל אנזימי עיכול המיועדים לעיכול מאקרונוטריינטים והוא נמכר ב-2 מינונים: 10,000 יחידות ללא מרשם רופא, 25,000 במרשם רופא.
קיימים תוספים ללא מרשם במינונים נמוכים שמקורם צמחי, כגון ברומלין ופפאין – שהם קומפלקס פרוטאזות ועמילאזות. כמו כן, קיימים אנזימים המיוצרים על ידי מיקרואורגניזמים (חיידקים ופטריות). הם כוללים ליפאזות (Lipases), פרוטאזות (Proteases), עמילאזות (Amylases) ובטא-גלקטוזידאז (Beta galactosidase, לקטאז - Lactase), אך יעילותם מוגבלת[129][130].
אנזימי עיכול פחמימות:
- לקטאז – לצורך פירוק לקטוז (Lactose, סוכר החלב) אפשר להיעזר בתוסף זה במטופלים עם אי סבילות ללקטוז אשר מעוניינים להמשיך לאכול מזונות עתירי לקטוז[129][131][132][133]
- אלפא גלקטוזידאז – אפשר לצרוך לשם עיכול רכיבי תא צמחי הקיים, בין היתר, בקטניות. תוסף זה עשוי לעזור למטופלים שמתקשים לאכול ארוחות המכילות כמות גדולה של ירקות וקטניות (כגון: תכשירים בשם Beano, זים גז)[134]
לסיכום, לא ניתן להסיק שתוספת אנזימי עיכול פנקראטיים יעילה בטיפול בתסמיני תמ"ר. עם זאת, אם אנמנזה ומידע רפואי מעלים חשד לקשיים בעיכול עם תסמינים אפיגסטריים/שלשול כרוני אפשר לשקול בירור נוסף וניסיון לתיסוף פומי[135][136][137].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול תוספת של תערובת אנזימי עיכול בקרב מטופלי מעי רגיש, בהתאם לתסמינים | IIb | C |
| ניתן לשקול שימוש בתוסף מסוג לקטאז בקרב מטופלים עם אי סבילות ללקטוז, לפני ארוחה עם תכולת לקטוז גבוהה | IIb | B |
| ניתן לשקול תוספת של אלפא גלקטוזידאז בקרב מטופלים עם קושי בעיכול של גלקטואוליגוסכרידים | IIb | B |
תוסף תזונה של שמן מנטה כטיפול בתסמונת מעי רגיש
החומר הפעיל בשמן מנטה, l-menthol, בעל יכולת הרפיית שרירים, תכונות אנטי דלקתיות והוא פועל על מערכת העצבים במעי. הוא נמצא בשימוש נרחב בתכשירים תרופתיים לטיפול בכאב סומטי[138][139][140][141][142]. מחקרים התערבותיים מבוקרים ואקראיים הראו כי הוא יעיל בהפחתת תסמיני תמ"ר. בין התוספים השונים ניכר יתרון לקפסולות ששחרורן תלוי רמת חומציות[143][144], עם יתרון מובהק לקפסולות המיועדות לפעול במעי הדק[145].
מטא־אנליזה של 9 מחקרים התערבותיים בקרב מטופלי תמ"ר הראתה כי טיפול בשמן מנטה יעיל יותר מפלצבו בשיפור תסמיני תמ"ר באופן כללי, ובפרט בכאבי בטן, נפיחות ודחיפות היציאות. עם זאת, המשתתפים דיווחו על תופעות לוואי קלות של צרבות, יובש בפה, טעם וריח של מנטה[146][147]. נדרשים מחקרים נוספים על מנת להוכיח את ההשפעה של שמן מנטה על תסמיני תמ"ר[137][148][149].
| המלצה | חוזק ההמלצה | חוזק ההוכחה |
|---|---|---|
| ניתן לשקול תוספת של שמן מנטה בקרב מטופלי מעי רגיש, בהתאמה אישית | IIb | B |
פרק 8 - סיכום הטיפול התזונתי בתסמונת מעי רגיש
תמ"ר היא השכיחה מבין ההפרעות התפקודיות של מערכת העיכול. חלה התקדמות ניכרת בהבנה כיצד שינוי תזונתי עשוי להשפיע על התסמינים ונצבר ידע רב המבסס את יעילות השימוש בהתערבויות תזונתיות בטיפול בה.
מהספרות ומניסיוננו עולה כי הנחיות תזונתיות כלליות יכולות וצריכות לשמש מסגרת טיפולית לסובלים מתמ"ר. להלן ההנחיות:
- התנהגות אכילה נכונה היא בסיס ראשון ומשמעותי לשליטה בתסמינים: זמני ארוחות קבועים, אכילה איטית, הימנעות מארוחות גדולות בשעות מאוחרות של הלילה וכדומה
- הימנעות ממזון חריף, הפחתה בצריכת אלכוהול, קפאין ושומן בתזונה תוך הימנעות ממזון מתועש ומעובד
- דיאטה דלת FODMAP יעילה בטיפול בכ-50 אחוז–70 אחוז ממטופלי תמ"ר, בעיקר בקרב תת-סיווג IBS-D ו IBS-M. השימוש בה ייעשה תוך ניסיון להטמעת דפוסי אכילה דוגמת דיאטה ים תיכונית, משלב האלימינציה (Restriction) ובוודאי במהלך "החזרת מזונות" (Personalization) באופן המותאם אישית
- מניסיוננו, במטופלי תמ"ר הסובלים מעצירות, תוספת של סיבים תזונתיים מסיסים עשויה לשפר את תדירות היציאות ומרקמן ללא החמרה בתסמינים אחרים
- רגישות לגלוטן (חיטה) שאינה צליאק (Non-celiac gluten sensitivity ,NCGS) – במקרים רבים אין מדובר ברגישות מבוססת אלא בתפיסתו של המטופל בלבד
- לדיאטה מבוססת על בדיקת רמות IgG4 אין תמיכה בספרות ואין מקום להמליץ עליה
- תוספי תזונה מסוג פרוביוטיקה – למרות ההיגיון הביולוגי, לא הוכחה חד משמעית יעילות הטיפול ולכן ניתן לשקול שימוש בה, אך לא כקו טיפול ראשון
לסיכום, אנמנזה הכוללת ניסיון עבר, איתור רגישות לרכיבי מזון ומתן תוכנית טיפולית המבוססת על "תזונה מותאמת אישית" בליווי דיאטנים ייעודיים בעלי ניסיון בתחום, תעלה את סיכויי ההצלחה בטיפול.
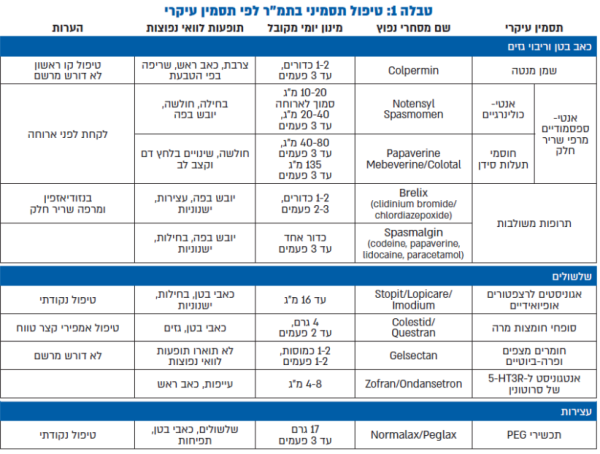
נספח 1: טיפולים תרופתיים לתסמונת המעי הרגיש
מתוך תקציר נייר עמדה לטיפול בתסמונת המעי הרגיש, מאת החוג הישראלי לנוירוגסטרואנטרולוגיה ולתנועתיות מערכת העיכול, באדיבות פרופ׳ רם דיקמן
צוות כתיבת נייר העמדה
עריכה
- רוני ברוך, RD, M.Sc דיאטנית קלינית, המחלקה לתזונה, המכון הגסטרואנטרולוגי מרכז רפואי תל אביב על שם סורסקי
- תמר פפר גיק, RD, M.Sc דיאטנית קלינית, היחידה לתזונה, המערך לגסטרואנטרולוגיה בי"ח בילינסון מרכז רפואי רבין, דוקטורנטית אוניברסיטת תל אביב
כותבות נייר העמדה (לפי סדר הא"ב)
- רוני ברוך, RD, M.Sc דיאטנית קלינית, המחלקה לתזונה, המכון הגסטרואנטרולוגי מרכז רפואי תל אביב על שם סורסקי
- רותם סגל-בונה RD, B.Sc דיאטנית קלינית וחוקרת, היחידה לגסטרואנטרולוגיה ילדים בי"ח וולפסון
- ד"ר נעמי פליס איסקוב, RD, PhD דיאטנית קלינית, מנהלת מחלקת מחקר בתזונה, אגף התזונה, משרד הבריאות.
- תמר פפר גיק, RD, M.Sc דיאטנית קלינית, היחידה לתזונה קלינית, המערך לגסטרואנטרולוגיה בי"ח בילינסון מרכז רפואי רבין, דוקטורנטית הפקולטה לרפואה על שם סאקלר אוניברסיטת תל אביב
- ד"ר סיגל פרישמן RD, MHA, Ph.D דיאטנית ראשית בתי חולים כללית, מנהלת היחידה לתזונה קלינית בי"ח בילינסון
- נעמי קידר, RD, M.Sc היחידה לתזונה ודיאטה, מכון גסטרואנטרולוגי, מרכז רפואי שיבא, תל השומר
תודות
פרופסור רם דיקמן, יושב ראש החוג הישראלי לנוירוגסטרואנטרולוגיה ולתנועתיות מערכת העיכול, סגן מנהלת המערך לגסטרואנטרולוגיה, מרכז רפואי רבין, בית החולים בילינסון
ביבליוגרפיה והערות שוליים
- ↑ The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD) (2007).Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur Heart J 28:88-136
- ↑ Canavan C, West J, Card T. The epidemiology of irritable bowel syndrome. Clin Epidemiol. 2014;6(1):71-80.
- ↑ Sperber AD, Bangdiwala SI, Drossman DA, et al. Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders, Results of Rome Foundation Global Study. Gastroenterology. 2021;160(1):99-114.e3.
- ↑ 4.0 4.1 Ford AC, Sperber AD, Corsetti M, Camilleri M. Irritable bowel syndrome. Lancet. 2020;396(10263):1675-1688.
- ↑ Hayes PA, Fraher MH, Quigley EMM. Irritable bowel syndrome: The role of food in pathogenesis and management. Gastroenterol Hepatol. 2014;10(3):164-174.
- ↑ Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783
- ↑ 7.0 7.1 McKenzie YA, Thompson J, Gulia P, Lomer MCE. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):576-592.
- ↑ Spiller R. Impact of diet on symptoms of the irritable bowel syndrome. Nutrients. 2021;13(2):1-19.
- ↑ Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology. 2016;150(6):1393-1407.e5.
- ↑ Black CJ, Ford AC. Best management of irritable bowel syndrome. Frontline Gastroenterol. 2021;12(4):303-315.
- ↑ 11.0 11.1 Ford AC, Lacy BE, Talley NJ. Irritable bowel syndrome. N Engl J Med. 2017;376(26):2566-2578.
- ↑ Lacy BE, Pimentel M, Brenner DM, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44.
- ↑ Chey WD, Hashash JG, Manning L, Chang L. AGA Clinical Practice Update on the Role of Diet in Irritable Bowel Syndrome: Expert Review. Gastroenterology. 2022;162(6):1737-1745.e5.
- ↑ Ford AC, Lacy BE, Talley NJ. Irritable bowel syndrome. N Engl J Med. 2017;376(26):2566-2578.
- ↑ Mckenzie YA, Thompson J, Gulia P, Lomer MCE, Dietetic IBS, Review G. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults ( 2016 update ). 2016;(1).
- ↑ Tuck CJ, Reed DE, Muir JG, Vanner SJ. Implementation of the low FODMAP diet in functional gastrointestinal symptoms: A real-world experience. Neurogastroenterol Motil. 2020;32(1). doi:10.1111/NMO.13730
- ↑ McKenzie YA, Alder A, Anderson W, et al. British Dietetic Association evidence-based guidelines for the dietary management of irritable bowel syndrome in adults. J Hum Nutr Diet. 2012;25(3):260-274.
- ↑ Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014;146(1):67-75.e5.
- ↑ Whelan K, Martin LD, Staudacher HM, Lomer MCE. The low FODMAP diet in the management of irritable bowel syndrome: an evidence-based review of FODMAP restriction, reintroduction and personalisation in clinical practice. J Hum Nutr Diet. 2018;31(2):239-255.
- ↑ van Lanen AS, de Bree A, Greyling A. Efficacy of a low-FODMAP diet in adult irritable bowel syndrome: a systematic review and meta-analysis. Eur J Nutr. 2021;60(6):3505-3522.
- ↑ Black CJ, Staudacher HM, Ford AC. Efficacy of a low FODMAP diet in irritable bowel syndrome: Systematic review and network meta-analysis. Gut. 2021:1-10.
- ↑ 22.0 22.1 22.2 Bennet SMP, Böhn L, Störsrud S, et al. Multivariate modelling of faecal bacterial profiles of patients with IBS predicts responsiveness to a diet low in FODMAPs. Gut. 2018;67(5):872-881. d
- ↑ Mckenzie YA, Thompson J, Gulia P, Lomer MCE, Dietetic IBS, Review G. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults ( 2016 update ). 2016;(1)
- ↑ Halmos EP, Christophersen CT, Bird AR, Shepherd SJ, Gibson PR, Muir JG. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut. 2015;64(1):93-100.
- ↑ 25.0 25.1 Rossi M, Aggio R, Staudacher HM, et al. Volatile Organic Compounds in Feces Associate With Response to Dietary Intervention in Patients With Irritable Bowel Syndrome. Clin Gastroenterol Hepatol. 2018;16(3):385-391.e1.
- ↑ 26.0 26.1 Wang XJ, Camilleri M, Vanner S, Tuck C. Review article: biological mechanisms for symptom causation by individual FODMAP subgroups - the case for a more personalised approach to dietary restriction. Aliment Pharmacol Ther. 2019;50(5):517-529.
- ↑ 27.0 27.1 27.2 Halmos P, Gibson P. Controversies and reality of the FODMAP diet for patients with irritable bowel syndrome. J Gastroenterol Hepatol. 2019;34(7):1134-1142.
- ↑ Sofi F, Cesari F, Abbate R, Gensini GF, Casini A. Adherence to Mediterranean diet and health status: Meta-analysis. BMJ. 2008;337(7671):673-675.
- ↑ Falony G, Joossens M, Vieira-Silva S, et al. Population-level analysis of gut microbiome variation. Science. 2016;352(6285):560-564.
- ↑ 30.0 30.1 Gutiérrez-Díaz I, Fernández-Navarro T, Salazar N, et al. Adherence to a Mediterranean Diet Influences the Fecal Metabolic Profile of Microbial-Derived Phenolics in a Spanish Cohort of Middle-Age and Older People. J Agric Food Chem. 2017;65(3):586-595.
- ↑ 31.0 31.1 Rinninella E, Cintoni M, Raoul P, et al. Health Gut Microbiota. Nutrients. 2019:1-23.
- ↑ 32.0 32.1 Zito F, Polese B, Vozzella L, et al. Good adherence to mediterranean diet can prevent gastrointestinal symptoms: A survey from Southern Italy. World J Gastrointest Pharmacol Ther. 2016;7(4):564.
- ↑ 33.0 33.1 Elmaliklis I, Liveri A, Ntelis B, K P, I G, AE K. Increased Functional Foods’ Consumption and Mediterranean Diet Adherence May Have a Protective Effect in the Appearance of Gastrointestinal Diseases: A Case−Control Study. Med (Basel, Switzerland). 2019;6(2):50.
- ↑ 34.0 34.1 Agakidis C, Kotzakioulafi E, Petridis D, K A, T K-L. Mediterranean Diet Adherence is Associated with Lower Prevalence of Functional Gastrointestinal Disorders in Children and Adolescents. Nutrients. 2019;11(6).
- ↑ Elizabeth L, Machado P, Zinöcker M, P B, M L. Ultra-Processed Foods and Health Outcomes: A Narrative Review. Nutrients. 2020;12(7):1-36.
- ↑ Buscail C, Sabate J, Bouchoucha M, et al. Western Dietary Pattern Is Associated with Irritable Bowel Syndrome in the French NutriNet Cohort. Nutrients. 2017;9(9):1-13.
- ↑ Schnabel L, Buscail C, Sabate JM, et al. Association Between Ultra-Processed Food Consumption and Functional Gastrointestinal Disorders: Results From the French NutriNet-Santé Cohort. Am J Gastroenterol. 2018;113(8):1217-1228.
- ↑ Tovoli F, Masi C, Guidetti E, Negrini G, Paterini P, Bolondi L. Clinical and diagnostic aspects of gluten related disorders. World J Clin Casess. 2015.
- ↑ Makharia A, Catassi C, Makharia GK. The Overlap between Irritable Bowel Syndrome and Non-Celiac Gluten Sensitivity: A Clinical Dilemma. Nutrients. 2015.
- ↑ Ludvigsson JF, Leffler DA, Bai JC, et al. The Oslo definitions for coeliac disease and related terms. Gut. 2013;62(1):43-52.
- ↑ Fjeldheim Dale H, Biesiekierski JR, Lied GA. Non-coeliac gluten sensitivity and the spectrum of gluten-related disorders: an updated overview. 2018.
- ↑ Ellis A, Linaker BD. Non-coeliac gluten sensitivity? Lancet (London, England). 1978;1(8078):1358-1359.
- ↑ Sapone A, Bai JC, Ciacci C, et al. Spectrum of Gluten-Related Disorders: Consensus on New Nomenclature and Classification.; 2012.
- ↑ Catassi C, Bai JC, Bonaz B, et al. Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders. Nutrients. 2013;5(10):3839.
- ↑ Catassi C, Elli L, Bonaz B, et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015;7:4966-4977.
- ↑ 46.0 46.1 Catassi C, Alaedini A, Bojarski C, et al. The Overlapping Area of Non-Celiac Gluten Sensitivity (NCGS) and Wheat-Sensitive Irritable Bowel Syndrome (IBS): An Update. Nutrients. 2017;9(11).
- ↑ Volta U, Pinto-Sanchez MI, Boschetti E, Caio G, De Giorgio R, Verdu EF. Dietary triggers in irritable bowel syndrome: Is there a role for gluten? J Neurogastroenterol Motil. 2016;22(4):547-557.
- ↑ Vazquez-Roque MI, Camilleri M, Smyrk T, et al. A Controlled Trial of Gluten-Free Diet in Patients with Irritable Bowel Syndrome-Diarrhea: Effects on Bowel Frequency and Intestinal Function. Gastroenterology. 2013;144(5):903.
- ↑ Rej A, Sanders DS. Gluten-Free Diet and Its “Cousins” in Irritable Bowel Syndrome. Nutrients. 2018;10(11).
- ↑ Biesiekierski JR. What is gluten? J Gastroenterol Hepatol. 2017;32 Suppl 1:78-81.
- ↑ Biesiekierski JR, Peters SL, Newnham ED, Rosella O, Muir JG, Gibson PR. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology. 2013;145(2).
- ↑ Aziz I, Hadjivassiliou M, Sanders DS. The spectrum of noncoeliac gluten sensitivity. Nat Rev Gastroenterol Hepatol. 2015;12(9):516-526.
- ↑ Junker Y, Zeissig S, Kim SJ, et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med. 2012;209(13):2395-2408.
- ↑ Molina-Infante J, Carroccio A. Suspected Nonceliac Gluten Sensitivity Confirmed in Few Patients After Gluten Challenge in Double-Blind, Placebo-Controlled Trials. Clin Gastroenterol Hepatol. 2017;15(3):339-348.
- ↑ Skodje GI, Sarna VK, Minelle IH, et al. Fructan, Rather Than Gluten, Induces Symptoms in Patients With Self-Reported Non-Celiac Gluten Sensitivity. Gastroenterology. 2018;154(3):529-539.e2.
- ↑ Bonder MJ, Tigchelaar EF, Cai X, et al. The influence of a short-term gluten-free diet on the human gut microbiome. Genome Med. 2016;8(1).
- ↑ De Palma G, Nadal I, Collado MC, Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult human subjects. Br J Nutr. 2009;102(8):1154-1160.
- ↑ Nordin E, Brunius C, Landberg R, Hellström PM. Fermentable oligo-, di-, monosaccharides, and polyols (FODMAPs), but not gluten, elicit modest symptoms of irritable bowel syndrome: a double-blind, placebo-controlled, randomized three-way crossover trial. Am J Clin Nutr. 2022;115(2):344-352.
- ↑ Tack GJ, Verbeek WHM, Schreurs MWJ, Mulder CJJ. The spectrum of celiac disease: epidemiology, clinical aspects and treatment. Nat Rev Gastroenterol Hepatol. 2010;7(4):204-213.
- ↑ See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA. Practical insights into gluten-free diets. Nat Rev Gastroenterol Hepatol. 2015;12(10):580-591.
- ↑ Akbar A, Yiangou Y, Facer P, Walters JRF, Anand P, Ghosh S. Increased capsaicin receptor TRPV1-expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain. Gut. 2008;57(7):923-929. doi:10.1136/GUT.2007.138982
- ↑ Chan CLH, Facer P, Davis JB, et al. Sensory fibres expressing capsaicin receptor TRPV1 in patients with rectal hypersensitivity and faecal urgency. Lancet (London, England). 2003;361(9355):385-391.
- ↑ Wouters MM, Balemans D, Van Wanrooy S, et al. Histamine Receptor H1-Mediated Sensitization of TRPV1 Mediates Visceral Hypersensitivity and Symptoms in Patients With Irritable Bowel Syndrome. Gastroenterology. 2016;150(4):875-887.e9.
- ↑ Bortolotti M, Porta S. Effect of red pepper on symptoms of irritable bowel syndrome: preliminary study. Dig Dis Sci. 2011;56(11):3288-3295.
- ↑ Gonlachanvit S, Mahayosnond A, Kullavanijaya P. Effects of chili on postprandial gastrointestinal symptoms in diarrhoea predominant irritable bowel syndrome: evidence for capsaicin-sensitive visceral nociception hypersensitivity. Neurogastroenterol Motil. 2009;21(1):23-32.
- ↑ 66.0 66.1 Agarwal MK, Bhatia SJ, Desai SA, Bhure U, Melgiri S. Effect of red chillies on small bowel and colonic transit and rectal sensitivity in men with irritable bowel syndrome. Indian J Gastroenterol. 2002;21(5):179-182.
- ↑ Atkinson W, Sheldon TA, Shaath N, Whorwell PJ. Food elimination based on IgG antibodies in irritable bowel syndrome: a randomised controlled trial. Gut. 2004;53(10):1459-1464.
- ↑ Zar S, Mincher L, Benson MJ, Kumar D. Food-specific IgG4 antibody-guided exclusion diet improves symptoms and rectal compliance in irritable bowel syndrome. Scand J Gastroenterol. 2005;40(7):800-807.
- ↑ 69.0 69.1 Drisko J, Bischoff B, Hall M, McCallum R. Treating irritable bowel syndrome with a food elimination diet followed by food challenge and probiotics. J Am Coll Nutr. 2006;25(6):514-522.
- ↑ Zar S, Benson MJ, Kumar D. Food-specific serum IgG4 and IgE titers to common food antigens in irritable bowel syndrome. Am J Gastroenterol. 2005;100(7):1550-1557.
- ↑ Algera J, Colomier E, Simrén M. The dietary management of patients with irritable bowel syndrome: A narrative review of the existing and emerging evidence. Nutrients. 2019;11(9).
- ↑ Reding KW, Cain KC, Jarrett ME, Eugenio MD, Heitkemper MM. Relationship between patterns of alcohol consumption and gastrointestinal symptoms among patients with irritable bowel syndrome. Am J Gastroenterol. 2013;108(2):270-276.
- ↑ 73.0 73.1 73.2 Simrén M, Månsson A, Langkilde AM, et al. Food-related gastrointestinal symptoms in the irritable bowel syndrome. Digestion. 2001;63(2):108-115.
- ↑ 74.0 74.1 74.2 Hayes P, Corish C, O’Mahony E, Quigley EMM. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27 Suppl 2(SUPPL2):36-47.
- ↑ Saito YA, Locke GR, Weaver AL, Zinsmeister AR, Talley NJ. Diet and functional gastrointestinal disorders: a population-based case-control study. Am J Gastroenterol. 2005;100(12):2743-2748.
- ↑ Faresjö Å, Johansson S, Faresjö T, Roos S, Hallert C. Sex differences in dietary coping with gastrointestinal symptoms. Eur J Gastroenterol Hepatol. 2010;22(3):327-333.
- ↑ Simrén M, Agerforz P, Björnsson ES, Abrahamsson H. Nutrient-dependent enhancement of rectal sensitivity in irritable bowel syndrome (IBS). Neurogastroenterol Motil. 2007;19(1):20-29.
- ↑ Böhn L, Störsrud S, Törnblom H, Bengtsson U, Simrén M. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol. 2013;108(5):634-641.
- ↑ Serra J, Salvioli B, Azpiroz F, Malagelada JR. Lipid-induced intestinal gas retention in irritable bowel syndrome. Gastroenterology. 2002;123(3):700-706.
- ↑ Simrén M, Abrahamsson H, Björnsson ES. Lipid-induced colonic hypersensitivity in the irritable bowel syndrome: the role of bowel habit, sex, and psychologic factors. Clin Gastroenterol Hepatol. 2007;5(2):201-208.
- ↑ 81.0 81.1 81.2 Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021;18(2):101-116. doi:10.1038/s41575-020-00375-4
- ↑ Vanhauwaert E, Matthys C, Verdonck L, de Preter V. Low-residue and low-fiber diets in gastrointestinal disease management. Adv Nutr. 2015;6(6):820-827. doi:10.3945/AN.115.009688
- ↑ Valdés-Ramos R, Martnez-Carrillo BE, Aranda-González II, et al. Diet, exercise and gut mucosal immunity. Proc Nutr Soc. 2010;69(4):644-650. doi:10.1017/S0029665110002533
- ↑ Zhang C, Björkman A, Cai K, et al. Impact of a 3-Months Vegetarian Diet on the Gut Microbiota and Immune Repertoire. Front Immunol. 2018;9(APR). doi:10.3389/FIMMU.2018.00908
- ↑ Zimmerman MA, Singh N, Martin PM, et al. Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells. Am J Physiol Gastrointest Liver Physiol. 2012;302(12). doi:10.1152/AJPGI.00543.2011
- ↑ Folkerts J, Stadhouders R, Redegeld FA, et al. Effect of Dietary Fiber and Metabolites on Mast Cell Activation and Mast Cell-Associated Diseases. Front Immunol. 2018;9(MAY). doi:10.3389/FIMMU.2018.01067
- ↑ May CL, Kaestner KH. Gut endocrine cell development. Mol Cell Endocrinol. 2010;323(1):70-75. doi:10.1016/J.MCE.2009.12.009
- ↑ El-Salhy M. Irritable bowel syndrome: diagnosis and pathogenesis. World J Gastroenterol. 2012;18(37):5151-5163. doi:10.3748/WJG.V18.I37.5151
- ↑ Mazzawi T, El-Salhy M. Changes in small intestinal chromogranin A-immunoreactive cell densities in patients with irritable bowel syndrome after receiving dietary guidance. Int J Mol Med. 2016;37(5):1247-1253. doi:10.3892/IJMM.2016.2523
- ↑ Mazzawi T, Hausken T, Gundersen D, El-Salhy M. Dietary guidance normalizes large intestinal endocrine cell densities in patients with irritable bowel syndrome. Eur J Clin Nutr. 2016;70(2):175-181. doi:10.1038/EJCN.2015.191
- ↑ Mazzawi T, Gundersen D, Hausken T, El-Salhy M. Increased chromogranin a cell density in the large intestine of patients with irritable bowel syndrome after receiving dietary guidance. Gastroenterol Res Pract. 2015;2015. doi:10.1155/2015/823897
- ↑ Holzer P, Farzi A. Neuropeptides and the microbiota-gut-brain axis. Adv Exp Med Biol. 2014;817:196-219. doi:10.1007/978-1-4939-0897-4_9
- ↑ Cani PD, Everard A, Duparc T. Gut microbiota, enteroendocrine functions and metabolism. Curr Opin Pharmacol. 2013;13(6):935-940. doi:10.1016/J.COPH.2013.09.008
- ↑ Maljaars PWJ, Keszthelyi D, Masclee AAM. An ileal brake-through? Am J Clin Nutr. 2010;92(3):467-468. doi:10.3945/AJCN.2010.30180
- ↑ Van Citters GW, Lin HC. Ileal brake: neuropeptidergic control of intestinal transit. Curr Gastroenterol Rep. 2006;8(5):367-373. doi:10.1007/S11894-006-0021-9
- ↑ Singh R, Salem A, Nanavati J, Mullin GE. The Role of Diet in the Treatment of Irritable Bowel Syndrome: A Systematic Review. Gastroenterol Clin North Am. 2018;47(1):107-137. doi:10.1016/J.GTC.2017.10.003
- ↑ Ruepert L, Quartero AO, de Wit NJ, van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane database Syst Rev. 2011;2011(8). doi:10.1002/14651858.CD003460.PUB3
- ↑ 98.0 98.1 98.2 Ford AC, Harris LA, Lacy BE, Quigley EMM, Moayyedi P. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther. 2018;48(10):1044-1060. doi:10.1111/APT.15001
- ↑ Ooi SL, Correa D, Pak SC. Probiotics, prebiotics, and low FODMAP diet for irritable bowel syndrome - What is the current evidence? Complement Ther Med. 2019;43:73-80. doi:10.1016/J.CTIM.2019.01.010
- ↑ Moayyedi P, Quigley EMM, Lacy BE, et al. The effect of fiber supplementation on irritable bowel syndrome: a systematic review and meta-analysis. Am J Gastroenterol. 2014;109(9):1367-1374. doi:10.1038/AJG.2014.195
- ↑ Nagarajan N, Morden A, Bischof D, et al. The role of fiber supplementation in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2015;27(9):1002-1010. doi:10.1097/MEG.0000000000000425
- ↑ Brandt LJ, Chey WD, Foxx-Orenstein AE, et al. An evidence-based position statement on the management of irritable bowel syndrome. Am J Gastroenterol. 2009;104 Suppl 1(SUPPL. 1). doi:10.1038/AJG.2008.122
- ↑ Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783. doi:10.3748/WJG.V23.I21.3771
- ↑ El-Salhy M, Ystad SO, Mazzawi T, Gundersen D. Dietary fiber in irritable bowel syndrome (Review). Int J Mol Med. 2017;40(3):607-613. doi:10.3892/IJMM.2017.3072
- ↑ Moayyedi P, Andrews CN, MacQueen G, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29. doi:10.1093/JCAG/GWY071
- ↑ Gwee KA, Gonlachanvit S, Ghoshal UC, et al. Second Asian Consensus on Irritable Bowel Syndrome. J Neurogastroenterol Motil. 2019;25(3):343-362. doi:10.5056/JNM19041
- ↑ Axelrod CH, Saps M. The Role of Fiber in the Treatment of Functional Gastrointestinal Disorders in Children. Nutrients. 2018;10(11). doi:10.3390/NU10111650
- ↑ 108.0 108.1 108.2 Song KH, Jung HK, Kim HJ, et al. Clinical Practice Guidelines for Irritable Bowel Syndrome in Korea, 2017 Revised Edition. J Neurogastroenterol Motil. 2018;24(2):197-215. doi:10.5056/JNM17145
- ↑ Lacy BE, Pimentel M, Brenner DM, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44. doi:10.14309/ajg.0000000000001036
- ↑ McKenzie YA, Thompson J, Gulia P, Lomer MCE. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):576-592. doi:10.1111/jhn.12386
- ↑ Spiller R. Impact of diet on symptoms of the irritable bowel syndrome. Nutrients. 2021;13(2):1-19. doi:10.3390/nu13020575
- ↑ McRorie JW. Evidence-Based Approach to Fiber Supplements and Clinically Meaningful Health Benefits, Part 2: What to Look for and How to Recommend an Effective Fiber Therapy. Nutr Today. 2015;50(2):90-97. doi:10.1097/NT.0000000000000089
- ↑ Algera J, Colomier E, Simrén M. The dietary management of patients with irritable bowel syndrome: A narrative review of the existing and emerging evidence. Nutrients. 2019;11(9). doi:10.3390/nu11092162
- ↑ Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783.
- ↑ Miwa H. Life style in persons with functional gastrointestinal disorders--large-scale internet survey of lifestyle in Japan. Neurogastroenterol Motil. 2012;24(5):464-471. doi:10.1111/J.1365-2982.2011.01872.X
- ↑ Guo Y Bin, Zhuang KM, Kuang L, Zhan Q, Wang XF, Liu S De. Association between Diet and Lifestyle Habits and Irritable Bowel Syndrome: A Case-Control Study. Gut Liver. 2015;9(5):649-656. doi:10.5009/GNL13437
- ↑ MD Crowell, L J Cheskin, Musial F. Prevalence of gastrointestinal symptoms in obese and normal weight binge eaters. Am J Gastroenterol. 1994;89(3):387-391.
- ↑ Irritable bowel syndrome in adults: diagnosis and management Clinical guideline. 2008. www.nice.org.uk/guidance/cg61. Accessed April 10, 2022.
- ↑ McKenzie YA, Thompson J, Gulia P, Lomer MCE. British Dietetic Association systematic review of systematic reviews and evidence-based practice guidelines for the use of probiotics in the management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):576-592. doi:10.1111/jhn.12386
- ↑ 120.0 120.1 Review AUS, Lied GA. Probiotics in Irritable Bowel Syndrome : Nutrients. 2019;11(9):1-15.
- ↑ Lacy BE, Pimentel M, Brenner DM, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44. doi:10.14309/ajg.0000000000001036
- ↑ Hod K, Dekel R, Aviv Cohen N, et al. The effect of a multispecies probiotic on microbiota composition in a clinical trial of patients with diarrhea-predominant irritable bowel syndrome. Neurogastroenterol Motil. 2018;30(12). doi:10.1111/nmo.13456
- ↑ Connell M, Shin A, James-Stevenson T, Xu H, Imperiale TF, Herron J. Systematic review and meta-analysis: Efficacy of patented probiotic, VSL#3, in irritable bowel syndrome. Neurogastroenterol Motil. 2018;30(12). doi:10.1111/nmo.13427
- ↑ Staudacher HM, Lomer MCE, Anderson JL, et al. Fermentable Carbohydrate Restriction Reduces Luminal Bifidobacteria and Gastrointestinal Symptoms in Patients with Irritable Bowel Syndrome. J Nutr. 2012;142(8):1510-1518. doi:10.3945/jn.112.159285
- ↑ Halmos EP, Christophersen CT, Bird AR, Shepherd SJ, Gibson PR, Muir JG. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut. 2015;64(1):93-100. doi:10.1136/gutjnl-2014-307264
- ↑ Lenhart A, Dong T, Joshi S, et al. Effect of Exclusion Diets on Symptom Severity and the Gut Microbiota in Patients with Irritable Bowel Syndrome. Clin Gastroenterol Hepatol. 2021. doi:10.1016/j.cgh.2021.05.027
- ↑ Staudacher HM, Lomer MCE, Farquharson FM, et al. A Diet Low in FODMAPs Reduces Symptoms in Patients With Irritable Bowel Syndrome and A Probiotic Restores Bifidobacterium Species: A Randomized Controlled Trial. Gastroenterology. 2017;153(4):936-947. doi:10.1053/j.gastro.2017.06.010
- ↑ Löhr JM, Oliver MR, Frulloni L. Synopsis of recent guidelines on pancreatic exocrine insufficiency. United Eur Gastroenterol J. 2013;1(2):79-83. doi:10.1177/2050640613476500
- ↑ 129.0 129.1 129.2 Ianiro G, Pecere S, Giorgio V, Gasbarrini A, Cammarota G. Digestive Enzyme Supplementation in Gastrointestinal Diseases. Curr Drug Metab. 2016;17(2):187. doi:10.2174/138920021702160114150137
- ↑ Mario Roxas. The role of enzyme supplementation in digestive disordersNo Title. Altern Med Rev. 2008;13(4):307-314.
- ↑ Medow MS, Thek KD, Newman LJ, Berezin S, Glassman MS, Schwarz SM. Beta-galactosidase tablets in the treatment of lactose intolerance in pediatrics. Am J Dis Child. 1990;144(11):1261-1264. doi:10.1001/ARCHPEDI.1990.02150350093034
- ↑ Solomons NW, Guerrero AM, Torun B. Effective in vivo hydrolysis of milk lactose by beta-galactosidases in the presence of solid foods. Am J Clin Nutr. 1985;41(2):222-227. doi:10.1093/AJCN/41.2.222
- ↑ Misselwitz B, Butter M, Verbeke K, Fox MR. Update on lactose malabsorption and intolerance: pathogenesis, diagnosis and clinical management. Gut. 2019;68(11):2080-2091. doi:10.1136/GUTJNL-2019-318404
- ↑ Tuck CJ, Taylor KM, Gibson PR, Barrett JS, Muir JG. Increasing Symptoms in Irritable Bowel Symptoms With Ingestion of Galacto-Oligosaccharides Are Mitigated by α-Galactosidase Treatment. Am J Gastroenterol. 2018;113(1):124-134. doi:10.1038/AJG.2017.245
- ↑ Moayyedi P, Andrews CN, MacQueen G, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29. doi:10.1093/JCAG/GWY071
- ↑ Gwee KA, Gonlachanvit S, Ghoshal UC, et al. Second Asian Consensus on Irritable Bowel Syndrome. J Neurogastroenterol Motil. 2019;25(3):343-362. doi:10.5056/JNM19041
- ↑ 137.0 137.1 Cozma-Petrut A, Loghin F, Miere D, Dumitrascu DL. Diet in irritable bowel syndrome: What to recommend, not what to forbid to patients! World J Gastroenterol. 2017;23(21):3771-3783.
- ↑ Hawthorn M, Ferrante J, Luchowski E, Rutledge A, Wei XY, Triggle DJ. The actions of peppermint oil and menthol on calcium channel dependent processes in intestinal, neuronal and cardiac preparations. Aliment Pharmacol Ther. 1988;2(2):101-118. doi:10.1111/J.1365-2036.1988.TB00677.X
- ↑ Juergens U, M Stöber HV. The anti-inflammatory activity of L-menthol compared to mint oil in human monocytes in vitro: a novel perspective for its therapeutic use in inflammatory diseases. Eur J Med Res. 1998;16(3):539-545.
- ↑ Walstab J, Wohlfarth C, Hovius R, et al. Natural compounds boldine and menthol are antagonists of human 5-HT3 receptors: implications for treating gastrointestinal disorders. Neurogastroenterol Motil. 2014;26(6):810-820. doi:10.1111/NMO.12334
- ↑ Galeotti N, Di Cesare Mannelli L, Mazzanti G, Bartolini A, Ghelardini C. Menthol: a natural analgesic compound. Neurosci Lett. 2002;322(3):145-148. doi:10.1016/S0304-3940(01)02527-7
- ↑ Camilleri M, Boeckxstaens G. Dietary and pharmacological treatment of abdominal pain in IBS. Gut. 2017;66(5):966-974. doi:10.1136/GUTJNL-2016-313425
- ↑ Cappello G, Spezzaferro M, Grossi L, Manzoli L, Marzio L. Peppermint oil (Mintoil) in the treatment of irritable bowel syndrome: a prospective double blind placebo-controlled randomized trial. Dig Liver Dis. 2007;39(6):530-536. doi:10.1016/J.DLD.2007.02.006
- ↑ Kline RM, Kline JJ, Di Palma J, Barbero GJ. Enteric-coated, pH-dependent peppermint oil capsules for the treatment of irritable bowel syndrome in children. J Pediatr. 2001;138(1):125-128. doi:10.1067/MPD.2001.109606
- ↑ Weerts ZZRM, Masclee AAM, Witteman BJM, et al. Efficacy and Safety of Peppermint Oil in a Randomized, Double-Blind Trial of Patients With Irritable Bowel Syndrome. Gastroenterology. 2020;158(1):123-136. doi:10.1053/J.GASTRO.2019.08.026
- ↑ Khanna R, Macdonald JK, Levesque BG. Peppermint oil for the treatment of irritable bowel syndrome: a systematic review and meta-analysis. J Clin Gastroenterol. 2014;48(6):505-512. doi:10.1097/MCG.0B013E3182A88357
- ↑ Hawrelak JA, Wohlmuth H, Pattinson M, et al. Western herbal medicines in the treatment of irritable bowel syndrome: A systematic review and meta-analysis. Complement Ther Med. 2020;48. doi:10.1016/J.CTIM.2019.102233
- ↑ Moayyedi P, Andrews CN, MacQueen G, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29. doi:10.1093/JCAG/GWY071
- ↑ Defrees DN, Bailey J. Irritable Bowel Syndrome: Epidemiology, Pathophysiology, Diagnosis, and Treatment. Prim Care. 2017;44(4):655-671. doi:10.1016/J.POP.2017.07.009
המידע שבדף זה נכתב על ידי רוני ברוך, RD, M.Sc דיאטנית קלינית, המחלקה לתזונה ,המכון הגסטרואנטרולוגי מרכז רפואי תל אביב על שם סורסקי ותמר פפר גיק, RD, M.Sc דיאטנית קלינית, היחידה לתזונה, המערך לגסטרואנטרולוגיה בי"ח בילינסון מרכז רפואי רבין, דוקטורנטית אוניברסיטת תל אביב ושאר צוות כתיבת נייר העמדה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק