הבדלים בין גרסאות בדף "סרטן דרכי שתן מקומי מתקדם או גרורתי - טיפול באנפורטומאב ודוטין - Locally advanced or metastatic urinary tract cancer - treatment with enfortumab vedotin"
מ (Motyk העביר את הדף סרטן דרכי שתן מקומי מתקדם או גרורתי - טיפול באנפורטומאב ודוטין לשם סרטן דרכי שתן מקומי מתקדם או גרורתי - טיפול באנפורטומאב ודוטין - Locally advanced or metastatic urinary tract cancer - treatment with enfortumab vedotin) |
|||
| (14 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה=TransCellCaMark.png | |תמונה=TransCellCaMark.png | ||
|כיתוב תמונה=קרצינומה של תאי מעבר של שלפוחית השתן. הלבן בשלפוחית השתן הוא ניגוד. | |כיתוב תמונה=קרצינומה של תאי מעבר של שלפוחית השתן. הלבן בשלפוחית השתן הוא ניגוד. | ||
|שם עברי=Enfortumab vedotin לטיפול בסרטן דרכי שתן מקומי מתקדם או גרורתי | |שם עברי=Enfortumab vedotin לטיפול בסרטן דרכי שתן מקומי מתקדם או גרורתי | ||
| − | |שם לועזי= | + | |שם לועזי=Locally advanced or metastatic urinary tract cancer - treatment with Enfortumab vedotin |
| − | |שמות נוספים=PADCEV) Enfortumab vedotin) | + | |שמות נוספים=PADCEV) Enfortumab vedotin) לטיפול בסרטן דרכי שתן מקומי מתקדם או גרורתי |
|ICD-10= {{ICD10|C67}} | |ICD-10= {{ICD10|C67}} | ||
|ICD-9={{ICD9|188}} | |ICD-9={{ICD9|188}} | ||
| שורה 12: | שורה 11: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | על פי נתונים אפידמיולוגיים מישראל (עדכון לרישום לאומי של סרטן שלפוחית השתן, 1996 | + | {{הרחבה|סרטן במערכת השתן}} |
| + | על פי נתונים אפידמיולוגיים מישראל (עדכון לרישום לאומי של [[סרטן שלפוחית השתן]], 2018-1996){{כ}}{{הערה|שם=הערה1|https://www.health.gov.il/PublicationsFiles/bladder-cancer1996-2018.pdf}} סרטן שלפוחית השתן הוא החמישי בשכיחותו בישראל ושכיח יותר בגברים בהשוואה לנשים, בין היתר בשל הקשר החזק שבין [[עישון]] לבין היארעות המחלה. מחלה זו מופיעה לרוב בעשור השישי או השביעי לחיים. עישון ממושך הוא גורם הסיכון המשמעותי ביותר למחלה. בשנת 2019 אובחנו 1,791 חולים בסרטן שלפוחית השתן, מתוכם 51 אחוזים (918 חולים) עם סרטן חודרני (נתוני רישום סרטן לאומי לשנת 2019). בשנת 2018 נפטרו בישראל 401 חולים בשל סרטן שלפוחית השתן, 77 אחוזים מהם גברים. שיעור התמותה בגברים גבוה פי ארבעה ויותר בהשוואה לנשים. | ||
| − | שיעור | + | שיעור ההישרדות נמצא בקורלציה לשלב המחלה - שיעור התמותה עולה ככל שהסרטן מפושט יותר. בגילוי מוקדם של המחלה, ההישרדות לחמש שנים טובה - 96 אחוזים. בחולים עם סרטן דרכי שתן גרורתי (mUC{{כ}} - metastatic Urothelial Carcinoma), מהלך המחלה אלים הרבה יותר ושיעור התמותה עולה בצורה דרמטית. הישרדות חציונית היא כ-14 חודשים בלבד. שיעור הישרדות לחמש שנים בנוכחות גרורות מרוחקות עומד על 8.9 אחוזים על פי SEER{{כ}} (Surveillance, Epidemiology, and End Results) {{כ}}{{הערה|שם=הערה2|https://seer.cancer.gov/statfacts/html/urinb.html}}. |
==קו טיפול ראשון== | ==קו טיפול ראשון== | ||
| − | חולים אשר יכולים לקבל [[ציספלטין]] שורדים יותר. בחולים אלה, הטיפול הראשוני המועדף, המהווה סטנדרט עולמי, הוא טיפול כימותרפי המבוסס ציספלטין. הכימותרפיה | + | חולים אשר יכולים לקבל [[ציספלטין]] (Cisplatin) שורדים יותר. בחולים אלה, הטיפול הראשוני המועדף, המהווה סטנדרט עולמי, הוא טיפול כימותרפי המבוסס ציספלטין. הכימותרפיה הנזכרת למעלה ניתנת לרוב בארבעה עד שישה מחזורי טיפול{{הערה|שם=הערה3|Bladder cancer ESMO clinical practice guidelines for diagnosis, treatment and follow up. Powles T, et al. on behalf of the ESMO Guidelines Committee, Annals of Oncology (2021), doi: |
| − | https://doi.org/10.1016/j.annonc.2021.11.012}}. לאחר מכן היה נהוג להפסיק בטיפול ועם התקדמות המחלה לעבור לקו טיפול שני באימונותרפיה. בחולה שמחלתו לא התקדמה בטיפול בקו ראשון כימותרפי (Platinum based Chemotherapy), הסטנדרט הטיפולי המקובל הוא טיפול אחזקה עם אימונותרפיה [[Avelumab]]. | + | https://doi.org/10.1016/j.annonc.2021.11.012}}. לאחר מכן היה נהוג להפסיק בטיפול ועם התקדמות המחלה לעבור לקו טיפול שני באימונותרפיה. בחולה שמחלתו לא התקדמה בטיפול בקו ראשון כימותרפי (Platinum based Chemotherapy), הסטנדרט הטיפולי המקובל הוא טיפול אחזקה עם אימונותרפיה - [[Avelumab]]. |
==טיפול אחזקה עם Avelumab== | ==טיפול אחזקה עם Avelumab== | ||
| − | הטיפול | + | הטיפול ב-[[Avelumab]] שיפר משמעותית את הישרדות המטופלים שהיו בקבוצת הטיפול האחזקה לעומת טיפול תומך עד התקדמות, כאשר שיעור המטופלים ששרדו לאחר 30 חודשים היה 43 אחוזים בקבוצת ה-Avelumab לעומת 33 אחוזים בקבוצת הביקורת, עם הישרדות חציונית של 23.8 חודשים לעומת 15 חודשים. מחקר זה הוביל לאישור טיפול אחזקתי ב-Avelumab על ידי ה-FDA וגישה זאת אומצה כטיפול מקובל בסרטן כיס שתן גרורתי{{הערה|שם=הערה4|T. Powles, S.H. Park, E. Voog, C. Caserta, B.P. Valderrama. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2020; 383:1218-30. September 18, 2020.}}. |
| − | חולים בקו ראשון שאינם מתאימים לקבל ציספלטין הוגדרו כ-Cisplatin Ineligible. | + | חולים בקו ראשון שאינם מתאימים לקבל ציספלטין הוגדרו כ-Cisplatin Ineligible. כ-40 אחוזים עד 50 אחוזים מהחולים אינם יכולים לקבל טיפול בציספלטין לאור פוטנציאל תופעות הלוואי הגבוה שלה{{הערה|שם=הערה5|Galski et al. Treatment of Patients With Metastatic Urothelial Cancer "Unfit” for Cisplatin-Based Chemotherapy. J Clin Oncol 29:2432-2438. 2011 by American Society of Clinical Oncology}}. אופציות הטיפול עבורם הן: |
| − | #משלב [[Carboplatin]]-[[Gemcitabine]] - יעילות משלב זה הוכחה במחקר EORTC שבדק את יעילות משלבי קרבופלטין | + | #משלב [[Carboplatin]]-[[Gemcitabine]] (קרבופלטין-גמציטבין) - יעילות משלב זה הוכחה במחקר EORTC שבדק את יעילות משלבי קרבופלטין ב-238 חולים עם [[אי ספיקת כליות]] ודרגת תפקוד נמוכה. נמצאה תגובה של 40 אחוזים לטיפול. משלב קרבופלטין-גמציטבין נסבל טוב יותר מהאחרים והיה בעל יעילות דומה. יעילות זו נתמכת גם בעבודות אחרות. בעבודה פאזה 2 שבדקה יעילות המשלב קרבופלטין-גמציטבין נצפתה תגובה כוללת של 38 אחוזים, הזמן החציוני להתקדמות המחלה עמד על 5.8 חודשים וזמן ההישרדות החציוני עמד על 9.3 חודשים בלבד{{הערה|שם=הערה6|De Santis et al. Randomized Phase II/III Trial Assessing Gemcitabine/Carboplatin and Methotrexate/Carboplatin/Vinblastine in Patients with Advanced Urothelial Cancer Who Are Unfit for Cisplatin-Based Chemotherapy: EORTC. J Clin Oncol 30:191-199 2011}}{{הערה|שם=הערה7|Bamias Et al. The Combination of Gemcitabine and Carboplatin as First-Line Treatment in Patients with Advanced Urothelial Carcinoma. 2005 American Cancer Society DOI 10.1002/cncr.21604 Published online 7 December 2005}} |
| − | #תרופות מסוג מעכבי Programmed | + | #תרופות מסוג מעכבי (Programmed cell death ligand 1 - PDL1) - ההתוויה של משרד הבריאות לטיפול עם מעכבי PDL1 בקו ראשון בחולים עם סרטן גרורתי של דרכי השתן או מתקדם מקומית היא: |
| − | #*[[Pembrolizumab]] - למטופלים שאינם יכולים לקבל ציספלטין שהגידול מבטא רמות CPS מעל 10 או שאינם יכולים לקבל כל כימותרפיה מבוססת פלטינום ללא התייחסות לסטטוס CPS. התגובה לטיפול ב- | + | #*[[Pembrolizumab]] - למטופלים שאינם יכולים לקבל ציספלטין שהגידול מבטא רמות CPS מעל 10 או שאינם יכולים לקבל כל כימותרפיה מבוססת פלטינום ללא התייחסות לסטטוס CPS. התגובה לטיפול ב-Pembrolizumab בקו הראשון בחולים שלא יכלו לקבל ציספלטין, נבדקה במחקר 052-KENOTE. שיעור התגובה עמד על 29 אחוזים. שיעור התגובה החלקית עמד על 22 אחוזים, ושיעור התגובה המלאה עמד על 7 אחוזים{{הערה|שם=הערה8|Keytruda Spc MOH approved}} |
| − | #*[[Atezolizumab]] - למטופלים שאינם יכולים לקבל כימותרפיה מבוססת ציספטין והגידול שלהם מבטא רמות 5<PDL1. התגובה הכללית | + | #*[[Atezolizumab]] - למטופלים שאינם יכולים לקבל כימותרפיה מבוססת ציספטין והגידול שלהם מבטא רמות 5<PDL1. התגובה הכללית ל-Atezolizumab במחקר פאזה 2 (IMvigor210) הייתה 23 אחוזים, 6 אחוזים הגיבו תגובה מלאה ו-9 אחוזים תגובה חלקית |
#טיפולים אחרים - מחקרים קליניים, טיפול תומך{{הערה|שם=הערה9|Tecentric Spc MOH approved}} | #טיפולים אחרים - מחקרים קליניים, טיפול תומך{{הערה|שם=הערה9|Tecentric Spc MOH approved}} | ||
==התקדמות בגישה הטיפולית בקו הראשון== | ==התקדמות בגישה הטיפולית בקו הראשון== | ||
| − | + | ה-FDA אישר אופציה טיפולית נוספת לחולים אלה עם la/mUC שאינם יכולים לקבל כימותרפיה מבוססת על ציספלטין, הכולל משלב טיפולי בין ([[Enfortumab Vedotin]] + [[Pembrolizumab]]) (EV+P). | |
| − | |||
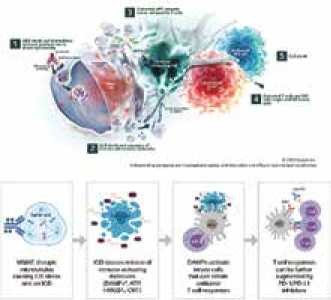
| − | קיים רציונל ביולוגי חזק שתומך בשילוב של | + | קיים רציונל ביולוגי חזק שתומך בשילוב של ADC {{כ}}(Antibody Drug Conjugate) עם אימונותרפיה כדי לשפר את תוצאות הטיפול. |
| − | ADCs מתקשרים עם תאים סרטניים ותאי מערכת החיסון על ידי יצירת מנגנונים כגון מוות של תאים אימונגניים, ציטוטוקסיות תלוית נוגדנים והפעלת תאים דנדריטיים, ובסופו של דבר מספקים סינרגיה פוטנציאלית עם | + | ADCs מתקשרים עם תאים סרטניים ותאי [[מערכת החיסון]] על ידי יצירת מנגנונים כגון מוות של תאים אימונגניים, ציטוטוקסיות תלוית [[נוגדנים]] והפעלת תאים דנדריטיים, ובסופו של דבר מספקים סינרגיה פוטנציאלית עם הטיפול האימונותרפי. הם מגבירים את החדירה של תאי ה-T למיקרו-סביבה של הגידול, בעוד שמעכבי מחסום חיסוני (Checkpoint Inhibitors), כדוגמת pembrolizumab, ממריצים מחדש תאי T מותשים. בכך משתפרת התגובה החיסונית האנטי-סרטנית{{הערה|שם=הערה10|Nicolo et al. Combining antibody-drug conjugates with immunotherapy in solid tumors: current landscape and future perspectives. Cancer Treatment Reviews. Volume 106, May 2022, 102395}}. |
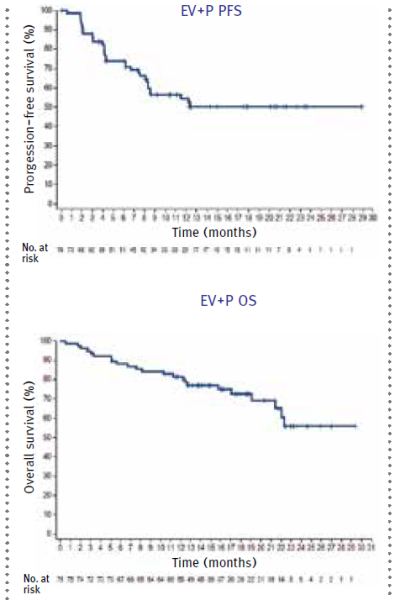
| − | יעילות הטיפול | + | יעילות הטיפול ב-EV+P בחולים שאינם יכולים לקבל ציספלטין נבדקה במחקר 103-EV. תוצאות מעודכנות של המחקר פורסמו בכנס ASCO{{כ}} (American Society of Clinical Oncology) ביוני 2022. במחקר השתתפו 151 חולים אשר טופלו באופן רנדומלי ב-EV+P{{כ}} (76 חולים) או EV{{כ}} (73 חולים). כעבור 12 חודשי טיפול: |
| + | |||
| + | 80 אחוזים מהחולים שקיבלו משלב EV+P היו בחיים; 55 אחוזים מהחולים שקיבלו משלב EV+P שרדו ללא התקדמות מחלה; 64 אחוזים מהחולים שקיבלו משלב EV+P הגיבו לטיפול. חציון הישרדות כללית, הישרדות ללא התקדמות ושיעור התגובה עדיין לא התקיימו בשלב זה של המחקר. נכון לחודש יולי 2023, המחקר ממשיך להתקיים{{הערה|שם=הערה11|Friedlander T et al. Poster Presentation at 2023 ASCO Annual Meeting; June 2-6, 2023; Abstract #4568}}. | ||
[[קובץ:Enfortumab 1.jpg|מרכז|400px]] | [[קובץ:Enfortumab 1.jpg|מרכז|400px]] | ||
==פרופיל הבטיחות של הטיפול== | ==פרופיל הבטיחות של הטיפול== | ||
| − | תופעות הלוואי השכיחות ביותר (הופיעו | + | תופעות הלוואי השכיחות ביותר (הופיעו ב-20 אחוזים מהחולים ומעלה) בחולים שקיבלו משלב EV+P היו: [[עייפות]], [[פריחה]], [[נוירופתיה פריפרית]], [[נשירת שיער]], [[ירידה במשקל]], [[גרד]], [[ירידה בתיאבון]], [[שלשולים]], [[בחילות]], [[אנמיה]], [[יובש בעיניים]] ו[[עור יבש]]; תופעות עוריות - 67 אחוזים; נוירופתיה פריפרית - 60 אחוזים; תופעות עיניות - 26 אחוזים; [[היפרגליקמיה]] - 14 אחוזים. תופעות לוואי חמורות הופיעו ב-23 אחוזים מהחולים שקיבלו EV+P וב-15 אחוזים מהחולים שקיבלו EV. |
| + | |||
| + | תופעות לוואי שהובילו למוות - דלקת ברקמת הריאה, אי ספיקה נשימתית, [[אלח דם]] (3.9 אחוזים בזרוע EV+P וב-2.7 אחוזים בזרוע EV). | ||
| − | בחודש מאי 2023 בוצע עדכון בהנחיות NCCN לטיפול בסרטן דרכי השתן. על סמך עדכון זה, הטיפול במשלב Enfortumab vedotin + Pembrolizumab הוא אופציה מועדפת בחולים עם סרטן מקומי מתקדם או גרורתי של דרכי השתן, אשר אינם יכולים לקבל כימותרפיה מבוססת | + | בחודש מאי 2023 בוצע עדכון בהנחיות NCCN{{כ}} (National Comprehensive Cancer Network) לטיפול בסרטן דרכי השתן. על סמך עדכון זה, הטיפול במשלב Enfortumab vedotin + Pembrolizumab הוא אופציה מועדפת בחולים עם סרטן מקומי מתקדם או גרורתי של דרכי השתן, אשר אינם יכולים לקבל כימותרפיה מבוססת ציספלטין כקו טיפול ראשון{{הערה|שם=הערה12|NCCN guidelines Bladder Cancer Version 3.23 - May 23. Available at bladder.pdf (nccn.org).}}. |
[[קובץ:EV P PFS1.png|מרכז|400px]] | [[קובץ:EV P PFS1.png|מרכז|400px]] | ||
| − | מחקר פאזה שלישית 302-EV התקיים אך טרם פורסמו תוצאותיו. המחקר הוא מחקר רנדומלי גלובלי רב מרכזי שבו נבדקת יעילות המשלב EV+P בחולים עם la/mUC אשר יכולים לקבל כימותרפיה מבוססת ציספלטין. המחקר התקיים גם | + | מחקר פאזה שלישית (302-EV) התקיים אך טרם פורסמו תוצאותיו. המחקר הוא מחקר רנדומלי גלובלי רב מרכזי שבו נבדקת יעילות המשלב EV+P בחולים עם la/mUC אשר יכולים לקבל כימותרפיה מבוססת ציספלטין. המחקר התקיים גם ב-11 מרכזים בישראל ותוצאותיו טרם פורסמו (נכון למאי 2023). משלב זה נבחן באופן רחב גם במספר מחקרים קליניים בשלבים טרום ניתוחיים. מרכזים רבים בישראל משתתפים במחקרים האלה. |
| + | |||
| + | [[קובץ:Enfortumab3.png|מרכז|400px]] | ||
==יעילות Enfortumab vedotin {{כ}}(EV) בחולים שנחשפו לשני קווי טיפול קודמים== | ==יעילות Enfortumab vedotin {{כ}}(EV) בחולים שנחשפו לשני קווי טיפול קודמים== | ||
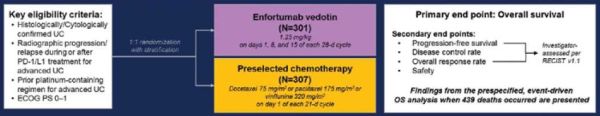
| − | מחקר 301-EV אשר בחן יעילות של Enfortumab vedotin היה ניסוי אקראי, שלב III מבוקר פתוח, שכלל מטופלים עם קרצינומה אורותליאלית מתקדמת מקומית או גרורתית שקיבלו כימותרפיה קודמת המבוססת על פלטינום והתקדמות מחלה במהלך או אחרי טיפול במעכבי PD-1/L1. המטופלים שגויסו חולקו באקראי באופן של 1:1 כדי לקבל 1.25 Enfortumab vedotin | + | מחקר 301-EV אשר בחן יעילות של Enfortumab vedotin היה ניסוי אקראי, שלב III מבוקר פתוח, שכלל מטופלים עם קרצינומה אורותליאלית מתקדמת מקומית או גרורתית שקיבלו כימותרפיה קודמת המבוססת על פלטינום והתקדמות מחלה במהלך או אחרי טיפול במעכבי PD-1/L1. המטופלים שגויסו חולקו באקראי באופן של 1:1 כדי לקבל 1.25 מיליגרם/קילוגרם של Enfortumab vedotin בימים 1, 8 ו-15 של כל מחזור של 28 יום, או כימותרפיה סטנדרטית שנבחרה על ידי החוקר, עם [[Docetaxel]] ,[[Paclitaxel]] או [[Vinflunine]]. |
| − | + | ||
| + | המטרה העיקרית של המחקר הייתה להוכיח את הארכת תוחלת החיים בקבוצה שקיבלה EV. המטרות המשניות של המחקר כללו את הערכת ה-PFS{{כ}} (Progression Free Survival) לפי RECIST v1.1, כמו גם בטיחות וסבילות. | ||
| + | |||
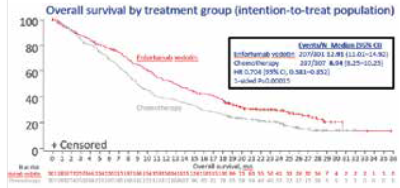
| + | המטופלים חולקו באקראי: 608 חולים עם UC מתקדם מקומי או גרורתי ל-n=301) EV) או כימותרפיה (307=n). נכון לנתונים מה-30 ביולי 2021, התרחשו 444 מקרי מוות (207 = EV, n; כימותרפיה, 237 = n). כבר באנליזה הסטטיסטית הראשונה המתוכננת מראש המחקר השיג את מטרתו ותוצאתו פורסמו בעיתון NEJM{{כ}} (New England Journal of Medicine){{כ}}{{הערה|שם=הערה13| Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. Thomas Powles, et al. N Engl J Med 2021; 384:1125-1135.}}. | ||
| + | |||
| + | בפרסום עדכני של המחקר ב-ASCO2022, עם מעקב חציוני של 23.75 חודשים, השרידות החציונית הייתה ארוכה משמעותית בקרב החולים שקיבלו EV (12.91 חודשים) בהשוואה לכימותרפיה (8.94 חודשים), הבדל של 3.97 חודשים. כמו כן, נראתה הפחתה של סיכויי התמותה ב-30 אחוזים (0.704=HR, Hazard Ratio). נתונים מעודכנים אלו למעשה מאשרים את נתוניו המקוריים של הפרסום הראשון ב-NEJM, עם שיפור של כ-10 אחוזים בהישרדות לשנתיים עבור חולים שטופלו ב-EV {{כ}}{{הערה|שם=הערה14|ASCO 2022: Long-Term Outcomes in EV-301: 24-Month Findings From the Phase 3 Trial of Enfortumab Vedotin Versus Chemotherapy in Patients With Previously Treated Advanced Urothelial Carcinoma. Presented by: Jonathan E. Rosenberg, MD}}. | ||
| + | |||
| + | [[קובץ:Enfortumab 4.jpg|מרכז|600px]] | ||
| + | |||
| + | |||
| + | בנוסף, היתרון בשרידות בקבוצת ה-EV נשמר ברוב תת-הקבוצות שצוינו מראש. חל שיפור גם בזמן להתקדמות המחלה (PFS) אשר השתפר באופן משמעותי עם EV (חציון 5.55 חודשים) לעומת כימותרפיה (חציון 3.71 חודשים) (0.632 = HR). | ||
| + | |||
| + | שיעור התגובה לטיפול היה גבוה, כאשר 40.6 אחוזים הגיבו לטיפול בזרוע המחקר לעומת 17.9 אחוזים בזרוע הכימותרפיה. התגובה לטיפול בדרך כלל היא מוקדמת ובמרבית החולים נצפתה כבר בהדמיה הראשונה, לאחר שמונה שבועות. | ||
| + | |||
| + | יתרה מכך, שיעורי תופעות הלוואי הקשורות לטיפול (TRAEs - Treatment Related Adverse Effects{{כ}}; 93.9 אחוזים לעומת 91.8 אחוזים), כולל TRAEs רציני (22.6 אחוזים לעומת 23.4 אחוזים), היו דומים בין זרועות הטיפול. TRAEs בדרגה גבוהה (דרגה 3) התרחשו ב-50 אחוזים מהחולים בשתי הקבוצות. תופעות הלוואי אינן חמורות בדרך כלל וכוללות פריחה מפושטת, נימול באצבעות (נוירופתיה פריפרית), עלייה בערכי הסוכר ובחילות{{הערה|שם=הערה14}}. תופעות אלו משתפרות עם הפסקת הטיפול. ניהול מקצועי והשגחה צמודה על המטופלים (במיוחד בשלושת החודשים הראשונים) מאפשרים זיהו מוקדם של תופעות הלוואי וטיפול יעיל בהם. | ||
| + | |||
| + | [[קובץ:Enfortumab 5.jpg|מרכז|400px]] | ||
| + | |||
| + | איכות החיים נשמרה במהלך הטיפול במחקר עם חולים שקיבלו Enfortumab vedotin. | ||
| + | |||
| + | לחולים שטופלו ב-Enfortumab vedotin הייתה הפחתה בתסמיני כאב בהשוואה לחולים שטופלו בכימותרפיה, אולם בחולים אלה נראתה ירידה משמעותית בתיאבון. בציוני התפקוד והסימפטומים, נראה שיפור מובהק סטטיסטית ברוב התחומים, עם שיפורים בעלי משמעות קלינית הגבוהים פי 1.6 עד פי 2.7{{הערה|שם=הערה15|ASCO 2021: Quality of Life, Functioning, and Symptoms in Patients with Previously Treated Locally Advanced or Metastatic Urothelial Carcinoma from EV-301: A Randomized Phase 3 Trial of Enfortumab Vedotin vs Chemotherapy. | ||
| + | Presented by: Ronac Mamtani, MD, MSCE Assistant Professor of Medicine at the Hospital of the University of Pennsylvania | ||
| + | }}. | ||
| + | |||
| + | [[קובץ:Enfortumab 6.jpg|מרכז|400px]] | ||
| − | + | עבודה של REAL WORLD DATA מ-23 מרכזים באירופה סיכמה את יעילות הטיפול ב-EV) Enfortumab Vedotin) ב-125 חולים. התוצאות היו דומות לתוצאות מניסויים קליניים של פאזה 3 לגבי הבטיחות והיעילות של טיפול זה{{הערה|שם=הערה16|Zschabitz S et al. Enfortumab Vedotin in Metastatic Urothelial Carcinoma: Survival and Safety in a European Multicenter Real-world Patient Cohort. Eur Urol Open Sci. 2023 May 17;53:31-37. doi: 10.1016/j.euros.2023.04.018. PMID: 37441344; PMCID: PMC10334227. }}. | |
| − | + | '''לסיכום''', Enfortumab Vedotin (EV) הוא טיפול יעיל ומאריך חיים תוך כדי שמירה על איכות החיים עבור מטופלים עם מחלה מסכנת חיים שמיצו את אפשרויות הטיפול הקיימות בקווים הקודמים. התרופה מציגה את יעילותה הרבה בקווים מוקדמים יותר של מחלה, במיוחד בשילוב עם אימונותרפיה (Pembrolizumab). צפויים פרסומים נוספים בנוגע ליעילות התרופה בקווים המוקדמים עם פוטנציאל להפוך ל-SOC{{כ}} (Standard Of Care) חדש. | |
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| שורה 65: | שורה 94: | ||
<center>'''פורסם ב[https://cdn.doctorsonly.co.il/2023/11/sal-2024.pdf חוברת סל בריאות 2024], עמוד 83'''</center> | <center>'''פורסם ב[https://cdn.doctorsonly.co.il/2023/11/sal-2024.pdf חוברת סל בריאות 2024], עמוד 83'''</center> | ||
| + | |||
| + | '''הכתבה בחסות חברת אסטלס פארמה ישראל בע"מ. הכותב מביע את דעתו באופן עצמאי. תוכן מאמר זה נועד לספק מידע קליני הרלוונטי לצורכי דיונים הנוגעים למימון ציבורי של התכשיר טרם האישור הרגולטורי של המוצר.''' | ||
[[קטגוריה:אונקולוגיה]] | [[קטגוריה:אונקולוגיה]] | ||
[[קטגוריה:אורולוגיה]] | [[קטגוריה:אורולוגיה]] | ||
| + | [[קטגוריה:פרמקולוגיה קלינית]] | ||
גרסה אחרונה מ־15:52, 25 בנובמבר 2024
| Enfortumab vedotin לטיפול בסרטן דרכי שתן מקומי מתקדם או גרורתי | ||
|---|---|---|
| Locally advanced or metastatic urinary tract cancer - treatment with Enfortumab vedotin | ||
| ||
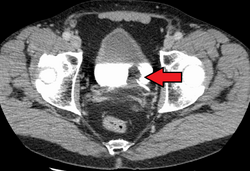
קרצינומה של תאי מעבר של שלפוחית השתן. הלבן בשלפוחית השתן הוא ניגוד.
| ||
| שמות נוספים | PADCEV) Enfortumab vedotin) לטיפול בסרטן דרכי שתן מקומי מתקדם או גרורתי | |
| ICD-10 | Chapter C67 {{{2}}}.{{{3}}} | |
| ICD-9 | 188 | |
| MeSH | D001749 | |
| יוצר הערך | ד"ר דוד סריד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן במערכת השתן
על פי נתונים אפידמיולוגיים מישראל (עדכון לרישום לאומי של סרטן שלפוחית השתן, 2018-1996)[1] סרטן שלפוחית השתן הוא החמישי בשכיחותו בישראל ושכיח יותר בגברים בהשוואה לנשים, בין היתר בשל הקשר החזק שבין עישון לבין היארעות המחלה. מחלה זו מופיעה לרוב בעשור השישי או השביעי לחיים. עישון ממושך הוא גורם הסיכון המשמעותי ביותר למחלה. בשנת 2019 אובחנו 1,791 חולים בסרטן שלפוחית השתן, מתוכם 51 אחוזים (918 חולים) עם סרטן חודרני (נתוני רישום סרטן לאומי לשנת 2019). בשנת 2018 נפטרו בישראל 401 חולים בשל סרטן שלפוחית השתן, 77 אחוזים מהם גברים. שיעור התמותה בגברים גבוה פי ארבעה ויותר בהשוואה לנשים.
שיעור ההישרדות נמצא בקורלציה לשלב המחלה - שיעור התמותה עולה ככל שהסרטן מפושט יותר. בגילוי מוקדם של המחלה, ההישרדות לחמש שנים טובה - 96 אחוזים. בחולים עם סרטן דרכי שתן גרורתי (mUC - metastatic Urothelial Carcinoma), מהלך המחלה אלים הרבה יותר ושיעור התמותה עולה בצורה דרמטית. הישרדות חציונית היא כ-14 חודשים בלבד. שיעור הישרדות לחמש שנים בנוכחות גרורות מרוחקות עומד על 8.9 אחוזים על פי SEER (Surveillance, Epidemiology, and End Results) [2].
קו טיפול ראשון
חולים אשר יכולים לקבל ציספלטין (Cisplatin) שורדים יותר. בחולים אלה, הטיפול הראשוני המועדף, המהווה סטנדרט עולמי, הוא טיפול כימותרפי המבוסס ציספלטין. הכימותרפיה הנזכרת למעלה ניתנת לרוב בארבעה עד שישה מחזורי טיפול[3]. לאחר מכן היה נהוג להפסיק בטיפול ועם התקדמות המחלה לעבור לקו טיפול שני באימונותרפיה. בחולה שמחלתו לא התקדמה בטיפול בקו ראשון כימותרפי (Platinum based Chemotherapy), הסטנדרט הטיפולי המקובל הוא טיפול אחזקה עם אימונותרפיה - Avelumab.
טיפול אחזקה עם Avelumab
הטיפול ב-Avelumab שיפר משמעותית את הישרדות המטופלים שהיו בקבוצת הטיפול האחזקה לעומת טיפול תומך עד התקדמות, כאשר שיעור המטופלים ששרדו לאחר 30 חודשים היה 43 אחוזים בקבוצת ה-Avelumab לעומת 33 אחוזים בקבוצת הביקורת, עם הישרדות חציונית של 23.8 חודשים לעומת 15 חודשים. מחקר זה הוביל לאישור טיפול אחזקתי ב-Avelumab על ידי ה-FDA וגישה זאת אומצה כטיפול מקובל בסרטן כיס שתן גרורתי[4].
חולים בקו ראשון שאינם מתאימים לקבל ציספלטין הוגדרו כ-Cisplatin Ineligible. כ-40 אחוזים עד 50 אחוזים מהחולים אינם יכולים לקבל טיפול בציספלטין לאור פוטנציאל תופעות הלוואי הגבוה שלה[5]. אופציות הטיפול עבורם הן:
- משלב Carboplatin-Gemcitabine (קרבופלטין-גמציטבין) - יעילות משלב זה הוכחה במחקר EORTC שבדק את יעילות משלבי קרבופלטין ב-238 חולים עם אי ספיקת כליות ודרגת תפקוד נמוכה. נמצאה תגובה של 40 אחוזים לטיפול. משלב קרבופלטין-גמציטבין נסבל טוב יותר מהאחרים והיה בעל יעילות דומה. יעילות זו נתמכת גם בעבודות אחרות. בעבודה פאזה 2 שבדקה יעילות המשלב קרבופלטין-גמציטבין נצפתה תגובה כוללת של 38 אחוזים, הזמן החציוני להתקדמות המחלה עמד על 5.8 חודשים וזמן ההישרדות החציוני עמד על 9.3 חודשים בלבד[6][7]
- תרופות מסוג מעכבי (Programmed cell death ligand 1 - PDL1) - ההתוויה של משרד הבריאות לטיפול עם מעכבי PDL1 בקו ראשון בחולים עם סרטן גרורתי של דרכי השתן או מתקדם מקומית היא:
- Pembrolizumab - למטופלים שאינם יכולים לקבל ציספלטין שהגידול מבטא רמות CPS מעל 10 או שאינם יכולים לקבל כל כימותרפיה מבוססת פלטינום ללא התייחסות לסטטוס CPS. התגובה לטיפול ב-Pembrolizumab בקו הראשון בחולים שלא יכלו לקבל ציספלטין, נבדקה במחקר 052-KENOTE. שיעור התגובה עמד על 29 אחוזים. שיעור התגובה החלקית עמד על 22 אחוזים, ושיעור התגובה המלאה עמד על 7 אחוזים[8]
- Atezolizumab - למטופלים שאינם יכולים לקבל כימותרפיה מבוססת ציספטין והגידול שלהם מבטא רמות 5<PDL1. התגובה הכללית ל-Atezolizumab במחקר פאזה 2 (IMvigor210) הייתה 23 אחוזים, 6 אחוזים הגיבו תגובה מלאה ו-9 אחוזים תגובה חלקית
- טיפולים אחרים - מחקרים קליניים, טיפול תומך[9]
התקדמות בגישה הטיפולית בקו הראשון
ה-FDA אישר אופציה טיפולית נוספת לחולים אלה עם la/mUC שאינם יכולים לקבל כימותרפיה מבוססת על ציספלטין, הכולל משלב טיפולי בין (Enfortumab Vedotin + Pembrolizumab) (EV+P).
קיים רציונל ביולוגי חזק שתומך בשילוב של ADC (Antibody Drug Conjugate) עם אימונותרפיה כדי לשפר את תוצאות הטיפול.
ADCs מתקשרים עם תאים סרטניים ותאי מערכת החיסון על ידי יצירת מנגנונים כגון מוות של תאים אימונגניים, ציטוטוקסיות תלוית נוגדנים והפעלת תאים דנדריטיים, ובסופו של דבר מספקים סינרגיה פוטנציאלית עם הטיפול האימונותרפי. הם מגבירים את החדירה של תאי ה-T למיקרו-סביבה של הגידול, בעוד שמעכבי מחסום חיסוני (Checkpoint Inhibitors), כדוגמת pembrolizumab, ממריצים מחדש תאי T מותשים. בכך משתפרת התגובה החיסונית האנטי-סרטנית[10].
יעילות הטיפול ב-EV+P בחולים שאינם יכולים לקבל ציספלטין נבדקה במחקר 103-EV. תוצאות מעודכנות של המחקר פורסמו בכנס ASCO (American Society of Clinical Oncology) ביוני 2022. במחקר השתתפו 151 חולים אשר טופלו באופן רנדומלי ב-EV+P (76 חולים) או EV (73 חולים). כעבור 12 חודשי טיפול:
80 אחוזים מהחולים שקיבלו משלב EV+P היו בחיים; 55 אחוזים מהחולים שקיבלו משלב EV+P שרדו ללא התקדמות מחלה; 64 אחוזים מהחולים שקיבלו משלב EV+P הגיבו לטיפול. חציון הישרדות כללית, הישרדות ללא התקדמות ושיעור התגובה עדיין לא התקיימו בשלב זה של המחקר. נכון לחודש יולי 2023, המחקר ממשיך להתקיים[11].
פרופיל הבטיחות של הטיפול
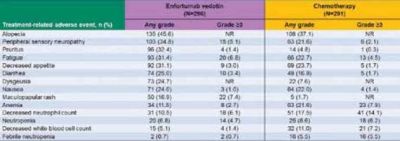
תופעות הלוואי השכיחות ביותר (הופיעו ב-20 אחוזים מהחולים ומעלה) בחולים שקיבלו משלב EV+P היו: עייפות, פריחה, נוירופתיה פריפרית, נשירת שיער, ירידה במשקל, גרד, ירידה בתיאבון, שלשולים, בחילות, אנמיה, יובש בעיניים ועור יבש; תופעות עוריות - 67 אחוזים; נוירופתיה פריפרית - 60 אחוזים; תופעות עיניות - 26 אחוזים; היפרגליקמיה - 14 אחוזים. תופעות לוואי חמורות הופיעו ב-23 אחוזים מהחולים שקיבלו EV+P וב-15 אחוזים מהחולים שקיבלו EV.
תופעות לוואי שהובילו למוות - דלקת ברקמת הריאה, אי ספיקה נשימתית, אלח דם (3.9 אחוזים בזרוע EV+P וב-2.7 אחוזים בזרוע EV).
בחודש מאי 2023 בוצע עדכון בהנחיות NCCN (National Comprehensive Cancer Network) לטיפול בסרטן דרכי השתן. על סמך עדכון זה, הטיפול במשלב Enfortumab vedotin + Pembrolizumab הוא אופציה מועדפת בחולים עם סרטן מקומי מתקדם או גרורתי של דרכי השתן, אשר אינם יכולים לקבל כימותרפיה מבוססת ציספלטין כקו טיפול ראשון[12].
מחקר פאזה שלישית (302-EV) התקיים אך טרם פורסמו תוצאותיו. המחקר הוא מחקר רנדומלי גלובלי רב מרכזי שבו נבדקת יעילות המשלב EV+P בחולים עם la/mUC אשר יכולים לקבל כימותרפיה מבוססת ציספלטין. המחקר התקיים גם ב-11 מרכזים בישראל ותוצאותיו טרם פורסמו (נכון למאי 2023). משלב זה נבחן באופן רחב גם במספר מחקרים קליניים בשלבים טרום ניתוחיים. מרכזים רבים בישראל משתתפים במחקרים האלה.
יעילות Enfortumab vedotin (EV) בחולים שנחשפו לשני קווי טיפול קודמים
מחקר 301-EV אשר בחן יעילות של Enfortumab vedotin היה ניסוי אקראי, שלב III מבוקר פתוח, שכלל מטופלים עם קרצינומה אורותליאלית מתקדמת מקומית או גרורתית שקיבלו כימותרפיה קודמת המבוססת על פלטינום והתקדמות מחלה במהלך או אחרי טיפול במעכבי PD-1/L1. המטופלים שגויסו חולקו באקראי באופן של 1:1 כדי לקבל 1.25 מיליגרם/קילוגרם של Enfortumab vedotin בימים 1, 8 ו-15 של כל מחזור של 28 יום, או כימותרפיה סטנדרטית שנבחרה על ידי החוקר, עם Docetaxel ,Paclitaxel או Vinflunine.
המטרה העיקרית של המחקר הייתה להוכיח את הארכת תוחלת החיים בקבוצה שקיבלה EV. המטרות המשניות של המחקר כללו את הערכת ה-PFS (Progression Free Survival) לפי RECIST v1.1, כמו גם בטיחות וסבילות.
המטופלים חולקו באקראי: 608 חולים עם UC מתקדם מקומי או גרורתי ל-n=301) EV) או כימותרפיה (307=n). נכון לנתונים מה-30 ביולי 2021, התרחשו 444 מקרי מוות (207 = EV, n; כימותרפיה, 237 = n). כבר באנליזה הסטטיסטית הראשונה המתוכננת מראש המחקר השיג את מטרתו ותוצאתו פורסמו בעיתון NEJM (New England Journal of Medicine)[13].
בפרסום עדכני של המחקר ב-ASCO2022, עם מעקב חציוני של 23.75 חודשים, השרידות החציונית הייתה ארוכה משמעותית בקרב החולים שקיבלו EV (12.91 חודשים) בהשוואה לכימותרפיה (8.94 חודשים), הבדל של 3.97 חודשים. כמו כן, נראתה הפחתה של סיכויי התמותה ב-30 אחוזים (0.704=HR, Hazard Ratio). נתונים מעודכנים אלו למעשה מאשרים את נתוניו המקוריים של הפרסום הראשון ב-NEJM, עם שיפור של כ-10 אחוזים בהישרדות לשנתיים עבור חולים שטופלו ב-EV [14].
בנוסף, היתרון בשרידות בקבוצת ה-EV נשמר ברוב תת-הקבוצות שצוינו מראש. חל שיפור גם בזמן להתקדמות המחלה (PFS) אשר השתפר באופן משמעותי עם EV (חציון 5.55 חודשים) לעומת כימותרפיה (חציון 3.71 חודשים) (0.632 = HR).
שיעור התגובה לטיפול היה גבוה, כאשר 40.6 אחוזים הגיבו לטיפול בזרוע המחקר לעומת 17.9 אחוזים בזרוע הכימותרפיה. התגובה לטיפול בדרך כלל היא מוקדמת ובמרבית החולים נצפתה כבר בהדמיה הראשונה, לאחר שמונה שבועות.
יתרה מכך, שיעורי תופעות הלוואי הקשורות לטיפול (TRAEs - Treatment Related Adverse Effects; 93.9 אחוזים לעומת 91.8 אחוזים), כולל TRAEs רציני (22.6 אחוזים לעומת 23.4 אחוזים), היו דומים בין זרועות הטיפול. TRAEs בדרגה גבוהה (דרגה 3) התרחשו ב-50 אחוזים מהחולים בשתי הקבוצות. תופעות הלוואי אינן חמורות בדרך כלל וכוללות פריחה מפושטת, נימול באצבעות (נוירופתיה פריפרית), עלייה בערכי הסוכר ובחילות[14]. תופעות אלו משתפרות עם הפסקת הטיפול. ניהול מקצועי והשגחה צמודה על המטופלים (במיוחד בשלושת החודשים הראשונים) מאפשרים זיהו מוקדם של תופעות הלוואי וטיפול יעיל בהם.
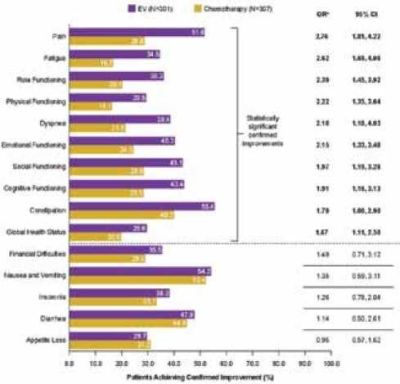
איכות החיים נשמרה במהלך הטיפול במחקר עם חולים שקיבלו Enfortumab vedotin.
לחולים שטופלו ב-Enfortumab vedotin הייתה הפחתה בתסמיני כאב בהשוואה לחולים שטופלו בכימותרפיה, אולם בחולים אלה נראתה ירידה משמעותית בתיאבון. בציוני התפקוד והסימפטומים, נראה שיפור מובהק סטטיסטית ברוב התחומים, עם שיפורים בעלי משמעות קלינית הגבוהים פי 1.6 עד פי 2.7[15].
עבודה של REAL WORLD DATA מ-23 מרכזים באירופה סיכמה את יעילות הטיפול ב-EV) Enfortumab Vedotin) ב-125 חולים. התוצאות היו דומות לתוצאות מניסויים קליניים של פאזה 3 לגבי הבטיחות והיעילות של טיפול זה[16].
לסיכום, Enfortumab Vedotin (EV) הוא טיפול יעיל ומאריך חיים תוך כדי שמירה על איכות החיים עבור מטופלים עם מחלה מסכנת חיים שמיצו את אפשרויות הטיפול הקיימות בקווים הקודמים. התרופה מציגה את יעילותה הרבה בקווים מוקדמים יותר של מחלה, במיוחד בשילוב עם אימונותרפיה (Pembrolizumab). צפויים פרסומים נוספים בנוגע ליעילות התרופה בקווים המוקדמים עם פוטנציאל להפוך ל-SOC (Standard Of Care) חדש.
ביבליוגרפיה
- ↑ https://www.health.gov.il/PublicationsFiles/bladder-cancer1996-2018.pdf
- ↑ https://seer.cancer.gov/statfacts/html/urinb.html
- ↑ Bladder cancer ESMO clinical practice guidelines for diagnosis, treatment and follow up. Powles T, et al. on behalf of the ESMO Guidelines Committee, Annals of Oncology (2021), doi: https://doi.org/10.1016/j.annonc.2021.11.012
- ↑ T. Powles, S.H. Park, E. Voog, C. Caserta, B.P. Valderrama. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2020; 383:1218-30. September 18, 2020.
- ↑ Galski et al. Treatment of Patients With Metastatic Urothelial Cancer "Unfit” for Cisplatin-Based Chemotherapy. J Clin Oncol 29:2432-2438. 2011 by American Society of Clinical Oncology
- ↑ De Santis et al. Randomized Phase II/III Trial Assessing Gemcitabine/Carboplatin and Methotrexate/Carboplatin/Vinblastine in Patients with Advanced Urothelial Cancer Who Are Unfit for Cisplatin-Based Chemotherapy: EORTC. J Clin Oncol 30:191-199 2011
- ↑ Bamias Et al. The Combination of Gemcitabine and Carboplatin as First-Line Treatment in Patients with Advanced Urothelial Carcinoma. 2005 American Cancer Society DOI 10.1002/cncr.21604 Published online 7 December 2005
- ↑ Keytruda Spc MOH approved
- ↑ Tecentric Spc MOH approved
- ↑ Nicolo et al. Combining antibody-drug conjugates with immunotherapy in solid tumors: current landscape and future perspectives. Cancer Treatment Reviews. Volume 106, May 2022, 102395
- ↑ Friedlander T et al. Poster Presentation at 2023 ASCO Annual Meeting; June 2-6, 2023; Abstract #4568
- ↑ NCCN guidelines Bladder Cancer Version 3.23 - May 23. Available at bladder.pdf (nccn.org).
- ↑ Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. Thomas Powles, et al. N Engl J Med 2021; 384:1125-1135.
- ↑ 14.0 14.1 ASCO 2022: Long-Term Outcomes in EV-301: 24-Month Findings From the Phase 3 Trial of Enfortumab Vedotin Versus Chemotherapy in Patients With Previously Treated Advanced Urothelial Carcinoma. Presented by: Jonathan E. Rosenberg, MD
- ↑ ASCO 2021: Quality of Life, Functioning, and Symptoms in Patients with Previously Treated Locally Advanced or Metastatic Urothelial Carcinoma from EV-301: A Randomized Phase 3 Trial of Enfortumab Vedotin vs Chemotherapy. Presented by: Ronac Mamtani, MD, MSCE Assistant Professor of Medicine at the Hospital of the University of Pennsylvania
- ↑ Zschabitz S et al. Enfortumab Vedotin in Metastatic Urothelial Carcinoma: Survival and Safety in a European Multicenter Real-world Patient Cohort. Eur Urol Open Sci. 2023 May 17;53:31-37. doi: 10.1016/j.euros.2023.04.018. PMID: 37441344; PMCID: PMC10334227.
המידע שבדף זה נכתב על ידי ד"ר דוד סריד, מנהל תחום אורולוגיה אונקולוגית במערך האונקולוגי, המרכז הרפואי איכילוב-תל אביב
הכתבה בחסות חברת אסטלס פארמה ישראל בע"מ. הכותב מביע את דעתו באופן עצמאי. תוכן מאמר זה נועד לספק מידע קליני הרלוונטי לצורכי דיונים הנוגעים למימון ציבורי של התכשיר טרם האישור הרגולטורי של המוצר.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק