הבדלים בין גרסאות בדף "Orosomucoid"
| שורה 38: | שורה 38: | ||
[[קובץ:ORM2.gif|מרכז|500 פיקסלים]] | [[קובץ:ORM2.gif|מרכז|500 פיקסלים]] | ||
| + | |||
| + | |||
| + | יתרה מכך, סוכר הקצה של השרשרות הסוכריות ב-ORM הוא חומצה סיאלית או N-acetyl-neuraminic acid , מהווה 10-12% מכלל הסוכרים במולקולה, ובגלל מטענו השלילי מתקבלת הנקודה האיזואלקטרית הנמוכה של המולקולה. סוכר טרמינאלי זה יכול להיות קשור בקשרי α2-3 או α2-6 לסוכר galactose. גם הסוכר fucose הוא סוכר קצה ב-ORM, שיכול להיות קשור בקשר α1-3 לסוכר GlcNAc. התגלו 12-20 גליקופורמים של ORM בנסיוב תקין, אם כי במצבים פתולוגיים יש עדיפות להופעת גליקאנים עם מבנה של שרשרת סוכרית דו-אנטנארית, שניתן לגלותם לדוגמה בשלב המוקדם של ריאקציית acute phase. נמצא שהציטוקינים IL-1, IL-6 ו-TNF-α וכן גלוקו-קורטיקואידים קשורים למודיפיקציות אלו במבנה הסוכרי של ORM {{כ}}(Van Dijk ב-Glycoconj J משנת 1995). השינויים בגליקוזילציה של מולקולת ORM אינם מוגבלים רק למצבים חריפים של דלקת, אלא מופיעים במגוון של מצבים פתו-פיזיולוגיים כמו הריון, דלקת מפרקים שגרונית חמורה, צמקת כבד מאלכוהוליזם, והפאטיטיס (Biou וחב' ב-Clin Chim Acta משנת 1991). | ||
| + | |||
| + | ==הפעילות הביולוגית של ORM== | ||
| + | תכונות ביולוגיות רבות יוחסו ל-ORM על ידי Kremer וחב' ב-Pharmacol Rev משנת 1988: ההגנה שהוא מעניק כנגד ספסיס נאונטלי, האינטראקציה שלו עם פוספוליפידים בממברנה, יכולתו לקשור היסטמין, כמו גם לעכב צימות טסיות, כימוטקסיס של ניטרופילים, יצירת סופר-אוקסידים, והשפעתו על שגשוג לימפוציטים. ORM נחשב כגורם טבעי נוגד-דלקות ואימונו-מודולטורי בעיקר בהקשר של פעילות נוגדת המשלים (complement) והאנטי-ניטרופילית (Williams וחב' ב-Am J Physiol משנת 1997). ואמנם, הודגם הן in-vitro כמו גם in vivoש-ORM היא מולקולה אימונו-מודולטורית: In vitro, ORM מעכב שפעול ניטרופילים (Vasson וחב' ב-Clin Chim Acta משנת 1994) ומגביר את ההפרשה של מעכב IL-1 על ידי מקרופאגים בעכבר [שהוא כנראה אנטגוניסט של הקולטן ל-IL-1 (Tilg וחב' ב-J Exp Med משנת 1993), וכמו כן מאפנן את הפרשת ציטוקינים המושרית על ידי ליפופוליסכרידים (LPS) (Boutten וחב' ב-Eur J Immunol משנת 1992). מאוחר יותר הודגם ש-ORM מגיב באופן ישיר עם LPS (Moore וחב' ב-Inflammation משנת 1997). מחקרים in vitro עם מונוציטים מאדם, הראו שהפרשת TNF-α המושרית על ידי ORM תלויה בשפעול של האנזים טירוזין קינאזה (Su וחב' ב-Immunopharmacol משנת 1999). כמו כן הוצע ש-ORM דרוש לשמור על חדירותן של קפילרות כנראה על ידי הגברת הסלקטיביות של המטען הפולי-אניוני במחסום האנדותליאלי (Curry וחב' ב-Am J Physiol משנת 1989). | ||
| + | |||
| + | In vivo, עירוי של ORM נמצא מגן על עכברים מפני הפאטיטיס וכן מפני הלם קטלני המושרה על ידי TNF-α (Libert וחב' ב-J Exp Med משנת 1994). עלתה השערה שפעילות עיכוב צימות הטסיות והיכולת של ORM לעכב כמוטקסיס של ניטרופילים ולעכב מטבוליזם חמצוני, עומדים בבסיס פעילויותיו המגוננות (Costello וחב' ב-Nature משנת 1979). כן נמצא ש-ORM מעכב באופן ספציפי אפופטוזיס המושרה על ידיTNF-α בעכברים, אך נראה שההגנה שמעניק ORM לתאים פועלת על ידי מנגנון בלתי-ישיר, שכן in vitro ORM נכשל בהגנה על תאי הפאטומה אנושיים, מפני אפופטוזיס המושרה בתאים אלה על ידי TNF-α בשילוב עם אקטינומיצין D (Van Molle וחב' ב-J Immunol משנת 1997). | ||
| + | |||
| + | הפעילות האימונו-מודולטורית של ORM נמצאה תלויה בדרגת הגליקוזילציה שלו. לדוגמה, העיכוב של שגשוג לימפוציטים תלוי בדרגת ההסתעפות של השרשרות הסוכריות של ORM (Pos וחב' ב-Inflammation משנת 1990), ועיכוב צימות הטסיות מוגבר כאשר מולקולת ORM עוברת דה-סיאליזציה. הדגמה נוספת של חשיבות השרשרות הסוכריות של ORM לפעילותו הביולוגית, מוצאים בנתון הבא: ORM עם מבנה סוכרי של sialyl Lewis X הנוצר במהלך דלקת, משדרג את הנזקים הנגרמים על ידי המשלים וכן על ידי ניטרופילים , ואילו ORM ללא המבנה הסוכרי של sialyl Lewis X אינו פועל באופן דומה (De Graaf וחב' ב-J Exp Med משנת 1993). כידוע, sialyl Lewis X הוא הליגנד אליו נקשרות מולקולות הספיחה E-selectin ו-P-selectin בתהליכי הספיחה של ניטרופילים, מונוציטים או תאי T לתאי האנדותל או לטסיות במצבי דלקת (Lasky ב-Science משנת 1992). | ||
| + | |||
| + | בשיטת surface plasmon resonance spectroscopy נמצא ש-ORM מאנשים עם דלקת חריפה, בו יש תכולה גבוהה של sialyl Lewis X, משמש כליגנד ספציפי למולקולה כימרית של E-selectin-IgG. נמצא שאוליגו-סככרידים עם סיאליזציה מלאה הגנו כנגד נזק לריאות בחולדות in vivo (Mulligan וחב' ב- J Exp Medמשנת 1993). נראה אם כן, שהגדלת החלק של sialyl Lewis X המושרה על ידי מצבי דלקת בקומפלקס הגליקני של ORM, מייצגת מנגנון של עיכוב על ידי משוב-חוזר של חדירת גרנולוציטים לתוך הרקמות הדלקתיות. במקובץ, נתונים אלה מראים שהשרשרות הסוכריות של ORM הן בעלת תפקיד קריטי בפעילויות האימונו-מודולטוריות של גליקופרוטאין זה. | ||
גרסה מ־12:13, 15 ביוני 2017
| מדריך בדיקות מעבדה | |
| Orosomucoid | |
|---|---|
| שמות אחרים | ORM ;AGP1 ;AGP-A ;HEL-S-153w ,α-1-acid glycoprotein |
| מעבדה | כימיה בדם |
| תחום | חלבון acute phase הפעיל במצבי דלקת ומודולציה של התגובה החיסונית |
| טווח ערכים תקין | בגברים בטווח הגילים 5-50 שנה-0.6-1.2 גרם /ליטר, בנשים באותו טווח גילים-0.4-1.0 גרם/ליטר. מעל גיל 50 שנה ערכי ORM בגברים ובנשים-0.8-1.2 גרם/ליטר. בילדים מתחת גיל שנה הערכים נמוכים יותר |
| יוצר הערך | פרופ' בן-עמי סלע |
- מטרת הבדיקה
רמת ORM משמשת לאבחון וניטור של מחלות מעי דלקתיות, והערכה של מחלת קרוהן, בעיקר בשלביה המוקדמים. רמות מוגברות של ORM כרוכות בתגובת acute phase לדלקת, זיהומים, נזק רקמתי וממאירות, כאשר רמות מופחתות של ORM מופיעות במהלך היריון ומחלת כבד כרונית.
החלבון ORM
החלבון ORM התגלה בעת ובעונה אחת על ידי Schmid במחצית המאה הקודמת (J Am Chem Soc משנת 1950), ו-Winzler וחב' ב-J Biol Chem משנת 1950). התברר עד מהרה שמדובר בחלבון מאוד בלתי רגיל הן בנקודה האיזואלקטרית המאוד נמוכה שלו (pI 2.8-3.8) וכן בשל האחוז המאוד גבוה של סוכרים המהווה 45% מכלל המולקולה. משך 30 שנה נחשב ORM כגליקופרוטאין עם אחוז הסוכר הגבוה ביותר, עד לגילויו בשנות ה-80 של ה-galactoglycoprotein המכיל 76% סוכר (Schmid וחב' ב-J Biol Chem משנת 1980). למרות מחקרים לא מעטים על ORM במשך למעלה מ-60 שנה, תפקידו הביולוגי אפוף סימני שאלה. יחד עם זאת, מספר פעילויות פיזיולוגיות פוטנציאליות יוחסו ל-ORM כגון מספר השפעות אימונו-מודולטוריות, יכולתו לקשור תרופות בעלות מטען שלילי, כמו גם יכולתו לקשור הורמונים סטרואידיים, מה שהביא להשערה ש-ORM יכול להיות חבר במשפחת ה-lipocalin. בנוסף, ריכוזי ORM בנסיוב יציבים בתנאים פיזיולוגיים (כ-1 גרם/ליטר באדם, ו-0.2 גרם/ליטר בחולדה), אך עולים פי כמה בריאקציות acute phase, ולכן הוא נחשב לאחד ממגיבי acute phase הבולטים.
Orosomucoid (להלן ORM) הידוע גם כ-α-1-acid glycoprotein (להלן α1AGP) הוא חלבון של הפאזה החריפה (acute phase protein), ששייך למשפחת plasma globulins α1. הגליקופרוטאין ORM מאופנן על ידי החלבון ORM מסונתז בעיקר בהפטוציטים וריכוזו התקין בפלזמה במבוגרים הוא 0.6-1.2 גרם/ליטר, והוא מהווה 1-3% מכלל חלבוני הפלזמה (Colombo וחב' ב-Clin Pharmacol Ther משנת 2006. בהיותו acute phase protein רמתו בפלזמה עולה משמעותית במצבי דלקת, בכוויות, בנשאי HIV ובשימוש בתרופות מסוימות.
התפקיד הפיזיולוגי היחיד המוסכם לגבי ORM, הוא לשמש נשא של חומרים ליפופיליים בסיסיים או כאלה שהם ניטרליים מבחינת מטענם. ברפואה, ORM ידוע כנשא עיקרי של תרופות בסיסיות (הטעונים מטען שלילי), בעוד שאלבומין הוא הנשא של תרופות חומציות (שמטענן החשמלי שלילי) או הניטרליות מבחינת מטענן. ORM נשא של סטרואידים, של פרוגסטרון וויטמין B12 ושל מעכבי פרוטאזות (Urien וחב' ב-Biochem J משנת 1991). הזדקנות גורמת לעלייה קלה ביותר ברמת ORM, ואכן ההשפעה של שינויים קלים אלה על הקישור של תרופות שונות ל-ORM זעירה (Barash ב- Clinical Anesthesia משנת 209). ל-ORM יש אינטראקציה מורכבת עם הגורמים להומאוסטאזיס של בלוטת התריס: ORM בריכוזים נמוכים מעודד את הקולטן ל-TSH ולהצטברות התוך-תאית של c-AMP. לעומת זאת, ORM בריכוזים גבוהים מעכבים את פעילות TSH (Zimmermann-Belsing וחב' ב- Molecular and Cellular Endocrinology משנת 2002, ו-Dietrich וחב' ב- J Thyroid Resמשנת 2012).
ORM זוהה כאחד מתוך ארבעה סמנים שימושיים בצירקולציה להערכה של הסיכון לתמותה מסיבה כלשהי במהלך 5 השנים הבאות, כאשר יתר הסמנים הם רמת אלבומין, רמת ציטראט וגודל החלקיק של very low-density lipoprotein (Fischer וחב' ב- PLos Med משנת 2014). ORM גדל בריכוזו בצהבות חסימתיות, ופוחת בריכוזו בצהבת הפאטו-תאית ובזיהומי מעי.
המבנה של ORM
משקלו המולקולארי של ORM הוא 41-43 אלף דלטון, אם כי יש הגורסים תחומי משקל מולקולארי רחבים יותר, של 37-54 אלף דלטון, וזאת כתוצאה משיעורי גליקוזילציה שונים המתבטאים בתכולה משתנה של המרכיב הסוכרי של המולקולה. כל חמש השרשרות הסוכריות העשירות בחומצה סיאלית, מחוברות לשלד הפפטידי של ORM בקשרי N-linkage (Yoshima וחב' ב-J Biol Chem משנת 1981). ORM גובש כמלח עופרת ליצירת דו-פירמידות בעלות 6 צלעות. נמצא של-ORM יש מסיסות גבוהה במיוחד במים ובממיסים אורגניים קוטביים, מה שמוסבר על ידי התכולה הגבוהה של סוכרים במבנה המולקולה. באדם, הקודמן ORM1 היא שרשרת פוליפפטידית אחת עם 201 חומצות אמינו, כאשר בקצה ה-N טרמינאלי שלה מופיע signal peptide בן 18 חומצות אמינו המבוקע בתהליך העיבוד של החלבון, ומוליך לחלבון המונומרי הבשל המכיל באדם 183 חומצות אמינו או 187 חומצות אמינו בחולדה, עם שני קשרים דיסולפידים באדם, וקשר דיסולפידי בודד בחולדה. יש הבדל של 22 חומצות אמינו בין 2 הואריאנטים ORM1 ו-ORM2 המקודדים על ידי 2 גנים פולימורפיים (ORM1 ו-ORM2) שמיקומם בכרומוזום 9 בעמדה q31-qter. בנוסף, בעמדות 32 ו-47 ייתכן שחלוף של חומצות האמינו, מה שמשקף כנראה פולימורפיות באוכלוסייה האנושית. נתון מעניין נוסף הוא דרגת ההומולוגיה הגבוהה בין ORM לבין מולקולת IgG מאדם (Schmid וחב' ב-Biochemistry משנת 1973), וכן בין ORM לבין הקולטן של EGF (Toh וחב' ב-Nature משנת 1985).
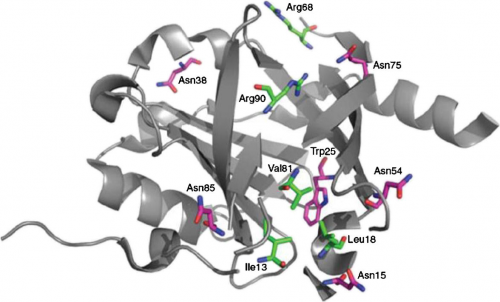
כפי שרואים בתרשים למטה לגבי המבנה של אתר הקישור של ORM (Filip וחב' ב-Expert Opin drug Metabol Toxicol משנת 2013), נמצא 2 שרשרות צדדיות טעונות חיובית (Arg68 ו-Arg90) הממוקמות מצדו האחד של הגומחה (cleft) של אתר הקישור, כאשר שאר הגומחה בעיקרה אינה קוטבית. החלק הפנימי של שקע זה מקביל לשרשרת צדדית בו משחקים תפקיד חיוני השיירים Tyr27, Phe49, Phe51, Leu62, Leu79, Ile88, Leu101, Tyr110, Leu112 ו-Tr127. החלק התחתון של הגומחה נוצר על ידי Ile13, Leu18 ו-Val81. בתרשים מצוינים חמשת שיירי האספרגין (Asn), אליהם נקשרות חמשת השרשרות הסוכריות. מולקולת ORM בחולדה היא בעלת הומולוגיה של 59% ברצף חומצות האמינו לזו של האדם. עם זאת, המקטע (domain) התפקודי של ORM משומר ביותר בין אדם, חולדה ועכבר.
החלק הסוכרי של ORM
המרכיב הסוכרי של ORM נחקר היטב שכן זהו אחד הגליקופרוטאינים הבודדים המכיל שרשרות סוכריות עם הסתעפויות טטרה-אנטנריות, תלת-אנטנריות ודו-אנטנריות, כאשר כל חמשת השרשרות הצדדיות מחוברות לשייר אספרגין בעמדות 15, 38, 54, 75 ו-85, (תרשים למטה):
יתרה מכך, סוכר הקצה של השרשרות הסוכריות ב-ORM הוא חומצה סיאלית או N-acetyl-neuraminic acid , מהווה 10-12% מכלל הסוכרים במולקולה, ובגלל מטענו השלילי מתקבלת הנקודה האיזואלקטרית הנמוכה של המולקולה. סוכר טרמינאלי זה יכול להיות קשור בקשרי α2-3 או α2-6 לסוכר galactose. גם הסוכר fucose הוא סוכר קצה ב-ORM, שיכול להיות קשור בקשר α1-3 לסוכר GlcNAc. התגלו 12-20 גליקופורמים של ORM בנסיוב תקין, אם כי במצבים פתולוגיים יש עדיפות להופעת גליקאנים עם מבנה של שרשרת סוכרית דו-אנטנארית, שניתן לגלותם לדוגמה בשלב המוקדם של ריאקציית acute phase. נמצא שהציטוקינים IL-1, IL-6 ו-TNF-α וכן גלוקו-קורטיקואידים קשורים למודיפיקציות אלו במבנה הסוכרי של ORM (Van Dijk ב-Glycoconj J משנת 1995). השינויים בגליקוזילציה של מולקולת ORM אינם מוגבלים רק למצבים חריפים של דלקת, אלא מופיעים במגוון של מצבים פתו-פיזיולוגיים כמו הריון, דלקת מפרקים שגרונית חמורה, צמקת כבד מאלכוהוליזם, והפאטיטיס (Biou וחב' ב-Clin Chim Acta משנת 1991).
הפעילות הביולוגית של ORM
תכונות ביולוגיות רבות יוחסו ל-ORM על ידי Kremer וחב' ב-Pharmacol Rev משנת 1988: ההגנה שהוא מעניק כנגד ספסיס נאונטלי, האינטראקציה שלו עם פוספוליפידים בממברנה, יכולתו לקשור היסטמין, כמו גם לעכב צימות טסיות, כימוטקסיס של ניטרופילים, יצירת סופר-אוקסידים, והשפעתו על שגשוג לימפוציטים. ORM נחשב כגורם טבעי נוגד-דלקות ואימונו-מודולטורי בעיקר בהקשר של פעילות נוגדת המשלים (complement) והאנטי-ניטרופילית (Williams וחב' ב-Am J Physiol משנת 1997). ואמנם, הודגם הן in-vitro כמו גם in vivoש-ORM היא מולקולה אימונו-מודולטורית: In vitro, ORM מעכב שפעול ניטרופילים (Vasson וחב' ב-Clin Chim Acta משנת 1994) ומגביר את ההפרשה של מעכב IL-1 על ידי מקרופאגים בעכבר [שהוא כנראה אנטגוניסט של הקולטן ל-IL-1 (Tilg וחב' ב-J Exp Med משנת 1993), וכמו כן מאפנן את הפרשת ציטוקינים המושרית על ידי ליפופוליסכרידים (LPS) (Boutten וחב' ב-Eur J Immunol משנת 1992). מאוחר יותר הודגם ש-ORM מגיב באופן ישיר עם LPS (Moore וחב' ב-Inflammation משנת 1997). מחקרים in vitro עם מונוציטים מאדם, הראו שהפרשת TNF-α המושרית על ידי ORM תלויה בשפעול של האנזים טירוזין קינאזה (Su וחב' ב-Immunopharmacol משנת 1999). כמו כן הוצע ש-ORM דרוש לשמור על חדירותן של קפילרות כנראה על ידי הגברת הסלקטיביות של המטען הפולי-אניוני במחסום האנדותליאלי (Curry וחב' ב-Am J Physiol משנת 1989).
In vivo, עירוי של ORM נמצא מגן על עכברים מפני הפאטיטיס וכן מפני הלם קטלני המושרה על ידי TNF-α (Libert וחב' ב-J Exp Med משנת 1994). עלתה השערה שפעילות עיכוב צימות הטסיות והיכולת של ORM לעכב כמוטקסיס של ניטרופילים ולעכב מטבוליזם חמצוני, עומדים בבסיס פעילויותיו המגוננות (Costello וחב' ב-Nature משנת 1979). כן נמצא ש-ORM מעכב באופן ספציפי אפופטוזיס המושרה על ידיTNF-α בעכברים, אך נראה שההגנה שמעניק ORM לתאים פועלת על ידי מנגנון בלתי-ישיר, שכן in vitro ORM נכשל בהגנה על תאי הפאטומה אנושיים, מפני אפופטוזיס המושרה בתאים אלה על ידי TNF-α בשילוב עם אקטינומיצין D (Van Molle וחב' ב-J Immunol משנת 1997).
הפעילות האימונו-מודולטורית של ORM נמצאה תלויה בדרגת הגליקוזילציה שלו. לדוגמה, העיכוב של שגשוג לימפוציטים תלוי בדרגת ההסתעפות של השרשרות הסוכריות של ORM (Pos וחב' ב-Inflammation משנת 1990), ועיכוב צימות הטסיות מוגבר כאשר מולקולת ORM עוברת דה-סיאליזציה. הדגמה נוספת של חשיבות השרשרות הסוכריות של ORM לפעילותו הביולוגית, מוצאים בנתון הבא: ORM עם מבנה סוכרי של sialyl Lewis X הנוצר במהלך דלקת, משדרג את הנזקים הנגרמים על ידי המשלים וכן על ידי ניטרופילים , ואילו ORM ללא המבנה הסוכרי של sialyl Lewis X אינו פועל באופן דומה (De Graaf וחב' ב-J Exp Med משנת 1993). כידוע, sialyl Lewis X הוא הליגנד אליו נקשרות מולקולות הספיחה E-selectin ו-P-selectin בתהליכי הספיחה של ניטרופילים, מונוציטים או תאי T לתאי האנדותל או לטסיות במצבי דלקת (Lasky ב-Science משנת 1992).
בשיטת surface plasmon resonance spectroscopy נמצא ש-ORM מאנשים עם דלקת חריפה, בו יש תכולה גבוהה של sialyl Lewis X, משמש כליגנד ספציפי למולקולה כימרית של E-selectin-IgG. נמצא שאוליגו-סככרידים עם סיאליזציה מלאה הגנו כנגד נזק לריאות בחולדות in vivo (Mulligan וחב' ב- J Exp Medמשנת 1993). נראה אם כן, שהגדלת החלק של sialyl Lewis X המושרה על ידי מצבי דלקת בקומפלקס הגליקני של ORM, מייצגת מנגנון של עיכוב על ידי משוב-חוזר של חדירת גרנולוציטים לתוך הרקמות הדלקתיות. במקובץ, נתונים אלה מראים שהשרשרות הסוכריות של ORM הן בעלת תפקיד קריטי בפעילויות האימונו-מודולטוריות של גליקופרוטאין זה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק