הבדלים בין גרסאות בדף "Angiopoietin-like protein 3"
(←ראו גם) |
מ (Motyk העביר את הדף Angiopoietin-like 3 לשם Angiopoietin-like protein 3) |
גרסה מ־19:09, 13 בספטמבר 2017
| מדריך בדיקות מעבדה | |
| Angiopoietin-like 3 | |
|---|---|
| שמות אחרים | ANGPTL3 |
| מעבדה | מולקולארית בדם |
| תחום | מחלות כלי-דם ולב |
| טווח ערכים תקין | באוכלוסייה בארה"ב, בגברים-82±227 ננוגרם/מ"ל, בנשים-94±253 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה: מדד נוסף להערכה של ליפופרוטאינים וטריגליצרידים בפלזמה, ולהערכה אפידמיולוגית של תחלואת כלי-דם ולב.
החלבון ANGPTL3
החלבון angiopoietin-like protein 3 (ובקצרה ANGPTL3) הוא חבר במשפחה של חלבונים מופרשים בעלי הומולוגיה עם angiopoietins, חלבונים המווסתים את פעולת האנגיוגניות. חלבון זה מקודד על ידי הגן AGNPTL3 הממוקם על הזרוע הקצרה של כרומוזום 1 בעמדה 1p31.3, גן המכיל 7 אֶקסונים (Conklin וחב' ב-Genomics משנת 1999). ל-ANGPTL3 יש מבנה אופייני ל-angiopoietins, המכיל signal peptide ומקטע C טרמינאלי הדומה לפיברינוגן, כאשר מקטע אחרון זה הוא בעל יכולת קישור ל-α-5/β-3 integrins, מה שמעודד יכולת ספיחה אך גם נדידה של תאי אנדותל (Camenisch ב-J Biol Chem משנת 2002).
לחלבון זה 460 חומצות אמינו עם מקטע N-טרמינאלי סלילני, שמייחסים לו יצירה של מבנים אוליגומריים, והוא מופרש באופן כמעט בלעדי על ידי הכבד ונקשר באופן הפיך לאנזים LPL (או lipoprptein lipase) תוך עיכוב פעילות האחרון, כמו גם מעכב את ההידרוליזה של טריגליצרידים בכילומיקרונים וב-VLDL (על פי Tikka ו-Jauhiainen ב-Endocrine משנת 2016, ו-Shan וחב' ב-J Biol Chem משנת 2009, וכן Shimizugawa וחב' באותו כתב עת משנת 2002). לצורך פעילויות מעכבות אלו, יש צורך ב-furin cleavage site בשיירים 222-224 (על פי Ono וחב' ב-J Biol Chem משנת 2003). בנוסף, ANGPTL3 גם פוגע בפעילות האנזים endothelial lipase הממוקם בשטח הפנים הלומנאלי של תאי האנדותל הווסקולאריים התורמים ל-remodeling של HDL על ידי הידרוליזה של פוספוליפידים לליזו-פוספוליפידים.
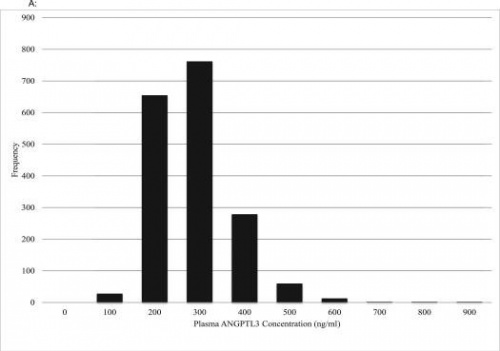
ריכוזי ANGPTL3 והיחס בינם לבין ליפופרוטאינים וטריגליצרידים בדם
Robciuc וחב' השתמשו בשיטת ELISA כמותית למדידת ריכוזי ANGPTL3 בפלזמה J Lipid Res משנת 2010). במדגם של אוכלוסייה פינית שכלל 125 גברים ו-125 נשים בטווח הגילים 30-94 שנה, נמצא ריכוז ממוצע של 168 368 ± ננוגרם /מ"ל (שהיה גבוה ב-53% מהנתונים שהתקבלו לגבי האוכלוסייה האמריקנית על ידי Mehta וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2014). (תרשים של הממצאים בפינלנד למטה):
ריכוז ANGPTL3 בפלזמה נמצא במתאם חיובי עם רמות LDL ו-HDL, אך אין כל מתאם עם רמת טריגליצרידים.
הפעילות הביולוגית של ANGPTL3
הבקרה של פעילות LPL מאוד מורכבת. apolipoprotein CII ו-apoAV משפעלים את LPL, ולעומתם apoCIII מעכב את LPL. מערכת זו של היזונים ובקרות על מעבר אנרגיה בצורת טריגליצרידים האמורים לספק חומצות שומן לרקמות, יכולה הייתה להתפתח באבולוציה של יונקים כדי לשמר דלק יקר בעיתות של עליות וירידות בדרישה לאנרגיה. עם זאת באדם המודרני, חוסר מוחלט של ANGPTL3 אינו גורם לבעיות רפואיות, ואפילו נראה כגורם להפחתת טרשת עורקים. ANGPTL3 מסייע לקליטה של טריגליצרידים שב-VLDL לתוך רקמת השומן "הלבן", ולא לרקמת שריר השלד או לרקמת השומן "החום" בלב (Wang וחב' ב-Proc Natl Acad ci USA משנת 2015). בכבד, אינאקטיבציה של ANGPTL3 היא בעלת השפעה מועטה על מספר הליפופרוטאינים המופרשים המכילים apoB, אך ליפופרוטאינים אלה מפונים מהר יותר מהצירקולציה (Wang וחב' ב-J Lipid Res משנת 2015).
הביטוי של ANGPTL3 בכבד אדם, מושרה באופן בולט על ידי שפעול של liver X receptor או LXR, הנקשר ל-promoter של ANGPTL3. החלבון מבוקע פרוטאוליטית על ידי האנזים proprotein convertase ליצירה של המקטע ה-N טרמינאלי הפעיל ביולוגית ומקטע C-טרמינאלי שאינו פעיל ביולוגית. המקטע ה-N-טרמינאלי מדכא באופן מתון את הפעילות הקטליטית של LPL בניסויים in vitro (Mattijssen וחב' ב-Biochim Biophys Acta משנת 2012). בכבד, לאינאקטיבציה של ANGPTL3 יש השפעה מועטה על כמות הליפופרוטאינים המופרשים המכילים apoB, יחד עם זאת ליפופרוטאינים אלה מתפנים במהירות מהצירקולציה (Wang וחב' ב-J Lipid Res משנת 2015).
ANGPTL3 נותר חלבון מעניין עד אשר Musunuru וחב' פרסמו בשנת 2010 ב-New Eng J Med מחקר המראה בשיטת ריצוף של exome-wide DNA שהמצב של loss-of-function homozygosity (או compound heterozygosity) של ANGPTL3 בגן המקודד לחלבון זה בזרוע הקצרה של כרומוזום 1 בעמדה 1p31, היא הסיבה לתרחיש של FHBL2 או familial hypobetalipoproteinemia. מאז תצפית זו התגלו מספר משפחות עם FHBL2 עם מוטציות ב-ANGPTL3 ונחקרו ביסודיות (Martin-Campos וחב' ב-Clin Chim Acta משנת 2012, ו-Pisciotta וחב' ב-Cardiovasc Genet משנת 2012, וכן Noto וחב' ב-Artheriosclr Thromb Vasc Biol משנת 2012, ו-Robciuc וחב' באותו כתב עת משנת 2013). מטופלים הטרוזיגוטיים למוטציית LOF ב-ANGPTL3 אינם בעלי פנוטיפ השונה בהרבה מאנשים ללא מוטציה זו. עכברים טרנסגניים ללא כל פעילות של ANGPTL3, מדגימים פנוטיפ היפוליפידמי עם נגעים טרשתיים מופחתים (Ando וחב' ב-J Lipid Res משנת 2003).
עם הרקע הזה, פרסמו Stitziel וחב' בשנת 2017 ב-J Am Coll Cardiol מחקר בו נבחנה השפעת חוסר ב-ANGPTL3 על ההגנה מפני מחלת עורקים כליליים (CAD). בסדרה של מחקרים אלגנטיים מספקים חוקרים אלה ראיות נחרצות ש-ANGPTL3 קשור באופן נסיבתי ל-CAD. ראשית, הם חקרו על ידי אנגיוגרפיה תחת CT של העורקים הכליליים, את שלושת בני המשפחה שתוארה על ידי Musunuru וחב', עם compound heterozygosity ל-LOF בגן של ANGPTL3, וכן שלושה אחאים באותה משפחה שלא הושפעו על ידי מוטציה זו. שנית, הם בחנו מוטציות LOF באוכלוסייה גדולה (n=21,980) של מטופלים עם CAD וכן קבוצת ביקורת של 158,200 אנשים בריאים. שלישית, הם מדדו את רמת החלבון ANGPTL3 ב-1,493 אנשים עם אוטם שריר הלב, וכן ב-3,232 אנשים בריאים כביקורת.
מדידות אלה הראו שבמטופלים עם LOF לגבי הגן ל-ANGPTL3 לא ניתן היה לגלות CAD ניכר בהשוואה לאחאים שלהם ללא מוטציות אלה, תוך התבססות על אנגיוגרפיה תחת CT. תוך שימוש בבדיקה מתוחכמת, הם שחזרו כל אחת מהמוטציות ב-ANGPTL3 שזוהו במדגם שלהם, על ידי בחינת ההשפעה של gene transfer על ידי נגיף adeno בעכברי knockout ללא ANGPTL3, על רקע של עכברי C57Bl6. החוקרים בחרו רק במוטציות מובהקות הגורמות ל-LOF, ואשר הראו פחות מ-25% מהפעילות של ANGPTL3 שמוצאים בעכברי wild-type. הם מצאו ששכיחות האלל הכרוך במוטציות LOF של ANGPTL3 הייתה 1 מתוך 309 נבדקים, וכן נמצא שבאלה מהנבדקים שהיו נשאים הטרוזיגוטים של המוטציות הייתה רמה מופחתת משמעותית של 17% ברמת טריגליצרידים, כמו גם הפחתה של 12% ברמת LDL. אך אולי משמעותי יותר הממצא, שבהטרוזיגוטים האמורים נמצאה הפחתה של 34% בסיכון למחלה קרדיו-וסקולארית. לבסוף, מטופלים הנמצאים בשלישון הנמוך ביותר של רמות החלבון ANGPTL3 היו בסיכון מופחת לאוטם שריר הלב. מסקנות בעלי מחקר זה היו שמוטציות LOF ב-ANGPTL3 כרוכות בהגנה מפני CAD.
באנשים עם CAD, נותר סיכון שארי משמעותי לאירוע קרדיו-וסקולארי גם לאחר הפחתה משמעותית ברמת כולסטרול-LDL כתוצאה מטיפול בסטטינים, ב-ezetimibe או בעזרת נוגדנים המכוונים כנגד proprotein convertase subtilisin-kexin type 9 או PCSK9. ברבים ממטופלים אלה, מוצאים רמה מוגברת של ליפופרוטאינים עתירי-טריגליצרידים לעתים רבות בהקשר של השמנת-יתר ועמידות לאינסולין. קשר נסיבתי בין רמות מוגברות ליפופרוטאינים עתירי-טריגליצרידים לבין CAD הוצע על ידי מחקרים של רנדומיזציה מנדליאנית, בהם נמצא שפולימורפיזמים בגנים הקשורים לליפופרוטאינים עם רמות גבוהות של טריגליצרידים נמצאו כרוכים עם CAD. אחדים מהגנים הללו מעכבים את פעילות האנזים lipoprotein lipase המתווך בליפוליזה של ליפופרוטאינים עתירי-טריגליצרידים, ובטרנספר של חומצות שומן לרקמות השומן ולשריר. אחד מהגנים הללו הוא ANGPTL3 המופרש מהכבד ומעכב את פעילות האנזים LPL ברקמות היקפיות (Koishi וחב' ב-Nature Genet משנת 2002).
בשנת 2017 פרסמו Dewey וחב' ב-New Eng J Med שוואריאנטים עם מוטציות loss-of-function (או LOF) ב-ANGPTL3 כרוכות ברמות מופחתות של טריגליצרידים, כולסטרול-LDL וכן כולסטרול-HDL בפלזמה, אך חשוב מכך כרוכות גם בהפחתה בסיכון ל-CAD. חוקרים אלה הראו שפרופיל של ליפופרוטאינים הדומה לזה שמוצאים בנבדקים עם וואריאנטים של LOF, ניתן להשרות גם במתנדבים בריאים על ידי הזרקה של הנוגדן החד-שבטי evinacumab המכוון כנגד ANGPTL3. במאמר קשור של Graham וחב' שהתפרסם באותה חוברת של New Eng J Med, הודגם ששינוי ב-ANGPTL3 בכבד על ידי שימוש באוליגו-נוקלאוטידים antisense, גם כן הוביל להפחתה ברמת ליפופרוטאינים עתירי-טריגליצרידים וכן בליפופרוטאינים אחרים בפלזמה, ולהפחתה של יצירת רבדים טרשתיים.
המסקנות אליהן הגיעו בעלי המחקר הן שמוטציות LOF של ANGPTL3 כרוכות בהגנה כנגד CAD. עם זאת, הקשר בין מוטציות אלו לבין CAD השיג רק מובהקות סטטיסטית מתונה (p=0.04). לא מדובר בפולימורפיזם של נוקלאוטידים אינדיבידואליים , אלא בפירוש במוטציות נדירות של LOF. למרות שתדירות האלל באוכלוסיית המוטציות ב-LOF הייתה 1 ב-309, הומוזיגוטיות או compound heterozygosity צפויה להיות נדירה (בקירוב 0.0000026, או מקרה אחד לכל 382,000 איש, אם האוכלוסייה נמצאת בשיווי משקל על פי Hardy-Weinberg, מה שהיה הופך מוטציה זו לנדירה אף יותר מהיפר-כולסטרולמיה משפחתית הומוזיגוטית.
מהם, אם כן, ההיבטים התרגומיים של מחקר זה? לא סביר שאנשים בריאים עם פרופיל שומנים תקין (אף על פי שרמת ה-HDL-כולסטרול שלהם נמוכה) יזדקקו לאנליזה של DNA למטרות אבחוניות. גם אם לפרט הנבדק נמצא הומוזיגוטי למוטציות LOF ב-ANGPTL3, הדבר לא יניד עפעף אצל הרופא המטפל מתחום הליפידים. אך חשובה אולי אף יותר השאלה האם ANGPTL3 אמור להפוך ליעד טיפולי? Stitziel וחב' ב-J Am Coll Cardiol משנת 2007, מדגישים שרמה נמוכה של ANGPTL3 כרוכה בסיכון קרדיו-וסקולארי נמוך יותר, אך ממצא זה אינו מעיד בהכרח על סיבתיות. יתרה מכך, הנוכחות של אלל בודד של LOF, נמצאה כרוכה רק עם שינויים מתונים בפנוטיפ הליפופרוטאיני. זהו נתון חשוב, שכן מולקולה קטנה שיכולה להפחית את פעילות ANGPTL3 עשויה להניב רק תועלת קטנה בהשוואה לפעולתם של תכשירים מפחיתי רמת ליפידים המקובלים כיום.
הפחתת פעילות ANGPTL3 כאמצעי להפחתת מחלות לב וכלי-דם
על מנת לחקות את הפנוטיפ הליפופרוטאיני של LOF הומוזיגוטי של ANGPTL3, נזדקק לתרופה (או לנוגדן חד-שבטי, או ל-antisense RNA) המנטרלים באופן מוחלט את פעילות ANGPTL3 בפלזמה או בכבד. נוגדן חד-שבטי המכוון כנגד ANGPTL3 משפר את פרופיל הליפופרוטאינים בעכברים כמו גם בקופים עם רמת טריגליצרידים גבוהה, מה שמרמז שגישה זו עשויה להיות מועילה גם באנשים עם מצבי דיס-ליפידמיה ספציפיים (Gusarova וחב' ב-J Lipid Res משנת 2015).
אך כאן עולה סוגיה של ממש: בשלב זה אין אנו מבינים באופן מלא את התפקידים הפיזיולוגיים של ANGPTL3, ואת המנגנון בו הוא מפחית את רמת כולסטרול-LDL. המטופלים שניתן לקחת בחשבון כאלה שיפיקו תועלת מעיכוב פעילות ANGPTL3, הם אלה עם דיסליפידמיה הנובעת מסוכרת או מהתסמונת המטבולית, או אלה עם היפר-ליפידמיה משולבת. אך במטופלים אלה יש קצב מוגבר של יצירת חלקיקים המכילים apoB (ובעיקר VLDL) בכבד. הגדלת הפעילות של LPL על ידי עיכוב ANGPTL3 יכולה להיות בעלת השפעה פרדוקסלית על ידי התמרה של VLDL לחלקיקי-LDL, התמרה שמוצאים לעתים בטיפול עם נגזרות של fibrates. לכן, יש להמתין ולהיווכח כיצד הנתונים על ANGPT3 יפתחו מסלול טיפולי חדש, כאשר תרופות נוגדות ANGPTL3 תהפוכנה זמינות לטיפולים בדיסליפידמיות.
לכן, גישה תרפויטית של הפחתת רמות ANGPTL3 עשויה להפחית באופן יעיל את רמות ליפופרוטאינים-עתירי-טריגליצרידים וכן את רמות כולסטרול-LDL, ובכך להפחית תחלואה ב-CAD. ממצאים אלה ביחד עם מחקרים עדכניים המכוונים כנגד מעכבי האנזים LPL, כולל תרופות המעכבות את ANGPTL4 (על פי Dewey וחב' ב-New Eng J Med משנת 2016), ואת apolipoprotein C-III (על פי Gaudet וחב' ב-New Eng J Med משנת 2015), הפותחות צוהר טיפולי חדש בהפחתת רמות מוגברות של ליפופרוטאינים עתירי-טריגליצרידים על ידי שפעול של האנזים LPL. את האשראי לגילוי תפקידו של ANGPTL3 במטבוליזם של ליפופרוטאינים באדם יש להעניק ל-Musunuru וחב' על תגליתם הראשונית משנת 2010 במאמר ב-N Eng J Med שמוטציות נדירות של LOF בגן ANGPTL3 באנשים עם רמות מופחתות בהרבה של ליפופרוטאינים עתירי-טריגליצרידים, כולסטרול LDL ו-HDL, בעלי הפנוטיפ הידוע גם כ-familial combined hypolipidemia.
תרומתם של Dewey וחב' הייתה בעיקר בריצוף ה-exomes של מטופלים ובזיהוי של מספר ואריאנטים של LOF בגן של ANGPTL3 , ובמציאת הקשר בין ההטרוזיגוטיות של מוטציות אלו והפחתה מתונה ברמות טריגליצרידים, LDL ו-HDL, כמו גם הקטנת הסיכון ל-CAD.
מטבוליזם של ליפופרוטאינים בחסר של ANGPTL3
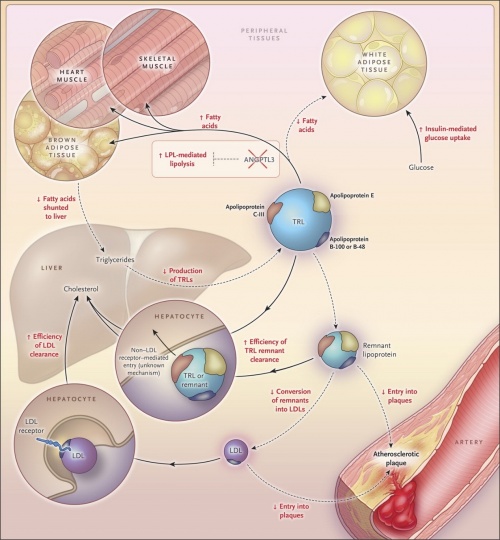
הרמות המופחתות של ליפופרטאינים-עתירי טריגליצרידים (TLR) בחסר של ANGPTL3 משקפות הן את השפעול ליפוליזה על ידי האנזים LPL או lipoprotein lipase ברקמות היקפיות כמו גם הפרשה מופחתת של VLDL מהכבד. ליפוליזה מהירה ברקמות היקפיות מובילה לפינוי יעיל יותר של שיירים (remnants) עתירי-כולסטרול על ידי הכבד, וממילא להמרה מופחתת של שיירים אלה ל-LDL, ולחדירה מופחתת של LDL לתוך רבדים טרשתיים בדופן כלי הדם. חלקיקי LDL מתפנים אז ביתר שאת על ידי הכבד. ליפוליזה מוגברת של TRLs ברקמות המחמצנות חומצות שומניות, כגון הלב, השריר ורקמת השמן החומה, יכולה לגרום לזמינות נמוכה יותר של חומצות שומן הנאגרות ברקמת השומן הלבנה, מה שמפחית שטף של חומצות אלה לתוך הכבד, בו הן אמורות לעבור רה-אסטריפיקציה ולהפוך ל-VLDL ולטריגליצרידים. מסלולים מוגברים בחסר של ANGPTL3 מסומנים בקווים רצופים, ואילו מסלולים בעלי פעילות מופחתת מסומנים בקווים מקוטעים.
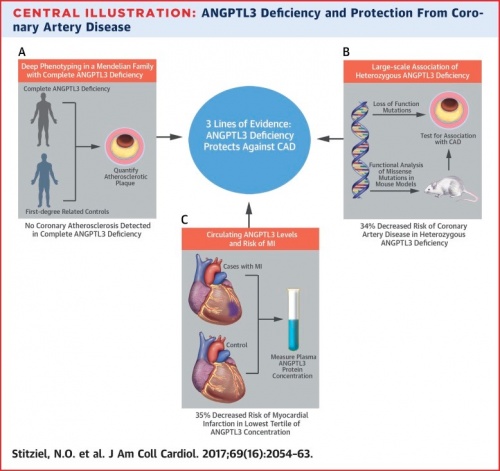
ראיות המרמזות שחסר של ANGPTL3 כרוך בהגנה מפני מחלת עורקים כליליים (CAD)
- (A) חסר משפחתי מוחלט של חלבון זה מתבטא בחסר של רבדים (plaques) טרשתיים;
- (B) אנליזה גֶנומית של ואריאנטים של ANPPTL3 עם מוטציות loss-of-function בלמעלה מ-180,000 נבדקים מצאה הפחתה של 34% ב-CAD;
- (C) רמות של ANGPTL3 בצירקולציה נמצאו נמוכות יותר בנבדקים בריאים, מאשר בנבדקים עם רקע של MI.
Gaudet וחב' טיפלו ב-evinacumab ב-9 מטופלים עם היפר-כולסטרולמיה משפחתית ורמת כולסטרול ממוצעת של ב-9 מטופלים עם היפר-כולסטרולמיה משפחתית ורמת כולסטרול ממוצעת של 376±240 מיליגרם/דציליטר, כאשר אחרי הפעלת הטיפול רמת כולסטרול ירדה בממוצע ב-49±23% כבר לאחר 4 שבועות. כמו כן נרשמה ירידה של 46±18% ברמת apolipoB, ירידה של 49±22% ברמת non-HDL, ירידה של 47% ברמת טריגליצרידים, וירדה של 36% ברמת HDL (N Eng J Med משנת 2017).
במחקר המשמעותי ביותר בתחום של ANGPTL3 רצפו Dewey וחב' את ה-exons של ANGPTL3 ב-58,335 משתתפים במחקר DiscovEAR, מתוכם 13,102 מטופלים ו-40,430 אנשים בריאים כקבוצת ביקורת. כמו כן נסקרו בדרך זו 23,317 מטופלים ו-107,166 נבדקים בקבוצת ביקורת ב-4 ניסויים אוכלוסייתיים גדולים. כמו כן נלמדה על ידי Dewey וחב' השפעת הטיפול ב-evinacumab בעכברים, ובמתנדבים בריאים עם רמות גבוהות של טריגליצרידים או של LDL.
במחקר DiscovEAR, המשתתפים עם ואריאנטים של LOF ב-,ANGPTL3 נמצאו בעלי רמות נמוכות משמעותית של טריגלצרידים, של LDL ושל HDL, בהשוואה למטופלים ללא ואריאנט זה. בעכברים עם דיסליפידמיה עיכוב פעילות ANGPTL3 עם evinacumab, גרם לירידה גדולה יותר של בשטח הנמדד של רבדים טרשתיים, ולהפחתה בתכולת הנמק ברבדים אלה. באדם, טיפול ב-evinacumab גרם לירידה ברמת טריגליצרידים ב-76%, ולהפחתת רמת LDL בפלזמה בשיעור של 23%.
סביר שהפחתת רמות ליפו-פרוטאינים עתירי-טריגליצרידים עם תכשירים המגבירים פעילות LPL, תוביל לספקטרום מגוון של יתרונות אך גם של תופעות לוואי, בהשוואה לפעילות טיפולים המגבירים את פעילות הקולטן ל-LDL. לדוגמה, פעילות מוגברת של האנזים LPL עשויה להחליש את העמידות לאינסולין ולהפחית את הסיכון לסוכרת. אכן, הגברת הרגישות לאינסולין נמצאה במטופלים עם מוטציות ב-ANGPTL3 (על פי Robciuc וחב' ב-Arterioscler Thromb Vasc Biol משנת 2013), כמו גם בעכברים משוללי פעילות של ANGPTL3 (Wang ב-Proc Natl Acad Sci USA משנת 2015), בהם הייתה קליטה מעטה יותר של חומצות שומן לתוך רקמות מחמצנות כגון רקמת השריר או רקמת השומן החומה. סיבה אחת לדאגה בטפולים לעיכוב ANGPTL3, היא בירידה ברמת HDL, אך נראה שהשפעת עיכוב ANGPTL3 בהגברת הפעילות של endothelial lipase היא ערובה לאי העלייה בסיכון ל-CAD.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק