הבדלים בין גרסאות בדף "אינטרלויקין-2-Interleukin"
| שורה 71: | שורה 71: | ||
==הוראות לביצוע הבדיקה== | ==הוראות לביצוע הבדיקה== | ||
דם נלקח במבחנה כימית (פקק אדום) או במבחנת ג'ל (פקק צהוב), לאחר קרישת הדם מתבצע סרכוז והנסיוב מוקפא במבחנת פלסטיק. יש לשים לב לעובדה שרמות ציטוקינים בדם עלולות להיות מושפעות מזמן לקיחת הדם במהלך היממה (diurnal variation), לכן בהשוואות ארוכות טווח של רמת IL-2, יש להקפיד על נטילת הדם באותה שעה. יש לפסול דגימות שעברו אינאקטיבציה בחשיפה לטמפרטורות גבוהות. יש להעביר את הדגימה למעבדה באופן קפוא (מועדף). הדגימות הקפואות יציבות למשך שנה. שיטת הבדיקה: ELISA או Quantitative Multplex beads. | דם נלקח במבחנה כימית (פקק אדום) או במבחנת ג'ל (פקק צהוב), לאחר קרישת הדם מתבצע סרכוז והנסיוב מוקפא במבחנת פלסטיק. יש לשים לב לעובדה שרמות ציטוקינים בדם עלולות להיות מושפעות מזמן לקיחת הדם במהלך היממה (diurnal variation), לכן בהשוואות ארוכות טווח של רמת IL-2, יש להקפיד על נטילת הדם באותה שעה. יש לפסול דגימות שעברו אינאקטיבציה בחשיפה לטמפרטורות גבוהות. יש להעביר את הדגימה למעבדה באופן קפוא (מועדף). הדגימות הקפואות יציבות למשך שנה. שיטת הבדיקה: ELISA או Quantitative Multplex beads. | ||
| + | |||
| + | ==ראו גם== | ||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[סמני דלקת|בדיקות מעבדה - סמני דלקת]] | ||
| + | * [[סמנים סרטניים|בדיקות מעבדה - סמנים סרטניים]] | ||
| + | |||
| + | |||
| + | {{ייחוס בן עמי}} | ||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה - סמנים סרטניים]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
| + | [[קטגוריה:בדיקות מעבדה - מדדי דלקת]] | ||
גרסה מ־17:59, 21 בספטמבר 2022
| מדריך בדיקות מעבדה | |
| אינטרלויקין-2 | |
|---|---|
| 2-Interleukin | |
| מעבדה | כימיה בדם |
| תחום | ציטוקינים והשפעתם על מערכת החיסון. |
| טווח ערכים תקין | פחות מ-2.1 פיקוגרם/מ"ל (על פי מעבדות Mayo Clinic). |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הבנת הפּתוֹ-פיזיולוגיה של מפגעים של מערכת החיסון, הדבקות או דלקות.
כללי
אינטרלויקין-2 (להלן IL-2), חלבון משקל מולקולרי של 15.5-16.0 קילו-דלטון, הוא אחד הציטוקינים הראשונים שהתגלו ושובטו, וכן גם הקולטן שלו IL-2R. התפקיד המורכב של ציטוקין זה וקולטנו בוויסות של התגובה החיסונית הולך ומתברר מאז העשור השביעי של המאה ה-20. יש ל-IL-2 לכאורה פעילויות מנוגדות: מחד גיסא הוא חיוני לשגשוג של תאי T והוא משמש כגורם בהתמיינות של תאים אלה, ומאידך גיסא הוא הכרחי לשמור על עמידות היקפית. השיבוט של IL-2 ושל הקולטן שלו תואר על ידי Leonard וחב' ב-Nature משנת 1984, Nuikaido וחב' באותו כתב-עת מאותה שנה, ו-Taniguchi וחב' באותו כתב-עת משנת 1983. התפקיד הראשון שיוחס ל-IL-2 היה יכולת מרשימה לזרז in vitro שגשוג והתמיינות של תאי T (Gillis וחב' ב-J Exp Med משנת 1978, Gillis ו-Smith ב-Nature משנת 1977, Morgan וחב' ב-Science משנת 1976, ו-Smith ב-Science משנת 1988), ולפיכך הוא כונה במקור T-cell growth factor. בנוסף לפעילותו in vitro, שיערו שיש ל-IL-2 תפקיד קריטי in vivo, במהלך ההתרחבות השבטית של תאי T המוּעת על ידי אנטיגן. כיוון ש-IL-2 מיוצר בעיקר על ידי תאי T משופעלים, ובעיקר על ידי תאי CD4+-helper משופעלים, לפחות חלק מתפקיד ה-"helper" שלהם ביחס לתאי +CD8 יוחס ל-IL-2 (Keane ו-Forman ב-J Exp Med משנת 1982). בנוסף לתפקידים אלה של IL-2, מספר מחקרים הדגישו מספר גדול יותר של תפקידים סותרים של IL-2 .
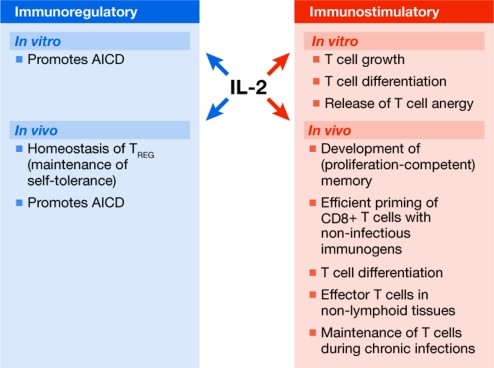
בניגוד לתפקודים מעודדי-חסינות, IL-2 יכול לעודד סיוע למותם של תאי T (להלן AICD) (Dai וחב' ב-J Immunol משנת 1999, Lenardo ב-Nature משנת 1991, Refaeli וחב' ב-Immunity משנת 1998, ו-Zheng וחב' ב-J Immunol משנת 1998). לפיכך, מיוחסת ל-IL-2 הפחתה של תאי T ספציפיים לאנטיגן (Khoruts וחב' ב-J Exp Med משנת 1998, Kneitz וחב' ב-Eur J Immunol משנת 1995, Ku וחב' ב-Science משנת 2000, ו-Van Parijs וחב' ב-J Immunol משנת 1997).
ל-IL-2 יש גם תכונות אנטי-דלקתיות, ובתהליך דומה לזה של אינטרפרון-γ, המפעיל את תכונותיו האנטי-דלקתיות על ידי דיכוי של תאי T-helper 17, IL-2 מסוגל לדכא יצירתIL-17 (Laurence וחב' ב-Immunity משנת 2007), והוא יכול להפגין את תפקודו בדיכוי מערכת החיסון על ידי עידוד היצירה וההומאסטאזיס של regulatory Tb cells ( (להלן (TREG (D'Cruz ו-Klein ב-Nature Immunol משנת 2005, Fontenot וחב' באותו כתב-עת משנת 2003, Klebb וחב' ב-Clin Immunol Immunopathol משנת 1996, Papiernik וחב' ב-Int Immunol משנת 1998, Suzuki וחב' ב-J Exp Med משנת 1999, ו-Wolf וחב' ב-Eur J Immunol משנת 2001).
IL-2 משחק תפקיד קריטי בוויסות של תגובות חיסוניות על ידי פעילותו האימונו-סטימולטורית ואימונו-רגולטורית. ראשית, הוא פועל כגורם גדילה של תאי T, החיוני לשגשוג ולהישרדות של תאי T, כמו גם ליצירה של memory T cells.{{כ]} IL-2 הוא ציטוקין הבנוי כצרור של ארבעה סלילוני אלפא, והוא שייך לקבוצה של ציטוקינים הדומים באופן מבני, הכוללת את IL-15 ,IL-9 ,IL-7 ו-IL-21. IL-2 מיוצר בעיקר על ידי תאי +T CD4 משופעלים בתגובה לגירוי אנטיגני, אך יכול להיות מיוצר גם באופן מופחת על ידי תאי +T CD8 ועל ידי תאי חיסון טבעי (innate) כגון דנדריטים משופעלים וכן על ידי תאי natural killer (להלן NK) (Malek ב-Ann Rev Immunol משנת 2008, Granucci וחב' ב-J Immunol משנת 2003, ו-Zelante וחב' ב-Front Immunol משנת 2012). IL-2 חיוני לתגובה החיסונית המוקדמת, בהכנת תאי T "נאיביים" לייצר IL-26.
היסטוריה
באמצע שנות ה-60 של המאה ה-20 מחקרים דיווחו על "פעילויות" במדיום הגידול של לויקוציטים, שסייעו לשגשוג של לימפוציטים (Chavez וחב' ב-Ann NY Acad Sci משנת 2009). באמצע שנות ה-70, התגלה שתאי T יכלו לשגשג באופן בררני כאשר תאים נורמליים של מח העצם הוכנסו לתרבית שמקורה בלימפוציטים אנושיים נורמליים שעודדו על ידי PHA או phytohemagglutinin) (Paul ב-Fundamental Immunology משנת 2008). גורם המפתח בודד וזוהה בשנת 1979 שמקורו בתאי עכבר בתרבית או בשנת 1980 מתאי אדם בתרבית (Welte וחב' ב-J Exp Med משנת 1982). הגן המקודד ל-IL-2 אנושי שובט בשנת 1982 (על פי Rabinow ב-Making PCR: A story of Biotechnology משנת 1997). בשנות ה-80 וה-90 הייתה פעילות מסחרית נמרצת להכניס את IL-2 לשוק. בשנת 1983, חברת Cetus הכינה גרסה רקומביננטית של IL-2 בשם Aldesleukin שהוסב בהמשך ל-Proleukin, בה אלנין הורחק מהקצה ה-N טרמינלי, ובמקומו הוכנס serine בעמדה 125 (על פי Wittington ו-Faulds ב-Drugs משנת 1993). עד שנת 1990 חברת Cetus קיבלה אישור לשיווק תכשיר זה ב-9 מדינות באירופה, אם כי ה-FDA לא נתן אישור דומה באותה שנה, מה שהביא לקריסת Cetus ומכירתה לחברת Chiron בשנת 1991 (Lehrman ב-The Scientist משנת 1992). חברת Chiron המשיכה בפיתוח של Proleukin וזכתה באישור התכשיר על ידי ה-FDA בשנת 1992 לטיפול בקרצינומה גרורתית של הכליות (על פי Ducher ב-Oncology משנת 2002). חברות נוספות נכנסו לתחום, כגון Roche שפיתחה רקומביננט בשם Taceleukin בו הוסף שייר מתיונין בקצה ה-N טרמינלי, וחברת Glaxo פיתחה גרסה בשם bioleukin בו בנוסף להכנסת מתיונין לקצה ה-N טרמינלי, שייר 125 הוחלף על ידי אלנין. עשרות ניסויים קליניים נערכו עם רקומביננטים של IL-2 או עם IL-2 עצמו או בשילוב עם תרופות אחרות, או ביצוע של תרפיה תאית, בה תאים הוצאו מהמטופל, שופעלו עם IL-2 והוחזרו בעירוי למטופל. חברת Novartis רכשה את חברת Chiron בשנת 2006, ומכרה את זכויות השיווק של aldesleukin לחברת Prometheus בשנת 2010, והאחרונה מכרה זכויות אלו לחברת Clinigen בשנת 2018.
הפוטנציאל של IL-2 לטיפול בסרטן החל מתברר, אך אבן הנגף בניסויים אלה הייתה המגבלה בייצור כמויות גדולות של IL-2 מטוהר לצורך ביצוע ניסויים קדם-קליניים בהיקף נרחב. אז התגלה ששורת תאים שמקורם בסרטן Jurkat אנושי של תאי T הפרישה כמויות גדולות של IL-2 לאחר גירוי תאים אלה על ידי phytohemagglutinin (להלן PHA) עובדה שנוצלה על ידי חברת DuPont (Robb וחב' ב-Proc Natl Acad Sci USA משנת 1983, ו-Taniguchi וחב' ב-Nature מאותה שנה), שביצעה ניסויים בין יולי 1983 לפברואר 1984. בניסויים אלה שותפו 16 מטופלים עם מחלת סרטן מתקדמת שטופלו עם IL-2 מטוהר, אך פרט לתופעות לוואי דוגמת חולשה, חום, צמרמורות, ותפקוד לקוי באופן קל של הכבד, לא ניכרה בהם פעילות אנטי-סרטנית. אך בהמשך יצרו ב-E. coli רקומביננט של IL-2 (Davos וחב' ב-Nucleic Acids Res משנת 1983, ו-Rosenberg וחב' ב-Science משנת 1984). לימפוציטים אנושיים שהודגרו עם PHA הניבו בנוזל הגידול 0.7 מיקרוגרם/ליטר של IL-2, ואילו כאשר תאי Jurkat הודגרו עם PHA ריכוז IL-2 במדיום עלה ל-3 מיקרוגרם/ליטר. לעומת זאת, E. coli רקומביננטי היה יכול לייצר 100 מיליגרם IL-2 בליטר. כמות גדולה זו אפשרה טיפול בעכברים ובאנשים בכמויות גדולות של IL-2.
ניסויים מוקדמים הדגימו רגרסיה בהחדרת IL-2 רקומביננטי לעכברים נושאי גידולים סרטניים וגרורות ריאתיות, אם כי ניכרו תופעות לוואי טוקסיות (Rosenberg וחב' ב-J Exp Med משנת 1985). תוצאות אלה במודלים של חיות, סיפקו תמריץ לניסויים דומים באדם. עשרים ושלושה מטופלים קיבלו מינונים שונים של IL-2 רקומביננטי (Lotze וחב' ב-J Immunol משנת 1985), תקופת מחצית החיים של החומר המוזרק הייתה 7 דקות, ונרשמה ירידה בכל התאים הלימפואידים מיד לאחר הזרקת הציטוקין, אך מספרם חזר לנורמה לאחר הפסקת הזרקתו. אך פרט לתופעות לוואי של חולשה, חום, צמרמורות וכאבי פרקים, לא הושגה נסיגה באף לא אחד מהמטופלים באופן יחידני עם IL-2. כבר בשלב מוקדם זה נמצא שתאי טחול מעכבר או תאים מונונוקלאריים מדם אדם (להלן PBMC) שטופלו עם IL-2, יכלו לייצר תאים שכונו לאחר מכן תאי LAK (או lymphokine-activated killer cells) שיכלו לזהות ולהרוג תאים סרטניים בתרבית תאים, כמו גם תאי סרטן אנושיים טרייםin vitro (Iron וחב' ב-J Immunol משנת 1985, Grimm וחב' ב-J Exp Med משנת 1982, ו-Yang וחב' ב-J Immunol משנת 1986).
ניסויים בהם נוסתה החדרת תאי LAK שגודלו in vitro לעכברים מסורטנים, הראתה פעילות אנטי-סרטנית in vivo, אך רק במודלים בהם הגידולים הסרטניים טופלו לפני שהם עברו וסקולריזציה (Mule ו-Rosenberg ב-Immune Responses to Metastases משנת 1985, Rosenberg ב-J Natl Cancer Inst משנת 1985, Ettinghausen ו-Rosenberg ב-Cancer Res משנת 1986, ו-Lafreniere ו-Rosenberg ב-Surg Forum משנת 1985). מחקרים אלה עודדו ביצוע ניסוי קליני ב-30 מטופלים עם סרטן מתקדם, שקיבלו בתחילה עירוי של תאי LAK שנוצרו מטיפול עם IL-2 טבעי, מלווה על ידי תאי LAK שנוצרו על ידי טיפול עם IL-2 רקומביננטי (Lotze וחב' ב-J Immunol משנת 1980). באף לא אחד ממטופלים אלה הייתה תגובה אנטי-סרטנית. הניסויים בעכברים הצביעו על הצורך במינונים יותר אגרסיביים של IL-2 שהם עדיין נסבלים באדם.
אכן, מינונים גבוהים יותר הביאו להדגמה הראשונה שהחדרת IL-2 הייתה מסוגלת לגרום לנסיגת הגידולים באדם (Rosenberg וחב' ב-N Eng J Med משנת 1985). רוב המטופלים טופלו בשלבי מחלה מוקדמים במינון של IU/Kg60,000 אחת ל-8 שעות, ובהמשך הטיפול קיבלו 180,000U/Kg ואף600,000U/Kg, ונמצא שרמות קראטינין ובילירובין היו מוגברות בערך במחצית מהמטופלים, והן חזרו לנורמה בתום הטיפול. גידולים אינם מבטאים קולטנים ל-IL-2, ולכן הפעילות האנטי-סרטנית היא התוצאה של גירוי תאי החיסון על ידי IL-2. בשנת 1987, דווחו התוצאות של 157 המטופלים הראשונים עם סרטן מתקדם שטופלו במינון גבוה של IL-2 באופן יחידני או בשילוב עם תאי LAK (Rosenberg וחב' ב-N Eng J Med משנת 1987). מינון של 600,000-720,000U/Kg אחת ל-8 שעות, נקבע כמינון הנסבל המקסימלי. בשלושים מתוך 157 המטופלים, נמצאה נסיגה אובייקטיבית של הגידולים, מתוכם 13 מתוך 57 מטופלים עם סרטן כליות, ו-12 מתוך 42 מטופלים עם מלנומה. נסיגת הגידולים הייתה מתמשכת, ובשבעה מתוך תשעה מטופלים עם תגובה מושלמת, הרמיסיה נמשכה שנים אחדות. ניסוי אקראי שכלל 181 מטופלים עם מלנומה גרורתית, או עם סרטן תאי כליה, הראה שההשפעה האנטי-סרטנית הייתה כתוצאה מטיפול יחידני עם IL-2 ללא צורך בשילוב עם תאי LAK (Rosenberg וחב' ב-J Natl Cancer Inst משנת 1993). תוצאות אלה הביאו לגל ניסויים במטופלים עם סרטן גרורתי בעזרת עירוי מתמשך עם IL-2 (Rosenberg וחב' ב-JAMA משנת 1994, Rosenberg וחב' ב-Ann Surg משנת 1998, ו-Yang ב-J Clin Oncol משנת 2003). מטופלים עם מלנומה גרורתית או עם תאי סרטן כליה גרורתיים הגיבו להחדרת מינון גבוה של IL-2' ופרט למטופלים עם לימפומה non-Hodgkin מתקדמת, רק תגובה נדירה לציטוקין זה נרשמה בסוגי סרטן אחרים (Weber וחב' ב-J Clin Oncol משנת 1992).
ישנן ראיות לתפקידים של IL-2 בסיוע לפעילות החיסונית (Bamford וחב' ב-Proc Natl Acad Sci USA משנת 1994, ו-Smith וחב' ב-Nature משנת 1980) בהישרדות של תאי T (Blattman וחב' ב-Nature Med משנת 2003), ובהתמיינות של תאי T "נאיבים" לתאים אפקטורים ולתאי זיכרון (Cho וחב' ב-J Exp Med משנת 2007, Kamimura ו-Bevan באותו כתב-עת משנת 2007, ו-Ke וחב' באותו כתב-עת משנת 1998). ראיות עדכניות מראות ש-IL-2 הוא גם גורם חשוב המסייע לזיכרון של תאי T, כאשר אלה יכולים לעבור התרחבות שניונית כאשר הם פוגשים מחדש באנטיגן בו נתקלו בעבר (Bachmann וחב' ב-Eur J Immunol משנת 2007, ו-Williams וחב' ב-Nature משנת 2006). בנוסף, ל-IL-2 היכולת להתגבר על מחסום שגשוגי של תאים אנרגיים שאינם מגיבים לאנטיגנים המוצגים להם in vitro (Powell וחב' ב-Immunol Rev משנת 1998, ו-Schwartz ב-J Exp Med משנת 1996), ובמצבים מסוימים גם לאנטיגנים המוצגים להם in vivo (Kundig וחב' ב-Immunity משנת 1996).
קסקדת האיתותים התלויה ב-IL-2
IL-2 נקשר ראשית על ידי הקולטן IL-2Rα, מה שגורם לשינוי בקונפורמציה של IL-2 ומגביר את הזיקה שלו לקולטנים IL-2Rβ ו-IL-2Rγ (Spangler וחב' ב-Immunity משנת 2015). הקשר של IL-2 עם IL-2R משרה דימריזציה של ה-motifs המאותתים בזנב הציטופלמטי של IL-2Rβ ושל IL-2Rγ, וגורם לפוספורילציה של שתי קינאזות Janus, JAK1 ו-JAK3, מה שמפעיל פעילות קינאזות על שיירי טירוזין החיוניים בזנב של IL-2Rβ (Cheng וחב' ב-Immunol Rev משנת 2011). האיתות במורד הציטופלזמה מתרחש בשלושה מסלולים עיקריים: מסלול JAK-STAT, מסלול phosphoinisitide3-kinase-AKT (להלן (PI3K-AKT ומסלול mitogen-activated protein kinase (להלן MAPK). מסלולים אלה בסופו של תהליך, מביאים לשעתוק של גנים חיוניים התורמים לפעילויות הביולוגיות התלויות ב-IL-2, על ידי גיוס של החלבון המתאם She ושל גורם השעתוק STAT5. הגנים הקשורים לאיתות של IL-2 כוללים את cyclin D2 ,bcl-2 ,fasL ווהגן prdm1 המשתיק את IL-2 ומקודד לגורם השעתוק BLIMP1 (Kovanen וחב' ב-Int Immunol משנת 2005).
הזרוע האדפטיבית של שפעול התלוי ב-IL-2
IL-2 משחק תפקיד דואלי בשפעול של תאי T על ידי עידוד השגשוג וההתמיינות של תאי T "קונבנציונליים"' כמו גם תחזוק והרחבה של אוכלוסיית תאי T רגולטוריים (להלן Treg cells) שתפקידם סופרסיבי (Mitra וחב' ב-J Leukoc Biol משנת 2018). תאי T נאיבים "קונבנציונליים" +CD4 ו-+CD8, מבטאים את הקולטן הדימרי IL-2R, ולכן דורשים ריכוז גבוה של IL-2 על מנת להשרות את השגשוג ההתחלתי (Liao וחב' ב-Immunity משנת 2013). כאשר תאים אלה משופעלים, הם מבטאים את הקולטן הטרימרי IL-2R, מה שמדרבן את ההתמיינות של התאים לכיוון של תאים אפקטורים או של תאי זיכרון (Boyman ו-Sprent ב-Nat Rev Immunol משנת 2012). התמיינות זו תלויה בעוצמה ובמשך הפעולה של האיתות של IL-2.
במהלך ההתרחבות ההתחלתית של תאי +T CD8 כתוצאה מרמות נמוכות-עד-מתונות של IL-2, תת-קבוצה של תאי +CD8 מתמיינת לתאי זיכרון T (Pipkin וחב' משנת 2010). היא עושה זאת על ידי דיכוי של CD25 והגברת הביטוי של CD127 (להלן (IL-R7) ושל CD62 (להלן L-selectin) שהם קולטנים קריטיים בתגובה השניונית במקרי הדבקה חוזרת. במהלך הדבקה חריפה, רמות מוגברות של IL-2 גורמות להגברה מחדש של CD25, ולהתמיינות של תאי +T CD8 לתאים ציטוטוקסיים אפקטורים (Choudhry וחב' ב-Biomed Res Int משנת 2018, ו-Kalia וחב' ב-Immunity משנת 2010). פעילות זו מכינה את הביטוי המונחה על ידי IL-2 של קולטני ה"מוות" fas ו-fasL, מה שגורם למות תאים בעת פינוי הפתוגן. באשר לתאי +T CD4, השפעול של איתות STAT5 על ידי IL-2, משפיע על ההתמיינות של תאים אלה לאוכלוסייה של T helper cells כולל Th2 ,Th1 ו-Th17.
רמות הומאוסטטיות של IL-2 חיוניות להישרדות ולתפקוד של תאי Treg, על ידי שמירה על הביטוי של FOXP3 ושל CD251. תאי Treg מופיעים באופן טבעי בבלוטת התימוס, והם יכולים להיווצר בעזרת גירוי של תאי T +CD4 "קונבנציונליים" תוך כדי אינטראקציה עם אנטיגנים באיברים לימפואידים היקפיים. כיוון שתאי Treg אינם יכולים לייצר IL-2, הם תלויים בתאים המייצרים ציטוקין זה כגון תאי T "קונבנציונליים". בנוסף, כיוון שתאי Treg מבטאים באופן ניכר את CD25, הם יכולים לנצל ולהגביל את הריכוזים הסיסטמיים של IL-2, ובכך לוודא את הרגולציה של המאזן החיסוני (Klatzmann ו-Abbas ב-Nat Rev Immunol משנת 2015). בהיעדר IL-2, מספרם של תאי Treg פוחת, ולעומת זאת עולה מספרם של תאי T אפקטורים, מה שמוביל לרגישות מוגברת למפגעים אוטו-אימוניים ודלקתיים. לפיכך, השפעול הייחודי של תאי Treg ברמות נמוכות של IL-2, שאינו משפעל תאי T מסוג +CD4 או +CD8, מאפשר פיתוח של IL-2 בגישה תרפויטית מבטיחה במפגעים אוטו-אימוניים או דלקתיים כמו קוליטיס. היצירה של IL-2 מ-2 הזרועות של מערכת החיסון מדגישה את החשיבות של ציטוקין זה בשלבים המוקדמים של הדבקה. כמו גם בתגובה האדפטיבית השניונית של מערכת זו. יתרה מכך, התפקודים הדואליים של IL-2 באופן מגונן אך גם בסובלנות חיסונית, מאפשרת לעשות שימוש ב-IL-2 כגורם תרפי פוטנציאלי במצבים לכאורה סותרים כגריין חיסוני כנגד סרטן אך גם כמדכא חיסוני במחלות אוטו-אימוניות (Abbas וחב' ב-Sci Immunol משנת 2018).
הקולטנים של IL-2
ציטוקין זה נקשר לצורות שונות של הקולטן IL-2R, מונומרים, דימרים וטרימרים. הקולטן IL-2R המונומרי מורכב משרשרת בחלק הממברנלי IL-2α (או CD25) שקיימת גם בצורה מסיסה שאינה מסוגלת להשרות איתותים. הצורה הדימרית של הקולטן מורכבת משרשרת IL-2Rβ (או CD122) ומשרשרת IL-2Rγ (או CD132). הצורה הטרימרית של הקולטן מורכבת מ-IL-2Rα ,IL-2Rβ ו-IL-2Rγ. שרשרת γ מהווה קולטן לכל חברי משפחת הציטוקינים הזו (Liao וחב' ב-Curr Opin Immunol משנת 2011). תת-יחידה α של הקולטן IL-2R קושרת IL-2 בזיקה נמוכה (Kd בערך 10-8M) האינטראקציה בין IL-2 ו-IL-2α אינה מוליכה להעברת איתותים היות שהמקטע התוך-תאי של קולטן זה הוא קצר מדי, אך יש ל-IL-2 היכולת (כאשר הוא נקשר לתת-יחידות β ו-γ) להגביר את הזיקה ל-IL-2R פי-100 (Arenas-Ramirez וחב' ב-Trends Immunol משנת 2015, ו-Wang וחב' ב-Science משנת 2005). הטרוֹ-דימריזציה של תת-יחידות β ו-γ חיונית לאיתות בתאי T (Gaffen ו-Liu ב-Cytokine משנת 2004). IL-2 יכול לאותת או דרך הקולטנים הדימריים CD25/CD122/CD132 עם הזיקה הבינונית (Kd=10-8M), או דרך הקולטנים הטרימריים CD25/CD122/CD132 עם הזיקה הגבוהה (Kd=10-11M). IL-2R הדימרי מבוטא על ידי תאי T זיכרון +CD8, וכן על ידי תאי ,NK בעוד שתאי Treg ותאי T משופעלים מבטאים רמות גבוהות של IL-2R טרימרי.
בניגוד לצורה המונומרית של IL-2R, הצורות הדימרית והטרימרית גורמות לשיכוך קסקדת האיתותים, בעת קישור IL-2 לקולטנו. IL-2 נקשר בזיקה גבוהה לצורה הטרימרית של הקולטן, אך בזיקה נמוכה-עד-בינונית לצורה הדימרית של הקולטן. בנוסף, IL-2 יכול להיקשר ל-IL-2Rα המבוטא על פני תאים דנדריטים משופעלים, באופן שהוא מוצג לתאים שכנים, כולל תאי T נאיביים הספציפיים לאנטיגנים, ותאי NK המבטאים שרשראות IL-2Rβ ו-IL-2Rγ. בשנת 1984, אישה עם מלנומה גרורתית שהחמירה למרות טיפולים קודמים, טופלה על ידי עירוי אגרסיבי של rIL-2. תוך חודש לאחר הטיפול, ביופסיה של אחד הגידולים שלה הצביעה על נמק ניכר, ולאחר חודשיים כל משקעי הגידולים התכווצו, כאשר מספר חודשים לאחר מכן, הראיות לגבי גידולים נעלמו. מטופלת זו נותרה נקייה ממחלה עד שנת 2014 ועדיין נקייה ממחלה להמשך המעקב על פי עדותו של סטיבן רוזנברג הרופא הנודע והמוביל בתחום. אישה זו הייתה חולת הסרטן הראשונה שהגיבה לטיפול עם IL-2, והראשונה להדגמה שטיפול אימונולוגי טהור המעודד לימפוציטים מסוג T, יכול לתווך באדם בהרג מוחלט של סרטן גדול, חודרני, ומוזן על המערכת הווסקולרית. מטופלת זו כמו גם אלפי מטופלים עם IL-2, שיחקו תפקיד בהחדרת אימונו-תרפיה כגישה מרכזית בטיפול בסרטן. מספר אירועים סמינליים בהתפתחות של אימונולוגיה תאית מודרנית, סייעו בתרגום של מושגים אימונולוגיים לאימונו-תרפיה יעילה בחולי סרטן. המחקר על התפקיד הישיר של לימפוציטים ועל חשיבות התגובה החיסונית התאית, הביאה לימפוציטים לחזית המחקרים האימונולוגיים (Mitchison ב-J Exp Med משנת 1955). אך מחקרים אלה, בראשית הדרך, היו מסובכים לביצוע בגין אי היכולת לשמר את ההישרדות ואת השגשוג של לימפוציטים ex vivo עד לשנת 1976, והגילוי של גורם הגדילה של תאי T הידוע כ-IL-2, והמיוצר על ידי הלימפוציטים עצמם, שבעזרתו ניתן לגדל לימפוציטים in vitro מה שקידם במהירות מחקרים באימונולוגיה תאית (Morgan וחב' ב-Science משנת 1976).
בשלב מוקדם של התגובה החיסונית, היצירה של IL-2 על ידי דנדריטים דורשת את קישורם של ליגנדים מיקרוביאלים ספציפיים כמו ליפופוליסכרידים, פפטידוגליקנים, זימוסאנים, ו-CpG DNA לקולטנים הכרתיים. באופן ספציפי, אגוניסטים אלה מעודדים את הטרנסלוקציה של NFAT (או nuclear factor of activated T cells) לגרעין של דנדריטים על ידי שפעול של פוספטאזה חיונית התלויה בסידן, או calcineurin. תהליך זה, גורם לביטוי התלוי ב-NFTA של מספר גנים המקודדים ל-IL-2 (Friedmann וחב' ב-Proc Natl Acad Sci USA משנת 1996). נמצא שיצירת IL-2 המתווכת על ידי calcineurin בתאים מייאלואידים, משחקת תפקיד חשוב במיקרוביוטה במעי. מה ששומר על ההומאוסטזיס במעי על ידי השפעה על המאזן בין התגובות הדלקתיות והרגולטוריות של תאי +T CD4 (על פי Liao וחב' ב-Immunity משנת 2010).
מסלולי האיתות והרגולציה של IL-2
ההשפעות הפלאוטרופיות של IL-2 מתאפשרות בגין העובדה שהאיתות של IL-2 יכול להיות מועבר דרך שלושה מסלולי איתותים: JAK-STAT ,PI3K/Akt/mTOR ו-.MAPK-ERK לאחר ש-IL-2 נקשר לקולטן שלו, המקטעים הציטופלזמטיים של CD122 ו-CD132 עוברים דימריזציה מה שמוביל לשפעול של שני ה-Janus kinases, JAK1 ו-JAK3, המבצעים פוספורילציה של שייר טירוזין 338 על פני CD122, מה שמגייס גורמי שעתוק של STAT, ובעיקר את STAT5 שעובר דימריזציה ונודד לגרעין התא שם הוא נקשר ל-DNA. הרגולציה של ביטוי הגן המקודד ל-IL-2, יכולה להתרחש ברמות ובדרכים שונות. מסלולי האיתותים המתחילים ב-TCR (או T cell antigen receptor) דרך פעילות של פוספוליפאזה C המשפעלת שלושה גורמי שעתוק מרכזיים ומסלוליהם: NFκB ,NFAT ו-AP-1. לאחר קו-סטימולציה בעת ובעונה אחת על ידי CD28, מושרה השפעול האופטימלי של ביטוי IL-2 ושל שלושת המסלולים האחרונים. באותו זמן, מבוטא Oct-1 בלימפוציטים T המסייע לשפעול האמור, כאשר Oct-2 מושרה לאחר השפעול. ל-NFAT יש מספר חברי משפחה, הממוקמים כולם בציטופלזמה, והאיתות דרכם מתבצע דרך calcineurin. NFAT עובר דה-פוספורילציה ומועבר לגרעין. AP-1 הוא דימר המורכב מהחלבונים c-Jun ו-,c-Fos והוא פועל בתיאום עם גורמי שעתוק אחרים כולל NFκB ו-Oct. NFκB מועבר לגרעין לאחר סטימולציה דרך CD28. NFκB הוא הטרודימר ויש לו 2 אתרי קישור על פני ה-promoter של IL-2.
שימושים רפואיים
אנלוגים פרמצבטיים: Aldesleukin היא צורה רקומביננטית של IL-2, הוא משווק בשם המותג Proleukin. הוא קיבל את אישור ה-FDA וכן במספר מדינות באירופה, לטיפול במלנומה ממאירה וכן בסרטן תאי הכליה, במינון גבוה באופן מתמשך (Noble ו-Goa ב-BioDrugs משנת 1997, Bhatia וחב' ב-Oncology משנת 2009). Interking הוא רקומביננט של IL-2 עם שייר serine בעמדה 125, המשווק על ידי Shenzhen Neptunus (Bloomberg Business Week משנת 2014). Neoleukin 2/15 הוא אנלוג שנועד למנוע תופעות לוואי (Silva וחב' ב-Nature משנת 2019). ההתעניינות באנלוגים אלה נמוכה כיוון שהמינון המומלץ שלהם מאוד נמוך והעלות גבוהה. הטיפול מתבצע או בעירוי לווריד או בהזרקה תת-עורית, ובמקרים של מלנומה הוא ניתן בהזרקה ישירה לתוך הגידול עם תגובה מרשימה (Shi וחב' ב-J Am Acad Dermatol משנת 2015). בניסויים קדם-קליניים החדרה מקומית של IL-2 לתוך הגידול נמצאה יותר יעילה קלינית מאשר תרפיה סיסטמית בטווחי מינון שונים ללא תופעות לוואי חמורות (Den Otter וחב' ב-Cancer Immunol Immunother משנת 2008). כלי-דם בגידולים, רגישים יותר מכלי-דם נורמליים להשפעות של IL-2. בהזרקה של האחרון ישירות לגידול, השפעתו ניכרת רק בגידול עצמו, פגיעה בזרימת הדם בתוך הגידול, הורסת את רקמת הגידול עצמה (Jacobs וחב' ב-Cancer Immunol Immunother משנת 2005). במקרים של קרצינומה אפית-לועית המטופלת על ידי הקרנות, ההישרדות החופשית ממחלה לפרק זמן של 5 שנים גדלה מ-8% ל-63% לאחר הזרקה מקומית של IL-2.
טוקסיות
טיפול סיסטמי עם IL-2 הוא בעל חלון תרפויטי צר כאשר מינונים גבוהים עלולים להחמיר את תופעות הלוואי (Shaker ו-Younes ב-J Pharmaceut Sci משנת 2009). במקרים של טיפול מקומי עם IL-2 חלון המינונים גדל בכמה סדרי גודל. תופעות הלוואי השכיחות ביותר הן תסמינים דמויי שפעת (חום, כאבי ראש, כאבי שרירים ופרקים, עייפות, בחילה והקאות, עור יבש או מגרד עם פריחה, חולשה וקוצר-נשימה; שלשולים, לחץ-דם נמוך, איבוד תיאבון, רדימות ובלבול. תופעות לוואי חמורות יותר יכולות להתבטא בקשיי נשימה, זיהומים חמורים, פרכוסים, תגובות אלרגיות, בעיות לב או כשל כליות. תופעת הלוואי השכיחה ביותר של מינון גבוה של IL-2 היא תסמונת הדליפה הווסקולרית (להלן VLS) הנגרמת על ידי תאי אנדותל בריאות המבטאים קולטני IL-2R בעלי זיקה גבוהה לציטוקין זה. תאים אלה, לאחר קישורם על ידי IL-2, מגבירים את החדירות הווסקולרית, באופן שנוזל תוך-וסקולרי דולף החוצה לרקמות הריאה, מה שמגביר את סכנת החיים כתוצאה מבצקת ריאתית או מוחית. חולשה נוספת של אימונותרפיה עם IL-2 במחלות סרטניות, היא תקופת מחצית החיים הקצרה שלו בצירקולציה.
נגזרות פרמצבטיות
חברת Eisai משווקת תכשיר הידוע כ-denileukin diftitox (שם מותג Ontak) שהוא רקומביננט של חלבון איחוי של IL-2 אנושי כליגנד הקשור לטוקסין של דיפטריה (Figgitt וחב' ב-Am J Clin Dermatol משנת 2000). תכשיר זה נקשר לקולטנים של IL-2 ומחדיר את הטוקסין של דיפטריה לתוך תאים המבטאים קולטנים אלה, והורג אותם. במקרים אחדים של לימפומה ולויקמיה, תאים סרטניים מבטאים את הקולטן של IL-2 באופן שהתכשיר האחרון מסוגל להמית אותם. בשנת 1999, אושר Ontak על ידי ה-FDA לטיפול בלימפומה של תאי T בעור.
מחקר קדם-קליני
IL-2 אינו נוהג לפי עקומת ה-dose-response הקלאסית של תכשירים כימותרפויטיים. הפעילות האימונולוגית של מינון גבוה או נמוך של IL-2 גורמת להשפעות מנוגדות. הדבר עלול להיות כרוך לפיזור השונה של הקולטנים (CD122, CD25 ו-CD132 ) של IL-2 על פני אוכלוסיות תאים שונות, המשופעלים על ידי מינונים גבוהים או נמוכים של הציטוקין. בדרך כלל, מינונים גבוהים מדכאים את התגובה החיסונית, בעוד שמינונים נמוכים מעודדים חסינות type 1 (Tomova וחב' ב-Anticancer Res משנת 2006). לדוגמה, מינון נמוך של IL-2 מדווח כמפחית הדבקות עם הפאטיטיס B ו-C (Tomova וחב' באותו כתב-עת משנת 2009). כמו כן נמצא שמינון נמוך של IL-2 הצליח לאפנן את מערכת החיסון במקרים של סוכרת type 1 ושל וסקוליטיס (Hartmann וחב' ב-Lancet Diabetes Endocrinol משנת 2013). שלא בדומה, טיפול במינון גבוה של IL-2 במקרים של נשאי HIV נמצא לא יעיל במניעת התקדמות המחלה לשלב של AIDS בשני דיווחים משנת 2009. ניסויים בוצעו על ידי הזרקה של IL-2 בשילוב עם נוגדנים חד-שבטיים כנגד IL-2, שנמצאו מגבירים את הפעילות הביולוגית של IL-2 in vivo, כאשר ההשפעה העיקרית של תופעה זו היא בהארכה של תקופת מחצית החיים שלו בצירקולציה. בתלות בסוג הנוגדן החד שבטי האמור, IL-2 יכול לעודד באופן בררני תאים עם ביטוי גבוה של הקולטן CD25, כאשר הקומפלקס הוא IL-2/JES6-1. או לעודד תאים עם ביטוי גבוה של הקולטן CD122, כאשר הקומפלקס הוא .IL-2/S4B6 הקומפלקס האחרון הוא בעל פעילות מעודדת גבוהה לגבי תאי NK ולגבי תאי CD8+ T memory, והוא יכול לבוא במקום טיפול עם IL-2 קונבנציונלי באימונו-תרפיה של סרטן. לעומת זאת, הקומפלקס IL-2/JES6-1 הוא בעל בררנות גבוהה המעודדת תאי T רגולטוריים, והוא עשוי להיות שימושי פוטנציאלית במקרים השתלת איברים או לטיפול במחלות אוטו-אימוניות (Boyman וחב' ב-Science משנת 2006).
הוראות לביצוע הבדיקה
דם נלקח במבחנה כימית (פקק אדום) או במבחנת ג'ל (פקק צהוב), לאחר קרישת הדם מתבצע סרכוז והנסיוב מוקפא במבחנת פלסטיק. יש לשים לב לעובדה שרמות ציטוקינים בדם עלולות להיות מושפעות מזמן לקיחת הדם במהלך היממה (diurnal variation), לכן בהשוואות ארוכות טווח של רמת IL-2, יש להקפיד על נטילת הדם באותה שעה. יש לפסול דגימות שעברו אינאקטיבציה בחשיפה לטמפרטורות גבוהות. יש להעביר את הדגימה למעבדה באופן קפוא (מועדף). הדגימות הקפואות יציבות למשך שנה. שיטת הבדיקה: ELISA או Quantitative Multplex beads.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 