הבדלים בין גרסאות בדף "אוביקוויטין - Ubiquitin"
| שורה 21: | שורה 21: | ||
==גילוי ה-ubiquitin== | ==גילוי ה-ubiquitin== | ||
| − | משפחת ה-ubiquitin (הכוללת את Nedd8, ubiquitin, SUMO, ISG15 ועוד) נכרכה עם וויסות של פרוטאוליזה, המיקום הגרעיני, מבנה הכרומטין, האינטגריטי הגנטי, פיקוח על איכות החלבונים, ואיתותים (Schwartz ו-Hochstrasser ב-rends Biochem Sci משנת 2003). הדוגמה הפרוטוטיפית של פעילות זו היא הקישור הקו-ולנטי של ubiquitin לחלבונים על מנת ליעד אותם לפירוק על ידי ה-proteasome, אשר תואר בשני מאמרים מתחילת שנות ה-80 וב-2004 על ידי | + | משפחת ה-ubiquitin (הכוללת את Nedd8, ubiquitin, SUMO, ISG15 ועוד) נכרכה עם וויסות של פרוטאוליזה, המיקום הגרעיני, מבנה הכרומטין, האינטגריטי הגנטי, פיקוח על איכות החלבונים, ואיתותים (Schwartz ו-Hochstrasser ב-rends Biochem Sci משנת 2003). הדוגמה הפרוטוטיפית של פעילות זו היא הקישור הקו-ולנטי של ubiquitin לחלבונים על מנת ליעד אותם לפירוק על ידי ה-proteasome, אשר תואר בשני מאמרים מתחילת שנות ה-80 וב-2004 על ידי Hershko Ciechanover ו-Rose (Ciechanover וחב' ב-Proc Natl Acad Sci USA משנת 1980, ו-Hershko וחב' באותו כתב-עת מאותה שנה). החוקרים הסבירו את העובדה שפרוטאוליזה תוך תאית בתאי יונקים דורשת אנרגיה. Melvin Simpson הוא הראשון שהבחין בתופעה זו במחקרו על סימון איזוטופי של חלבוני תאים (Simpson ב-J Biol Chem משנת 1953). ההידרוליזה של הקשר הפפטידי היא אקסרגונית, ואין סיבה תרמודינמית להזדקק לאנרגיה. חלק מההסבר לכך, החל מתברר באמצע שנות ה-70, כאשר Goldberg וחב' הראו שחלבונים ניזוקים או בלתי נורמליים מורחקים במהירות מהתאים (Goldberg ו-Dice ב-Ann Rev Biochem משנת 1974, ו-Goldberg ו-St John באותו כתב עת משנת 1976). He ו-Schimke מצאו שאנזימים המקטלזים שלבים מגבילי קצב (rate-limiting steps) במסלולים מטבוליים הם בדרך כלל קצרי ימים וכמויותיהם מגיבות למצבים המטבוליים (Circ Res משנת 1976). לפיכך, בסוף שנות ה-70 החל החשד שפרוטאוליזה תוך-תאית תלויה באנרגיה (Ciechanover ב־Nat Rev Mol Cell Biol משנת 2005, ו-Goldberg ב-Neuron מאותה שנה). בשנת 1979, Hershko ו-Ciechanover עשו שימוש בממצא הסמינלי של Etlinger ו-Goldberg שליזטים של רטיקולוציטים (החסרים ליזוזומים) הפגינו פרוטאוליזה התלויה ב-ATP של חלבונים שעברו דנטורציה ולכן מועמדים לפרקציונציה ביוכימית (Proc Natl Acad Sci USA משנת 1977). |
| − | Hershko ו-Ciechanover היו הראשנים להראות שהמערכת יכולה להיות מופרדת לשתי פרקציות בהן פרוטאוליזה תלויה ב-ATP (Ciechanover וחב' ב־Biochem. Biophys. Res. Commun משנת 1978): הפרקציה הראשונה מכילה מרכיב בודד קטן, שהוא חלבון עמיד לחום אותו הם הגדירו כ־APF-1 (או ATP-dependent proteolysis factor 1) כיוון שהוא היה הפקטור הראשון שאופיין. שני החוקרים האלה המשיכו לאפיין את פרקציה II וגילו פרקציה בעלת משקל מולקולרי גדול (APF-2) המיוצב על ידי ATP ונדרש לרה-קונסטיטוציה של פרוטאוליזה התלויה ב-ATP (Hershko וחב' ב־Proc Natl Acad Sci USA משנת 1979). בראיה רטרוספקטיבית התברר ש-APF-1 הוא ubiquitin, וש- APF- | + | Hershko ו-Ciechanover היו הראשנים להראות שהמערכת יכולה להיות מופרדת לשתי פרקציות בהן פרוטאוליזה תלויה ב-ATP (Ciechanover וחב' ב־Biochem. Biophys. Res. Commun משנת 1978): הפרקציה הראשונה מכילה מרכיב בודד קטן, שהוא חלבון עמיד לחום אותו הם הגדירו כ־APF-1 (או ATP-dependent proteolysis factor 1) כיוון שהוא היה הפקטור הראשון שאופיין. שני החוקרים האלה המשיכו לאפיין את פרקציה II וגילו פרקציה בעלת משקל מולקולרי גדול (APF-2) המיוצב על ידי ATP ונדרש לרה-קונסטיטוציה של פרוטאוליזה התלויה ב-ATP (Hershko וחב' ב־Proc Natl Acad Sci USA משנת 1979). בראיה רטרוספקטיבית התברר ש-APF-1 הוא ubiquitin, וש-APF-2 הוא הפרוטאזה הפעילה, 26S proteasome.{{כ}} Gideon Goldberg גילה לראשונה את ubiquitin במחקריו על thymopoietin (Proc Natl Acad Sci USA משנת 1975), וחמש שנים לאחר מכן הוכח ש-APF-1 הוא אכן ubiquitin (Wilkinson וחב' ב-J Biol Chem משנת 1980). כדי לענות על השאלה האם יצירת הקשר הקו-ולנטי קשורה לפרוטאוליזה, הראו Hershko וחב' שהמצעים האותנטיים של המערכת עברו שינויים מפליגים ושמספר ניכר של מולקולות APF-1 נקשרו לכל מולקולה של מצע. הקוניוגציה נראתה מקוטלזת על ידי אנזים, מה שהצביע לראשונה על הפעילות של ligases של ubiquitin (Hershko ו-Ciechanover ב-Ann Rev Biochem משנת 1998, Tanaka וחב' ב-Mol Cells מאותה שנה, Pickart ב־Ann Rev Biochem משנת 2001, ו-Petroski ו-Deshaies ב־Nat Rev Mol.Cell Biol משנת 2005). |
==מנגנון הפעולה== | ==מנגנון הפעולה== | ||
גרסה מ־19:40, 16 בינואר 2024
| מדריך בדיקות מעבדה | |
| אוביקוויטין | |
|---|---|
| Ubiquitin | |
| מעבדה | כימיה בדם |
| תחום | הרס תוך-תאי של חלבונים לא-רצויים. |
| טווח ערכים תקין | בנסיוב – 9-100 ננוגרם/מ"ל, ובממוצע 32.7±13.8 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
Ubiquitin באדם הוא חלבון רגולטורי קטן, המכיל 76 חומצות אמינו, ומשקלו המולקולרי 8,548 דלטון. הנקודה האיזואלקטרית שלו (pI) היא 6.79, והוא נמצא ברוב הרקמות של יצורים אאוקריוטיים. Ubiquitin התגלה בשנת 1975 על ידי Gideon Goldstein במאמר שפרסם באותה שנה ב-Proc Natl Acad Sci USA. החלבון מקודד על ידי 4 גנים בגנום האנושי: ,UBB UBC, UBA52 ו־RPS27A (Kimura ו-Tanaka ב-J Biochem משנת 2010). ההוספה של ubiquitin למצע חלבוני מכונה ubiquitylation, והיא משפיעה על החלבונים בצורות רבות: הוא מסמן אותם לדגרדציה דרך פרוטאוזומים, הוא מסוגל לשנות את מיקומם בתא, הוא יכול לשנות את תפקודם, והוא מסוגל להגביר או למנוע את האינטראקציה שלהם עם חלבונים (Glickman ו-Ciechanover ב-Physiol Rev משנת 2002, Mukhopadhyay ו-Riezman ב-Science משנת 2007, ו-Schnell ו-Hicke ב-J Biol Chem משנת 2003). Ubiquitylation מורכב מ-3 שלבים: שלב השפעול, שלב הקוניוגציה, ושלב הליגציה, המבוצעים על ידי ubiquitin-activating enzymes (להלן E1s), ubiquitin-conjugating enzymes (להלן E2s) ו־ubiquitin ligases (להלן E3s), בהתאמה. התוצאה של הקסקדה הרציפה הזו היא ש-ubiqitin ייקשר לשיירי ליזין על מצע חלבון דרך קשר איזופפטידי, ייקשר לשיירי ציסטאין דרך קשר תיואסטרי, וייקשר לשיירי תריאונין דרך קשר אסטרי, או ייקשר לקבוצת אמינו של החלבון באזור ה-N-טרמינלי דרך קשר פפטידי (Pickart ו-Eddins ב-Bichim Biophys Acta משנת 2004, Komander ו-Rape ב-Ann Rev Biochem משנת 2012, ו-McDowell ו-Philpott ב־Int J Biochem Cell Biol משנת 2013). Ubiquitin משומר מאוד באבולוציה של אאוקריוטים, ולדוגמה קיימת הומולוגיה של 96% ברצף חומצות האמינו שלו באדם ובשמרים, אך גם בצמחים.
המודיפיקציה של החלבון יכולה להתבצע או על ידי חלבון ubiquitin בודד, או על ידי שרשרת של ubiquitins. מולקולות ubiquitin שניוניות קשורות תמיד לאחד מתוך 7 שיירי ליזין כגון כגון K29או K48, או למתיונין N-טרמינלי כגון M1. מולקולת ubiquitin הראשונה קשורה לחלבון קו-ולנטית דרך הקרבוקסילאט ה-C-טרמינלי לליזין, ציסטאין, סרין תראונין או לקצה ה-N-טרמינלי של חלבון היעד. ה־polyubiquitylationn מתרחש כאשר ה-C-טרמינל של ubiquitin אחר נקשר לאחד מתוך שיירי הליזין או לשייר מתיונין הראשון של מולקולת ubiquitin ליצירת שרשרת. תהליך זה חוזר על עצמו מספר פעמים. רק polyubiquitylation על שיירי ליזין מוגדרים כגון K29 או K48, כרוכים בדגנרציה של על ידי הפרוטאזום, ואילו polyubiquitylations אחרים, כגון ההתקשרות לשיירים K6, K11, K63 ו-M1, כמו גם monoubiquitylations, יכולים לווסת תהליכים כגון תגובה חיסונית, אנגיוגניות, שגשוג תאים, אפופטוזיס, endocytic trafficking, דלקת, תרגום ותיקון של DNA (Miranda ו-Sorkin ב-Mol Interventions משנת 2007). פענוח הדגרדציה של חלבונים על ידי ubiquitin זיכה את החוקרים בפרס נובל בכימיה בשנת 2004 (Ciechanover וחב' ב-Biochim Biophys Res Commune משנת 1978).
מערכת ה-ubiquitination הוגדרה בתחילה כמערכת פרוטאוליטית התלויה ב-ATP הנמצאת בתמצית תאים. פוליפפטיד עמיד לחום הנמצא בתמציות אלו, שכינויו, ATP-dependent proteolysis factor-1 (להלן APF-1), נמצא מתקשר קו-ולנטית למצע חלבוני בדמות האנזים ליזוזים בתהליך התלוי ב-ATP וב-Mg++ (McDowell וחב' ב־Biochem Biophys Res Commun משנת 2010). מולקולות אחדות של APF-1 נקשרו למולקולת מצע אחת על ידי קשר איזופפטידי, והקוניוגטים שנוצרו נהרסו במהירות עם השחרור של APF-1 חופשי. מיד לאחר שאופיינה הקוניוגציה של APF-1-protein. APF-1 זוהה כ-ubiquitin. קבוצת הקרבוקסיל של שייר הליזין ה-C-טרמינלי (Gly76) במולקולת ubiquitin זוהתה כקבוצה העוברת קוניוגציה עם שיירי ליזין של המצע. הגנים UBA52 ו-RPS27A מקודדים לעותק בודד של ubiquitin העובר איחוי עם החלבונים הריבוזומליים L40 ו-S27a, בהתאמה. הגנים UBB ו-UBC מקודדים לחלבונים הקודמניים polyubiquitin.
גילוי ה-ubiquitin
משפחת ה-ubiquitin (הכוללת את Nedd8, ubiquitin, SUMO, ISG15 ועוד) נכרכה עם וויסות של פרוטאוליזה, המיקום הגרעיני, מבנה הכרומטין, האינטגריטי הגנטי, פיקוח על איכות החלבונים, ואיתותים (Schwartz ו-Hochstrasser ב-rends Biochem Sci משנת 2003). הדוגמה הפרוטוטיפית של פעילות זו היא הקישור הקו-ולנטי של ubiquitin לחלבונים על מנת ליעד אותם לפירוק על ידי ה-proteasome, אשר תואר בשני מאמרים מתחילת שנות ה-80 וב-2004 על ידי Hershko Ciechanover ו-Rose (Ciechanover וחב' ב-Proc Natl Acad Sci USA משנת 1980, ו-Hershko וחב' באותו כתב-עת מאותה שנה). החוקרים הסבירו את העובדה שפרוטאוליזה תוך תאית בתאי יונקים דורשת אנרגיה. Melvin Simpson הוא הראשון שהבחין בתופעה זו במחקרו על סימון איזוטופי של חלבוני תאים (Simpson ב-J Biol Chem משנת 1953). ההידרוליזה של הקשר הפפטידי היא אקסרגונית, ואין סיבה תרמודינמית להזדקק לאנרגיה. חלק מההסבר לכך, החל מתברר באמצע שנות ה-70, כאשר Goldberg וחב' הראו שחלבונים ניזוקים או בלתי נורמליים מורחקים במהירות מהתאים (Goldberg ו-Dice ב-Ann Rev Biochem משנת 1974, ו-Goldberg ו-St John באותו כתב עת משנת 1976). He ו-Schimke מצאו שאנזימים המקטלזים שלבים מגבילי קצב (rate-limiting steps) במסלולים מטבוליים הם בדרך כלל קצרי ימים וכמויותיהם מגיבות למצבים המטבוליים (Circ Res משנת 1976). לפיכך, בסוף שנות ה-70 החל החשד שפרוטאוליזה תוך-תאית תלויה באנרגיה (Ciechanover ב־Nat Rev Mol Cell Biol משנת 2005, ו-Goldberg ב-Neuron מאותה שנה). בשנת 1979, Hershko ו-Ciechanover עשו שימוש בממצא הסמינלי של Etlinger ו-Goldberg שליזטים של רטיקולוציטים (החסרים ליזוזומים) הפגינו פרוטאוליזה התלויה ב-ATP של חלבונים שעברו דנטורציה ולכן מועמדים לפרקציונציה ביוכימית (Proc Natl Acad Sci USA משנת 1977).
Hershko ו-Ciechanover היו הראשנים להראות שהמערכת יכולה להיות מופרדת לשתי פרקציות בהן פרוטאוליזה תלויה ב-ATP (Ciechanover וחב' ב־Biochem. Biophys. Res. Commun משנת 1978): הפרקציה הראשונה מכילה מרכיב בודד קטן, שהוא חלבון עמיד לחום אותו הם הגדירו כ־APF-1 (או ATP-dependent proteolysis factor 1) כיוון שהוא היה הפקטור הראשון שאופיין. שני החוקרים האלה המשיכו לאפיין את פרקציה II וגילו פרקציה בעלת משקל מולקולרי גדול (APF-2) המיוצב על ידי ATP ונדרש לרה-קונסטיטוציה של פרוטאוליזה התלויה ב-ATP (Hershko וחב' ב־Proc Natl Acad Sci USA משנת 1979). בראיה רטרוספקטיבית התברר ש-APF-1 הוא ubiquitin, וש-APF-2 הוא הפרוטאזה הפעילה, 26S proteasome. Gideon Goldberg גילה לראשונה את ubiquitin במחקריו על thymopoietin (Proc Natl Acad Sci USA משנת 1975), וחמש שנים לאחר מכן הוכח ש-APF-1 הוא אכן ubiquitin (Wilkinson וחב' ב-J Biol Chem משנת 1980). כדי לענות על השאלה האם יצירת הקשר הקו-ולנטי קשורה לפרוטאוליזה, הראו Hershko וחב' שהמצעים האותנטיים של המערכת עברו שינויים מפליגים ושמספר ניכר של מולקולות APF-1 נקשרו לכל מולקולה של מצע. הקוניוגציה נראתה מקוטלזת על ידי אנזים, מה שהצביע לראשונה על הפעילות של ligases של ubiquitin (Hershko ו-Ciechanover ב-Ann Rev Biochem משנת 1998, Tanaka וחב' ב-Mol Cells מאותה שנה, Pickart ב־Ann Rev Biochem משנת 2001, ו-Petroski ו-Deshaies ב־Nat Rev Mol.Cell Biol משנת 2005).
מנגנון הפעולה
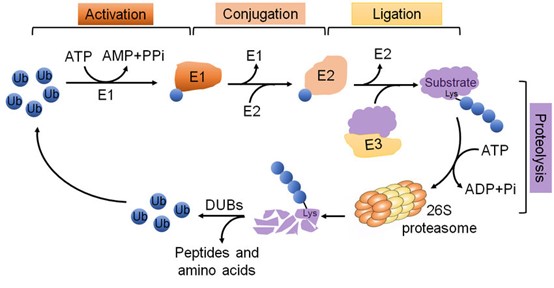
Ubiquitylation מתחלק לשלושה שלבים חיוניים המקוטלזים על ידי אנזימים המשפעלים אותו, ubiquitin ligases, אנזימים הקשורים לקוניוגציה שלubiquitin E2 ,E1) ו- (E3שלשת השלבים הם: 1) שפעול: אנזימי E1 עושים שימוש בתהליך התלוי ב-ATP ליצירה של קשר תיואסטרי בין קבוצת הקרבוקסיל ה־C- טרמינלית של ubiquitin וקבוצת הציסטאין של האנזים המשפעל אותו. 2) קוניוגציה: אנזים E2 נקשר אז ל-ubiquitin המשופעל ולקומפלקס E1,E2 מקטלז את הטרנספר של ubiquitin מאתר E1 לאתר הפעיל על פני E2 על ידי ריאקציית טרנס-אסטריפיקציה. 3) ליגציה: בשלב האחרון של מסלול ה־ubiquitination E3 ubiquitination ligase יוצר קשר איזופפטידי עם שייר ליזין של חלבון היעד והגליצין ה-C טרמינלי של ubiquitin. התוצאה של תהליכים אלה היא יצירת קומפלקס ubiquitin-מצע. כמו הפוספורילציה, ריאקציית ה-ubiquitination היא הפיכה. מה שמושג על ידי פעולת ה-deubiquitinating enzymes (או DUBs) (He וחב' ב-Cell Biosci משנת 2016). זיהוי המצע של E3 ligases קריטי להבין את משמעותו במחלות סרטניות באדם ומחלות אחרות. הדה-רגולציה של אינטראקציות המצע של E3 היא לרוב אינדיקטור של רבות מהפתולוגיות הללו. כמו כן, האסטרטגיה של genome-wide screening (הידועה כ-Global Protein Stability, להלן GPS) פותחה לזהות את המצעים של E3 ligases שלא היו מוכרים קודם לכן.
E1 משפעל את ubiquitin באופן התלוי ב-ATP, תוך שהוא מאפשר את הטרנספר לאנזים נושא ubiquitin .E2 Ubiquitin משופעל עובר כעת טרנספר על ידי ligase של ubiquitin E3 ופעילותיו כגון אנדוציטוזה, רגולציה של היסטון, תיקון של DNA, הנצה של נגיפים, ויצוא גרעיני. Ubiquitin יכול גם להתקשר לחלבון יעד בתהליך של polyubiquitination בו מספר רב של מולקולות ubiquitin נקשרות לשייר בודד של ליזין. Ubiquitin מכיל 7 שיירי ליזין שיכולים לשמש להגדלת שרשרת. Polyuiquitination הקשור ל-Lys48 כרוך בדרך כלל לדגרדציה של חלבוני-יעד על ידי מערכת 26S proteasome, בעוד ש- polyubiquitination הקשור ל-Lys63 קשור לתיקון DNA, להעברת איתותים ולאנדוציטוזה, אך לא לדגרדציה. E3 ubiquitin ligases הם משפחת חלבונים (עם כמעט 700 מהם בגנום האנושי) הידועים כמווסתים פעילות של חלבונים בתפקודים מגוונים. E3 ligases מחולקים לשתי קבוצות גדולות: האחת עם הומולוגיה לקרבוקסיל הטרמינלי של חלבון E6 של המקטע המכיל E3 ligases, והאחרת היא המקטע RING המכיל E3 ligases. ה-E3-ligases מסוג RING כוללים תת-יחידה בודדת של E3 ligases כגון Cbl family E3 ligases וכן E3 ligases רב תת-יחידות כגון Cullin-RING ubiquitin ligases.. מערכת ה-26S ptoteasome מורכבת מ-28 תת-יחידות, המסודרת כ-4 טבעות הפּטמריות מסודרות לסירוגין (Kaiser ו-Huang ב-Genome Biol משנת 2005). אף על פי שמספר תרופות (לדוגמה bortezomib) פותחו לעכב את מסלול ה-proteasome, הפעילויות הלא-ספציפיות שלהן הפחיתה מאוד את האפליקציה התרפויטית שלהן.
המודיפיקציה של החלבון יכולה להתבצע או על ידי חלבון ubiquitin בודד, או על ידי שרשרת של ubiquitins. מולקולות ubiquitin שניוניות קשורות תמיד לאחד מתוך 7 שיירי ליזין כגון כגון K29או K48, או למתיונין N-טרמינלי כגון M1. מולקולת ubiquitin הראשונה קשורה לחלבון קו-ולנטית דרך הקרבוקסילאט ה-C-טרמינלי לליזין, ציסטאין, סרין תראונין או לקצה ה-N-טרמינלי של חלבון היעד. ה־polyubiquitylationn מתרחש כאשר ה-C-טרמינל של ubiquitin אחר נקשר לאחד מתוך שיירי הליזין או לשייר מתיונין הראשון של מולקולת ubiquitin ליצירת שרשרת. תהליך זה חוזר על עצמו מספר פעמים. רק polyubiquitylation על שיירי ליזין מוגדרים כגון K29 או K48, כרוכים בדגנרציה של על ידי הפרוטאזום, ואילו polyubiquitylations אחרים, כגון ההתקשרות לשיירים K6, K11, K63 ו-M1, כמו גם monoubiquitylations, יכולים לווסת תהליכים כגון תגובה חיסונית, אנגיוגניות, שגשוג תאים, אפופטוזיס, endocytic trafficking, דלקת, תרגום ותיקון של DNA (Miranda ו-Sorkin ב-Mol Interventions משנת 2007). פענוח הדגרדציה של חלבונים על ידי ubiquitin זיכה את החוקרים בפרס נובל בכימיה בשנת 2004 (Ciechanover וחב' ב-Biochim Biophys Res Commune משנת 1978). גישה של אנליזה פרוטאומית הראתה שישנן מאות מולקולות של ligases כאלו שני סוגים שונים. לכן נראה שמספר רב של ligases היו פעילות בפרקציה II, מה שעשוי להסביר מדוע כל כך הרבה חלבונים שונים עברו ubiquitination. כמעט 10 שנים לאחר מכן, הראו Chau וחב' ב-Science משנת 1989 שהמצעים עבור פרוטאוליזה עברו כולם polyubiquitination, ליצירת שרשרת דרך שייר K48 של ubiquitin אחד וה-C-טרמינל של ה-ubiquitin הסמוך. מחקר חלוצי של Finley ושל Ellison הראה ששרשרות אחרות של polyubiquitin גם כן קיימות ושהן נדרשות במסלולים לא-פרוטאוליטיים (Spence וחב' ב־Mol Cell. Biol משנת 1995, ו-Amason ו-Ellison באותו כתב עת משנת 1994).
מערכת ה-ubiquitylation הוגדרה בתחילה כמערכת פרוטאוליטית התלויה ב-ATP הנמצאת בתמצית תאים. פוליפפטיד עמיד לחום הנמצא בתמציות אלו, שכינויו, ATP-dependent proteolysis factor-1 (להלן APF-1), נמצא מתקשר קו-ולנטית למצע חלבוני בדמות האנזים ליזוזים בתהליך התלוי ב-ATP וב-Mg++ (McDowell וחב' ב־Biochem Biophys Res Commun משנת 2010). מולקולות אחדות של APF-1 נקשרו למולקולת מצע אחת על ידי קשר איזופפטידי, והקוניוגטים שנוצרו נהרסו במהירות עם השחרור של APF-1 חופשי. מיד לאחר שאופיינה הקוניוגציה של ,APF-1-protein APF-1 זוהה כ-ubiquitin. קבוצת הקרבוקסיל של שייר הליזין ה-C-טרמינלי (Gly76) במולקולת ubiquitin זוהתה כקבוצה העוברת קוניוגציה עם שיירי ליזין של המצע. הגנים UBA52 ו-RPS27A מקודדים לעותק בודד של ubiquitin העובר איחוי עם החלבונים הריבוזומליים L40 ו-S27a, בהתאמה. הגנים UBB ו-UBC מקודדים לחלבונים הקודמניים polyubiquitin.
Ubiquitylation
הוא שינוי בתר-תרגומי בו חלבון ubiquitin נקשר לחלבון מצע. בתהליך זה נקשרת חומצת האמינו האחרונה של ubiquitin (glycine 76) לשייר ליזין של המצע. נוצר קשר איזופפטידי בין קבוצת קרבוקסיל (COO−) של הגליצין ב-ubiquitin ובין קבוצת ה־epsilon-amino(ε-NH+(3) של הליזין במצע (Tatham וחב' ב-Biochem J משנת 2013). ביקוע על ידי טריפסין של הקשר בין ubiquitin והמצע שלו מותיר את שְׁאֵרִית הדו-גליצין המשמשת לזיהוי אתר ה-biquitylation (Johnson וחב' ב-J Biol Chem משנת 1995, ו-Kirisako וחב' ב-EMBO J משנת 2006). Ubiquitylation נכרך גם עם מספר מפגעים גנטיים. תסמונת Angelman היא מפגע גנטי נדיר המשפיע על מערכת העצבים הנגרמת ממוטציה ב-UBE3A המקודד ל-E3 ubiquitin ligase. מחקרים גנטיים קודמים הציעו ש-UBE3A המקודד ל-E3 ubiquitin ligase חיוני לתפקוד הקוגניטיבי התקין באדם. גם מוטציית 3-M היא מפגע המאופיין על ידי עיכוב צמיחה תוך-רחמית הנגרמת על ידי מוטציות ב-CUL7, החשוב בהתגבשות של קומפלקס E3 ubiquitin ligase ומסייע ל-ubiquitylation.
Deubiquiylation
האנזימים של deubiquitylation (להלן (DUBs הם בעל פעילות נוגדת שלubiquitylation על ידי הרחקת ubiquitin חלבוני המצע. מדובר בפרוטאזות ציסטאין המבקעות את הקשר האמידי בין שני החלבונים. ה-DUBs מאוד ספציפיים בדומה ל־E3 ligases המתחברים ל-ubiquitin, עם מספר מצעים קטן לכל אנזים. הם יכולים לבקע הן האיזופפטיד הנוצר בין ubiquitin וליזין, וכן את הקשרים הפפטידיים הנוצרים בין ubiquitin לבין הקצה ה-N-טרמינלי. מעבר להרחקת ubiquitin מחלבוני המצע שלו, DUBs הם בעלי תפקידים נוספים בתוך התאים. Ubiquitin מבוטא כעותקים רבים המחוברים כשרשרת (polyubiquitin) או כקשור לתת-יחידות ריבוזומליות. DUBs מבקעים חלבונים אלה ליצירה של ubiquitin פעיל. הם מסוגלים למחזר ubiquitin שנקשר למולקולות נוקלאופיליות קטנות במהלך תהליך ה-ubiquitylation. חד-ubiquitin נוצר על ידי DUBs המבקעים ubiquitin משרשרות חופשיות של polyubiquitin שהוסרו קודם לכן מחלבונים (Schmidt וחב' ב־Proc Natl Acad Sci USA משנת 2003, ו-Knuutilaet וחב' ב-Am J Pathol משנת 1999).
Polyuiquitylation הקשור ל-Lys48, כרוך בדרך כלל לדגרדציה של חלבוני-יעד על ידי מערכת 26S ,proteasome בעוד ש- polyubiquitination הקשור ל-Lys63 קשור לתיקון DNA, להעברת איתותים ולאנדוציטוזה, אך לא לדגרדציה. E3 ubiquitin ligases, הם משפחת חלבונים (עם כמעט 700 חלבונים בגנום האנושי) הידועים כמווסתים פעילות של חלבונים בתפקודים מגוונים. E3 ligases מחולקים לשתי קבוצות גדולות: האחת עם הומולוגיה לקרבוקסיל הטרמינלי של חלבון E6 של המקטע המכיל E3 ligases, והאחרת היא המקטע RING המכיל E3 ligases ה-E3-ligases מסוג RING כוללים תת-יחידה בודדת של E3 ligases כגוןCbl family E3 ligases) ) וכן E3 ligases רב תת-יחידות כגון Cullin-RING ubiquitin ligases. מערכת ה-26S ptoteasome מורכבת מ-28 תת-יחידות, המסודרת כ-4 טבעות הפטמריות מסודרות לסירוגין (Kaiser ו-Huang ב-Genome Biol משנת 2005). אף על פי שמספר תרופות (לדוגמה bortezomib) פותחו לעכב את מסלול ה-proteasome, הפעילויות הלא-ספציפיות שלהן הפחיתה מאוד את האפליקציה התרפויטית שלהן.
המשמעות הקלינית
שינוי בקשר בין ubiquitin וה-proteasome עלול לגרום ליצירת גידולים סרטניים כמו גם למפגעים נוירו-דגנרטיביים. לפיכך, טיפולים פרמקולוגיים המכוונים ברמת המסלול ubiquitin-proteasome מספקים הזדמנויות פוטנציאליות לטפל בגידולים ובמפגעים נוירו-דגנרטיביים. לדוגמה, ubiquitin ligase MDM2 הוא בעל תפקיד חיוני בוויסות היציבות של p53, ומחקר מתמקד בפיתוח של מעכב הפוגע באינטראקציה האחרונה. עיכוב של proteasome הוא היעד התרפויטי היחיד של מערכת ubiquitin שעברה תיקוף, ואכן מעכב ה-proteasome הידוע כ-bortezomib קיבל בשנת 2003 את אישור ה-FDA לטפל במשברי multiple myeloma עמידים לטיפולים אחרים. צברים של חלבון המכילים חלבונים שעברו ubiquitination זוהו במחלת אלצהיימר, ב-amyotrophic lateral sclerosis ובמחלת פרקינסון (Edelmann וחב' ב־Expert Rev Mol Med משנת 2011, Ciechanover ו-Iwai ב-IUBMB Life משנת 2004, Lowe וחב' ב-Methods Enzymol משנת 2005, ו-Chu וחב' ב-Mod Pathol משנת 2000).
גישה של אנליזה פרוטאומית הראתה שישנן מאות מולקולות של ligases כאלו שני סוגים שונים. לכן נראה שמספר רב של ligases היו פעילות בפרקציה II, מה שעשוי להסביר מדוע כל כך הרבה חלבונים שונים עברו ubiquitination. כמעט 10 שנים לאחר מכן, הראו Chau וחב' ב-Science משנת 1989 שהמצעים עבור פרוטאוליזה עברו כולם polyubiquitination, ליצירת שרשרת דרך שייר K48 של ubiquitin אחד וה-C-טרמינל של ה-ubiquitin הסמוך. מחקר חלוצי של Finley ושל Ellison הראה ששרשרות אחרות של polyubiquitin גם כן קיימות ושהן נדרשות במסלולים לא-פרוטאוליטיים (Spence וחב' ב־Mol Cell. Biol משנת 1995, ו-Amason ו-Ellison באותו כתב עת משנת 1994).
רמה תאית
Ubiquitination מווסתת באופן מהודק וספציפי והליכים ביולוגיים התלויים ב-ATP מוצאים לפועל על ידי קסקדה מסובכת של אנזימים. Ubiquitination הוא שחקן הכרחי בהומאוסטאזיס של חלבון, הפועל להרחיק במהירות חלבונים לא רצויים או פגועים. מסלול ה-ubiquitination קשור לרגולציה של תהליכים תאיים רבים, הכוללים חלוקת תאים, תגובה לעקה חיצונית, התמיינות תאים, תגובה חיסונית תיקון DNA ואפופטוזיס (Ciechanover ב-EMBO J משנת 1998).
רמה מולקולרית
המשתתפים העיקריים בפעילות ubiquitin הם 7 שיירי הליזין שלו והקצה ה--N-טרמינלי. שרשרות הקשורות לליזין-48 ולליזין-63 הן אתרי ה-polyubiquitination השכיחים ביותר, שיכולות לגרום להרס חלבונים ולאנדוציטוזה שלהם (Grice ו-Nathan ב-Cell Mol Life Sci משנת 2016). Ubiquitination משחק תפקיד קריטי בכל ההיבטים התפקודיים של התא. אחד התפקודים המובנים ביותר של polyubiquitination הוא פירוק חלבונים. מסלול זה מוליך חלבונים ל-proteasome, שם מתבצע פירוק ומחזור של החלבונים. מסלול ה-ubiquitination הוא המפתח באיתותים תאיים רבים. לדוגמה, polyubiquitin של IkB-α הוא בעל תפקיד מרכזי בשפעול על ידי איתות של IkB-α . ה-nuclear factor-kappa B (להלן NF-κB) מווסת תהליכים ביולוגיים רבים בגוף, ושפעול פגום שלו עלול לגרום לפתוגנזה של מחלות, כגון מחלות נשימתיות וסוגי סרטן. ה-ubiquitination של IκBα מתרחש כאשר IκBα עובר פוספורילציה באתר Ser32/Ser36. פוספורילציה זו מאפשרת ל-ubiquitin E3 ligases מסוימים לזהות את IκBα, ולגרום לזיהויו של IκBα על ידי קומפלקס ה-proteasome המביא להריסתו, ולשחרור של transcription factor NFkB בגרעין מה שגורם לתגובה דלקתית. כמו שצוין למעלה ה-ubiquitination של חלבון משחק גם תפקיד בתנועת החלבון, לדוגמה התהליך האנדוציטוזה. Ubiquitination של תנועת חלבוני ממברנה אחראי גם לתנועה של מספר נגיפים כגון Ebola ו-HIV, העושים דרכם לשטח הפנים של התא לאחר שעברו רפליקציה בתוך התא (Heaton וחב' ב-J Exp Med משנת 2016, Wu וחב' ב-Cell Div מנת 2008, Chen ו-Qiu ב-Chin J Cancer משנת 2013, ו-Komander ב-Biochem Soc Trans משנת 2009).
פתופיזיולוגיה
Ubiquitination מתרחשת במהלך איתותים של תאים אאוקריוטיים, ויוחסה לממאירויות רבות על ידי מוטציות gain of function ו-loss of function. במחלת von-Hippel Lindau (להלן VHL) מוטציית loss of function ב-VHL tumor suppressor גורמת ליצירה של hemangioblastoma באיברים רבים, ולקרצינומה של תאי כליה, כמו גם ל-.pheochromocytoma החלבון של VHL הוא סוג של E3 ubiquitin ligase המקטלז את ה-ubiquitination של ה-transcription factor-α (HIF1-α) המושרה על ידי היפוקסיה. HIF-α מווסת יצירת אריתרופויאטין EPO)) וכן את יצירת vascular endothelial growth factor (VEGF) בצורת ההידרוקסילציה שלו, HIF1-α יכול להיות מוכר ולהתפרק על ידי חלבון VHL, מה שיכול למנוע את האינדוקציה של EPO ושל VEGF בתנאים נורמו-טוקסיים. במחלת VHL, מוטציה בגן גורמת לאיבוד היכולת של חלבוני VHL להיקשר ל-,HIF-α מה שמוביל לגידול בלתי מבוקר. דרך נוספת בה ubiquitination מעורבת בממאירות היא באופן בו שגשוג בלתי מבוקר נמצא מסוגל להתחמק ממסלול הפירוק של החלבון ב־ubiquitin-proteasome הקומפלקס האחרון משחק תפקיד חיוני בתאי המעי הגס ברגולציה של מסלול האיתות של β-catenin-adenomatous polyposis coli (APC) בתאי האפיתל של המעי הגס. מוטציות ב־APC 0, גורמות לכשל של פירוק β-catenin ולמניעת שגשוג תאים אלה.
Ubiquitination נכרך גם עם מספר מפגעים גנטיים. תסמונת Angelman היא מפגע גנטי נדיר המשפיע על מערכת העצבים הנגרמת ממוטציה ב-UBE3A המקודד ל-E3 ubiquitin ligase. מחקרים גנטיים קודמים הציעו ש-UBE3A המקודד ל-E3 ubiquitin ligase חיוני לתפקוד הקוגניטיבי התקין באדם. גם מוטציית 3-M היא מפגע המאופיין על ידי עיכוב צמיחה תוך-רחמית הנגרמת על ידי מוטציות ב-CUL7, החשוב בהתגבשות של קומפלקס E3 ubiquitin ligase ומסייע ל-ubiquitination. הרס של מסלול זה משחק תפקיד בפתוגניות של תסמונת זו (Voutsadakis ב-Biochim Biophys Acta משנת 2008, Greer וחב' ב-Cell משנת 2010, ו-Huber וחב' ב-Nature Genet משנת 2005).
פתוגנזה
מסלול ה-ubiquitin מעורב בפתוגנזה של מספר רב של מחלות ושל מפגעים כולל נוירו-דגנרציה, הדבקה וחסינות, מפגעים גנטיים וסרטן (Kobashigawa וחב' ב-Proc nal Acad Sci USA משנת 2011). Ubiquitin מעורב במחלת אלצהיימר, וב-motor neuron disease, במחלות Huntington ופרקינסון. רמות גבוהות יותר של ubiquitin במוח נמצאו מפחיתות מלפורמציה של amyloid precursor protein (להלן APP), המשחק תפקיד מפתח במחלת אלצהיימר.
הדבקה וחסינות
Ubiquitin ומולקולות הדומות לו מווסתים מסלולי איתותים מווסתי חיסוניות בשלבים השונים של הדבקה ופינוי הפתוגן מהגוף. הגן המושרה על ידי חומצה רטינואית (RIG-I) הוא סנסור ראשוני של מערכת החיסון כנגד RNA נגיפי או אחר בתאי אדם. הקולטן של RIG-I ( הידוע כ-RLR) נחקר במסגרת התפקיד של ubiquitin בוויסות של מערכת החיסון.
מפגעים גנטיים
תסמונת Angelman נגרמת על ידי פגיעה בגן UBE3A המקודד לאנזים ubiquitin ligase(E3) המכונה E6-AP. תסמונת Von Hippel–Lindau כרוכה בפגיעה בגן VHL המקודד ל־ubiquitin E3 ligase וידוע כמדכא של VHL tumor באנמיה ע"ש Fanoni. שמונה מתוך 13 הגנים המזוהים שההרס שלהם עלול לגרום למחלה האחרונה מקודדים לחלבונים היוצרים קומפלקס ubiquitin ligase (E3) גדול. תסמונת 3-M היא מפגע אוטוזומלי-רצסיבי של פגיעה בגדילה הכרוכה במוטציות של Cullin7 E3 ubiquitin ligase.
הוראות לביצוע הבדיקה
דם ורידי נלקח למבחנה כימית (פקק אדום או צהוב) ולאחר סרכוז הנסיוב מוקפא. שיטת הבדיקה על ידי ELISA. יש לקחת החשבון שתקופת מחצית החיים של ubiquitin היא 60 דקות בטמפרטורת החדר.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק