הבדלים בין גרסאות בדף "רישום תרופות בחולים עם תפקוד כלייתי ירוד - Drug prescribing for patients with decreased renal function"
| שורה 115: | שורה 115: | ||
במחלת כליה כרונית יש ירידה בפינוי כלייתי של תכשירים שעברו שינוי. לדוגמה, מורפיום: רוב המורפיום עובר מטבוליזם בכבד, ורק 4% מופרש ללא שינוי בכליה. שני מטבוליטים פעילים - Morphine 3 glucuronide ו-Morphine 6 glucuronide - מופרשים על ידי הכליה ומצטברים כאשר התפקוד הכלייתי ירוד. המטבוליט Morphine 6 glucoronide הוא בעל השפעה גדולה יותר מאשר תכשיר האם(19). הצטברות המטבוליטים עלולה לגרום לתופעות של רעילות עד כדי דיכוי נשימה, ולפיכך יש להפחית במינון(18). | במחלת כליה כרונית יש ירידה בפינוי כלייתי של תכשירים שעברו שינוי. לדוגמה, מורפיום: רוב המורפיום עובר מטבוליזם בכבד, ורק 4% מופרש ללא שינוי בכליה. שני מטבוליטים פעילים - Morphine 3 glucuronide ו-Morphine 6 glucuronide - מופרשים על ידי הכליה ומצטברים כאשר התפקוד הכלייתי ירוד. המטבוליט Morphine 6 glucoronide הוא בעל השפעה גדולה יותר מאשר תכשיר האם(19). הצטברות המטבוליטים עלולה לגרום לתופעות של רעילות עד כדי דיכוי נשימה, ולפיכך יש להפחית במינון(18). | ||
| − | במנגנון אחר, הצטברות מטבוליטים מקבוצות כמו Acyl glucuronides ותכשירים המכילים קבוצה קרבוקסילית יכולה להביא להידרוליזה חוזרת שלהם ולהצטברות של תרופת האם(9). לדוגמה, [[Ketoprophen]], השייך לקבוצת | + | במנגנון אחר, הצטברות מטבוליטים מקבוצות כמו Acyl glucuronides ותכשירים המכילים קבוצה קרבוקסילית יכולה להביא להידרוליזה חוזרת שלהם ולהצטברות של תרופת האם(9). לדוגמה, [[Ketoprophen]], השייך לקבוצת נוגדי הדלקת שאינם סטרואידים. |
==הערכת תפקוד הכליה== | ==הערכת תפקוד הכליה== | ||
גרסה מ־15:52, 30 באפריל 2013
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| רישום תרופות בחולים עם תפקוד כלייתי ירוד | ||
|---|---|---|
| Drug prescribing for patients with decreased renal function | ||
| יוצר הערך | ד"ר נעה ברר-ינאי
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אי ספיקת כליות
תפקוד הכליה יכול להשפיע על פינוי תרופות ועל תגובה להן בדרכים רבות. תרופות או מטבוליטים של תרופות המתפנים דרך הכליה, עלולים להצטבר במצב של ירידה בתפקוד הכליה ולגרום תופעות של רעילות או מינון יתר. אופן ההשפעה ומידתה ספציפיים עבור תרופות שונות, עבור מטופלים שונים ועבור שילובי תרופות שונים. ההערכה של מידת ההשפעה אינה טריוויאלית. בחולים עם ירידה בתפקוד הכליה נדרשת התאמת מינון עבור תרופות רבות. התאמה זאת מבוססת, על פי רוב, על הערכת קצב הסינון הפקעיתי (GFR - Glomerular filtration rate).
חשוב לזהות מטופלים עם ירידה בתפקוד הכליה. יש להעריך את תפקודי הכליה על ידי מדידת פינוי קריאטינין או הערכה על פי נוסחה.
יש לבדוק אם קיימות תרופות שיש להפסיק או להחליף בגלל תפקוד הכליה, לבחור תרופות שאינן נפרוטוקסיות ולקבוע את המינון ואת משטר הטיפול המתאימים. חשוב להתייחס לשילוב של תרופות, ולנטר את הטיפול התרופתי ואת תפקודי הכליה.
אפידמיולוגיה
מחלת כליה כרונית היא נפוצה ביותר. שכיחות המחלה באוכלוסייה הבוגרת היא יותר מ-10%(2 ,1). מרבית החולים עם מחלת כליה כרונית סובלים מתחלואה נוספת ומטופלים במספר רב של תרופות. חולים אלה נוטלים בממוצע שבע תרופות, ואילו מטופלי דיאליזה נוטלים בממוצע 11 תרופות(4 ,3).
בעיות הקשורות ברישום תרופות כרוכות בתחלואה ובתמותה מוגברות וכן בעלויות גבוהות(6 ,5). שיעור הטעויות ברישום תרופות בחולים עם ירידה בתפקוד הכליה הוא גבוה מאוד. שיעור זה יכול להגיע עד ל-45% במסגרת אשפוז(7), ואילו בקרב מטופלים בדיאליזה הוא אף גבוה יותר ומגיע ליותר מ-90% מהמטופלים. שכיחות בעיות אלה תלויה במספר התרופות, במידת הירידה בתפקוד הכלייתי, בגיל החולים ובתחלואה נוספת(4).
פתופיזיולוגיה
הכליה והכבד הם שני האיברים העיקריים האחראים לפינוי תרופות מהגוף. פינוי תרופות נעשה במספר מסלולים. דרכי הפינוי העיקריות הן(8):
- פינוי התרופה דרך הכליה מבלי שהתרופה עוברת כל שינוי, לדוגמה: Amikacin, Atenolol.
- פינוי דרך הכליה לאחר שתרופה עברה שינוי/מטבוליזם על ידי הכבד.
- פינוי על ידי מטבוליזם בכבד והפרשה דרך המרה, לדוגמה: Amiodarone.
בחולים עם ירידה בתפקוד הכליה נפגע הפינוי של תרופות רבות. לירידה בתפקוד הכליה יש השפעה על משתנים פרמקוקינטיים נוספים. נוסף על כך, ירידה בתפקוד הכליה יכולה להשפיע גם על תרופות שהפינוי שלהן אינו כלייתי.
פינוי תרופות על ידי הכליה
במחלות כליה מאטיולוגיות שונות תיתכן פגיעה בדרגת חומרה שונה במבנה התקין של הפקעיות והאבוביות הכלייתיות. בהתאם, תיתכן פגיעה בדרגות שונות במסלולים הספציפיים של פינוי תרופות על ידי הכליה, כלומר סינון, הפרשה וספיגה מחדש. עם זאת, קיימת הנחה כי כל המבנים של הנפרונים שאינם נפגעים, מתפקדים במידה שווה(22). בהתאם להנחה זאת, ללא קשר לדרך הפינוי הכלייתית הספציפית, הערכת המידה של הירידה ביכולת הפינוי של תרופה על ידי הכליה נעשית על בסיס הערכת הירידה בקצב הסינון הפקעיתי (GFR - Glomerular filtration rate).
פינוי תרופות דרך הכליה מושפע מארבעה תהליכים: סינון פקעיתי, הפרשה באבוביות (Tubules), ספיגה באבוביות, וספיגה ומטבוליזם של חלבונים.
סינון פקעיתי
דרך סינון פקעיתי מפונות מולקולות קטנות יחסית ומסיסות במים. במצב שבו יש קישור של תרופה לחלבוני הדם, רק החלק החופשי של התרופה יכול להתפנות על ידי סינון פקעיתי.
הפרשה באבוביות
נוסף על סינון פקעיתי, הכליה יכולה לפנות תרכובות על ידי הפרשה שעיקרה מתבצע באזור הקריבני (פרוקסימלי) של האבוביות (10 ,9). בתאי האבוביות קיימות מערכות של נשאים למגוון גדול של מולקולות, כגון: אניונים, קטיונים, פפטידים ונוקליאוזידים. מדובר בקבוצות של מערכות נשאים הממוקמות בתאי האבוביות שהסידור שלהן על פני התא מאפשר כיווניות. מעבר תרכובות מכלי הדם אל תאי האבוביות נעשה דרך הממברנה הבזולטרלית, ומתוך התאים אל החלל שבו מתהווה השתן דרך הממברנה הלומינלית. על פי רוב, למערכות אלה אין ספציפיות גבוהה, וכל אחת מהן יכולה להעביר מספר תרכובות דומות(11). מנגנון זה חשוב במיוחד בהפרשה של תרופות שקשורות לחלבוני הדם, ומאפשר הפרשה של תרופות הנמצאות גם בתוך תאי הדם. קישור תרופה לחלבון מקטין את הפינוי בסינון פקעיתי ומגדיל את הפרקציה המתפנה בהפרשה באבוביות.
דוגמאות לתרופות המתפנות דרך מערכות נשאים אניוניים:
- אנטיביוטיקות מקבוצת בטא לקטם (β-Lactam antibiotics)
- משתנים
- נוגדי דלקת לא סטרואידליים (NSAIDs - Nonsteroidal anti-inflammatory drugs).
- מעכבי האנזים המהפך אנגיוטנסין (ACE inhibitors).
נשאים קטיוניים מתווכים הפרשה של תכשירים דוגמת Cemidin (Cimetidine), אנטרהציקלינים (Anthracyclines) ו-Digoxin.
ספיגה באבוביות
תרכובות שעברו סינון או הפרשה יכולות לעבור ספיגה מחדש מהתסנין אל מחזור הדם. מידת הספיגה מחדש יכולה להיות ממעטה ביותר ועד ספיגה שלמה. הספיגה תלויה בעיקר במידת הליפופיליות, במשקל המולקולרי של התרכובת ובקבוע שיווי המשקל. תרופות שעוברות ספיגה שלמה, למעשה, אינן מתפנות דרך הכליה(9). ה-Licarbium (Lithium) הוא דוגמה לתרופה שעוברת ספיגה באבוביות.
ספיגה ומטבוליזם של חלבונים
חלבונים יכולים לעבור סינון פקעיתי. היכולת לעבור סינון תלויה בגודל החלבון ובמטען החשמלי. ככל שהחלבון גדול יותר (מעל 30 KDa) וככל שמטענו החשמלי שלילי יותר, מידת הסינון פחותה. החלבונים שנמצאים בתסנין יכולים לעבור בשלב ראשון ספיגה מחדש על ידי אנדוציטוזיס. בשלב שני, החלבון שנכנס אל התא חוזר אל מחזור הדם או עובר פירוק לפפטידים וחומצות אמינו(9). נוסף על כך, בתאי האבוביות קיימות מערכות נשאים מיוחדות לספיגה של פפטידים(12). בדרך זאת מתפנים הורמונים פפטידיים רבים, כמו אינסולין, הורמון גדילה, הורמון הפאראתירואיד, קלציטונין ואחרים.
השפעת טיפול בדיאליזה
תרופות שונות מתפנות בעת טיפול בדיאליזה. פינוי במהלך דיאליזה תלוי במאפיינים של התרופה ובמאפייני הטיפול(23). עבור מטופלים בדיאליזה נדרשת תשומת לב מיוחדת לגבי התזמון של מתן תרופות המתפנות בדיאליזה ולצורך במתן תוספת טיפול (טבלה 1).
ספיגה וזמינות ביולוגית
בתרופה הניתנת דרך הפה הזמינות הביולוגית היא החלק של המינון שמגיעה למחזור הדם(8). הזמינות הביולוגית תלויה בגורמים שונים במערכת העיכול שחלקם משתנים במחלת כליה כרונית. בגלל קיומם של תהליכים עם השפעות מנוגדות יש להבין בכל מקרה את סכום ההשפעות:
- זמן פינוי מהקיבה יכול להתארך. לנתון זה השפעה על הזמן להגעה לריכוז מקסימלי (T Max). על פי רוב, אין לנתון זה חשיבות קלינית.
- ירידה בחומציות הקיבה: במחלת כליה כרונית קיימת ירידה בחומציות הקיבה בגלל גורמים שונים וביניהם - עלייה בייצור אמוניה במערכת העיכול ושימוש בתרופות, כגון מעכבי משאבת פרוטונים ותכשירים סופחי זרחן. תהליכים אלה מביאים להפחתה בזמינות של תרופות שלספיגתן נדרשת סביבה חומצית(10, 9).
- מטבוליזם פרה-סיסטמי במערכת העיכול: תרופה המגיעה למעי נספגת בדיפוזיה או באמצעות מערכות נשאים אל תאי המעי (אנטרוציטים), ומשם דרך המערכת הפורטלית אל המערכת הסיסטמית. בתאי המעי קיימות מערכות חלבונים המשפיעות על ספיגת תרופות שונות, לדוגמה: מערכת ציטוכרום P450 מעבדת תרופה למטבוליטים שלה ומביאה, במקרים שבהם המטבוליטים אינם פעילים, להפחתה בכמות התרופה המגיעה למחזור הדם. באופן דומה, מערכת P גליקופרוטאין היא מערכת של נשאים המוציאה מתאי המעי אל חלל המעי תרופות שכבר עברו ספיגה. פעילות מערכת זאת מפחיתה את כמות התרופה הנספגת(13). פעילות מערכות אלה מעוכבת במחלת כליה כרונית. עיכוב זה יכול להביא להגדלה בכמות התרופה הנספגת(14).
נפח פיזור
במצב של שיווי משקל, נפח הפיזור נגזר מהיחס בין כמות כוללת של תרופה בגוף לריכוז התרופה בפלזמה. ליחס זה אין מקבילה אנטומית(15). ככלל, לתרופות מסיסות בשומן יש נפח פיזור גבוה יחסית, בעוד לתרופות מסיסות במים או לתרופות עם קישור משמעותי לחלבונים יש נפח פיזור קטן יותר.
קישור תרופות לחלבוני הדם
פגיעה בתפקוד הכליה משפיעה על קישור תרופות לחלבוני הדם ולרקמות, ובכך משפיעה על נפח הפיזור. השפעה זאת מודגמת היטב בקבוצת התרופות החומציות (צפלוספורינים, Penicillin, Phenytoin, Furosemide). תרופות אלה נקשרות בעיקר לאלבומין. במצב של מחלת כליה קיימת ירידה בקישור תרופות חומציות לחלבוני הדם. לירידה זאת מספר גורמים, בין השאר(16):
- תחרות על אתרי הקישור לחלבון עם חומרים אנדוגניים המצטברים בגוף בשל ירידה בתפקוד הכליה.
- ירידה ברמת האלבומין.
- ירידה בזיקה בין אתרי הקישור לתרופה בשל שינויי קונפורמציה באתרי הקישור של החלבון.
בשל הירידה בקישור לחלבון תיתכן עלייה בכמות התרופה החופשית בדם. מצד אחד, עלייה כזאת יכולה להביא לתופעות של רעילות בשל הצטברות התרופה, ומצד שני, תיתכן האצה במטבוליזם של התרופה וירידה בהשפעתה. מדידת רמת תרופה בפלזמה משקפת הן את הפרקציה הקשורה לחלבון והן את הפרקציה החופשית.
רמת תרופה נתונה בחולה עם תפקוד כלייתי ירוד אינה בהכרח משקפת את רמת התרופה הזמינה לפעילות, ולפיכך תיתכן הופעת רעילות גם כאשר רמת התרופה הנמדדת היא בטווח הנחשב לתקין. בסיכומו של דבר, שינויים בקישור תרופות לחלבוני הדם גורמים לקושי רב ביכולת לצפות אם מינון נתון יביא לרמת תרופה בטווח הטיפולי או לרמות תת או על טיפוליות (16, 10, 9).
קישור לרקמות
קישור תרופה לרקמות משפיע על נפח הפיזור של התרופה, ויש לו חשיבות בקביעת מנת העמסה(15). ברוב המקרים לשינוי זה אין משמעות קלינית. יוצא דופן במקרה זה הוא ה-Digoxin. במחלת כליה כרונית מתקדמת יש ירידה בקישור Digoxin לרקמות. בשל כך מתן מנת העמסה רגילה, בהינתן טווח טיפולי צר מאוד, יכולה להביא לעלייה ברמת ה-Digoxin בדם לערך רעיל(17).
שינויים בהרכב הגוף
מחלת כליה כרונית יכולה להשפיע על הרכב מדורי הגוף השונים: אגירת נוזלים ועלייה בנפח החוץ-תאי מביאה לעלייה בנפח הפיזור של תרופות הידרופיליות ולירידה בריכוזן בפלזמה. ירידה במסת שריר, לעומת זאת, מקטינה את נפח הפיזור של תכשירים הידרופיליים, ויכולה לגרום לעלייה ברמת התרופה בפלזמה(18).
מטבוליזם חוץ-כלייתי
מחלת כליה יכולה להשפיע לא רק על תרופות המתפנות דרך הכליה אלא גם על פינוי של תרופות שאינן מתפנות על ידי הכליה. זאת דרך עיכוב מסלולים מטבוליים ספציפיים במערכת CYP450 ומסלולים מטבוליים נוספים (21 ,20 ,9). מסיבה זאת, בנוכחות פגיעה כלייתית יש לעתים צורך לשנות גם מינון תרופות שהפינוי שלהן אינו כלייתי.
מעט תרופות מתפנות מהגוף דרך הכליה מבלי לעבור שינוי. תרופות שמסיסותן במים אינה גבוהה, אינן יכולות להתפנות דרך הכליה. תרופות אלה עוברות שינוי ביולוגי בשלב אחד או בשני שלבים עוקבים:
- השלב הראשון כולל הידרוליזה, חמצון או חיזור.
- השלב השני כולל אחד מהבאים:
- הצמדה אל מולקולות קטנות: צימוד לחומצה גלוקורונית (Glucuronidation), צימוד לגופרית, צימוד לגלוטתיון
- שינוי במבנה המולקולה - הוספת קבוצת מתיל או אצטיל.
תהליכים אלה מגבירים את מסיסות התרכובות במים ובכך מתאפשרת הפרשתן דרך הכליה. מערכת ה-CYP 450 על נגזרותיה השונות היא המערכת העיקרית שבה מתרחשים תהליכים אלה, ופעילותה בעיקר בכבד. עם זאת, בתנאים רגילים הכליה תורמת כ-15% לפעילות מערכת זאת.
במחלת כליה כרונית יש ירידה בפינוי כלייתי של תכשירים שעברו שינוי. לדוגמה, מורפיום: רוב המורפיום עובר מטבוליזם בכבד, ורק 4% מופרש ללא שינוי בכליה. שני מטבוליטים פעילים - Morphine 3 glucuronide ו-Morphine 6 glucuronide - מופרשים על ידי הכליה ומצטברים כאשר התפקוד הכלייתי ירוד. המטבוליט Morphine 6 glucoronide הוא בעל השפעה גדולה יותר מאשר תכשיר האם(19). הצטברות המטבוליטים עלולה לגרום לתופעות של רעילות עד כדי דיכוי נשימה, ולפיכך יש להפחית במינון(18).
במנגנון אחר, הצטברות מטבוליטים מקבוצות כמו Acyl glucuronides ותכשירים המכילים קבוצה קרבוקסילית יכולה להביא להידרוליזה חוזרת שלהם ולהצטברות של תרופת האם(9). לדוגמה, Ketoprophen, השייך לקבוצת נוגדי הדלקת שאינם סטרואידים.
הערכת תפקוד הכליה
קיימת חשיבות רבה בזיהוי החולים הנמצאים בסיכון עבורם נדרשת התאמת מינון תרופות לתפקוד הכליה. המדד הכולל הנפוץ ביותר להערכת תפקוד הכליה הוא קצב הסינון הפקעיתי, ה-GFR (Glomerular filtration rate). ניתן למדוד GFR בצורה מדויקת, אך מדובר בבדיקות ארוכות, מורכבות ויקרות. לצרכים קליניים נהוג לחשב פינוי קריאטינין (Ccr - Creatinine clearance rate) כבסיס להערכת GFR. ניתן למדוד פינוי קריאטינין על ידי איסוף שתן, מדידת קריאטינין בדם ובשתן ומדידת נפח השתן.
לשיטה זאת מספר מגבלות: אי דיוק באיסוף השתן יכול לשנות את התוצאה באופן משמעותי. נוסף על כך, בדיקה זאת עושה הערכה ביתר של GFR היות והיא מודדת קריאטינין שהגיע לשתן הן על ידי סינון פקעיתי והן על ידי הפרשה באבוביות. השיטה מתאימה למצבים בהם יש שינוי קיצוני במסת השריר, לדוגמה, בחולים קטועי גפיים. ייצור הקריאטינין תלוי במסת שריר, ולפיכך מושפע מגורמים, כגון: מין, גיל וגזע. נוסחאות שונות שפותחו להערכת פינוי קריאטינין ו-GFR, מתחשבות בגורמים אלה (תרשים 2).
הנוסחאות הנפוצות ביותר בשימוש הן:
- נוסחת Cockroft-Gault להערכת פינוי קריאטינין(24).
- נוסחת MDRD (Modification of Diet in Renal Disease formula) להערכת GFR(25) - בגרסתה המלאה בעלת שישה משתנים:
- מין
- גיל
- גזע
- רמת קריאטינין
- רמת שתנן (Urea)
- רמת אלבומין
- נוסחת MDRD המקוצרת, בעלת ארבעה משתנים: מין, גיל, גזע, רמת קריאטינין.
ניתן לחשב את תפקוד הכליה על ידי שימוש במחשבונים אלקטרוניים(26). לכל אחת מהנוסחאות יש מגבלות, ואין תמימות דעים לגבי מי מהן עדיפה בהתייחס לרישום תרופות.
חשוב לזכור, כי נוסחאות אלה ישימות רק במצב של שיווי משקל, והן אינן יכולות לשמש במצב של פגיעה כלייתית חריפה. במחלת כליה חריפה ייתכנו שינויים פרמקוקינטיים נוספים, כגון שינויים בנפח הפיזור שאינם קשורים ישירות לתכולת המים בגוף(27). כמו כן, נוסחאות אלה אינן מתאימות לשימוש בילדים ובאוכלוסייה שבה יש שינוי קיצוני במסת השריר.
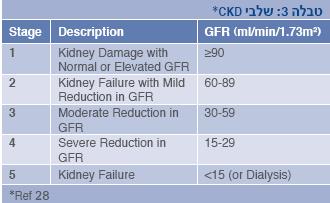
על פי הנחיות ה-KDOQI (Kidney Disease Outcomes Quality Initiative) מקובל היום לחלק מחלות כליה כרוניות לשלבים על פי אומדן ה-GFR (טבלה 3). עם זאת, במקורות שונים ההמלצות להתאמת מינון התרופות אינן מתבססות על שלבים אלה, אלא על חלוקה לקטגוריות אחרות, לדוגמה: GFR מעל 50 מ"ל לדקה לשטח גוף 1.73 מ"ר; GFR של 10-50 מ"ל לדקה; GFR הקטן מ-10 מ"ל לדקה; טיפול בדיאליזה(18).
קביעת מינון
חולים עם מחלת כליה כרונית נמצאים בסיכון גבוה לרעילות ולתופעות לוואי מתרופות. מעבר להשפעה ישירה על פינוי תרופות דרך הכליה, ירידה בתפקוד הכליה משפיעה על משתנים חשובים נוספים ביניהם נפח הפיזור, קישור לחלבונים ומטבוליזם. ירידה בתפקוד הכליה יכולה להשפיע גם על תרופות שהפינוי שלהן אינו דרך הכליה. קביעת מינון תרופות בחולים אלה היא משימה מורכבת. התאמת המינון מתבססת על הערכת GFR ועל נתונים פרמקוקינטיים.
במקרים רבים, חסרים נתונים ספציפיים לאוכלוסייה עם מחלת כליה כרונית, ונוסף על כך, ההמלצות ממקורות שונים לעתים אינן זהות. התאמת מינון דורשת התייחסות למנת העמסה, למינון התרופה ולמרווח בין המנות. בכל מקרה, יש להביא בחשבון נתונים ספציפיים של כל חולה, כגון מצב נפח הנוזלים ונוכחות תחלואה נוספת. יש להתייחס גם לשילובים עם תרופות נוספות. גם לאחר קביעת מינון ומשטר טיפול מותאם לתפקוד הכליה יש להמשיך ולעקוב אחר השפעת התרופה ואחר תפקוד הכליה.
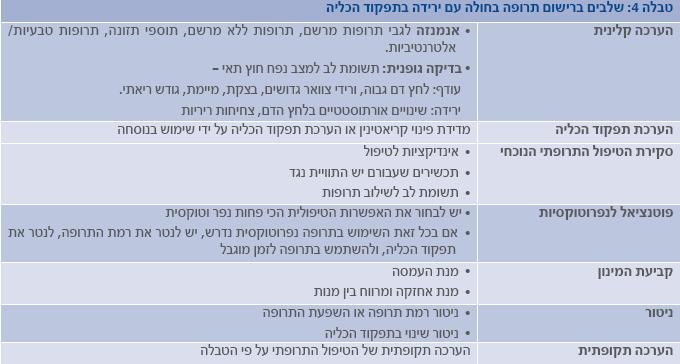
לשם התאמת מינון תרופה במצב של תפקוד כלייתי ירוד (טבלה 4) נדרשות הכרת המשתנים הפרמקוקינטים של התרופה, הערכה קלינית של המטופל והערכת תפקוד הכליה. הערכת תפקוד הכליה על פי הנוסחאות המקובלות אינה מתאימה לחולים עם מחלת כליה חריפה. התאמת המינון במצבים אלה נעשית לעתים על ידי הקשה מההנחיות לגבי מחלת כליה כרונית.
ככלל, בתרופה שעבורה החלק המופרש דרך הכליה נשאר ללא שינוי, לאחר מתן תוך-ורידי הגבוה מ-30%, יש להתאים מינון לתפקוד הכליה לפחות בטווח של GFR הקטן מ-30ml/min (מחלת כליה כרונית בדרגה IV). עבור תרופות שפרקציה זאת מתקרבת ל-10%, התאמת המינון נדרשת כבר עבור GFR הקטן מ-50ml/min (מחלת כליה כרונית בדרגה III) ואולי אף בשלב מוקדם יותר(9).
הבעיות העיקריות ברישום תרופות בחולים עם תפקוד כלייתי ירוד הן:
- מתן תרופה במינון שאינו מתאים
- מתן תרופות נפרוטוקסיות
- אי רישום תרופות נדרשות בגלל מחלת הכליה
- שילוב תרופות שאינו מתאים
הכרת העקרונות הפרמקולוגיים בהקשר של תפקוד כלייתי ירוד, זיהוי החולים עם מחלת כליה כרונית והערכת מידת הפגיעה על ידי חישוב קצב הסינון הפקעיתי הם חיוניים להתאמת הטיפול התרופתי, ויכולים להביא להפחתה משמעותית בשיעור הבעיות ברישום התרופות בקבוצה זאת.
מנת העמסה
במצב שבו מתחילים טיפול תרופתי ללא מנת ההעמסה, זמן ההגעה לריכוז הנדרש של התרופה תלוי בזמן מחצית החיים שלה. במקרים שבהם הירידה בתפקוד הכליה גורמת להארכה משמעותית של זמן מחצית החיים, ובמקרים שבהם נדרשת הגעה במהירות לרמת תרופה טיפולית, יש מקום לשקול מתן מנת העמסה (טבלה 5). מנת ההעמסה עצמה תלויה בריכוז התרופה הנדרש ובנפח הפיזור(29).
במקרים מסוימים תהיה מנת ההעמסה המנה הרגילה הניתנת גם לחולים עם תפקוד כלייתי תקין. כאשר יש שינוי משמעותי בתכולת המים בגוף (Total body water), כגון במצבים של בצקת מפושטת או מיימת, תיתכן עלייה גם בנפח הפיזור של תרופות שונות. במצב זה יש לשקול הגדלת מנת ההעמסה. במצב ההפוך - ירידה בתכולת המים בגוף - יש לשקול הקטנת מנת ההעמסה(29, 18).
מנת אחזקה
שינויים במנת האחזקה כוללים הפחתה במינון (Drug dose) והגדלת המרווח בין מנות האחזקה (Dose interval). יש תרופות שעבורן נדרשת רק הפחתת המינון או רק הגדלת המרווח. עבור תרופות אחרות נדרש שילוב שתי השיטות.
הגדלת המרווח הטיפולי מתאימה במצבים שבהם לתרופה טווח טיפולי רחב וזמן מחצית חיים ארוך. שיטה זאת מפחיתה את הסיכון לרעילות של התרופה, אך עלולה ליצור פרקי זמן שבהם ריכוז התרופה הוא בתחום התת-טיפולי. הקטנת המינון תוך השארת המרווח הטיפולי הקבוע מאפשרת השגה של יציבות רבה יותר ברמת התרופה, אך מגבירה את הסיכון להופעת רעילות (21 ,10).
כאשר המשתנים הפרמקוקינטיים ומידת הירידה בתפקוד הכליה ידועים, ניתן להעריך את המינון המופחת או את המרווח המוגדל הנדרש על ידי שימוש בנוסחאות (23 ,9). עם זאת, לנוסחאות אלה יש מגבלות מרובות. קיימים מקורות מידע שונים להתאמת מינון עבור מטופלים עם תפקוד כלייתי ירוד (טבלה 6).
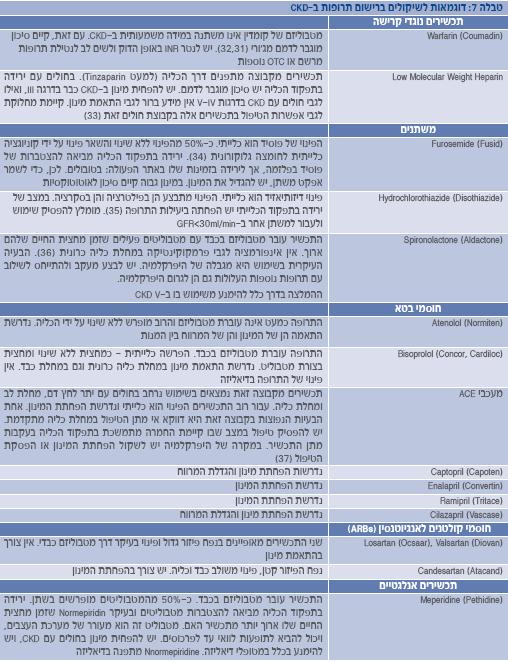
חשוב לציין, כי במקרים רבים קיימים הבדלים בהמלצות בין המקורות השונים. זאת, בין השאר, משום שעבור תרופות רבות אין מידע פרמקוקינטי ספציפי למחלת כליה כרונית(30). יש לזכור, כי מדובר בהמלצות כלליות, וצריך להתחשב בנסיבות של כל מטופל. ניטור רמת התרופה בדם או תוצאת פעילותה יכול לסייע בהתאמה ספציפית יותר של משטר הטיפול (ראו דוגמאות בטבלה 7). עבור תרופות עם טווח טיפולי צר נדרשת זהירות רבה במיוחד.
ביבליוגרפיה
- Coresh J, Astor BC, Greene T, et al. Prevalence of chronic kidney disease and decreased kidney function in the adult US population: third National Health and Nutrition Examination Survey. Am J Kidney Dis 2003;41:1-12
- Chadban SJ, Briganti EM, Kerr PG, et al. Prevalence of kidney damage in Australian adults: the AusDiab kidney study. J Am Soc Nephrol 2003;14:131-138
- Kappel J, Calissi P. Safe drug prescribing for patients with renal insufficiency. CMAJ 2002;166:473-477
- Manley HJ, McClaran ML, Overbay DK, et al. Factors associated with medication-related problems in ambulatory hemodialysis patients. Am J Kidney Dis 2003;41:386-393
- Ebbesen J, Buajordet I, Erikssen J, et al. Drug related deaths in a department of internal medicine. Arch Intern Med 2001;161:2317-2323
- Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients: A meta-analysis of prospective studies. JAMA 1998;279:1200-1205
- Cantú TG, Ellerbeck EF, Yun SW, et al. Drug prescribing for patients with changing renal function. Am J Hosp Pharm. 1992;49(12):2944-2948
- Buxton ILO. Pharmacokinetics and pharmacodynamics: the dynamics of drug absorption, distribution, action and elimination In Goodman & Gilman’s: The pharmacological basis of therapy. McGrow-Hill 2006;11:1-40
- Verbeek RK, Musuamba FT. Pharmacokinetics and dosage adjustment in patients with renal dysfunction. Eur J Clin Pharmacol 2009; 65:757-773
- Gabardi S, Abramson S. Drug dosing in chronic kidney disease. Med Clin N Am 2005; 89:649-687
- Lee W, Kim B. Transporters and renal elimination. Annu Rev Pharmacol Toxicol 2004;44:137-166
- Daniel H, Rubio- Aliaga I. An update on renal peptide transporters. Am J Renal Physiol 2003;284:885-892
- Zhang Y, Benet LZ. The gut as a barrier to drug absorption: combined role of cytochrome P450 3A and P-glycoprotein. Clin Pharmacokinet 2001;40:159-168
- Leblond FA, Petrucci M, Dube P, et al. Downregulation of intestinal cytochrome p450 in chronic renal failure. J Am Soc Nephrol 2002;13:1579-1585
- Winter ME. Basic clinical pharmacokinetics 5th edition. Philadelphia: Lippincott Williams and Wilkins 2010
- Matzke GR, Frye RF. Drug administration in patients with renal insufficiency: minimizing renal and Extrarenal toxicity. Drug Saf 1997;16:205-231
- Lam YW, Banerji S, Hatfield C, et al. Principles of drug administration in renal insufficiency. Clin Pharmacokinet 1997;32:30-57
- Aronoff GR, Berns JS, Brier ME, et al. Drug prescribing in renal failure: dosing guidelines for adults 5th edition. Philadelphia: American College of Physicians 2007
- Säwe J, Odar-Cederlöf I. Kinetics of morphine in patients with renal failure. Eur J Clin Pharmacol 1987;32:377-382
- Yuan R, Venitz J. Effect of chronic renal failure on the disposition of highly hepatically metabolized drugs. Int J Clin Pharmacol Ther 2000;38:245-253
- Elston C, Baylis MK, Park GR. Effect of renal failure on drug metabolism by the liver. Br J Anaesth 1993;71:282-290
- Bricker NS, Morrin PA, Kime SW. The pathologic physiology of chronic Bright's disease. An exposition of the "intact nephron hypothesis. J Am Soc Nephrol 1997;8:1470-1476
- Swan SK, Bennett WM. Drug dosing guidelines in patients with renal failure. Western Journal of Medicine 1992;156:633-638
- Cockroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31-41
- Levey AS, Bosch JP, Lewis JB, et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Ann Intern Med 1999;130:461-470
- GFR calculator. http://www.nephron.com/cgi-bin/CGSI.cgi
- Himmelfarb J, Evanson J, Hakim RM, et al. Urea volume of distribution exceeds total body water in patients with acute renal failure. Kidney Int 2002;61:317-323
- National Kidney Foundation K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002;39(Suppl 1):1-266
- Brater DC. Drug dosing in patients with impaired renal function. Clinical pharmacology & therapeutics 2009;86:483-489
- Vidal L, Shavit M, Fraser A, et al. Systematic comparison of four sources of drug information regarding adjustment of dose for renal function. Br Med J 2005;331:263-266
- Levine MN, Raskob G, Landefeld S, et al. Hemorrahgic complications of anticoagulant treatment. Chest 2001;119:108-121
- Beyth RJ, Quinn LM, Landefeld CS. Prospective evaluation of an index for predicting the risk of major bleeding in outpatients treated with warfarin. Am J Med 1998;105:91-98
- Gallieni M, Cozzolino M, Ronga C, et al. Low-molecular-weight heparins should be used with caution in patients with chronic kidney disease. Nature clinical practice nephrology 2008;4:488-489
- Brater DC. Diuretic therapy. NEJM 1998;339:387-395
- Dussol B, Moussi-Frances J, Morange S, et al. A randomized of Furosemide vs Hydrochlorothiazide in patients with chronic renal failure and hypertension. Nephrol Dial Transplant 2005;20:349-353
- Sica DA. Pharmacokinetics and pharmacodynamics of mineralocorticoid blocking agents and their effects on potassium homeostasis. Heart Fail Rev 2005;0:23-29
- Bakris GL, Weir MR. Angiotensin-converting enzyme inhibitor-associated elevations in serum creatinine: is this a cause for concern? Arch Intern Med 2000;169:685-693
- Conway BR, Fogarty DG, Nelson WE, et al. Opiate toxicity in patients with renal failure. BMJ 2006;332:345-346
- Hanraty CG, McGlinchey P, Jhonston GD, et al. Differential pharmacokinetics of Digoxin in elderly patients. Drug Aging 2000;17:353-362
קישורים חיצוניים
- רישום תרופות בחולים עם תפקוד כלייתי ירוד, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר נעה ברר-ינאי, המכון הנפרולוגי, מרכז רפואי הלל יפה, חדרה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק