הבדלים בין גרסאות בדף "סקלרוסטין - Sclerostin"
| שורה 66: | שורה 66: | ||
==גורמים המשפיעים על ביטוי הגן SOST== | ==גורמים המשפיעים על ביטוי הגן SOST== | ||
| − | מספר גורמים סיסטמיים ומקומיים הוצעו כמווסתים אפשריים של ביטוי SOST/sclerosin על ידי אוסטאוציטים. אחד הטיפולים באוסטאופורוזיס הוא על ידי ההורמון האנושי הרקומביננטי PTH, או על ידי מקטעים פעילים של PTH (על פי Pleiner-Duxneuner וחב' ב- Calcif Tissue | + | |
| + | מספר גורמים סיסטמיים ומקומיים הוצעו כמווסתים אפשריים של ביטוי SOST/sclerosin על ידי אוסטאוציטים. אחד הטיפולים באוסטאופורוזיס הוא על ידי ההורמון האנושי הרקומביננטי PTH, או על ידי מקטעים פעילים של PTH (על פי Pleiner-Duxneuner וחב' ב- Calcif Tissue Int משנת 2009). בניגוד להשפעות המעודדות של הגברה מתמשכת של PTH אנדוגני על ספיגת עצם, כמו שמוצאים באנשים עם hyperparathyroidism, הגברה סירוגית של PTH הניתן על ידי הזרקות יומיות כרוכה בהשפעות אנאבוליות ברורות. | ||
המנגנון דרכו PTH מתווך בהתרחשות עצם אנאבולית זו, אינו ברור דיו. חלק ממנגנון זה עשוי להשתמש בסקלרוסטין, שהרי נמצא ש-PTH מעכב את ביטוי סקלרוסטין in vitro וגם in vivo. במערכת in vitro מפחית PTH את השעתוק של הגן SOST על ידי תאים אוסטאובלסטים ואוסטאוציטים תוך 4 שעות. עיכוב זה לא הושפע על ידי מעכב של סינתזת החלבונים cyclohexamide, אך פחת על ידי forskolin המשרה יצירת cAMP (על פי Bellido וחב' ב-Endocrinology משנת 2005, ו-Keller ו-Kneissel ב-Bone משנת 2005). תצפיות אלו מצביעות על השפעה מווסתת ישירה של PTH הנמצאת בתלות ב-cAMP על הביטוי של SOST. מסתבר שמקטע בתוך המקטע הגנומי בגודל של 52kb שנשמט במחלת van Buchem, זוהה כאלמנט תגובה הידוע כ-MEF2, שהוא חיוני ל-downregulation של SOST בהשראת PTH (על פי Leupin וחב' ב-J Bone Miner Res משנת 2007). | המנגנון דרכו PTH מתווך בהתרחשות עצם אנאבולית זו, אינו ברור דיו. חלק ממנגנון זה עשוי להשתמש בסקלרוסטין, שהרי נמצא ש-PTH מעכב את ביטוי סקלרוסטין in vitro וגם in vivo. במערכת in vitro מפחית PTH את השעתוק של הגן SOST על ידי תאים אוסטאובלסטים ואוסטאוציטים תוך 4 שעות. עיכוב זה לא הושפע על ידי מעכב של סינתזת החלבונים cyclohexamide, אך פחת על ידי forskolin המשרה יצירת cAMP (על פי Bellido וחב' ב-Endocrinology משנת 2005, ו-Keller ו-Kneissel ב-Bone משנת 2005). תצפיות אלו מצביעות על השפעה מווסתת ישירה של PTH הנמצאת בתלות ב-cAMP על הביטוי של SOST. מסתבר שמקטע בתוך המקטע הגנומי בגודל של 52kb שנשמט במחלת van Buchem, זוהה כאלמנט תגובה הידוע כ-MEF2, שהוא חיוני ל-downregulation של SOST בהשראת PTH (על פי Leupin וחב' ב-J Bone Miner Res משנת 2007). | ||
| שורה 72: | שורה 73: | ||
בתנאי in vivo, הזרקה של PTH גרמה להפחתה ב-mRNA של סקלרוסטין בעכברים ובחולדות (Silvestrini וחב' ב-J Mol Histol משנת 2007). החשיבות של וויסות הגן SOST על ידי PTH, נתמכת על ידי הממצאים שההשפעה האנאבולית של PTH נעלמת בעכברים נטולי-SOST כמו גם בעכברים המבטאים ביתר את SOST תוך שימוש בפרומוטר פעיל מוּבנֶה (constitutive) (על פי Kramer וחב' ב-J Bone Miner Res משנת 2009). | בתנאי in vivo, הזרקה של PTH גרמה להפחתה ב-mRNA של סקלרוסטין בעכברים ובחולדות (Silvestrini וחב' ב-J Mol Histol משנת 2007). החשיבות של וויסות הגן SOST על ידי PTH, נתמכת על ידי הממצאים שההשפעה האנאבולית של PTH נעלמת בעכברים נטולי-SOST כמו גם בעכברים המבטאים ביתר את SOST תוך שימוש בפרומוטר פעיל מוּבנֶה (constitutive) (על פי Kramer וחב' ב-J Bone Miner Res משנת 2009). | ||
| − | שני גורמים סיסטמיים אחרים נמצאו גם כן משפיעים על הביטוי של SOST/sclerostin. נמצא ש-1,25 | + | שני גורמים סיסטמיים אחרים נמצאו גם כן משפיעים על הביטוי של SOST/sclerostin. נמצא ש-Dihydroxy D3{{כ}}1,25 לבד או בשילוב עם חומצה רטינואית, הגבירו את ביטוי SOST באוסטאובלסטים של בני-אדם בתרבית (Sutherland וחב' ב-Bone משנת 2004, ו-Sevetson וחב' ב-J Biol Chem משנת 2004). ההשפעה הספציפית של גלוקו-קורטיקואידים על ביטוי של SOST, תלויה בתנאי הניסויים. In vitro, דקסמתאזון מדכא את הביטוי של SOST באוסטאובלסטים, בה בשעה ש-in vivo, טיפול של עכברים ב-prednisolone הגדיל את הביטוי של SOST בעצמות השוק, מה שמצביע על כך שדיכוי איתותי Wnt על ידי upregulation של סקלרוסטין, יכול להיות אחראי לדיכוי של יצירת עצם בהשראת גלוקו-קורטיקואידים (Yao וחב' ב-Arthritis Rheum משנת 2008). |
| − | עוד גורמי גדילה מקומיים כגון BMP4 ,BMP2 ו-BMP6 מעודדים ביטוי של SOST באוסטאובלסטים in vitro (על פי Ohyama וחב' ב-Endocrinology משנת 2004). כמו כן ידוע שאלמנטים המגיבים ל-BMP, נמצאים בתוך אזור הפרומוטר של SOST (על פי Kamiya וחב' ב-Development משנת 2008). כן נמצא שאיתות מופחת של BMP בעכברי knockout עם פגיעה ב-BMPR1A הספציפי לאוסטאובלסטים, הפחיתה את ה-mRNA ואת הביטוי של סקלרוסטין בכיפת הגולגולת (calvary) של עוברי עכברים אלה, והיה כרוך בהגדלת מסת העצם באזור זה. בעכברים אלה נמצאה גם הפחתה בספיגת עצם, כנראה בהשפעת הגברת איתותי Wnt, כתוצאה מהקטנת הביטוי של סקלרוסטין. | + | עוד גורמי גדילה מקומיים כגון BMP4 ,BMP2 ו-BMP6 מעודדים ביטוי של SOST באוסטאובלסטים in vitro (על פי Ohyama וחב' ב-Endocrinology משנת 2004). כמו כן ידוע שאלמנטים המגיבים ל-BMP, נמצאים בתוך אזור הפרומוטר של SOST (על פי Kamiya וחב' ב-Development משנת 2008). כן נמצא שאיתות מופחת של BMP בעכברי knockout עם פגיעה ב-BMPR1A הספציפי לאוסטאובלסטים, הפחיתה את ה-mRNA ואת הביטוי של סקלרוסטין בכיפת הגולגולת (calvary) של עוברי עכברים אלה, והיה כרוך בהגדלת מסת העצם באזור זה. בעכברים אלה נמצאה גם הפחתה בספיגת עצם, כנראה בהשפעת הגברת איתותי Wnt, כתוצאה מהקטנת הביטוי של סקלרוסטין. |
==Sclerosteosis ומחלת van Buchem- שני מפגעי עצם הקשורים לפגם בסקלרוסטין== | ==Sclerosteosis ומחלת van Buchem- שני מפגעי עצם הקשורים לפגם בסקלרוסטין== | ||
גרסה מ־06:37, 1 בנובמבר 2016
| מדריך בדיקות מעבדה | |
| סקלרוסטין | |
|---|---|
| Sclerostin | |
| מעבדה | כימיה בדם |
| תחום | מחלות עצם כגון אוסטאופורוזיס |
| טווח ערכים תקין | 0.05-1.0 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
סקלרוסטין הוא חלבון המעכב את תהליכי יצירת העצם. מדידת רמתו בנסיוב, עשויה לסייע בהבנת תרחישים פתולוגיים בהם יש שיבוש ביצירת עצם, כמו אוסטאופורוזיס.
החלבון סקלרוסטין
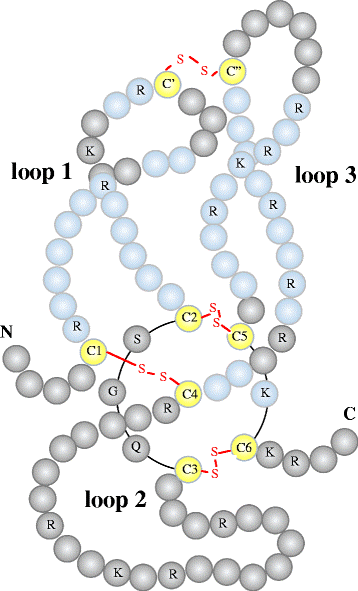
חלבון זה מקודד בבני-אדם על ידי הגן SOST (על פי Brunkow וחב' ב- Am J Hum Genet משנת 2001). גן זה ממוקם בכרומוזום 17 בעמדה q12-q2117 על פי Van Bezooijen וחב' ב-BoneKEy-Osteovision משנת 2005. סקלרוסטין הוא גליקופרוטאין בעל מקטע (domain) בקצה ה-C טרמינאלי הידוע כ-CTCK או C-terminal cysteine knot-like, המהווה סידור בלתי רגיל של 6 שיירים של ציסטאין המחוברים ליצירת קונפורמציה של "קשר ציסטין". סקלרוסטין מכיל 213 חומצות אמינו (Weidauer וחב' ב-Bicem Biophys Res Commun משנת 2009), משקלו המולקולארי 22,000 דלטון, והוא בעל רצף המראה דמיון למשפחת חלבוני DAN האנטגוניסטים של BMP או bone morphogenetic protein (על פי Avsian-Kretchmer ו-Hsueh ב-Mol Endocrinol משנת 2004, ו-Bezooijen וחב' ב-Endocrinol Invest משנת 2005). סקלרוסטין מיוצר על ידי תאי העצם- האוסטאוציטים, אותם תאים הנוצרים מאוסטאובלסטים מיצרי העצם שחדלים להיות פעילים. לסקלרוסטין השפעות אנטי-אנאבוליות על יצירת עצם.
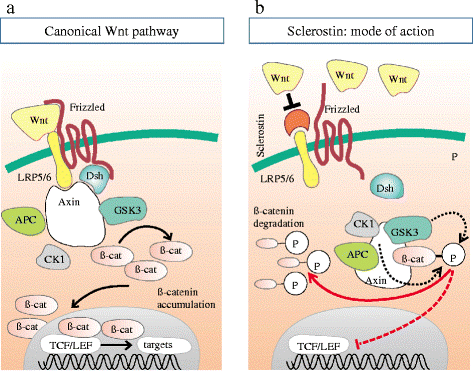
במקור נחשב סקלרוסטין כאנטגוניסט לא-קלאסי של BMP (על פי Winkler וחב' ב-The EMBO J משנת 2003), וזו לכאורה הייתה הדרך בה מווסתים אוסטאוציטים את יצירת העצם דרך סקלרוסטין. אך לאחרונה נמצא שחלבון זה נקשר לקולטנים של LRP5/6 ומעכב את מסלול האיתותים של Wnt (על פי Li וחב' ב-J Biol Chem משנת 2005, ו-Ellies וחב' ב-J Bone Miner Res משנת 2006). עיכוב של מסלול Wnt מפחית את יצירת העצם, ולמרות שהמנגנונים הספציפיים אינם ברורים, מאמינים שהאנטגוניזם המופעל על ידי סקלרוסטין ליצירת עצם המושרית על BMP נעשה בתיווך של איתות Wnt, ולא על ידי איתות של מסלולי BMP (על פי van Bezooijen וחב' ב-J Bone Miner Res משנת 2007, ו-Krause וחב' ב-J Biol Chem משנת 2010). בהמשך נמצא שסקלרוסטין מיוצר לא רק באוסטאוציטים אלא גם בתאי סחוס אחדים (כונדרוציטים), ומעכב יצירת עצם על ידי אוסטאובלסטים (Bonewald וחב' ב-J Bone Miner Res משנת 2011, ו-Burgers ו-Williams ב-Bone משנת 2013, כמו גם Bellido וחב' באותו כתב עת מאותה שנה).
וויסות הביטוי של הגן SOST ליצירת סקלרוסטין
מפאת המיקום והמורפולוגיה שלהם, אוסטאוציטים נחשבו זמן רב כבעלי תפקיד מרכזי באׅתחול של תגובה אנאבולית של העצם למה שמוגדר כ-mechanical load (על פי Knothe-Tate וחב' ב-Int J Biochem Cell Biol משנת 2004, ו-Han וחב' ב-Proc Natl Acad Sci USA משנת 2004). כתמיכה בהשערה זו נמצא שנטרול ספציפי של אוסטאוציטים בעכברים הביא ליצירת עצמות פריכות, ועכברים אלה לא הגיבו באיבוד רקמת עצם למצב של unloading (על פי Tatsumi וחב' ב-Cell Metabol משנת 2007). איתות Wnt עשוי לשחק אף הוא תפקיד בתגובה האנאבולית לדפורמציה ול-loading, שכן נמצאה הגברה של איתותי Wnt לאחר loading של תאים אוסטאובלסטים in vitro ושל עצמות השוֹק in vivo (Hens וחב' ב-J Bone Miner Res משנת 2005, ו-Robinsion וחב' ב-J Biol Chem משנת 2006, כמו גם Lin וחב' ב-J Bone Miner Res משנת 2009). כמו כן נמצא שהקולטן LRP5 המשותף ל-Wnt ולסקלוסטין, חיוני להגברת מסת העצם לאחר loading (על פי Sawakami וחב' ב-J Biol Chem משנת 2006).
כיוון שסקלרוסטין מיוצר על ידי אוסטאוציטים בעצם ומעכב יצירת עצם על ידי אנטגוניסטים של איתותי Wnt, נראה שיש לסקלרוסטין תפקיד בוויסות של איתותי Wnt, בתגובה ל-loading מכני. בהסכמה עם השערה אחרונה זו, נמצא ש-loading הפחית את פעילות הגן SOST, וכן את רמת mRNA של סקלרוסטין ואת רמת חלבון זה עצמו, בה בשעה ש-unloading הגביר את רמת mRNA של סקלרוסטין (Robling וחב' ב-J Biol Chem משנת 2008, ו-Moustafa וחב' ב-Bone משנת 2009). הפחתה של עוצמת הצביעה של סקלרוסטין הייתה בולטת ביותר באזורים עם העומס המכני הגבוה ביותר, מה שמצביע על תגובה למצב של loading מקומי. יתרה מכך, עכברי knockout עם פגיעה בגן SOST, אינם מראים איבוד עצם לאחר loading, וכן אין כל שינוי באיתותי Wnt.
ה-mRNA של SOST מבוטא בעיקר בתקופת העוברות ברקמות רבות, בעוד שסקלרוסטין מבוטא רק לאחר הלידה בתאים משוקעים בתוך מטריקס שעבר מינרליזציה, דהיינו באוסטאוציטים, בתאי סחוס היפרטרופיים שעברו מינרליזציה, וב-cementocytes שהם תאים מרובי שלוחות המצויים בחללי ה-cementum שבשורשי השיניים (Poole וחב' ב-FASEB J משנת 2005). הביטוי של ה-mRNA של SOST ברקמות שלא עברו מינרליזציה, התגלה בשלבי האמבריוגנזה של עכברים ב-otic vesicle או ב-auditory vesicle המהווה חלק מהאקטודרם העצבי, שיתפתח למבוך הממברנלי של האוזן הפנימית. כמו כן ביטוי ה-mRNA של SOST התגלה בשלב העוברי של עכברים באזורים הקדם-דיגיטאליים או התוך-דיגיטאליים של ה-limb buds שהם המבנים הנוצרים מוקדם בהתפתחות הגפיים, וזה כנראה הקשר בינם לבין התפתחות סינדיקטליה באנשים עם sclerosteosis (על פי Ohyama וחב' ב-Endocrinology משנת 2004). בבני אדם, mRNA של SOST מתבטא בלב, באבי העורקים ובכבד, ובריכוזים גבוהים במיוחד בכליות (Balemans ו-Hul ב-Dev Biol משנת 2002, ו-Kusu וחב' ב-J Biol Chem משנת 2003), אך לא נמצא כל סקלרוסטין ברקמות הללו. לכן, אנשים עם sclerosteosis או עם מחלת van Buchem אינם סובלים מבעיות כליה או מאי-סדירות קרדיו-וסקולארית.
בעצם הבוגרת של עכברים ובני-אדם, ביטוי סקלרוסטין מוגבל לאוסטאוציטים, עם צביעה דיפוזית המייצגת דנדריטים בתעלות (canaliculi) שביניהם, אך אוסטאוקלסטים ואוסטאובלסטים אינם מבטאים סקלרוסטין. כיוון שנכון להיום לא ניתן לבודד אוסטאוציטים מן העצם ביונקים, מחקרים in vitro על ביטוי של SOST ושל סקלרוסטין מסובכים מבחינה טכנית. תרבית תאים אוסטאוגניים היוצרים קשרירי עצם (nodules) שעברו מינרליזציה, היא אחת השיטות המעטות ליצירה של תאים דמויי-אוסטאוציטים in vitro (על פי Pockwinse וחב' ב-J Cell Biochem משנת 1992). במח עצם אוסטאוגני ראשוני בעכברים, ובשורת התאים המזנכימאליים בתרבית KS483 בעכברים, ביטוי של mRNA של SOST מושרה ברמות נמוכות לאחר מינרליזציה של קשרירי העצם. בדומה להשראה של mRNA של SOST בתנאי in vitro, אוסטאוציטים שרובצו זה עתה בתוך אוסטאואידים שלא עברו מינרליזציה באדם, אינם מבטאים סקלרוסטין, אך הופכים חיוביים לחלבון זה מיד לאחר תחילת המינרליזציה. לעומת זאת, כאשר המינרליזציה של אוסטאואידים מעוכבת על ידי החדרת הביפוספונאט etidronate לחולדות, אוסטאוציטים בתוך המטריקס שלא עבר מינרליזציה אינם מבטאים סקלרוסטין (Irie וחב' ב-J Histochem Cytochem משנת 2008).
הביטוי של סקלרוסטין על ידי אוסטאוציטים שרובצו זה עתה עם תחילת המינרליזציה של אוסטאואידים, יכול לשמש כאיתות משוב שלילי על אוסטאובלסטים. המידע על ההשפעה של סקלרוסטין על ספיגת עצם על ידי אוסטאוקלסטים באדם הוא מוגבל ובלתי עקבי, כאשר במחלת van Buchem וב-sclerosteosis יש דיווחים על ספיגת עצם נמוכה, בלתי מושפעת או מוגברת. בנוסף, במהלך התגבשות (modeling) העצם, סקלרוסטין עשוי לשמור על תאי המעטפת (lining) של העצם במצב רדום, ועל ידי כך למנוע את השפעול של אוסטאובלסטים ויצירת עצם, בלי למנוע ספיגת עצם.
מנגנון הפעולה של סקלרוסטין
שני תהליכים אחראיים לבניית העצם במהלך החיים, והם תהליכי modeling ו-remodeling של העצם. תהליך ה-remodeling מאפשר התחדשות קבועה של תהליך בניית השלד. בתהליך זה, ספיגת עצם על ידי אוסטאוקלסטים כרוכה באופן הדוק עם מה שמכונה BMU או basic multicellular unit, באופן שספיגת עצם מקדימה תמיד את בנייתו. הביטוי של סקלרוסטין על ידי אוסטאוציטים בתחילת תהליך המינרליזציה של אוסטאואידים. (אוסטואיד הוא החלק האורגני הבלתי מינרלי של מטריקס העצם, הנוצר לפני ההבשלה של רקמת העצם. אוסטאובלסטים מתחילים את תהליך יצירת רקמת העצם על ידי הפרשת האוסטאואיד, וכאשר האחרון עובר מינרליזציה. הוא ותאי עצם סמוכים מתפתחים ליצירת רקמת עצם חדשה. ה-osteoid מהווה כ-50% מנפח העצם וכ-40% ממשקל העצם. הוא מורכב מסיבים ומחומר טחון, כאשר הסיב הדומיננטי הוא קולאגן type 1, המהווה כ-90% מה-osteoid. החומר הטחון מורכב בעיקר מ- chondroitin sulfate ומ-(osteocalcin.
כיום ידוע שיצירת סקלרוסטין על ידי אוסטאוציטים מעוכבת על ידי הורמון הפאראתירואיד-PTH (על פי Bellido וחב' ב-Endocrinology משנת 2005), על ידי העמסת משקל כבד (Robling וחב' ב-J Biol Chem משנת 2008) ועל ידי פעילות ציטוקינים אחדים כולל פרוסטגלנדין E2 (על פי Genetos וחב' ב-PLos ONE משנת 2011), וכן על ידיoncostatin M , cardiotrophin-1 ו-LIF או leukemia inhibitory factor (על פי Walker וחב' ב-J Clin Invest משנת 2010). לעומת זאת, יצירת סקלרוסטין מוגברת על ידי קלציטונין (Gooi וחב' ב-Bone משנת 2010).
על בסיס רצף חומצות האמינו, משתייך סקלרוסטין למשפחת DAN, המורכבת מחלבונים מופרשים שמשותפת להם היכולת להוות אנטגוניסטים של פעילות החלבון המורפוגנטי של העצם, BMP. יחד עם זאת נראה שסקלרוסטין אינו אנטגוניסט קלאסי של BMP. אחדים ממשפחת DAN נמצאו אנטגוניסטים של איתות Wnt, ומתוכם החלבון Wise נראה הקרוב ביותר לסקלרוסטין (Ellies וחב' ב-J Bone Miner Res משנת 2006). ה-Wnts הם גליקופרוטאינים המופרשים מהתא ונקשרים ל-7 קולטנים טרנס-ממברנליים מסוג Frizzled, ומאתחלים מסלול המשפעל את האנזים phospholipase C, את חלבון G ואת האנזים Protein Kinase C המשפיעים על התנהגות וגורל התא. גירוי של קולטנים אלה, גורם לאיתות תוך-תאי של מולקולת β-catenin ולהצטברותה ומעברה אל תוך גרעין התא, שם היא מאתחלת את השעתוק של גנים אחדים על ידי יצירת קומפלקס עם גורמי השעתוק TCF/Lef1.
לעומת זאת, בהיעדר Wnt, יוצר beta-catenin קומפלקס עם החלבונים מדכאי-סרטן APC ו-Axin, וכן עם שני האנזימים GSK3 או glycogen synthase kinase 3 ו-CK1 או casein kinase I, מה שמסייע לזרחון ולפירוק הפרוטאזומאלי של beta-catenin (על פי Clevers ב-Cell משנת 2006).
הזיהוי בחולים עם מסת עצם מוגברת של מוטציות gain-of-function ב-LRP5 או low-density lipoprotein receptor-related protein שהוא קו-פקטור ממברנאלי חיוני לאיתותי Wnt (על פי Boyden וחב' ב-N Engl J Med משנת 2002, ו-Little וחב' ב-Am J Hum Genet משנת 2002), לצד גילוי מוטציות loss-of-function ב-LRP5 של חולים עם תסמונת osteoporosis pseudoglioma, מדגישים את החשיבות של תיווך LRP5 באיתות של Wnt בוויסות יצירת העצם (Gong וחב' ב-Cell משנת 2001) נמצא שסקלרוסטין יכול להיקשר ל-LRP5 כמו גם לקולטן הדומה LRP6, ולגרום לעיכוב האיתות של Wnt (על פי Li וחב' ב-J Biol Chem משנת 2005, ו-Semenov וחב' באותו כתב עת ובאותה שנה, וכן Bezooijen וחב' ב-J Bone Miner Res משנת 2007).
עם זאת, למרות שסקלרוסטין נקשר ל-LRP5/6, על מנת לשמש אנטגוניסט לאיתות Wnt, נראה שאין הוא מתחרה עם Wnt להתקשרות ל-LRP5/6. ייתכן שסקלרוסטין משפיע על ידי קישור לקולטן כפול זה, ומשרה את ההחדרה (internalization) שלו אל תוך התא כמו שנמצא לגבי Dkk1, אנטגוניסט אחר של Wnt. בחינת המבנה של סקלרוסטין הראתה שחלבון זה אכן מכיל קשר ציסטיני, וכן מכיל 3 לולאות (Veverka וחב' ב-J Biol Chem משנת 2009, ו-Weidauer וחב' ב-Biochim Biophys Res Commun משנת 2009). אחת מלולאות אלו עשירה בשיירים טעונים חיובית, מה מצביע על אתר אפשרי של אינטראקציה של סקלרוסטין עם מבנה β-propeller של LRP5 הטעון שלילית. בנוסף, אתר הקישור של הנוגדן המנטרל את סקלרוסטין היא הלולאה הספציפית האמורה, מה שמרמז על תפקיד פונקציונאלי של אזור זה בעיכוב איתותי Wnt.
עלה ספק לגבי התפקיד של LRP5 בוויסות יצירת העצם, שכן שֶמֶט מכוון של LRP5 באוסטאובלסטים על ידי שימוש בפרומוטר של קולאגן type 1, נכשל להשרות osteopenia בעכברי knockout עם מוטציה G171V ב-LRP5 ואף לא הגביר את מסת העצם בעכברים אלה (Yadav וחב' ב-Cell משנת 2008). נמצא שתיווך איתותים על ידי LRP5 בתריסריון, עיכב את הביטוי של Tph1, האנזים קובע הקצב של יצירת סרוטונין מחוץ למוח, ולכן הקטין את רמות סרוטונין בנסיוב. לעומת זאת, בעכברי knockout עם פגיעה ב-LRP5 שהיו בעלי מסת עצם נמוכה, רמת סרוטונין בנסיוב הייתה גבוהה. בנוסף, הפחתה של הרמות המוגברות של סרוטונין על ידי הזרקה של p-chlorophenylalanine, או דיאטה דלה בטריפטופאן הביאו לנורמליזציה של יצירת העצם ומסת העצם. ממצאים אלה מצביעים על מנגנון חדש לגבי השפעת האיתות דרך LRP5 המשפיע על עיכוב בניית מסת העצם. סקלרוסטין מעכב את יצירת העצם על ידי שהוא משבש את האיתות של Wnt, המשחק תפקיד חשוב בוויסות יצירת העצם. ייתכן גם שסקלרוסטין מעודד תהליכי אפופטוזיס של תאי עצם, ובכך מונע את שגשוג העצם.
המשמעות הקלינית של פעילות סקלרוסטין
מוטציות בגן המקודד לחלבון סקלרוסטין הכרוכות במפגעים קליניים באות לביטוי במסות עצם מוגזמות, כמו ב-sclerosteosis ובמחלת van Buchem. המפגע הידוע כ- sclerosteosis הוא בעל אופי אוטוזומטלי-רצסיבי המאופיין על ידי שגשוג יתר של רקמת העצם. הוא תואר לראשונה בשנת 1958 (Balemans וחב' ב-Hum Mol Genet משנת 2001, ו-Truswell ב-J Bone Joint Surg ותואר כ-osteopetrosis וסינדקטיליה (אי-הפרדה בין האצבעות) המהווה ואריאנט מורפולוגי של מחלת Albers-Schönberg.
אחד האתגרים במחקרים על מעכבי סקלרוסטין הוא לשלול את השפעת עיכוב מעבר הסיגנל דרך Wnt/beta-catenin על הטומוריגנזיס, עקב ביטויו הרחב בתאים רבים בגוף כולל בתאי הגידול. בניסויphase I הזרקת נוגדן מונוקלונלי לסקלרוסטין אצל מתנדבים בריאים גרם לעלייה משמעותית של סמני בניית העצם P1NP , bone alkaline phosphatase ואוסטאוקלצין, תוך ירידה ב-CTx. במקביל לעדות ביוכימית לחלון האנבולי, צפיפות העצם בעמוד השדרה ובראש הירך עלתה באופן ניכר במשך 85 ימי מחקר. (5.3% ו-2.8% בהתאמה). לא היו תופעות לוואי רציניות מלבד אירוע אחד של הפטיטיס זמנית. 6 חולים פיתחו נוגדנים, בחלקם ניטרליים.
כצפוי, סקלרוסטין אינו מבוטא באוסטאוציטים בביופסיות עצם של אנשים עם sclerosteosis (Bezooijen וחב' ב-J Exp Med משנת 2004). בנוסף לא נמצא ביטוי של סקלרוסטין בביופסיות עצם של מטופלים עם מחלת van Buchem, מה שתומך בחיוניות של אותו חלק מהגנום שהושמט (deletion) ליצירת סקלרוסטין בעצם (Bezooijen וחב' ב-J Dent Res משנת 2009).
גורמים המשפיעים על ביטוי הגן SOST
מספר גורמים סיסטמיים ומקומיים הוצעו כמווסתים אפשריים של ביטוי SOST/sclerosin על ידי אוסטאוציטים. אחד הטיפולים באוסטאופורוזיס הוא על ידי ההורמון האנושי הרקומביננטי PTH, או על ידי מקטעים פעילים של PTH (על פי Pleiner-Duxneuner וחב' ב- Calcif Tissue Int משנת 2009). בניגוד להשפעות המעודדות של הגברה מתמשכת של PTH אנדוגני על ספיגת עצם, כמו שמוצאים באנשים עם hyperparathyroidism, הגברה סירוגית של PTH הניתן על ידי הזרקות יומיות כרוכה בהשפעות אנאבוליות ברורות.
המנגנון דרכו PTH מתווך בהתרחשות עצם אנאבולית זו, אינו ברור דיו. חלק ממנגנון זה עשוי להשתמש בסקלרוסטין, שהרי נמצא ש-PTH מעכב את ביטוי סקלרוסטין in vitro וגם in vivo. במערכת in vitro מפחית PTH את השעתוק של הגן SOST על ידי תאים אוסטאובלסטים ואוסטאוציטים תוך 4 שעות. עיכוב זה לא הושפע על ידי מעכב של סינתזת החלבונים cyclohexamide, אך פחת על ידי forskolin המשרה יצירת cAMP (על פי Bellido וחב' ב-Endocrinology משנת 2005, ו-Keller ו-Kneissel ב-Bone משנת 2005). תצפיות אלו מצביעות על השפעה מווסתת ישירה של PTH הנמצאת בתלות ב-cAMP על הביטוי של SOST. מסתבר שמקטע בתוך המקטע הגנומי בגודל של 52kb שנשמט במחלת van Buchem, זוהה כאלמנט תגובה הידוע כ-MEF2, שהוא חיוני ל-downregulation של SOST בהשראת PTH (על פי Leupin וחב' ב-J Bone Miner Res משנת 2007).
בתנאי in vivo, הזרקה של PTH גרמה להפחתה ב-mRNA של סקלרוסטין בעכברים ובחולדות (Silvestrini וחב' ב-J Mol Histol משנת 2007). החשיבות של וויסות הגן SOST על ידי PTH, נתמכת על ידי הממצאים שההשפעה האנאבולית של PTH נעלמת בעכברים נטולי-SOST כמו גם בעכברים המבטאים ביתר את SOST תוך שימוש בפרומוטר פעיל מוּבנֶה (constitutive) (על פי Kramer וחב' ב-J Bone Miner Res משנת 2009).
שני גורמים סיסטמיים אחרים נמצאו גם כן משפיעים על הביטוי של SOST/sclerostin. נמצא ש-Dihydroxy D31,25 לבד או בשילוב עם חומצה רטינואית, הגבירו את ביטוי SOST באוסטאובלסטים של בני-אדם בתרבית (Sutherland וחב' ב-Bone משנת 2004, ו-Sevetson וחב' ב-J Biol Chem משנת 2004). ההשפעה הספציפית של גלוקו-קורטיקואידים על ביטוי של SOST, תלויה בתנאי הניסויים. In vitro, דקסמתאזון מדכא את הביטוי של SOST באוסטאובלסטים, בה בשעה ש-in vivo, טיפול של עכברים ב-prednisolone הגדיל את הביטוי של SOST בעצמות השוק, מה שמצביע על כך שדיכוי איתותי Wnt על ידי upregulation של סקלרוסטין, יכול להיות אחראי לדיכוי של יצירת עצם בהשראת גלוקו-קורטיקואידים (Yao וחב' ב-Arthritis Rheum משנת 2008).
עוד גורמי גדילה מקומיים כגון BMP4 ,BMP2 ו-BMP6 מעודדים ביטוי של SOST באוסטאובלסטים in vitro (על פי Ohyama וחב' ב-Endocrinology משנת 2004). כמו כן ידוע שאלמנטים המגיבים ל-BMP, נמצאים בתוך אזור הפרומוטר של SOST (על פי Kamiya וחב' ב-Development משנת 2008). כן נמצא שאיתות מופחת של BMP בעכברי knockout עם פגיעה ב-BMPR1A הספציפי לאוסטאובלסטים, הפחיתה את ה-mRNA ואת הביטוי של סקלרוסטין בכיפת הגולגולת (calvary) של עוברי עכברים אלה, והיה כרוך בהגדלת מסת העצם באזור זה. בעכברים אלה נמצאה גם הפחתה בספיגת עצם, כנראה בהשפעת הגברת איתותי Wnt, כתוצאה מהקטנת הביטוי של סקלרוסטין.
Sclerosteosis ומחלת van Buchem- שני מפגעי עצם הקשורים לפגם בסקלרוסטין
שני מפגעי עצם נדירים אלה, sclerosteosis ומחלת van Buchem, לראשונה בשנות ה-50 בתור שתי ישויות קליניות נפרדות, עם פנוטיפים דומים (Hamersma וחב' ב-Clin Genet משנת 2003, ו-Beighton וחב' באותו כתב עת משנת 1984). המפגע sclerosteosis אובחן בעיקר בקרב האפריקנרים (afrikaners) ממוצא הולנדי בדרום אפריקה, בעוד שמחלת van Buchem מקורה בכפר דייגים קטן בהולנד. מספר בודדים או משפחות עם sclerosteosis או עם מחלת van Buchem דווחו באזורי עולם אחרים כמו ספרד, ברזיל, ארה"ב, יפאן, שוויץ וסנגל.
הביטוי השלדי החריג של sclerosteosis ושל מחלת van Buchem הם תוצאה של מה שידוע כ-endosteal hyperostosis או מפגע עצם מולד המאופיין על ידי שגשוג יתר של עצם הלסת ושל העצם באזור גבות העיניים, שיכול להתפתח למצב של osteosclerosis (על פי Benzooijen וחב' ב-Cytokine Growth Factor Res משנת 2005, ו-Benzooijen וחב' ב-Principles of bone biology משנת 2008). כאמור הביטוי של 2 מפגעים אלה בולט בלסת ובגולגולת, מה שעלול להגביר את הלחץ התוך גולגולתי, לכליאת עצבי הגולגולת, ולגרום לעתים לשיתוק עצבי הפנים (facial palsy), לאיבוד שמיעה ולעתים לאיבוד חוש הריח. אלה המאובחנים עם sclerosteosis הם בעלי מאפיינים פנוטיפיים חמורים יותר מאשר אלה עם מחלת van Buchem, ואף סובלים לעתים מסינדיקטליה. במספר מוגבל של ביופסיות עצם שבוצעו בפרטים הלוקים במפגעים אלה, יש ראיות ליצירת עצם מוגברת, לפעילות מוגברת של של אוסטאובלסטים קובואידאליים (דמויי קובייה), ולמסה מוגברת של אוסטאואידים שעוברים מינרליזציה, ולא נרשמה בהם פעילות אוסטאוקלסטית (Hill וחב' ב-Am J Neuroradiol משנת 1986, ו-Stein וחב' ב-Neurology משנת 1983).
במטופלים עם sclerosteosis השילוב של מסת עצם גבוהה עקב יצירת עצם מוגברת, ונוכחות של קודונים גורמי פּסק מוקדמת בגן SOST, גורמים להשפעה מעכבת של יצירת סקלרוסטין על תהליך בניית העצם. ואכן הוספה של סקלרוסטין אקסוגני לתרביות תאים אוסטאוגניים עכבה את שגשוג והתמיינות של אוסטאובלסטים של עכבר ואדם בתרבית תאים (Winkler וחב' ב-EMBO J משנת 2003). בנוסף, הראו שסקלרוסטין מקטין את תוחלת החיים של אוסטאובלסטים, על ידי הגברת תהליך האפופטוזיס (Sutherland וחב' ב-Bone משנת 2004). בעכברים נמצא שיצירת-יתר של סקלרוסטין גרמה אצלם ל-osteopenia, כתוצאה מיצירה מופחתת של עצם ללא שינוי בתהליכי ספיגת עצם. יתרה מכך, אנליזה של עכברי knockout בהם הושרתה פגיעה בגן SOST, הראתה עליות ניכרות בצפיפות העצם, בצפיפות המינרלים בעצם (BMD), בנפח של עצם הבריח, בקצב יצירת העצם, ובחוזק העצם (Li וחב' ב-J Bone Miner Res משנת 2008). נתונים אלה תומכים בהשפעה השלילית של סקלרוסטין על יצירת העצם.
קבוצתו של Beighton דווחה על רמה מוגברת בנסיוב של alkaline phosphatase שהוא מדד ליצירת עצם ברוב הנבדקים עם sclerosteosis (על פי Epstein וחב' ב-S Afr Med J משנת 1979, ו-Beighton וחב' ב-Ann Intern Med משנת 1976). לעומת זאת, Wergedal וחב' דווחו ב- J Clin Endocrinol Metab משנת 2003, על כך שמצאו בנסיוב של-6 חולים עם מחלת van Buchem גם רמות מוגברות של סמנים של בניית עצם (alkaline phosphatase, P1NP, ו-osteocalcin), אך גם רמות מוגברות בשתן של הסמן CTx של ספיגת עצם, זאת בהשוואה לנשים חסרות תסמינים של המחלה. יחד עם זאת, מדגם הנבדקים בניסוי זה קטן מכדי הסקת מסקנות לגבי המוגברות של NTX בשתן.
הפגם הגנטי הגורם ל-sclerosteosis זוהה בגן SOST, הממוקם בכרומוזום 17 באתר 17q12-21, והוא הגן המקודד לסקלרוסטין. עד כה זוהו 5 מוטציות בגן זה בחולים עם sclerosteosis, כאשר בשלוש מתוכן מוצאים קודון פסק מוקדם או premature termination codon המובילים ליצירתו של חלבון קצר יותר, ובשניים האחרים יש הפרעה ל-splicing של הגן (Balemans וחב' ב-Hum Mol Genet משנת 2001 וב-Bone משנת 2005, ו-Brunkow וחב' ב-Am J Hum Genet משנת 2001, וכן Kim וחב' ב-Genet Test משנת 2008). לעומת זאת, לא נמצאו מוטציות בגן זה בחולים עם van Buchem, אך יחד עם זאת באחרונים התגלה שמט (deletion) של52kb במורד הגן SOST (על פי Belemans וחב' ב-J Med Genet משנת 2002, ו-Staehling-Hampton וחב' ב-Am J Med Genet משנת 2002). האזור שנשמט נמצא לאחר מכן מכיל אלמנטים מווסתים של שעתוק SOST, מה שמסביר את יכולתו להשרות פנוטיפ הדומה לזה של אלה עם sclerosteosis (על פי Loots וחב' ב-Genome Res משנת 2005). הפגמים השונים בגן SOST אינם יכולים להסביר בקלות את ההבדלים בפנוטיפים של שני מפגעי העצם הללו.
הפוטנציאל הטיפולי בנטרול סקלרוסטין
אוסטאופורוזיס מתאפיין על ידי מסת עצם נמוכה ועל מיקרו-ארכיטקטורה פגומה של רקמת העצם, מה שמגביר את שבירות העצם והרגישות המוגברת לשברי-עצם. האיזון בין תהליכי ספיגת עצם לבניית עצם קובע את מסת העצם והשלמות המבנית שלה, ואלה משובשים באוסטאופורוזיס. הטיפולים הרווחים כיום במחלה זו, מלבד זה של PTH, מקטינים את הסיכון לשברי עצם על ידי הפחתת ספיגת עצם ועל ידי השמירה של ארכיטקטורת העצם, אך אינם יכולים לעודד בניית עצם. בשנים האחרונות, מחקרים אודות מפגעי עצם נדירים, כמו גם מניפולציות גנטיות במודלים של חיות מעבדה, הביאו לזיהוי של מסלולי איתות המווסתים יצירת עצם, ואלה סיפקו יעדים פוטנציאליים לפיתוח תכשירי טיפול חדשים. בסיס חיוני להתקדמות טיפולית זו, היו מחקרים ב-2 דיספלסיות טרשתיות נדירות של העצם, sclerosteosis ומחלת van Buchem, שהביאו לזיהוי של החלבון סקלרוסטין (sclerostin), ווסת שלילי חשוב של בניית עצם (Moester וחב' ב-Calcif Tissue Int משנת 2010).
הזיהוי של חסר סקלרוסטין כגורם לסקלרוסטאוזיס ולמחלת van Buchem, וההתקדמות בהבנה של פעילות סקלרוסטין ביצירת עצם, פתח עידן חדש בטיפול במחלות עצם. ההתבטאות המוגבלת של סקלרוסטין והפנוטיפ של עודף עצם באיכות טובה ב-2 המפגעים האמורים, נותנים בסיס ליצירת תכשירים המעודדים בניית עצם מה שרלוונטי לטיפול באוסטאופורוזיס. כיוון שסקלרוסטין הוא חלבון מופרש, גישה קלינית אחת היא בפיתוח נוגדנים המסוגלים לעכב את הפעילות הביולוגית של חלבון זה, ובכך לחקות את העדרו בתרחיש של sclerosteosis. נוגדנים כאלה כבר הוכחו ככאלה המעלים את ה-BMD, את נפח העצם ואת חוזקה בחולדות ששחלותיהן הוסרו (Li וחב' ב-J Bone Mine Res משנת 2009), כמו גם בפרימטים (Ominsky וחב' בכינוס השנתי של החברה האמריקנית לחקר העצם בפילדלפיה בשנת 2006), וכן למנוע איבוד עצם במודל של colitis (על פי Eddleston וחב' ב-J Bone Miner Res משנת 2009).
נתונים ראשוניים של ניסוי כפול-סמיות, מבוקר כנגד פלצבו בו השתתפו 48 נשים בגיל חידלון הווסת, הראה שהזרקה חד-פעמית של נוגדן חד-שבטי כנגד סקלרוסטין, הגדילה באופן בולט את הסמנים של יצירת עצם ואת ה-BMD, והייתה נסבלת בהחלט (Padhi וחב' ב-J Bone Miner Res משנת 2007). רמות P1NP בנסיוב, הגיעו לשיאן 14-25 יום לאחר הזרקת נוגדן זה, וחזרו בהדרגה לערכי הבסיס לאחר חודשיים בערך. בניגוד לכך, הסמן CTx של ספיגת עצם פחת למינימום לאחר 14 יום מהזרקת הנוגדן, וחזר אף הוא לערכי הבסיס שלו לאחר חודשיים.
:Romosozumab הנוגדן המנטרל סקלרוסטין ומצטייר כפוטנציאל משמעותי בטיפול באוסטאפורוזיס
בינואר 2014 התפרסם ב-N Engl J Med מחקרם של McClung וחב' שדיווח על תוצאות ניסוי רב-מוסדי phase II עם הנוגדן החד-שבטי romosozumab (תוצרת חברות Amgen ו-UCB) בהשתתפות 419 נשים בגילים שבין 55-85 שנה, שסבלו מ-osteopeia מתונה. ניסוי זה נועד לבחון את יכולת הנוגדן האמור לעודד יצירת עצם ולחזק את השלד מפני שברים. אכן, רוב התרופות לטיפול באוסטאופורוזיס פועלות למניעת קטבוליזם של רקמת העצם כתוצאה מספיגתו על ידי אוסטאוקלסטים, כאשר תרופה אחרת שנוסתה בגישה אנאבולית שמגבירה יצירת עצם (teriparatide או Forteo) נחשדת להגברת הסיכון לסרטן עצמות.
התוצאות הראו כי התכשיר החדש יעיל יותר פי 1.5-3 מאשר התרופות לאוסטאופורוזיס הקיימות היום לבניה מחדש של צפיפות עצם בעמוד השדרה המותני. romosozumab העלה את צפיפות המינרלים בעמוד השדרה ב-11.3% במהלך תקופת המחקר, בהשוואה לעליה של 7.1% עם Forteo ו-4.1% עם Fosamax, תכשיר ממשפחת הביספוספונטים. בקבוצת הפלצבו הייתה ירידה של 0.1% בצפיפות המינרלים בעצם. התרופה הראתה גם עליות ניכרות בצפיפות המינרלים בעצם באזורי גוף אחרים, כאשר עליות משמעותיות נצפו כבר בהערכה מוקדמת שבוצעה לאחר שלושה חודשי טיפול. נראה גם כי התרופה החדשה הניתנת בהזרקה לא גרמה לתופעות לוואי משמעותיות.
תוצאות הניסוי המוקדם של McClung, הביאו את Cosman וחב' לניסוי רב מוסדי בארה"ב, קנדה, גרמניה, יפן, שוויץ, פולין והונג-קונג, אליו גויסו 7,180 נשים בגיל חידלון הווסת, עם T score של -2.5עד -3.5 בצוואר הירך. משתתפות הניסוי חולקו באקראי לכאלה שהוזרקו מתחת לעור אחת לחודש למשך 12 חודשים עם 210 מיליגרם romosozumab, או עם פלצבו. לאחר תקופה זו טופלו הנשים ב-2 הקבוצות עם התכשיר המונע ספיגת עצם denosumab (בהזרקות תת-עוריות של 690 מיליגרם אחת ל-6 חודשים. תוצאות ניסוי זה היו כדלקמן: לאחר 12 חודשים, שברי חוליות בעמוד השדרה התגלו ב-16 מתוך 3,321 נשים בקבוצת ה-romosozumab (0.5%), בהשוואה ל-59 נשים מתוך 3,322 בקבוצת הפלצבו (1.8%), מה שמבטא הפחתה של 73% בסיכון לשברי חוליות השדרה (p<0.001). באשר לשברים קליניים, הם הופיעו ב-58 מתוך ,3,589 נשים בקבוצת ה-romosozumab (1.6%), לעומת 90 נשים מתוך 3,591 נשים בקבוצת הפלצבו (2.5%), מה שמבטא ירידה בסיכון של 36% (p=0.008). שברים לא חולייתיים התרחשו ב-56 מתוך 3,589 נשנים בקבוצת הנוגדן (1.6%) לעומת 75 נשים מתוך 3,591 בקבוצת הפלצבו (2.1%) (p=0.10). לאחר 24 חודשים, השיעור של שברי חוליות היה נמוך משמעותי בקבוצת romosozumab בהשוואה לקבוצת הפלצבו, 21 מתוך 3,325 או 0.6%, לעומת 84 מתוך 3,327 או 2.5%. מה שמהווה הפחתה של 75% בשברים אלה (p<0.001). תופעות הלוואי היו דומות ב-2 הקבוצות. גישות נוספות לעיכוב יצירת סקלרוסטין או את פעילותו, אפשריות אף הן, אך מעבר ליעילותן במניעת אוסטאופורוזיס, הן צריכות להיות אף בטיחותיות. הממצא שרמות BMD מוגברות באלה עם sclerosteosis, ללא סיבוכים שלדיים (Gardner וחב' ב-J Clin Endocrinol Metab משנת 2005), מצביעה על כך שניתן לטטר את דרגת העיכוב של סקלרוסטין, ולהגיע לתוצאות הנדרשות ללא תופעות לוואי. יחד עם זאת, התעוררו ספקות שמא עידוד יצירת עצם על ידי הגברת איתות Wnt עלול לגרום להשפעות שלדיות בלתי-רצויות (Whyte וחב' ב-N Engl J Med משנת 2004, ו-Rickels וחב' ב-J Bone Miner Res משנת 2005). לדוגמה, מעכב Wnt הידוע כ-WIF1 או Wnt inhibitor factor 1, זוהה כמועמד לשמש כגן מדכא סרטן ב-אוסטאו-סרקומה באדם, מה שמצביע שהסיכון ללקות בסוג סרטן העצמות האחרון עלול לגדול במטופלים המקבלים טיפולים אנאבוליים חדשים, המכוונים כנגד אנטגוניסטים של Wnt (על פי Kansara וחב' ב-J Clin Invest משנת 2009).
הוראות לביצוע הבדיקה
דם ורידי נלקח בשעת בוקר במבחנה כימית (פקק אדום או צהוב) בצום של 8 שעות. הנסיוב המופרד נשמר בהקפאה בטמפ של מינוס 30 מעלות. המדידה של סקלרוסטין מתבצעת בשיטת ELISA, או על ידי ECL (electrochemiluminiscence).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק