הבדלים בין גרסאות בדף "תסמיני דרכי השתן התחתונות בגברים - ההקשר ההורמונלי - Lower urinary tract symptoms in men - hormonal aspect"
| שורה 18: | שורה 18: | ||
==הורמונים אנדרוגניים, הגדלה או שגשוג שפירים של הערמונית ותסמינים של דרכי שתן תחתונות== | ==הורמונים אנדרוגניים, הגדלה או שגשוג שפירים של הערמונית ותסמינים של דרכי שתן תחתונות== | ||
| − | האנדרוגן הפעיל ביותר בערמונית הוא ה-[[5 אלפא דהידרוטסטוסטרון]] (Dihydrotestosterone, DHT) שנוצר בערמונית על ידי פעילות של האנזים 5 אלפא רדוקטז על הטסטוסטרון. טסטוסטרון גם עובר ארומטיזציה והופך ל[[אסטרוגן]] בערמונית, בכבד, בעור וברקמת השומן. אסטרוגן ו-DHT לעומת זאת, אינם יכולים להפוך לטסטוסטרון. ריכוז ה-DHT בערמונית גדול פי 5 מהטסטוסטרון (5 נ"ג/גר' משקל רטוב של רקמה). | + | האנדרוגן הפעיל ביותר בערמונית הוא ה-[[5 אלפא דהידרוטסטוסטרון]] ([[Dihydrotestosterone]], DHT) שנוצר בערמונית על ידי פעילות של האנזים 5 אלפא רדוקטז על הטסטוסטרון. טסטוסטרון גם עובר ארומטיזציה והופך ל[[אסטרוגן]] בערמונית, בכבד, בעור וברקמת השומן. אסטרוגן ו-DHT לעומת זאת, אינם יכולים להפוך לטסטוסטרון. ריכוז ה-DHT בערמונית גדול פי 5 מהטסטוסטרון (5 נ"ג/גר' משקל רטוב של רקמה). |
הערמונית מגיבה לשינויים ההורמונליים המתרחשים במהלך חייו של הגבר. בגיל שבין 10 ל-20 שנים, תחת השפעה של רמות טסטוסטרון הולכות ועולות, עוברת הערמונית תהליך של גדילה מואצת. לאחר גיל 20, תחת רמות גבוהות ממושכות של טסטוסטרון, שומרת הערמונית על נפח קבוע תוך כדי איזון בין התפתחות של תאים חדשים ואפופטוזה (Apoptosis). החל מגיל 50, מתחילה הערמונית במקרים רבים לעלות בנפחה, ומתפתח שגשוג שפיר של הערמונית ובמקרים רבים גם [[סרטן הערמונית|ממאירות]], המופיעה באחד מכל 6 גברים. גדילה מחודשת זו של הערמונית מתרחשת בד-בבד עם ירידה איטית והדרגתית ברמות האנדרוגנים, ועלייה יחסית ברמות האסטרוגנים בדם ההיקפי בתהליך ההזדקנות. אחת התיאוריות המסבירה את התופעה, גורסת כי עם ירידה ברמות האנדרוגנים נוצר בערמונית "רעב" להורמונים אלה. כדי לשמור על מנות מתאימות של אנדרוגנים, מתבצעת פעילות שעתוק מואצת לבניית חלבונים לצורך העלאת ריכוזי הקולטנים האנדרוגניים ברקמת הערמונית. תהליכים אלה יכולים להביא ל[[חוסר יציבות גנטית]], להפר את האיזון שבין התפתחות תאים חדשה ואפופטוזה, ולהביא להגדלה (BPE) ושגשוג שפיר בערמונית (BPH), ואף להתפתחות ממאירות. בעבודה על מודל של כלבים נמצא, כי פעילות איגבור (סינרגיזם) של אסטרוגן ו-DHT גורמת לשגשוג ולהגדלת הערמונית בקצב ובממדים גדולים יותר מאשר פעילות של אנדרוגנים בלבד, וכן גורמת להאטה ניכרת של האפופטוזה של תאים בערמונית. האסטרוגנים, על ידי האצת הפעילות של הארומטזות, מביאים גם לעלייה בריכוז הקולטנים האנדרוגניים. בגבר המבוגר, עם ירידה ברמות הטסטוסטרון, רמות האסטרוגנים נשארות יחסית קבועות ואף עולות, כך שייתכן כי בהשפעה הגוברת של האסטרוגנים עולה ריכוז הקולטנים האנדרוגנים ופעילות הארומטזות בערמונית, העשויה להביא להגדלה ושגשוג שפיר של הבלוטה. מנתנוים אלה עולה ההשערה, כי ניתן למנוע את ההגדלה השפירה של הערמונית בגבר המבוגר על ידי החזרת היחס בין טסטוסטרון ואסטרוגן לזה שהיה קיים בשנות השלושים לחייו. עבודותיהם של Walsh ו-Bartsch מראות כי התמונה מורכבת יותר. החוקרים הראו, כי קיימות רמות דומות של DHT בערמוניות של גברים מבוגרים ללא שגשוג שפיר של הערמונית ובגברים מבוגרים עם שגשוג שפיר של הערמונית. כמו כן, לא היה הבדל בין שתי הקבוצות ברמות של [[פרוגסטרון]], [[אסטריול]], [[אסטרון]] ו[[אסטרדיול]]. | הערמונית מגיבה לשינויים ההורמונליים המתרחשים במהלך חייו של הגבר. בגיל שבין 10 ל-20 שנים, תחת השפעה של רמות טסטוסטרון הולכות ועולות, עוברת הערמונית תהליך של גדילה מואצת. לאחר גיל 20, תחת רמות גבוהות ממושכות של טסטוסטרון, שומרת הערמונית על נפח קבוע תוך כדי איזון בין התפתחות של תאים חדשים ואפופטוזה (Apoptosis). החל מגיל 50, מתחילה הערמונית במקרים רבים לעלות בנפחה, ומתפתח שגשוג שפיר של הערמונית ובמקרים רבים גם [[סרטן הערמונית|ממאירות]], המופיעה באחד מכל 6 גברים. גדילה מחודשת זו של הערמונית מתרחשת בד-בבד עם ירידה איטית והדרגתית ברמות האנדרוגנים, ועלייה יחסית ברמות האסטרוגנים בדם ההיקפי בתהליך ההזדקנות. אחת התיאוריות המסבירה את התופעה, גורסת כי עם ירידה ברמות האנדרוגנים נוצר בערמונית "רעב" להורמונים אלה. כדי לשמור על מנות מתאימות של אנדרוגנים, מתבצעת פעילות שעתוק מואצת לבניית חלבונים לצורך העלאת ריכוזי הקולטנים האנדרוגניים ברקמת הערמונית. תהליכים אלה יכולים להביא ל[[חוסר יציבות גנטית]], להפר את האיזון שבין התפתחות תאים חדשה ואפופטוזה, ולהביא להגדלה (BPE) ושגשוג שפיר בערמונית (BPH), ואף להתפתחות ממאירות. בעבודה על מודל של כלבים נמצא, כי פעילות איגבור (סינרגיזם) של אסטרוגן ו-DHT גורמת לשגשוג ולהגדלת הערמונית בקצב ובממדים גדולים יותר מאשר פעילות של אנדרוגנים בלבד, וכן גורמת להאטה ניכרת של האפופטוזה של תאים בערמונית. האסטרוגנים, על ידי האצת הפעילות של הארומטזות, מביאים גם לעלייה בריכוז הקולטנים האנדרוגניים. בגבר המבוגר, עם ירידה ברמות הטסטוסטרון, רמות האסטרוגנים נשארות יחסית קבועות ואף עולות, כך שייתכן כי בהשפעה הגוברת של האסטרוגנים עולה ריכוז הקולטנים האנדרוגנים ופעילות הארומטזות בערמונית, העשויה להביא להגדלה ושגשוג שפיר של הבלוטה. מנתנוים אלה עולה ההשערה, כי ניתן למנוע את ההגדלה השפירה של הערמונית בגבר המבוגר על ידי החזרת היחס בין טסטוסטרון ואסטרוגן לזה שהיה קיים בשנות השלושים לחייו. עבודותיהם של Walsh ו-Bartsch מראות כי התמונה מורכבת יותר. החוקרים הראו, כי קיימות רמות דומות של DHT בערמוניות של גברים מבוגרים ללא שגשוג שפיר של הערמונית ובגברים מבוגרים עם שגשוג שפיר של הערמונית. כמו כן, לא היה הבדל בין שתי הקבוצות ברמות של [[פרוגסטרון]], [[אסטריול]], [[אסטרון]] ו[[אסטרדיול]]. | ||
גרסה מ־10:18, 21 במרץ 2017
| תסמיני דרכי השתן התחתונות בגברים - ההקשר ההורמונלי | ||
|---|---|---|
| Lower urinary tract symptoms in men - hormonal aspect | ||
| יוצר הערך | ד"ר משה שלו 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – ערמונית, מעכבי PDE5
מבחינה הורמונלית, בשנות הארבעים המוקדמות מתחילה להופיע בגבר ירידה ברמות האנדרוגנים בדם ההיקפי, ויש המצביעים על כך כתחילת תהליך ההזדקנות, ובתחילת שנות החמישים לחייו מתחילות להיראות התוצאות הראשונות של תהליך זה. החל מגיל 40, רמת הטסטוסטרון בדם הגבר יורדת בממוצע של 1% כל שנה. ירידה זו היא תוצאה של ירידה במספר תאי ליידיג (Leydig cells) באשכים כמו גם ירידה ברגישותם של תאים אלה להשפעת הורמון מחלמן LH (Luteinizing Hormone, LH). התוצאה היא תת-פעילות בלוטות מין (Hypogonadism) ביוכימי בכ-10% מהגברים מתחת לגיל 60, והוא עולה עד יותר מ-35% באוכלוסיית הגברים מעל גיל 60. לירידה בערכי הטסטוסטרון מתלווה עם הגיל עליה ברמת הגלובולין הקושר הורמוני מין SHBG (Sex Hormone-Binding Globulin, SHBG). חלבון זה קושר טסטוסטרון חופשי, ועם ירידה בהיענות לטסטוסטרון של אברי המטרה כמו המוח, עצמות, ערמונית ושרירים, מביא החלבון SHBG לכך שסך כמות הטסטוסטרון הזמינה לפעילות התאים יורדת בצורה משמעותית. ירידה זו ברמות הטסטוסטרון נקשרת להופעת תסמינים רבים חיצוניים ופנימיים בגוף האדם האופייניים לתהליך הזקנה. כמו כן, נמצא קשר בין רמות נמוכות של טסטוסטרון והופעת מחלות לב וכלי דם, הפרעה בשומני הדם (Dyslipidemia), טרשת עורקים וסוכרת סוג 2, כך שחוקרים רבים סבורים שרמות נמוכות של טסטוסטרון, קרי תת-פעילות בלוטות מין בהופעתה בגיל המבוגר (Late Onset Hypogonadism, LOH) או בשמה האחר, התסמונת של חסר בטסטוסטרון (Testosterone Deficiency Syndrome, TDS) הוא חלק מהתסמינים המאפיינים את התסמונת המטבולית ואף מהווה גורם סיכון להופעתה.
החל מגיל חמישים ההיארעות של הגדלה (Benign Prostatic Enlargement, BPE) או שגשוג שפיר של הערמונית (Benign Prostatic Hyperplasia, BPH) הולכת ועולה עם הגיל. הגדלת הערמונית יכולה להוביל ללחץ על השופכה, צוואר ובסיס כיס השתן ולגרום למערך של תסמינים הכוללים היסוס במתן שתן, זרם שתן חלש ומקוטע, טפטוף ארוך, תכיפות בעיקר בלילה, דחיפות ואף לאי נקיטת שתן. כך, שנים רבות קישרו את התסמינים הללו אך ורק לתוצאת הלחץ של ערמונית הולכת וגדלה על השופכה והאבחנה של הגדלת ערמונית מצאה לה מקום של כבוד במילון הרפואי. אלא שהפרעות בדרכי השתן התחתונות (Lower Urinary Tract Symptoms, LUTS) יכולות להופיע גם ללא הגדלה משמעותית בנפח הערמונית. רק ב-50% מהחולים עם הוכחה היסטולוגית לשגשוג שפיר של הערמונית קיימת הגדלה של הערמונית. בנוסף על כך, הצטברו עבודות אפידמיולוגיות שהראו כי לאחר גיל 60 ההיארעות של תסמינים בדרכי שתן תחתונות מופיעה באופן שווה בגברים ובנשים כאחת. בעבודות מעבדה על ארנבים זכרים מסורסים נמצאה ירידה בהיענות של כיס השתן והופעה של כיס שתן המאופיין בפעילות יתר, שחלפה לאחר הזרקת טסטוסטרון. מכאן התפתחה ההשערה, שהופעה של הפרעות בדרכי השתן התחתונות בגיל המבוגר קשורה לא רק להגדלת נפח הערמונית, אלא גם להופעתם של שינויים הורמונליים המתרחשים בתהליך הזקנה.
הורמונים אנדרוגניים, הגדלה או שגשוג שפירים של הערמונית ותסמינים של דרכי שתן תחתונות
האנדרוגן הפעיל ביותר בערמונית הוא ה-5 אלפא דהידרוטסטוסטרון (Dihydrotestosterone, DHT) שנוצר בערמונית על ידי פעילות של האנזים 5 אלפא רדוקטז על הטסטוסטרון. טסטוסטרון גם עובר ארומטיזציה והופך לאסטרוגן בערמונית, בכבד, בעור וברקמת השומן. אסטרוגן ו-DHT לעומת זאת, אינם יכולים להפוך לטסטוסטרון. ריכוז ה-DHT בערמונית גדול פי 5 מהטסטוסטרון (5 נ"ג/גר' משקל רטוב של רקמה).
הערמונית מגיבה לשינויים ההורמונליים המתרחשים במהלך חייו של הגבר. בגיל שבין 10 ל-20 שנים, תחת השפעה של רמות טסטוסטרון הולכות ועולות, עוברת הערמונית תהליך של גדילה מואצת. לאחר גיל 20, תחת רמות גבוהות ממושכות של טסטוסטרון, שומרת הערמונית על נפח קבוע תוך כדי איזון בין התפתחות של תאים חדשים ואפופטוזה (Apoptosis). החל מגיל 50, מתחילה הערמונית במקרים רבים לעלות בנפחה, ומתפתח שגשוג שפיר של הערמונית ובמקרים רבים גם ממאירות, המופיעה באחד מכל 6 גברים. גדילה מחודשת זו של הערמונית מתרחשת בד-בבד עם ירידה איטית והדרגתית ברמות האנדרוגנים, ועלייה יחסית ברמות האסטרוגנים בדם ההיקפי בתהליך ההזדקנות. אחת התיאוריות המסבירה את התופעה, גורסת כי עם ירידה ברמות האנדרוגנים נוצר בערמונית "רעב" להורמונים אלה. כדי לשמור על מנות מתאימות של אנדרוגנים, מתבצעת פעילות שעתוק מואצת לבניית חלבונים לצורך העלאת ריכוזי הקולטנים האנדרוגניים ברקמת הערמונית. תהליכים אלה יכולים להביא לחוסר יציבות גנטית, להפר את האיזון שבין התפתחות תאים חדשה ואפופטוזה, ולהביא להגדלה (BPE) ושגשוג שפיר בערמונית (BPH), ואף להתפתחות ממאירות. בעבודה על מודל של כלבים נמצא, כי פעילות איגבור (סינרגיזם) של אסטרוגן ו-DHT גורמת לשגשוג ולהגדלת הערמונית בקצב ובממדים גדולים יותר מאשר פעילות של אנדרוגנים בלבד, וכן גורמת להאטה ניכרת של האפופטוזה של תאים בערמונית. האסטרוגנים, על ידי האצת הפעילות של הארומטזות, מביאים גם לעלייה בריכוז הקולטנים האנדרוגניים. בגבר המבוגר, עם ירידה ברמות הטסטוסטרון, רמות האסטרוגנים נשארות יחסית קבועות ואף עולות, כך שייתכן כי בהשפעה הגוברת של האסטרוגנים עולה ריכוז הקולטנים האנדרוגנים ופעילות הארומטזות בערמונית, העשויה להביא להגדלה ושגשוג שפיר של הבלוטה. מנתנוים אלה עולה ההשערה, כי ניתן למנוע את ההגדלה השפירה של הערמונית בגבר המבוגר על ידי החזרת היחס בין טסטוסטרון ואסטרוגן לזה שהיה קיים בשנות השלושים לחייו. עבודותיהם של Walsh ו-Bartsch מראות כי התמונה מורכבת יותר. החוקרים הראו, כי קיימות רמות דומות של DHT בערמוניות של גברים מבוגרים ללא שגשוג שפיר של הערמונית ובגברים מבוגרים עם שגשוג שפיר של הערמונית. כמו כן, לא היה הבדל בין שתי הקבוצות ברמות של פרוגסטרון, אסטריול, אסטרון ואסטרדיול.
עבודות אפידמיולוגיות מאוחרות יותר הראו, שבו בזמן שרמות טסטוסטרון יורדות בתהליך ההזדקנות, רמות ה-DHT בערמונית נשארות יחסית קבועות ואף מעט גבוהות יותר בערמוניות עם שגשוג שפיר. בהתאם לכך, טיפול בתרופות החוסמות את פעילות האנזים 5 אלפא רדוקטז, היה בעל יכולת להוריד את נפח הערמונית ולהקל את התסמינים של דרכי שתן תחתונות, וזאת מבלי להשפיע על רמות הטסטוסטרון בדם ההיקפי. בנוסף, לא נמצא יחס ישיר בין רמות טסטוסטרון לנפח הערמונית, וטיפול משלים בטסטוסטרון בחולים עם תת-פעילות בלוטות המין של הגיל המבוגר לא הביא להגדלת נפח הערמונית. המסקנה המתבקשת היא, אם כן, שהגדלה שפירה של הערמונית עם או בלי הפרעות בדרכי שתן תחתונות, תלויה ברמות ה-DHT רק באופן חלקי. ייתכן, ועם העלייה בגיל מתרחשת עלייה בפעילות הארומטזות בערמונית, הגורמת גם לעלייה יחסית ברמות האסטרוגן, ופעילות איגבור זו מביאה להגדלה של הערמונית ולשגשוגה השפיר. אולם, כנזכר לעיל, הופעת תסמינים של דרכי שתן תחתונות בגיל המבוגר אינה תלויה רק בגודל הערמונית ואף לא בעצם הימצאותה של הבלוטה.
המחקר העוסק בחסר הורמוני מין בגבר המבוגר התמקד, באופן טבעי ומסורתי, בתפקוד אברי המין והרבייה, ולא עסק בקשר שבין הורמונים אלה לתפקוד מערכת השתן. ידוע, כי ל-DHT תפקיד חשוב בהתפתחות השופכה וצוואר כיס השתן בתקופה העוברית, ומכאן שייתכן וגם בגבר המבוגר לטסטוסטרון חשיבות בתפקוד מערכת השתן. קיימות מספר עבודות מעוררות עניין בהקשר זה, בעיקרן על חיות מעבדה. בחולדות, נמצאו קולטנים אנדרוגניים ואסטרוגניים באפיתל המעבר המצפה את דרכי השתן כמו גם בשריר הדטרוזור (Detrusor), ובשריר המשורטט של השופכה הקריבנית ובמעצבים (גנגליונים) האוטונומיים המעצבבים את הערמונית. גם העצבים האוטונומיים המוטוריים שמקורם במעצבים שבאגן, נתגלו כרגישים ביותר להורמונים האנדרוגניים והאסטרוגניים. סירוס גרם לירידה בריכוז הקולטנים האלפא אדרנרגיים בבסיס כיס השתן, ואילו הזרקת טסטוסטרון העלתה את ריכוז הקולטנים הכולינרגיים מוסקריניים. כך גם בשריר החלק שבמערכת השתן התחתונה, סירוס הביא לירידה בפעילות של הקולטנים האלפא 1 אדרנרגיים וכולינרגיים מוסקריניים, ואילו הזרקת טסטוסטרון הביאה לעלייה בריכוז של קולטנים אלה. סירוס גם גרם לירידה ביכולת ההרפיה על ידי השריה חשמלית על שריר חלק מהשופכה שבערמונית, קרוב לוודאי כביטוי לחוסר יכולתו של השריר להגיב לחומרי הרפיה. כמו כן, גרם הסירוס לשיבושים בפעילות אנזימים מיטוכונדריאליים בדרכי שתן תחתונות בארנבים.
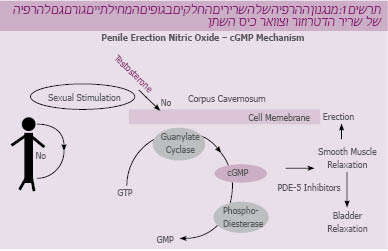
עבודות רבות חקרו את תפקידם של נוירוטרנסמיטורים לא אדרנרגיים ולא כולינרגיים בהפרעות בדרכי השתן התחתונות בגברים ובנשים מעל גיל 50. ההחשוב שבהם הוא החנקן החמצני NO (Nitric Oxide, NO), בעל השפעה מרפה על איברים במערכת המין-שתן. החנקן החמצני אחראי על תהליך הזקפה, אך גם גורם להרפיה של צוואר כיס השתן והשופכה. כ-96%-72% מהנוירונים בדופנות כיס השתן בשריר הדטרוזור, ובשופכה בבני אדם, מכילים את האנזים NO synthase. פעילותו של אנזים זה תלויה בהימצאות רמות פיזיולוגיות תקינות של טסטוסטרון. הזרקה של טסטוסטרון בעכברים עם חסר ב-NO synthase גרמה לירידה בתכיפות ההשתנה. האנזים פוספודיאסטרז Phosphodiesterase 5) PDE-5) מהווה שליח שניוני לחנקן החמצני, וממלא תפקיד חשוב בתהליך הזקפה. לאחרונה, הוכח כי PDE-5 ממלא תפקיד גם בוויסות הטונוס של השריר החלק בכיס השתן (תרשים 1). תרופות החוסמות את PDE-5 יכולות להקל תסמינים של כיס שתן רגיז ושל הפרעות בדרכי שתן תחתונות. בחיות מעבדה, גרם סירוס לירידה בביטוי של PDE-5, ותוספת של טסטוסטרון הביאה לחידוש ההביטוי של האנזים. גם בבני אדם קיים רמז לקיום מנגנון דומה, שכן ידוע כי אחוז ניכר מהחולים עם תסמינים של דרכי שתן תחתונות ושגשוג שפיר של הערמונית סובלים גם מאין אונות ומהופעה של תת-פעילות בלוטות המין. המסקנה מכך היא, שהורמונים אנדרוגניים אחראיים גם לפעילות התקינה של מערכת השתן התחתונה. מכאן, שהירידה ברמות הטסטוסטרון בגבר המבוגר יכולה למלא תפקיד בהופעת הפרעות בדרכי שתן תחתונות בקבוצת גיל זו. עבודות אפידמיולוגיות הראו, שכ-20% מהגברים מעל גיל 50 עם הפרעות בדרכי שתן תחתונות סובלים גם מתת פעילות של בלוטות המין. בעבודה על 30 חולים עם תסמינים בדרכי שתן תחתונות ותת פעילות בלוטות המין, אשר טופלו בטסטוסטרון פומי או בזריקות, נמצא שיפור בתסמינים כפי שנמדדו על ידי טבלאות של IPSS (International Prostate Symptom Score, IPSS). כמו כן, בד-בבד עם עלייה ברמות הטסטוסטרון בדם ההיקפי, חל שיפור בתסמינים של תת פעילות בלוטות המין אשר נמדדו על פי טבלאות של AMS (Aging Male Symptoms, AMS).
הפרעות בדרכי שתן תחתונות, טסטוסטרון והתסמונת המטבולית
התסמונת המטבולית היא מערכת של תסמינים המופיעים בגבר המבוגר הכוללים היפרגליקמיה או סוכרת סוג 2, הפרעה בשומני הדם, יתר לחץ דם והשמנה בטנית. ירידה ברמות הטסטוסטרון נקשרת גם היא להופעת תסמינים רבים האופייניים לתהליך הזקנה, כמו ירידה במסת השריר והכוח הגס, ירידה בתשעורת ובעובי העור, כאבי גב ואוסטאופורוזיס, גניקומסטיה, שינויים במצבי רוח, הופעת גלי חום והזעות לילה, נטייה לדיכאון וירידה בחיוניות, ירידה בתשוקה ובתפקוד המיני והופעת תכיפות ודחיפות במתן שתן. נוסף על כך, נמצא גם קשר בין רמות נמוכות של טסטוסטרון להופעת תסמינים אופייניים לתסמונת המטבולית כמו מחלות לב וכלי דם, יתר שומנים בדם, טרשת עורקים, השמנה בטנית וסוכרת סוג 2, כך שחוקרים רבים סבורים שרמות נמוכות של טסטוסטרון, הן חלק מהתסמינים המאפיינים את התסמונת המטבולית ואולי אף גורמות להופעתה.
בעבודה על עכברים זכרים שלא היו מסוגלים לייצר טסטוסטרון, וקיבלו תזונה עתירת שומן, נמצאו השמנת יתר ותהליך מוגבר של טרשת עורקים משמעותי בהשוואה לעכברים עם רמות טסטוסטרון תקינות שקיבלו את אותה תזונה. בעבודה אחרת, גברים עם הופעה מאוחרת של תת פעילות בלוטות המין היו עם השמנה בטנית משמעותית יותר מאשר גברים עם רמות טסטוסטרון תקינות באותה קבוצת גיל.
חוקרים מבריטניה הראו בעבודה כפולת-סמיות על 24 חולים עם הופעה מאוחרת של תת פעילות בלוטות המין וסוכרת סוג 2, שקיבלו טיפול בטסטוסטרון, שיפור משמעותי בשליטה על רמות הסוכר בדם, בתנגודת לאינסולין, בהיקף המותניים, ברמות הכולסטרול בדם ההיקפי וירידה משמעותית ברמות הלפטין. כמו כן, עבודות רבות הצליחו להראות קשר בין רמות טסטוסטרון ויתר לחץ דם, יתר כולסטרול בדם והפרעה בשומני הדם.
בעבודה שמטרתה הייתה לברר את הקשר בין תסמינים של דרכי שתן תחתונות והתסמונת המטבולית, נבדקו 1,899 גברים בגילאים 30 עד 79, ונמצא שבגברים עם תסמינים של דרכי שתן תחתונות בדרגה בינונית עד קשה, הכוללים חוסר התרוקנות של כיס השתן, תכיפות והטלת שתן לילית (Nocturia) היה הסיכוי הגדול ביותר למצוא את הסימנים האופייניים לתסמונת המטבולית. ההקשר היה חזק יותר בגברים מתחת לגיל 60. מסקנת החוקרים בעבודה זו היתה, שתסמינים בדרכי השתן התחתונות והתסמונת המטבולית הם סימנים משותפים להפרעה כרונית שמקורה מחוץ לדרכי השתן. החוקרים אף ציינו, שהחולים עם תסמונת מטבולית התלוננו באופן משמעותי יותר על הפרעות בתפקוד המיני.
הגורם המשותף להפרעות בדרכי השתן התחתונות, הפרעות בתפקוד המיני והתסמונת המטבולית, כפי שעולה אינטואיטיבית מעבודות אלה, הוא החסר באנדרוגנים בגבר המבוגר, עם כי עדיין יש מקום לעבודות נוספות כדי להוכיח שבסיס כל ההפרעות הללו הוא התהליך של ירידה בטסטוסטרון המופיעה בתהליך ההזדקנות.
סיכום
בחקר תהליך הזקנה בגברים הולך ומתברר שבבסיס הרבה מתהליכי התחלואה האופייניים המופיעים בגבר המבוגר, כגון הפרעות בדרכי שתן תחתונות, השמנה בטנית, התסמונת המטבולית והפרעות בתפקוד המיני, נמצא מכנה משותף וכך שהתהליכים קשורים זה בזה. הבסיס המשותף הוא רמות נמוכות של טסטוסטרון, תופעה שמתחילה בגיל 40 ונותנת את ביטוייה הקליניים בגבר המזדקן. יש צורך בעבודה נרחבת ומבוקרת אודות ההשפעה של טיפול משלים בטסטוסטרון על התסמינים הנזכרים לעיל - מניעת הופעתם וטיפול בהם לאחר הופעתם.
דגלים אדומים
ביבליוגרפיה
- Veltri R, Rodriguez R. Molecular biology, endocrinology, and physiology of the prostate and seminal vesicles. In. Campbell – Walsh Urology 9th ed
2007;2677-2726
- Roehrborn CG, McConnell JD. Benign prostatic hyperplasia: etiology, pathophysiology, epidemiology, and natural history. In: Campbell – Walsh Urology 9th ed 2007;2727-2765
- Krieg M, et al. Effect of aging on endogenous level of 5 alpha-dihydrotestosterone, testosterone, estradiol, and estrone in epithelium and stroma of normal and hyperplastic human prostate. J Clin Endocrinol Metab 1993;77:375–381
- Brendler CB, et al. Spontaneous benign prostatic hyperplasia in the beagle. Age-associated changes in serum hormone levels, and the morphology and secretory function of the canine prostate. J Clin Invest 1983;1114
- Walsh P C, et al. Tissue content of dihydrotestosterone in human prostatic hyperplasia is not supranormal. J Clin Invest 1983;1772
- Barrack ER, et al. Subcellular distribution of androgen receptors in human normal, benign hyperplastic, and malignant prostatic tissues: characterization of nuclear salt-resistant receptors. Cancer Res 1983;1107–1116
- Bartsch G. Correlation of biochemical (receptors, endogenous tissue hormones) and quantitative morphologic (stereologic) findings in normal and hyperplastic human prostates. J Urol 1987;559-564
- Bartsch G, et al. Light-microscopic stereologic analysis of spontaneous and steroid-induced canine prostatic hyperplasia. J Urol 1987;552-558
- Schatzl G, et al. Endocrine patterns in patients with benign and malignant prostatic diseases. Prostate 2000;p219-224
- Hajjar RR, et al. Outcomes of long- term Testosterone replacement in older hypogonadal males: a retrospective analysis. J clin Endocrinol Metab 1997;3793-3796
- Marks LS, et al. Effect of Testosterone replacement therapy on prostate tissue in men with late-onset hypogonadism: a randomized controlled trial. JAMA 2006;2351-2361
- Pradidarcheep W. Lower urinary tract symptoms and its potential relation with late-onset hypogonadism. The Aging Male 2008;51–55
- Kalichenko S, et al. Beneficial effects of Testosterone administration on symptoms of the lower urinary tract in men with late-onset hypogonadism: A pilot study. The Aging Male 2008;57-61
- Agledahl I, et al. Low serum Testosterone in men is inversely associated with non-fasting serum triglycerides: the Tromso study. Nutr Metab Cardiovasc Dis 2008;256–262
- Shabsigh R, et al. The triad of erectile dysfunction, hypogonadism and the metabolic syndrome. Int J Clin Pract 2008;791–798
- Kupelian V, et al. Association of lower urinary tract symptoms and the metabolic syndrome: results from the Boston Area Community Health Survey. J Urol 2009;616–624
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר משה שלו - המחלקה לאורולוגיה, מרכז רפואי מאיר, כפר סבא; יו"ר החברה לחקר וטיפול בגבר המבוגר, ההסתדרות הרפואית בישראל; בית הספר לרפואה ע"ש סאקלר, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק