הבדלים בין גרסאות בדף "מוטציות בתסמונת Hunter"
| שורה 36: | שורה 36: | ||
==מבנה הגן IDS== | ==מבנה הגן IDS== | ||
| + | בשנת 1993 קבעו Flomen וחב' ב-Genomics שהגן IDS מכיל 9 אֶקסונים (שסומנו כ-A עד I). הם אפיינו את ה-introns המקיפים את 9 האֶקסונים, ומצאו שלגן IDS אין כל קשר לארגון האֶקסון של steroid sulfatase, זאת למרות ההומולוגיה בין שני האנזימים. ממצא זה רמז לכך שחלוקת הסולפטאזות ל-2 תת-קבוצות על בסיס הספציפיות שלהם למצע האנזים, משתקף גם ברמת מבנה האנזים. Wilson וחב' פרסמו בשנת 1993 ב-Genomics את הרצף השלם של הגן IDS שגודלו בערך 24kb. הפרומוטר הפוטנציאלי עבור IDS חסר TATA box אך הוא מכיל רצפים של GC box, התואמים את תפקידו של IDS כ-housekeeping gene. בשנת 1990 פרסמו Wilson וחב' ב-Proc Natl Acad Sci USA את המיקום של הגן IDS בזרוע הארוכה של כרומוזום X בעמדה Xq28 במיקום דיסטאלי לזה של "כרומוזום X השביר", על ידי שימוש בשבט cDNA של IDS. | ||
| + | |||
| + | בשנת 1992 הדגימו Faust וחב' ב-Genomics ובשנת 1993 עשו זאת Daniele וחב' באותו כתב עת, שהגן IDS תופס בעכברים את אותה עמדה בכרומוזום X ביחס לגן F9 המקודד לפקטור הקרישה IX, לגן FMR1 המקודד לחלבון הקרוי fragile X mental retardation protein או FMRP, וכן לגן GABRA3 המקודד לחלבון Gamma-aminobutyric acid receptor subunit alpha-3. | ||
| + | |||
| + | ==פסבדו-גן== | ||
גרסה מ־09:00, 15 באפריל 2017
| מדריך בדיקות מעבדה | |
| מוטציות בתסמונת Hunter | |
|---|---|
| מעבדה | כימיה בדם |
| תחום | פגם אנזימטי הגורם לתסמונת Hunter |
| טווח ערכים תקין | > or =1.5 nmol/h/mL |
| יוצר הערך | פרופ' בן-עמי סלע |
- מטרת הבדיקה
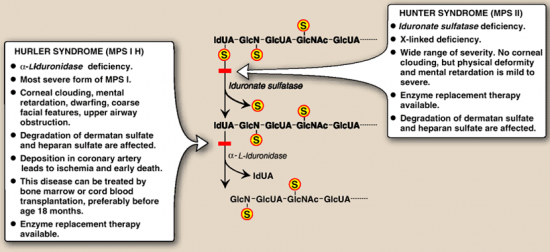
אבחון של תסמונת Hunter הידועה גם כ-mucopolysaccharidosis II או MPS II.
מידע קליני:
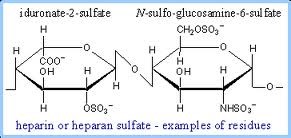
המוקופוליסכרידוזות הן משפחה של מפגעים הנגרמים בשל חסר של כל אחד מהאנזימים הכרוכים בפירוק השלבי של dermatan sulfate ,heparan sulfate, keratan sulfate ושל chondroitin sulfate הידועים כגליקוז-אמינו-גליקנים או GAGs. הצטברות של GAGs בליזוזומים פוגעת בתפקוד התקין של התאים, הרקמות, והאיברים. מחלת Hunter היא מפגע של אגירה ליזוזומלית הכרוך בכרומוזום X, הנובע מחסר האנזים iduronate sulfatase (להלן IDS), שגורם לביטוי קליני פנימי וחיצוני כאחד בתסמונת Hunter. האנזים iduronate 2-sulfatase כרוך בפירוק הליזוזומאלי של heparan sulfate ושל dermatan sulfate (Bielicki וחב' ב-Biochemistry משנת 1990).
המאפיינים הקליניים וחומרתם מגוונים ביותר החל במחלה חמורה ועד צורה מתונה שלה המתחילה להתבטא רק בגיל מתקדם יותר עם תסמינים קליניים בדרגת חומרה נמוכה עד מתונה. כללית, תסמיני מפגע זה כוללים תווי פנים גסים, קומה נמוכה, כבד וטחול מוגדלים, קול צרוד, מפרקים נוקשים, מחלת לב, ומעורבות נירולוגית בולטת הכוללת פיגור התפתחותי ונסיגה מנטאלית. כיוון שתסמונת Hunter כרוכה בכרומוזום X, היא מופיעה כמעט בלעדית בזכרים בתדירות של 1:120,000 לידות זכרים, אם כי דווח גם על נשים נשאיות עם חלק מתסמיני המחלה. חלופות טיפוליות כוללות השתלת תאי גזע המאטו-פויאטיים, ותרפיה על ידי עירוי האנזים החסר.
בירור אבחוני באלה המאובחנים עם MPS II מדגים באופן אופייני רמות מוגברות בשתן של גליקוזאמינוגליקנים (GAGs) ורמות מוגברות בעיקר של dermatan sulfate ושל heparin sulfate. רמה מופחתת או חסר מוחלט של IDS יכולים לאשר אבחון של MPS II. יחד עם זאת, בדיקה אנזימטית אינה אמינה בכל הקשור לגילוי נשאי הטרוזיגוטיים של המחלה. לעומת זאת בחינה גנטית מולקולארית של בחינת הגן IDS המקודד לאנזים הרלוונטי, מאפשר גילוי המוטציה שגרמה למחלה וכן לזיהוי נשים נשאיות בעלות קרבת-דם לזכר הנגוע. נכון להיום, עדיין לא ביססו קשר ברור בין הגנוטיפ והפנוטיפ של המחלה.
טווח הערכים הנורמאלי של האנזים IDS הוא מעל 1.5nmol/h/ml. רמות אנזים הנמוכות מערך זה בדגימות שנדגמו כראוי תואמות מצב של חסר iduronate-2-sulfatase או MPS II. אם גם יש אישוש המפגע על פי המדדים הקליניים, יש לשקול אימות נוסף באנליזה המולקולארית-גנטית של הגן IDS. יש לקח בחשבון שפעילות אנזים זה יכולה להיות מופחתת ב-MDS או multiple sulfatase deficiency. אם יש גם ראיות קליניות, יש לשקול בחינה גנטית מולקולארית של סולפטאזות אחרות או בחינה מולקולארית של הגן SUMF 1 לשלול אפשרות של MSD.
שיבוט וביטוי של הגן האנזים המקודד ל-IDS
בשנת 1981 פרסמו DiNatale ו-Ronsisvalle ב-Biochim Biopys Acta על זיהוי שתי צורות של iduronate sulfatase משליית אדם, ואילו Bielicki וחב' דווחו ב-Biochem J בשנת 1990, על ניקוי של 2 צורות עיקריות של אנזים זה עם משקלים מולקולאריים של 42,000 ו-14,000 דלטון. Wilson וחב' ב-Hum Genet משנת 1990 דווחו על בידוד וריצוף של cDNA בגודל של 2.3kb, המקודד לרצף המלא של IDS מאדם מתוך ספריה של cDNA ממקור תאי אנדותל. אנליזה של קודמן (precrsor) האנזים בעל 550 חומצות האמינו, הצביע על כך ש-IDS הוא בעל מקטע של 25 חומצות אמינו המשמש כ-signal sequence, המלווה על ידי מקטע של 8 חומצות אמינו המורחקות מהקודמן pro-protein.
ביקוע פרוטאוליטי תוך-מולקולארי מתרחש ליצירה של 2 פוליפפטידים בשלים עם משקלים מולקולאריים של 42,000 ו-14,000 דלטון שמוצאים בכבד, בריאות ובשלייה. נמצאה כמו כן הומולוגיה חזקה של IDS עם שלושת הצורות של arylsulfatase B, arylsulfatase A ו-arylsulfatase C האנושיים, וכן עם האנזים האנושי glucosamine-6-sulfatase. אנליזה של Northern blot זיהתה שלושה סוגים עיקריים של RNA בגדלים של 5.4kb, 5.7kb ו-2.1kb וכן RNA מינורי בגודל 1.4kb. על פי Malmgren וחב' ב-Genomics משנת 1995, זוהה העותק המינורי של 1.4kb והוצע שהוא יכול לקודד לאנזים דמוי-IDS.
החלבון המשוער זהה לאנזים שתואר, פרט לעובדה שהוא חסר מקטע של 207 חומצות אמינו בקצה ה-N-טרמינאלי, ובמקום המקטע החסר מופיעות 7 חומצות אמינו חלופיות.
מבנה הגן IDS
בשנת 1993 קבעו Flomen וחב' ב-Genomics שהגן IDS מכיל 9 אֶקסונים (שסומנו כ-A עד I). הם אפיינו את ה-introns המקיפים את 9 האֶקסונים, ומצאו שלגן IDS אין כל קשר לארגון האֶקסון של steroid sulfatase, זאת למרות ההומולוגיה בין שני האנזימים. ממצא זה רמז לכך שחלוקת הסולפטאזות ל-2 תת-קבוצות על בסיס הספציפיות שלהם למצע האנזים, משתקף גם ברמת מבנה האנזים. Wilson וחב' פרסמו בשנת 1993 ב-Genomics את הרצף השלם של הגן IDS שגודלו בערך 24kb. הפרומוטר הפוטנציאלי עבור IDS חסר TATA box אך הוא מכיל רצפים של GC box, התואמים את תפקידו של IDS כ-housekeeping gene. בשנת 1990 פרסמו Wilson וחב' ב-Proc Natl Acad Sci USA את המיקום של הגן IDS בזרוע הארוכה של כרומוזום X בעמדה Xq28 במיקום דיסטאלי לזה של "כרומוזום X השביר", על ידי שימוש בשבט cDNA של IDS.
בשנת 1992 הדגימו Faust וחב' ב-Genomics ובשנת 1993 עשו זאת Daniele וחב' באותו כתב עת, שהגן IDS תופס בעכברים את אותה עמדה בכרומוזום X ביחס לגן F9 המקודד לפקטור הקרישה IX, לגן FMR1 המקודד לחלבון הקרוי fragile X mental retardation protein או FMRP, וכן לגן GABRA3 המקודד לחלבון Gamma-aminobutyric acid receptor subunit alpha-3.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק