הבדלים בין גרסאות בדף "חלבון - Protein - S"
| שורה 43: | שורה 43: | ||
==מנגנון הפתו-פיזיולוגיה== | ==מנגנון הפתו-פיזיולוגיה== | ||
| − | חסר protein S יכול להיות מולד או נרכש, כאשר האחרון נובע בדרך כלל | + | חסר protein S יכול להיות מולד או נרכש, כאשר האחרון נובע בדרך כלל מ[[מחלות כבד]] או מחסר ויטמין K. חסר protein S בא בדרך כלל לביטוי קליני כ-VTE. הקשר בין חסר protein S לבין אירועי פקקת בעורקים נראית מקרית או חלשה לכל היותר, ואכן פקקת עורקית אינה מתרחשת גם באי-סדירויות נוגדות-קרישה מולדות אחרות כגון חסר ב-protein C, חסר ב-antithrombin III, או מוטציה בגן של פקטור V Leiden. |
| − | להבנת התרחשות פקקת בחסר של protein S, יש להבין את מנגנון פעולתו של חלבון זה. Protein S מהווה חלק ממערכת משולבת של חלבונים נוגדי-קרישה, כאשר בתנאים | + | להבנת התרחשות פקקת בחסר של protein S, יש להבין את מנגנון פעולתו של חלבון זה. Protein S מהווה חלק ממערכת משולבת של חלבונים נוגדי-קרישה, כאשר בתנאים נורמליים חלבונים אלה נמצאים ברמה תקינה, והדם נשמר על כן בפאזה נוזלית ללא יצירת קרישי דם. בתרחיש בו גורמי תומכי-קרישה משופעלים כדי לייצר קריש דם פיזיולוגי (למניעת דימום) או פתולוגי (בקרישיות-יתר), מהווה חלבון S חלק ממנגנון הנועד לפקח ולווסת תהליכי קרישה אלה. תהליך פיקוח וויסות זה מתרחש דרך מערכת חלבונים הפועלים בקואורדינציה, הידועה כ-protein C system, כמתואר בתרשים באופן סכמטי: |
| שורה 53: | שורה 53: | ||
לצורך פעילות נוגדת קרישה תקינה, APC ו-protein S דורשים פוספוליפידים טעונים שלילית ויוני +Ca2 לפעילות נוגדת קרישה תקינה. מחקרים על המבנה והתפקוד של protein S הדגימו שאתרי האינטראקציה עם APC ממוקמים ששייר ה-Gla וכן במקטע הראשון דמוי EGF של protein S. לעומת זאת, אתר הקישור עם C4bBP באזור דמוי-SHBG החיוני אף הוא לפעילות נוגדת קרישה. בפלזמה קיימים מספר איזופורמים של C4b-BP, אך רק C4b-BPβ קושר protein S. | לצורך פעילות נוגדת קרישה תקינה, APC ו-protein S דורשים פוספוליפידים טעונים שלילית ויוני +Ca2 לפעילות נוגדת קרישה תקינה. מחקרים על המבנה והתפקוד של protein S הדגימו שאתרי האינטראקציה עם APC ממוקמים ששייר ה-Gla וכן במקטע הראשון דמוי EGF של protein S. לעומת זאת, אתר הקישור עם C4bBP באזור דמוי-SHBG החיוני אף הוא לפעילות נוגדת קרישה. בפלזמה קיימים מספר איזופורמים של C4b-BP, אך רק C4b-BPβ קושר protein S. | ||
| − | מחקר של Heeb וחב' ב-Proc Natl Acad Sci USA משנת 1994, מצא של-protein S יש פעילות נוגדת קרישה התלויה ב-APC, המוגדרת כ-PS-direct, המעכבת תרומבין הנוצר על ידי הקומפלקס factor Xa/factor Va prothrombinase, תהליך המתאפשר על ידי נוכחות יוני +Zn2 ב-protein S. החוקרים מצאו שרמת Zn2+ קשורה עם PS-direct במבדקים לקביעת | + | מחקר של Heeb וחב' ב-Proc Natl Acad Sci USA משנת 1994, מצא של-protein S יש פעילות נוגדת קרישה התלויה ב-APC, המוגדרת כ-PS-direct, המעכבת תרומבין הנוצר על ידי הקומפלקס factor Xa/factor Va prothrombinase, תהליך המתאפשר על ידי נוכחות יוני +Zn2 ב-protein S. החוקרים מצאו שרמת Zn2+ קשורה עם PS-direct במבדקים לקביעת פעילות prothrombinase והקרישה, אך יחד עם זאת מצאו שפעילות הקו-פקטור של פרוטאין S לגבי APC אינה תלויה בריכוז Zn2+. בנוסף, protein S שהכיל Zn2+, קשר פקטור Xa באופן יעיל יותר מאשר protein S ללא אבץ (Heeb וחב' ב- FASEB Jמשנת (2009. |
מחקרים מולקולאריים להבנת הסיבות הגנטיות לחסר חלבון S, מסתבכים כתוצאה מנוכחות הפסבדו-גן, PROS-b. השמטים (deletions) של מקטעים נרחבים בגן הפעיל PROS-a, גורמים לחסר חלבון S ולתרומבופיליה. המקטע חסר ראשון אותר בחלק המרכזי של הגן PROS-a, ועוד מקטע חסר בגודל של 5.3kb, הוא של האקסון המקודד XIII, מה שגורם ליצירת חלבון S קטום (truncated) על פי Beauchamp וחב' ב-Brit J Haematol משנת 2004, ו- García de Frutos וחב' ב-Thromb Hemost משנת 2007). | מחקרים מולקולאריים להבנת הסיבות הגנטיות לחסר חלבון S, מסתבכים כתוצאה מנוכחות הפסבדו-גן, PROS-b. השמטים (deletions) של מקטעים נרחבים בגן הפעיל PROS-a, גורמים לחסר חלבון S ולתרומבופיליה. המקטע חסר ראשון אותר בחלק המרכזי של הגן PROS-a, ועוד מקטע חסר בגודל של 5.3kb, הוא של האקסון המקודד XIII, מה שגורם ליצירת חלבון S קטום (truncated) על פי Beauchamp וחב' ב-Brit J Haematol משנת 2004, ו- García de Frutos וחב' ב-Thromb Hemost משנת 2007). | ||
| שורה 59: | שורה 59: | ||
בני משפחה עם השמט של אחד מ-2 המקטעים האמורים בגן הפעיל PROS-a, יסבלו מחסר בחלבון S ומתרומבופיליה. יחד עם זאת, מחקרים אחדים מצביעים על כך שהפגמים השכיחים ביותר בגן המקודד לחלבון S הם דווקא מוטציות נקודתיות (point mutations) ולא השמטים נרחבים בגן (gene deletions). | בני משפחה עם השמט של אחד מ-2 המקטעים האמורים בגן הפעיל PROS-a, יסבלו מחסר בחלבון S ומתרומבופיליה. יחד עם זאת, מחקרים אחדים מצביעים על כך שהפגמים השכיחים ביותר בגן המקודד לחלבון S הם דווקא מוטציות נקודתיות (point mutations) ולא השמטים נרחבים בגן (gene deletions). | ||
| − | רמות protein S פוחתות בהיריון, ויכולות אף לרדת לתחום נמוך ביותר, אך רמות נמוכות אלו לא גורמות לפקקת כשלעצמן. עוד סיבה המועלית לעתים נדירות לחסר ב-protein S, היא אנמיה חרמשית (Piccin וחב' ב-Ann Hematol משנת 2012), אך גם בתרחיש זה, רמות נמוכות של protein S אינן גורמות למצב של קרישיות-יתר. חסר של protein S מולד, קשור לתרחיש התרומבופיליה המולדת השכיח ביותר ביפן (Adachi ב-Curr Drug Targets משנת 2005). | + | רמות protein S פוחתות בהיריון, ויכולות אף לרדת לתחום נמוך ביותר, אך רמות נמוכות אלו לא גורמות לפקקת כשלעצמן. עוד סיבה המועלית לעתים נדירות לחסר ב-protein S, היא [[אנמיה חרמשית]] (Piccin וחב' ב-Ann Hematol משנת 2012), אך גם בתרחיש זה, רמות נמוכות של protein S אינן גורמות למצב של קרישיות-יתר. חסר של protein S מולד, קשור לתרחיש התרומבופיליה המולדת השכיח ביותר ביפן (Adachi ב-Curr Drug Targets משנת 2005). |
גיל משפיע על סך רמת protein S אך לא על רמות החלבון החופשי. בדרך כלל רמות סך החלבון עולות באנשים מעל גיל 50 שנה, כאשר עלייה זו כרוכה עם העליות ברמת החלבון קושר המשלים Cb4BP. אך כיוון שרמות protein S החופשי אינן משתנות עם הגיל, ניתן להסביר את הממצא לפיו משפחות עם אותו פגם גנטי ב-protein S, יכולות להיות הן type I או type III של החסר. כאמור, type I משקף הפחתה הן בסך protein S כמו גם בחלבון החופשי. לעומת זאת, ב-type III יש ירידה מבודדת ברמת החלבון החופשי. חסר של type III protein S נובע בחלקו ממוטציות במקטע של protein S הנקשר ל-C4bBP-β. | גיל משפיע על סך רמת protein S אך לא על רמות החלבון החופשי. בדרך כלל רמות סך החלבון עולות באנשים מעל גיל 50 שנה, כאשר עלייה זו כרוכה עם העליות ברמת החלבון קושר המשלים Cb4BP. אך כיוון שרמות protein S החופשי אינן משתנות עם הגיל, ניתן להסביר את הממצא לפיו משפחות עם אותו פגם גנטי ב-protein S, יכולות להיות הן type I או type III של החסר. כאמור, type I משקף הפחתה הן בסך protein S כמו גם בחלבון החופשי. לעומת זאת, ב-type III יש ירידה מבודדת ברמת החלבון החופשי. חסר של type III protein S נובע בחלקו ממוטציות במקטע של protein S הנקשר ל-C4bBP-β. | ||
גרסה מ־14:27, 3 במאי 2017
| מדריך בדיקות מעבדה | |
| חלבון S | |
|---|---|
| Protein S | |
| שמות אחרים | S-protein |
| מעבדה | קרישה |
| תחום | בירור בעיות של קרישיות יתר |
| טווח ערכים תקין | סך (toal) רמת protein S: בגברים-70-160% (משקף אחוז של רמה תקינה בעיכוב קרישה), בנשים-(בגיל פחות מ-50 שנה)- 65-155% של עיכוב הקרישה ובנשים מעל גיל 50 שנה-70-155% של עיכוב הקרישה. יש המבטאים רמה תקינה של סך protein S כ-0.67-1.25 יחידות למ"ל, או גם כ-21-42 מיקרוגרם למ"ל. רמתprotein S חופשי (free): בגברים-65-160%, בנשים-(בגיל פחות מ-50 שנה)- 50-140%, ובנשים מעל גיל 50 שנה-65-160%. יש המבטאים רמה תקינה של protein S חופשי כ-0.23-0.49 יחידות למ"ל, או גם כ-7.2-16.4 מיקרוגרם למ"ל. יש המבטאים את הרמה הנורמאלית בגברים מעל 73 U/dL, ובנשים מעל 63 U/dL.
בילודים בריאים לאחר הריון תקין, או בפגים בריאים רמת סך protein S יכולה להיות נמוכה (15-50%), אך כיוון שיש להם רמות נמוכות של C4bBP, רמת protein S חופשי יכולה להיות תקינה או כמעט תקינה כמו במבוגרים (רמה שווה או גבוהה מ-50%). רמת סך protein S מגיעה במלואה לרמתה במבוגרים בין 90-180 יום לאחר הלידה. תקופת מחצית החיים של protein S היא כ-42 שעות (Lijfering וחב' ב-Blood משנת 2009). |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
בדיקת דרג שני לאבחון של חסר מולד או נרכש של protein S, לדוגמה כבדיקה נלווית לבדיקה מקדימה המבוססת על התוצאות של המבדק של רמת האנטיגן protein S החופשי כמו גם של סך החלבון (החופשי והקשור). הבדיקה נועדה גם להערכה של מטופלים עם רקע של תסחיף פקקתי ורידי (VTE), או באלה עם סיפור משפחתי של יצירת קרישי דם. הבדיקה נועדה גם לקרובי משפחה מדרגה ראשונה של מטופלים עם חסר ידוע של protein S. לעתים בדיקה זו נדרשת לבחינת הסיבות להפלות חוזרות.
קיום דרישה למדידת protein S
בדיקה זו עשויה לסייע בהבנת תרחישים כ-VTE או DVT, בעיקר אם אלה מופיעים באנשים יחסית צעירים (מתחת לגיל 50 שנה) או כאשר אלה מופיעים באתרים בלתי מקובלים כגון ורידים המוליכים לכבד או לכליות, וכן בכלי דם מוחיים. מדידת protein S יכולה להיות מוזמנת כאשר ביילודים או בתינוקות בימי חייהם הראשונים מופיע חשד למפגע קרישתי חמור, כגון DIC או purpura fulminans. אם מזוהה חסר נרכש של החלבון, מתבקשת בדיקה תקופתית שלו כדי לנטר את רמתו אם התרחיש מחמיר או מתפוגג.
Protein S
Protein S הוא חלבון נוגד קרישה בעל משקל מולקולארי של כ-70,000 דלטון התלוי בפעילותו בוויטמין K, שהתגלה בשנת 1979 בסיאטל-וושינגטון, ועל כן כונה במקור על שם עיר זו. תפקידו העיקרי של חלבון S הוא כקו-פקטור לא-אנזימטי לסייע לפעילות של נוגד-קרישה אחר, protein C משופעל (activated protein C, להלן APC) על מצעיו, פקטור קרישה V משופעל (להלן FVa) ופקטור קרישה VIII משופעל (להלן FVIIIa). באנשים בריאים בערך 30-40% מסך חלבון S נמצא כפרקציה חופשית. רק חלבון S חופשי יכול לפעול כקו-פקטור במערכת protein C. חסר בחלבון S, הוא אחד הגורמים לקרישת יתר ויצירת פקקת.
Protein S הוא גליקופרוטאין מונומרי המסונתז בכבד בתאי האנדותל ובמֶגָה-קריוציטים, ומופיע גם בטסיות-דם. בצירקולציה מופיע protein S ב-2 תצורות: כחלבון חופשי, או כחלבון הקשור באופן לא קו-ולנטי אך בזיקה גבוהה למרכיב C4b-BP של המשלים. מולקולת C4BP מורכבת מ-7 שרשראות α הנקשרות ל-C4b, ומשרשרת β אחת. שרשרת β של מולקולות C4bBP מכילה את אתרי הקישור לחלבון S. התפקיד של חלבון S בוויסות פעילות המשלים על ידי C4BP אינו ברור במלואו.
תפקוד חלבון S
חלבון S יכול להיקשר לפוספוליפידים טעונים שלילית דרך השייר שעבר קרבוקסילציה-Gla. תכונה זו של חלבון S, מאפשרת להם להרחיק תאים העוברים אפופטוזיס, בהם חלים שינויים ממברנאליים כמו עלייה בריכוז של פוספוליפידים על פני ממברנת תאים אלה, ובעיקר עליה ברמת פוספטידיל סרין. בתאים בריאים, מערכת אנזימטית התלויה ב-ATP, מרחיקה את הפוספוליפידים משטח פני התאים, תאים בעלי אופי פגוציטי כמו מקרופאגים מזהים את עודף הפוספוליפדים על פני תאים שעברו אפופטוזיס ובולעים אותם. לחלבון S יש תפקיד בתהליך זה בהיקשרו לפוספוליפידים ובשמשו מעין גשר המקשר בין התאים הפגומים לבין מקרופאגים.
חלבון S נקשר גם לקומפלקס המשלים C5,6,7 הנוצר בתהליך זה, ומונע מקומפלקס זה חדירה אל תוך ממברנת התאים, ובכך נמנע השפעול הלא-רצוי של מערכת המשלים, מה שעלול היה לגרום דלקת סיסטמית בלתי נשלטת (Padock וחב' ב-J Immunol משנת 1977).
בעת תרחיש של קרישת דם, תלכידים רב-מולקולאריים נוצרים על פני ממברנות של טסיות דם משופעלות, ותלכידים אלה הם בעלי פעילות של prothrombinase בגין פעילותם בשפעול של פקטור X ושל פרותרומבין. שני גורמים מרכזיים בפעילות זו הם הצורות המשופעלות של פקטור VIII ושל פקטור V. אותו אנזים החיוני לתהליך קריש הדם, תרומבין, עובר לפעילות נוגדת-קרישה על פני האנדותליום, והוא שמשפעל את חלבון C, לצורתו הפעילה אנזימטית-APC. אלא ש-APC זקוק לחלבון S כקו-פקטור לצורך פעילותו האנזימטית על 2 מצעיו, FVa ו-FVIIIa. תהליך זה נועד לדכא את שני פקטורי הקרישה הללו, אלא שחלבון S ו-APC מספיקים לגרום לאינאקטיבציה של FVa, ולצורך האינאקטיבציה של FVIIIa, נזקקים APC וחלבון S לעזרה של גורם קרישה בלתי-משופעל, פקטור V.
הגורם המשופעל FVa עובר אינאקטיבציה בכך שהוא מבוקע על ידי APC, והפועל היוצא החשוב של הפעילות הדואלית של פקטור V בסיוע לקרישה ובמניעתה, הוא בכך שבאלה עם מוטציית Leiden בפקטור V שעמיד לביקוע על ידי APC, פקטור V הפגום אינו יכול להפגין את פעילותו כנוגד קרישה. בנוסף לתפקידו כקו-פקטור במערכת protein C, חלבון S פועל באופן בלתי תלוי ב-protein C לעכב ישירות את הקומפלקס המשפעל את גורם הקרישה X, וכן לעכב את הקומפלקס המשפעל את פרותרומבין.
יתרה מכך, חלבון S מגיב עם מערכת המשלים, ועשוי לשחק תפקיד בפגוציטוזה של תאים שמתו בתהליך אפופטוזיס. נמצא שחלבון S נקשר לפוספטידיל-סרין על פני תאים אפופטוטיים, ובכך מעודד את תהליך הפגוציטוזה שלהם כבר בשלבי אפופטוזיס מוקדמים. המשמעות הפיזיולוגית של פעילויות משניות אלו של חלבון S אינה ברורה.
חלבון S הוא גליקופרוטאין התלוי בפעילותו בוויטמין K, וכמו חלבונים אחרים התלויים בוויטמין K. הוא מסונתז כזימוגן או או קדם-חלבון, המכיל מקטע פרו-פפטידי ייחודי, המשמש כיעד לאנזים תלוי-ויטמין, הידוע כγ-carboxylase, אנזים הממיר שייר של חומצה גלוטמית הממוקם ליד אותו פרו-פפטיד והופך אותה לשייר של חומצה קרבוקסי-גלוטמית (Gla). שיירי Gla אחראיים לקישור התלוי-בסידן למשטחי ממברנות. מחקרים סטרוקטוראליים מצביעים על כל שחלבון S מכיל 10-12 שיירי Gla, כמו גם אזור של לולאה הרגישה לתרומבין (ידועה כ- TSR או thrombin-sensitive region), ובנוסף 4 יחידות פפטידיות קטנות עם דמיון ליחידות דומות על פני גורם גדילה אפידרמלי (EGF), וכן אזור קרבוקסי-טרמינאלי שהוא הומולוגי לאזור זה ב-SHBG או sex hormone-binding globulin.
הגנים המקודדים ל-protein S
באדם, protein S מקודד על ידי הגן PROS1 (על פי Lundwall וחב' ב-Proc Nat. Acad Sci USA משנת 1986, ו-Long וחב' ב- Somat Cell Mol Genetמשנת 1988). החלבון protein S מראה הומולוגיות חלקית לחלבון נוגד-קרישה נוסף התלוי בוויטמין K כגון protein C, ולפקטורי קרישה VII, IX ו-X. בדומה לאחרונים, ל-protein S יש מקטע Gla ומספר מקטעים דמויי-EGF (ארבעה בהשוואה לשניים), אך הוא חסר מקטע של serine protease. לעומת זאת יש ב-protein S מקטע C-טרמינאלי גדול, המראה הומולוגיות לחלבונים קושרי הורמונים סטרואידים כגון sex hormone-binding globulin או SHBG, וכן corticosteroid-binding globulin. בנוסף, ל-protein S יש פפטיד ממוקם בין מקטע Gla לבין המקטע דמוי-EGF המבוקע על ידי תרומבין. מקטע Gla והמקטע דמוי EGF נותרים מחוברים לאחר הביקוע על ידי תרומבין, על ידי קשר דיסולפידי ביניהם. יחד עם זאת, protein S מאבד את תפקודו כקו-פקטור של APC לאחר הביקוע המתואר (Dahlbäck וחב' ב-Proc Natl Acad Sci USA משנת 1986).
זוהו 2 גנים המקודדים לחלבון S באדם, ושניהם קשורים ליד הצנטרומר של כרומוזום 3 באתר 3p11.1-3q11.2 (על פי Watkins וחב' ב-Blood משנת 1988. אחד מ-2 הגנים הוא פעיל וידוע כ-PROS-α או PROS1, ואילו הגן השני, PROS-b, עבר באופן אבולוציוני דופליקציה והוא אינו פעיל, ומוגדר כפסבדו-גן כיוון שהוא מכיל טעויות קידוד מרובות (stop codons ו-frameshifts) על פי Schmidel וחב' ב-Biochemistry משנת 1990. אורכו של הגן הפעיל PROS1-α , הוא למעלה מ-80kb, והוא מכיל 15 exons ו-14 introns. לפסבדוגן PROS-b יש הומולוגיה של 97% עם הגן PROS-a (על פי Long וחב' משנת 1988 ב-(Somat. Cell Mol. Genet.
מנגנון הפתו-פיזיולוגיה
חסר protein S יכול להיות מולד או נרכש, כאשר האחרון נובע בדרך כלל ממחלות כבד או מחסר ויטמין K. חסר protein S בא בדרך כלל לביטוי קליני כ-VTE. הקשר בין חסר protein S לבין אירועי פקקת בעורקים נראית מקרית או חלשה לכל היותר, ואכן פקקת עורקית אינה מתרחשת גם באי-סדירויות נוגדות-קרישה מולדות אחרות כגון חסר ב-protein C, חסר ב-antithrombin III, או מוטציה בגן של פקטור V Leiden.
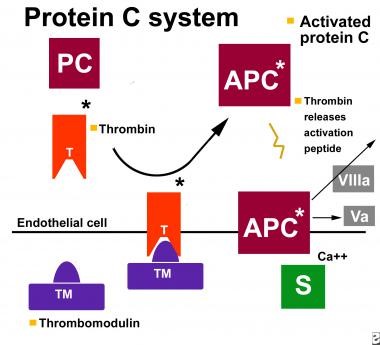
להבנת התרחשות פקקת בחסר של protein S, יש להבין את מנגנון פעולתו של חלבון זה. Protein S מהווה חלק ממערכת משולבת של חלבונים נוגדי-קרישה, כאשר בתנאים נורמליים חלבונים אלה נמצאים ברמה תקינה, והדם נשמר על כן בפאזה נוזלית ללא יצירת קרישי דם. בתרחיש בו גורמי תומכי-קרישה משופעלים כדי לייצר קריש דם פיזיולוגי (למניעת דימום) או פתולוגי (בקרישיות-יתר), מהווה חלבון S חלק ממנגנון הנועד לפקח ולווסת תהליכי קרישה אלה. תהליך פיקוח וויסות זה מתרחש דרך מערכת חלבונים הפועלים בקואורדינציה, הידועה כ-protein C system, כמתואר בתרשים באופן סכמטי:
לצורך פעילות נוגדת קרישה תקינה, APC ו-protein S דורשים פוספוליפידים טעונים שלילית ויוני +Ca2 לפעילות נוגדת קרישה תקינה. מחקרים על המבנה והתפקוד של protein S הדגימו שאתרי האינטראקציה עם APC ממוקמים ששייר ה-Gla וכן במקטע הראשון דמוי EGF של protein S. לעומת זאת, אתר הקישור עם C4bBP באזור דמוי-SHBG החיוני אף הוא לפעילות נוגדת קרישה. בפלזמה קיימים מספר איזופורמים של C4b-BP, אך רק C4b-BPβ קושר protein S.
מחקר של Heeb וחב' ב-Proc Natl Acad Sci USA משנת 1994, מצא של-protein S יש פעילות נוגדת קרישה התלויה ב-APC, המוגדרת כ-PS-direct, המעכבת תרומבין הנוצר על ידי הקומפלקס factor Xa/factor Va prothrombinase, תהליך המתאפשר על ידי נוכחות יוני +Zn2 ב-protein S. החוקרים מצאו שרמת Zn2+ קשורה עם PS-direct במבדקים לקביעת פעילות prothrombinase והקרישה, אך יחד עם זאת מצאו שפעילות הקו-פקטור של פרוטאין S לגבי APC אינה תלויה בריכוז Zn2+. בנוסף, protein S שהכיל Zn2+, קשר פקטור Xa באופן יעיל יותר מאשר protein S ללא אבץ (Heeb וחב' ב- FASEB Jמשנת (2009.
מחקרים מולקולאריים להבנת הסיבות הגנטיות לחסר חלבון S, מסתבכים כתוצאה מנוכחות הפסבדו-גן, PROS-b. השמטים (deletions) של מקטעים נרחבים בגן הפעיל PROS-a, גורמים לחסר חלבון S ולתרומבופיליה. המקטע חסר ראשון אותר בחלק המרכזי של הגן PROS-a, ועוד מקטע חסר בגודל של 5.3kb, הוא של האקסון המקודד XIII, מה שגורם ליצירת חלבון S קטום (truncated) על פי Beauchamp וחב' ב-Brit J Haematol משנת 2004, ו- García de Frutos וחב' ב-Thromb Hemost משנת 2007).
בני משפחה עם השמט של אחד מ-2 המקטעים האמורים בגן הפעיל PROS-a, יסבלו מחסר בחלבון S ומתרומבופיליה. יחד עם זאת, מחקרים אחדים מצביעים על כך שהפגמים השכיחים ביותר בגן המקודד לחלבון S הם דווקא מוטציות נקודתיות (point mutations) ולא השמטים נרחבים בגן (gene deletions).
רמות protein S פוחתות בהיריון, ויכולות אף לרדת לתחום נמוך ביותר, אך רמות נמוכות אלו לא גורמות לפקקת כשלעצמן. עוד סיבה המועלית לעתים נדירות לחסר ב-protein S, היא אנמיה חרמשית (Piccin וחב' ב-Ann Hematol משנת 2012), אך גם בתרחיש זה, רמות נמוכות של protein S אינן גורמות למצב של קרישיות-יתר. חסר של protein S מולד, קשור לתרחיש התרומבופיליה המולדת השכיח ביותר ביפן (Adachi ב-Curr Drug Targets משנת 2005).
גיל משפיע על סך רמת protein S אך לא על רמות החלבון החופשי. בדרך כלל רמות סך החלבון עולות באנשים מעל גיל 50 שנה, כאשר עלייה זו כרוכה עם העליות ברמת החלבון קושר המשלים Cb4BP. אך כיוון שרמות protein S החופשי אינן משתנות עם הגיל, ניתן להסביר את הממצא לפיו משפחות עם אותו פגם גנטי ב-protein S, יכולות להיות הן type I או type III של החסר. כאמור, type I משקף הפחתה הן בסך protein S כמו גם בחלבון החופשי. לעומת זאת, ב-type III יש ירידה מבודדת ברמת החלבון החופשי. חסר של type III protein S נובע בחלקו ממוטציות במקטע של protein S הנקשר ל-C4bBP-β.
שלושת הסוגים של חסר protein S בהתבסס על תוצאות בדיקות המעבדה
| Deficiency Type | Functional Protein S | Free Protein S Antigen | Total Protein S Antigen |
|---|---|---|---|
| 1 | Decreased | Decreased | Decreased |
| 2 | Decreased | Normal | Normal |
| 3 | Decreased | Decreased | Normal |
חסר של type 2 נדיר ביותר, ואכן 2 הסוגים השכיחים הם type 1 ו-type 3. אין כל משמעות קלינית להבדיל בין 2 הסוגים השכיחים, שכן בשניהם קיים חסר ברמת protein S חופשי-פונקציונאלי. חסר של protein S type 3 נובע בחלקו כתוצאה ממוטציות באזור של protein S הנקשר ל-C4b-BP.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק