הבדלים בין גרסאות בדף "סרמיד - Ceramide"
| שורה 1: | שורה 1: | ||
{{בדיקת מעבדה | {{בדיקת מעבדה | ||
| − | |שם עברי= | + | |שם עברי=סרמיד |
| − | |שם לועזי= | + | |שם לועזי=Ceramide |
| − | |קיצור= | + | |קיצור=N-palmitoyl-sphingosine, N-stearoyl-sphingosine |
| − | |תמונה= | + | |תמונה=[[קובץ:Ceramide1.png|250 פיקסלים]] |
|כיתוב תמונה= | |כיתוב תמונה= | ||
| − | |מעבדה= | + | |מעבדה=[[כימיה בדם]] |
| − | |תחום= | + | |תחום=גורם סיכון ל[[תחלואה קרדיו-וסקולארית]] |
|יחידות מדידה= | |יחידות מדידה= | ||
| − | |טווח ערכים תקין= | + | |טווח ערכים תקין=(בערכים של מיקרומול/ליטר): סך הריכוז של סרמיד בפלזמה הוא ±5153; ריכוזי הסרמידים עם סוגי חומצות השומן השונות הם: C16:0 - 0.21±6.4 ; C18:0 - 0.17±2.93 ; C22:0 - 18.4±0.8; C24:0 - 77.9±3.0; C24:1 – 38.9±1.2 ; C24:2 – 8.12±0.35. |
|יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]] | |יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]] | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | ==מטרת הבדיקה== | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | מטרת הבדיקה | ||
הערכה של הסיכון לאירועים קרדיו-וסקולאריים משמעותיים בטווח הזמן של 1-5 השנים הבאות. | הערכה של הסיכון לאירועים קרדיו-וסקולאריים משמעותיים בטווח הזמן של 1-5 השנים הבאות. | ||
| + | ==בסיס פיזיולוגי== | ||
| + | סרמידים הם משפחת מולקולות שומניות דמויות-שעווה. סרמיד מורכב ממולקולת sphingosine ומחומצת שומן. ניתן למצוא סרמידים בריכוז גבוה בשכבה הליפידית של ממברנות תאים, שם הם מהווים את המרכיב הליפידי של sphingomyelin אחד הליפידים המרכזיים ב-lipid bilayer. בניגוד להשערות קודמות שסרמידים וספינגוליפידים אחרים הנמצאים בממברנת התא מהווים בסך הכול אלמנטים התומכים במבנה הממברנה, כיום מייחסים לסרמידים מגוון של איתותים תאיים כגון וויסות של התמיינות תאים, התרבותם של תאים ואף מותם המתוכנת של תאים (אפופטוזיס). הביטוי ceramide מקורו במילה cera (או שעווה בלטינית) ו-amide. | ||
| − | + | ==הסינתזה של סרמיד== | |
| + | ישנם שלושה מסלולים ליצירת סרמיד. המסלול הראשון בו האנזים sphingomyelinase מבקע את מולקולת ספינגומיאלין בממברנת התא ומשחרר את הסרמיד. מסלול שני של ביוסינתזה de novo, יוצר סרמיד ממרכיביו, ספינגוזין וחומצה שומנית. מסלול שלישי המכונה salvage pathway, פועל על ידי שבירה של ספינגוליפידים מורכבים לשחרור מוגבר של מולקולות ספינגוזין המנוצלות בהמשך על ידי התקשרות עם חומצות שומן (reacylation) ליצירת סרמיד. | ||
| − | + | *מסלול ההידרוליזה של ספינגומיאלין מקוטלז כאמור על ידי sphingomyelinase. כיוון שספינגומיאלין הוא אחד מארבעת הפוספוליפידים השכיחים בממברנת התא, משמעות שיטה זו של ייצור סרמיד היא שהממברנה התאית היא המטרה של איתותים חוץ-תאיים המובילים למות התא בתהליך אפּוֹפּטוֹטי. מחקר מסוים קבע שכאשר קרינה מייננת גורמת למותם של סוגי תאים אחדים, קרינה זו מובילה לשפעול האנזים sphingomyelinase הפועל בממברנת התאים ומביא בסופו של דבר ליצירה של סרמיד (Haimovitz-Friedman וחב' ב-J Exp Res משנת 1994). | |
| − | + | *מסלול הסינתזה de novo של סרמיד מתחיל בדחיסה של חומצה פּלמיטית ו-serine ליצירה של keto-dihydrosphingosine{{כ}}-3. ריאקציה זו מקוטלזת על ידי האנזים serine palmitoyl transferase, והיא מהווה את השלב קובע-הקצב (rate limiting) של מסלול זה. בהמשך, 3-keto-dihydrosphingosine מחוזר ליצירת dihydrosphingosine, כאשר לאחר מכן מתרחש שלב האצילציה על ידי האנזים dihydroceramide synthase ליצירה של dihydroceramide. הריאקציה האחרונה ליצירת סרמיד מקוטלזת על ידי האנזים dihydroceramide desaturase. הסינתזה de novo של סרמיד מתרחשת ברטיקולום האנדופלזמי. בהמשך עובר סרמיד טרנספורט ל-Golgi apparatus על ידי הסעתו בתוך בועיות (vesicles) ציטופּלזמטיות או על ידי טרנספורט בעזרת CERT או ceramide transfer protein. כאשר הסרמיד נמצא בתוך ה-Golgi apparatus הוא יכול לעבור מטבוליזם לספינגוליפידים אחרים כמו sphingomyelin או glycosphingolipids מורכבים (Hannun ו-Obeid ב-Nature Rev Mol Cell Biol משנת 2008). | |
| − | + | *מסלול ה-salvage על ידי פירוק מוּ של ספינגוליפידים וגליקוספינגוליפידים המתרחש באברונים תאיים חומציים, כגון אנדוזומים וליזוזומים, שמטרתו הסופית לייצר ספיגוזין. במקרה של גליקוספינגוליפידים, אקסו-הידרולאזות פועלות ב-pH חומצי, גורמות לשחרור הדרגתי של יחידות חד-סוכריות מקצותיהם של שרשרות אוליגוסכרידיות, בהותירם רק את את חלק הספינגוזין של המולקולה, שיכול בהמשך לתרום ליצירת סרמיד. הסרמיד יכול בהמשך להמשיך להתפרק בריאקציה הידרוליטית בעזרת האנזים acid ceramidase ליצירת ספינגוזין וחומצת שומן חופשית, כאשר שני המרכיבים האחרונים יכולים לעזוב את הליזוזום, בניגוד לסרמיד. הספינגואידים ארוכי השרשרת המשתחררים מהליזוזום יכולים אז להשתלב מחדש במסלולים לסינתזה של סרמיד או של sphingosine-1-phosphate. מסלול ה-salvage עושה שימוש מחודש בספינגואידים ארוכי-שרשרת ליצירה של סרמיד על ידי פעולתו של האנזים ceramide synthase. לכן, חברים במשפחת ceramide synthase כנראה לוכדים ספינגוזין חופשי המשתחרר מהליזוזום ברמת שטח הפנים של הרטיקולום האנדופלזמי. יש גם לציין שמסלול ה-salvage מוערך כתורם של 50-90% מכלל הביוסינתזה של ספינגוליפידים (Kitatanu וחב' ב-Cell Signaling משנת 2008). | |
| − | |||
| − | |||
| − | |||
| − | |||
תפקידים פיזיולוגיים של סרמיד: | תפקידים פיזיולוגיים של סרמיד: | ||
בהיותו ליפיד פעיל ביולוגית, יוחסו לסרמיד תפקידים פיזיולוגיים כולל אפופטוזסיס, בלימת שגשוג תאים, הזדקנות תאים, תנועת תאים ויכולת הספיחה שלהם. כמו כן יוחסו לסרמיד ולמטבוליטים שלו, תפקידים במצבים פתולוגיים כולל סרטן, ניוון נוירולוגי, סוכרת, פּתוגניות מיקרוביאלית, השמנת-יתר ודלקת (Zeidan ו-Hannun ב-Trends Mol Med משנת 2007, ו-Wu וחב' ב-J Immunol משנת 2007). | בהיותו ליפיד פעיל ביולוגית, יוחסו לסרמיד תפקידים פיזיולוגיים כולל אפופטוזסיס, בלימת שגשוג תאים, הזדקנות תאים, תנועת תאים ויכולת הספיחה שלהם. כמו כן יוחסו לסרמיד ולמטבוליטים שלו, תפקידים במצבים פתולוגיים כולל סרטן, ניוון נוירולוגי, סוכרת, פּתוגניות מיקרוביאלית, השמנת-יתר ודלקת (Zeidan ו-Hannun ב-Trends Mol Med משנת 2007, ו-Wu וחב' ב-J Immunol משנת 2007). | ||
גרסה מ־16:48, 27 בנובמבר 2017
| מדריך בדיקות מעבדה | |
| סרמיד | |
|---|---|
| Ceramide | |
| שמות אחרים | N-palmitoyl-sphingosine, N-stearoyl-sphingosine |
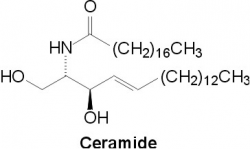
| |
| מעבדה | כימיה בדם |
| תחום | גורם סיכון לתחלואה קרדיו-וסקולארית |
| טווח ערכים תקין | (בערכים של מיקרומול/ליטר): סך הריכוז של סרמיד בפלזמה הוא ±5153; ריכוזי הסרמידים עם סוגי חומצות השומן השונות הם: C16:0 - 0.21±6.4 ; C18:0 - 0.17±2.93 ; C22:0 - 18.4±0.8; C24:0 - 77.9±3.0; C24:1 – 38.9±1.2 ; C24:2 – 8.12±0.35. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של הסיכון לאירועים קרדיו-וסקולאריים משמעותיים בטווח הזמן של 1-5 השנים הבאות.
בסיס פיזיולוגי
סרמידים הם משפחת מולקולות שומניות דמויות-שעווה. סרמיד מורכב ממולקולת sphingosine ומחומצת שומן. ניתן למצוא סרמידים בריכוז גבוה בשכבה הליפידית של ממברנות תאים, שם הם מהווים את המרכיב הליפידי של sphingomyelin אחד הליפידים המרכזיים ב-lipid bilayer. בניגוד להשערות קודמות שסרמידים וספינגוליפידים אחרים הנמצאים בממברנת התא מהווים בסך הכול אלמנטים התומכים במבנה הממברנה, כיום מייחסים לסרמידים מגוון של איתותים תאיים כגון וויסות של התמיינות תאים, התרבותם של תאים ואף מותם המתוכנת של תאים (אפופטוזיס). הביטוי ceramide מקורו במילה cera (או שעווה בלטינית) ו-amide.
הסינתזה של סרמיד
ישנם שלושה מסלולים ליצירת סרמיד. המסלול הראשון בו האנזים sphingomyelinase מבקע את מולקולת ספינגומיאלין בממברנת התא ומשחרר את הסרמיד. מסלול שני של ביוסינתזה de novo, יוצר סרמיד ממרכיביו, ספינגוזין וחומצה שומנית. מסלול שלישי המכונה salvage pathway, פועל על ידי שבירה של ספינגוליפידים מורכבים לשחרור מוגבר של מולקולות ספינגוזין המנוצלות בהמשך על ידי התקשרות עם חומצות שומן (reacylation) ליצירת סרמיד.
- מסלול ההידרוליזה של ספינגומיאלין מקוטלז כאמור על ידי sphingomyelinase. כיוון שספינגומיאלין הוא אחד מארבעת הפוספוליפידים השכיחים בממברנת התא, משמעות שיטה זו של ייצור סרמיד היא שהממברנה התאית היא המטרה של איתותים חוץ-תאיים המובילים למות התא בתהליך אפּוֹפּטוֹטי. מחקר מסוים קבע שכאשר קרינה מייננת גורמת למותם של סוגי תאים אחדים, קרינה זו מובילה לשפעול האנזים sphingomyelinase הפועל בממברנת התאים ומביא בסופו של דבר ליצירה של סרמיד (Haimovitz-Friedman וחב' ב-J Exp Res משנת 1994).
- מסלול הסינתזה de novo של סרמיד מתחיל בדחיסה של חומצה פּלמיטית ו-serine ליצירה של keto-dihydrosphingosine-3. ריאקציה זו מקוטלזת על ידי האנזים serine palmitoyl transferase, והיא מהווה את השלב קובע-הקצב (rate limiting) של מסלול זה. בהמשך, 3-keto-dihydrosphingosine מחוזר ליצירת dihydrosphingosine, כאשר לאחר מכן מתרחש שלב האצילציה על ידי האנזים dihydroceramide synthase ליצירה של dihydroceramide. הריאקציה האחרונה ליצירת סרמיד מקוטלזת על ידי האנזים dihydroceramide desaturase. הסינתזה de novo של סרמיד מתרחשת ברטיקולום האנדופלזמי. בהמשך עובר סרמיד טרנספורט ל-Golgi apparatus על ידי הסעתו בתוך בועיות (vesicles) ציטופּלזמטיות או על ידי טרנספורט בעזרת CERT או ceramide transfer protein. כאשר הסרמיד נמצא בתוך ה-Golgi apparatus הוא יכול לעבור מטבוליזם לספינגוליפידים אחרים כמו sphingomyelin או glycosphingolipids מורכבים (Hannun ו-Obeid ב-Nature Rev Mol Cell Biol משנת 2008).
- מסלול ה-salvage על ידי פירוק מוּ של ספינגוליפידים וגליקוספינגוליפידים המתרחש באברונים תאיים חומציים, כגון אנדוזומים וליזוזומים, שמטרתו הסופית לייצר ספיגוזין. במקרה של גליקוספינגוליפידים, אקסו-הידרולאזות פועלות ב-pH חומצי, גורמות לשחרור הדרגתי של יחידות חד-סוכריות מקצותיהם של שרשרות אוליגוסכרידיות, בהותירם רק את את חלק הספינגוזין של המולקולה, שיכול בהמשך לתרום ליצירת סרמיד. הסרמיד יכול בהמשך להמשיך להתפרק בריאקציה הידרוליטית בעזרת האנזים acid ceramidase ליצירת ספינגוזין וחומצת שומן חופשית, כאשר שני המרכיבים האחרונים יכולים לעזוב את הליזוזום, בניגוד לסרמיד. הספינגואידים ארוכי השרשרת המשתחררים מהליזוזום יכולים אז להשתלב מחדש במסלולים לסינתזה של סרמיד או של sphingosine-1-phosphate. מסלול ה-salvage עושה שימוש מחודש בספינגואידים ארוכי-שרשרת ליצירה של סרמיד על ידי פעולתו של האנזים ceramide synthase. לכן, חברים במשפחת ceramide synthase כנראה לוכדים ספינגוזין חופשי המשתחרר מהליזוזום ברמת שטח הפנים של הרטיקולום האנדופלזמי. יש גם לציין שמסלול ה-salvage מוערך כתורם של 50-90% מכלל הביוסינתזה של ספינגוליפידים (Kitatanu וחב' ב-Cell Signaling משנת 2008).
תפקידים פיזיולוגיים של סרמיד: בהיותו ליפיד פעיל ביולוגית, יוחסו לסרמיד תפקידים פיזיולוגיים כולל אפופטוזסיס, בלימת שגשוג תאים, הזדקנות תאים, תנועת תאים ויכולת הספיחה שלהם. כמו כן יוחסו לסרמיד ולמטבוליטים שלו, תפקידים במצבים פתולוגיים כולל סרטן, ניוון נוירולוגי, סוכרת, פּתוגניות מיקרוביאלית, השמנת-יתר ודלקת (Zeidan ו-Hannun ב-Trends Mol Med משנת 2007, ו-Wu וחב' ב-J Immunol משנת 2007). סרמידים משרים תנגודת לאינסולין בתאי שריר כאשר הם מסונתזים כתוצאה משפעול של TLR4 על ידי ליפידים רוויים (Holland וחב' ב-J Clin Invest משנת 2011), בעוד שלליפידים בלתי-רוויים אין השפעה דומה. TLR4 או toll-like receptor 4 הוא חלבון טרנס-ממברנאלי, השייך למשפחת ה-PRR או pattern recognition receptor. השפעול של TLR4 מוביל למסלולי איתות תוך-תאיים וליצירה של גורם השיעתוק NF-κB ושל ציטוקינים מקדמי דלקת שאחראיים לשפעול מערכת החיסון הטבעית (innate). ה-TLR4 ידוע בעיקר ביכולתו לזהות lipopolysaccharide המהווה מרכיב של חיידקים גראם-שליליים רבים כמו Neisseria, וחיידקים גראם-חיוביים מסוימים. בין הליגנדים הנקשרים ל-TLR4 ניתן למנות מספר חלבונים של נגיפים, ומגוון של חלבונים אנדוגניים כגון LDL, β-דפנסינים וחלבון heat shock. סרמידים משרים תנגודת לאינסולין ברקמות רבות על ידי עיכוב של מסלול האיתות של Akt/PKB (על פי Chavez וחב' ב-Cell משנת 2014). מסלול זה מעביר איתותים המסייעים להישרדות ושגשוג בתגובה לאיתותים חוץ-תאיים, כאשר חלבוני מפתח הכרוכים במסלול זה הם P13K או phosphatidylinositol 3-kinase ו-protein kinase B. צימות של כולסטרול-LDL על ידי סרמיד גורם להתרבצות LDL על פני הדופן העורקי, מה שמגביר תהליכי טרשת עורקית (Li וחב' ב-Biochim Biophys Acta משנת 2005). סרמידים גורמים גם להפרעות בתפקוד של האנדותל על ידי שפעול של PP2A או protein phosphatase 2A (על פי Mehra וחב' ב-Am J Pathol משנת 2014). במיטוכונדריה, סרמיד מדכא את שרשרת מעבר האלקטרונים ומשרה יצירה של מולקולות חמצן פעיל (reactive oxygen species או ROS (על פי Kogot-Levin ו-Saada ב-Biochimie משנת 2014). אפופטוזיס: אחד מהתפקידים הנחקרים ביותר של סרמיד היא דרך פעולתו כמולקולה מקדמת אפופטוזיס, או מה שמוגדר כ-Type I programmed cell death, פעולה החיונית לשמירה על הֶמוסטאזיס תאי תקין, וחשובה כתגובה פיזיולוגית לצורות רבות של עקה תאית. הצטברות של סרמיד תועדה כאשר מטפלים בתאים עם מספר גורמים לאפופטוזיס הכוללים קרינה מייננת (Dbaibo וחב' ב-J Clin Invest משנת 1998), חשיפה ל-UV (Rotolo וחב' ב-J Biol Chem משנת 2005), TNF-α (Dbaibo וחב' ב-FEBS lett משנת 2001), וכן תכשירים כימותרפיים. נתונים אלה מרמזים שיש לסרמיד תפקיד בתגובות הביולוגיות של כל הגורמים הללו. בגלל ההשפעות משרות האפופטוזיס של סרמיד בתאי סרטן, יש המכנים מולקולה זו כ-"tumor suppressor lipid". מספר מחקרים ניסו להגדיר את התפקיד הספציפי של סרמיד באירועים של מות תאים מתוכנת, ויש ראיות מסוימות שסרמיד פועל במיטוכונדריה להשריית אפופטוזיס. יחד עם זאת ראיות אלה אינן מוצקות דיין, והמנגנון דרכו סרמיד מווסת את האפופטוזיס עדיין לא ברור (Taha וחב' ב-Biochim Biophys Acta משנת 2006). עור: סרמיד הוא מרכיב עיקרי של ה-stratum corneum בשכבת האפידרמיס של עור האדם (Hill ו-Wertz ב-Lipids משנת 2009, ו-Garidel וחב' ב-Biophys Chem משנת 2010). ביחד עם כולסטרול וחומצות שומן רוויות, סרמיד יוצר מחסום עורי שאינו חדיר למים על מנת למנוע איבוד נוזלים על ידי התאדות, כמו גם מחסום המונע חדירת מיקרואורגניזמים דרך העור. במפגע כגון פסוריאזיס נפגע המחסום המונע מעבר מים (Feingold ב- J Lipid Res משנת 2007).
שכבת ה-stratum corneum מורכבת מ-50% סרמידים, 25% כולסטרול ו-15% חומצות שומן חופשיות. מרכיבים עיקריים בעַלְעַלים (lamellae) הליפידיים החוץ-תאיים של ה- stratum corneum הם סרמידים המכילים חומצות שומן אולטרה-ארוכות (C28-C36) (Jennemann וחב' ב-Hum Mol Genet משנת 2012). עם הזדקנות האדם יש ירידה בכמות הכולסטרול והסרמידים ב- stratum corneum (Popa וחב' ב-Int J Cosmetic Sci משנת 2010). ניסוי קליני בו נעשה שימוש בתמצית חיטה עשירה בסרמיד, הראה הגברה בלחות העור בצורכים תמצית זו בהשוואה לצורכי פלצבו (Guillou וחב' ב- Int J Cosmetic Sciמשנת 2011). תפקידים הורמונאליים: סינתזה מוגברת של סרמיד מובילה הן לתנגודת ל-leptin וכן לתנגודת לאינסולין, על ידי הגברת הביטוי של SOCS-3 (Yang וחב' ב-Am J Physiol משנת 2009). חלבון זה ידוע גם כ- suppressor of cytokine signaling, כלומר הגברת ביטויו על ידי סרמיד מגבירה את האיתות על ידי ציטוקינים. רמות מוגברות של סרמיד גורמות גם לעיכוב של מסלולי איתות של אינסולין ולעיכוב הזרחון של שיירי serine של JNK, מה שמוביל לתנגודת לאינסולין (Febbario ב-Trends Endocrinol Metabol משנת 2014). חומרים הידועים כמשרים יצירה של סרמיד: Anandamide (מרכיב במערכת האנדו-קנבּינואידית האחראי על תחושות אושר ושמחה); מעכבי האנזים ceramidase; תכשירים כימותרפיים; אנדוטוקסין, הומוציסטאין, MMP או matrix metalloproteinases, TNF-α וכן reactive oxygen species (Bismuth וחב' ב-Atherosclerosis משנת 2008); אינטרפרון-γ, THC או tetrahydrocannabinol וקנבינואידים אחרים (Velasco וחב' ב-Life Sciences משנת 2005), קרינה מייננת (Hallahan ב-Sem Radiat Oncol משנת 1996); 1,25 dihydroxy vitamin D, Fas ligand (סיגנל מוות נקשר לרצפטור חוצה הממברנה בעל ה- Death Domain , דוגמת Fas receptor הקושר את ליגנד ה-Fas). המנגנונים דרכם מתרחש איתות על ידי סרמיד: עדיין לא התבררו במלואן מנגנוני האיתות של סרמיד. היפותזה אחת היא שסרמיד הנוצר בממברנת התא מגביר את קשיחות הממברנה, ומייצב בממברנה מבנים ליפידיים קטנים הידועים כ-lipid rafts, מה שמאפשר לאחרונים לשמש פלטפורמות למולקולות איתות. יתרה מכך, כיוון ש- raftsעל עלעל (leaflet) ממברנה אחד יכולים להשרות שינויים מקומיים של עלעל נגדי בממברנה, הם יכולים לשמש באופן פוטנציאלי כמקשרים בין איתותים מחוץ לתא לאיתותים הנוצרים בתוך התא.
נמצא גם שסרמיד יכול ליצור תעלות גדולות ומאורגנות החוצות את הממברנה החיצונית של המיטוכונדריה. פעילות זו יכולה להביא ליציאה של חלבונים מהחלל התוך-ממברנאלי (Siskind וחב' ב-J Biol Chem משנת 2002, Stiban וחב' ב-Apoptosis משנת 2006, ו-Siskind וחב' ב-Mitochondrion משנת 2006).
הקשר בין סרמידים בפלזמה וגורמי סיכון לטרשת עורקים:
Ichi וחב' (Lipids משנת 2006) בחנו את הקשר בין ריכוז סרמידים בפלזמה נורמאלית לבין גורמי סיכון לטרשת עורקים על ידי מדידה בשיטת LC-MS/MS. נמצא ששני הסרמידים העיקריים בפלזמה מכילים חומצות שומן מסוג C24:0 ו-C24:1. ריכוז הסרמידים הראה מתאם חיובי משמעותי עם רמת סך-כולסטרול, ועם רמת טריגליצרידים. בנוסף, רמת הסרמיד בפלזמה עלתה באופן ניכר בנוכחות רמות גבוהות של כולסטרול-LDL שמעל 170 מיליגרם/דציליטר. מחקרים קודמים של קבוצה זו שגם apolipoprotein B-100 הנחשב למדד של טרשת עורקים נמצא במתאם חיובי משמעותי עם רמות סרמיד בפלזמה. נראה אם כן שרמת סרמיד בפלזמה היא גורם סיכון לשלבים המוקדמים של טרשת עורקים. שלושת הסרמידים שהקשר שלהם לתחלואה קרדיו-וסקולארית ותנגודת לאינסולין הוא המשמעותי ביותר הם cer18:0, cer16:0 ו-cer24:1. אנשים עם רמות מוגברות של סרמידים בפלזמה, הם בסיכון מוגבר לאירועם קרדיו-וסקולאריים משמעותיים גם לאחר התאמה לגיל, מגדר, עישון, ומדדים בנסיוב כגון LDL ו-HDL, כולסטרול, CRP ו-lipoprotein-associated phospholipase A2 או LP-PLA2.
יש ראיות לכך שסרמידים בפלזמה מנבאים של אירועים קרדיו-וסקולאריים הנובעים מרבדים טרשתיים (plaques) בלתי יציבים. פעילות מטבולית בלתי-סדירה וכן דיס-ליפידמיה גורמים להצטברות של סרמידים ברקמות שאינן מותאמות לאגירת ליפידים. במחקר ATHEROREMO-IVUS נמצא שרמות מוגברות של סרמידים בפלזמה כרוכות ביצירה מואצת של רבדים טרשתיים כלי דם (Cheng וחב' ב-Atherosclerosis משנת 2015).מחקרים אחרים הראו את הקשר בין רמות מוגברות של סרמידים לבין היווצרות מחלת לב איסכמית ואוטם שריר לב (Pan וחב' ב-Coron Artery Dis משנת 2014 ו-Tarasov וחב' ב-J Clin Endocrinol Metabol משנת 2014), לחץ-דם מוגבר (Spijkers וחב' ב-PLos One משנת 2011), שבץ-מוחי (Yu וחב' ב-J Oleo Sci משנת 2011), וסוכרת type 2, עמידות לאינסולין והשמנת-יתר (Bergman וחב' ב-Am J Physiol Endocrinol Metab משנת 2015). ניסויים של התערבות ישירה עדיין בראשית דרכם אך יחד עם זאת ריכוזי סרמיד מופחתים על ידי שיטות תרפיה הכוללות סטטינים (Ng וחב' ב-J Clin Endocrinol Metabol משנת 2014), ezetimibe, ומעכבי פעילות proprotein convertase subtilisin/kexin type 9 או PSCK9 על פי Ng וחב' ב-J Clin Endocrinol Metabol משנת 2014.מחקר באוכלוסייה פינית מצא שסרמידים בפלזמה יכולים לנבא מוות קרדיו-וסקואלרי במטופלים עם מחלת עורקים כליליים יציבה או באלה עם תסמונת כלילית חריפה (Laaksonen וחב' ב-Eur Heart J משנת 2016).
המסלולים של סינתזת סרמידים וספיגוזין: הסינתזה של סרמידים יכולה להתרחש במסלול de novo או במסלול ההידרוליזה. מסלול הסינתזה de novo מתחיל עם הטרנסאמינציה של palmitoyl-CoA על ידי ריאקצית דחיסה עם serine. ריאקציה מקוטלזת על ידי serine palmitoyltransferase, מייצגת את השלב מגביל הקצב של בסינתזה של סרמיד.
משמעות מדידת רמות סרמיד:
בדיקה זו ראויה לאשש את דרגת הסיכון של נבדקים עם מחלת עורקים כליליים ידועה, של אלה עם היסטוריה של חשד קליני לתסמונת כלילית חריפה או של אוטם שריר הלב. כמו כן בדיקה זו ראויה בנבדקים עם סיכון בלתי ידוע או ממוצע של מחלה טרשתית, שכן מקובל ש-19.4% מהאירועים הקרדיו-וסקולאטריים מתרחשים בהיעדר גורמי-סיכון מסורתיים (Khot וחב' ב-JAMA משנת 2003). רמות סרמידים בפלזמה מנבאות אירועים קרדיו-וסקולאריים העלולים להתרחש תוך שנה אחת באלה עם מחלת עורקים כליליים ידועה (Laaksonen וחב' ב-Eur Heart J משנת 2016), או תוך 3-5 שנים באלה עם חשד ל-CAD או עם מחלת לב כרונית (Yu וחב' ב-Canadian J Cardiol משנת 2015). יש לציין שרמת סרמידים בפלזמה נמוכה יותר בנבדקים עם פעילות מופחתת של PCSK9.
נתונים המבוססים על 4,000 נבדקים ניתנים לסיכום בטבלה הבאה:
_____________________________________________________
רמת סרמיד יחסית סיכון יחסי קטגוריית סיכון ל-CVD
0-2 1.0 נמוכה יותר
3-6 1.8 מתונה
7-9 2.3 מוגברת
10-12 5.1 גבוהה יותר
__________________________________________________
במרס 2017 במסגרת הכינוס השנתי ה-66 של ה-American College of Cardiology שהתקיים בוושינגטון הוצג מחקרם של Jeff Meeusen וחב' מהמעבדה לתחלואה קרדיו-וסקולארית ב-Mayo Clinic תחת הכותרת: Plasma Ceramide Concentrations Predict Risk of Cardiovascular Events.
מחקר זה קובע שמדידת רמות סרמיד בפלזמה תסייע לקלינאים לזהות נבדקים עם חשד ל-CHD הראויים למעקב צמוד יותר. זהו המחקר הראשון מסוגו שבחן משמעות רמות מוגברות של סרמיד במטופלים ללא חסימות עורקיות או באלה עם רמות LDL נמוכות. למעשה, נמצא שמטופלים עם הרמות המוגברות ביותר של סרמיד, היו בסיכון מוגבר פי-3-4 לסבול מאירוע קרדיו-וסקולארי בהשוואה לאלה עם רמות סרמיד הנמוכות ביותר, בלי קשר לרמת LDL שלהם או לדרגת החסימות בכלי הדם הכליליים. בניגוד לכולסטרול שנחשב גורם סיכון אינרטי הפועל כחוסם עורקי, סרמידים הם בעלי תפקיד אקטיבי בתהליך ה-CVD בכך שהם מגייסים תאי דלקת המעודדים קרישת יתר. כל התאים הם בעלי יכולת לייצר סרמידים, אלא שרמות סרמיד נוטות להצטבר בדם כאשר רמת השומנים בדם מוגברת.
המחקר כלל 499 נבדקים ב-Mayo Clinic שהופנו לאנגיוגרפיה של העורקים הכליליים על מנת לאתר חסימות עורקיות, כאשר ב-46% מתוכם אמנם נמצאו חסימות אלו. המטופלים היו דומים בגיל, בלחץ-הדם, בסטאטוס העישון שלהם וברמת HDL. אלה עם תחלואת סוכרת או היסטוריה של אירועי לב או אירועים מוחיים קודמים לא נכללו במחקר. במחקר נמדדו בדם בבסיס האשפוז הרמות של 4 סוגי סרמיד (בהתאם לחומצות השומן שלהם), ונקבעו בסקאלה של 0-12: המטופלים קובצו ל-4 קטגוריות סיכון על בסיס רמות הסרמיד שלהם: 0-2 (סיכון נמוך); 3-6 (סיכון ביניים); 7-9 (סיכון מתון); 10-12 (סיכון גבוה).
מטופלים אלה נמצאו במעקב שנמשך בממוצע 8 שנים, תוך תיעוד של התרחשות התקפי-לב, שבץ מוחי, טיפול חוזר להרחבת כלי-דם כליליים או מוות. בסך הכול, נמצא שב-5.1% מכלל המטופלים חוו אירוע קרדיו-וסקולארי משמעותי במהלך המעקב האמור. יחד עם זאת, הסיכון לאירוע כזה היה באופן הדרגתי גבוה יותר ככל שרמות סרמיד בדם היו גבוהות יותר, כאשר עלייה של נקודה אחת בסקאלת ריכוזי סרמיד מ-0 עד 12, העלתה את הסיכון ב-9%, מגמה שנמשכה גם לאחר התאמה לגורמי סיכון אחרים הכוללים גיל, מגדר, לחץ-דם מוגבר, עישון, סך-כולסטרול, HDL וסמני דלקת. למעשה, שיעור האירועים היה כפול בקרב אלה אלה עם רמות סרמיד הגבוהות ביותר בהשוואה לאלה עם רמות סרמיד הנמוכות ביותר (8.1 לעומת 4.1, בהתאמה). כמו כן שנצא שגברים הם בעלי רמות סרמיד נמוכות יותר מאשר נשים.
בקרב אלה ללא CAD על פי תוצאות האנגיוגרפיה, שיעור האירועים הקרדיו-וסקולאריים היה רק 3.1%, שהיה נמוך יותר מאשר הרמה הממוצעת של סיכון זה באוכלוסייה הכללית. אך כאשר נבדקה במדגם זה התחלואה הקרדיו-וסקולארית על בסיס ה-ֶ, אלה עם רמות סרמיד הגבוהות ביותר נמצאו בסיכון מוגבר פי-4 בהשוואה לאלה עם רמות סרמיד הנמוכות ביותר (7.8% לעומת 2.2%). מגמה דומה נמצאה בנבדקים עם רמות נמוכות של LDL (פחות מ-100 מיליגרם לדציליטר), הנחשבות ליעד "טוב" של LDL. בקבוצה זו, שיעור התקפי הלב, השבץ המוחי, הרֶה-וסקולריזציה או המוות היה 3.7% בקרב אלה עם רמות סרמיד נמוכות, לעומת 16.4% באלה עם רמות סרמיד הגבוהות ביותר.
החל מאוגוסט 2016, קרדיולוגים ב-Mayo Clinic בודקים באופן שיגרתי את רמות סרמיד על מנת לרבד את הסיכון של מטופלים שהיו בסיכון גבוה לאירועי לב חמורים, ואף על פי כן לא קיבלו טיפול מונע. מטופלים אלה עשויים להפיק תועלת הטיפול אינטנסיבי יותר כגון מינון מוגבר של סטטינים, ייעוץ דיאטני או ייעוץ לפעילות גופנית מוגברת.
שימושים של סרמיד:
ניתן למצוא סרמיד כמרכיב של מספר תכשירים טופיקלים כמשחות עור המשמשות לטיפול במפגעי עור כגון אקזמה. סרמיד נכלל גם בתכשירים קוסמטיים כגון סוגי סבון, שמפו, ומשחות עור וכן בקרם הגנה.
הוראות לביצוע הבדיקה:
נוטלים דם במבחנת ספירת דם (EDTA, פקק סגלגל), ולאחר הסרכוז להקפיא תוך 8 שעות. יש לפסול דגימת פלזמה המוליטית גם באופן מתון, או דגימות ליפמיות או איקטריות מאוד. ניתן לקבל דגימות פלזמה ליפמיות או איקטריות באופן מתון. דגימת הפלזמה יציבה בטמפרטורת החדר למשך 8 שעות, בקירור למשך 24 שעות ובהקפאה למשך 30 יום.
אין לבצע מדידת רמת סרמיד בפלזמה של מטופלים בעירוי תוך-ורידי של Intralpid מחשש לקבלת תוצאות מוגברות כזובות (false positive). עירוי של Intralipid שהיא אמולסיה שומנית המכילה שמן סויה, פוספוליפידים ממקור ביצים וגליצרין זמינה בריכוזים של 10%, 20% ו-30%. שיטת המדידה: Liquid Chromatography-Tandem Mass Spectrometry או LC-MS/MS.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 