הבדלים בין גרסאות בדף "Kidney injury molecule-1"
| שורה 41: | שורה 41: | ||
==KIM-1 כ-biomarker== | ==KIM-1 כ-biomarker== | ||
נמצאו מספר מאפיינים של KIM-1 שהוליכו למחשבה שחלבון זה עשוי להיות סמן אידיאלי לנזק כלייתי: העדרו של החלבון מכליות בריאות; המיקום ועליית ביטויו דווקא בממברנה האפיקלית של האבובית הקריבנית; נוכחותו העקבית בתאי אפיתל עד שהתאים מתאוששים לחלוטין מהנזק שנגרם להם; החיתוך המהיר של ה-ectodomain ויציבותו של מקטע זה ex vivo בטמפרטורת החדר. השיטות הקלאסיות להערכת תפקוד הכליה כוללות את מדידת urea וקראטינין בדם, שני סמנים שאינם רגישים ואינם ספציפיים, במיוחד בתרחיש של AKI. | נמצאו מספר מאפיינים של KIM-1 שהוליכו למחשבה שחלבון זה עשוי להיות סמן אידיאלי לנזק כלייתי: העדרו של החלבון מכליות בריאות; המיקום ועליית ביטויו דווקא בממברנה האפיקלית של האבובית הקריבנית; נוכחותו העקבית בתאי אפיתל עד שהתאים מתאוששים לחלוטין מהנזק שנגרם להם; החיתוך המהיר של ה-ectodomain ויציבותו של מקטע זה ex vivo בטמפרטורת החדר. השיטות הקלאסיות להערכת תפקוד הכליה כוללות את מדידת urea וקראטינין בדם, שני סמנים שאינם רגישים ואינם ספציפיים, במיוחד בתרחיש של AKI. | ||
| − | כמו כן, חשוב להכיר בעובדה שהשינויים בריכוזי urea וקראטינין בנסיוב, משקפים בעיקר שינויים תפקודיים ביכולת הסינון הכלייתי, ואינם יכולים לשמש סמנים אמיתיים של נזק כלייתי. יש מספר הולך וגדל של מחקרים בחיות, המדגימים את השימושיות של KIM-1 בשתן כסמן לא-חודרני לנזק כלייתי. רשימה חלקית של תרחישים בהם הודגמה השימושיות של KIM-1 כסמן כוללת: איסכמיה ונזק מושרה על ידי אנגיוטנסין בחולדת Ren, נזק המושרה על ידי מספר רעלנים כולל ציספלטין, S-(1,1,2,2-tetrafluoroethyl)-l-cysteine (TFEC), חומצה פולית, gentamycin, כספית, כרום (Zhou וחב' ב-Toxicol Sci משנת 2008), קדמיום (Prozialeck וחב' ב-Kidney Int משנת 2007), חומרי ניגוד בהדמיה המכילים יוד (Jost וחב' ב-Invest Radiol משנת 2009), ציקלוספורין, vancomycin ו- ochratoxin A (על פי Perez-Rojas וחב' ב-Am J Physiol Renal Physiol משנת 2007), נפרופתיה מושרה על ידי גיל מתקדם, [[נפרופתיה]] הנגרמת מהעמסת-יתר של חלבון וכן על ידי d-serine (על פי van Timmeren וחב' ב-Am J Physiol Renal Physiol משנת 2006). | + | כמו כן, חשוב להכיר בעובדה שהשינויים בריכוזי urea וקראטינין בנסיוב, משקפים בעיקר שינויים תפקודיים ביכולת הסינון הכלייתי, ואינם יכולים לשמש סמנים אמיתיים של נזק כלייתי. יש מספר הולך וגדל של מחקרים בחיות, המדגימים את השימושיות של KIM-1 בשתן כסמן לא-חודרני לנזק כלייתי. רשימה חלקית של תרחישים בהם הודגמה השימושיות של KIM-1 כסמן כוללת: איסכמיה ונזק מושרה על ידי אנגיוטנסין בחולדת Ren, נזק המושרה על ידי מספר רעלנים כולל [[ציספלטין]], S-(1,1,2,2-tetrafluoroethyl)-l-cysteine (TFEC), [[חומצה פולית]], [[gentamycin]], [[כספית]], [[כרום]] (Zhou וחב' ב-Toxicol Sci משנת 2008), [[קדמיום]] (Prozialeck וחב' ב-Kidney Int משנת 2007), חומרי ניגוד בהדמיה המכילים [[יוד]] (Jost וחב' ב-Invest Radiol משנת 2009), [[ציקלוספורין]], [[vancomycin]] ו- [[ochratoxin A]] (על פי Perez-Rojas וחב' ב-Am J Physiol Renal Physiol משנת 2007), נפרופתיה מושרה על ידי גיל מתקדם, [[נפרופתיה]] הנגרמת מהעמסת-יתר של חלבון וכן על ידי d-serine (על פי van Timmeren וחב' ב-Am J Physiol Renal Physiol משנת 2006). |
המחקרים הראשונים על KIM-1 באדם התפרסמו בשנת 2002 על ידי Han וחב' ב-Kidney Int, והודגם בהם שהיתה עלייה בולטת בביטוי של KIM-1 בדגימות ביופסיה כלייתית ממטופלים עם אבחנה פתולוגית של ATN או acute tubular necrosis. כן נמצא שהיו ריכוזים גבוהים מאוד של ectodomain בשתן של נבדקים עם AKI. רמות מוגברות אלו של KIM-1 בשתן התגלו יוד לפני זיהוי של גבישים (casts) בשתן. ריכוז KIM-1 בשתן עמד ביחס ישר לחומרת AKI. מאוחר יותר נמצא ש-KIM-1 הוא גם סמן רגיש לנזק כלייתי בילדים העוברים ניתוח לב (Han וחב' ב-Kidney Int משנת 2008). השוואה בין KIM-1 לבין סמן אחר, NAG או -N-acetylglucosaminidase, ב-201 חולים עם אבחון AKI מוכח קלינית, ונמצא ששני סמנים אלה היו כרוכים משמעותית עם תמותה או הזדקקות לדיאליזה (Liangos וחב' ב- J Am Soc Nephrol משנת 2007). מחקר מקיף אחר של Vaidya וחב' ב-Clin Trans Sci משנת 2008, העריכה את הביצועים האבחוניים של 9 סמנים של AKI בשתן, כדלקמן: KIM-1, החלבון NGAL או neutrophil gelatinase-associated lipocalin, ציסטטין C, הציטוקין IL-18, hepatocyte growth factor (HGF), N-acetyl-β-D-glucosaminidase (NAG), vascular endothelial growth factor (VEGF), chemokine interferon-inducible protein 10 (IP-10) וכן סך-חלבון, כל אלה בהשוואות של 204 מטופלים עם או ללא AKI מתועד קלינית. | המחקרים הראשונים על KIM-1 באדם התפרסמו בשנת 2002 על ידי Han וחב' ב-Kidney Int, והודגם בהם שהיתה עלייה בולטת בביטוי של KIM-1 בדגימות ביופסיה כלייתית ממטופלים עם אבחנה פתולוגית של ATN או acute tubular necrosis. כן נמצא שהיו ריכוזים גבוהים מאוד של ectodomain בשתן של נבדקים עם AKI. רמות מוגברות אלו של KIM-1 בשתן התגלו יוד לפני זיהוי של גבישים (casts) בשתן. ריכוז KIM-1 בשתן עמד ביחס ישר לחומרת AKI. מאוחר יותר נמצא ש-KIM-1 הוא גם סמן רגיש לנזק כלייתי בילדים העוברים ניתוח לב (Han וחב' ב-Kidney Int משנת 2008). השוואה בין KIM-1 לבין סמן אחר, NAG או -N-acetylglucosaminidase, ב-201 חולים עם אבחון AKI מוכח קלינית, ונמצא ששני סמנים אלה היו כרוכים משמעותית עם תמותה או הזדקקות לדיאליזה (Liangos וחב' ב- J Am Soc Nephrol משנת 2007). מחקר מקיף אחר של Vaidya וחב' ב-Clin Trans Sci משנת 2008, העריכה את הביצועים האבחוניים של 9 סמנים של AKI בשתן, כדלקמן: KIM-1, החלבון NGAL או neutrophil gelatinase-associated lipocalin, ציסטטין C, הציטוקין IL-18, hepatocyte growth factor (HGF), N-acetyl-β-D-glucosaminidase (NAG), vascular endothelial growth factor (VEGF), chemokine interferon-inducible protein 10 (IP-10) וכן סך-חלבון, כל אלה בהשוואות של 204 מטופלים עם או ללא AKI מתועד קלינית. | ||
גרסה מ־07:14, 6 ביוני 2018
| מדריך בדיקות מעבדה | |
| Kidney Injury Molecule 1 | |
|---|---|
| שמות אחרים | TIM-1 או T cell immunoglobulin & mucin domain 1 , וכן Hepatitis A virus cellular receptor 1 (HAVcr-1) , ו-KIM-1, כמו גם CD365. |
| מעבדה | כימיה בשתן |
| תחום | נזק כלייתי כרוני וחריף |
| טווח ערכים תקין | פחות מ-1 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
רמות מוגברות בשתן של KIM-1, עשויות לסיוע באבחון נזק כלייתי בעיקר לאבוביות הקריבניות (פרוקסימליות). בדיקה זו יכולה לתת הערכה פרוגנוסטית מוקדמת לגבי מטופלים עם אי-ספיקת כליות חריפה (להלן AKI), ויכולה לסייע לקלינאי לנקוט צעדים מוקדמים להאטה של ההתדרדרות הכלייתית לאחר AKI.
המבנה של KIM-1
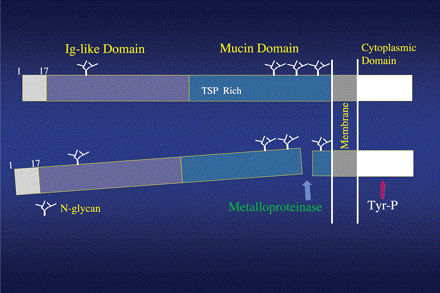
מולקולת KIM-1 מכילה 339 חומצות אמינו, כאשר הקצה ה-N טרמינאלי שלה הוא הקצה המשתרבב מפני התא החוצה, וחלק חיצוני זה מורכב 272 חומצות אמינו המכילים את המקטע דמוי-אימונוגלובולין וכן את מקטע ה-mucin. המקטע החיצוני (ectodomain) יכול להיות מופרש לשתן במצבי פגיעה איסכמית וניתן לגילוי בעזרת נוגדנים ספציפיים. מכאן ששיטות גילוי אימונולוגיות הן השיטות המקובלות לגילוי ולכימות שלו בשגרת המעבדה הקלינית.
KIM-1 הוא גליקופרוטאין ממברנלי type 1, המכיל בחלק החוץ-תאי שלו מקטע חדש המכיל 6 שיירי ציסטאין דמוי-אימונוגלובולין, שני אתרי N-גליקוזילציה וכן מקטע עשיר ב- Thr/Ser/Pro האופייני לחלבונים עם אתרי O-גליקוזילציה. KIM-1 מכיל כמובן מקטע תוך-או טרנס-ממברנלי, וכן מקטע תוך-תאי קצר יחסית עם tyrosine phosphorylation signalling motif בתאי הכליה שסימונו KIM-1b.
אנליזה של רצף חומצות האמינו קבעה ש-339 חומצות האמינו של KIM-1, היו בעלי זהות של 79% בין הגליקופרוטאין האנושי וזה של קופים. חלבון זה מכיל רצף איתות (signal sequence), מקטע N-טרמינאלי של 109 חומצות אמינו עשיר בציסטאין המכיל רק אתר אחד של N-גליקוזילציה (בצבע אפור), מקטע mucin של 163 חומצות אמינו העשיר ברצף Thr/Ser/Pro המכיל 3 אתרי O-גליקוזילציה (בצבע כחול), ומקטע תוך תאי בן 48 חומצות אמינו (צבוע בלבן).
רקע פיזיולוגי
KIM-1 הידוע גם כ-TIM-1 וכן כ-HAVcr-1, הוא גליקופרוטאין טרנס-ממברנלי המכיל mucin חוץ-תאי וכן מקטעים (domains) של אימונוגלובולין (Chimura וחב' ב-J Biol Chem משנת 1998). הוא מבוטא במידה מעטה ביותר בתאי אפיתל של כליות בריאות, אך הביטוי שלו מתגבר משמעותית בעקבות נזק בתר-איסכמי באבוביות הקריבניות (proximal tubules). המקטע החוץ-תאי של KIM-1 מופיע בשתן זמן קצר לאחר הופעת הנזק האיסכמי המתואר וניתן לגלותו באופן איכותי בבדיקת סקר על ידי טבילת מקלון (dipstick) מתאים בשתן, מה שהופך את KIM-1 לסמן נוח וניתן לגילוי ולהערכה איכותית של נזק כלייתי חריף (להלן AKI).
ה-mRNA של הגליקופרוטאין הידוע כ-kidney injury molecule-1 המסומן במכרסמים כ-kim-1 ובבני-אדם כ-KIM-1, זוהה בשיטה המבוססת על PCR הידועה כ- representational difference analysis של cDNA שפותחה על ידי Hubank ו-Schatz ופורסמה בשנת 1994 ב-Nucl Acid Res. היה זה Joseph Bonventre במעבדתו ב-Harvard Med School בשיתוף פעולה עם Ichimura שהשתמשו לראשונה ב-1998 ב-J Biol Chem תוך שימוש בשיטה המתוארת כאן לחפש גנים שהביטוי שלהם התגבר מאוד 24-48 שעות לאחר איסכמיה בחולדות, ומצאו שביטוי הגן Kim-1 עלה באופן הבולט ביותר. אוטולוגים של KIM-1 נמצאים במינים רבים כולל דגי Zebra, קופים וכלבים.
תאגיד פרמצבטי גדול נקט בשיטה גנומית להעריך גנים המתבטאים-ביתר לאחר טיפול בציספלטין הידוע כמשרה נזק נפרוטוקסי, ואכן מצאו שהגן Kim-1 הגדיל את ביטויו יותר מכל אחד מגנים אחרים שנסרקו (Amin וחב' ב-Environ Health Perspect משנת 2004). מספר גדול של מחקרים בחיות הראו יצירה ניכרת של החלבון Kim-1 באזורים מושפעים של האבוביות הקריבניות כל אימת שרעלן או תרחיש פתו-פיזיולוגי גרם לפגיעה בהתמיינות (dedifferntiation) של אפיתל הכליה (Ichimura וחב' ב-Am J Physiol Renal Physiol משנת 2004, Vaidya וחב' באותו כתב עת משנת 2006, ו-Zhou וחב' ב-Toxicol Sci משנת 2009).
תהליך ה- dedifferntiation הוא ביטוי מאוד מוקדם של תגובת תאי האפיתל לפגיעה (Bonventre וחב' ב- J Am Soc Nephrol משנת 2003). הגליקופרוטאין KIM-1 מבוטא גם בלימפוציטים אם כי ברמות נמוכות בהרבה, ולכן קרוי גם T-cell immunoglobulin mucin (TIM)-1. דווח גם ש-KIM-1 מבוטא גם בשבלול האוזן (cochlea) בתגובה לנזק הנגרם מטיפול בציספלטין (Mukherjea וחב' ב-Neuroscience משנת 2006). משפחת KIM/TIM מורכבת מ-8 חברים בעכברים, ששה בחולדות ו-3 באדם (Kuchroo וחב' ב-Adv Immunol משנת 2006). על ידי שימוש באנליזות סטנדרטיות כגון western blot או northern blot כמו גם אימונו-ציטוכימיה, הגן Kim-1 או ביטויו, אינם ניתנים לגילוי בכליה הנורמאלית. לאחר נזק כלייתי מופיע במהירות KIM-1 mRNA וחלה עלייה ניכרת ברמת החלבון KIM-1 הממוקם בריכוזים גבוהים בממברנה האפיקלית של האבוביות הקריבניות באזור בו האבוביות נפגעו באופן הניכר ביותר. במקרה של השרייה ניסויית של איסכמיה במכרסמים, ביטויו של Kim-1 הוא בעיקר בקטע S3 של האבובית הקריבנית. בבני-אדם, איסכמיה או נזק טוקסי הגורם לפגיעה כלייתית חריפה (AKI), ביטויו של KIM-1 הוא בשלושת הקטעים של האבובית הקריבנית.
המבנה של חלבון זה הביא את Bonventre ואנשיו למחשבה שיש לו תכונות של מולקולת ספיחה (adhesion) כפי שפרסמו Bailly וחב' ב-J Biol Chem משנת 2002. לאחר מכן מצאו Han וחב' (J Am Soc Nephrol משנת 2005) ש-KIM-1 מבוטא גם בריכוזים גבוהים במטופלים עם renal cell carcinoma מסוג תאי Clear, שגם בהם הנזק כרוך בדה-דיפרנציאציה של תאים האבובית הקריבנית.
כעת מתחילים להעריך את תפקודו של KIM-1 בכליה. חלבון זה מעניק לתאי האפיתל את היכולת לזהות ולבלוע בתהליך של פגוציטוזה תאים מתים המופיעים לאחר טראומה כלייתית, אשר גורמים לחסימה של נהור (lumen) האבוביות, מהמאפיינים של AKI. כמו כן, KIM-1 הוא קולטן של phosphatidylserine המזהה תאים אפופטוטים ומכוון אותם לליזוזומים. בנוסף, KIM-1 משמש קולטן לליפופרוטאינים מחומצנים ולכן הוא מתאים לזיהוי של איתותי "השמד אותי" של תאים אפופטוטים. לנוכח סגולות אלו נראה ש-KIM-1 ייחודי בהיותו הקולטן הראשון הלא-מילואידי של phosphatidylserine המתמיר תאי אפיתל לתאים עם פנוטיפ פגוציטי (Ichimura וחב' ב-J Clin Invest משנת 2008). בנוסף לסיוע שלו לפינוי של פסולת אפופטוטית מהנהור האבובי, KIM-1 עשוי לשחק תפקיד בהגבלת התגובה האוטו-אימונית לנזק כלייתי, כיוון שידוע במערכות רבות שפגוציטוזה של גופים אפופטוטים הוא מנגנון המגביל את התגובה הדלקתית. עם זאת, תגובת ההגנה האקוטית, אינה אמורה בהכרח להיות מתורגמת להשפעות הכרוניות של ביטוי KIM-1, כיוון שמטופלים רבים עם אי-ספיקה כלייתית כרונית, מבטאים את KIM-1 באבוביות הקריבניות שלהם (Vaidya וחב' ב-Clin Trans Sci משנת 2008, ו- van Timmeren ב-J Pathol משנת 2007).
חלקו החיצוני (ectodomain) של KIM-1 משתחרר מהתאים in vitro ו-in vivo לשתן במכרסמים ובאדם, לאחר נזק לאבוביות הקריבניות או האלה עם RCC. הפרשה זו מווסתת לפחות חלקית על ידי מסלולי איתות של MAP kinase, המשופעלים על ידי עקה (Zhang וב' ב-J Am Soc Nephrol משנת 2007). פעילות של אנזימים מסוג metalloproteinase גורמת לשחרור KIM-1 מסיס. התפקיד של ה-KIM-1 המשתחרר בתוך האבוביות נותר בלתי ידוע, כמו גם המשמעות של הביטוי לזמן-ארוך של KIM-1 במטופלים עם מחלת כליות כרונית, אם כי ברמה נמוכה מזו שמוצאים במחלת כליות חריפה, צריכה עדיין הבהרה.
KIM-1 כ-biomarker
נמצאו מספר מאפיינים של KIM-1 שהוליכו למחשבה שחלבון זה עשוי להיות סמן אידיאלי לנזק כלייתי: העדרו של החלבון מכליות בריאות; המיקום ועליית ביטויו דווקא בממברנה האפיקלית של האבובית הקריבנית; נוכחותו העקבית בתאי אפיתל עד שהתאים מתאוששים לחלוטין מהנזק שנגרם להם; החיתוך המהיר של ה-ectodomain ויציבותו של מקטע זה ex vivo בטמפרטורת החדר. השיטות הקלאסיות להערכת תפקוד הכליה כוללות את מדידת urea וקראטינין בדם, שני סמנים שאינם רגישים ואינם ספציפיים, במיוחד בתרחיש של AKI. כמו כן, חשוב להכיר בעובדה שהשינויים בריכוזי urea וקראטינין בנסיוב, משקפים בעיקר שינויים תפקודיים ביכולת הסינון הכלייתי, ואינם יכולים לשמש סמנים אמיתיים של נזק כלייתי. יש מספר הולך וגדל של מחקרים בחיות, המדגימים את השימושיות של KIM-1 בשתן כסמן לא-חודרני לנזק כלייתי. רשימה חלקית של תרחישים בהם הודגמה השימושיות של KIM-1 כסמן כוללת: איסכמיה ונזק מושרה על ידי אנגיוטנסין בחולדת Ren, נזק המושרה על ידי מספר רעלנים כולל ציספלטין, S-(1,1,2,2-tetrafluoroethyl)-l-cysteine (TFEC), חומצה פולית, gentamycin, כספית, כרום (Zhou וחב' ב-Toxicol Sci משנת 2008), קדמיום (Prozialeck וחב' ב-Kidney Int משנת 2007), חומרי ניגוד בהדמיה המכילים יוד (Jost וחב' ב-Invest Radiol משנת 2009), ציקלוספורין, vancomycin ו- ochratoxin A (על פי Perez-Rojas וחב' ב-Am J Physiol Renal Physiol משנת 2007), נפרופתיה מושרה על ידי גיל מתקדם, נפרופתיה הנגרמת מהעמסת-יתר של חלבון וכן על ידי d-serine (על פי van Timmeren וחב' ב-Am J Physiol Renal Physiol משנת 2006).
המחקרים הראשונים על KIM-1 באדם התפרסמו בשנת 2002 על ידי Han וחב' ב-Kidney Int, והודגם בהם שהיתה עלייה בולטת בביטוי של KIM-1 בדגימות ביופסיה כלייתית ממטופלים עם אבחנה פתולוגית של ATN או acute tubular necrosis. כן נמצא שהיו ריכוזים גבוהים מאוד של ectodomain בשתן של נבדקים עם AKI. רמות מוגברות אלו של KIM-1 בשתן התגלו יוד לפני זיהוי של גבישים (casts) בשתן. ריכוז KIM-1 בשתן עמד ביחס ישר לחומרת AKI. מאוחר יותר נמצא ש-KIM-1 הוא גם סמן רגיש לנזק כלייתי בילדים העוברים ניתוח לב (Han וחב' ב-Kidney Int משנת 2008). השוואה בין KIM-1 לבין סמן אחר, NAG או -N-acetylglucosaminidase, ב-201 חולים עם אבחון AKI מוכח קלינית, ונמצא ששני סמנים אלה היו כרוכים משמעותית עם תמותה או הזדקקות לדיאליזה (Liangos וחב' ב- J Am Soc Nephrol משנת 2007). מחקר מקיף אחר של Vaidya וחב' ב-Clin Trans Sci משנת 2008, העריכה את הביצועים האבחוניים של 9 סמנים של AKI בשתן, כדלקמן: KIM-1, החלבון NGAL או neutrophil gelatinase-associated lipocalin, ציסטטין C, הציטוקין IL-18, hepatocyte growth factor (HGF), N-acetyl-β-D-glucosaminidase (NAG), vascular endothelial growth factor (VEGF), chemokine interferon-inducible protein 10 (IP-10) וכן סך-חלבון, כל אלה בהשוואות של 204 מטופלים עם או ללא AKI מתועד קלינית.
במקרה של כל אחד מהסמנים המוזכרים, הרמה הממוצעת שלהם בשתן הייתה גבוהה משמעותית בנבדקים AKI בהשוואה לאלה ללא AKI. השטח מתחת לעקומת ROC או AUC-ROCהמחושב עבור KIM-1, נקבע כ-0.95 כאשר משווים מטופלים עם AKI לעומת אנשים בריאים. רמות מותאמות לגיל של KIM-1, NAG, HGH, VEGF וסך-חלבון בשתן, היו משמעותית גבוהים יותר במטופלים שנפטרו או שנדרשה עבורם השתלת כליה, זאת בהשוואה למטופלים שלא נפטרו ולא היו זקוקים להשתלת כליה. Van Timmeren וחב' צבעו את KIM-1 בביופסיות כלייתיות של 102 מטופלים עם מחלות כליה שונות, והראו צביעה חיובית בתאי אבוביות קריבניות שעברו דה-דיפרנציאציה, שהיו בהתאמה עם תהליך פיברוזיס אינטרסטיציאלי ודלקת. גם Humphreys וחב' הדגימו במודל של עכברים (J Clin Invest משנת 2013) כיצד ביטוי כרוני של KIM-1 באפיתל הכלייתי עלול לגרום לפיברוזיס בכליות עכברים.
אנליזה של מספר קטן של מטופלים לא סוכרתיים עם מחלת כליות, מצאה שרמת KIM-1 בשתן הייתה מוגברת במטופלים פרוטאינוריים, ופחתה כאשר חולים אלה טופלו בתכשירים מעכבי הציר renin–angiotensin–aldosterone, בהגבלת נתרן, או בתכשירים משתנים (diuretics), שהפחיתו את הפרוטאינוריה (Waanders וחב' ב-Am J Kidney Dis משנת 2007).
אנליזה של פרוגנוזה לטווח ארוך של מטופלים עם AKI
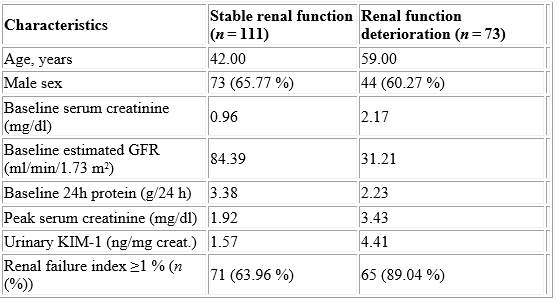
מבין 184 מטופלים עם AKI לאחר שנה של מעקב, נמצאו 111 מטופלים עם תפקוד כלייתי יציב, ו-73 מטופלים עם התדרדרות של תפקודם הכלייתי. רמת KIM-1 בשתן הייתה גבוהה משמעותית בקבוצת התפקוד הכלייתי הירוד מאשר באלה עם מצב כלייתי יציב. על מנת לנבא את ההתדרדרות בתפקוד הכלייתי במטופלים עם AKI, נמצא שבערך cutoff של 2.46 ננוגרם/מיליגרם קראטינין רגישות הניבוי היא 78.6%, ואילו הספציפיות שלו 57.9%. עקומת Kaplan-Meyer הצביעה על כך שרמות KIM-1 בשתן מעל ערך של 2.46 ננוגרם/מיליגרם קראטינין היה במתאם עם פרוגנוזה גרועה לטווח ארוך במטופלים עם AKI (p<0.001).
בטבלה הבאה מופיעה השוואה בין רמת KIM-1 בנבדקים עם ירידה בתפקוד הכלייתי לבין אלה עם תפקוד כלייתי יציב, לאחר שנה של מעקב במטופלים עם AKI.
מחקר זה הראה שהסיכון לירידה בתפקוד הכלייתי לאחר AKI גדל ב-3.3% לכל שנה של תוספת גיל, וגדל ב-2.4% לכל ירידה של 1 ml/min/1.73 m2ב-GFR הבסיסי. הסיכון של ירידה בתפקוד הכלייתי לאחר AKI, גדל ב-6.4% לכל עלייה של 1 ננוגרם/מיליגרם קראטינין ברמתKIM-1 בשתן. הערך האבחוני של רמת KIM-1 במקרים של AKI:התרחיש של AKI הוא שכיח ומאופיין על ידי דעיכה מהירה ואינטנסיבית בתפקודי כליות הכרוכה בסדרה של תסמינים קליניים האחראיים לתחלואה קשה ולתמותה. לאלה השורדים את התרחיש יש סיכון מוגבר למחלת כליות כרונית, כל שאבחון מוקדם של AKI וטיפול מתאים עשויים למנוע את הפגיעה הכלייתית המתמשכת. אך למרות ההתקדמות בהבנת האטיולוגיה והפתולוגיה של AKI, הזיהוי הקליני שלו שנוי במחלוקת. כיום המדד המקובל והנפוץ ביותר להגדרה ולאבחון של AKI הוא העלייה ברמת קראטינין בנסיוב, או הירידה בפינויו לשתן. אך הגלל רגישות וספציפיות נמוכות יחסית, מדד זה אינו אידיאלי לאבחון AKI במהלך 72 השעות הראשונות של התרחיש. Shao וחב' פרסמו בשנת 2014 ב-PLos ONE מטה-אנליזה בה נסקרו 11 מחקרים שכללו במקובץ 2,979 מטופלים. ממחקרים אלה התקבלה ההערכה שהרגישות של רמת KIM-1 בשתן לאבחון AKI היא 74%, והספציפיות היא 86%. השטח מתחת לקומת ROC נקבע כ-0.86.
KIM-1 במצבי השתלת כליה
במחקרים על השתלת כליות מדדו Zhang וחב' ב-Kidney Int משנת 2008 את הביטוי של KIM-1 בביופסיות של כליות מושתלות על ידי אימונו-ציטוכימיה. למרות שביופסיות אלה לא גילו נזק טובולארי בבחינה היסטולוגית, נמצאו מוקדים חיוביים של ביטוי KIM-1 ב-28% מהמקרים. נתון זה אינו מבטא תוצאה false positive אלא הוכחה לרגישות המאוד גבוהה של ביטוי KIM-1 לגילוי נזק טובולארי בהשוואה לבחינה מורפולוגית. במחקר של allografts כלייתיים, נמצא ביטוי של KIM-1 ב-100% מהביופסיות שנלקחו ממטופלים עם התדרדרות של התפקוד הכלייתי, ושינויים מורפולוגיים המצביעים על נזק טובולארי. נמצא שביטויו של KIM-1 הייתה במתאם טוב עם רמות קראטינין ו-urea , ובמתאם הפוך ל-GFR ביום ביצוע הביופסיה. כמו כן KIM-1 היה מבוטא באופן ממוקד באבוביות פגועות ב-92% של הביופסיות שנלקחו ממטופלים עם נטייה לדחייה של השתל.
Van Timmeren וחב' דיווחו בשנת 2007 ב-Transplantation, על בחינה של רמתKIM-1 בשתן של מושתלי כליה. המדגם כלל מושלים עם משך ממוצע של 6 שנים לאחר ההשתלה, ומדדו את רמות KIM-1 לפני ההשתלה ובדגימות שתן שנלקחו והוקפאו במועדים שונים אחריה. ההתרחשות של דחיית השתל הייתה במתאם עם העלייה ברמת KIM-1, שנמצאה במתאם טוב עם פינוי קראטינין נמוך, פרוטאינוריה וגיל מתקדם של המושתלים. רמות KIM-1 נבאו את דחיית השתל באופן בלתי תלוי בפינוי קראטינין, פרוטאינוריה או גיל המושתל.
ב-5 בספטמבר 2014 נתן ה-FDA וחודשים אחדים אחריו גם ה-EAEA את האישור להכללת המבדק של KIM-1 ברשימה הקטנה של סמנים ל-AKI.
KIM-1 הוא סמן מוקדם של נפרוטוקסיות על ידי קדמיום
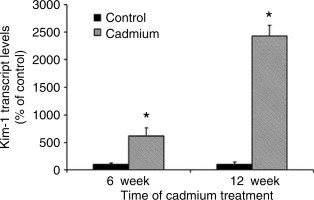
בשנת 2007 הופיע ב-Kidney Int מחקרם של Prozialeck וחב' על הנזק שגורמת חשיפה לקדמיום לאבובית הקריבנית, שבא לביטוי על ידי polyuria ו-proteinuria. חולדות Sprague-Dawley הוזרקו מדי יום על ידי קדמיום לתקופה של עד 12 שבועות. מדי שבוע נמדדו דגימות שתן לרמת Kim-1, חלבון, קראטינין, metallothionein וחלבון תאי Clara הידוע כ-CC-16. כמויות משמעותיות של Kim-1 התגלו בשתן לאחר 6 שבועות, וריכוזים אלה המשיכו לעלות לאורך כל תקופת הניסוי. הופעת Kim-1 בשתן הקדימה את העלייה ברמת חלבון ב-4-5 שבועות, ו-1-3 שבועות לפני הופעת metallothionein ו-CC-16 בשתן.ריכוזי Kim-1 בשתן עמדו ביחס ישר למינון קדמיום שהוזרק. אנליזה אימונו-היסטוכימית גילתה Kim-1 בעיקר בתאי האבובית הקריבנית, של החולדות המטופלות בקדמיום.
קדמיום הוא מזהם תעסוקתי וסביבתי חשוב בעל השפעות פליאומורפיות על איברים שונים בגוף כולל ריאות, כבד, כליות, עצמות ואשכים. בנוסף קדמיום הוא קרצינוגני וטרטוגני, אך נראה שהבליות הן יעד הטוקסיות העיקרי של קדמיום בחשיפה כרונית ואף ברמת חשיפה נמוכה, כאשר הנזק העיקרי הוא באבוביות הקריבניות. אכן, יש עניין רב בזיהוי מוקדם של נפרו-טוקסיות מחשיפה לקדמיום, חלק מהסמנים ששימשו במחקר זה כוללים beta2-microglobulin, וכן CC-16 ו-metallothioneine. הסמן האחרון הוא חלבון הקושר מתכות כגון קדמיום והוא המעביר רעלן זה לתאי האפיתל של האבובית הקריבנית. beta2-microglobulin ו-CC-16, הם חלבונים קטן-מולקולאריים הנמצאים בריכוזים נמוכים בפלזמה. בתנאים נורמאליים הם מסוננים דרך פקעיות (glomeruli) הכליה ונספגים מחדש באבוביות הקריבניות וחוזרות לדם. אך כאשר אבוביות אלו נפגעות, מתחילים לקבל הפרשה של 2 חלבונים אלה בשתן. יחד עם זאת, לא ברור לחלוטין האם העלייה בהפרשת 2 חלבונים אחרונים אלה בשתן, נובעת בלעדית מהפגיעה באבוביות, או שהיא משקפת את הרמות המוגברות שלהם בדם, שיכולות לנבוע מהשפעת רעלנים על איברים שונים פרט לכליות.
עלתה השערה ש-Kim-1 מתפקד כווסת של ספיחה בינתאית, בשעה שתאי האבובית הקריבנית הפגועה שעברו דה-דיפרנציאציה משתקמים, ומשנים את מיקומם לאזורים בממברנת הבסיס (basement membrane) ויוצרים מחדש שכבה אפיתליאלית רציפה. תהליך זה כרוך בביקוע פרוטאוליטי של ה-ectodomain של Kim-1, ושחרור החלק המבוקע לשתן. ה-ectodomain יציב בשתן, וניתן לגילוי באדם, כמו גם במגוון של מודלים נפרו-טוקסיים בחיות. נמצא גם ש-Kim-1 הוא סמן רגיש לנזק כלייתי הנגרם על ידי ציספלטין, וכן על ידי חומצה פולית, כספית, ציקלוספורין ו-S-(1,1,2,2,-tetrafluoroethyl)-L-cysteine.
שיטה מהירה לגילוי KIM-1 בשתן
Vaidya מהצוות המקורי שגילה את KIM-1 במעבדתו של Bonventre, דיווח בשנת 2009 ב-Kidney Int על שיטה מהירה וקלה לביצוע למדידה חצי-כמותית שלKIM-1 בשתן. חוקר זה פיתח שיטה lateral flow immunochromatographic, תוך שימוש ב-RenaStick. דגימות שתן מוכנסות לבארות של פלטת 96 בארות, מעל ממברנה של ניטרוצלולוזה המכילה חלקיקי זהב המצופים בנוגדנים כנגד KIM-1. קומפלקס זה של KIM-1 הנקשר על ידי הנוגדן מתנייד על הממברנה ונוצר מגע עם נוגדן שני באופן שמתקבל צבע אדום, שעוצמתו עומדת ביחס ישר למספר מולקולות KIM-1 הנקשרות לממברנה. התשובה מתקבלת תוך 15 דקות.
הוראות לביצוע הבדיקה
יש להשתמש בדגימת שתן השנייה של הבוקר, ורצוי להשתמש במְשַמרי שתן. יש לשמור את השתן בקירור (יציבות של 6 ימים עם חומרים משמרים, או 3 ימים ללא חומרים משמרים), או בהקפאה (יציבות של 30 יום). הבדיקה מתבצעת בשיטת ELISA או quantitative sandwich enzyme immunoassay technique.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק