הבדלים בין גרסאות בדף "וימנטין - Vimentin"
(←ראו גם) |
|||
| שורה 74: | שורה 74: | ||
{{ייחוס בן עמי}} | {{ייחוס בן עמי}} | ||
| + | [[קטגוריה:בדיקות מעבדה: אימונולוגיה]] | ||
[[קטגוריה:בדיקות מעבדה: כימיה בדם]] | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
[[קטגוריה:בדיקות מעבדה - סמנים סרטניים]] | [[קטגוריה:בדיקות מעבדה - סמנים סרטניים]] | ||
גרסה אחרונה מ־06:31, 29 בספטמבר 2021
| מדריך בדיקות מעבדה | |
| וימנטין | |
|---|---|
| Vimentin | |
| מעבדה | כימיה בדם, אימונולוגיה בדם |
| תחום | תאי סרטן ממוצא מזנכימלי |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
זיהוי תאים מזנכימליים ברקמות בריאות או סרטניות.
המיקרופילמנטים, ה-IFs (או intermediate filaments) וה-microtubules מהווים את שלושת החלבונים השלדיים העיקריים בתאים שאינם תאי-שריר. משפחת חלבוני IF כוללת כ-70 חלבונים באדם, בעכבר וביונקים אחרים ( Hesse וחב' ב-J Cell Sci משנת 2001, ו-Fuchs ו-Weber ב-Annu Rev Biochem משנת 1994). ישנם 6 סוגים עיקריים של IFs הנמצאים בכל תאי הגוף כמו גם בחיידקים (Chang וחב' ב-J Cell Biol), הכוללים את type I ו-type II (קרטינים חומציים ובסיסיים הנמצאים בעיקר בתאי אפיתל, type III שהוא vimentin המופיע בתאים מזנכימליים, type IV שהם נוירו-פילמנטים המצויים בעיקר בנוירונים, type V שהם lamins המופיעים בגרעין התא, ו-type VI שהוא nestin המופיע בנוירונים עובריים. בנוסף לכך, ישנם חלבונים הקשורים ל-IFs (להלן IFAPs) המארגנים את ה-IFs בצרורות וברשתות (networks), הכוללים חלבונים דוגמת plectin, ankyrin, desmoplakin ו-fillagrin (Green וחב' ב-Adv Protein Chem משנת 2005). IFAPs אלה אחראיים לקואורדינציה בין ה-IFs לבין אלמנטים שלדיים ואברונים (organelles) של התא, וביחד הם מייצבים את שלד התא ואת מבנהו תוך שהם מספקים עוצמה לאיברים השונים.
האופי הדינמי של vimentin חיוני בהקניית גמישות לתא, תכונות שלא מוצאים ברשתות של מיקרוטוּבּולי או של actin בתרחישים של עקה מכנית in vivo. נמצא שתאים נטולי vimentin מפגינים רגישות רבה בתרחישים של micropuncture (Eckes וחב' ב-J Cell Sci משנת 2000). Vimentin הוא חלבון בעל משקל מולקולרי של 57 אלף דלטון, ונמנה עם החלבונים המבוטאים ומשומרים ביותר במשפחת החלבונים type III. במהלך התפתחות עוברי עכברים הביטוי של vimentin מתחיל כבר בין הימים 8 ו-9 (Franke וחב' ב-Differentiation משנת 1982), והביטוי שלו במבוגרים מוגבל לתאים מזנכימליים ברקמת החיבור, ל-CNS ולשריר (Larsson וחב' ב-Neurochem Res משנת 2004). Vimentin מבוטא במגוון רחב של סוגי תאים, כולל תאים קודמנים של הלבלב, תאי Sertoli, תאים נוירונליים קודמנים, תאי-ענק טרופובלסטיים, פיברובלסטים, תאי אנדותל בדופן כלי-דם, אבוביות הכליה, מקרופאגים, נויטרופילים, תאי מזנגיום, לויקוציטים ותאי סטרומה בכליה (Cochard ו-Paulin ב-Neurosci J משנת 1984, de Souza ו-Katz ב-Tissue Cell משנת 2001, Ko וחב' ב-Pancreas משנת 2004, Mahrle וחב' ב-J Invest Dermatol משנת 1983, Carter וחב' ב-Transplant Proc משנת 2005, ו-Evans ב-Biassays משנת 1998). Vimentin זכה להערכת חשיבותו הרבה כסמן קנוני של תהליך ה-EMT או epithelial–mesenchymal transition שהוא תהליך בו תאי אפיתל מאבדים את קוטביות התא ואת צורתו ואת יכולת הספיחה שלהם לתאים אחרים, ומקבלים תכונות נדידה וחודרנות על מנת להפוך לתאי גזע מזנכימליים (Thiery ב-Nature Rev Cancer משנת 2002). תהליך EMT זה מאופיין על ידי ביטוי של vimentin בתאי האפיתל, שבאופן נורמלי מבטאים רק keratin. בהתאם, במהלך התהליך ההפוך של EMT, הידוע כ-MET או mesenchymal-epithelial transition, התאים מתחילים לרכוש פנוטיפ אפיתליאלי עם ירידה בביטוי vimentin ויכולת תנועה נמוכה יותר (Chaffer וחב' ב-Cancer Res משנת 2006). ביטוי מוגבר של vimentin דווח בשורות אחדות של תאים סרטניים, וברקמות סרטניות כגון סרטני הערמונית, השד, האנדומטריום, ה-CNS, מלנומה ממאירה, וממאירויות של מערכת העיכול כולל סרטן הלבלב, הכבד והמעי הגס. אך למרות החשיבות שמייחסים ל-vimentin כחלבון השומר על מבנה התאים (Ivaska וחב' ב-Exp Cell res משנת 2007), מסתבר שבמודלים של עכברי knockout המשוללים חלבון זה, הפנוטיפ של עכברים אלה נורמלי ללא פגמים יוצאי-דופן (Colucci-Guyon וחב' ב-Cell משנת 1994), וייתכן שרשת המיקרוטובולי מפצה על חסר vimentin (Ogrodnik וחב' ב-Proc Natl Acad Sci USA משנת 2014). תצפית זו מעידה על כך ש-vimentin אינו קריטי להישרדות של עכברים בתנאים פיזיולוגיים נורמליים. עם זאת, מחקרים עדכניים ומפורטים יותר, הראו שעכברים משוללי vimentin (-/-), הם בעלי כושר מופחת לריפוי פצעים בשלב העוברי והבוגר, בגלל חולשת פיברובלסטים ואיבוד כושר נדידתם (Eckes וחב' ב-J Cell Sci משנת 2000, Eckes וחב' באותו כתב עת משנת 1998, ו-Sarria וחב' ב-J Biol Chem משנת 1992), והם מתו כתוצאה מכשל כליות סופני (Terzi וחב' ב-J Clin Invest משנת 1997), וכן כתוצאה מיכולת מופחתת של התרחבות עורקית, מה שמצביע על יכולת המודולציה של מבנה העורק בתגובה לשינויים בזרימת הדם (Schiffers וחב' ב- Arterioscler Thromb Vasc Biol משנת 2000). בנוסף, לימפוציטים משוללי vimentin הם בעלי יכולת מופחתת להגיע לבלוטות הלימפה ולטחול בתהליך הידוע כ-homing (Nieminen וחב' ב-Nature Cell Biol משנת 2006).
המבנה והרגולציה של vimentin
פוליפפטיד זה מורכב מ-466 חומצות אמינו, ומבנהו כקָנֶה אלפא-סלילוני משומר מאוד המאוגף על ידי מקטעים N ו-C טרמינלים שאינם α-סלילונים (Katsumoto וחב' ב-Cell Biol משנת 1990), המכונים מקטע "ראש" בעל 77 שיירי חומצות אמינו בקצה ה-N טרמינלי, ומקטע "זנב" בעל 61 שיירי חומצות אמינו בקצה ה-C טרמינלי (Goldie וחב' ב-J Struct Biol משנת 2007). בנוסף, ידוע ש-vimentin יוצר הומו-פולימרים והטרו-פולימרים, תכונה שכיחה המשותפת לכל החלבונים במשפחת IF, המיוחסת לנוכחות של המבנה ה-α סלילוני המסייע ליצירת פולימרים יציבים (Goldman וחב' ב-J Cell Biol משנת 1996). מקטעי ה"ראש" של דימר ה-vimentin יוצרים מבנה סימטרי, וזוהו שלושה אתרים המצביעים של הגדלת המרחק בין מקטעי ה"ראש" במצב של פוספורילציה, המייצג מודיפיקציה post-traslational האחראית לרגולציה של הִתְגּוֹדְדוּת או של פירוק הקשר בין מולקולות vimentin (Aziz וחב' ב-J Biol Chem משנת 2002, Eriksson וחב' ב-J Cell Sci משנת 2004, ו-Evans ב-J Cell Biol משנת 1989).
Vimentin משמש מצע מעולה למספר קינאזות in vitro ומספר ניכר של אתרים לפוספורילציה מוקמו על פני מולקולת vimentin (Huang וחב' ב-J Protein Chem משנת 1994, Ando חב ב-Biochemistry משנת 1989, Ando וחב' ב- Biochem Biophys Res Commun משנת 1991, Nakamura וחב' ב-Genes ells משנת 2000, ו-Cheng וחב' ב- J Cell Biochem משנת 2003). פוספורילציה זו משפיעה על תפקוד vimentin בעיקר על משמעותו במסלולי איתות בתא. לדוגמה, protein kinase A (להלן PKA) המזרחן vimentin בעמדות S38 ו-S72, מפחיתה את יצירת פילמנטים in vivo, אם כי סבורים שאין לזרחון זה השפעה על התגודדות פילמנטים אלא על ההיפרדות שלהם. ה-p21-activated kinase (להלן PAK) נמצא מזרחן את vimentin במספר אתרים והוא מעורב ברגולציה של הרה-ארגון המבני של vimentin (Goto וחב' ב-Genes Cells משנת 2000). Aurora B Kinase, בעל תפקיד מפתח ברגולציה של תהליכי מיטוזה, נמצא מזרחן את vimentin במהלך תהליכים ציטו-קינטיים (Goto וחב' ב-J Biol Chem משנת 2003). יתרה מכך, protein phosphatase 2A (להלן PP2A), כרוך עם vimentin ומונע את הפוספורילציה שלו, מה שמצביע על כך של-PP2A תפקיד חשוב בפיקוח על הדינמיקה של IF (Turowski וחב' ב- Mol Biol Cell משנת 1999). נמצא גם ש-vimentin משמש יעד למודיפיקציות post-translational נוספות, הכוללות ציטרולינציה ומודיפיקציה של O-GlcNAc. ציטרולינציה היא מודיפיקציה post-translational, בה שיירים של ארגינין עוברים דה-אימינציה לציטרולין על ידי האנזים peptidylarginine deiminase (van Venrooij ו-Pruijn ב- Arthritis Res משנת 2000). Vimentin נמצא עובר ציטרלינציה במקרופאגים שעוברים אפופטוזיס, ונוגדנים כנגד vimentin שעבר ציטרולינציה נוצרים במצב בו אין הרחקה ראויה של חומר אפופטוטי (Vossenaar וחב' ב- Ann Rheum Dis משנת 2004). O-GlcNAcylation מתבצעת למניעת היפר-פוספורילציה של vimentin בתאי glia, ובכך נשמרת יכולתו לתרום למבנה הקשיח של התא, ולספק שלד לנדידה נוירונלית (Farach ו-Galileo ב-Brain Cell boil משנת 2008).
הגן המקודד ל-vimentin נמצא כיעד לשינויים אפיגנטיים. גן זה ((VIM לעיתים קרובות עובר מתילציה בקרצינומה מתקדמת של המעי הגס ונמצא משמש כסמן אבחוני של סוג סרטן זה תוך שימוש בדגימות נסיוב וצואה (Shirahata וחב' ב-Anticancer Res משנת 2009). זאת ועוד, בטיפול עם מעכב המתילציה 5-aza-deoxycytidine, הביטוי של mRNA של vimentin גדל פי-כמה במספר שורות תאים של סרטן המעי הגס (Zou וחב' ב-Cancer Epidemiol & Biomarkers Prev משנת 2007), מה שמצביע על כך שדה-מתילציה של DNA מספיקה לשפעל את השיעתוק של vimentin בתאי סרטן. כמו כן נמצא שגורם השיעתוק ZBP-89 מגייס את האנזים histone deacetylase 1 (להלן HDAC1) לפרומוטר של vimentin, מה שמפחית את הביטוי של vimentin (על פי Wu וחב' ב-Genes & Cells משנת 2007). השפעה זו בוטלה בנוכחות trichoststin A שהוא מעכב של HDAC1, מה שמצביע על כך שהגן של-vimentin רגיש ופגיע על ידי HDACs ותורם בכך למנגנון של השקטת vimentin. מחקרים אלה מראים שישנם שיש מספר משפעלים או מעכבים אנדוגניים של שיעתוק, המווסתים את ביטוי vimentin בתאים, וגורמים אלה מווסתים את האירועים הכרוכים ב-EMT הנוטלים חלק בתהליך נדידת התאים.
המיקום התוך-תאי של vimentin והייצוא שלו אל פני התא
בתור חלבון מבני של ה-cytoskeleton, היה צפוי ש-vimentin יהיה מוגבל במיקומו לציטוזול של התא, אך מסתבר שחלבון זה נמצא גם בגרעין התא כמו גם בחלקו החיצוני של התא. אפשרות הועלתה שחלבוני IF לא רק משתתפים בתפקידים ציטוזוליים אלא גם מתווכים אירועים המתווכים על ידי DNA ו-RNA בגרעין התא, אך תפקודים אלה היו מסופקים שכן לא היה ברור כיצד vimentin חודר לגרעין (Traub ו-Shoeman ב- Int Rev Cytol משנת 1994). מאוחר יותר הוצע מנגנון חדירה של vimentin לגרעין התא על ידי ssDNA בשיטת "שק קמח" (piggyback) (Hartig וחב' ב-J Cell Sci משנת 1998). נמצא שאזור הזנב של vimentin שגודלו 6,600 דלטון עובר במעטפת הגרעין אינטראקציה עם lamin B ובכך מתאפשרת סדרה רציפה של מגעים בין ה- plasma membrane skeleton לבין שלד גרעין התא (karyoskeleton) של תאים אאוקריוטיים (Georgatos ו-Blobel ב-J Cell Biol משנת 1987). נמצא ש-vimentin ממוקם בגרעין של תאי נוירובלסטומה ומווסת את הביטוי של p21Waf1 הידוע גם כ-,cyclin-dependent kinase inhibitor1 אך מנגנון וויסות זה עדיין אינו ברור (Mergui וחב' ב-BMC Cancer משנת 2010). כפי שצוין למעלה vimentin הוא גם חלבון חוץ-תאי, חלבון זה חסר את הרצף עליו פועל האיתות המאפשר לו להיות מופרש מהתא, אם כי הוצע שהמקטע הטעון חיובית הקצה ה-N טרמינלי של vimentin, העשיר בחומצות אמינו הידרופוביות או אלה עם שייר הידרוקסיל, יכול לכוון את vimentin לממברנת התא, שם הוא נקשר לשכבת הליפידים הכפולה (Peridas וחב' ב-J Biol Chem משנת 1987). ישנם מספר דיווחים נוספים המתארים את הטרנספורט של vimentin אל שטח פני התא. Vimentin שהתגלה על פני תאים קרדיו-מיוציטים ועל פני תאי שריר חלק וסקולריים נקבעו כמהווים 7.5% ו-13% מכלל חלבוני שטח הפנים בשני סוגי תאים אלה, בהתאמה (Ise וחב' ב-Glycobiol משנת 2010). יתרה מכך, צביעה של המשתית החוץ-תאית הראתה מתווה נקודתי, מה שמוכיח שרק פרקציה של vimentin מבוטאת על שטח פני התא. מחקר אחר הראה ש-vimentin מגיב עם β3-integrins ועם plectin, ושני חלבונים אלה מווסתים את הארגון והפיזור של vimentin β3-integrins על שטח הפנים של מספר סוגי תאים (Bhattacharya וחב' ב-J Cell Sci משנת 2009). בנוסף, הוצע תפקיד אפשרי לגיוס של vimentin אל פני התא על ידי β3-integrin, מה שמגביר את יכולת הספיחה של תאים.
Vimentin ואיתות תאים
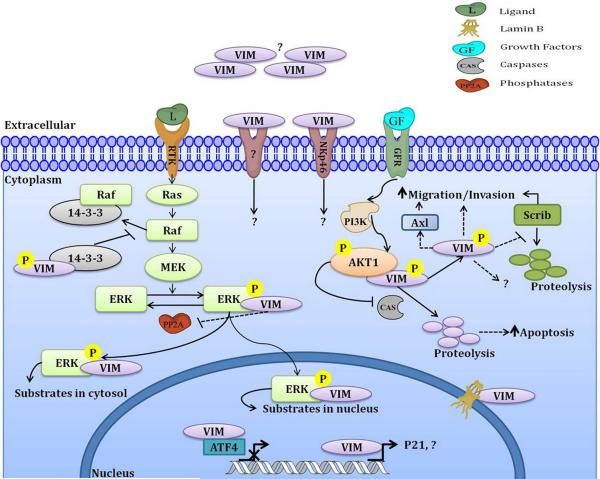
Vimentin מופיע בציטופזמה של תאים מזנכימליים, שם הוא מתפקד בשמירה על הארכיטקטורה התאית. חלבון זה מגיב עם מספר גדול של חלבונים ומשתתף במספר תפקודים תאיים. בנוסף, vimentin מעורב גם במספר תהליכים הקשורים ליצירה של קומפלקסים עם מספר מולקולות איתות תאי. לדוגמה, נמצא ש-vimentin מגיב עם Erk מזורחן (להלן pErk) שהוא MAP kinase, ומגן עליו מפני דה-פוספורילציה (Perlson וחב' ב-J Mol Biol משנת 2006). תוך שימוש במודלים ביוכימיים ומולקולריים, נמצא שקישור vimentin ל-pErk ממוקם במקטע הסלילוני השני של vimentin וקישור זה תלוי בסידן. המסקנה היא ש-vimentin מייצב את pErk על ידי שהוא מגן עליו מפני דה-פוספורילציה ובכך הוא מאפשר ל-pErk לעבור טרנספורט ארוך-טווח בתוך התא. ממצא נוסף הוא ש-AKT1 kinase נמצא נקשר ל-vimentin-מזורחן, ומגן עליו מפני פרוטאוליזה מושרית על ידי caspase, מה שמגביר את תנועתיות התא ולחודרנות של תאי סרקומה. נמצא ש-vimentin מזורחן יכול לעבור אינטראקציה עם חלבון 14-3-3 ולמנוע את ההִתְגּוֹדְדוּת של Raf-14-3-3 עם קומפלקסים אחרים, וכן לווסת את הזמינות של 14-3-3 (על פי Tzivion וחב' ב-J Biol Chem משנת 2000).
חלבוני 14-3-3 התגלו במקור כמולקולות שכיחות במוח (Moore ו-Perez ב-Physiol & Biochem Aspects of Nerve Integr משנת 1968, ומחקרי המשך הוכיחו שהריכוזים הגבוהים ביותר של חלבוני 14-3-3 נמצאים במוח (Boston וחב' ב-J Neurochem משנת 1982), ולמעשה חלבוני 14-3-3 מהווים כ-1% מכלל חלבוני המוח (Martin וחב' ב-J Neurochem משנת 1994, ו-Baxter וחב' ב-Biochem Soc Trans משנת 2002). התפקיד של חלבוני 14-3-3 נחקר באופן נרחב בשל יכולתם המרשימה להשפיע על הפעילות ועל המיקום של חלבוני מצע. בנוירונים, חלבוני 14-3-3 מתפקדים במגוון תהליכים כולל התמיינות, נדידה, הישרדות, הנצה של נויריטים, ובקרה על תעלות ברזל (Berg וחב' ב-Nat Rev Neurosci משנת 2003). בעוד שתפקידיהם הנוירו-פיזיולוגיים אינם ברורים לגמרי, יוחסו לחלבוני 14-3-3 מעורבות במספר מפגעים נוירולוגיים, ונראה שיש להם תפקיד בהגנה מפני מפגעים נוירו-ניווניים (Steinacker וחב' ב-Semin Cell Dev Biol משנת 2011).
חלבון נוסף, Srcrib, קשור לתנועתיות של התא, והוא מוגן מפני דגרדציה בפרוטאזום על ידי האינטראקציה עם vimentin, שמגבירה את יכולת Scrib לסייע לכושר הנדידה של התא ואת החודרנות שלו לרקמות סמוכות (Phua וחב' ב-Mol Biol Cell משנת 2009). נתון אחר הוא ש-vimentin פוגע בהתמיינות של אוסטאובלסטים לא-בשלים, על ידי האינטראקציה שלו עם activating transcription factor 4 (להלן ATP4) (Lianet וחב' ב-J Biol Chem משנת 2009). כמו כן נמצא ש-vimentin משמש כרגולטור של AxI ובכל הוא מגביר את נדידת התא (Vuoriluoto וחב' ב-Oncogene משנת 2010). זאת ועוד, השינויים ב-EMT המושרים על ידי Slug ו-Ras תלויים אף הם בהגברת הפעילות של vimentin.
נויטרופילים העוברים אפופטוזיס באופן ספונטני, נמצאו מבטאים vimentin ו-lamin B1 על שטח פני תאים אלה (Moisan ו-Girard ב-J Leukoc Biol משנת 2006), מה שפותח את האפשרות שתאים אלה משתתפים בהתפתחות נוגדנים עצמיים בנסיוב, מצב הכרוך לעיתים קרובות במספר מפגעים דלקתיים (Kurki ו-Virtanen ב-J Immunol Methods משנת 1984). הודגם ש-vimentin עובר פוספורילציה במקרופאגים משופעלים, מה שמביא לביטויו על פני תאים אלה לסיוע בהריגת חיידקים, וליצירה של מטבוליטים חמצוניים (Mor-Vaknin וחב' ב-Nat Cell Biol משנת 2003). מחקר זה מצא קשר מוגבר של vimentin עם הרטיקולום האנדופלסמטי ועם Golgi, מה שמצביע על כך ש-vimentin מופרש לסביבה החוץ-תאית. הפרשה זו של vimentin נחסמת על ידי נוכחות של monesin החוסם של Golgi, כמו גם על ידי חוסם הגליקוזילציה tunicamycin. זאת ועוד, הציטוקין הדלקתי IL-10, נמצא חוסם את הפרשת vimentin על ידי עיכוב PKC, בעוד שהציטוקין מקדם הדלקת TNFα דווקא מחיש את הפרשת vimentin. במחקר אחר תוך שימוש באנליזה על ידי מס-ספקטרומטריה, התגלה ש-vimentin המופרש משטח הפנים של מונוציטים מודבקים עם M. tuberculosis, משמש כליגנד הנקשר לקולטנים של NKp46 על תאי natural killer (על פי Garg וחב' ב-J Immunol משנת 2006). קישור זה תורם להכרה של המונוציטים המודבקים על ידי תאי NK. נמצא שקישור זה ספציפי ביותר ל-vimentin המופרש ולא ל-vimentin התוך תאי. אף על פי שהקולטנים ל-NKp46 מאוד ספציפיים לתאי NK, הביטוי שלהם מדווח גם במספר תאי סרטן (Srivastava ו-Srivastava ב-Leuk Res משנת 2006).
דיווח הראה שהנוגדן החד-שבטי SC5, מזהה באופן ספציפי את ה-vimentin המופרש משטח הפנים של תאי Sezary, או מפני תאי T נורמליים משופעלים (Huet וחב' ב-J Immunol משנת 2006). בנוסף, הוצע על ידי חוקרים אלה שנוכחות נוגדנים עצמיים כנגד vimentin בנסיוב של חולי Sezary, עשויים לשמש סמנים מעולים של מחלה זו בנוסף להיותם סמנים פרוגנוסטיים. יש אפשרות ש-vimentin מופרש קשור לשטח הפנים של תאי סרטן, מזוהה על ידי קולטני NKp46, הממוקמים על פני תאי NK אך מדוכאים במנגנונים שונים, וכך פעולת ההרג של תאי הסרטן נחלשת (Uchida וחב' ב-Br J Cancer משנת 1984, ו-Ashiru וחב' ב-Cancer Res משנת 2010).
Vimentin וסרטן הערמונית
בסרטן הערמונית, הביטוי של vimentin מתגלה בעיקר בתאים סרטניים בדרגת התמיינות נמוכה, ובגרורות של תאים אלה לעצמות, אך כמעט לא ניתן לגילוי בתאי סרטן בדרגת התמיינות גבוהה או ממוצעת (Zhao וחב' ב- Cell Biochem Funct משנת 2008, ו-Lang וחב' ב-Prostate משנת 2002). בנוסף, הביטוי של vimentin היה כרוך בדרגת התנועתיות של תאי סרטן הערמונית, באופן שביטוי נמוך יחסית שלו בתאי PC-3 הביא לירידה בדרגת התנועתיות והפולשנות של תאים אלה. כאשר ביטלו באופן ניסויי את ביטוי-היתר של vimentin בתאי סרטן הערמונית מסוג CL1 שהם פולשנים באופיים, נמצאה ירידה משמעותית בפולשנות שלהם (Singh וחב' ב-Cancer Res משנת 2003). במחקר אחר נמצא ביטוי-יתר של vimentin בתאים אפיתליאליים של סרטן הערמונית הידועים כ-PC-3M-1E8, שהם תאים מאוד גרורתיים, והתפקיד של vimentin במודולציה של הגרורתיות יוחס ליכולתו לגרום לרגולציה של הקומפלקס E-Cadherin/β-catenin דרך רגולציה של C-src (Wei וחב' ב- Anticancer Res משנת 2008). מחקרים נוספים תומכים בדעה ש-vimentin מבוטא ביתר בתאי סרטן ערמונית ותורם לחודרנות ולממאירות של תאים אלה (Wu וחב' ב-Proteomics משנת 2007, ו-Sethi וחב' ב- Am J Transl Res משנת 2013).
Vimentin וסרטן מערכת העיכול
סרטני מערכת העיכול כוללים סרטני הקיבה, המעי הדק, המעי הדק והחלחולת, הכבד והלבלב. בסרטני הקיבה, הביטוי של vimentin היה כרוך בפנוטיפ יותר אגרסיבי של קרצינומה של הקיבה, והוצע כמשחק תפקיד חשוב בתהליך הגרורתי של סרטן זה (Fuyohiro וחב' ב- Anticancer Res, ו-Takemura וחב' ב-Pathobiol משנת 1994). אנליזה של קרצינומה של תאי הקשקש בוושט במטופלים עם ביטוי תאי של vimentin מצביעה על עלייה משמעותית בגרורות לבלוטות הלימפה (Jin וחב' ב- Biomed Res משנת 2010). ב- Hepato-cellular carcinoma (להלן HCC), הביטוי של vimentin היה בולט בעיקר בצורה הגרורתית של המחלה (Hu וחב' ב-Oncogene משנת 2004). גם בגידולים קטנים של HCC (בקוטר של מתחת 2 ס"מ) ניתן היה לגלות vimentin בנסיוב (Sun וחב' ב- J Proteome Res משנת 2010). לעומת זאת, מחקר אחר מצא שביטוי-יתר של vimentin ב-HCC, הפחית את השגשוג של תאי סרטן אלה ואת כושר הפולשנות שלהם בתנאי in vitro (Li וחב' ב- Zhonghua Zhong Liu Za Zhin משנת 2008). בסרטן המעי הגס והחלחולת, המתילציה של הגן המקודד ל-vimentin זוכה לתשומת לב רבה ויש המוצאים אותה לעיתים מזומנות בשלב המתקדם של סרטן המעי הגס והחלחולת (Zou וחב' ב-Clin Chem משנת 2007, ו-Chen וחב' ב- J Natl Cancer Inst משנת 2005).
ניתן לרתום ממצאים אלה על מנת לפתח שיטות טכניקות מאוד רגישות לזיהוי מתילציה של הגן המקודד ל-vimentin בדגימות קליניות כולל נסיוב וצואה. יהיה מעניין לדעת האם המתילציה של גן זה, עשויה לשמש סמן לנבא את תחילת התהליך הסרטני הראשוני במעי הגס או את הישנות התהליך הזה לאחר פרק זמן של רמיסיה. ביטוי-יתר של vimentin בסרטן המעי הגס והחלחולת כרוך בעיקר עם מרכיב הסטרומה בפיברובלטים, בתאי אנדותל בכלי דם קטנים, ובלימפוציטים שעברו הסננה לתוך הגידול (von Bassewitz וחב' ב- Pathol Res Pract משנת 1982, ו-Ngan וחב' ב-Br J Cancer משנת 2007, וMcInroy- ו- Maatta ב-Biochem Biophys Res Commune משנת 2007).
כאשר הפחיתו יצירת vimentin על ידי siRNA ספציפי לחלבון זה, פחתה הפולשנות של תאי סרטן המעי הגס והחלחולת (McInroy ו-Maatta ב- Biochem Biophys Res Commun משנת 2007). כמו כן נמצא שהפחתת ביטוי vimentim ב-70% הספיקה להפחית את כושר הנדידה והפולשנות של תאי קרצינומה של המעי הגס. בעוברים של מכרסמים נמצא שביטוי של vimentin בתאי תעלות הלבלב החל בין הימים 12–13 של ההתפתחות העוברית, והגיע לשיאו מיד לאחר הלידה, כנראה בגלל העלייה הסימולטנית בביטוי TGF-β במהלך תקופה זו (Wu וחב' ב-Biochim Biophys Acta משנת 2007, ו-DiBellaet וחב' ב-J Histochem Cytochem משנת 2009). בסרטן הלבלב רמת vimentin הייתה גדולה פי-3 בהשוואה לסוגי סרטן אחרים, ואיזופורם ספציפי של vimentin אף היה מוגבר פי-5–10 עם הופעה של נוגדנים עצמיים כנגד איזופורם זה בנסיוב, ואף הוצע שנוגדנים אלה עשויים לשמש סמנים לאבחון מוקדם של סרטן הלבלב (Hong וחב' ב-Biomark Insights משנת 2006). נמצא ש-TGF-β מבוטא ביתר בתאי סרטן הלבלב, והוא אף מווסת את הביטוי של vimentin בתאי Panc-1 (על פי Yin וחב' ב- Med Sci משנת 2006). בנוסף, נמצא ש-vimentin מגביר את הפוטנציאל הגרורתי של תאי סרטן הלבלב, ופוטנציאל זה פחת בנוכחות siRNA ספציפי של vimentin (על פי Walsh וחב' ב-Proteome Sci משנת 2009).
סרטן השד
הביטוי של vimentin נמצא מוגבר במספר שורות תאים של סרטן שד אגרסיבי (Gilles וחב' ב-cancer Res משנת 2003), וביטוי יתר זה נמצא במתאם עם כושר נדידה וחודרנות מוגבר של תאי סרטן השד (Korsching וחב' ב- Brain Cell Biol משנת 2006). יתרה מכך, תאי סרטן שד מסוג NCF-7 הנחשבים לא גרורתיים, מציגים תכונות של תנועתיות וגרורתיות בביטוי-יתר של vimentin, ותכונות אלו דוכאו על ידי antisense oligos של vimentin בתאי MDA-MB-231, המבטאים vimentin באופן קונסטיטוטיבי. vimentin מבוטא ביתר בתאי MCF-10A, ומקנה לתאים אלה פוטנציאל גרורתיות בתלות ב-EGF. בחינה היסטולוגית של דגימות מתאי קרצינומה של השד, הראתה שהביטוי של vimentin מופיע בעיקר בתאי ductal carcinoma בדרגה גבוהה, עם רמות נמוכות של קולטנים לאסטרוגן (Domagala וחב' ב- Am J Pathol משנת 1990). מחקרים נוספים מדווחים על ביטוי-יתר של vimentin בתאים וברקמות הנגועות בסרטן (Kokkinos וחב' ב-Cell Tissue Organs משנת 2006). מחקרים עדכניים מדווחים על תפקיד מרכזי של vimentin בתהליך EMT של סרטן השד ובוויסות של Axl וכן בעידוד של כושר הנדידה של תאי סרטן השד המושרה על ידי Slug ו-Ras (על פי Vuoriluoto וחב' ב-Oncogene משנת 2011).
Vimentin וסוגי סרטן נוספים
ביטוי-יתר של vimentin נמצא במספר סוגי סרטן כולל סרטן פי-הרחם (Giles וחב' ב-J Pathol משנת 1996), Clear renal cell carcinoma (Williams וחב' ב-BMC Clin Pathol משנת 2009), מספר סוגי לימפומה (Gustmann וחב' ב-Am J Pathol משנת 1991), קרצינומה פפילרית של התירואיד (Yamamoto וחב' ב-Cancer משנת 1992), וקרצינומה של האנדומטריום (Coppola וחב' ב-Hum Pathol משנת 1998). בסרטן הריאות, הביטוי של vimentin התגלה באדנוקרצינומה בדרגת התמיינות מתונה או גבוהה, וכן ב-giant cell carcinoma (על פי Upton וחב' ב-Am J Surg Pathol משנת 1986). בסרטן ריאות מסוג NSCLC, ביטוי-יתר של vimentin נמצא מנבא בלתי-תלוי של הישרדות גרועה מטופלים לאחר ניתוח להרחקת הגידול (Al-Saad וחב' ב-Br J Cancer משנת 2008). מחקר אחר הראה ש-glycosylated vimentin היה ירוד בכמותו באדנוקרצינומה של הריאות, והוצע לייצג סמנים תפקודיים חדשים לאבחון וטיפול של סרטני ריאות (Rho וחב' ב-Protein J משנת 2009). יתרה מכך, נמצא ש-vimentin מבוטא באופן דיפרנציאלי בשורות תאי סרטן ריאות, ו-PARP-1 (או Poly(ADP-ribose) polymerase-1) נמצא בעל יכולת להיקשר למקטע הפרומוטר של vimentin, ולהשרות את ביטויו בתאי סרטן ריאות (Chu וחב' ב-Am J Physiol Lung Cell Mol Physiol משנת 2007). לאור כל נתונים אלה, vimentin אינו רק כלי אבחוני לזיהוי סרטן, אלא גם עשוי לשחק תפקיד בהתפתחות המחלה ובהתקדמותה. אף על פי שהביטוי שלו מודגש יותר בתהליך EMT, נראה שחשיבות ביטוי היתר היא בתהליכי נדידה וחודרנות, לעומת האטה בנדידה במצב של knock-down של vimentin בתאי סרטן in vitro (על פי Li וחב' ב-J Exp Clin Cancer Res משנת 2010).
מלנומה ממאירה
תוך שימוש באנליזה פרוטאומית על מגוון רחב של דגימות מלנומה, נמצא שביטוי-יתר של vimentin בגידולים ראשוניים לא רק משמש כסמן אבחוני, אלא גם כמנבא של גרורות המטוגניות (Li וחב' ב-J Exp Clin (Cancer Res. ממצא זה אושר גם במחקרים נוספים (Chu וחב' ב-Am J Pathol משנת 1996, Hendrix וחב' ב-J Natl Cancer Inst משנת 1992, Ben-Ze'ev ו-Raz ב-Cancer Res משנת 1985, ו-Caselitz וחב' ב-Virchows Arch A Pathol Anat Histopathol משנת 1983).
גידולים של המוח
במוח נורמלי של אדם, ביטוי מתון עד חזק של vimentin מופיע בדרך כלל בתאים אפנדימליים, ב-choroid plexus, בתאים מנינגיאליים, ובשכבה הגרנולרית הסובפיאלית (subpial granular layer), בעוד שביטוי חלש של vimentin נמצא בתאים אנדותליאלים (Yamada וחב' ב-Acta Neuropathol משנת 1992). הביטוי של vimentin בתאי glioma נמצא תלוי בצפיפות התאית ובטיפול כימי/קרינתי, וביטויו היה בולט בעיקר בתאים בתרבית בצפיפות נמוכה (Trog וחב' ב-Amino Acids משנת 2008). זאת ועוד, בתאי גליובלסטומה, galectin-1 נמצא מווסת את PKCε ואת נדידת integrin β1 המתווכת על ידי vimentin החיוניים להעצמה של הממאירות של glioblastoma (Fortin וחב' ב-Brain Pathology). בגידולים מסוג meningioma, יש ביטוי של צורה ספציפית של vimentin מזורחן, הכרוכה עם גידול לא חודרני, בהשוואה לגידולי מנינגיומה חודרניים (Bouamrani וחב' ב-(PLos One, וצורה זו של vimentin משפיעה כנראה על פוטנציאל הנדידה של גידולי מנינגיומה ועל ההתמיינות של סוגי מנינגיומה שונים. ביטוי של vimentin התגלה גם בגידולים מסוג schwannoma ו-neurofibroma(Kawahara וחב' ב-Am J Surg Pathol משנת 1988).
הוראות לביצוע הבדיקה
הבדיקה בעיקרון מתבצעת על ידי צביעה אימונו-היסטוכימית של הרקמה. מועדפים 2 זכוכיות נושא טעונות חיובית (75X25X1 מ"מ), כאשר עובי הרקמה הנבדקת 4 מיקרון. מתקבל block של רקמה שעבר קיבוע בפורמלין, ותהליך embedding בפרפין. יש לפסול דגימה רובה או קפואה, משטח ציטולוגי, רקמה שלא קובעה בפורמלין, דגימה שלא עברה embedding בפרפין, זכוכיות נושא לא-טעונות או זכוכיות נושא ProbeOn. מועדפת דגימה הנשלחת בטמפרטורת החדר או בקירור. רצוי להשתמש בדגימות שלא עבר פרק זמן של 6 שבועות, מאז ביצוע ה-embedding בפרפין.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק