מחלות עיניות ממאירות - Eye neoplasms
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מחלות עיניות ממאירות | ||
|---|---|---|
| Eye neoplasms | ||
| שמות נוספים | חידושים באונקולוגיה של העיניים | |
| יוצר הערך | ד"ר ויקטוריה (ויקי) וישנבסקיה-דאי 
|
|
תחום האונקולוגיה של העין עוסק באבחון חולים הסובלים מגידולים של העין ומערכת הראייה, ובכלל זה עפעפיים, שטח פני העין, גלגל העין והארובה, ובטיפול בהם.
בארץ ישנם שני מרכזים מוכרים על ידי משרד הבריאות כמתמחים באונקולוגיה של העין, בהדסה עין כרם ובשיבא. אולם צוות רחב של רופאי עיניים המתמחים בתחומים כמו אוקולופלסטיקה, מקטע קדמי, נוירואופטלמולוגיה ועוד, נוטלים חלק בטיפול בחולים הסובלים ממחלות אונקולוגיות של העיניים.
מכיוון שסקירה אחת צרה מלהכיל את כל המחלות שתחום זה עוסק בהן, בחרתי במאמר זה להתמקד בגידולי עיניים תוך עיניים ממאירים.
גידולם ממאירים תוך עיניים הם נדירים מאוד. ככלל, היעדים הטיפוליים בחולים הסובלים מגידולים אלו הם הצלת חיים במקום ראשון, ובהמשך הצלת העין והראייה. שיטות טיפול חדשות שתפורטנה בהמשך, מאפשרות עמידה מצוינת ביעדי טיפול אלו, תוך עלייה בשיעור החולים הזוכים, נוסף על הצלת החיים, גם בשימור העין החולה, ואף בשימור הראייה בה.
מטרת סקירה זאת היא להביא את החידושים באבחון, בטיפול ובמעקב אחר גידולי עיניים ממאירים תוך עיניים במבוגרים ובילדים.
מלנומה של הענביה - Uveal Melanoma
הקדמה
הגידול התוך עיני הראשוני הממאיר השכיח ביותר במבוגרים הוא מלנומה של הענביה (Uveal Melanoma). גידול זה מקורו בתאים המלנוציטים של הענביה. ההיארעות (Incidence) של גידול זה היא כשישה עד שמונה מקרים חדשים למיליון. מדי שנה בשנה מטופלים בישראל כ-45 חולים חדשים הסובלים מהמחלה.
האתיולוגיה של התפתחות הגידול אינה ברורה. גורם הסיכון החשוב ביותר להתפתחות המחלה הוא צבע גוף (Complexion) בהיר וצבע עיניים בהיר. אף שקיימת אסוציאציה לחשיפה לאור, לא הוכח קשר אתיולוגי לחשיפה לאור UV.
האבחון של המחלה הוא קליני, ועל פי רוב אקראי. הגילוי נעשה בבדיקת עיניים שגרתית, ולעתים בשל תלונה של החולה על הפרעה בראייה.
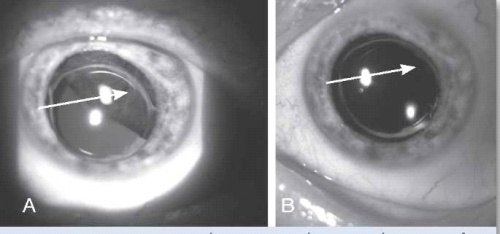
בבדיקה של החולה תתגלה מסה, לרוב מלנוטית, בענביה, שיכולה להיות ממוקמת אנטומית בחלק הקדמי של העין (בקשתית - Iris) או בחלקים האחוריים של העין (בגוף הסיליארי - Ciliary Body או בכורואיד - Choroid) (ראו צילומים 1 ו-2). גידולים גדולים יכולים לערב שני אזורים אנטומיים, ולעתים אף את כל השלושה.
אישוש האבחנה נעשה באמצעות בדיקת אולטרא-סאונד של העין הנגועה. אחוז הטעות בדיוק באבחנה של מלנומה של הענביה הוא רק 0.3% על פי ה-Collaborative Ocular Melanoma Study (COMS Study) [1]
למיקום האנטומי של הגידול יש משמעות פרוגנוסטית.
מלנומה של הקשתית מהווה כ-5% מכלל המלנומות של הענביה, גידול זה נחשב פחות אגרסיבי ביולוגית. במעקב ארוך טווח נמצא שמלנומה של הקשתית נוטה לשלוח גרורות רק ב-3%, ב-5% וב-10% במעקב של חמש שנים, עשר שנים ועשרים שנה בהתאמה.[2]
מלנומה של הגוף הסיליארי היא לרוב א-סימפטומטית. גידול זה מהווה כ-10% מכלל המלנומות של הענביה. בשל מיקומו החבוי מאחורי הקשתית, הגילוי של המחלה נעשה בדרך כלל רק בשלבים מתקדמים. מלנומה של הגוף הסיליארי נחשבת לאגרסיבית מבין המלנומות של הענביה.
מלנומה של הכורואיד מהווה כ-5% 8 מכלל המלנומות של הענביה, כ-50%-30% בממוצע מכלל החולים עם מלנומה כורואידלית ימותו תוך עשר שנים מאבחון מחלתם משנית למשלוח גרורות.[3]
טיפול
כאמור היעדים הטיפוליים בחולים הסובלים מגידולים אלו הם הצלת חיים במקום ראשון, וכשאפשר גם הצלת העין והראייה. בחירת שיטת הטיפול המתאימה נסמכת על פרמטרים התלויים בגידול (כגון מיקום וגודל) וגם על נתוני החולה (מצב כללי, גיל ועוד).
אמצעי הטיפול המצויים בידינו היום מגוונים, וכוללים:
ברכיתרפיה (Brachytherapy)
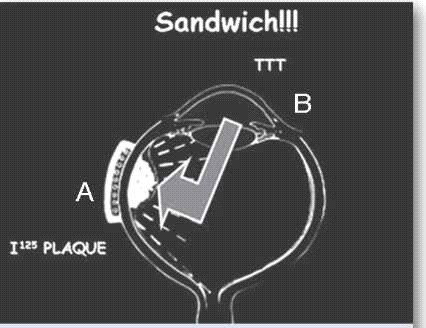
הקרנה סלקטיבית של העין באמצעות לוחית מתכת (פלאק) המונחת על פני לובן העין (Sclera) ומשחררת קרינה רדיואקטיבית לתוך חלל העין, ישירות על בסיס הגידול (ראו ציור 1). הטיפול נעשה בשני ניתוחים עוקבים. בניתוח הראשון הלוחית מקובעת ללובן העין, ובניתוח השני מוסרת ממקומה.
המקורות לקרינה הרדיואקטיבית שונים ויכולים להיות רדון, זהב, קובלט 60, אירידיום 192, פלדיום 103, רוטניום 106 ויוד 125.
מחקר Collaborative Ocular Melanoma Study (COMS) היה מחקר רנדומלי, כפול סמיות, שנערך בארבעים מרכזים מובילים בארה"ב ובשני מרכזים בקנדה, וכלל 8,712 חולים עם מלנומה של הענביה. הוא בדק הבדל בשיעור התמותה בין חולים שטופלו באמצעות עקירה של העין הנגועה (Enucleation) לאלו שטופלו בברכיתרפיה באמצעות פלאק רדיואקטיבי, כשהחומר הפעיל היה יוד 125. במחקר זה לא נמצא הבדל בשיעור התמותה בין שתי הקבוצות.
בניגוד לאנוקלאציה, יתרונו של הטיפול בברכיתרפיה הוא היכולת לשמר את העין, ובחלק מן המקרים גם לשמר חלק מהראייה, מבלי לסכן את חיי החולה. הפלאקים הנפוצים היום הם רוטניום 106 ויוד 125.
לוחיות הרוטניום נפוצות בשימוש נרחב יותר באירופה. הן מגיעות מוכנות מהיצרן, כשכל שטח פני הלוחית פולט קרינה. התאמת הקרינה לגידול מתבססת על מדידת קוטר הבסיס. משך הטיפול נקבע על פי עובי הגידול ועל פי קצב דעיכת החומר הרדיואקטיבי בלוחית, וכך קורה שמשך הטיפול בחולים המטופלים בלוחיות ישנות יחסית, ארוך יותר. הרוטניום פולט אלקטרונים (קרינת בטא) בטווח חדירה קצר, ולכן על פי הוראות היצרן אין להשתמש בו בגידולים גדולים בעובי של מעל 6-5 מ"מ. במרכזים שבהם נעשה שימוש בלוחיות רוטניום בטיפול בגידולים גדולים, מדווחים על אחוזי הישנות של כ-23%, עובדה המרמזת אולי על שליטה סוב אופטימלית בגידול.[4]
הקונספט שעליו בנויים פלאקים של יוד 125 שונה. מדובר בתבניות זהב בקוטר משתנה, המותאמות בדיוק רב על פי תוכנת מחשב מתקדמת לקוטר, לעובי ולצורה המדויקת של הגידול בעינו של המטופל (Custom Designed Plaque). הטיפול מאפשר מתן מינון קרינה המתאים להשגת שליטה מלאה על הגידול, תוך הימנעות ממתן קרינה עודפת לאזורי רשתית בריאים בעין. עובדה המסייעת בשימור הראייה העתידית של העין שטופלה. פלאקים מסוג זה מצויים בשימוש נרחב בארה"ב ובאירופה ובארץ בשיבא. השימוש בשיטה זאת נסמך כאמור על תוצאותיו של מחקר COMS שהוכיח את יעילותה ואת בטיחותה של שיטת הטיפול.
סיבוכי הטיפול בברכיתרפיה הם רטינופתיה קרינתית, נוירופתיה אופטית קרינתית, התפתחות ירוד, ולעתים התפתחות גלאוקומה משנית. סיבוכים אלה מופיעים בדרך כלל כשנתיים לאחר ההקרנה. זיהוי מוקדם של הסיבוכים וטיפול מתאים מאפשר לשמר את הראייה במצבים שבהם הגידול הראשוני אינו מערב את מרכז הראייה (Macula) או את עצב הראייה.
TTT) Transpupillary Thermotherapy)
בגידולים אחוריים מסוימים נהוג להוסיף חימום של הגידול, בדרך כלל באמצעות טיפול בלייזר Diode, כטיפול אדג׳ובנטי לברכיתרפיה. זהו לייזר המרכז קרן אור אינפרה אדום באורך גל 810 ננומטר ישירות על תאי הגידול, ומחמם את התאים לטמפרטורה של 60-45 מעלות. אפשר להשתמש בשיטה זו בחדר הניתוח או כטיפול במרפאה לאחר הרחבת אישונים והקרנה דרך האישון הרחב. הנזק התרמי בשילוב עם הנזק הקרינתי מסייעים להשגת שליטה טובה יותר על הגידול התוך עיני, מבלי להוסיף נזק סביבתי לרשתית התקינה סביב הגידול. שילוב של שתי שיטות הטיפול הוריד את אחוזי ההישנות ל-3% בלבד במעקב של חמש שנים על פי Shields וחברים[5] (ראו ציור 1).
שיטת טיפול זאת יכולה לשמש כשיטת טיפול יחידה בגידולים קטנים נבחרים (בעובי מתחת ל-3 מ"מ) שאינם ממוקמים במרכז הראייה או על פני עצב הראייה.
הקרנה חיצונית ממוקדת
במלנומות של הענביה שאינן מתאימות לטיפול בברכיתרפיה (בשל מיקום המקיף את עצב הראייה או בשל גודלן), אפשר לעתים לטפל באמצעות הקרנה חיצונית ממוקדת מטרה בכמה שיטות:
- Stereotactic Radio Surgery
- זו היא שיטה של הקרנה חיצונית ממוקדת מטרה, היכולה להתבצע באמצעות כמה טכנולוגיות:
- מאיץ קווי LINAC) Linear Accelerator) - בשיטה זאת משתמשים במאיץ קווי של קרני X למיקוד מדויק של הקרינה למסה הגידולית. לטיפול ארבעה שלבים: קיבוע מסגרת סטראוטקטית סביב גולגולת המטופל; הדמיה מוחית; תכנון הקרינה על פי ההדמיה וההקרנה. לצורך ביצוע ההקרנה יש צורך בהרדמה רטרובולברית המספיקה בדרך כלל לקיבוע גלגל העין במשך הטיפול. הקרנה זו היא בעלת דיוק רב עם פגיעה מינימלית ברקמה הבריאה, ובשל כך מתאימה מאוד להקרנה של גידולים תוך עיניים. אחוז סיבוכי הקרינה בטווח המיידי נמוך מהקרנה חיצונית שאינה ממוקדת (External ERBT - Beam Radiotherapy), אך גבוה מברכיתרפיה. השיטה מצויה בשימוש בתל השומר כטיפול במלנומה של הענביה משנת 2009, ותוצאותיה מעודדות מאוד.
- GKR) Gamma Knife) - GKR הוא מכשיר המכיל יותר מ-200 מקורות של קובלט רדיואקטיבי הממוקדים במסה הגידולית. גם כאן הטיפול כולל ארבעה שלבים: קיבוע מסגרת סטראוטקטית סביב גולגולת המטופל; הדמיה מוחית; תכנון הקרינה והקרנה.
- PBT) Proton Beam Radiotherapy)
- הקרנה של חלקיקים טעונים (פרוטונים) לרקמה הגידולית. חלקיקים אלו גורמים לנזק בדנ"א ולמות התא. רוב האנרגיה של חלקיקים אלו מתפרקת בסוף טווח הקרן (Bragg Peak Effect), כך שאפשר לווסת את עוצמת הקרינה ולהימנע מנזק לרקמה. טיפול זה אינו דורש פרוצדורות ניתוחיות, אינו תלוי בתכונות הגידול ודורש רק שני טיפולים. הסיבוכים כוללים כוויה לעפעף, מדרוסיס (אובדן ריסים), נאווסקולריזציה של הקשתית, גלאוקומה נאווסקולרית, קטרקט, וכן נזקי קרינה לרשתית ולעצב הראייה ופפילופתיה הקרנתית.
הרחקה כירורגית של הגידול (Resection of the Tumor)
במרכזים שונים בעולם מבצעים פרוצדורות כירורגיות שונות המאפשרות הרחקה של הגידול דרך חתכים חיצוניים בלובן העין (Sclera) או דרך חלל הזגוגית (Vitreous) בעזרת מכשור ייעודי. שיטות אלו אינן מצויות בשימוש נרחב, וברוב המקרים הן מלוות בטיפול משלים בקרינה, לרוב ברכיתרפיה.
עקירה (Enucleation)
אחוז קטן של עיניים עם מלנומה מתקדמת מטופלות גם היום באנוקלאציה. כירורגיה נכונה עם שיקום טוב מאפשרים התאמה של פרוטזה אסתטית בהמשך, המאפשרת תפקוד עתידי טוב.
פרוגנוזה
שיטות הטיפול שתוארו מאפשרות השגת שליטה מקומית טובה על הגידול הראשוני עם פרופיל בטיחותי טוב. אולם על פי דיווח מספר 26 של ה-25% COMS ו-34% מכלל החולים ישלחו גרורות במעקב של חמש ועשר שנים בהתאמה. המקום השכיח ביותר להופעת גרורות הוא הכבד (90%-80%) ואחריו הריאות, ובשכיחות נמוכה מאוד גם המוח והעצמות.[3]
על פי דיווח מספר 28 של COMS התמותה הכוללת מגרורות בחולים עם מלנומה של הענביה היא כ-11% בחמש שנים, 18% בעשר שנים, וכ-30% ב-15 שנים מהאבחנה.6 מרגע גילוי הגרורות אחוזי התמותה הם 80% בשנה הראשונה ו-94% בשנה השנייה מהאבחנה.[6]
מכיוון שעדיין לא נמצא טיפול יעיל בגרורות ממלנומה של הענביה, אחוזי התמותה של חולים אלו לא השתנו בחמישים השנים האחרונות, למרות השיפור הניכר בשיטות הטיפול בגידול הראשוני. לכן אלו הם כיווני המחקר המובילים בתחום היום.
- הגורמים הפרוגנוסטיים המנבאים משלוח גרורת עתידיות בחולים עם מלנומה של הענביה
- גורמים קליניים:
- גודל הגידול - Shields וחברים בדקו את הסיכון למשלוח גידולים משניים כפונקציה של עובי הגידול הראשוני ב-8,033 חולים עם מלנומה של הענביה. במאמרם נמצא כי במעקב של עשר שנים נמצאו גרורות ב-6% מהחולים עם גידול בעובי 1-0 מ"מ, ב-12% מהחולים עם גידול בעובי 3-1.1 מ"מ, ב-16% מהחולים עם גידול בעובי 4-3.1 מ"מ, ב-28% מהחולים עם גידול בעובי של 6-5.1 מ"מ וב-51% מהחולים עם גידול בעובי גדול מ-10 מ"מ[7]
- מיקום אנטומי של הגידול - כאמור מלנומה של הקשתית היא בעלת הפקטור הפרוגנוסטי הטוב ביותר, ומלנומה של הגוף הסיליארי הרע ביותר[8], [9]
- נתוני המטופל - גיל מבוגר ומין זכר הם פקטורים פרוגנוסטיים רעים[8]
- גורמים היסטופתולוגיים:
- נוכחות של תאים אפיתליואידיים בפרפרט ונוכחות של תבניות כלי דם ייחודיות (Vascular Closed Loops or Vascular Networks) הם גורמים מנבאים למשלוח גרורות מוקדם. יש לציין שמכיוון שרוב המלנומות של הענביה מטופלות היום בקרינה, מדדים היסטופתולוגיים הפכו לפחות רלוונטיים ברוב המטופלים, ומשמשים מדד להערכה של הסיכון למשלוח גרורות עתידיות רק במצבים שבהם הגידול עובר הסרה כירורגית או כאשר מבוצעת עקירה של העין עם הגידול[8], [9], [10]
- גורמים ציטוגנטיים:
- בשנים האחרונות נמצא כי אפשר לנבא את ההסתברות להתפתחות גרורות על פי הציטוגנטיקה של הגידול הראשוני. גידולים הנוטים לשלוח יותר גרורות נושאים שינויים כרומוזומליים. מונוזומיה של כרומוזום 3 או אבדן ההטרוגניות של כרומוזום 3 (Loss of Heterozygosity) נחשבים לפקטור הפרוגנוסטי הרע החשוב ביותר. תוספת של הזרוע הארוכה של כרומוזום 8 (8q Gain) ואבדן של הזרוע הקצרה של כרומוזום 6 (6p Loss) נחשבים גם הם לפקטור פרוגנוסטי רע.
- בסדרה של 452 חולים שעברו עקירה של העין בשל מלנומה כורואידלית, בקרב חולים שלא הייתה בהם מונוזומיה של כרומוזום 3, לא היו מקרים של מוות הקשור במחלה במעקב של עשר שנים. בחולים עם המונוזומיה שיעור התמותה בעשר שנים היה 55%, וכשנוסף על מונוזומיה נמצא גם אבדן הזרוע הארוכה של כרומוזום 8 שיעור התמותה היה 71%.[11]
- Harbour וחברים אפיינו תבנית ביטוי גנים ייחודית (Gene Expression Profile) של גידולים שנוטים יותר לשלוח גרורות. קבוצת סיכון זאת קרויה קבוצה 2 (2 Class). וקבוצת הגידולים שאינם נוטים לשלוח גרורות קרויה קבוצה 1 (1 Class). במעקב ממוצע של 17 חודשים בקבוצה של 459 חולים מ-12 מרכזים בארה"ב, 1.1% מהחולים בקבוצה 1 פיתחו גרורות לעומת 25% בקבוצה 12.2
- נוסף על כך, גילוין של מוטציות ה-GNA11 וה- GNAQ בחולים עם מלנומה של הענביה פתח אפיקי מחקר חדשים בחיפוש אחר טיפול מונע להתפתחות עתידית של גרורות בחולים בסיכון.[12]
- אפיון ציטוגנטי מתבצע במחלקתנו בחולים המעוניינים במידע, בזמן הטיפול בברכיתרפיה באמצעות ביופסיה עם מחט (FNABX). יתרונה של השיטה הוא ביכולת לבצע דגימה היסטופתולוגית מבלי להקריב את העין. חסרונה הוא בסיכון שהדגימה אינה מייצגת (False Negative) בשל הווריאביליות הביולוגית בתוך הגידול. כל הגידולים של עיניים שעברו עקירה עוברים הערכה ציטוגנטית במחלקתנו.
מבט לעתיד
נכון להיום, אף שיש בידינו שיטות אבחון מצוינות לזיהוי האוכלוסייה המצויה בסיכון גבוה למשלוח עתידי של גרורות, אין עדיין פריצת דרך בגילוי טיפול מונע או טיפול המאפשר עצירה של התפתחות הגרורות לאחר גילוין. לכן עיקר המאמץ מתרכז במעקב סיסטמי צמוד אחר החולים, בניסיון לאבחן גרורות בשלב מוקדם. המעקב מתבצע בשיבא בשיתוף פעולה הדוק עם צוות האונקולוגים במכון אלה. גילוי מוקדם של מחלה גרורתית יאפשר להציע למטופלים כריתה של גרורות סולידיות בודדות או כמואמבוליזציה של הגרורות המפושטות בשלב מוקדם. טיפולים אלו נמצאו כמאריכי חיים.
לאחרונה בכנס השנתי של American Society of Clinical Oncology (ASCO) הוצגו תוצאות ראשונות של מחקר פאזה II שנערך Memorial Sloan-Kettering Cancer Centers על ידי Richard D. Carvajal וקבוצתו. במחקר ראשוני זה שימוש Selumetinibo (מעכב ספציפי של Tyrosine Kinase במסלול MAP Kinase Pathways) הביא לעצירה בהתקדמות מחלה גרורותית ממלנומה של הענביה ב-47 חולים. אף שכאמור מדובר במחקר קליני בפאזה II עם תוצאות ראשוניות בלבד, ממצאי מחקר זה מעודדים.[13]
גרורות תוך עיניות - Intraocular Metastasis
הקדמה
גרורה עינית תוארה לראשונה ב-1872, ובמשך עשורים נחשבה נדירה ביותר.[14] כיום בשל השיפור באבחון ובטיפול המאריך את חיי חולי הסרטן, גרורות עיניות הן הממאירות התוך עינית השכיחה ביותר. ההנחה היא שהענביה היא האתר המועד ביותר בגוף (פר יחידת שטח) לפתח גרורה מסרטן מרוחק השולח תאים סרטניים באמצעות פיזור המטופואטי (במערכת הדם). על פי הספרות ההיארעות של גרורות בענביה (Uveal Metastases) בחולי סרטן היא 9%-2%, ובמחקרים מהשנים האחרונות האחוזים גבוהים יותר, אך עד היום לא הוכחו יתרון קליני ועלות-תועלת בבדיקות סקר עיניות לחולים אלו. ברוב החולים (97%-66%) ידוע על היסטוריה של סרטן עוד לפני האבחנה של הגרורה העינית.[15] על פי רוב המקור הראשוני לגרורה הוא סרטן שד בנשים (87%) וסרטן ריאה בגברים (26%).[16] האחוז הנמוך יחסית של סרטן ריאה כמקור לגרורה עינית ביחס לסרטן שד מוסבר בהישרדות הנמוכה של חולים אלו. גרורות נוספות במערכת העצבים המרכזית (CNS) יופיעו ב-44% מהחולים, ובמחצית מהחולים הן תופענה לאחר האבחנה של הגרורה העינית, ולכן ההמלצה היא לבצע לפחות הדמיה מוחית אחת במסגרת הבירור.[17]
חשוב לציין שרוב החולים מוכרים כחולים אונקולוגיים בהגיעם לבדיקה של אונקולוג העיניים, אולם בחלק קטן מהחולים מעורבות העיניים היא הסימן הראשון לנוכחות מחלה גרורתית. חולים אלו מופנים מיידית לבירור סיסטמי מקיף, המאפשר הגעה מהירה לאבחנה וטיפול סיסטמי מתאים, המוביל להצלה או להארכה של חיי החולה כתלות במחלתו הראשונית ופיזורה הסיסטמי.
מאפיינים קליניים
רוב החולים עם גרורה עינית הם א-סימפטומטיים.[17], [18], [19] אם מופיעים סימפטומים הם בדרך כלל מתפתחים תוך זמן קצר (ימים-שבועות). התלונה השכיחה ביותר היא על טשטוש בראייה (88%), אך ייתכנו גם כתם-סקוטומה (31%-6%), כאב (16%), Floaters (5%) והבזקים (5%).[20], , [21], [22], [23], [24], [25]
מיקומן האנטומי של הגרורות הוא לרוב בכורואיד (88%), אך הן יכולות להופיע גם בקשתית (9%) או בגוף הסיליארי (Ciliary Body) (2%) [25]
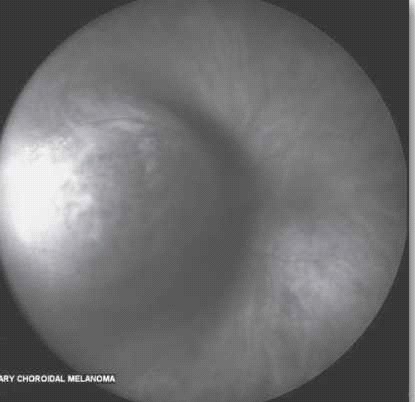
בבדיקת עיניים יתגלה נגע מורם בגוון קרמי או צהוב חיוור, המלווה בנוזל תת רשתי[22] (ראו צילום 4), בקוטר מקסימלי ממוצע של 9 מ"מ ובעובי ממוצע של 3 מ"מ.[25] לכשליש יהיו כמה מוקדים גרורתיים בעין.[15] יש לציין כי יש גידולים השולחים גרורות בעלות מראה ייחודי ואופייני, למשל קרצינומה של הטירואיד וקרצינואיד נוטים לשלוח גרורות בעלות גוון כתום אופייני.
הגרורות העיניות צומחות במהירות ומסכנות את הראייה. לכן אבחנה מהירה וטיפול מתאים חיוניים לשמירה על איכות חיי המטופל.
האבחנה של מוקד גרורתי היא קלינית בעיקרה, ומתבססת על אנמנזה ובדיקה ללא צורך בביופסיה. מבחנים הדמייתיים המתבצעים לצורך אישור האבחנה כוללים הערכה סונוגרפית של הגידול וצילום עיניים עם הזרקה של פלורוסאין (FA) המשמש חומר ניגוד בצילומי עיניים.
טיפול
לרוב סוגי הסרטן, ובמיוחד בשלב הגרורתי, אין פוטנציאל ריפוי, ועיקר המאמץ הטיפולי הוא בהארכת חיי המטופל על ידי ייצוב המחלה תוך שמירה מקסימלית על איכות חייו. ברור אם כן, עד כמה חשוב הטיפול בגרורות עיניות לשמירה על הראייה ועל איכות חיי המטופל, המסייעים לשיפור התפקוד היומיומי ולהתמודדות של המטופל עם המחלה.
שכבת הכורואיד אינה מוגנת על ידי ה-Blood Ocular Barrier, ולכן התרופות הסיסטמיות חודרות לאזור. לאור זאת, ההמלצה הראשונית היא להמתין לתגובה לטיפול הסיסטמי שניתן על ידי האונקולוגים המטפלים במחלתו הבסיסית של החולה. התגובה לטיפול הסיסטמי צפויה להתרחש תוך חודש עד ארבעה חודשים מתחילתו.[26] בשלושת המקרים להלן נשלב טיפול מקומי עם הטיפול הסיסטמי כבר בשלב הראשון:
- כאשר הגרורה העינית גדלה במהלך השבועות הראשונים של הטיפול
- כאשר הגרורה העינית היא הגרורה היחידה, טיפול מקומי יחסוך למטופל טיפול כימותרפי סיסטמי אגרסיבי
- כאשר במסגרת הטיפול הסיסטמי מתוכננת הקרנה למוח, אז נשקול להקרין במקביל גם את הנגע העיני.[26]
בעשור האחרון פותחו תרופות ביולוגיות ששינו את אופי הטיפול בחולי הסרטן. הרעיון בבסיס טיפולים אלו הוא לפתח תרופות הפועלות באופן סלקטיבי על תכונות ייחודיות של הרקמה הגידולית בחולה הספציפי, ובכך להימנע מהרעילות הסיסטמית של התרופות הכימותרפיות. רוב התרופות הביולוגיות חודרות גם לכורואיד. מעניינת במיוחד הגישה הטיפולית הביולוגית המותאמת אישית למטופל, על פי הביולוגיה הספציאלית של הגידול הראשוני שלו. דוגמה לתרופה ביולוגית כזאת היא ה-Gefitinib (אירסה). מדובר במולקולה קטנה הפועלת על תת-היחידה טירוזין קינאז ברצפטור EGFR. רצפטור זה נמצא על גבי תאים אפיתליאליים בגוף וחשוב בפרוליפרציה של התא, הוא מוטנטי או מבוטא ביתר בכמה גידולים סרטניים. בחולים עם גידולי ריאה חיוביים למוטציה ב-EGFR שטופלו בתרופה, נרשמה ירידה של 70% בהתקדמות הגידול בהשוואה לכימותרפיה, ושיפור בהישרדות של יותר מחצי שנה.[27] תרופה זאת חודרת לכורואיד ומשפיעה על גרורות עיניות בחולים בהם הגידול הראשוני חיובי למוטציה.
הערכה של הגרורות העיניות ושל תגובתן לטיפול יכולה להתבצע בבדיקה קלינית במרפאתו של אונקולוג העיניים ובאמצעות US. מעקב אחר התגובה של הגרורות העיניות לטיפול יכולה במקרים מסוימים לסייע בניטור ובהערכת התגובה הכללית של המטופל לטיפול האנטי גרורתי שניתן לו.
כאשר הטיפול הסיסטמי נכשל, אפשר לטפל מקומית בגרורה העינית. מטרת הטיפולים הללו היא לשפר את הראייה תוך פגיעה מינימלית בשאר חלקי העין. נסיגה של הגרורה העינית לאחר טיפול מקומי צפויה בכשני שלישים מהמקרים.[28], [29] האפשרויות לטיפול מקומי מגוונות וכוללות הקרנה בכל השיטות שתוארו בפרק הטיפול במלנומה של הענביה.[29], [30]שיטות טיפול נוספות כוללות:
הזרקה תוך עינית של Bevacizumab (אבסטין)
הזרקה תוך עינית של אנטי VEGF טרם הוכחה כטיפול יעיל בגרורות עיניות. אולם קיימים כמה תיאורי מקרה[31], [32], [33], [34], [35], [36], [37] עם תוצאות מעודדות של נסיגת הגידול ונסיגה של היפרדות הרשתית המלווה גידולים פעילים. ההנחה היא שהאפקט של אבסטין במניעת יצירת כלי דם חדשים ובמניעת דליפה מכלי דם מביא לכיווץ אספקת הדם לגרורה ולספיגה של הנוזל התת רשתי. המינון הטיפולי המקובל הוא של 2.5-1.25 מ"ג, וייתכן שיהיה צורך בכמה הזרקות טיפוליות. סיבוכי הטיפול נדירים ויכולים להיות דימום, אירועים טרומבואמבולים, אנדופטלמיטיס ואובאיטיס.
טיפולי לייזר מסוגים שונים
Laser ,Transpupillary Thermotherapy Photocoagulation וטיפולים פוטודינמיים.
טיפולים כירורגיים מקומיים
הקפאה של גידולים תוך עיניים קטנים, כריתה של הגידול, ואפילו עקירה של העין, כשהגידול מאוד גדול ואין צפי לשימור ראייה.
פרוגנוזה
הפרוגנוזה של חולים אלו גרועה. קשה להעריך במדויק את הפרוגנוזה, מכיוון שקבוצה הטרוגנית זו כוללת מקורות גידוליים שונים בשלבים שונים של המחלה. ממוצע ההישרדות הכולל הוא כ-13 חודשים.[16] אך בשנים האחרונות בשל ההתקדמות באפשרויות הטיפול ופיתוח טיפולים ביולוגיים מותאמים אישית, יותר ויותר חולים חיים חודשים ארוכים עם מחלה יציבה.
רטינובלסטומה - Retinoblastoma
הקדמה
רטינובלסטומה (RB) תוארה לראשונה בספרות הרפואית ב-1809 ע"י הרופא הסקוטי ד"ר James Wardrop[38]. אולם כבר בגילוף אבן מימי המאיה משנת 2000 לפני הספירה, נמצא תיאור של ילד עם עין בולטת. זהו הגידול הראשוני התוך עיני השכיח ביותר בילדים. מקורו של הגידול הוא בשגשוג לא מבוקר של תאי הרשתית הסנסורית. היארעות המחלה שווה בין בנות לבנים, ועומדת על כ-1:15,000 עד 1:18,000 לידות חי בסדרות שונות.
על פי הערכתו של Kivela [39], [40] 8,102-7,202 ילדים מכל העולם יפתחו את המחלה בכל שנה, וכ-3,376-3,001 מתוכם ימותו מהמחלה, בעיקר באפריקה ובאסיה.
גנטיקה
למחלה שתי צורות: מחלה תורשתית ומחלה שאינה תורשתית. המוטציה העיקרית הגורמת להתפתחות מחלת הרטינובלסטומה יושבת על כרומוזום 13 בגן הנקרא RB1 Gene. גן זה פועל לדיכוי התפתחות גידולים (Tumor Suppressor Gene). כאשר הגן הזה מוטנטי או חסר, אין דיכוי של ייצור גידולים.[41]
בכ-45%-40% מהחולים המחלה יושבת על תאי הנבט של החולה. מחלה זאת קרויה תורשתית. הילד החולה במחלה התורשתית עלול להוריש את המחלה לצאצאיו בבוא העת. כ-68% מהילדים עם המחלה התורשתית יפתחו מחלה בשתי העיניים בגיל מאוד צעיר ו-32% יפתחו מחלה רק בעין אחת.
בכ-60%-55% מהחולים המוטציה יושבת על התאים הסומטיים (תאי הרשתית בלבד). מחלה זאת קרויה לא תורשתית. הילד החולה במחלה הלא תורשתית לא יוריש את המחלה לצאצאיו בבוא העת. רוב הילדים הללו יפתחו מחלה חד-עינית, שתבוא לידי ביטוי בגיל מאוחר יותר.
כשאחד ההורים חולה במחלה, המחלה קרויה משפחתית (Familial), והמקרים שבהם הילד הוא הנציג הראשון במשפחה החולה במחלה קרויים ספורדיים (Sporadic).
בחלק מהמטופלים ידוע על מוזאיקה של הימצאות המוטציה בגן. מוזאיקה הוא מצב שבו חלק מתאי הגוף מבטאים את המוטציה וחלק לא. כך קורה שבילד עם המוטציה, הבדיקה תתקבל כשלילית אם נדגמו רק תאים ללא המוטציה (False Negative Test).
בשנים האחרונות קבוצתה של Brenda Gallie מקנדה מצאה כי אמפליפיקציה של הפרוטו-אונקוגן הסומטי MYCN, המוכר מהנוירובלסטומה, גורם למחלה בכמה מקרים של רטינובלסטומה לא תורשתית חד-עינית אגרסיבית. האמפליפיקציה זוהתה בכ-1.4% מסך כל המקרים של רטינובלסטומה חד-עינית.[42]
מאפיינים קליניים
המחלה יכולה לערב את שתי העיניים או עין אחת. בשני שלישים מהמקרים רק עין אחת מעורבת במחלה (רטינובלסטומה יונילטרלית), ובשליש הנותר שתי העיניים מעורבות (רטינובלסטומה בילטרלית). במצבים שבהם המוח, ובעיקר Pineal Glands, מעורבים, המחלה קרויה רטינובלסטומה טרילטרלית.
מספר הגידולים בכל עין ומיקומם מכתיבים את שיטת הטיפול בילד. אם הילד החולה אינו מטופל, המחלה היא לטלית. בעולם המערבי זוהי מחלה עם סיכויי ריפוי מצוינים של 95%-98%. MacCarthy וחבריו[43] הראו שחמש שנות הישרדות לילדים עם רטינובלסטומה חד-צדדית עלו באנגליה מ-85% לילדים שאובחנו בשנים 1967-1963 ל-97% בשנים 2002-1998.
80% מהילדים עם רטינובלסטומה מאובחנים לפני גיל שלוש. מחלה דו-עינית מאובחנת לרוב עד גיל 16-14 חודשים, והיא נדירה מאוד בילדים מעל גיל שש. מחלה חד-עינית מאובחנת לרוב בגיל ממוצע של 24 חודשים.
יוצאי דופן הם הילדים עם אמפליפיקציה של הגן MYCN. כאמור לילדים אלו רטינובלסטומה חד-עינית אגרסיבית במיוחד. הם מאובחנים בדרך כלל עד גיל ארבעה חודשים וחצי, בהשוואה לגיל ממוצע לאבחון של 24 חודשים ברטינובלסטומה חד-עינית עם מוטציה בגן 1RB. האמפליפיקציה זוהתה בכ-18% מהמקרים של רטינובלסטומה חד-עינית אגרסיבית שאובחנה עד גיל שישה חודשים.[42]
כמו בסוגי סרטן אחרים, גם ברטינובלסטומה הפרוגנוזה משתפרת והולכת ככול שהאבחון נעשה מוקדם יותר. במשפחות עם סיכון לרטינובלסטומה אפשר וחשוב לבצע אבחון טרום-לידתי, היכול להביא לאבחון ולטיפול מוקדמים או אף להחלטה על הפלה במקרה הצורך.
הסתמנות
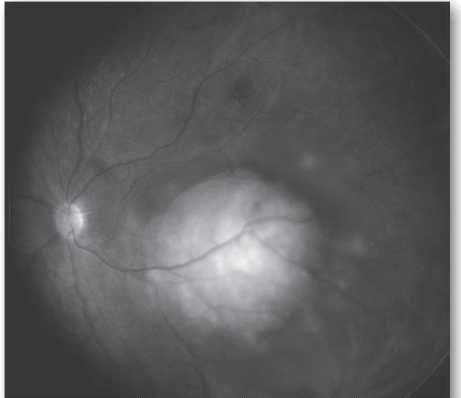
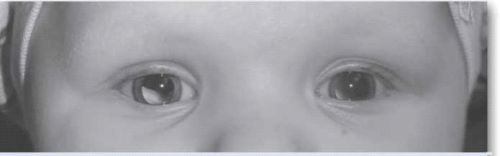
ההסתמנות השכיחה ביותר של המחלה בעולם המערבי היא הופעה של לויקוקוריאה (צילום 5), ובמקום שני פזילה. בארצות מתפתחות בלט עין הוא הסתמנות יותר שכיחה של המחלה, ומקורה, קרוב לוודאי, באבחנה מאוחרת של המחלה.
עד כה לא הוכחה קורולציה בין המוטציה אצל המטופל להתייצגות המחלה בעת גילויה.
דירוג חומרת המחלה על פי קבוצות (Grouping)
הסיווג המקובל היום של המחלה קרוי International Classification of Retinoblastoma. סיווג זה מחלק את הגידולים לקבוצות A עד E. מטרת הסיווג החדש היא להקל על קבלת ההחלטה בבחירת שיטת הטיפול בעידן הכימותרפיה. הסיווג הוא:
- גידולים מקבוצה A - גידולים קטנים מ-3 מ"מ
- גידולים מקבוצה B - גידולים גדולים מ-3 מ"מ או ממוקמים במרכז הראייה (Macula) או ליד עצב הראייה (Juxtapapillary) ומלווים בהיפרדות רשתית
- גידולים מקבוצה C - גידולים המלווים בזרעים (גידולי בת קטנים) המצויים בסמיכות לגידול המקור
- גידולים מקבוצה D - גידולים המלווים בזרעים דיפוזיים המרוחקים מגידול המקור
- גידולים מקבוצה E - גידולים מאסיביים.
אבחנה מבדלת=
בילדים מתחת לגיל שנתיים האבחנות המבדלות העיקריות הן Persistent Hyperplastic) Persistent Fetal Vasculature PHPV - Primary Vitreous), מחלת Coats ודימום לזגוגית, וכן ROP) Retinopathy of Prematurity), ובילדים מעל גיל חמש האבחנות המבדלות העיקריות הן מחלת Coats, טוקסוקריוזיס -g 47.Familial Exudative Vitreoretinopathy
טיפול66-48 כמו בכל המחלות האונקולוגיות של העיניים, מטרות הטיפול הן שימור חיי החולה, שימור גלגל העין ושימור הראייה. נוסף על כך, לאור העובדה שמדובר בילדים ובתינוקות רכים, נתמקד בבחירת האסטרטגיה הטיפולית שתאפשר בטיחות מקסימלית עכשווית ועתידית, ולכן ננסה למשל להימנע מטיפול בילד באמצעות הקרנה חיצונית, כמעט תמיד, עד גיל 12 חודשים, בשל חשש מעצירת התפתחות הארובה המוקרנת, ובמידת האפשר בכל גיל, בשל חשש מהתפתחות גידולים משניים מאוחרים במסלול ההקרנה. אסטרטגיית הטיפול תלויה בלטרליות של המחלה, במספר הגידולים בכל עין ומיקומם, Staged של המחלה, בגיל המטופל ובמצבו הסיסטמי.
הצוות המטפל בילדים עם רטינובלסטומה כולל אונקולוג עיניים, המטואונקולוג ילדים, נוירורדיולוג, נוירורדיולוג פולשני או נוירוכירורג, צוות מרדימים, רופאי עיניים ילדים, צוות סיעוד מיומן, בית מרקחת וצוות תומך כגון פסיכולוג ילדים, עובדת סוציאלית ועוד. במאה האחרונה חלו תמורות שהביאו לשינוי דרמטי של שיטות הטיפול בילדים עם רטינובלסטומה. גידולים מקבוצה A ולעתים מקבוצה B נחשבים לגידולים שאפשר לעתים לשלוט עליהם בטיפול מקומי בלבד. גידולים מקבוצה EH D נחשבו בעבר לכאלה שאי אפשר להציל בהם את העיניים, בשל מחלה מאוד מתקדמת, ובקבוצות גידולים אלו חלו עיקר השינויים. ככלל טיפול כימותרפי בכל צורות המתן הוא הבסיס להשגת שליטה על המחלה. אולם, אף שהטיפול יעיל, עליו להיות מלווה בקונסולידציה של הגידול באמצעות טיפול מקומי מתאים, הכולל הקפאה או חימום באמצעות לייזר TTT) Transpupillary Thermotherapy) או ברכיתרפיה על פי הצורך ועוד.
טיפול תוך ורידי בכימותרפיה - IVC) Intravenous Chemotherapy): כולל בדרך כלל מתן של שלוש תרופות, ,Etoposide Vincristine- Carboplatin, בשישה מחזורים בהפרש של כשלושה-ארבעה שבועות, עם טיפול מקומי עוקב בהרדמה מיד לאחר כל מחזור טיפולי. פרוטוקול זה נמצא יעיל כקו טיפול ראשון לשליטה על המחלה התוך עינית (ראה צילום 6), למניעת התפתחות גרורות, להורדת השכיחות של מעורבות בלוטת הפיניאליס ולמניעת התפתחות גידולים משניים לאורך חיי החולה.48 מכיוון שמתן הכימותרפיה לווריד מלווה תמיד בטיפול מקומי, צורת טיפול זאת קרויה CRD) Chemoreduction). תופעות הלוואי העיקריות של הטיפול הן דיכוי חולף של מח העצם, נפרוטוקסיות, סכנה לזיהומים ורעילות נדירה אוטוטוקסית (למערכת השמע) של קרבופלטין.
פרוטוקולים נוספים נמצאים בבדיקה בימים אלו על ידי ^COG (Children Oncology Group), וביניהם פרוטוקולים קצרים יותר או פרוטוקולים שבהם הילד מקבל שתי תרופות בלבד. טיפול בהזרקה של כימותרפיה ישירות לעורק האופטלמי -
- (IAC) Intra-Arterial Chemotherapy
שיטת טיפול זאת מאפשרת הבאה ישירה (באמצעות צנתור) של כימותרפיה (בדרך כלל מלפאלאן) לאיבר המטרה (העין עם הגידול). בשיטה זאת אפשר לחשוף את העין עם הגידול לכמות גדולה של כימותרפיה, מבלי לחשוף את הילד לתרופות הלוואי הסיסטמיות של הטיפול. הראשונים שהחלו לטפל ברטינובלסטומה בשיטה זאת היו 66,52SuzukH Kaneko מיפן, שעשו זאת באמצעות צנתר ובלון ייחודיים. בהמשך Abramson וחברים החליפו את הבלון בצנתר קטן החודר ישירות לעורק האופטלמי.57,54,53 ריכוז הכימותרפיה המגיע לעין בשיטה זאת גבוה פי עשר מהריכוז בטיפול תוך ורידי, ולעתים דבר זה מאפשר להציל עיניים שבעבר אי אפשר היה להצילן. שיטת טיפול זאת יכולה להינתן כטיפול ראשוני או כטיפול הצלה (Salvage Therapy) לאחר כישלון טיפול בכימותרפיה לווריד. גם בשיטת טיפול זאת נדרשת קונסולידציה של הגידול על ידי טיפול מקומי אינטנסיבי.
על פי Shields וחברים60,55 שימוש בשיטה זאת כשיטת טיפול ראשונית, אפשרה השגה של 67% שימור עיניים במטופלים מכל הקבוצות (A-E), ובחלוקה לתת קבוצות: 100% שימור עין בילדים עם גידולים מקבוצות C או D ו-33% בקבוצה E. כאשר נעשה שימוש בשיטה כטיפול הצלה, אחוז ההצלחה של שימור העין בכלל הקבוצות עמד על 55.50% על פי 66SuzukH Kaneko מעקב ארוך טווח (2007-1988) שבדק שימוש בשיטתם, הביא לשימור הגלגל ב-100% מהעיניים מקבוצה A; ב-88% מקבוצה B; ב-65% מקבוצה C; ב-45% מקבוצה D וב-30% מקבוצה E. השיטה נחשבת בטוחה סיסטמית, ואף שתוארו מקרים של נוטרופניה לאחר הטיפול, לא ידוע על מקרים שבהם הילד נזקק לעירוי דם. תוצאות השיטה מבטיחות, ולכן היא מקובלת היום בכל המרכזים הגדולים לרטינובלסטומה בעולם כולו ובמוסדנו. החיסרון העיקרי של השיטה הוא עקומת למידה, עם הצלחה טכנית נמוכה במקרים הראשונים. ידוע כי ואריאנטים אנטומים מקשים או לא מאפשרים צנתור מוצלח בכ-5%-3% מהמקרים. קושי טכני ניכר קיים גם בילדים מתחת לגיל שישה חודשים. תופעות הלוואי העיקריות של השיטה הן בצקת עפעפיים זמנית, איסכמיה כורואילדית וחסימות וסקולריות.
טיפול בהזרקה של כימותרפיה ישירות לחלל הזגוגית: נעשה על פי הפרוטוקול שפרסמו Munier וחבריו,63,64 תוך שימוש זהיר בהזרקה של מלפאלן ישירות לחלל הזגוגית. טיפול זה שמור למצבים שבהם יש מחלה פעילה בחלל הזגוגית, לאחר שימוש בכל צורות המתן המתוארות.
בחירת הטיפול המתאים נסמכת כאמור בכל מקרה ומקרה על גיל הילד, מצבו הכללי, הלטרליות של המחלה, מספר הגידולים בכל עין ומיקומם. במאמר שפרסמו לאחרונה Shields וחברים48 הוצע תרשים הזרימה העקרוני הבא: במחלה דו צדדית: טיפול תוך ורידי בכימותרפיה, Intravenous Chemotherapy (IVC), על פי הפרוטוקול שתואר לעיל. במחלה דו-צדדית מתקדמת: (קבוצות E- D): מתן תוספת של הזרקה של קרבופלטין (Carboplatin) מתחת לטנון. במחלה חד-צדדית: יש מקום לשקול טיפול בהזרקה של כימותרפיה ישירות לעורק האופטלמי, Intra-Arterial IAC) Chemotherapy).
במחלה חד-עינית מתקדמת (קבוצות E-! D): אפשר לשקול טיפול ראשוני באנוקלאציה או בטיפול משמר גלגל באמצעות IVC או באמצעות IAC. יש לציין כי במאמר של Shields וחברים67 בבחינה היסטופתולוגית של 519 עיניים שעברו אנוקלאציה כטיפול ראשוני, נמצאה עדות לרטינובלסטומה בעלת פוטנציאל סיכון גבוה למשלוח גרורות ב-17% מהעיניים מקבוצה D וב-24% מהעיניים מקבוצה E. ילדים אלו זקוקים לטיפול סיסטמי אדג'ובנטי (בכימותרפיה ולעתים גם בקרינה) לאחר ביצוע אנוקלאציה.
עם השגת שליטה על הגידול הפעיל נכנסים לתמונה גם אופטומטריסטים, אורטופטיסטים וצוות של פדיאטרים-אופטלמולוגיים במטרה להביא את עיני המטופל לשיקום ראייה מקסימלי.
ילדים עם רטינובלסטומה זקוקים למעקב רפואי ארוך טווח, מכיוון שכמו בכל מחלה אונקולוגית ידוע על הישנויות עיניות מאוחרות תחת כל סוגי הטיפול (קרינה, כימותרפיה IVC או IAC), וכן על התפתחות של גידולים משניים מאוחרים במערכות אחרות (שלד למשל), בעיקר במקרים התורשתיים או בילדים שנחשפו לקרינה. ילדים אלו ומשפחותיהם זקוקים לליווי ולתמיכה ארוכי טווח גם שנים רבות לאחר ההחלמה, כדי לסייע להתפתחות רגשית תקינה של הילד ולאפשר את קליטתו האופטימלית במוסדות כגון גנים, בתי ספר ועוד.
חולים עם גידולי עיניים ממאירים אחרים חולים עם לימפומה ולויקומיה תוך עינית מטופלים בשיתוף פעולה הדוק עם המחלקה ההמטואונקולוגית (או נוירואונקולוגית) המטפלת בחולה, וזוכים לטיפול משולב המכסה את מחלתם העינית והסיסטמית בהתאם לאבחנה הבסיסית.
יש לציין כי בחולים עם Primary CNS Lymphoma, תיתכן מעורבות עינית המקדימה את המעורבות המוחית. ערנות של אונקולוג העיניים ומאמץ אבחנתי עשויים במקרים אלו להציל או חיי החולה.
בסקירה זאת התרכזתי בתיאור גידולי עיניים ממאירים תוך עיניים, ולכן לא נכללו כאן המצבים האונקולוגיים המערבים את שטח פני העין או הארובה. בין החידושים בתחום זה אביא רק אזכור לפרוצדורות כגון ביופסיה של קשריות זקיף (Sentinel Lymph Node Biopsy) וטיפול כימותרפי מקומי בהזרקת אינטרפרון או בטיפות כגון MMC או ציקלוספרין, שהפכו בשנים האחרונות לחלק שגרתי בטיפול ובמעקב אחר חולים עם מחלות עיניים אונקולוגיות של שטח פני העין.
סיכום האונקולוגיה העינית עוסקת בענף ייחודי ונדיר עם יעדים טיפוליים ברורים: הצלת חיים במקום ראשון, ובהמשך הצלת העין והראייה. שיטות טיפול חדשות מאפשרות עמידה מצוינת ביעדי טיפול אלו.
ההצלחה של טיפול בחולה עם מחלה אונקולוגית של העיניים היא תולדה של מחויבות הרופא המטפל, של נכונות החולה לעבור טיפול ושל מערכת מולטידיסציפלינרית רחבה ותומכת המלווה את החולה במוסד המטפל.
ביבליוגרפיה
- ↑ Histopathologic characteristics of uveal melanomas in eyes enucleated from the Collaborative Ocular Melanoma Study. COMS report no. 6. Am J Ophthalmol. 1998;125:745-766
- ↑ Shields CL, Shields JA, Materin M, Gershenbaum E, Singh AD, Smith A. Iris melanoma: risk factors for metastasis in 169 consecutive patients. Ophthalmology. 2001;108(1):172-8
- ↑ 3.0 3.1 Diener-West M, Reynolds SM, Agugliaro DJ, et al. Development of metastatic disease after enrollment in the COMS trials for treatment of choroidal melanoma: Collaborative Ocular Melanoma Study Group Report No. 26. Arch Ophthalmol. 2005;123:1639-1643
- ↑ Kaiserman N, Kaiserman I, Hendler K, et al. Ruthenium-106 plaque brachytherapy for thick posterior uveal melanomas. Br J Ophthalmol. 2009; 93:1167-1171
- ↑ Shields et al. Combined plaque radiotherapy and transpupillary thermotherapy for choroidal melanoma: tumor control and treatment complications in 270 consecutive patients. Arch Ophthalmol. 2002;120:933-40
- ↑ The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma: V. Twelve-year mortality rates and prognostic factors: COMS report No. 28. Arch Ophthalmol. 2006;124:1684-1693
- ↑ Shields CL, et al. Metastasis of uveal melanoma millimeter-by-millimeter in 8033 consecutive eyes. Arch Ophthalmol. 2009;127:989-998
- ↑ 8.0 8.1 8.2 Isagar p, Enlers N, Overgaard JA. Prognostic factors for survival after enucleation for choroidal and ciliary body melanomas. Acta Ophthalmol Scand. 2004;82(5):517-25
- ↑ 9.0 9.1 McLean IW, Foster WD, Zimmerman LE. Uveal melanoma: location, size, cell type, and enucleation as risk factors in metastasis. Hum Pathol. 1992;13:123-132
- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה10- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה11- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה13- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה14- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה15- ↑ 15.0 15.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה16- ↑ 16.0 16.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה17- ↑ 17.0 17.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה18- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה19- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה20- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה21- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה22- ↑ 22.0 22.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה23- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה24- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה25- ↑ 25.0 25.1 25.2 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה26- ↑ 26.0 26.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה27- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה28- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה29- ↑ 29.0 29.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה30- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה31- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה33- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה34- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה35- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה36- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה37- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה38- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה39- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה40- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה41- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה42- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה440- ↑ 42.0 42.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה45- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה46
המידע שבדף זה נכתב על ידי ד"ר ויקטוריה (ויקי) וישנבסקיה-דאי - שירות מתמחה ארצי באונקולוגיה של העין, והשירות למחלות אוטואימונית של העיניים מכון גולדשלגר, בית חולים שיבא, תל השומר; אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק