נוירוטנסין - Neurotensin
| מדריך בדיקות מעבדה | |
| נוירוטנסין | |
|---|---|
| Neurotensin | |
| מעבדה | כימיה בדם, אנדוקרינולוגיה בדם |
| תחום | טווח ערכים תקין: 50-100 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
נוירוטנסין הוא פפטיד בעל 13 חומצות אמינו הנוצר בעיקר על ידי תאי N האנדוקריניים של רירית ה-ileum אך הוא מיוצר בכמות קטנה גם במוח (על פי Carraway ו-Leeman ב-J Biol Chem משנת 1976, ו-Holzer וחב' ב-Neuroscience משנת 1982). בין פעילויותיו הפיזיולוגיות של נוירוטנסין ניתן למנות השריית יתר-לחץ, הרחבת כלי-דם, היפרגליקמיה, ועיכוב תנועתיות הקיבה (gastric motility). הקצה ה-C טרמינאלי של פפטיד זה דומה לזה של אנגיוטנסין I. נוירוטנסין הוא משכך כאבים יעיל, שהשפעותיו ניכרות גם המשפיע במצבי היפו-תרמיה, הרפיית שרירים, והפחתת פעילות מוטורית. הפרשה של פוליפפטיד פנקראטי מגורה בחוזקה על ידי נוירוטנסין, כמו גם הפרשת ביקרבונאט מבלוטה זו. נוירוטנסין משפיע גם על הפרשת LH-RH ו-CRH המשפיעים על הפרשת luteinizing hormone, כמו גם FSH ו-ACTH, אך אינו משפיע על הפרשת TSH או על זו של הורמון הגדילה. נוירוטנסין מעודד הפרשת prolactin מבלוטת יותרת המוח. נוירוטנסין מופיע באזורים שונים במערכת העצבים המרכזית, כאשר ריכוזיו הגבוהים ביותר הם בהיפותלמוס, באמיגדלה, וב-nucleus acumbens. לנוירוטנסין אינטראקציה משמעותית עם המערכת הדופאמינרגית, רמות נוירוטנסין מושפעות על ידי מזון שומני וכן על ידי bombesin (הפפטיד המגרה הפרשת gastrin בקיבה). רמות מוגברות של נוירוטנסין נמצאו בגידולים אנדוקריניים של הלבלב, בתאי SCLC, בקרצינומה של תאי קשקש ובאדנו-קרצינומה. רמה מוגברת של נוירוטנסין נמצאה גורמת לשלשולים מימיים.
בסיס פיזיולוגי
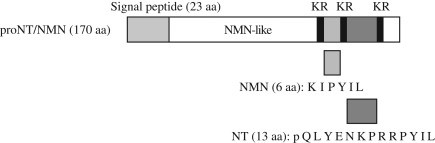
נוירוטנסין בודד לראשונה בשנת 1973 על ידי Carraway ו-Leeman מהיפותלמוס של בקר. בשנת 1988 בודד ורוצף הגן NT של נוירוטנסין מחולדה על ידי Kislauskis וחב' כפי שפורסם ב-J Biol Chem, ונמצא מורכב ממקטע של 10.2kb, המכיל אקסונים ו-3 אינטרונים. גן זה מקודד לחלבון קודמן בעל 170 חומצות אמינו, המכיל את הרצף של 13 חומצות האמינו של נוירוטנסין, ואת הרצף של 6 חומצות האמינו של הנוירופפטיד neuromedin N (על פי Dobner ב-Proc Natl Acad Sci USA משנת 1987, ו-Kislauskis ב-J Biol Chem משנת 1988). השם נקבע כנוירוטנסין, כיוון שהתגלה במוח והייתה לו פעילות היפוטנסיבית. בהמשך, בודד נוירוטנסין מהמעיים, בהם פעילותו הייתה אנדוקרינית וכנראה גם פרקרינית. ב-CNS נוירוטנסין פועל כנירוטרנסמיטור הפועל בעיקר לעכב מסלולים דופמינרגיים. במערכת העיכול, נוירוטנסין משפיע על תנועתיות המעי, על הפרשות הלבלב והמרה, ועל שגשוג רירית המעי. כ-10 שנים לאחר זיהוי נוירוטנסין, בודד מההיפותלמוס של חזיר בודד פפטיד בעל 6 חומצות אמינו, neuromedin N, שהפיזור ההיקפי שלו דומה לזה של נוירוטנסין. הרצף של ארבע חומצות האמינו בקצה ה-C טרמינאלי של שני פפטידים אלה זהה : Pro-Tyr-Ile-Leu, כאשר על פי Lambert וחב' ב-Ann NY Acad Sci משנת 1995 ששת חומצות האמינו בעמדות 8–13 חיוניות לפעילותו הביולוגית של נוירוטנסין. הגן NT/NN המקודד לנוירוטנסין ולנוירומדין N עבר שימור במהלך האבולוציה בין מיני בעלי חיים שונים. הרצף של נוירוטנסין מבקר נקבע כ-pyroGlu-Leu-Tyr-Glu-Asn-Lys-Pro-Arg-Arg-Pro-Tyr-Ile-Leu-OH (על פי Caraway ב-J Biol Chem משנת 1975).
נוירוטנסין במוח ובמערכת העיכול פועל על 3 סוגי קולטנים, ששלושתם הם קולטנים מצומדים לחלבוני G: לקולטן NTR1 הוא נקשר בזיקה גבוהה, לקולטן NTR2 הוא נקשר בזיקה נמוכה, והקולטן השלישי שהוא טרנס ממברנלי ידוע כ-NTR3 (או Sortilin 1). הקולטן NTR1 הוא זה המתווך של כל התגובות לנוירוטנסין במעי.
השפעות ביולוגיות של נוירוטנסין
ידועות למעלה מ-30 השפעות ביולוגיות של נוירוטנסין in vivo ו-in vitro. השפעות היקפיות כוללות הרחבת כלי-דם, cyanosis, הגברת הפרשת היסטמין, השפעה מעודדת של הפרשות אקסוקריניות מהלבלב, השפעה על פעילות השריר החלק במעי והתנועתיות של המעי, עידוד הפרשות מעי, עיכוב שפיעת דם לרקמת השומן, השפעות מרכזיות של נוירוטנסין כוללות היפותרמיה, השפעה מעכבת של קולטנים תחושתיים של כאב במערכת העצבים (anti-nociceptive), מודולציה של מערכות דופמינרגיות במוח, והשפעה על הפרשת פרולקטין ו-luteinizing hormone.
השפעות מרכזיות של נוירוטנסין
ההשפעות הנוירו-אנדוקריניות של נוירוטנסין הן מאוד מורכבות ותלויות בדרך החדרתו, בסטאטוס של סטרואידי המין, ובזן. יתרה מכך, ישנם נושאים המבדילים בין ההשפעות הפיזיולוגיות ודרך הפעולה של נוירוטנסין (נוירוקרינית, אוטוקרינית, פרקרינית ואנדוקרינית). בהקשר זה, ההתפתחות של קולטנים ספציפיים והשימוש בנסיוב בעל פעילות אנטי-נוירוטנסינית, היו מאוד מועילים. האנטגוניסט SR-48,692 חוסם את הפעילויות המתבצעות דרך הקולטן NTR-1, כגון הפרשת דופאמין בתיווך אשלגן, אך אינו משפיע על הפעילות ההיפותרמית או משככת הכאבים של נוירוטנסין. שתי פעילויות אלו מתבצעות דרך הקולטן NTR-2, והן נחסמות על ידי האנטגוניסט R142948A האנטגוניסט של 2 הקולטנים NTR-1 ו-NTR-2. עם זאת, מחקרים עדכניים עם עכברי knockout ללא קולטן מסוג NTR-1 מראים שקולטן זה כן תורם לשיכוך כאבים ולהיפותרמיה. קולטנים אלה הם בעלי פעילויות רבות מרכזיות והיקפיות כולל מודולציה של מעבר דופאמין במסלול הניגרו-סטריאטלי כמו גם במסלול המזו-קורטיקו-לימבי, מודולציה במערכת העיכול והשפעות היפותרמיות ומשככות כאבים.
לפי סקירה של Binder וחב' ב-Pharmacol Rev משנת 2001, ישנן מספר אינטראקציות אנטומיות בין נוירוטנסין ודופאמין במערכת העצבים המרכזית, לרוב עם מודולציה רציפרוקלית של פעילויות השניים. נוירוטנסין משפעל פעילויות דופמינרגיות ונור-אדרנרגיות בהיפותלמוס, במצב בסיסי אך לא בתנאי רעב. החדרה מרכזית של נוירוטנסין מגבירה בפלזמה את הרמות של ACTH ושל corticosterone על ידי שהוא מעודד הפרשת cortical-releasing factor (להלן CRF) לתוך המערכת השערית של ההיפופיזה. בחיות שנכרתו בהן השחלות, הזרקה של נוירוטנסין באזור ה-preoptic, עודד הפרשה של LH, בעוד שהזרקתו לחדרי המוח עיכבה הפרשת LH. לעומת זאת, לא נמצאה כל השפעה בהזרקה ורידית שלו באדם. באשר להפרשת גונדוטרופין, מקום ההזרקה של נוירוטנסין קריטי לקביעת השפעתו על שחרור פרולקטין. הזרקה לתוך חדרי המוח מפחיתה רמות פרולקטין בצירקולציה, בעוד שהזרקתו לווריד מגבירה את רמת פרולקטין. אסטרוגן מגביר רמת mRNA של נוירוטנסין באזורים ספציפיים של ההיפו-תלמוס, אך לעומת זאת אסטרוגן מפחית את רמות נוירוטנסין באזור הקדמי של ההיפופיזה. כמו כן נמצא שנוירוטנסין מעודד הפרשה של TSH במנגנון פעולה אוטוקריני או פרקריני. נוירוטנסין הוא בעל פעילות הגנתית במודלים ניסויים בחיות בהן משרים אי ספיקה היפוסית צרברלית (Katz ב-Crit Care Med משנת 2004).
נוירוטנסין והפרשות במעי
הזרקה של נוירוטנסין אקסוגני לשריר או החדרתו לחדרי המוח, מעכבת הפרשת חומצת קיבה. החדרתו ההיקפית תלויה ב-vagus, וכמות הנוירוטנסין הדרושה לעכב הפרשת חומצת קיבה, גדולה מזו המושגת לאחר ארוחה עתירת שומן, כך שסביר להניח שנוירוטנסין פועל בשיתוף עם אנטרו-גסטרונים המופעלים על ידי ארוחות, כגון secretin. אינטראקציה דומה מזוהה גם עם הפרשה אקסוקרינית של הלבלב. נוירוטנסין כשלעצמו מגביר את הפרשות הלבלב האקסוקריניות, בעוד שהשילוב של נוירוטנסין עם secretin, מעודדת הפרשת חלבונים מהלבלב, והשילוב של נוירוטנסין עם cholecystokinin מעודד הפרשת ביקרבונאט מהלבלב. מסלולים כולינרגיים תורמים אף הם להשפעות המעודדות של נוירוטנסין בלבלב. נכון לזמן כתיבת מאמר זה לא סבורים שיש לנוירוטנסין השפעה המווסתת את הפעילות האנדוקרינית של הלבלב, כגון הפרשת אינסולין. גם הפרשות מעי מעודדות על ידי מינונים קטנים של נוירוטנסין. פרט להשפעה המעכבת של נוירוטנסין על הפרשת מיץ הקיבה ותנועתיות הקיבה, נוירוטנסין מקטין את שפיעת הדם ברקמת השומן, אך מגביר את שפיעת הדם במעי.
התפקיד של נוירוטנסין ושל NTR-1 בדלקות מעי:
מחקרים מוקדמים על נוירוטנסין ודלקות מעי עשו שימוש במודל in vivo של קוליטיס חריפה עם טוקסין A של Clostridium difficile שהוא אנטרוטוקסין המתווך בהופעת קוליטיס מטיפול אנטיביוטי בחיות ובאדם. מודלים מאוחרים יותר של פציעה הנגרמת על ידי קוליטיס בהחדרה לתוך המעי הגס של trinitrobrenzene sulfonic acid (להלן TNBS), או בהחדרה פומית של dextran sodium sulfate (להלן DSS), הראו אף הם את תפקידו החשוב של נוירוטנסין במודולציה של הדלקת. מחקרים אלה עשו שימוש באנטגוניסטים של NTR-1 או בעכברי knockout החסרים קולטן זה. הזרקה של toxin A מביאה לעלייה דרמטית של נוירוטנסין ושל NTR-1 ברירית המעי הגס של חולדות תוך מהלך של 4 שעות. לאחר חשיפה של ה-ileum לטוקסין A המוחדר למעי, טיפול קודם עם SR-48,692 האנטגוניסט של NTR-1, מעכב הפרשות מעי, מגביר את חדירות המעי, את הסננת נויטרופילים לרירית המעי, לשפעול תאי-פיטום ולנזק למעי הגס. תוצאות אלו מחזקות את הדעה שנוירוטנסין הוא פפטיד קדם-דלקתי במצבים של מגע עם אנטרוטוקסין חיידקי. נראה שבתהליך זה חשובים תאי פיטום, המכילים קולטן NTR-1, המתווך בהפרשת היסטמין בתגובה לנוירוטנסין. נמצא שנוירוטנסין משפיע על פעילות פגוציטית, כמוטקטית, וספיחתית של נויטרופילים, מקרופאגים, ולימפוציטים. נוירוטנסין יכול גם להשפיע על דלקת, על ידי מודולציה של חודרנות וסקולרית, על ידי איתות ישיר דרך קולטני NTR-1 המבוטאים גם על פני תאי אנדותל.
בהחלט סביר שנוירוטנסין מעודד דלקת באופן עקיף על ידי עידוד הביטוי של ציטוקינים קדם-דלקתיים, בקולונוציטים ובאדיפוציטים מזנטריים באדם. NTR-1 מבוטא בתאי אפיתל קולוניים בחולדה, בעכבר ובאדם, כמו גם בשורות תאים הלקוחים מאפיתל בסרטני המעי הגס. השפעול של NTR-1 על ידי נוירוטנסין, מביא להפרשת הציטוקין הקדם-דלקתי IL-8, ותגובה זו תלויה בהגדלת ריכוז סידן בתאים, ובשפעול של האנזים MAP kinase, בגורם השעתוק NF-κB, ב-PKC-δ, באנזים GTP-ase, וב-RhoA, Rac1 ו-Cdc42.
נוירוטנסין מעודד שגשוג וריפוי תאים ברירית מערכת העיכול:
חלק מתפקידי פפטיד טרופי זה מתבטאים בעידוד של גדילה ושגשוג של תאי אפיתל ברירית הקיבה, המעי הדק והמעי הגס, בתרחישים פתו-פיזיולוגיים עם נזק לרירית. הזרקת נוירוטנסין לחולדות, מחישה את השיקום של תאי רירית המעי לאחר התקשרות הפפטיד לקולטן NTR-1. Brun וחב' ב-Am J Physiol Gastrointest Liver Physiol משנת 2005, הראו שנוירוטנסין מעודד שיקום רירית המעי במודל DSS של קוליטיס כרונית. לאחר החדרה פומית של DSS, טיפול עם האנטגונסט הספציפי SR 48,692 של קולטן NTR-1 מחמיר את הנזק לרירית, בעוד שטיפול עם נוירוטנסין מפחית נזק זה, מפחית את הסננת נויטרופילים לרירית המעי, ומפחית את איבוד המשקל (Ackan וחב' ב-World J Gastroenterol משנת 2008). נמצא ש-NTR-1 מבוטא ברמות גבוהות יותר בביופסיות הלקוחות מאזורי מעי גס של נבדקים עם קוליטיס כיבית פעילה, מאשר באזורים ללא קוליטיס. חשיפה של קולונוציטים מאדם לנוירוטנסין, משפעלת את הקולטן ל-EGF, הקריטי לשיקום הנזק למעי (Zhao וחב' ב-Peptides משנת 2006).
נוירוטנסין ותגובות המעי לעקה:
תסמונת המעי הרגיז (IBS) היא תרחיש שכיח ומייסר של מערכת פגומה של תפקוד המעי הקשורה לעקה פסיכולוגית. במודל של עקידת חולדות ל-30 דקות ליצירת עקה, יש עלייה ברמת נוירוטנסין בפלזמה, הגברה בהפרשת mucin במעי, ירידה גדולה בתאי goblet, הפרשה יתרה של פרוסטגלנדין E2, ושפעול של תאי פיטום. אם לעומת זאת, מקדימים את יצירת העקה בחולדות על ידי החדרה של האנטגוניסט SR 48,692, נחלשות הפרשות ה-mucin והפרוסטגלנדין, אך משופעלים תאי הפיטום. תוצאות אלה מצביעות על כך שנוירוטנסין עשוי לתווך במספר תגובות של המעי הגס ובתסמינים של אלה הסובלים מ-IBS.
נוכחות משותפת של נוירוטנסין ונוירוטרנסמיטורים קלאסיים:
נוירוטנסין ממוקם ביחד עם דופמין בנוירונים אחדים במוח המרכזי ובהיפותלמוס. המיקום המשותף של נוירוטנסין ודופמין היווה כר פורה למחקרים על משמעות הצמידות של שני נירוטרנסמיטורים אלה. בקליפה ה-prefrontal של חולדות, נוירוטנסין נמצא רק באקסונים דופמינרגיים, אף על פי שחלק מאקסונים אלה אינם מכילים נוירוטוקסין. ההפרשה של נוירוטנסין בקליפת מוח זו מוגברת כאשר נוירונים דופמינרגיים משחררים דופמין באופן "התפרצותי" (Bean ו-Roth ב-J Neurosci משנת 1991). אגוניסטים של דופמין (המפחיתים את הפרשתו) דווקא מחישים הפרשת נוירוטנסין מאקסונים המכילים את שני נירוטרנסמיטורים אלה. היפוכו של דבר, לגבי אנטגוניסטים של דופמין, המפחיתים הפרשת נוירוטנסין ומחישים הפרשת דופמין. נראה אם כך, שהפרשת דופמין ונוירוטנסין מבוקרת באופן רציפרוקלי על ידי אוטו-קולטנים האחראים למודולציה של הפרשת דופמין. נוירוטנסין ותחלואה בנשים: רמות גבוהות של נוירוטנסין נכרכות עם הסיכון של נשים לחלות בסוכרת, סרטן שד ומחלה קרדיו-וסקולרית, על פי מחקרם של Melander וחב' מאוניברסיטאות Malmo ו-Lund שהתפרסם ב-JAMA בשנת 2012). מחקר זה גייס 29,000 גברים ונשים, והתמקד ב-4,632 ממשתתפי המחקר בהם נמדדו רמות מוגברות של נוירוטנסין בין 4–1991. המדגם האמור היה בגיל ממוצע של 57 שנה, והם נותרו במעקב עד שנת 2009. בנשים, אך לא בגברים, שפיתחו סוכרת, מחלת לב או סרטן שד, ואלה מתוכם שנפטרו בתקופת המעקב, רמות מוגברות של נוירוטנסין הגבירו את הסיכון לתחלואה האמורה (ב-41% להתפתחות סוכרת, ב-33% להתפתחות מחלות קרדיו-וסקולריות, ב-44% לסרטן השד, ב-13% לתמותה מכל סיבה, ול-50% למות ממת לב או שבץ מוחי). על פי Melander, מחקרים במודלים בחיות הראו בבירור שהורמון הנשי אסטרוגן, מעודד שגשוג תאים המייצרים נוירוטנסין, וכיוון שנשים נחשפות לאסטרוגנים לתקופת חיים ארוכה יחסית, רמת נוירוטנסין בהן גבוהה מזו שנמדדה בגברים. עם זאת, אין עדיין ראיות ישירות לכך למנגנון הכורך נוירוטנסין לתחלואה האמורה.
המשמעות של נוירוטנסין וקולטניו בסרטן המעי הגס:
נוירוטנסין נכרך בקרצינוגניות של מספר סוגי סרטן. נוירוטנסין הוא מיטוגן פעיל בסרטן המעי הגס והחלחולת (Wang ב-Clin Cancer Res משנת 2006). בסרטן המעי הגס יש ראיות ממחקרים in vivo ו-in vitro באדם, הכורכות פעילות הורמון זה עם התפתחות התאים הסרטניים. יתרה מכך, חסימה של התקשרות נוירוטנסין לקולטנו, נמצאה מעכבת התפתחות תאי סרטן בתרבית (Heasley ב-Oncogene משנת 2001, ו-Thomas וחב' ב-Endocrine Rev משנת 2003). ב-jejunum, נוירוטנסין מופרש מתאי N האנדוקריניים, בעיקר לאחר ארוחה עתירת שומן (Ferris וחב' ב-Peptides משנת 1985). בין פעילויותיו האנדוקריניות והפרקריניות, מודולציה של פעילות תאי שריר חלק וסקולריים, תנועתיות המעי, והפרשות לבלביות-מרתיות (Ferris ב-Comp Physiol משנת 2011). במערכת ההיקפית פעיל הקולטן NTR-1, בעוד שב-CNS חשוב יותר הקולטן NTR-2 (על פי Chalon וחב' ב-FEBS lett משנת 1996).
נוירוטנסין וקולטניו כרוכים בהתפתחות של מגוון רחב של סוגי סרטן. אלה כוללים סרטן שד, ערמונית, ריאות, כבד ולבלב (Dupouy וחב' ב-PLoS One משנת 2009, Souaze וחב' ב-Cancer Res משנת 2006, Alifano וחב' ב-Clin Cancer Res משנת 2010, Wang וחב' ב-Neuropeptides משנת 2011, ו-Allen וחב' ב-Peptides משנת 1988). ביטוי של הקולטן NTR-1 הגביר את השגשוג של גידולי סטרומה במערכת העיכול (Gromova וחב' ב-PLoS One משנת 2011). קישור נוירוטנסין לתאי סרטן ושליחת איתותים שלו מגיבים עם מסלולים אונקוגניים בתאים (Myers ב-ACS Chem Biol משנת 2009). נמצא בשורות תאים של סרטן המעי הגס, שנוירוטנסין מתקבל מהקודמן שלו, proneurotensis/neuromedin N על ידי האנזים prohormone convertase 5 (על פי Rovere וחב' ב-Bichem Biophys Res Commun משנת 1998). חלק מגידולי המעי הגס, מסנתזים ומפרישים נוירוטנסין, באופן המשפיע אוטוקרינית על שגשוג התאים הסרטניים (Evers וחב' ב-Ann Surg משנת 1992). בתרבית תאים, רמות פיזיולוגיות של נוירוטנסין מעודדים גידולם של שורות תאי מעי גס מאדם כגון SW480 ,SW620 ,HT29 ועוד, שכן אלה תאים המבטאים את הקולטן NTR-1 (על פי Maoret וחב' ב-Int J Cancer משנת 1999). אכן, קולטני נוירוטנסין נמצאו מבוטאים ב-40% של שורות תאי סרטן המעי הגס באדם.
נמצא שהביטוי של NTR-1 על פני תאי סרטן המעי הגס, מסתייע ב-מסלול האיתות של Wnt/APC (adenomatous polyposis coli), מסלול קרצינוגני מוכר בסרטן המעי הגס (Souaze וחב' ב-Carcinogenesis משנת 2006). במחקר על 30 מטופלים עם אדנוקרצינומה הקשורה למחלת מעי דלקתי (IBS), האחוז של תאי אפיתל החיוביים ל-NTR-1, גדל באופן מתקדם ממצבי דלקת גרידא לאדנוקרצינומה (Bossard וחב' ב-Peptides משנת 2007). ממצאים דמים התגלו על ידי Gui וחב' באותו כתב עת משנת 2008, שמדדו רמת NTR-1 ו-mRNA של קולטן זה ברירית תקינה של המעי הגס, ובדגימות שנלקחו מרקמת אדנוקרצינומה. בעוד שרמת NTR-1 mRNA לא נתנה לגילוי בתאי אפיתל בדרגת התמיינות גבוהה באפיתל תקין של המעי הגס, הוא נמצא ברמות מתונות באדנומה ובאדנוקרצינומה, ורמות גבוהות יותר נמצאו בשוליים החודרניים של אדנוקרצינומה. רקמה שהתקבלה מגרורות לבלוטות הלימפה של סרטן זה הכילו NTR-1 mRNA ברמות עוד יותר גבוהות.
נוירוטנסין אקסוגני גורם לשגשוג משמעותי של רירית המעי הדק הנורמלי, אך במעי הגס מינונים גבוהים וחשיפה ממושכת לנוירוטנסין (300 מיליגרם/ק"ג משקל גוף) שהוחדר 3 פעמים ביום למשך 10 ימים, עודדו שגשוג של רירית המעי הגס במודל של חולדות. נוירוטנסין החיש את הקרצינוגניות של רירית המעי הגס בחיות אחדות. בחולדות שהוזרקו עם azoxymethane שהוא קרצינוגן של המעי הגס וכן עם נוירוטנסין במינון של 200 מיליגרם/ק"ג משקל אחת ליומיים למשך 40 יום, מספר הגידולים הסרטניים, ממדיהם וחודרנותם גדלו משמעותית (Tasuta וחב' ב-Br J Cancer משנת 1990). החדרה של נוירוטנסין במינון של 300 מיליגרם/ק"ג משקל, עודד משמעותית שגשוגם של גידולי המעי הגס בעכברים, כמו גם את שגשוג גידולי מעי מאדם שהושתלו בעכברים (xenografts). החדרת נוירוטנסין הפחיתה משמעותית את ההישרדות של עכברים עם סרטן המעי הגס, בהשוואה לעכברים עם סרטן זה שהוזרקו עם saline (על פי Yoshinaga וחב' ב-Surg Oncol משנת 1992). שיעורי הסרטן היו מופחתים משמעותית בעכברים החסרים NTR-1, בהשוואה לעכברי-בר (Bugni וחב' ב-Int J Cancer משנת 2012).
הגידול של שורות תאי סרטן המעי הגס שהושתלו לעכברים חסרי תימוס, גורו על ידי נוירוטנסין בעוד ש-SR 48,692, האנטגוניסט של קולטני נוירוטנסין, עיכב את שגשוג הגידול. בדומה, החדרת נוירוטנסין לתוך הפריטונאום של עכברים, הגדיל את שיעור השגשוג של גידול מסוג HCT116 שהושתל בעכברים. חסימה של miR-21 ושל miR-155, שהם הגנים המקודדים ל-microRNA, האט את גידול התאים הסרטניים (Bakirtzi וחב' ב-Gastroenterology משנת 2011). לכן, נוירוטנסין ו-NTR-1 יכולים לשמש יעד פוטנציאלי למניעת גידול הסרטן בגישה טיפולית. Kamimae וחב' ב-Oncotarget משנת 2015, מצאו שהשתקה אפיגנטית של NTR-1, הייתה כרוכה בהפחתת החודרנות של גידולי המעי הגס. חוקרים אלה מצאו שבעוד שגידולים לא גרורתיים של המעי הגס, נטו לבטא רמות גבוהות של NTR-1 שעבר מתילציה ביתר, גידולי מעי גס גרורתיים נטו להכיל NTR-1 שלא עבר מתילציה. ייתכן שמתילציה של איי CpG ספציפיים בגן המקודד ל-NTR-1 גורמת להשתקת הגן בתאי גידול המעי הגס. מספר קבוצות בררו את האפשרות של שימוש במסלול נוירוטנסין כיעד לדימות לצורך גילוי גידולים סרטניים (Alshoukr וחב' ב-Bioconjugate Chem משנת 2009, Janssen וחב' ב-Cancer Biotherapy & Radio-pharmaceuticals משנת 2007, Wu וחב' ב-J Nucl Med משנת 2014, ו-Garcia-Garayoa וחב' ב-Eur J Nucl Med Mol Imaging משנת 2009). יתרה מכך, פּוּתח biosensor פלואורסצנטי המבוסס על אצות שיכול לנטר את השפעול של NTR-1 על ידי האגוניסט שלו (Ishii וחב' ב-Anal Biochem משנת 2014). במחקר שהעריך רמות נוירוטנסין בהשתתפות 56 חולים עם סרטן המעי הגס, ו-15 מתנדבים בריאים, רמות נוירוטנסין ו-IL-8 בדם, נמצאו שונות בין הנבדקים הבריאים לבין אלה עם המחלה הסרטנית. ערכי נוירוטנסין בפלזמה היו מעל 54.47 מיקרוגרם/מ"ל בעת גיוסם למחקר, עם רגישות של 77%, וספציפיות של 90%, בהערכה של גידול במעי הגס שאושרה בהמשך על ידי קולונוסקופיה. נתון זה מעלה את האפשרות להשתמש בנוירוטנסין כסמן לסוג סרטן זה (Sgourakis וחב' ב-Tumour Biol משנת 2014).
הנוכחות של נוירוטנסין בסרטן המעי הגס in vivo:
בשנת 1983 פרסמו Ulich וחב' לראשונה ב-Cancer, על כך שבאדנוקרצינומה של המעי הגס בדרגת התמיינות גבוהה ישנם תאים נוירואנדוקריניים רבים. בדגימות שהתקבלו מניתוחי סרטן מעי גס, זוהו רמות משמעותיות של נוירוטנסין, שלא נמצא ברירית תאים בריאים בקרבת הגידול. תפקידו של נוירוטנסין הודגם לאחר גילויו ב-13 שורות תאים מסרטן מעי גס באדם, בהמשך נמצא ש-NTR-1 היה מבוטא ב-35% של תאי סטרומה, ורק ב-12% של תאי אפיתל בסרטן המעי הגס (Chao וחב' ב-J Surg Res משנת 2005).
תפקידו של נוירוטנסין בטיפולים בסרטן המעי הגס:
טיפולים המכוונים כנגד מסלולי האיתות של נוירוטנסין וקולטניו נבחנו בתרבית תאים ובמודלים של חיות. סודיום בוטיראט, שהוא מעכב יעיל של האנזים histone deacetylase, הקטין דרמטית את רמות NTR1 mRNA ואת רמת נוירוטנסין. האנזימים ממשפחת histone deacetylase ידועים כגורמים לעצירת שגשוג, התמיינות ואפופטוזיס בתאי סרטן המעי הגס. לכן, ההשפעה המעכבת של סודיום בוטיראט, יכולה להיות בחלקה כתוצאה מהדיכוי של מסלול האיתות של נוירוטנסין וקולטנו (Wang וחב' ב-Mol Cancer Therap משנת 2010). בהקשר של מסלולי איתות תאי, נמצא שנוירוטנסין הוא בעל השפעה מעטה על רמות cAMP ועל cGMP בשורת תאי HT29, שמקורה בסרטן המעי הגס, אך הוא מעודד בחוזקה את התַּחְלוּפָה (turnover) של phosphtidylinositol (על פי Amar וחב' ב-FEBS Lett משנת 1986). במחקר אחד נמצא שנוירוטנסין עודד את הגיוס של סידן בתיווך phosphtidylinositol, אך לא את השפעול של האנזים protein kinase C (להלן PKC) בתאי HT29 (על פי Bozou וחב' ב-Biochem J משנת 1989). איתות של סידן הוא ווסת מפתח של תהליכים החיוניים להתמינות של תאי סרטן המעי הגס. בהקשר זה, נמצא שההתמיינות של גידול מסוג HT29, היא שלב מרכזי בהתמרה הסרטנית של תאי סרטן אלה (Chowdhuri וחב' ב-Biochem Biophys Res Commun משנת 2013). מחקרים מאשרים הדגימו שהוספה של נוירוטנסין לתאי סרטן מעי גס בתרבית, הביאו לגיוס סידן ולשפעול של מסלול MAPK/ERK, ומגבירה את הביטוי של c-fos (על פי Ehlers וחב' ב-Surgery משנת 1998, Briviba וחב' ב-Nutr Cancer משנת 2001, ו-Navarro וחב' ב-Peptides משנת 2006).
נמצא גם שנוירוטנסין משרה את הזרחון של glycogen synthase kinase (להלן GSK-3-) בתאי סרטן המעי הגס מסוג HCT116, דרך האנזים PKC (על פי Wang וחב' ב-Neoplasia משנת 2006). האנזים GSK-3 הוא ווסת של מגוון רחב של תהליכים תאיים כולל שגשוג תאים. בתאי HT29, נוירוטנסין משרה סינתזת DNA על ידי זרחון של ERK ו-Akt דרך טרנס-אקטיבציה של קולטני EGF. בסוגי סרטן אחרים, נויוטנסין משרה שפעול פרקריני של הקולטן של EGF (על פי Younes וחב' ב-Oncotarget משנת 2014). לעומת זאת, Massa וחב' ב-Biochem Biophys Res Commun משנת 2011, דיווחו שבתאי HT29 ו-HCT116, הזרחון של MAP kinase המושרה על ידי נוירוטנסין, אינו קשור ל-EGFR, וחסימת קולטן זה כשלעצמו אינה מעכבת את שגשוג תאי סרטן המעי הגס המושרית על ידי נוירוטנסין. במורד המסלולים התאיים, נוירוטנסין נמצא גם מעודד ביטוי דיפרנציאלי של 38 microRNAs, ובהם miR-21, ו-miR-155, הקשורים לשגשוג הגידול הסרטני, כפי שהודגם בתאי HCT116 (על פי Bakirtzi וחב' ב-Gastroenterology משנת 2011).
בסקירה של Muller וחב' ב-BMC Cancer משנת 2011, מצביעים חוקרים אלה על התפקיד של PKC ושל EGFR באיתות לשגשוג תאי קרצינומה של המעי הגס, המושרה על ידי נוירוטנסין. בעוד שההשפעות המיטוגניות של נוירוטנסין מתבצעות דרך הקולטן NTR-1, פחות מוגדר וברור תפקידו של הקולטן השלישי NTR-3. כאמור, קולטן זה אינו קשור לחלבוני G, אך הוא מהווה קולטן ל-sortilin. קולטן NTR-3 נמצא לא רק באברוני Golgi וברטיקולום האנדופלמטי התוך תאיים, אלא גם על פני הממברנה החיצונית של תאי סרטן של המעי הגס (Munck-Petersen וחב' ב-EMBO J משנת 1999). הקולטנים NTR-1 ו-NTR-3 מופיעים כהטרודימרים על פני תאי HT29. לאחר גירוי עם נוירוטנסין, קומפלקס הקולטנים מופנם אל תוך התאים. למעשה, שתי צורות של NTR-3 נמצאו בתאי HT29, האחת בעלת משקל מולקולרי גבוה הקשורה לממברנה ואחראית לאנדוציטוזה של נוירוטנסין, והאחרת בעלת משקל מולקולרי נמוך, שהיא קולטן תוך-תאי, האחראית להעברת הנוירוטנסין המוחדר לתא אל מערכת Golgi, ולגרעין כדי ליישם את פעילותו המיטוגנית (Morinville וחב' ב-Int J Biochem Cell Biol משנת 2004).
הוראות לביצוע הבדיקה:
מדידת נוירוטנסין מתבצעת על ידי radioimmunoassay ישירה. על הנבדק להיות בצום 10–12 שעות לפני נטילת הדם. על הנבדק איסור ליטול תכשירי antiacid או כל תרופה המשפיעה על תפקוד מערכת העיכול, אם הדבר אפשרי למשך 48 שעות לפני הבדיקה. הדם צריך להילקח במבחנה עם אנטי-קואגולנט כגון ציטראט או EDTA, ולאחר הפרדת הדם בסרכוז, יש להקפיא 3 מ"ל של פלזמה במהירות האפשרית. יש לפסול דגימת נסיוב, או דגימות פלזמה שהגיעו למעבדה בטמפרטורת החדר, או בקירור רגיל, אלא רק כפלזמה קפואה, ולא מופשרת. אין לפסול דגימות המוליטיות או ליפמיות באופן מתון, אך יש לפסול דגימות מאוד המוליטיות או ליפמיות. אין לפסול דגימות איקטריות בכל מקרה. הדגימה יציבה כפלזמה קפואה למשך 30 יום.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק