טרשת רב-מערכתית - Systemic Sclerosis
| טרשת רב-מערכתית | ||
|---|---|---|
| Systemic Sclerosis | ||
| ||
תופעת ריינו
| ||
| שמות נוספים | סקלרוזיס סיסטמית, טרשת מערכתית, סקלרודרמה | |
| ICD-10 | Chapter M 34. | |
| ICD-9 | 710.1 | |
| MeSH | D012595 | |
| יוצר הערך | פרופסור אלכסנדרה בלביר
|
|
סקלרודרמה או טרשת רב-מערכתית (SSc, Systemic Sclerosis ,Scleroderma) היא מחלה כרונית אוטואימונית, מתאפיינת בהתעבות העור כתוצאה מהצטברות סיבי קולגן. שקיעת קולגן מתרחשת בעור, בדפנות כלי הדם הקטנים ובאיברים הפנימיים. כתוצאה מכך נוצרת הפרעה באספקת דם לרקמות, שינוי במבנה של רקמות ואיברים ובסופו של תהליך הצטלקות של רקמות ואיברים פנימיים (ריאות, לב, כליות, מערכת העיכול, ועוד). הפרוגנוזה של המחלה נקבעת על פי מעורבות האיברים החיוניים, ובעיקר הריאות, הלב והכליות[1].
אפידמיולוגיה
סקלרודרמה היא מחלה נדירה. על פי נתונים מארה"ב, שכיחות המחלה היא 2.6 מקרים ל-10,000 איש (0.026 אחוז). כל שנה מאובחנים בין 2 עד 5/100,000 מקרים חדשים. המחלה שכיחה הרבה יותר בקרב נשים (ביחס של נשים לגברים 1:3-6); הופעתה של המחלה נדירה בקרב ילדים וקשישים. במרבית המקרים הביטויים הראשונים של המחלה מופיעים בגילאי 30-50 לחיים. שכיחות המחלה בקרב קרובי משפחה מדרגה ראשונה גבוהה יותר (1.3 אחוז - 1.6אחוז) מהשכיחות באוכלוסייה הכללית. מחקר של הגנום האנושי (GWAS) ומחקרים גנטיים על קבוצות גדולות של חולי סקלרודרמה הצביעו על שינוים במבנה של הגנים GSDMA ו- PRDM1 בקרב חולי סקלרודרמה; המשמעות הקלינית של תגלית זו טרם הובהרה.
אטיולוגיה
סקלרודרמה היא מחלה שהגורם לה אינו ידוע. חלה התקדמות בהבנת מנגנונים העיקרים של סקלרודרמה: הפרעה במערכת האוטואימונית, הפרעה וסקולרית ופיברוזיס:
- הפרעה אוטואימונית - בסקלרודרמה היא מגוונת. הפרעה בתפקוד לימפוציטים מסוג B מובילה ליצירת נוגדנים עצמיים, הכוללים נוגדנים לגרעין (ANA, Antinuclear Antibodies), ונוגדנים אופייניים לסקלרודרמה כגון נוגדנים לטופואיזומראז ( SCL-70 או Anti Topoisomerase, ATA), נוגדנים לצנטרומר (Anti Centromere, ACA), ונוגדנים ל-RNA 3 Polymerase (RANP-3); יש עוד רשימת נוגדנים אופייניים לסקלרודרמה אך בשלב זה טרם הוחל שימוש שוטף בהם.
בין המנגנונים של סקלרודרמה פעילות של תאי דלקת כמו לימפוציטים מסוג T, בזרם הדם לימפוציטים מסוג T מפרישים ציטוקינים מקדמי דלקת עם מאפייני דלקת מסוג Th1. לימפוציטים מסוג T שבודדו מהעור והרקמות של חולי סקלרודרמה מבטאים אופי של Th2 הכולל הפרשה מוגברת של ציטוקינים המקדמים תהליך הצטלקות (פיברוזיס), כגון Monocyte Chemotactic Protein-1 (MCP-1) ואינטרלויקינים (Interleukins, IL-6, IL-4, IL-10). כמו כן, בקרב החולים הודגמו רמות גבוהות של הקולטן ל Platelet-Derived Growth Factor (PDGF) , המזוהה עם הופעה של גנים מקדמי פיברוזיס על פני תאים פיברובלסטים - הפרעה וסקולרית - מתבטאת בשפעול של תאי אנדותל (שכבה פנימית של כלי דם) ושינוים במבנה כלי דם קטנים. בקרב החולים הודגמו רמות גבוהות של von Willebrand Factor, אחד מגורמים אחראים עם היצרות של כלי דם והפרעות קרישה. הפגיעה בכלי הדם גורמת להפרעה באספקת דם (איסכמיה) ונמק של הרקמות. כתגובה לפגיעה בכלי הדם, מתקיימת הפרשה מוגברות של Vascular Endothelial Growth Factor (VEGF), אך למרות זאת בנייה מחודשת כלי הדם הקטנים אינה תקינה ובמקום נימים תקינים נוצרים נימי דם ענק (Giant capillaries) פגומים. נימי דם ענק אלו ניתן לראות כעור או ריריות של חולי סקלרודרמה בצורה של "כוכבית", הנקראות טלאנגיאקטזיות (Telangiectasia).
סקלרודרמה מתאפיינת בהפרעה של האיזון בין חומרים ביולוגיים מכווצים כלי דם ומרחיבים כלי דם, לטובת המכווצים. נמצא קשר בין ערכים מוגברים של אנדותלין-1, מכווץ כלי הדם החזק ביותר, לחומרת תופעת רינו (Raynaud's phenomenon), כיבים באצבעות, יתר לחץ הדם הריאתי (PAH), והמשבר הכלייתיים בקרב חולי סקלרודרמה. אנדותלין-1 גם אחראי על קידום פיברוזיס והתרבות של תאי שריר חלק ושאר שכבות בדופן של כלי הדם עם היצרות של נימי דם ועורקים קטנים. בסקלרודרמה נמצא מחסור במרחיבים של כלי דם פוטנטיים כגון פרוסטציקלינים (PGI2) וNitric Oxide (NO). כתוצאה מכך , בחלק מנימי דם מתפתח עיבוי דופן, היצרות ומספרם יורד. ההשלכות הקליניות של התהליך כוללות פצעים ונמק בעור, הופעת PAH, התפתחות של משבר כלייתי, פגיעה בלב, במערכת העיכול - פיברוזיס - הוא סימן מובהק של סקלרודרמה, הוא בולט בעור אך גם מתרחש באיברים הפנימיים וברקמות שונות. בטבע, בתנאים של אירוע דלקת או איסכמיה מופעל תהליך שפעול תאי פיברובלסטים האחראים על ריפוי פצעים על ידי יצירת סיבי קולגן. בסקלרודרמה, פיברובלסטים מתפקדים ביתר שאת והופכים למיו-פיברובלסטים המייצרים עודפים של קולגן תהליך זה מבוקר על ידי ציטוקינים מקדמי-פיברוזיס, כגון -β Transforming Growth Factor (TGF-β) וConnective Tissue Growth Factor, (CTGF) ו-6-IL
הושם דגש על תפקוד מפתח של פיברובלסטים, תאי אנדותל של כלי דם בריאות, תאי אפיתל (תאים שמצפים דופן של חללי ריאות קטנטנים - alveoli) בתאים פריציטים (פריציטים מקשרים בין אנדותל ואפיתל) בשילוב עם תהליכי דלקת במעורבות ריאות בסקלרודרמה (מחלת ריאות אינטרסטיציאלית, Interstitial Lung Disease, ILD) ופיברוזיס בריאות (Pulmonary Fibrosis, PF). כתוצאה מהפרעה משולבת ברקמת ריאות, פיברובלסטים רבים נמשכים לאזורי הפגיעה ומבצעים "תיקון" לא מוסדר ולא מבוקר לנזק הקיים. במהלך פעילותם, פיברובלסטים בריאות הופכים למיו-פיברובלסטים, המייצרים כמויות מוגזמות של סיבי קולגןהצטלקות של רקמת ריאות ופגיעה בתפקוד הנשימתי. בנוסף, תאי דלקת שונים כמו מקרופאגים ולימפוציטים מגויסים לאתר הפציעה ומשחררים מתווכים מקדמי פיברוזיס; כך מתרחשים תהליכי גירוי בלתי פוסקים ולא מבוקרים של פעילות יתר של פיברובלסטים ומיו-פיברובלסטים עם התקדמות הפיברוזיס בריאות. תהליך הפיברוזיס בריאות תלוי בפעילות יתרה של מספר ציטוקינים כמו VEGF, PDGF, Factors Fibroblast Growth (FGF) ו TGF-βוגם בפעילות ירודה של תססים מסוגMetalloproteinase (MMP) האחראים על פירוק של קולגן ורקמה פיברוטית. הבנה של מנגנון זה הוביל לפיתוח תרופות שמעכבות את ההגעה של פיברובלסטים לריאות. דיכוי הפעילות של פיברובלסטים ומיו-פיברובלסטים בריאות מאפשר לעצור את שרשרת האירועים שמובילה לפיברוזיס ת ולמנוע נזק לרקמת הריאות [2].
קליניקה
למחלת סקלרודרמה שתי צורות עיקריות בהתאם לחומרת המעורבות של עור:
- סקלרודרמה מוגבלת (Limited Cutaneous Systemic Sclerosis ,LcSSc) מופיעה בכ-66 אחוזים מכלל החולים; היא מתאפיינת במעורבות עורית מוגבלת לאזורים היקפיים (כפות ידיים, אמות, פנים, וחלקי הרגל מתחת לברך). LcSSc בעלת מהלך איטי יותר, והיא כוללת תופעת רינו והופעת פצעים בקצות האצבעות (Digital Ulcers, DU). עם הזמן, נוצרת פגיעה במערכת העיכול ובחלק מהחולים יכול להתפתח יתר לחץ דם ריאתי (PAH), קלצינוזיס (שקיעת גושי סידן בעור ורקמות שהוא חומר דמוי גיר). פורסמו דיווחים על שכיחות לא מבוטלת של מחלת ריאות אינטרסטיציאלית (ILD) בקרב חולים עם צורת סקלרודרמה מוגבלת אשר הם נשאים נוגדנים ל-70-SCL
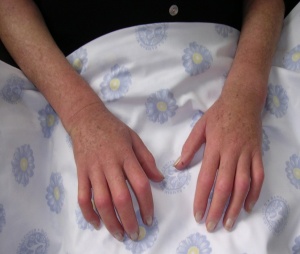
- סקלרודרמה נרחבת (Diffuse Cutaneous Systemic Sclerosis, DcSSc) מופיעה בכ-33 אחוזים מקרב חולי סקלרודרמה ובה עיבוי העור מופיע בצורה מפושטת (בנוסף למעורבות פנים, אצבעות ידיים וכפות רגליים, עיבוי העור מופיע גם בזרועות וירכיים, ובעור הבטן והחזה). מהלך של סקלרודרמה נרחבת סוער יותר, ומתאפיין בהסננה דלקתית של אזורי עור נרחבים. העור הופך לבצקתי ומאבד מגמישותו; החולים מתלוננים על עקצוץ וגרד, ולעתים אף על הרגשת "שרפה" וכאבים מפושטים בעור. הבצקת העורית בולטת יותר באצבעות ובכפות הידיים (Puffy Fingers/Puffy Hands). מתיחות העור עלולה להגביל את החולים בתנועת המרפקים, הכתפיים והירכיים ואף בתנועות נשימתיות של בית חזה. בחלק מהמקרים ניתן לחוש ברשרוש בזמן הנעת המפרקים בבדיקה פיזיקלית (Tendon Friction Rubs) כתוצאה ממעורבות נרתיקי גידים בדלקת ובפיברוזיס. לחולים עם סקלרודרמה נרחבת, תופעות מערכתיות כגון חולשה, עייפות וכאבי מפרקים ושרירים. בכשליש מחולי סקלרודרמה נרחבת מופיעה מעורבות שרירים, בצורת דלקת (Myositis) או בצורת איבוד נפח של שרירים (דלדול שרירים) . סמני מיוזיטיס כוללים כאבים וחולשה של שרירי הגפיים, עלייה ברמות אנזימי השריר (קריאטין פוספוקינאז CPK - , אלדולאז וטראנסאמינאזות -AST/ALT), הפרעה אופיינית בבדיקת אלקטרומיוגרפית (EMG), איבוד נפח שרירים וירידה בכוח גס של שרירים. בבדיקת הדמיה תהודה מגנטית (Magnetic Resonance Imaging, MRI) ניתן לאבחן סימני דלקת, נזק ודלדול של שרירים. מעורבות של ריאות (ILD, PF), לב וכליות שכיחות יותר בצורת סקלרודרמה הנרחבת. הופעת פצעים באצבעות, מעורבות מערכת העיכול, קלצינוזיס שכיחים בסקלרודרמה נרחבת
- סקלרודרמה ללא ביטוים בעור (Scleroderma sine Scleroderma) היא צורה נדירה של סקלרודרמה (1-2 אחוזים מכלל החולים) אך גם בה יש תסמונת רינו, נמצאים נוגדנים ומעורבות איברים פנימיים אופייניים לסקלרודרמה בעיקר מערכת העיכול ויתר לחץ דם ריאתי
שלבי הופעת המחלה
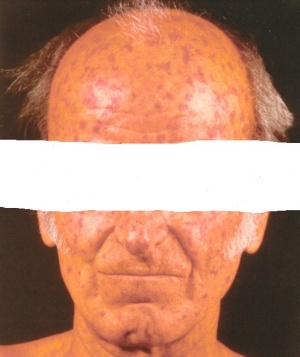
רוב נתיבי מנגנוני הסקלרודרמה מתקיימים במקביל. מעורבות של כלי דם בצורה של התקפי רינו יכולה להקדים ביטוים אחרים של סקלרודרמה בחודשים ואפילו בשנים. בחלק מהחולים כבר בשלב זה יהיה ניתן למצוא בדם נוגדנים מסוג ANA וגם את אחד הנוגדנים ספציפיים לסקלרודרמה (SCL-70, ACA, RNAP-3). בשלבים מוקדמים עיבוי עור הפנים יוצר מראה "צעיר", היעלמות של קמטים והגבלה במפתח הפה. עם הזמן, עיבוי העור ברוב האזורים נסוג, אבל יכולים להישאר שינוים בצבע העור לכיוון שחום יותר או להפך, עם היעדר פיגמנט והלבנה בצורת "מלח ופלפל". השפתיים מאבדות מהעסיסיות, פתח הפה נהיה קטן יותר ונוצרים קמטים אנכיים אופייניים סביב הפה.
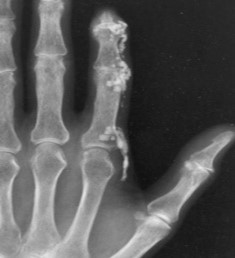
עם התקדמות סקלרודרמה יכול להופיע קיבעון של המפרקים (קונטרקטורות), שינוי בצורת האצבעות (Sclerodactyly) ונסיגה של קצות האצבעות (Acro-osteolysis) והופעת קלצינוזיס בעור ורקמות רכות האופייניים לשתי הצורות של סקלרודרמה, מוגבלת ונרחבת. הבדלים במהלך קליני של מחלה "צעירה" (עד 5-7 שנות מחלה) ומחלה "מאוחרת" בולטים בעיקר בסקלרודרמה נרחבת (DcSSc); הבדלים אלו פחות בולטים במחלה מסוג סקלרודרמה מוגבלת (LcSSc).
לא כל החולים מציגים את כל התופעות של סקלרודרמה.
מעורבות עורית - סקלרודרמה
עיבוי העור הוא הביטוי המובהק של סקלרודרמה. את הפגיעה העורית ניתן לאמוד בעזרת המדד ע"ש רודנן (mRSS, Modified Rodnan Skin Score) בבדיקה ידנית. לפי שיטה זו, מחלקים את שטח הגוף ל-17 אזורים (פנים, חזה, בטן, זרועות, אמות, כפות ידיים, אצבעות הידיים, ירכיים, שוקיים, כפות הרגליים) ונותנים ציון בין 0 לבין 3 לכל אזור ע"פ חומרת העיבוי של העור. מדד mRSS מתייחס לסכום הכולל של נקודות בכל האזורים; מדד mRSS מעל 12 או עליה מהירה בmRSS (מעל 5 נקודות) בפרקי זמן קצרים מעידים על מעורבות נרחבת ומנבא מחלה קשה יותר. הימצאות של נוגדנים ל70-SCL או 3RNAP- מזוהה עם מעורבות עור נרחבת.
ביופסיית עור בשלבים המוקדמים של סקלרודרמה מדגימה הסננה של העור והרקמות התת עוריות על ידי תאי דלקת ושקיעה של סיבי קולגן סביבם. עם השנים עיבוי העור נסוג במידה מסוימת, אך מותיר עור צלקתי, עם שינויים בצבע באזורים הנגועים. השינויים באצבעות (Sclerodactyly) אינם הפיכים; עיוותים של אצבעות וקיבעון (קונטרקטורות) במפרקים גורמים להפרעה בתפקוד הידיים ולהגבלה בטווח התנועה במפרקים.
מעורבות עורית פוגעת באופן קשה באיכות החיים של החולים, הן במישור הפיזי והן במישור הנפשי. לחולים קשה לקבל את השינויים החלים בגופם, והם סובלים מהערכה עצמית נמוכה ולעתים אף מחרדות, נדודי שינה ודיכאון.
טיפול בסקלרודרמה נרחבת הוא אתגר. במחקר קליני מבוקר (RCT, Randomized Controlled Trial ) נמצא ש-Methotrexate (מתוטרקסאט) עוזר במחלת עור נרחבת[3].
ב-RCT שמטרתם הייתה בדיקת יעילות של Cyclophosphamide (ציקלופוספמיד) ו-Mycophenolate Mofetyl (סלספט) במחלת ריאות אינטרסטיציאלית (ILD), נבדקה גם השפעתן על העור; ציקלופוספמיד וסלספט שיפרו את המצב של העור בצורה משמעותית[4].
דווח כי טיפול בקרני אור אולטרה סגול (UV) עשויות לסייע להתרככות העור בחולים עם סקלרודרמה נרחבת. בעקבות מידע מדעי שהצטבר נערכו מספר RCT עם טיפולים ביולוגיים שונים. במחקרים שונים, מחקר ASSET עם Abatacept (מכוון לתאי T לימפוציטים), מחקרים focuSSced ו-faSScinate עם Tocilizumab (מכוון לקולטנים ל6-IL)[5][6], מחקר RISE-SSc עם Riociguat (ממריץ גואנילט ציקלאז)[7] ומחקר CORBUS עם Lenabasum (מכוון לקולטנים קנאביואידים)[8] נבדקה השפעתה של תרופת מחקר על עיבוי העור לפי שינוי של מדד רודנן (mRSS) או על פי מדד מורכב ממספר נתונים CRISS (Combined Response Index in Diffuse Cutaneous Systemic Sclerosis); מחקרים לא השיגו נקודת יעד ראשונית (Primary endpoint). בסדרות קטנות לא מבוקרות דווח על הטבה במצב העור בעקבות טיפול בRituximab מכוון לאנטיגן CD20 מוצג על פני לימפוציטים מסוג B[9]. דווח על יעילות של Romilkimab (נוגדן המכוון לנטרל IL-4 /IL-13) לטיפול במעורבות של עור בסקלרודרמה[10]. פורסמו תוצאות של RCT אירופאי (ASTIS)[11] ואמריקאי (SCOT)[12] על טיפול בהשתלת תאי האב של מח העצם (Hematopoietic stem-cell transplantation,HSCT) בחולים עם מחלת עור דוהרת. טיפול ב-HSCT הראה הטבה משמעותית בעור, הטבה במצב הריאות ובהישרדות לטווח הארוך; הערכה מערכתית קפדנית לפני HSCT ובחירה של חולים מתאימים להשתלה (ללא מעורבות לב או מעורבות ריאות משמעותית) אפשרו שיפור בתוצאות התחלואה והתמותה הקשורים לפעולה עצמה ושיפרו את שיעורי ההישרדות במהלך שנות המעקב. טיפולים משלימים כמו פיזיותרפיה, הידרותרפיה וריפוי בעיסוק מהווים חלק חשוב מהטיפול הכללי בפגיעה העורית, ומסייעים בשמירה על גמישות העור, גידים ומפרקים. לביטויים עוריים מסוימים, כגון טלאנגיאקטזיות, שינויים בצבע העור וקלצינוזיס טרם נמצא טיפול יעיל.
סיכום:
המעורבות העורית מהווה ביטוי קליני מובהק של סקלרודרמה. ברוב המקרים, חומרת הפגיעה בעור תואמת את חומרת המעורבות של מפרקים, שרירים ואיברים חיוניים.
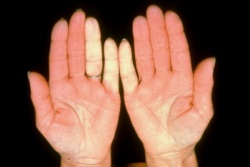
תופעת רינו (Raynaud's phenomenon)
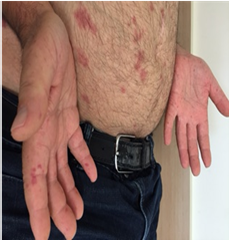
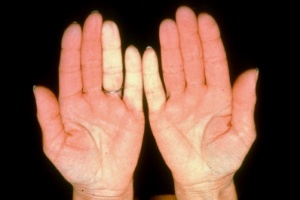
תופעה רינו היא ביטוי הכרחי של סקלרודרמה. תופעה זו יכולה להקדים ביטויים אחרים של המחלה בשנים רבות, בעיקר בצורתה המוגבלת. בסקלרודרמה נרחבת תסמונת רינו מופיעה במקביל או בסמוך להופעה של עיבוי העור. ביטוי עיקרי של תופעת רינו הוא שינוי חולף בצבע עור: חוור-לבן, כחול-סגול ואדום נובע מהתכווצות של נימי דם במצבים של קור או התרגשות. לרוב התקפי תופעת רינו מתרחשים באצבעות הידיים, פחות שכיחה מעורבות אצבעות ברגליים ועוד יותר נדירים התקפי רינו בקצה האף, לשון, פטמה. עישון סיגריות הוא גורם הסיכון המיוחס לחומרת הביטוי של תופעת רינו והכיבים.
תופעת ריינו ראשונית – מופיעה אצל אנשים ללא היסטוריה של מחלת רקמות חיבור (Connective Tissue Disease, CTD) או הפרעות קרישה או הפרעה באספקת דם לעורקים (Peripheral Vascular Disease). תסמונת רינו ראשונית שכיחה בקרב נשים צעירות, וב-30 אחוזים מהמקרים קיים סיפור משפחתי. בתסמונת רינו ראשונית אין שינויים מבניים בכלי הדם, לא מוצאים נוגדנים עצמיים ואין סיבוכים כמו איסכמיה, כיבים, או נמק. בדיקת נימי דם העוריים סביב מיטת הציפורן בהגדלה בעזרת מכשיר קפילרוסקופ (Capillaroscopy) מדגימה נימי דם תקינים.
תופעת ריינו משנית – מופיעה כביטוי של מחלות אוטואימוניות (CTD) או בעקבות הפרעות קרישה או מחלות כלי דם. בתופעת רינו משנית ל-CTD (כולל סקלרודרמה) ההתקפים מופיעים בתדירות גבוהה ובעוצמה רבה יותר, התקפים מלווים בהרגשת נימול או דקירות בקצות האצבעות. בסקלרודרמה, תופעת רינו נובעת מעיבוי ניכר בדופן נימי דם ועורקים, היצרות וסגירה שלהם עם ההפרעה באספקת הדם לרקמות. בחולים עם הופעת תופעת רינו חדשה הימצאות נוגדנים עצמיים כמו ANA ונוגדנים ספציפיים 70-SCL, ACA, 3RNAP- מעלים חשד לסקלרודרמה. בתופעת רינו על קרע סקלרודרמה בדיקה קפילרוסקופיה מדגימה את השינויים האופייניים למחלה כולל הופעת דימום מחוץ לנימי דם, נימי דם ענקיים "Giant Capillaries", ירידה במספר ואף היעלמות של נימי דם עם הופעת נימים בעלי צורה מופרעת. במחקר תצפיתי VEDOSS (Very Early Diagnosis of Systemic Sclerosis) של קבוצה אירופאית לחקר סקלרודרמה EUSTAR (European Scleroderma Trials and Research group[13] שילוב של תופעת רינו עם בדיקת ANA חיובית והופעת נפיחות באצבעות (Puffy Fingers) ניבא התפתחות של מחלת רקמות חיבור בכ40% אחוזים מהמקרים. במקרים בהם נמצאו אחד מהנוגדנים האופייניים לסקלרודרמה (70-SCL או ACA) בשילוב עם שינויים אופייניים בבדיקת קפילרוסקופיה, הסיכוי להתפתחות של סקלרודרמה היה 7.4 אחוזים בשנה ראשונה, 29.3 אחוזים אחרי 3 שנים ו-44.1 אחוזים אחרי 5 שנים.
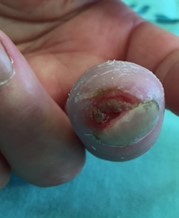
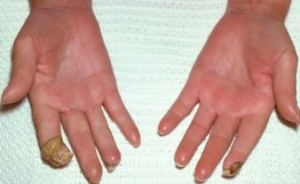
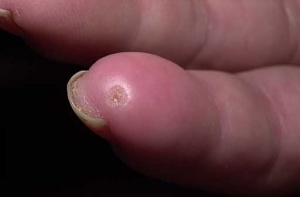
כיבים באצבעות (Digital Ulcers, DU)
כיבים בעור מופיעים במחצית מחולי הסקלרודרמה. מיקומם בדרך כלל בקצות האצבעות אך הם עשויים להופיע גם במקומות בהם העור מתוח: מעל מפרקי כפות הידיים או מעל המרפקים. הופעת פצעים בבהונות הרגליים יחסית נדירה. שליש מהחולים סובלים מכיבים חוזרים בעלי אופי עקשני עם נמק ונטייה לזיהום ברקמות. לאחר ריפוי הכיבים, נותרת בקצות האצבעות צלקת עגולה וקעורה, הנקראת Pitting Scar.
הכיבים משפיעים באופן משמעותי על איכות החיים בשל עוצמת הכאבים הגבוהה והירידה בתפקוד הכללי במיוחד בתפקוד הידיים. בשאלונים להערכת תפקוד כללי בשם Scleroderma Health Assessment Questionnaire (SHAQ) חולים רבים דיווחו על השפעה ניכרת בפעילות יום-יומית כללית ובזאת שתלויה בתפקוד הידיים.
מטרות הטיפול בכיבים הן ריפוי ושיפור איכות החיים של המטופלים. חשוב לשמור על היגיינה טובה של הידיים, לשמן אותן עם קרם לחות, למנוע פצעים טראומטיים ולהפסיק עישון.
לטיפול בתסמונת רינו משתמשים במרחיבים כלי דם כגון חסמי תעלות סידן, מעכבי ACE ותרופות נוגדות דיכאון בשל השפעתן החיובית על הרחבה של כלי דם קטנים. חולים שאינם משתפרים עם טיפול פומי, נזקקים לטיפול בעירוי לווריד של Iloprost. ב-RCT מתן של עירוי Iloprost לחולי סקלרודרמה הביא לשיפור משמעותי בתדירות וחומרת התקפי רינו וקידום ריפוי פצעים. עם סימני זיהום בפצע, משתמשים באנטיביוטיקה (רצוי בהתאם לתוצאות תרבית מהפצע) מקומי או סיסטמי. במקרים קשים, ייתכן צורך בהטריה כירורגית של הרקמות הנמקות. במקרים של איסכמיה קשה ונמק עמידים לטיפול יש צורך בבדיקות קרישה, בהערכה של מומחה כלי דם והדמיה של העורקים בעזרת אולטרה-סאונד או אנגיוגרפיה. במקרים של איסכמיה עמידה לטיפול ניתן לשקול סימפטקטומיה (Sympathectomy) ושימוש בתא לחץ. במקרים של הפרעות קרישה, מומלץ להוסיף טיפול בנוגדי קרישה (זריקות Clexane, Enoxaparin). שני RCT הראו יעילות של Bosentan (Tracleer)[14] המעכב קולטנים לאנדותלין-1, במניעת הופעה של כיבים חדשים בקרב חולי סקלרודרמה. דווח על יעילות של Sildenafil (סילדנפיל) מעכב של פוספודיאסתראז (PDE-5) על כיבים איסכמיים עמידים לטיפול.
מעורבות איברים פנימיים
מעורבות האיברים הפנימיים היא הקובעת את חומרת המחלה ואת הפרוגנוזה. המעורבות הראייתית היא הגורם העיקרי למוות בקרב חולי הסקלרודרמה, ולאחריה המעורבות הלבבית, הכלייתית, ומעורבות מערכת העיכול.
מעורבות ריאתית
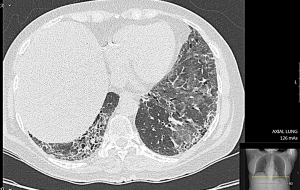
מעורבות הריאות בחומרה שונה מופיעה בכ-80 אחוזים מחולי סקלרודרמה, ב20-30 אחוזים מהם למעורבות ריאות השלכת קלינית ניכרת. מעורבות ריאות בדרך כלל מתבטאת במחלת ריאות אינטרסטיציאלית (ILD, Interstitial Lung Disease). כ-60 אחוזים מהחולים עם ILD ו-PF הם חולים עם מחלת סקלרודרמה נרחבת; בכ-40 אחוזים מחולים עם ILD וPF מחלת העור הינה מוגבלת. נוגדני 70-SCL מזוהים עם ILD וPF בקרב חולי סקלרודרמה נרחבת ומוגבלת. שכיחות של ILD ו-PF בקרב חולים עם מחלת סקלרודרמה מוגבלת הנושאים נוגדנים מסוג ACA נמוכה. בשלבים המוקדמים של סקלרודרמה, בעיקר בנוכחות נוגדנים מסוג 70-SCL, מתפתחת דלקת בדופן נאדיות הריאה הנקראת אלביאוליטיס (Alveolitis). עם התקדמות של אלביאוליטיס מתפתחת הצטלקות של רקמת הריאות (Pulmonary Fibrosis, PF). מעורבות ריאתית משמעותית גורמת באופן בלתי נמנע ליתר לחץ דם ריאתי (PAH) ומצוקה לבבית.
בשלבים המוקדמים הסתמנות של ILD אינה ספציפית ולרוב סמויה. כשליש מהחולים מתלוננים על שיעול יבש, ממושך וטורדני וקשיי נשימה במאמץ, מיחושים לא ספציפיים בחזה, חולשה ועייפות. עם התקדמות השינויים הפיברוטיים בריאות, מופיע חוסר אוויר במאמץ קטן ובמנוחה. לרוב החולים יש. בבדיקה פיסיקלית שומעים חרחורים יבשים מעל בסיסי הריאות. בשלבים המתקדמים של הפיברוזיס בריאות וירידה בריווי החמצן בדם, מופיעים סימנים של אי ספיקת לב ימין (גודש ורידי צוואר, הפרעות קצב הלב, הגדלת כבד, מיימת ובצקות ברגליים. בדיקת בית החזה בעזרת צילומי רנטגן איננה רגישה לגילוי של ILD; הבדיקה המומלצת לגילוי ולהערכה של ILD היא בדיקת טומוגרפיה ממוחשבת ברזולוציה גבוהה של בית החזה (High Resolution CT-HRCT). בדיקת HRCT מאפשרת לקטלג שינוים אינטרסטיציאליים בשדות ריאות כמו "זכוכית מט" (Ground Glass Opacities), שינוים רשתיים (Reticular Changes) או שינוים בצורת "חלת דבש" (Honey Combing), והרחבה של הסמפונות ((Traction Bronchiectasis. לשינויים אינטרסטיציאליים בריאות מספר צורות; בהכשר ל-CTD השכיחות ביניהן Non-Specific Interstitial Pneumonia (NSIP) ו-Usual Interstitial Pneumonia (UIP). בסקלרודרמה, יותר שכיחה NSIP ופחות שכיחה צורה של UIP; ל-UIP התקדמות הפיברוזיס עמוקה יותר לעומת NSIP. קיימת התאמה בין חומרת השינויים ב-HRCT וירידה במדדי תפקודי נשימה; פגיעה ביותר מ-20 אחוזים משטחי הריאות, המודגמת ב-HRCT, מנבאת שיעורי תחלואה ותמותה גבוהים יותר בקרב חולי סקלרודרמה. הומלץ על ביצוע HRCT של בית החזה לכל חולה סקלרודרמה חדש ומעקב סדיר אחרי שינויים בפרקי זמן נדרשים (בין 6-12 חודשים), ביחוד בחולה עם גורמי סיכון לILD) סקלרודרמה נרחבת, הימצאות נוגדנים 70-SCL). הפרעה בתפקודי נשימה נמצאה בכ-25 אחוזים מהחולים כבר ב-3 השנים הראשונות מתחילת הסקלרודרמה. בין המדדים העיקריים להערכת מצב הריאות בחולי סקלרודרמה בדיקת נפח Forced Vital Capacity (FVC) ובדיקת חילופי גזיםDiffusing Capacity of the Lungs For Carbon Monoxide (DLCO). ירידה מקבילה בFVC וDLCO מצביעה על קיומה של ILD. ערכי DLCO ו-FVC נחשבים ירודים כאשר הם מתחת ל-80 אחוזים מהתקן ביחס לגיל, מין וגובה. ירידה מעבר ל-50 אחוזים מצביעה על פגיעה ראייתית קשה ומנבאת שיעור תמותה גבוה ב-3 השנים הבאות. ירידה של כ-10 אחוזים בFVC וכ-15 אחוזים בDLCO בפרקי זמן קצרים נחשבת כסמן למחלת ILD מתקדמת. חולי סקלרודרמה עם ILD מתקשים בהליכה של 6 דקות (Minute Walk Test 6); מרחק הליכה הנמוך מ-300 מטר וירידה בריווי חמצן הנמדדת באצבע בעזרת מכשיר אוקסימטר לפני ואחרי המאמץ מעיד על מעורבות ריאות משמעותית. לבדיקת שטיפת סמפונות אין תרומה משמעותית לאבחנה של ILD, לרוב נעזרים בה בחשד למחלת ריאות אחרת (זיהום וכדומה). ביופסיה פתוחה מריאה איננה חובה בחשד לILD; לרוב ביופסיה מתבצעת לצורכי מחקר או במקרים בהם אבחנה של ILD מוטלת בספק.
אין הסכמה גורפת בנוגע ליעילותה של בדיקת BAL, הכוללת שטיפת סימפונות וספירת תאי הדלקת בהפרשה הברונכיאלית, לאבחנה ולמעקב אחר המחלה הריאתית. באופן עקרוני, ברקמה בריאה נצפה למצוא מקרופגים, ובחולה עם טרשת רב-מערכתית נראה נויטרופילים, אאוזינופילים ותאי CD-8. לעומת זאת, ביופסיה מרקמת הריאה יכולה לתת מידע מדויק על חומרת הדלקת וההצטלקות - אך השימוש בה מוגבל כאשר האבחנה אינה ודאית.
מטרת הטיפול במחלה הריאתית היא שיפור התפקוד הגופני ואיכות החיים של החולים, והפחתת שיעור התמותה. הטיפול המקובל במחלה כיום הוא Endoxan. למרות ריבוי המחקרים בנושא, עדיין לא נקבעה צורת המתן המיטבית, כמו גם משך הטיפול המומלץ וטיפול ההמשך הנדרש.
אפשרות נוספת לטיפול כוללת את התרופות Imuran (Azathioprine) (אימורן; אזתיופרין) או Mycophenolate Mofetyl, אך יעילותן של תרופות אלו טרם הוכחה בצורה חד משמעית במחקרים מבוקרים. גם יעילותם של סטרואידים לטיפול במחלה הריאתית טרם ידועה.
בחולים עם מחלה מתקדמת וסימנים של יתר לחץ דם ריאתי, הטיפול זהה למקרים של יתר לחץ דם ריאתי ראשוני.
סיכום
המעורבות הריאתית מופיעה כבר בשנים הראשונות למחלה, בעיקר בחולים עם נוגדנים מסוג SCL-70 או RNA-III-P. התסמינים הקליניים של המחלה הריאתית אינם ספציפיים. ישנה חשיבות רבה לגילוי מוקדם של המחלה הריאתית, ולהערכה קלינית חוזרת מדי 2-4 חודשים בסיוע בדיקות עזר. טיפול אגרסיבי מוקדם עשוי למנוע את התפשטות הפיברוזיס הריאתי ואת ההופעה של יתר לחץ דם ריאתי.
גם מחלה המזוהה בשלב מוקדם בהדמיה בלבד וללא תסמינים קליניים מצריכה מתן טיפול, על מנת למנוע את יצירת ההצטלקות הריאתית המפושטת. היעדר מעורבות ריאתית בחמש השנים הראשונות למחלה מצביעה על סבירות נמוכה למעורבות ריאתית בהמשך.
יתר לחץ דם ריאתי
יתר לחץ דם ריאתי נוצר כתוצאה מהפרעה בזרימת הדם בעורקי הריאה. האבחנה מבוססת על מדידה ישירה של הלחץ בעורק הריאה, המבוצעת באמצעות צנתור לב ימין. לחץ ממוצע בעורק הריאה הגבוה מ-25 מ"מ/כספית במנוחה או 30 מ"מ/כספית במאמץ נחשב מוגבר. בהיעדר לחץ יתד מוגבר (Wedge Pressure>15 מ"מ/כספית), ניתן להסיק כי העלייה בלחץ הריאתי מתרחשת כתוצאה מגורם ריאתי ולא לבבי. יתר לחץ דם ריאתי נחשב לאחד הביטויים הקשים של המחלה, עם שיעורי תחלואה ותמותה גבוהים.
האטיולוגיה של יתר לחץ הדם הריאתי כוללת פגיעה בשכבת האנדותל בעורקי הריאה, המלווה בהפרעה באיזון בין החומרים המכווצים את כלי הדם לחומרים המרחיבים את כלי הדם הריאתיים. בקרב חולי טרשת רב-מערכתית הסובלים מיתר לחץ דם ריאתי הודגמו רמות גבוהות של ET-1, מכווץ כלי הדם הריאתיים החזק ביותר, וחסר של NO ופרוסטציקלין. עורקי הריאה מתכווצים, ותאים בשכבת הדופן שלהם עוברים תהליך של שגשוג כך שהדופן מתעבה והקוטר קטן, עד לסגירה מלאה. זרימת הדם בעורקים אלו נפגעת, וכתוצאה מכך הלחץ במערכת עולה עד לפגיעה בתפקוד הלב הימני - המתרחב וכשל.
הקליניקה של יתר לחץ דם ריאתי אינה ספציפית. ברוב המקרים, החולים מתלוננים על חולשה, עייפות, מיחושים בבית החזה וקשיי נשימה במאמץ. עם התקדמות המחלה, קשיי הנשימה מופיעים גם במאמצים קלים ואף במנוחה. חלק מהחולים אפילו מדווחים על תחושת עילפון במאמץ. קוצר נשימה במנוחה, איבוד הכרה וסימנים של אי ספיקת לב ימין הם ביטויים מאוחרים עם פרוגנוזה גרועה.
10-15% מהחולים מפתחים יתר לחץ דם ריאתי בעל משמעות קלינית. שני שליש מהחולים המפתחים יתר לחץ דם ריאתי סובלים מהצורה המוגבלת של המחלה, ושליש מהם סובלים מהצורה הנרחבת.
בבדיקה גופנית לעתים ניתן לשמוע קול שני מוגדש מעל המסתם הריאתי. כמו כן, בשלב מאוחר עשויים להופיע סימנים של אי ספיקת לב ימנית. באק"ג ניתן להדגים סימני עומס על חדר ימין וסטייה ימנית של הציר. צילום חזה עשוי להדגים הרחבת כלי דם בשערי הריאות ומיעוט כלי דם בפריפריה. הריאות נראות שחורות היות וכלי הדם חסרים או חסומים. אקו לב מאפשר למדוד את הלחץ בעורקי הריאה בצורה עקיפה, וצנתור לב ימין מאפשר למדוד את הלחץ הזה באופן ישיר.
מהלך המחלה פרוגרסיבי וקשה - ללא טיפול ביתר לחץ דם ריאתי, תוחלת החיים קצרה ביותר - עד 2.5 שנים מרגע האבחון. אם כן, גילוי מוקדם עשוי לאפשר טיפול למניעת הפגיעה הבלתי הפיכה בכלי הדם הריאתיים. לצורך כך מבצעים הערכה קלינית חוזרת של החולים בפרקי זמן בין 3-6 חודשים, הכוללת שאלון תפקודי והערכה על ידי NYHA, בדיקה גופנית, מבחן הליכה למשך 6 דקות, ובדיקת תפקודי ריאה. ביתר לחץ דם ריאתי ראשוני, אופייני למצוא FVC שמור עם ירידה משמעותית של ה-DLCO. אקו לב מאפשר להעריך את יתר לחץ הדם הריאתי, אך בדיקת הבחירה לאבחנה היא צנתור לב ימין. הפרוגנוזה תלויה בעיקר ב-NYHA ובשינויים ההמודינמיים המודגמים בצנתור.
לאחרונה, גובר השימוש בסמנים ביולוגיים למעקב אחר החולים עם יתר לחץ דם ריאתי. BNP, ומקבילו NT pro-BNP, הם חומרים שרמתם עולה במצבים שונים, כולל יתר לחץ דם ריאתי. ישנה התאמה בין רמת ערכים אלו לחומרת יתר לחץ הדם הריאתי, חומרת אי ספיקת לב ימין, והצפי לתגובה לטיפול.
הבנת מנגנוני התפתחות יתר לחץ הדם הריאתי הביאה לפיתוח תרופות מכוונות לתופעה. PGE2 הוא מרחיב כלי דם חזק המונע שגשוג תאים בדופן כלי הדם והיצרות שלהם. הסינתזה של PGE2 לקויה בקרב החולים עם יתר לחץ דם ריאתי. לאור כך, קיימים שלושה סוגי PGE2 סינטטי המשמשים לטיפול ביתר לחץ דם ריאתי:
- Flolan (Epoprostenol) (אפופרוסטנול; פלולן) - הניתן תוך-ורידית דרך משאבה
- Iloprost (אילופרוסט) - הניתן תוך-ורידית דרך משאבה, או בשאיפה
- Remodulin (Treprostinil) (טרפרוסטניל; רמודולין) - הניתן תוך-ורידית או תת עורית דרך משאבה
מתן טיפול ללא הפסקה דרך משאבה מתאים לחולים עם יתר לחץ דם ריאתי קשה וירידה בתפקוד הכללי לרמת III-NYHA Class IV. בחולים עם יתר לחץ דם ריאתי קל יותר וירידה תפקודית בדרגת II-I Class NYHA, הטיפול המומלץ כולל תרופות המעכבות את 1- ET (Endothelin Receptor Antagonists, ERA) ,Iloprost בשאיפה, או מעכבים של פוספודיאסטראז-5.
קיימים שני סוגי קולטנים ל-ET-1: קולטן מסוג A וקולטן מסוג B. אם כן, ישנם מעכבים בלתי סלקטיביים המעכבים את שני הקולטנים – כגון Tracleer (Bosentan) (טרקליר; בוסנטן), ומעכבים סלקטיביים לקולטן A – כגון Volibris (Ambrisentan) (ווליבריס ; אמבריסנטן). לאחרונה פורסמו תוצאותיו של מחקר EARLY, שהדגים את יעילותה של Tracleer לטיפול בחולים עם יתר לחץ דם ריאתי בשלב מוקדם. התרופה הביאה לשיפור משמעותי בביצוע מבחן הליכה לשש דקות, דחייה של אירועי החמרה, ושיפור של המדדים ההמודינמיים.
NO משפיע דרך (cGMP) על הרחבה של כלי הדם. עיכוב 5-PDE מעלה את רמת cGMP, ובדרך זו מרחיב את כלי הדם, ומעכב את עיבוי הדופן שלהם. כיום קיימות קיימים מספר מעכבים של PDE-5, וביניהם Viagra (Sildenafil) (ויאגרה ; סילדנפיל) ו-Cialis (Tadalafil) (סיאליס; טדלפיל).
לאחרונה מתגבשת המלצה לשילוב תרופתי בחולים העמידים לטיפול באחת התרופות הנ"ל. השילוב עשוי למנוע הידרדרות נוספת ולשמר את הדרגה התפקודית והמדדים ההמודינמיים.
חולים עם כשל לב ימין על רקע יתר לחץ דם ריאתי מקבלים גם טיפול תומך במשתנים, Spironolactone (ספירונולקטון), Digoxin (דיגוקסין) , חמצן ומדללי דם. במצבים אלו נשקלת גם האפשרות של השתלת ריאה.
סיכום
יתר לחץ דם ריאתי הוא סיבוך קשה של טרשת רב-מערכתית, עם השפעה שלילית על איכות החיים ושיעורי תחלואה ותמותה גבוהים. עירנות קלינית של הצוות המטפל עשויה להביא לגילוי מוקדם ומניעת הידרדרות. האבחנה של יתר לחץ דם ריאתי מבוססת על תוצאות צנתור לב ימני ומבחנים המודינמיים. הצלחת הטיפול תלויה בחומרת הירידה התפקודית על פי ה-NYHA.
טיפול במעכבי הקולטן ל-ET-1, מעכבי PDE-5 ואנלוגים של PGE5 עשוי להביא לשיפור תפקודי, דחייה של אירועי הידרדרות, ושיפור של תוחלת החיים.
מעורבות לבבית
מעורבות הלב מופיעה בקרב 15-35% מהחולים. בחלק מהחולים מעורבות זו נסתרת. התסמינים הלבביים מעידים על מחלה קשה יותר, עם שיעורי תחלואה ותמותה גבוהים יותר.
הפגיעה הלבבית יכולה להופיע במספר צורות:
- פריקרדיטיס - בדרך כלל מופיעה בשנים הראשונות של המחלה, בחולים עם מחלה חריפה וסוערת. שכיחה בעיקר בחולים עם הצורה הנרחבת של המחלה, אך תיתכן גם בחולים עם מחלה מוגבלת לאחר שנים רבות של מחלה. הקליניקה עשויה לכלול קוצר נשימה, חולשה ניכרת, נטייה לעילפון, לחץ דם נמוך, גודש ורידי צוואר, כבד מוגדל ובצקות ברגליים. הטיפול כולל סטרואידים במינון בינוני (20-40 מ"ג ליום) וקולכיצין (במינון של 1 מ"ג ליום)
- הפרעות קצב - בעקבות הפגיעה בעורקיקים, עלולים להיווצר בשריר הלב מוקדים שונים של הפרעות קצב - ממקור פרוזדורי או חדרי. הטיפול בהתאם
- הפרעות הולכה - איסכמיה ופיברוזיס של מערכת ההולכה עשויים ליצור חסם הולכה עלייתי-חדרי מלא. החולים בדרך כלל מתלוננים על דפיקות לב, או להיפך – על הפסקה בפעימות הלב, חולשה ולעיתים עילפון. בדיקת אק"ג, ובעיקר בדיקת הולטר הכוללת רישום למשך 24-48 שעות, מאפשרות לאבחן את סוג ההפרעה ולהתאים טיפול. הטיפול עשוי להיות תרופתי, או לכלול השתלה של קוצב לב קבוע
- מיוקרדיטיס - שריר הלב יכול להיפגע כחלק מדלקת שרירים כללית, המופיעה בקרב 30% מהחולים, או בעקבות פגיעה בעורקיקים והתפתחות של פיברוזיס לבבי. אקו לב ידגים ירידה בתפוקת הלב לערכי EF מתחת ל-50%, או הפרעה דיאסטולית משמעותית. החולים בדרך כלל מתלוננים על אי נוחות בחזה, קוצר נשימה וחולשה כללית. רמות BNP גבוהות עשויות להביא לגילוי של אי ספיקת לב בשלב מוקדם
סיכום
המעורבות הלבבית בחולי טרשת רב-מערכתית היא מגוונת. ביטוייה העיקריים כוללים פריקרדיטיס, הפרעות קצב, חסם עלייתי-חדרי, הפרעה דיאסטולית ואי ספיקת לב. אק"ג, הולטר, אקו לב ומדידות של רמת BNP מסייעים לאבחנה. הטיפול סימפטומטי בלבד.
מעורבות מערכת העיכול
מעורבות מערכת העיכול שכיחה מאוד בקרב חולי טרשת רב-מערכתית. השינויים המתרחשים במערכת העיכול נובעים ממנגנוני המחלה: פגיעה בעורקיקים, פגיעה בחיבור בין העצבים לשריר החלק, עצבוב לקוי של השריר החלק ופגיעה ישירה בשרירי מערכת העיכול יוצרים ליקויים קשים בתנועתיות של חלקים שונים במערכת העיכול. מעורבות מערכת העיכול היא מבין ההפרעות העיקריות הגורמות לירידה משמעותית באיכות החיים; כמו כן, מעורבות זו אחראית לתמותה של כ-10% מהחולים. ההסתמנות הקלינית תלויה בחלק של מערכת העיכול אשר נפגע.
- פגיעה בושט דווחה בקרב 70-90% מהחולים. החולים מתלוננים על צרבת, הרגשת חנק, הפרעות בליעה, שובע מוקדם, בחילות ולעיתים הקאות. חלק מהחולים מאבדים את התאבון ויורדים במשקל. הפגיעה בושט נובעת מהחזר ושטי (GERD) - טבעת השריר החלק המפרידה בין הושט לקיבה נפגעת ונחלשת. התכווצויות הושט נפגעות גם הן בשל דלדול שרירי הושט. נוצר מצב בו הושט פעור, והתוכן החומצי של הקיבה חוזר אליו באופן חופשי. GERD עלול גם לגרום לדלקת ברירית הושט, כיבים בושט, הצטלקות, היצרות ושינויים במבנה תאי הרירית (Barret's Esophagus).
ישנה התאמה בין פגיעה קשה בושט לנוכחות של מחלה אינטרסטיציאלית. לאור כך, הפגיעה בושט מהווה סימן פרוגנוסטי גרוע. לכן, מומלץ לבצע הערכה של מצב הושט תחילת המחלה גם בחולים שאין להם תסמינים. הערכה נוספת תבוצע בהתאם לתלונות החולה. הבדיקות המומלצות כוללות גסטרוסקופיה, מנומטריה ו-pH מטריה ובליעת בריום.
הטיפול העיקרי כולל תרופות המעכבות את משאבת הפרוטונים (PPI) במינונים גבוהים, פעמיים ביום לפחות. חשוב להקפיד על צריכה של מאכלים שאינם מגבירים את חומציות הקיבה, ולאכול מנות קטנות בפסקי זמן קצרים. כמו כן, יש להימנע משכיבה למשך שעתיים לפחות לאחר הארוחה, ולשכב עם ראש מורם בעת הצורך. חשוב לשלב הדרכה על ידי תזונאית - פגיעה בקיבה מתבטאת לרוב בדימומים חוזרים מכלי הדם השטחיים של הקיבה (GAVE, Gastric Antral Vascular Ectasia). בגסטרוסקופיה רירית הקיבה מקבלת מראה של אבטיח. הדימומים מהקיבה עלולים לגרום לאנמיה מקרוציטית קשה, העשוייה להיות מסכנת חיים. הטיפול כולל צריבה של כלי הדם המדממים בלייזר, עם או בלי תוספת גז ארגון. הטיפול מבוצע בגסטרוסקופיה. טיפול תומך נלווה כולל עירויי דם וברזל.
צורה נוספת של מעורבות הקיבה עשויה לכלול האטה במעבר תוכן הקיבה למעי. ניתן לאבחן זאת בבליעת בריום או בליעת מזון המסומן באיזוטופ. במקרים אלו הטיפול מכוון לשיפור מעבר תוכן הקיבה למעי, וכולל תרופות כגון Pramin (Metoclopramide) (פרמין; מטוקלופרמיד) ו- Erythromycin (אריתרומיצין) - פגיעה במעי עשויה לכלול את המעי הדק, המעי הגס, ואזור האנוס והרקטום. מעורבות המעי הדק נובעת מפגיעה בשריר החלק של המעי, הפרעה בתנועתיות המעי, וצמיחה של סוגים שונים של חיידקים אנאירוביים בחלל ודופן המעי. החולים עשויים לסבול משלשולים, תפיחות בטנית, תת-ספיגה, ירידה במשקל, חסר ברזל וחסר ויטמין B12. הצטלקות של דופן המעי עלולה להוביל לחסימה, ואף להופעת בועות אוויר בדופן המעי (pneumatosis) - מצב חירום רפואי בעל השלכות קשות.
חולים הסובלים ממעורבות המעי הדק ונטייה לשלשולים מטופלים באמצעות סדרות קצרות של אנטיביוטיקה רחבת-טווח. טיפול פומי ניתן במקרים הקלים, בעוד מקרים קשים דורשים טיפול תוך-ורידי. חולים אלו נוטים לירידה קשה במשקל ולתת-תזונה, מה שמצריך תזונה תוך-ורידית (TPN) בחלק מהמקרים.
מעורבות המעי הגס נוטה להתבטא בעצירות קשה עם הרחבה ניכרת של חלל החלחולת. במרבית המקרים העצירות מתחלפת בשלשולים בשלב מסוים, בעקבות תהליך של bacterial overgrowth. כמו כן, טלנגיאקטזיות האופייניות למחלה עלולות להופיע גם במעי הגס ולגרום לדמם ולאנמיה של חסר ברזל. דלדול השרירים באזור הרקטום והאנוס עלול להוביל לאי שליטה בסוגרים בקרב 10% מהחולים. הטיפול במעורבות של המעי הגס הוא סימפטומטי בלבד, וכולל צריבה בלייזר ו/או גז ארגון של העורקיקים המדממים. הטיפול באי שליטה על הסוגר האנאלי כולל תרגילי פיזיותרפיה, קיצוב, וניתוחים שיעילותם אינה מוכחת - פגיעה בכבד - כ-15% מהחולים עם מחלה מוגבלת מפתחים PBC, צורה של מחלה פיברוטית בדרכי המרה. מהלך המחלה בדרך כלל שפיר וכולל עלייה ברמות אנזימי הכבד הכולסטטיים והופעה של נוגדנים למיטוכונדריה (AMA) בנוסף לנוגדנים הקיימים. התפתחות יתר לחץ דם פורטלי ומיימת נדירה בחולים מסוג זה
סיכום
מעורבות מערכת העיכול שכיחה מאוד בקרב החולים בטרשת רב-מערכתית. הושט נוטה להיפגע מוקדם, ונפגע במרבית המקרים. מעורבות הקיבה, המעי הדק והמעי הגס אינה נדירה. הפגיעה בהם נובעת מאיסכמיה ופיברוזיס בחיבור בין העצבים לשרירים, מה שמוביל להפרעה קשה בתנועתיות. ביטויים עיקריים של הפגיעה במערכת העיכול כוללים החזר ושטי, שלשולים, דמם מרירית הקיבה ותת ספיגה. הטיפול בהפרעות הושט והקיבה מתמקד במעכבי משאבת הפרוטונים.
מעורבות כלייתית
סיבוך חמור של מחלה כלייתית האופייני לטרשת רב-מערכתית הוא משבר כלייתי (Scleroderma Renal Crisis). סיבוך זה מתרחש בקרב 5%-10% מכלל החולים, בעיקר בנשים עם מחלת עור נרחבת ובשלבים המוקדמים של המחלה. המשבר הכלייתי עשוי להיות הביטוי הראשון של המחלה בכ-20% מהחולים. מעל 85% מהחולים הסובלים ממשבר כלייתי פיתחו סיבוך זה ב-4 השנים הראשונות של המחלה.
נמצא קשר בין טיפול במינונים גבוהים של סטרואידים להתפתחות של משבר כלייתי. גורמים אחרים המזוהים עם התפתחות משבר כלייתי כוללים פגיעה קשה בעור ובמפרקים, פריקרדיטיס ואנמיה. ניתן למצוא נוגדנים מסוג ANA עם צביעת גרעין מגורגרת (Speckled Pattern) במרבית החולים. במחצית מהחולים הודגמו גם נוגדנים ל P-III-RNA.
מנגנון היווצרות המשבר הכלייתי אינו לגמרי ברור, אך נראה כי הפגיעה בעורקיקים האופיינית למחלה גורמת לעיבוי שכבת הדופן ולסגירה הדרגתית של כלי הדם הקטנים בכליה. תהליך זה מלווה בעלייה ברמות ET-1 והקולטנים שלו. ההפרעה באספקת הדם לכליה מובילה לשגשוג התאים במערכת החוץ-גלומרולרית (Juxtaglomerular Apparatus), המביאה להפרשה מוגזמת של רנין (אחד ממכווצי כלי הדם החזקים ביותר).
המאפיינים העיקריים של המשבר הכלייתי כוללים הופעה חדשה של יתר לחץ דם מערכתי (מעל 150/85 מ"מ כספית) וירידה בתפקוד הכלייתי המתבטאת ב-eGFR מתחת ל-30%. הביטויים הקליניים כוללים כאבי ראש, הפרעות ראיה, בחילות והקאות, איבוד הכרה, ופרכוסים כתוצאה מהפרעה במערכת העצבים המרכזית הנגרמת בעקבות יתר לחץ הדם הקשה (hypertensive encephalopathy). יתר לחץ הדם עלול גם לגרום לצבירת נוזלים ולבצקת ריאתית, הפרעות קצב ובצקות ברגליים. סימנים כלליים יותר כוללים חום, ירידה בתאבון וחולשה קיצונית.
בבדיקות המעבדה ניתן לראות אנמיה המוליטית מיקרואנגיופטית הכוללת ירידה ברמת הטסיות ועלייה ברמות רנין וקראטינין. בבדיקת שתן אופייני למצוא חלבון, כדוריות דם אדומות וגלילים מגורענים.
ביופסיה כלייתית לרוב אינה מדגימה סימני דלקת, אך מראה סימנים של איסכמיה בגלומרולים, נמק פיברינואידי של העורקים והעורקיקים והיווצרות קרישים בעורקים הצרים.
הטיפול במשבר הכלייתי כולל איזון נוקשה וקפדני של לחץ הדם - כאשר טיפול הבחירה הוא במעכבי ACE. יש להעלות את המינון בצורה הדרגתית על מנת למנוע נמק טובולרי, העלול להיווצר כתוצאה מירידה חדה בלחץ הדם. תוספת של חסמי תעלות סידן עשויה לסייע. במקרים בהם מודגמים קרישים בכלי הדם הכלייתיים, מומלץ לבצע החלפת פלזמה.
למרות הטיפול האינטנסיבי, כ-25% מהחולים מפתחים אי ספיקת כליות חמורה ונזקקים לדיאליזה. לעומת זאת, עם הזמן כמחצית מהחולים משקמים את התפקוד הכלייתי ונגמלים מדיאליזה תוך 1-3 שנים. השתלת כליה נזקקת בחלק מהמקרים, ולרוב מבוצעת 2-3 שנים לאחר המשבר הכלייתי.
סיכום
הסיכון להתפתחות משבר כלייתי נע סביב 15%. משבר כלייתי נפוץ בעיקר בחולים עם מחלה סוערת, נוגדנים מסוג Speckled ANA, וחולים המטופלים במינון גבוה של סטרואידים. מעקב אחר לחצי הדם של החולים מאפשר אבחנה מוקדמת של המשבר הכלייתי. כמו כן, חיוני לבצע ביופסיה כלייתית. טיפול הבחירה הוא במעכבי ACE. חולים עם אי ספיקת כליות חמורה עלולים להזדקק לדיאליזה, אך יש סיכוי לשיקום התפקוד הכלייתי בשנתיים הבאות בקרב מחצית מהחולים.
מעורבות מערכות נוספות
- תסמונת התעלה הקרפלית - תסמונת המתבטאת בכאבים ונימול באצבעות בשעות הלילה. נפיחות בידיים ודלקת בנרתיקי הגידים המכופפים בשורשי כפות הידיים יוצרות לחץ על העצב המדיאני, מה שמוביל לתסמינים. האבחנה מתבססת על הסימנים הקליניים ובדיקת EMG. הטיפול הוא אנטי-דלקתי, וכולל הזרקה מקומית של סטרואידים בשילוב עם פיזיותרפיה וריפוי בעיסוק. טיפול ניתוחי שמור למקרים של כשלון הטיפול התרופתי.
- נוירלגיה טריגמינלית
- חרשות - ישנם תיאורי מקרים של ירידה משמעותית בשמיעה, ואף אבדן שמיעה בקרב החולים. מנגנון אפשרי לכך הוא הפגיעה הוסקולרית והפיברוזיס, העשויים להתרחש גם בעצב השמיעה.
- תסמונת Sicca - מתבטאת ביובש בעיניים, בפה ובריריות. יובש זה נובע מפיברוזיס של בלוטות הרוק והדמע
- הפרעה בתפקוד המיני - בעיקר בקרב גברים. בניגוד להפרעה תפקודית, המופיעה ברוב האוכלוסייה, בעיות הזקפה המופיעות אצל החולים נובעות מפיברוזיס של כלי הדם באיבר המין, ועל כן קשות לטיפול
- דיכאון - שכיח בקרב חלק גדול מהחולים. כאבים, הגבלה תפקודית, צורך בבדיקות מרובות, ביקורים בבתי חולים ומרפאות, שימוש כרוני בתרופות, שינוי במראה החיצוני, הפרעות בתפקוד המיני, שינוי בתנאי העבודה ותגובה של בני משפחה וחברים - הם אלו שגורמים לדיכאון. שימוש בFluoxetine (פלואוקסטין) יעיל גם לטיפול בתופעת ריינו, בנוסף ליעילותה של התרופה בטיפול בדיכאון.
אבחנה
האבחנה של טרשת רב-מערכתית מבוססת על ההסתמנות הקלינית. על פי הקריטריונים של ה-American College of Rheumatology מ-1980, ניתן לאבחן טרשת רב-מערתית כאשר ישנו עיבוי עורי מפושט ונרחב, או כאשר קיימים שני תסמינים מתוך שלושת הבאים:
- סקלרודקטילי באצבעות
- צלקת גומתית בקצות האצבעות
- פיברוזיס ריאתי
גילוי מוקדם של המחלה אפשרי בחולים עם תופעת ריינו, שינויים אופייניים למחלה בקפילרוסקופיה, והימצאות נוגדנים כגון ANA, ACA, SCL-70 או RNA-III-P.
אבחנה מבדלת
בשלבים המוקדמים של המחלה, קשה להבדיל אותה ממחלות אוטואימוניות אחרות.
- חשיפה לחומרים, כגון בלאומיצין, סיליקטים.
- סוכרת (עשויה לגרום לעיבוי העור באצבעות)
- Bushke Scleroderma – העיבוי העורי מזכיר את זה שמתרחש בטרשת רב-מערכתית, אך השינויים בביופסיה שונים, וכוללים שקיעת מוצין ולא קולגן. כמו כן, לא ניתן להדגים את הנוגדנים האופייניים לטרשת רב-מערכתית.
- Eosinophilic fasciitis– עיבוי עורי המלווה במעורבות של מעטפת השרירים. החולים בוסלים מכאבי פרקים ועיבוי עורי באמות, כפות הידיים והשוקיים - עם הגבלה ניכרת בתנועה. במעבדה ניתן לראות אאוזינופיליה. בביופסיה של מעטפת השריר ניתן לראות ריבוי תאי דלקת ואאוזינופילים. חלק מהחולים מדווחים על נטילת טריפטופן.
- סקלרודרמה ממוקמת (Localized Scleroderma) – תופעות עוריות הדומות לטרשת רב-מערכתית אך מקומיות בלבד. אין מעורבות של איברים פנימיים, ולא ניתן להדגים נוגדנים עצמיים. התופעה שכיחה בקרב ילדים ומתבגרים, ומופיעה במבוגרים רק במקרים בודדים. לקבוצה זו שייכת צורת morphea, המתבטאת ברבדי עור מעובה עם שינויי פיגמנטציה, וצורה קווית העשויה להופיע באזור הפנים ונקראת "de sabre coup", או לאורך הגפה (linear scleroderma). ביופסיה של הנגעים תדגים תוצאות זהות לטרשת רב-מערכתית נרחבת עם שקיעה של סיבי קולגן.
מעקב וטיפול
הטיפול מתמקד בניסיון תיקון ומניעת נזקים עתידיים. אפשרויות התיקון מאוד מוגבלות. החולים מצויים במעקב קפדני הכולל בדיקות עור תכופות וניטור של המערכות החיוניות: לחץ הדם, תפקודי הכליה, תפקודי הריאה, תפקוד הלב, ומעקב אחר לחץ הדם הריאתי. המעקב כולל גם בדיקות דם ושתן תכופות ו-CT ברזולוציה גבוהה. ניתן להשתמש בבדיקת מרחק הליכה ל-6 דקות בכדי לעקוב אחר המצב הקליני.
לא קיים טיפול רדיקלי למחלה. הטיפול מכוון לדיכוי מערכת החיסון, בשילוב עם טיפול מכוון לאתרי המטרה (עור, ריאות, לב, מערכת העיכול, מפרקים, כליות ועוד) למניעת הנזק לכלי הדם והתופעות הפיברוטיות.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- ↑ Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017 Oct 7;390(10103):1685-1699. doi: 10.1016/S0140-6736(17)30933-9. 2.
- ↑ Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2020 Mar 15;201(6):650-660.
- ↑ Pope JE, Bellamy N, Seibold JR, et al. A randomized, controlled trial of methotrexate versus placebo in early diffuse scleroderma. Arthritis Rheum. 2001 Jun;44(6):1351-8.
- ↑ Volkmann ER, Tashkin DP, LeClair H, et al. Treatment With Mycophenolate and Cyclophosphamide Leads to Clinically Meaningful Improvements in Patient-Reported Outcomes in Scleroderma Lung Disease: Results of Scleroderma Lung Study II. ACR Open Rheumatol. 2020 Jun;2(6):362-370.
- ↑ Khanna D, Denton CP, Lin CJF, et al. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open-label period of a phase II randomised controlled trial (faSScinate). Ann Rheum Dis. 2018 Feb;77(2):212-220.
- ↑ Khanna D, Lin CJF, Furst DE, et al; focuSSced investigators. Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2020 Oct;8(10):963-974.
- ↑ Khanna D, Allanore Y, Denton CP, et al. Riociguat in patients with early diffuse cutaneous systemic sclerosis (RISE-SSc): randomised, double-blind, placebo-controlled multicentre trial. Ann Rheum Dis. 2020 May;79(5):618-625.
- ↑ Spiera R, Hummers L, Chung L, et al. Safety and Efficacy of Lenabasum in a Phase II, Randomized, Placebo-Controlled Trial in Adults With Systemic Sclerosis. Arthritis Rheumatol. 2020 Aug;72(8):1350-1360.
- ↑ Tang R, Yu J, Shi Y, et al. Safety and efficacy of Rituximab in systemic sclerosis: A systematic review and meta-analysis. Int Immunopharmacol. 2020 Jun;83:106389.
- ↑ Allanore Y, Wung P, Soubrane C, et alP; Investigators. A randomised, double-blind, placebo-controlled, 24-week, phase II, proof-of-concept study of romilkimab (SAR156597) in early diffuse cutaneous systemic sclerosis. Ann Rheum Dis. 2020 Dec;79(12):1600-1607.
- ↑ van Laar JM, Farge D, Sont JK, et al; EBMT/EULAR Scleroderma Study Group. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA. 2014 Jun 25;311(24):2490-8.
- ↑ Sullivan KM, Goldmuntz EA, Keyes-Elstein L, et al; SCOT Study Investigators. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. N Engl J Med. 2018 Jan 4;378(1):35-47.
- ↑ Minier T, Guiducci S, Bellando-Randone S, et al; EUSTAR co-workers; EUSTAR co-workers. Preliminary analysis of the very early diagnosis of systemic sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis. Ann Rheum Dis. 2014 Dec;73(12):2087-93.
- ↑ Matucci-Cerinic M, Denton CP, Furst DE, Mayes MD, Hsu VM, Carpentier P, Wigley FM, Black CM, Fessler BJ, Merkel PA, Pope JE, Sweiss NJ, Doyle MK, Hellmich B,Medsger TA Jr, Morganti A, Kramer F, Korn JH, Seibold JR. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis. 2011 Jan;70(1):32-8.
- Matucci-Cerinic M, Denton CP, Furst DE, Mayes MD, Hsu VM, Carpentier P, Wigley FM, Black CM, Fessler BJ, Merkel PA, Pope JE, Sweiss NJ, Doyle MK, Hellmich B,Medsger TA Jr, Morganti A, Kramer F, Korn JH, Seibold JR. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis. 2011 Jan;70(1):32-8.
- Khanna D, Seibold JR, Wells A, Distler O, Allanore Y, Denton C, Furst DE. Systemic Sclerosis-Associated Interstitial Lung Disease: Lessons from Clinical Trials, Outcome Measures, and Future Study Design. Curr Rheumatol Rev. 2010 May 1;6(2):138-144.
- Khanna D, Denton CP. Evidence-based management of rapidly progressing systemic sclerosis. Best Pract Res Clin Rheumatol. 2010 Jun;24(3):387-400.
- Le Pavec J, Humbert M, Mouthon L, Hassoun PM. Systemic sclerosis-associated pulmonary arterial hypertension. Am J Respir Crit Care Med. 2010 Jun 15;181(12):1285-93.
- Hudson M, Thombs BD, Steele R, Panopalis P, Newton E, Baron M; Canadian Scleroderma Research Group. Health-related quality of life in systemic sclerosis: a systematic review. Arthritis Rheum. 2009 Aug 15;61(8):1112-20.
- Matucci-Cerinic M, Steen V, Nash P, Hachulla E. The complexity of managing systemic sclerosis: screening and diagnosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii8-13.
- Tyndall A, Matucci-Cerinic M, Müller-Ladner U. Future targets in the management of systemic sclerosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii49-53.
- Kahan A, Coghlan G, McLaughlin V. Cardiac complications of systemic sclerosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii45-8.
- Forbes A, Marie I. Gastrointestinal complications: the most frequent internal complications of systemic sclerosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii36-9.
- Denton CP, Lapadula G, Mouthon L, Müller-Ladner U. Renal complications and scleroderma renal crisis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii32-5.
- Steen V, Denton CP, Pope JE, Matucci-Cerinic M. Digital ulcers: overt vascular disease in systemic sclerosis. Rheumatology (Oxford). 2009 Jun;48 Suppl 3:iii19-24.
המידע שבדף זה נכתב על ידי ד"ר אלכסנדרה בלביר, מנהלת היחידה לראומטולוגיה, המרכז הרפואי רמב"ם, האיגוד הישראלי לראומטולוגיה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק