ADAMTS-13
| מדריך בדיקות מעבדה | |
| ' | |
|---|---|
| ADAMTS13 | |
| מעבדה | כימיה או קרישה בדם |
| תחום | הערכה של התרחשות תסמונת TTP |
| טווח ערכים תקין | מעל 67% של פעילות האנזים; אי-מציאות של נוגדנים מסוג IgG כנגד ADAMTS13 או Bethesda titer<0.4 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידת פעילות ADAMTS13 סבירה במקרים של חשד ל-TTP, או לצורות אחרות של מיקרואנגיופתיה תרומבוטית (TMA), אנמיה המוליטית מיקרו-אנגיופתית עם הופעת סכיסטוציטים במשטח דם, תרומבוציטופניה ו-רמת LDH מוגברת.
מדידת פעילות האנזים ADAMTS13 וכן גילוי מציאות נוגדנים כנגד אנזים זה, מאפשרת ברוב המקרים אבחנה מבדלת בין TTP נרכשת ו-TTP מולדת, ממפגעים תרומבוטיים או מיקרו-אנגיופתיים אחרים דוגמת HUS, HELLP, PET ועוד. בנוסף ביצוע בדיקות אלה עשוי להיות בעל ערך פרוגנוסטי לגבי הסבירות של relapse. חסר חמור (פחות מ-10% מפעילות ADAMTS13), ספציפי יותר לתצורה המולדת-משפחתית של TTP הידועה גם כתסמונת Upshaw-Schulman. פעילות נמוכה אם כי בדרך כלל באופן מתון יותר של ADAMTS13, תופיע במקרים השכיחים יותר של TTP נרכשת, על רקע הופעת נוגדנים עצמיים, שבפעילותם יכולים לנטרל את פעילות האנזים, או להחיש את פינויו מהצירקולציה.
בסיס פיזיולוגי
תסמונת TTP או thrombotic thrombocytopenic purpura היא התרחשות נדירה (4-6 מקרים למיליון מדי שנה) אך בעלת פוטנציאל קטלני, המתאפיינת על ידי יצירה מסיבית של קרישים עתירי טסיות-דם, במיקרו-צירקולציה של איברים רבים (TMA או thrombotic microangiopathy). הצימות המסיבי של טסיות ויצירת קרישי-דם בכלי דם קטנים, גורמת לאנמיה המוליטית, לאיסכמיה של איברים, כאשר בטיפול כושל עלולה להביא לתמותה ב-90% מהמקרים, עם תסמינים כלייתיים ונוירולוגיים בעיקרם. הגרסה המולדת של TTP עלולה לגרום למשבר כבר בתקופה הנאונטלית. האנמיה ב-TTP הנגרמת כתוצאה משבירת תאים אדומים, עלולה להוביל לבילירובינמיה (בלתי מצומדת).
TTP שכיחה בקרב נשים פי 2 עד פי-3 מאשר בגברים. המחלה תוארה לראשונה בשנת 1924 על ידי Moschowitz בנערה בת 16 שהופיעו אצלה חום, אנמיה, תרומבוציטופניה ושינויים ממוקדים במערכת העצבים המרכזית ובכליות. אך רק בשנת 1947 זכתה מחלה זו בהכרה כאשר Singer וחב' סקרו 12 מקרים שהיו ידועים באותה עת, ואילו בשנת 1960 פרסם Schulman ב-Blood לראשונה את הצורה המולדת של המחלה.
מספר דיווחים על TTP הופיעו לאחר מכן, שהובילו להגדרה של חמישייה של תסמינים האופייניים למחלה: חום, אנמיה המוליטית מיקרו-אנגיופתית (שברי תאים-schistocytes, קומבס שלילי), תרומבוציטופניה, הפרעות נוירולוגיות ואי-ספיקת כליות. אלא שחמישיית תסמינים אלה מתרחשת במלואה במספר קטן מאוד של מקרים, כאשר התסמינים הנוירולוגיים והפגיעה הכלייתית אינם תסמינים קבועים, בעיקר בשלבי המחלה הראשונים. לכן כיום מקובלת יותר הגדרת TTP כשילוב של אנמיה המוליטית מכנית עם שברי אריתרוציטים ותרומבוציטופניה (פחות מ-100,000 טסיות למיקרוליטר), ורמה מוגברת בנסיוב של האנזים lactate dehydrogenase ללא סיבות חלופיות, שהם המדדים המעבדתיים השימושיים ביותר לאבחון TTP.
במקביל להתפתחות ההבנה של התסמינים הקליניים, המנגנון הפאתו-פיזיולוגי של TTP הובהר רק בשנת 1982 כאשר Joel Moake וחב' פרסמו ב-N Eng J Med את ממצאם לפיו בפלזמה של חולה עם TTP נשנית, ניתן היה למצוא מולטימרים בעל משקל מולקולארי גבוה ביותר (ultra large) של von Willebrandt factor (להלן VWF), אותו גליקופרוטאין מולטימרי הגורם לצימות טסיות, שניתן למצוא בתאי אנדותל, בטסיות דם ובפלזמה.
כאשר צורת ה-ultra large של VWF משתחררת מתאי אנדותל, שלא ניתן למצוא בפלזמה בתנאים פיזיולוגיים תקינים, היא מעודדת צימות תוך-וסקולארי של טסיות, ונגרמים קרישי-דם מיקרו-וסקולאריים, כך שאנמיה המוליטית נגרמת כתוצאה מהנזק המכני לתאים אלה, בעיקר בתנאי שפיעת הדם המתאפיינים על ידי עקת גזירה (shear stress) גבוהה במיקרו-צירקולציה, וכן בעורקים עם דרגת היצרות גבוהה.
בשנת 1978 היה זה Jefferson Upshaw שדיווח לראשונה ב-N Eng J Med על כך שניתן לטפל בהצלחה באפיזודות של TTP חד, על ידי פלזמפרזיס או על ידי עירוי של פלזמה מתורם בריא. Upshaw הסיק שמדובר בחסר של גורם פלזמטי,
למעשה, היה זה Moake עצמו שהניח את ההיפותזה עוד במאמר המקורי משנת 1982 שהסיבה למציאות של VWF בגרסה של ultra-large multimers נובעת מחסר של פרוטאזה האמורה לבקע את המבנה הענק הזה. מתוך זהירות מתבקשת Moake לא התייחס בזמנו לחסר אפשרי של פרוטאזה, אלא כינה את הגורם החסר כ-"de-polymerase", אך היו אלה Furlan וחב' וכן Tsai ו-Lian אשר פרסמו בשנת 1998 את ממצאיהם זה לצד זה ב-N Eng J Med, שהיו דומים באופן מפתיע: שתי קבוצות מחקר אלה הצליחו לבודד מפלזמת אדם מֶטָלוֹ-פרוטאזה המכילה אבץ ומבקעת את הקשר הפפטידי בין טירוזין בעמדה 1605 ומתיונין בעמדה 1606 במקטע (domain) המרכזי (A2) של VWF. שתי קבוצות מחקר אלה מצאו באופן בלתי תלוי את חסר פעילות האנזים במדגם של סובלים מ-TTP. כבר במאמרם זה גילו Tsai ו-Lian בדמם של חולי TTP מהסוג הלא-משפחתי רמה מוגברת של נוגדנים מסוג IgG, שהגיבו עם הפרוטאזה האמורה, וממילא הפחיתו את פעילותה.
הפרוטאזה האחראית לוויסות של המבנה המולטימרי של VWF, זוהתה בשנת 2001 על ידי Zheng והופיעה ב-J Biol Chem. פרוטאזה זו היא הנציג ה-13 במשפחת ADAMTS או A Disintegrin And Metalloprotease with Thrombospondin I repeats, וכונה לפיכך ADAMTS13, אך גם ידוע כ-VWFCP או von Willebrandt factor cleaving protease. כיום ידועים 2 צורות של חסר חמור של ADAMTS13 ( פחות מ-5% מהכמות הנורמאלית), הצורה הנרכשת והצורה המולדת, ובשתיהן נוצרת הצטברות של טסיות בכלי-דם קטנים, מה שגורם בהמשך לקרישים מיקרו-וסקולאריים ול-TTP.
מבחינה גנומית, ADAMTS13 דומה ל-18 הפפטידאזות האחרות המשתייכות למשפחת ADAMTS, שמשותפים למבנה של כולם מקטע של פרוטאזה, מקטע סמוך של disintegrin, ואחד או יותר מקטעים של thrombospondin. ל-ADAMTS13 יש למעשה 8 מקטעי thrombospondin, אך אין לו מקטע הידרופובי טרנס-ממברנלי ולכן ADAMTS13 אינו מעוגן בממברנת תאים.

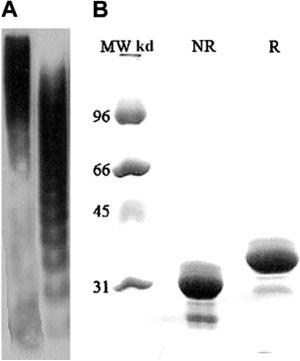
פוליפטיד בן 1,427 חומצות אמינו עם מספר אזורים (motifs) מוגדרים. S-מאופיין כ-signal peptide; P- מוגדר כ-propeptide; M-הוא metalloprotease; D-מציין disintegrin; אחריו Cys-rich spacer; אחריו 8 חזרות (repeats) של Thrombospondin-1; בקצה הימני שני מקטעי CUB דרכם נקשר האנזים ADAMTS13 ל-VWF.
הגילוי של ADAMTS13 חידש באופן ניכר את העניין ב-TTP למרות היותה מחלה מאוד נדירה, מה שהתבטא בעלייה חדה במספר המחקרים שפורסמו בנושא בעשור האחרון, אך לא פחות מעוררת עניין סוגיית הערך האבחוני והפרוגנוסטי של מדד זה. הגן המקודד ל-ADAMTS13 מופה לזרוע הארוכה של כרומוזום 9 בעמדה 9q34, גן שאורכו 34kb ומכיל 29 אקסונים מקודד לפוליפפטיד המכיל 1,427 חומצות אמינו. פרוטאזה זו מופרשת בעיקר מתאי כבד, אך יש ראיות לכך שהיא יכולה להיות מסונתזת גם על ידי תאי אנדותל. תקופת מחצית החיים של ADAMTS13 בפלזמה 2-3 ימים.
ביקוע של VWF על ידי ADAMTS13 אינו מתרחש באופן נורמאלי, כיוון שהקשר הפפטידי Tyr1605-Met1606, אינו זמין בהיותו שקוע בתוך הליבה של β-sheet של VWF. עקות גזירה, חומרים שונים הגורמים לדה-נטורציה (כמו urea או guanidine) או הקישור של טסיות ל-VWF, עלולים לחשוף את אותו אתר ביקוע בין חומצות אמינו 1605-6. מספר גדול של מוטציות בגן ADAMTS13 נמצאו במשפחות עם הצורה המולדת של TTP. בנוסף, יש מספר מצבי פולימורפיזם בתוך גן זה, שעלולים באופן פוטנציאלי להשפיע על הפרשת האנזים ולהפחית בהתאם את רמתו בפלזמה.
שתי תצורות של TTP
מפגע נדיר זה מופיע ב-2 תצורות: מולדת ונרכשת. התצורה המולדת-משפחתית (תסמונת Upshaw-Schulman) היא אוטוזומאלית-רצסיבית, נגרמת כאמור על ידי מוטציות בגן ADAMTS13 המקודד למטלו-פרוטאזה, ושכיחותה המשוערת היא 1 למיליון. צורת TTP זו באה בדרך כלל לביטוי אם כי לא בהכרח כבר בלידה, או במהלך הילדות. התצורה הנרכשת של TTP יכולה להתחלק לשני סוגים: הצורה האידיופתית שמקורה במערכת החיסון, והצורה הלא-אידיופתית שהיא כנראה משנית לגירוי מסיבי של האנדותל כמו השתלת תאי גזע המטופויאטים, תרופות אחדות, הדבקה במיקרואורגניזם, מחלות אוטו-אימוניות או סרטניות, שעלולים לגרום להפרשה של מולטימרים אולטרה-גדולים של VWF בכמויות העולות על יכולת המערכת לפרק אותם למרות נוכחות נורמאלית או רק מעט מופחתת של ADAMTS13. לתצורה זו יש נטייה להישנוּת (recurrence) ונוהגים לטפל בה על ידי פלזמה-פרזיס.
המצבים הפיזיולוגיים או פתולוגיים השכיחים ביותר הכרוכים בחסר מסיבי של ADAMTS13, (רמה הנמוכה מ-10% מהנורמה), הם הריון, הדבקות מיקרוביאליות, מחלות אוטו-אימוניות, ושימוש בתרופות נוגדות טסיות דוגמת ticlopidine ו-clopidogrel. המצבים השכיחים ביותר הכרוכים בצורה הנרכשת של TTP, הם תרחישי ממאירות עם גרורות, הריון, השתלות איברים או מח עצם, HIV, ושימוש בתרופות דוגמת ציקלוספורין, מיטומיצין ואינטרפרון-α. ברוב המקרים TTP מופיע כאפיזודה חדה לא סדירה ומבודדת, אם כי ישנן גם התצורות הנשנות ב-20-30% מהמקרים, להן בסיס גנטי או שהן כרוכות בהופעה עיקשת של נוגדנים עצמיים.
חסר נרכש של ADAMTS13
נוגדנים ספציפיים ל-ADAMTS13 נמצאים בפלזמה של כמעט כל המטופלים (94%-97%) הסובלים ממ-TTP אידיופתית, וחסר נרכש חמור של ADAMTS13. ברוב המקרים נוגדנים אלה מעכבים את פעילות האנזים, אם כי ב-10-15% מהמקרים יש אמנם נוגדנים כאלה, אך הם אינם מעכבים את הפעילות האנזימטית אלא מגבירים כנראה את הפינוי של ADAMTS13 מהצירקולציה. נוגדנים אלה הם בעיקר מסוג IgG4 ובאחוזים נמוכים יותר מהסוגים IgG1, וכן IgG2 ובמידה הנמוכה ביותר IgG3. כייל גבוה של נוגדנים מסוג IgG4 נמצאו במקרים של מצבי משבר (relapse) של TTP, ואילו נוכחות של נוגדנים מסוג IgG1 היו דווקא אופייניים למקרים עם פרוגנוזה ירודה.
נוגדנים כנגד ADAMTS13 המגיבים כנגד אפיטופ במקטע הידוע כ-spacer של האנזים הזה, התגלו ב-97-100% מהמקרים עם חסר חמור של ADAMTS13 הנובע מפעילות המתווכת על ידי נוגדנים אלה, אם כי ב-64% ממקרים אלה נמצאו גם נוגדנים בפלזמה המגיבים עם מקטעים אחרים של ADAMTS13. מיפוי עדין של מקטע ה-spacer ב-ADAMTS13 זיהה את חומצות האמינו ארגינין-568, פניל-אלנין-592, ארגינין-660, טירוזין-661 וטירוזין-665, כיעדים אנטיגניים של הנוגדנים המנטרלים את פעילות האנזים. עד כה לא זוהו אפיטופים על פני מקטעים (domains) אחרים של ADAMTS13 אליהם מקשרים נוגדנים עצמיים אלה.
עד כה לא הוברר המנגנון הגורם למערכת החיסון לייצר נוגדנים עצמיים אלה, ולהביא לתגובת נוגדנים בתצורה הנרכשת של TTP. כמו במחלות אוטו-אימוניות אחרות, גורמים מיקרוביאליים נכרכו עם תגובה עצמית זו, אם כי יש לציין את המספר הקטן ביותר של מקרים רלוונטיים להנחה זו.
שיטת מעבדה להערכת החסר של ADAMTS13
מאז גילויו בשנות ה-90 המאוחרות, נוסו מספר שיטות מעבדתיות להערכת פעילות האנזים ADAMTS13. בתחילה עיקר השיטות התבססו על אנליזה אלקטרופורטית בה נבחנו המולטימרים של VWF, או מציאותם או חסרונם של מקטעים של VWF כתוצאה מביקוע על ידי האנזים האמור. שיטות ישירות אלה כללו הרצה אלקטרופורטית על פלטות SDS agarose, או פלטות SDS-polyacrylamide מלוות על ידי Western blot. בשיטה זו VWF מנוקה עובר הדגרה למשך 24 שעות עם דגימת פלזמה של הנבדק, ובחינת המולטימרים נעשית על פני פלטת האלקטרופורזה, כאשר קבלת מקטעים קטנים יותר בגודלם נבחנת על פני נייר הניטרוצלולוזה המשמש ב-Western blot, בעזרת נוגדנים כנגד VWF להם מחובר האנזים peroxidase.
שיטה ישירה אחרת מתבצעת תוך שימוש בפלטות microtiter, מצופות עם נוגדן חד-שבטי המגיב עם מקטעי CUB של החלבון ADAMTS13, והמדידה מתבצעת בשיטת FRET או Fluorescence Resonance Energy Transfer. כיום יש גרסה חדשה הידועה כמבחן FRET-VWF73, בה משתמשים במקטע בן 73 חומצות אמינו של VWF, שעבר שינוי כימי כדי שישחרר פלואורסצנציה כאשר הוא עובר ביקוע על ידיADAMTS13 . בשנת 2009 הראו Kokame וחב' ש-VWF73, שהוא פפטיד בן 73 חומצות אמינו (Asp1596-Arg1668) הנמצא בתוך מקטע A2 של VWF, הוא המצע המינימאלי בגודלו הניתן לביקוע הידרוליטי על ידי ADAMTS13. בשיטה זו, מוסיפים את מקטע VWF73 לדגימת פלזמה של הנבדק, ומודדים את השינוי בפלואורסצנציה למשך זמן נתון לקביעת פעילות האנזים. כיוון שביקוע הפפטיד VWF73 על ידי ADAMTS13 מעוכב על ידי EDTA, חייבים לשלוח את הפלזמה הנדגמת במבחנת סודיום ציטראט (פקק תכול).
בהמשך, נוסו שיטות בלתי-ישירות כגון קביעה של אובדן יכולת הקישור של קולאגן ל-VWF, או קביעת פעילות התכשיר האנטיביוטי ristocetin (שיכולת צימות הטסיות שלו מתאפשרת רק בנוכחות מולטימרים של VWF).
- מבדק קישור קולאגן: פלזמה נורמאלית או VWF מנוקה עוברים הדגרה עם דגימת הפלזמה הנבדקת, בנוכחות BaCl2 ותמיסת 1.5 מולר urea, הגורמת לדנטורציה של VWF. בצורתו החדשה עןבר VWF ביקוע על ידי ADAMTS13, ושארית החלבון נמדדת ליכולת הקישור שלה לקולאגן type III. הקומפלקס VWF-קולאגן נמדד כמותית בשיטת ELISA עם נוגדן מסומן עם פראוקסידאזה הספציפי ל-VEF, כאשר הוספת מצע הפראוקסידאזה TMB או tetramethylbenzidine תביא להופעת צבע צהוב שעוצמתו ניתנת לכימות.
- מבדק צימות מושרה על ידי ristocetin: מבדק דומה לקודם, אלא שבמבדק זה נמדדת יכולת שארית VWF לאחר ביקועו על ידי ADAMTS13 לצמת טסיות בהשריית ristocetin, תוך שימוש במד צימות (platelet aggregometer). שיטות אלה היו כרוכות בפרוצדורות ארוכות, או בשימוש בחומרים בלתי-פיזיולוגיים לגרימת דנטורציה, והביאו לתוצאות בלתי-הדירות או כאלה עם דרגת שוֹנוּת גבוהה.
שיטות לגילוי נוגדנים עצמיים כנגד ADAMTS13
שני סוגים של נוגדנים ספציפיים ל-ADAMTS13 התגלו ודווחו במטופלים עם TTP נרכשת.
- נוגדנים מנטרלים את פעילות האנזים (בשני שליש מהמקרים). אלה מתגלים באופן קלאסי על ידי ערבוב של נפחים שווים של פלזמה נבדקת ושל פלזמה מבקרה נורמאלית, ולאחר מכן בחינת פעילות ADAMTS13.
- נוגדנים שאינם מנטרלים את פעילות האנזים (בשליש מהמקרים), שנקשרים לאנזים ומחישים את הפינוי (clearance) שלו מהפלזמה. נוגדנים אלה ניתנים לגילוי על ידי Western blot או באופן נוח יותר בעזרת שיטת ELISA.
פענוח תוצאות הבדיקה
המבדק למדידת הפעילות של ADAMTS13 הוא מבדק in vitro העושה שימוש בפפטיד סינתטי המשמש מצע לאנזים זה, בסביבה של תמיסה סטטית. לכן הפעילות הנמדדת של האנזים, עלולה לא לשקף את הפעילות הביולוגית האמיתית של ADAMTS13 בתנאי in vivo. לא כל המטופלים עם אבחון קליני של TTP, הם בעלי חסר חמור ב-ADAMTS13. היפוכו של דבר, מטופלים מאובחנים עם מפגעים אחרים שאינם TTP עלולים להימצא עם חסר ניכר של האנזים (פחות מ-10% מרמת הנורמה). מפגעים אלה כוללים כמו תסמונת המוליטית-אוּרֶמית (HUS), השתלת איברים או תאי גזע המאטופויאטים, מחלת כבד, DIC, מצב של thrombocytopenia-associated multi-organ failure או TAMO, אלח-דם (sepsis), הריון, ומספר טיפולים תרופתיים. לכן, בסופו של דבר, TTP בעיקר נתון לשיקולי הערכה קלינית.
כן יש לקחת בחשבון הפרעה או מיסוך של פעילות האנזים שעלולים להופיע כתוצאה מרמות גבוהות במיוחד של VWF אנדוגני, היפרליפידמיה, הֶמוליזה עם רמות המוגלובין חופשי בפלזמה שמעל 2 גרם לליטר, היפר-בילירובינמיה (רמות בילירובין שמעל 6 מיליגרם לד"ל), או ביקוע המצע על ידי פרוטאזות אחרות.
רמת ADAMTS13 נמוכה מ-5% מרמתו המרבית, כרוכה בתסמונת המולדת של Upshaw-Schulman, או במפגע הנרכש של TTP. במגוון של תרחישים קליניים תיתכן רמת חסר קלה עד מתונה. הליך של החלפת פלזמה שהתבצע בסמוך לבדיקת רמת ADAMTS13, ייתן רמה מוגברת כזובה של החלבון. שיטת הכימות בדיקה נעשה שימוש בנוגדנים חד-שבטיים המכוונים כנגד מקטע CUB של החלבון, ובמקרים של מוטציות במקטע CUB ייתכן קישור מופחת של הנוגדן מחד-שבטי לאפיטופ הספציפי שלו וקבלת תוצאה מופחתת כזובה.
הוראות לביצוע הבדיקה
אין צורך בצום, ואת דגימת הדם יש ליטול במבחנת סודיום ציטראט (פקק תכול). הבדיקה אינה מתבצעת בנסיוב וכן אינה מתבצעת בפלזמה שהופרדה מדגימת דם שנלקחה במבחנת ספירת-דם (EDTA, פקק סגלגל). יש להימנע מפלזמה המוליטית. יש לסרכז את דגימת הדם 15 דקות במהירות 5,000 סל"ד כדי לקבל פלזמה דלה בטסיות-דם. ולאחר הפרדת הפלזמה יש להקפיאה מייד. אין לשמור את הפלזמה מעל 3 שעות בטמפרטורת החדר, ואין לאחסן אותה בקירור רגיל. הקפאת הדגימה היא תנאי לאיכות הבדיקה, אך אין לשמור את הבדיקה קפואה מעל פרק זמן של שבועיים.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק