מחלת אלצהיימר - טיפול בלקאנמאב
| מחלת אלצהיימר - טיפול בלקאנמאב | ||
|---|---|---|
| ' | ||

| ||
| שמות נוספים | טיפול בלקאנמאב (לקמבי) בשלבים מוקדמים של מחלת אלצהיימר | |
| ICD-10 | Chapter G 30. Chapter F 00. | |
| ICD-9 | 331.0
, 290.1 |
|
| MeSH | D000544 | |
| יוצר הערך | ד"ר תמרה שיינר | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – שיטיון
ערך זה מעודכן לשנת 2024
מחלת אלצהיימר היא המחלה הניוונית המוחית השכיחה ביותר. שכיחות המחלה עולה משמעותית ככל שעולים בגיל, כאשר מעל גיל 65, אחד מכל תשעה אנשים יפתח את המחלה.
משקעים תוך מוחיים של חלבון β-עמילואיד הם סימן ההיכר הפתולוגי המרכזי של מחלת אלצהיימר, כפי שהוגדר על ידי המכון הלאומי להזדקנות (2018) ואחד מהיעדים העיקריים במחקרים תרופתיים למחלה זו.
הטיפולים למחלת אלצהיימר היו סימפטומטיים בלבד. כלומר, הביאו לשיפור קל ביכולת הקוגניטיביות, אך לא השפיעו על קצב ההתקדמות של המחלה או על התהליכים הפתולוגיים במוח. עד ינואר 2022, מספר רב של תרופות מכוונות כנגד חלבון העמילואיד לא הצליחו להראות השפעה על קצב התקדמות המחלה.
בינואר 2022 אושרה התרופה aducanumab, נוגדן מונוקלונלי המכוון כנגד חלבון העמילואיד, במנגנון אישור מואץ של מינהל המזון והתרופות בארצות הברית (FDA). אדוקנומאב הייתה התרופה הראשונה שהראתה הן פינוי של משקעי העמילואיד מהמוח והן האטה בקצב התקדמות התסמינים הקליניים. הטיפול באדוקנומאב ניתן בארצות הברית ובמרכזים רפואיים מועטים מחוץ לארצות הברית, אולם בשל קשיים רגולטוריים, על רקע תוצאות לא אחידות במחקרי הרישום שלה, השימוש שלה היה מוגבל והיא לא נרשמה מחוץ לארצות הברית.
ביולי 2023 קיבלה lecanemab אישור מלא של ה־FDA לטיפול בחולים בשלבים מוקדמים של מחלת האלצהיימר.
לקאנמאב - תוצאות מחקרים
לקאנמאב הוא נוגדן מונוקלונלי אשר נקשר לסיבים עמילואידיים בלתי מסיסים ובפרט לאוליגומרים, ופרוטופיברילים. לקנאמאב נבדק במסגרת מחקר CLARITY-AD, מחקר פאזה שלישית, כפול סמיות שגייס מטופלים החל ממרץ 2019 ב־235 מרכזים ברחבי ארצות הברית, אירופה ואסיה.
המחקר נמשך 18 חודשים ובמסגרתו גויסו 1,795 נבדקים עם ירידה קוגניטיבית קלה או דמנציה קלה על רקע מחלת אלצהיימר. לכל הנבדקים שנכללו במחקר הייתה בדיקת מיפוי מוח עמילואיד חיובית או מדידה של רמת עמילואיד נמוכה בנוזל השדרה (הוכחה למשקעי עמילואיד במוח). כמו כן, לכל הנבדקים היה ציון מעל 22 נקודות בבדיקת Mini mental state examination (MMSE) ולא הייתה להם ירידה תפקודית משמעותית בחיי היומיום. הנבדקים ביצעו בדיקה גנטית לפולימורפיזם בגן ה־APOE בשל העובדה שפולימורפיזם מסוג APOE e4 הוא גורם הסיכון הגנטי השכיח ביותר להתפתחות מחלת אלצהיימר. מתוך 1,795 נבדקים שגויסו למחקר, מחצית טופלו בלקאנמאב במינון של 10 מ"ג לק"ג, ומחצית בפלצבו בעירוי תוך ורידי פעמיים בחודש.
התוצאה העיקרית (primary end point) הייתה שינוי בסולם דירוג דמנציה קלינית (Clinical Dementia Rating scale-Sum of Boxes - CDR-SB). סולם זה מתבסס על ראיון חצי־מובנה של מטופלים ושל המלווים שלהם, ובו היכולות הקוגניטיביות מדורגות בשישה תחומים: זיכרון, התמצאות, שיפוט ופתרון בעיות, מעורבות חברתית, תפקוד בבית ותחביבים וטיפול עצמי. כל תחום מדורג בנפרד וציון CDR-SB מתקבל על ידי סיכום כל אחד מציוני התחומים ונע בין 0 ל־18. ל־CDR-SB יש מהימנות טובה כמנבא של ממצאים נוירופתולוגיים. התוצאים המשניים העיקריים במחקר היו שינוי בעומס משקעי העמילואיד במוח בבדיקת מיפוי עמילואיד, וסקאלות קליניות אחרות הבודקות יכולות קוגניטיביות, רגשיות ותפקודיות (לדוגמה, -ADAS (Cog14, ADCOMS, ADCS-MCI-ADL. במחקר גם נמדדו סמנים ביולוגיים בנוזל השדרה כולל מדדים של חלבון טאו מזורחן ועמילואיד.
יעילות התרופה
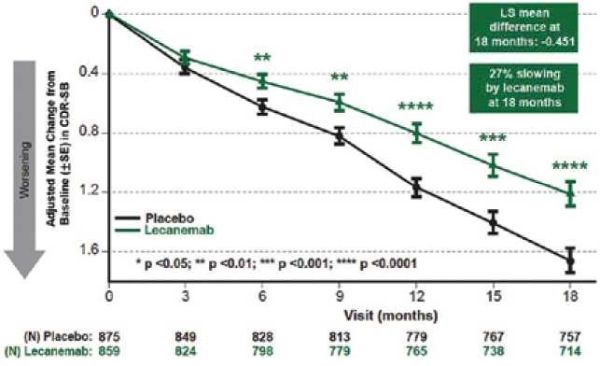
קבוצות המחקר היו דומות מבחינת גיל ומדדי חומרת המחלה. מספר הנשאים ההטרוזיגוטיים וההומזיגוטיים לפולימורפיזם של APOE ε4 היה שווה בקבוצת המחקר וקבוצת הפלצבו. התוצא העיקרי היה שינוי ב־1.21 ,CDR-SB נקודות בקבוצת הטיפול לעומת 1.66 נקודות בקבוצת הפלצבו (תמונה 1) (ציון גבוה יותר מעיד על מחלה קשה יותר). שינוי זה היה מובהק סטטיסטית (0.00005= p-value) ומשקף האטה של כ־27% בקצב התקדמות המחלה בקבוצת הטיפול.
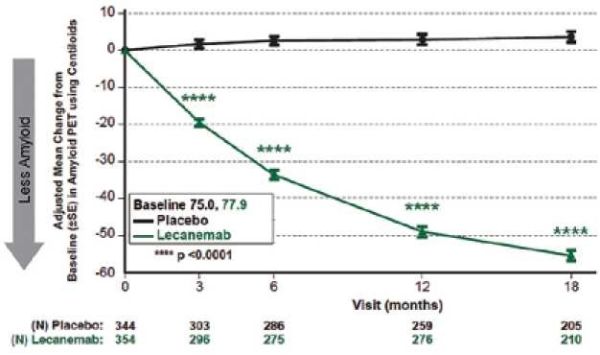
בתת מחקר אשר בדק עומס עמילואיד במיפוי מוח (תוצא משני עיקרי), וכלל 698 משתתפים, השינוי מנתוני הבסיס לאחר 18 חודשים הראה ירידה של 55.48 centiloids בקבוצת הטיפול, לעומת עלייה של 3.64 centiloids בקבוצת הפלצבו (תמונה 2). כמו כן, היה אפקט חיובי ומובהק סטטיסטית גם בתוצאים הקליניים האחרים שנמדדו (,ADCOMS ADCS-MCI-ADL, ADAS-Cog).
באנליזות של תוצאים על בסיס הסטטוס הגנטי, הודגמה האטה מועטה יותר בקרב נשאים של APOE ε4, כאשר הומוזיגוטים ל-APOE ε4 הגיבו באופן פחות משמעותי לטיפול (לעומת מטופלים שאינם נשאים או הטרוזיגוטיים).
בטיחות התרופה
שיעור התמותה היה דומה בין הקבוצות במהלך המחקר (0.7% בקבוצת הטיפול לעומת 0.8% בקבוצת הפלצבו). תופעת הלוואי הנפוצה ביותר הייתה תגובה לעירוי (infusion related reaction) שנצפתה בשיעור של 26% בקבוצת הטיפול לעומת 7% בקבוצת הפלצבו. תופעות הלוואי היו ברובן קלות או בינוניות (96%) והתרחשו בעיקר לאחר העירוי הראשון (75%).
נוגדנים מונוקלונליים המכוונים נגד β-עמילואיד (Aβ), ובכללם לקאנמאב, עלולים לגרום לתופעה של שינויים הדמייתיים הקשורים לפינוי העמילואיד ARIA (Amyloid related imaging abnormalities), שניתן לראות בהדמיה מוחית באמצעות MRI. ההשערה היא שנוגדנים כנגד עמילואיד מאיצים פירוק וסילוק של Aβ, מה שעלול להגדיל את חדירות כלי הדם ולגרום לדליפה של נוזלים או דם לתוך רקמת המוח. ישנם שני סוגים של ARIA:
- ARIA-E - בצקת וזוגנית או תפליט סולקלי
- ARIA-H - מיקרודימומים וסידרוזיס שטחי
שיעור ה־ARIA היה 21% בקבוצת הטיפול לעומת 9% בקבוצת הפלצבו. רוב אירועי ה־ARIA היו א־סימפטומטיים. ל־2.8% מהנבדקים בקבוצת הטיפול היה ARIA-E סימפטומטי. הסימפטומים הנפוצים ביותר היו כאבי ראש, הפרעות ראייה ובלבול. שיעור ה־ARIA-H (ללא ARIA-E) הסימפטומטי היה 0.7% בקבוצת הטיפול לעומת 0.2% בקבוצת הפלצבו. הסימפטום הנפוץ ביותר היה סחרחורת.
רוב האירועים של ARIA-E היו בשלושת החודשים הראשונים של הטיפול, אולם אירועי ARIA-H ללא ARIA-E אירעו לאורך כל המחקר. השיעור של ARIA-E היה גבוה יותר בקרב נשאים של APOE E4, כאשר להומוזיגוטים היה את השיעור הגבוה ביותר (32.6%), לעומת הטרוזיגוטים (10.9%) ולא נשאים (5.4%). הסתמנות דומה נראתה גם לגבי שכיחות הופעת ARIA-H.
על מנת לעקוב אחרי שיעורי ה־ARIA יש חשיבות למעקב באמצעות MRI מוח. ההמלצה היא לבצע MRI לפני תחילת טיפול (עד שנה לפני תחילת הטיפול) ולאחר חודשיים, שלושה חודשים וחצי שנה של טיפול.
סיכום
מחקר פאזה שלישית כפול סמיות, שבדק את ההשפעה של טיפול בלקאנמאב בקרב מטופלים בשלבים מוקדמים של מחלת אלצהיימר, הדגים האטה בקצב התקדמות המחלה ב־27% לאורך 18 חודשים לעומת מטופלים שקיבלו פלצבו. נתון זה משתווה לעיכוב של התקדמות המחלה של כשישה חודשים במהלך 18 חודשי המחקר.
תופעות הלוואי העיקריות כוללות ARIA, שינויים הדמייתיים שמשקפים היווצרות בצקת ו/או דימומים, שבאחוז קטן עלולים להיות סימטפומטיים.
פורסמו גם תוצאות מחקר שבדק תרופה בשם donanemab, גם היא נוגדן מונוקלונלי כנגד עמילואיד שהראתה תוצאות חיוביות, אולם טרם אושרה על ידי ה־ FDA. התרופות הללו מהוות שינוי מהותי ביכולת לטפל בחולים עם מחלת אלצהיימר, המחלה הניוונית השכיחה ביותר בעולם.
ביבליוגרפיה
- van Dyck H. et al. Lecanemab in Early Alzheimer’s Disease. New England Journal of Medicine. 2023; 388:9-21
- Cummings J. et al. Lecanemab: Appropriate Use Recommendations. The Journal of Prevention of Alzheimer’s Disease 2023;10(3):362-377
- Sims JR et al. Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial. The Journal of the American < Medical Association. 2023 Aug 8;330(6):512-527
המידע שבדף זה נכתב על ידי ד"ר תמרה שיינר, מנהלת המרכז לטיפולים מתקדמים למחלת אלצהיימר, המרכז הרפואי איכילוב-תל אביב
הכתבה בחסות חברת אסאיי ישראל. הכתבה כוללת מידע מדעי/ קליני על תרופה שטרם נרשמה בישראל והוגשה לרישום למשרד הבריאות ולהכללה בסל שירותי הבריאות 2024.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק