מחלות ראומטולוגיות וביטוייהן בכליה בילדים - Rheumatologic diseases and their renal expression in children
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מחלות ראומטולוגיות וביטוייהן בכליה בילדים | ||
|---|---|---|
| Rheumatologic diseases and their renal expression in children | ||
| יוצר הערך | אמיר אבירם, ד"ר לימור פרידנזון צוק, פרופ' יוסף עוזיאל, פרופ' אבישלום פומרנץ 
|
|
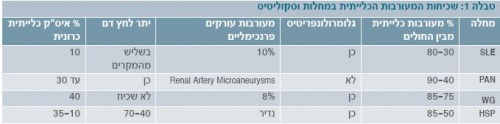
מחלות ראומטיות נובעות מתהליך חיסון עצמי (אוטואימוני) הגורם לתהליך דלקתי באיברי מטרה. היות ואיברי המטרה של תהליך דלקתי זה הם רבים, התסמינים הקליניים במחלות ראומטיות הם רבים ומגוונים. השכיחות של המעורבות הכלייתית במחלות ראומטיות משתנה בסינדרומים השונים (טבלה 1). בסקירה זו נתאר מחלות ראומטיות שבהן שכיחה התייצגות כלייתית, כתסמין מרכזי או בליווי תסמינים נוספים. בחלק מהמחלות משפיעה המעורבות הכלייתית על התחלואה והתמותה של חולים אלו, ולכן חשוב לאבחן חולים הסובלים מפגיעה כלייתית ולטפל בהם.
זאבת (לופוס)
האטיולוגיה המדויקת של מחלת הזאבת אינה ידועה. המחלה מתאפיינת בנוגדנים נגד אנטיגנים עצמיים, היוצרים קומפלקסים אימוניים שנקשרים לרקמות וגורמים לנזק ישיר או מצטברים ושוקעים ברקמות. כך נגרם נזק דלקתי לאיברי מטרה רבים, כגון: מפרקים, כליות, מערכת הדם ומערכת העצבים המרכזית. המהלך הטבעי של המחלה קשה לחיזוי ונע בין התייצגות כרונית ארוכת שנים והופעה חדה מסכנת חיים.
היארעות המחלה השנתית היא 5.6-1.9 ל-100,000 ילדים בקרב ילדים שגילם צעיר מ-15 שנים, וההימצאות המדווחת היא של 250-4 ל-100,000. היחס בין נשים לגברים הוא 4:1 לפני גיל ההתבגרות, ו-8:1 אחריו[1]. בקרב 20% מהחולים תופיע המחלה במהלך העשור השני לחיים. דיווחים שונים מצביעים על כך שהמחלה יכולה להופיע גם בשנה הראשונה לחיים, אולם היא אינה נפוצה לפני גיל 8.
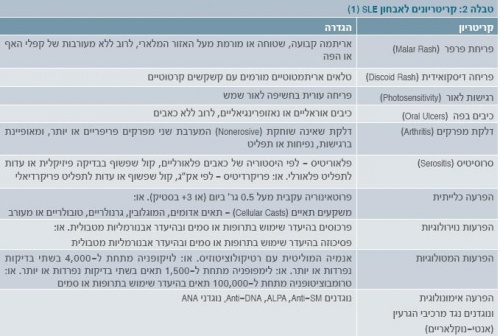
פרק הזמן הממוצע בין הופעת התסמינים לאבחנה הוא חודש אחד עד 3.3 שנים. התסמינים השכיחים בהתייצגות המחלה אינם כלייתיים. למטרת אבחנה, יש לזהות 4 תסמינים או יותר מתוך אחד עשר המקובלים בספרות (טבלה 2), המופיעים במקביל או בנפרד, במהלך תקופת המעקב. רוב מקרי המוות נובעים מזיהום, נפריטיס, אי ספיקה (איס"ק) כלייתית, מחלה נוירולוגית או דימום ריאתי [1].
זאבת כלייתית
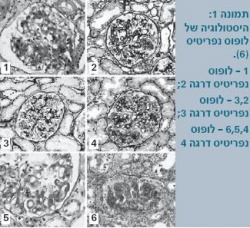
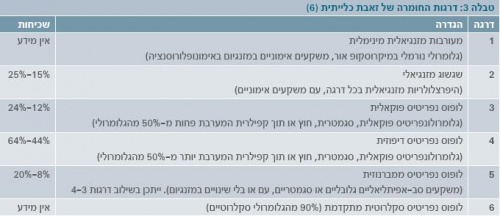
זאבת כלייתית מופיעה בקרב 80%-29% מהמקרים [2] [3] [4] [5]. ב-90% מהמקרים של זאבת כלייתית המחלה מופיעה כהתייצגות ראשונית או במהלך השנה הראשונה למחלה. מחלה כלייתית מתאפיינת בתסמונת נפריטית המתבטאת בלחצי דם גבוהים, בצקת בגפיים התחתונות, הפרעות אלקטרוליטרית ואי ספיקת כליות חריפה. מחלה כלייתית נפוצה יותר בילדים מאשר במבוגרים. ה-WHO ((World Health Organization הגדיר סיווג מורפולוגי המבוסס על ביופסיה כלייתית (תמונה 1), שעודכן בשנת 2003 על ידי החברה הבין-לאומית לנפרולוגיה ופתולוגיה כלייתית [6]. טווח הסיווג ההיסטולוגי הוא מכליה נורמלית במיקרוסקופ אור (דרגה 1) עד נפריטיס סקלרוטית מתקדמת (דרגה 6) (טבלה 3).
במקרים קיצוניים ניתן לחזות את דרגת הסיווג המורופולוגית, בייחוד כאשר החולה מתייצג עם מספר אפיזודות של איס"ק כלייתית קשה ויתר לחץ דם משמעותי. עם זאת, במקרים קלים יותר קשה לחזות את רמת הפגיעה הכלייתית על בסיס מאפיינים קליניים ומעבדתיים. ראוי לזכור כי גם מטופלים עם נפריטיס בדרגה הגבוהה ביותר יכולים להיות בשלבים הראשונים של המחלה עם תפקוד כלייתי תקין וערכים תקינים של לחץ דם. בכל התייצגות עם אי ספיקה כלייתית, הפרעה בתפקודי הכליה או משקע שתן פתולוגי יש לבצע ביופסיה כלייתית כדי לבסס את הסיווג שעל פיו יוחלט על טיפול.
טווח ההופעה הקלינית של נפריטיס ממברנוזית הוא מפרוטאינוריה קלה (עם או בלי המטוריה) ועד סינדרום נפרוטי. יש לחשוד בלופוס נפריטיס בכל מתבגר שמתייצג עם סינדרום נפרוטי אידיופתי, סינדרום נפרוטי עם המטוריה או סינדרום נפרוטי עמיד לטיפול.
רוב החולים עם לופוס נפריטיס מתייצגים עם סימפטומים מערכתיים, הכוללים חום, הרגשה כללית רעה, אנורקסיה ואיבוד משקל. בשליש מהמקרים ניתן למצוא לחצי דם גבוהים. הופעת לחץ דם גבוה בשילוב בצקת פריפרית קשורה לרוב לדרגות 3 או 4. לחץ הדם נוטה גם לעלות בהתחלת טיפול בסטרואידים. בדיקות השתן יכולות לגלות פרוטאינוריה ו/או המטוריה עם או בלי אזוטמיה. רוב החולים עם תפקוד כלייתי לקוי הם חולים בדרגות 3 או 4.
התלקחויות של מחלה כלייתית נפוצות במהלך המחלה, ולרוב ניתנות לזיהוי על ידי התגברות הפרוטאינוריה עוד לפני הישנות תסמינים קליניים במערכות נוספות.
רוב הנגעים (לזיות) המשמעותיים כרוכים במשקעים סב-אפיתליאליים נרחבים ושגשוג (פרוליפרציה) של המזנגיום. רוב המטופלים המפתחים ESRD (End Stage Renal Disease) הם בדרגות 3 או 4 לפי ביופסיה. דרגה 2 מצביעה על מחלה קלה יחסית, הדורשת טיפול מועט ביחס לדרגות הגבוהות יותר, עם שרידות גבוהה יותר ותפקוד כלייתי מצוין. ב-30%-20% מהמקרים, עם זאת, חולים יכולים לעבור טרנספורמציה לדרגות 3 או 4 אחרי חודשים ואף שנים. במקרים אלו הישרדותם של החולים והתפקוד הכלייתי שלהם זהים לאלו שאובחנו מלכתחילה בדרגות 3 או 4 [7] [8].
סיכויי השרידות למשך 5 שנים ללופוס נפריטיס בדרגה 4 הם 93%-88%, ולמשך 10 שנים 85%. גורמים פרוגנוסטיים שליליים כוללים מציאת לופוס נפריטיס דרגה 4 בביופסיה, עדויות לסינדרום נפרוטי בהופעה הראשונית וגזע שאינו לבן.
הטיפול מבוסס על הממצאים בביופסיה כלייתית [1]:
- דרגה 1 - ללא טיפול.
- דרגה 2 - קורס קצר של סטרואידים במינון נמוך (0.5-0.1 מ"ג לק"ג פרדניזון ביום), עם הפחתה הדרגתית במהלך מספר חודשים. הפרוגנוזה של חולים אלו מצוינת.
- דרגות 4-3 - קורס ארוך של סטרואידים במינון גבוה (2 מ"ג לק"ג פרדניזון ליום, עד מקסימום 80-60 מ"ג ביום, במנות מחולקות). לרוב מוסיפים טיפול נוסף, כגון פעימה (Pulse) חודשיים של ציקלופוספמיד או טיפול יומי באזאתיופרין. ייתכן שגם MMF (Mycofenolate Mofetil) יכול להיות אפקטיבי, כמו ציקלופוספמיד. MMF ואזאתיופרין בטוחים יותר לשימוש מציקלופוספמיד.
- דרגה 5 - רוב החולים בדרגה 5 נדרשים לקורסים קצרים של סטרואידים במינון נמוך. רק מיעוטם נדרש לקורס ארוך או לשימוש בטיפול נוסף.
Henoch-Schönlein Purpura
HSP (Henoch-Schönlein Purpura) היא אחת הצורות הנפוצות ביותר של וסקוליטיס סיסטמית בילדים. היא מורכבת, לרוב, מתסמינים עוריים (תפרחת פורפוריאלית על הגפיים התחתונות), תסמינים של מערכת העיכול (כאבי בטן), תסמינים מפרקיים ותסמינים כלייתיים. התסמינים הכלייתיים מופיעים ב-50% מהמקרים של HSP [9]. בחלק ניכר מהחולים יש עדות לזיהום בדרכי הנשימה בטרם הופעת המחלה [10]. הקריטריונים לאבחנה מפורטים בטבלה 4.
ההיארעות של נפריטיס עקב HSP היא 20.4 ל-100,000 בשנה [11]. התסמינים הכלייתיים מופיעים בד"כ 3 ימים עד 17 חודשים לאחר הופעת התסמינים הראשונים, אף על פי שלרוב הם מופיעים תוך שלושה חודשים מההתייצגות הראשונית [12]. טווח ההופעה הראשונית הכלייתית הוא מהמטוריה מיקרוסקופית חולפת ופרוטאינוריה קלה (ברוב המקרים) עד סינדרום נפרוטי RPGN (Rapidly Progressive Glomerulonephritis) ואיס"ק כלייתית [13] [14]. רובם המוחלט של המקרים חולף ספונטנית ללא נזק שארי. הסיכון לפיתוח RPGN עומד על 3% בקירוב [15]. תחלואה ארוכת טווח מופיעה רק ב-5.5%-2% מהמקרים [16] [17].
Zaffanello וחב' [9] סקרו את הספרות ואספו מחקרים הנוגעים לטיפול בפגיעה הכלייתית ב-HSP. מספר מחקרים בחנו את ההשערה שטיפול בסטרואידים בזמן אבחנת HSP בילדים ללא עדות לפגיעה כלייתית בעת ההתייצגות, יכול למנוע את הפגיעה הכלייתית. לאחר בחינת המחקרים סוכם כי אין די נתונים לתמוך בהמלצה לטיפול סטרואידלי מניעתי [9].
מחקרים אחרים בסקירה של Zaffanello וחב' ניסו לבחון טיפולים ספציפיים למעורבות כלייתית בינונית, כגון IVIg (Intravenous Immunoglobulin), ACEi (Angiotensin Converting Enzyme Inhibitor), שמן דגים וכריתת שקדים. רוב המחקרים הורכבו מאוכלוסיית מחקר מצומצמת, לרוב הטרוגנית, עם דרגות שונות של תסמינים כלייתיים. אי לכך, לא ניתן היה לבסס המלצות לטיפולים ספציפיים על פיהם [9]. מחקרים רבים נערכו גם לגבי הטיפול במחלה כלייתית סוערת (RPGN). נבחנו טיפולים אימונוסופרסיביים רבים הכוללים סטרואידים, ציקלוסופורין, Azathioprine, MMF ועוד. אף מחקרים אלו לא הציגו די נתונים כדי לבסס המלצה לגבי טיפול ספציפי [9] [18].
Polyarteritis Nudosa
PAN (Polyarteritis Nudosa) היא וסקוליטיס נמקית שפוגעת בעורקים קטנים ובינוניים, ועלולה לגרום להתפתחות של אנוריזמות ונודולים לאורך העורקים הפגועים. אף על פי שהמחלה נחשבת נדירה בילדים, מדובר בווסקוליטיס הסיסטמית השלישית בשכיחותה לאחר HSP ומחלת קווסקי [19] [20]. המחלה מופיעה לרוב בגילים 11-7, ופוגעת יותר בבנים [21].
הקריטריונים לאבחנת PAN מפורטים בטבלה 5. הרגישות והסגוליות של קריטריונים אלו הם 73% ו-100%, בהתאמה [22].
התסמינים העיקריים של PAN הם רב מערכתיים וכוללים בין השאר חולשה, חום, כאבי בטן, איבוד משקל, פריחה, כאבי שרירים (מיאלגיה) או ארתרופתיה.
איסכמיה כלייתית בשל הפגיעה בעורקים היא המנגנון האחראי לפגיעה הכלייתית. התסמינים הכלייתיים במחלה כוללים כאב במפשעות, המטוריה, פרוטאינוריה, איס"ק כלייתית המתקדמת באיטיות ויתר לחץ דם [10] [21]. במהלך השלב החריף תיתכן אוליגוריה או אנוריה, אך איס"ק כלייתית חדה אינה נפוצה [23].
אין בדיקות מעבדה ספציפיות ל-PAN. ניתן להבחין בממצאים המעידים על דלקת כרונית, כגון שקיעת דם מוחשת או CRP גבוה, עלייה בפיברינוגן ומרכיבי המשלים, אנמיה ולויקוציטוזיס. ב-20%-10% מהמקרים ניתן לזהות p-ANCA בסרום. ב-39% מהמקרים ניתן לזהות RF וב-10% ניתן למצוא נוגדני Anti-ds-DNA. נוגדנים עצמיים מסוג ANA אינם נפוצים [10]. אנגיוגרפיה כלייתית יכולה להדגים הימצאות היצרויות או מיקרואנוריזמות [10].
העדות התומכת העיקרית לקיום PAN היא ביופסיה, לרוב מהעור, מהשלד, מהשריר, מעצב ה-Sural או מהכבד. אין מקום לביצוע ביופסיית כליה, היות שהפרוצדורה טומנת בחובה סיכון גבוה מהרגיל לדימום ואינה עוזרת בקביעת האבחנה [10] [21].
כרבע מהחולים יפתחו מהלך של הידרדרות מהירה עם מעורבות רב מערכתית ותמותה גבוהה ב-6-3 החודשים הראשונים. כ-50% מהחולים יפתחו מחלה בדרגת חומרה בינונית עם תנודות רבות במהלך המחלה. כ-25% מהחולים יימצאו ברמיסיה ארוכה לאחר המהלך הראשוני החריף ללא קשר לטיפול [24].
השרידות הממוצעת עומדת על 76%-55% ל-5 שנים לחולים המטופלים בסטרואידים [25], ו-80%-64% לחולים המטופלים בסטרואידים ובתכשירים אימונוספרסיביים [26] [27].
הטיפול ב-PAN כולל פרדניזון במינון גבוה וציקלופוספמיד במינון 2 מ"ג לק"ג ליום למשך 3-2 חודשים. לאחר שהושגה רמיסיה, יש להמשיך את הטיפול במינונים הולכים ופוחתים של פרדניזון ואזאתיופרין עד 18 חודשים. ניתן להיעזר בשחלוף פלזמה במצבי חירום.
Wegner’s Granulomatosis
WG (Wegner’s Granulomatosis) מאופיינת בדלקת נמקית גרנולומטוטית בדרכי הנשימה העליונות והתחתונות, בווסקוליטיס של כלי דם קטנים ובינוניים ובגלומרולונפריטיס נמקית.
שיעור ההימצאות של WG מוערך כ-3 מקרים ל-100,000 איש, ובקרב מבוגרים שכיחותה שווה בין המינים [28]. בילדים המחלה נדירה יותר, ושכיחותה בקרב בנות גבוהה פי 3 משכיחותה בקרב בנים.
טווח ההתייצגות הקלינית במחלה רחב, החל מצורות המערבות רק את דרכי הנשימה (סינוסיטיס, דלקת אוזן תיכונה וכו') ועד לצורות היכולות להיות קטלניות, הכוללות דימום ריאתי ואיס"ק כלייתית בשל RPGN. הקריטריונים לאבחנה מפורטים בטבלה 6 .
לרוב תחילת המחלה מאופיינת בתסמינים נשימתיים (94%-80% מהמקרים). ככל שמהלך המחלה הופך לכרוני, כך מופיעים תסמינים המערבים מערכות נוספות, כגון חום (בשליש מהמקרים), איבוד משקל (15% מהמקרים), מערכת אף-אוזן-גרון (90%-75% מהמקרים) כליות (77%-85% מהמקרים) ועיניים (85%-77% מהמקרים) [29] [30] [31] {הערה|שם=הערה32| Anderson G, Coles ET, Crane M, et al. Wegener’s granuloma. A series of 265 British cases seen between 1975 and 1985. A report by a sub-committee of the British Thoracic Society Research Committee, Q J Med 1992;83(302):427-438 }} [32].
המחלה מסווגת לשני תת-סוגים: הצורה הקלאסית (המערבת את הכליה) והצורה שאינה מערבת את הכליה. שתי הצורות שונות בהתייצגות ובפרוגנוזה. עם זאת, התייצגות שאינה קלאסית יכולה להפוך להתייצגות קלאסית.
המחלה מאופיינת בתחילתה בחום, בהרגשה כללית רעה, בירידה במשקל, בכאבי שרירים ומפרקים. בהמשך מתפתחים תסמינים נשימתיים: שיעול, נזלת וסינוסיטיס, כמו גם קוצר נשימה והמופטיזיס. מעורבות כלייתית בתחילת המחלה אינה באה לידי ביטוי כתסמינים כלייתיים קליניים אלא בממצאים פתולוגיים בביופסיה של הכליה. בהמשך המחלה, הקליניקה הכלייתית באה לידי ביטוי כגלומרולונפריטיס בדרגות חומרה שונות. התקדמות המחלה מהשלב הא-תסמיני לגלומרולונפריטיס סוערת ואיס"ק כלייתית יכול להימשך ימים עד שבועות. לכן, חיוני לזהות אם יש מעורבות כלייתית בתחילת המחלה. בדיקות שתן יעילות בהערכת המצב הכלייתי ובמעקב אחריו. נוכחות משקעים של תאי דם אדומים היא בעלת ערך מנבא חיובי להתפתחות גלומרולונפריטיס [32].
המאפיין הפתולוגי של WG הוא הדלקת הגרנולומטוטית הנמקית. ברם, מאפיין זה כמעט אינו ניתן לגילוי בכליה. הממצאים הכלייתיים בביופסיה הם גלומרולונפריטיס סהרונים ו-Pauci Immune Necrotizing GN. באימונופלורוסנציה ניתן לזהות הצטברות משקעים אימוניים המכילים C3, IgM, IgG ו-IgA במזנגיום [24] [27] [33] [34].
האבחנה מבוססת על שילוב של קליניקה, היסטולוגיה, דימות וממצאים מעבדתיים. יש לחשוד ב-WG בכל ילד עם סינוסיטיס כרונית וממצאים בצילום חזה המתאימים לגרנולומות. 90% מהמטופלים עם מחלה קלאסית יפגינו ANCA חיובי (ב-80%-75% יימצא c-ANCA וב-15%-10% יימצא p-ANCA) [35]. לעומת זאת, במחלה ממוקמת שאינה מערבת את הכליה, לא ניתן יהיה למצוא ANCA בסרום. הסגוליות של c-ANCA ל-WG היא 100%-88% והרגישות – 92%-34% [36] [37] [38] [39] [40]. נוסף על כך, מדדי דלקת, כגון שקיעת דם ו-CRP, כמו גם אנמיה של מחלה כרונית, נפוצים ב-WG (175).
בעבר עמדה התמותה בשנתיים הראשונות לאחר גילוי המחלה על 80%. הטיפול הסטרואידלי שיפר במעט את הפרוגנוזה [24]. לעומת זאת, הטיפול האימונוסופרסיבי (ובעיקר ציקלופוספמיד) שיפר את הפרוגנוזה באופן משמעותי. בטיפול משולב של סטרואידים ואימונוסופרסיה 91% מהמטופלים משיגים רמיסיה חלקית ו-75% מהמטופלים משיגים רמיסיה מלאה. הישנות מתרחשת ב-46%-20% מהמטופלים [41] [42] [43] [44]. איס"ק כלייתית כרונית מתפתחת ב-42% מהמטופלים, ו-1% מתוכם יזדקקו לדיאליזה, ו-5% יזדקקו להשתלת כליה [30]. איס"ק ריאתית או כלייתית, ותופעות לוואי או סיבוכים של הטיפול הם הגורמים העיקריים לתמותה מהמחלה [10].
סיכום
הכליה מעורבת בכ-50% ומעלה במחלות החיסון העצמי. למעורבות הכלייתית במחלות אלו יש חשיבות רבה בקביעת התחלואה והתמותה של חולים אלו.
המעורבות הכלייתית מצביעה על מחלה חיסון עצמי קשה יותר, ודורשת טיפול מדכא חיסון. לטיפולים אלו תופעות לוואי כולל תחלואה מוגברת מזיהומים, עקרות משנית ועוד.
אבחון מוקדם של קבוצת חולים זו באוכלוסיית הילדים יכול לשפר את תוצאות הטיפול התרופתי ולהקטין את הנזק הכלייתית ארוך הטווח.
דגלים אדומים
ביבליוגרפיה
- Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides. Ann Rheum Dis 2006;65(7):936-941
- ↑ 1.0 1.1 1.2 Benseler SM, Silverman ED. Systemic Lupus Erythematosus. Pediatr Clin North Am 2005;52(2):443-467
- ↑ Barron KS, Silverman ED, Gonzales J, et al. Clinical, serologic, and immunogenetic studies in childhood-onset systemic lupus erythematosus. Arthritis Rheum 1993;36:348-354
- ↑ Hagelberg S, Lee Y, Bargman J, et al. Long-term followup of childhood lupus nephritis. J Rheumatol 2002;29:2635-2642
- ↑ Gupta KL. Lupus nephritis in children. Indian J Pediatr 1999;66:215-223
- ↑ Sumboonnanonda A, Vongjirad A, Suntornpoch V, et al. Renal pathology and long-term outcome in childhood SLE. J Med Assoc Thai 1998;81:830-834
- ↑ Weening JJ, D'Agati VD, Schwartz MM, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol 2004;15:241-250
- ↑ Austin HA, Muenz LR, Joyce KM. Prognostic factors in lupus nephritis. Contribution of renal histologic data. Am J Med 1983;75:382-391
- ↑ Schwartz MM, Lan SP, Bernstein J. Irreproducibility of the activity and chronicity indices limits their utility in the management of lupus nephritis. Lupus Nephritis Collaborative Study Group. Am J Kidney Dis 1993;21:374-377
- ↑ 9.0 9.1 9.2 9.3 9.4 Zaffanello M, Fanos V. Treatment-based literature of Henoch-Schönlein purpura nephritis in childhood. Pediatr Nephrol 2009;24(10):1901-1911
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 Samarkos M, Loizou S, Vaiopoulos G, et al. The Clinical Spectrum of Primary Renal Vasculitis. Semin Arthritis Rheum 2005;35(2):95-111
- ↑ Gardner-Medwin JM, Dolezalova P, Cummins C, et al. Incidence of Henoch–Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins. Lancet 2002;360:1197-1202
- ↑ Kaku Y, Nohara K, Honda S. Renal involvement in Henoch–Schönlein purpura: a multivariate analysis of prognostic factors. Kidney Int 1998;53:1755-1759
- ↑ Oner A, Tinaztepe K, Erdogan O. The effect of triple therapy on rapidly progressive type of Henoch-Schönlein nephritis. Pediatr Nephrol 1995;9:6-10
- ↑ Chang WL, Yang YH, Wang LC, et al. Renal manifestations in Henoch-Schönlein purpura: a 10-year clinical study. Pediatr Nephrol 2005;20:1269-1272
- ↑ Sanders JT, Wyatt RJ. IgA nephropathy and Henoch-Schönlein purpura nephritis. Curr Opin Pediatr 2008;20(2):163-170
- ↑ Stewart M, Savage JM, Bell B, et al. Long term renal prognosis of Henoch-Schönlein purpura in an unselected childhood population. Eur J Pediatr 1988;147:113-115
- ↑ Roberti I, Reisman L, Churg J. Vasculitis in childhood. Pediatr Nephrol 1993;7:479-489
- ↑ Chartapisak W, Opastiraku S, Willis NS, et al. Prevention and treatment of renal disease in Henoch-Schönlein purpura: a systematic review. Arch Dis Child 2009;94(2):132-137
- ↑ Dillon MJ. Classification and pathogenesis of arteritis in children. Toxicol Pathol 1989;17:214-218
- ↑ zen S, Bakkaloglu A, Dusunsel R, et al. Childhood vasculitides in Turkey: a nationwide survey. Clin Rheumatol 2007;26:196-200
- ↑ 21.0 21.1 21.2 Dillon MJ, Eleftheriou D, Brogan PA. Medium-size-vessel vasculitis. Pediatr Nephrol 2009. Epub ahead of print
- ↑ Ozen S, Pistorio A, Iusan MS, et al. The EULAR/PRINTO/PRES criteria for childhood polyarteritis nodosa. Ankara 2008. Ann Rheum Dis 2009;68(Suppl 3):713
- ↑ Ladefoged J, Nielsen B, Raaschou F, et al. Acute anuria due to polyarteritis nodosa. Am J Med 1969;46(5):827-831
- ↑ 24.0 24.1 24.2 Balow JE, Fauci AS. Vasculitic diseases of the kidney. In: Schrier RW, Grace WJ, Editors. Diseases of the Kidney, Little Brown, Boston 1997;1851-1878
- ↑ Cohen RD, Conn DL, Ilstrup DM. Clinical features, prognosis, and response to treatment in polyarteritis, Mayo Clin Proc 1980;55(3):146-155
- ↑ Leib ES, Restivo C, Paulus HE. Immunosuppressive and corticosteroid therapy of polyarteritis nodosa. Am J Med 1979;67(6):941-947
- ↑ 27.0 27.1 Fauci AS, Katz P, Haynes BF, et al. Cyclophosphamide therapy of severe systemic necrotizing vasculitis. NEJM 1979;301(5):235-238
- ↑ Cotch MF, Hoffman GS, Yerg DE, et al. The epidemiology of Wegener’s granulomatosis. Estimates of the five-year period prevalence, annual mortality, and geographic disease distribution from population-based data sources. Arthritis Rheum 1996;39(1):87-92
- ↑ Fauci AS, Haynes BF, Katz P, et al. Wegener’s Granulomatosis: prospective clinical and therapeutic experience with 85 patients for 21 years. Ann Intern Med 1983;98:76-85
- ↑ 30.0 30.1 Hoffman GS, Kerr GS, Leavitt RY, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992;116(6):488-498
- ↑ Boki KA, Dafni U, Karpouzas GA, et al. Necrotizing vasculitis in Greece: clinical, immunological and immunogenetic aspects. A study of 66 patients. Br J Rheumatol 1997;36(10):1059-1066
- ↑ 32.0 32.1 Duna GF, Galperin C, Hoffman GS. Wegener’s granulomatosis, Rheum Dis Clin North Am 1995;21:949-986
- ↑ Ronco P, Verroust P, Mignon F, et al. Immunopathological studies of polyarteritis nodosa and Wegener’s granulomatosis: a report of 43 patients with 51 renal biopsies. Q J Med 1983;52(206):212-223
- ↑ Horn RG, Fauci AS, Rosenthal AS, et al. Renal biopsy pathology in Wegener’s granulomatosis, Am J Pathol 1974;74(3):423-440
- ↑ Wiik AS. Clinical use of serological tests for antineutrophil cytoplasmic antibodies, What do the studies say? Rheum Dis Clin North Am 2001;27 (4):799
- ↑ Rao JK, Weinberger M, Oddone EZ, et al. The role of antineutrophil cytoplasmic antibody (c-ANCA) testing in the diagnosis of Wegener granulomatosis. A literature review and meta-analysis (see comments). Ann Intern Med 1995;123(12):925-932
- ↑ Venning MC, Quinn A, Broomhead V, et al. Antibodies directed against neutrophils (C-ANCA and P-ANCA) are of distinct diagnostic value in systemic vasculitis. Q J Med 1990;77(284):1287-1296
- ↑ Bosch X, Mirapeix E, Font J, et al. Anti-myeloperoxidase autoantibodies in patients with necrotizing glomerular and alveolar capillaritis. Am J Kidney Dis 1992;20(3):231-239
- ↑ Bindi P, Mougenot B, Mentre F, et al. Necrotizing crescentic glomerulonephritis without significant immune deposits: a clinical and serological study. Q J Med 1993;86(1):55-68
- ↑ Hagen EC, Andrassy K, Chernok E, et al. and EEC/BCR Group for ANCA Assay Standardization, The value of indirect immunofluorescence and solid phase techniques for ANCA detection. A report on the first phase of an international cooperative study on the standardization of ANCA assays. J Immunol Methods 1993;159(1-2):1-16
- ↑ Geffriaud-Ricouard C, Noel LH, Chauveau D, et al. Clinical spectrum associated with ANCA of defined antigen specificities in 98 selected patients. Clin Nephrol 1993;39(3):125-136
- ↑ Jayne DR, Gaskin G, Pusey CD, et al. ANCA and predicting relapse in systemic vasculitis, Q J Med 1995;88(2):127-133
- ↑ Westman KW, Bygren PG, Olsson H, et al. Relapse rate, renal survival, and cancer morbidity in patients with Wegener’s granulomatosis or microscopic polyangiitis with renal involvement. J Am Soc Nephrol 1998;9(5):842-852
- ↑ Nachman PH, Hogan SL, Jennette JC, et al. Treatment response and relapse in antineutrophil cytoplasmic autoantibody-associated microscopic polyangiitis and glomerulonephritis. J Am Soc Nephrol 1996;7(1):33-39
קישורים חיצוניים
- מחלות ראומטולוגיות וביטוייהן בכליה, מדיקל מדיה
המידע שבדף זה נכתב על ידי אמיר אבירם - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא, ד"ר לימור פרידנזון צוק - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא, פרופ' יוסף עוזיאל - היחידה לראומטולוגיה ילדים, מרכז רפואי מאיר, כפר סבא, פרופ' אבישלום פומרנץ - היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק