הקומפלקס פירובט דהידרוגנאז - pyruvate dehydrogenase
| מדריך בדיקות מעבדה | |
| הקומפלקס פירובט דהידרוגנאז | |
|---|---|
| pyruvate dehydrogenase | |
| שמות אחרים | PDC או Pyruvate Dehydrogenase Complex |
| |
| מעבדה | כימיה בדם |
| תחום | הערכה של חסר האנזים בתינוקות, ילדים ובוגרים עם חשד למפגע אנזימטי מטבולי. |
| טווח ערכים תקין | ערך תקין כאשר פעילות האנזים עולה על 25.0 nmol/min/g protein; רמה גבולית או רמת חסר קלה- 5.0-25.0nmol/min/g protein; רמת חסר של האנזים-פחות מ- 5/0nmol/min/g protein. רמות אלה מתייחסות לכל הגילים. |
| יוצר הערך | פרופ' בן-עמי סלע |
- מטרת הבדיקה
הערכה של נבדקים עם חשד קליני לחסר pyruvate dehydrogenase complex, או של מפגע במטבוליזם האנרגטי.
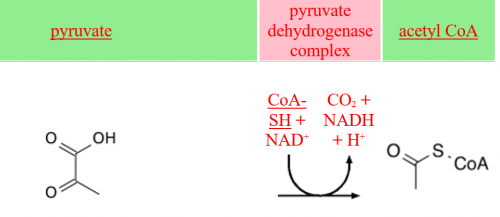
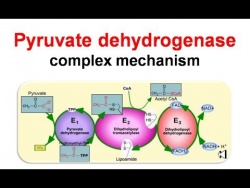
הקומפלקס פירובאט דהידרוגנאזה pyruvate dehydrogenase complex (להלן PDC) מקטלז את הדקרבוקסילציה החימצונית של פירובאט ל-acetyl-CoA, שהוא שלב קריטי ביצירת אנרגיה תאית. PDC הוא קומפלקס רב-אנזימי הממוקם בממברנה הפנימית של המיטוכונדריה, ומורכב מ-6 מרכיבים שונים: pyruvate decarboxylase שסימונו E1, והוא בנוי מ-2 תת יחידות α ו-2 תת-יחידות β; dihydrolipoic transacetylase שסימונו E2; האנזים dihydrolipoyl dehydrogenase שסימונו E3; שני אנזימים רגולטוריים (PDH kinase ו- PDH phosphatase) וכן חלבון קושר-E3 הידוע כ-E3BP. חסר של PDHC הוא מפגע מיטוכונדריאלי עם מגוון של תסמינים קליניים החל מ-lactic acidosis מולדת קטלנית וכלה בשיגשון (ataxia) או נירופתיה מתונים.
הקומפלקס של פירובאט דהידרוגנאזה מחבר בין הגליקוליזה למעגל TCA (הידוע כמעגל Krebs או מעגל חומצת הלימון). קומפלקס גדול זה מורכב מ-3 אנזימים הנתמכים על ידי 5 קו-פקטורים. תהליך החמצון של פירובאט מתרחש במיטוכונדריה לשם האחרון מגיע על ידי pyruvate translocase. האנזים E1 או Pyruvate dehydrogenase עושה שימוש ב-thiamine pyrophosphate (או TPP) כקבוצה הפרוסתטית שלו; האנזים E2 או dihydrolipoyl transacetylase עושה שימוש ב-lipoamide וב- coenzyme A כקבוצות הפרוסתטיות שלו; האנזים E3 או dihydrolipoyl dehydrogenase עושה שימוש ב-flavin adenine dinucleotide או +NAD כקו-פקטור שלו. קבוצה פרוסתטית היא מולקולה הקשורה קו-ולנטית לאנזים. נראה אם כן שהריאקציה המסבה פירובאט לאצטיל CoA ול- CO2 היא:
- 2pyruvate+2NAD++2coA→ 2acetyl coA+ 2NADH+2CO2
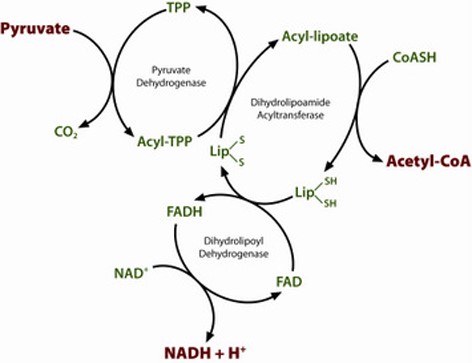
התהליך בכללותו הוא 5-שלבי:
- פירובאט עובר דקרבוקסילציה על ידי pyruvate dehydrogenase בעזרת TPP;
- הפחמן הפעיל בין N ו-S של הטבעת המחומשת של TPP מחומצן ומועבר כקבוצת אצטיל ל-lipoamide (המהווה קבוצה פרוסתטית של האנזים dihydrolipoyl transacetylase או E2. צעד זה יוצר תוצר ביניים של hydroxyethyl-TPP. נדרש כאן יון +H לתוצר הביניים לשחרר מולקולת CO2;
- dihydrolipoyl transacetylase והקופקטור lipoamide מחמצן hydroxyethyl לאצטיל, ואז מעביר אצטיל ל-CoA ליצירת acetyl-CoA;
- כיוון שהאנזים E2 עדיין קשור למולקולת acetyl-CoA, האנזים E3 או dihydrolipoyl dehydrogenase מחמצן את קבוצות ה-thiol של dihydrolipoamide בחזרה ל-lipoamide;
- כריאקציה צדדית, +NAD מחוזר והופך ל-NADH.
חסר של הקומפלקס של פירובאט דהידרוגנזאה
בתינוקות ובילדים עם חסר PDC, המאפיינים השכיחים ביותר הם פיגור התפתחותי והיפוטוניה. פרכוסים ואטקסיה גם כן תסמינים שכיחים, כאשר התבטאויות פחות שכיחות כוללת עיוותי מוח מולדים, בעיקר הרחבת חדרים (ventriculomegaly) או agenesis של הקורפוס קלוסום, או שינוים ניווניים הכוללים את תסמונת Leigh (Brown וחב' ב-Ann NY Acad Sci משנת 2003). בחלק קטן של אלה עם PDHC מוצאים תווי-פנים דיסמורפיים. חסר PDHC היא אחת הסיבות השכיחות לחמצת לקטית ראשונית בילדים, כאשר חומרת התקדמות המחלה קשורה לחומרה של החמצת הלקטית כמו גם לרמה השארית של הפעילות האנזימטית (Patel וחב' ב-Mol Genet Metab משנת 2012).
חסר PDC יכול להיגרם על ידי ליקויים בתת היחידות E1 α, E1 β, וכן E2 או E3. הסיבה השכיחה ביותר לחסר PDC הוא פגם בגן המקודד לתת היחידה E1 α, גן הממוקם על כרומוזום X. נקבות וזכרים עם המוטציה בגן E1 α, לוקים בחסר PDC, לכן הפגם מוגדר כ-X-linked dominant. הבדיקה האבחונית ההתחלתית החשובה ביותר היא המדידה בדם ובנוזל השדרה של רמות חומצה לקטית ופירובאט, וכן חישוב היחס לקטאט ל-פירובאט (L:P ratio), כאשר באופן אופייני מצביעה על רמות מוגברות של לקטאט ופירובאט, כאשר היחס בין השניים נורמאלי (Lib וחב' ב-Anal Chem משנת 2003). בנוסף, אנליזה כמותית של חומצות אמינו בפלזמה יכולה למצוא רמת אלנין מוגברת. האבחון של חסר PDC תלוי במדידה של פעילות הנזים בתאים או ברקמות, בעיקר בפיברובלסטים הלקוחים מהעור (Dahl ב-Am J Hum Genet משנת 1995).
חסר ב-pyruvate dehydrogenase מתאפיין בהצטברות של חומצת חלב ומגוון של בעיות נירולוגיות. סימנים ותסמינים של מצב זה בדרך כלל מופיעים מיד לאחר הלידה, בדרגות חומרה שונות. המאפיין השכיח ביותר הוא אמנם תרחיש של lactic acidosis שעלול אף לסכן חיים, שיכול לגרום לבחילה, הקאות, בעיות נשימה קשות וקצב-לב בלתי תקין. אלה עם חסר ב-pyruvate dehydrogenase, סובלים בדרך כלל מבעיות נירולוגיות, רובם סובלים מהתפתחות מעוכבת ביכולות המנטאליות ובכישורים מוטוריים כמו ישיבה והליכה. בעיות נירולוגיות נוספות הן ברמה האינטלקטואלית, פירכוסים, היפוטוניה, תנועות עיניים בלתי סדירות, קואורדינציה דלה, ובחלקם מוצאים מבנים מוחיים לא-נורמאליים כמו התפתחות דלה של ה-corpus callosum המחבר את חצאי המוח הימני והשמאלי, אטרופיה של החלק החיצוני של קליפת המוח, וכן נגעים של רקמה פגועה בחלקי מוח שונים.
תהליך 5 השלבים של קומפלקס PDH
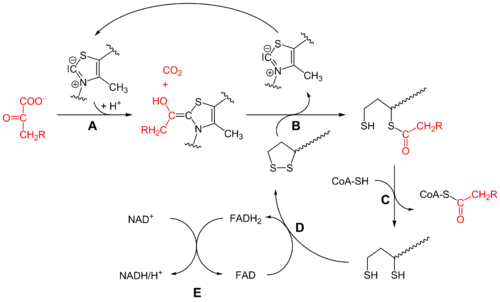
בתחילה, פירובאט ו-thiamine pyrophosphate או TPP, נקשרים על ידי תת היחידות של pyruvate dehydrogenase. טבעת ה-thiazolium של TPP נמצאת בצורה הצוויטריונית, והפחמן האניוני C2 מבצע התקפה נוקלאופילית על הקטון הקרבונילי C2 של פירובאט. תוצר הביניים ה-hemithioacetal עובר דקרבוקסילציה ליצירה של שווה-ערך של acyl anion, והאחרון תוקף את שייר S1 של lipoate מחומצן, הקשור לשייר lysine.
במנגנון של "פתיחת טבעת" דמוי SN2, שייר S2 מוחלף על ידי שיירי סולפיד או סולפהידריל. כתוצאה מכך ההתפרקות של ה-hemithioacetal הטטרהדראלי גורם לפליטת thiazole, לשחרור של הקו-פקטור TPP וליצירה של thioacetate על שייר S1 של lipoate. התהליך האנזימטי המקוטלז על ידי E1 הוא השלב ה-rate limiting של כל הקומפלקס של pyruvate dehydrogenase.
בשלב זה ה-lipoate-thioester מועבר לאתר הפעיל של dihydrolipoyl transacetylase או E2, שם ריאקציית טרנסאצילציה מעבירה שייר אצטיל ממולקולת lipoyl ל-thiol של קואנזים A. צעד זה יוצר אצטיל-CoA המשתחרר מהקומפלקס האנזימטי ונכנס למעגל חומצת הלימון. ניתן להתייחס ל-E2 כאל lipoamide reductase-transacetylase.
ה-dihydrolipoate שעדיין קשור לשייר הליזין של הקומפלקס, נודד אז לאתר הפעיל של E3 או dihydrolipoyl dehydrogenase שם הוא עובר חמצון בתיווך של flavin. בראשונה, FAD מחמצן dihydrolipoate בחזרה למצב המנוחה של ה-lipoate ומייצר FADH2. ואז, הקו-פקטור +NAD מחמצן FADH2 בחזרה למצב המנוחה של FAD, תוך שהוא מייצר NADH.
היבטים מבניים באאוקריוטים ובחיידקים גראם-חיוביים
באאוקריוטים, אך גם בחיידקים גראם-חיוביים (כמו Bacillus stearothermophilus) הגרעין המרכזי של PDC מכיל 60 מולקולות E2 המאורגנות ל-icosahedron (מבנה בעל 20 פאות). אאוקריוטים מכילים גם כן בגרעין של PDC עוד 12 עותקים של חלבון נוסף, E3BP או E3 binding protein. המיקום המדויק של החלבון האחרון אינו לגמרי ברור. באאוקריוטים, E1 נקשר באופן ספציפי על ידי E2, בעוד ש-E3 כרוך עם E3BP. יש סברה שעד 30 מולקולות E1 ו-6 מולקולות E3 נמצאות בקומפלקס של PD, אם כי המספר המדויק יכול להשתנות in vivo ולשקף את הדרישות המטבוליות של הרקמה הספציפית.
רגולציה של פעילות הקומפלקס
תפקוד ומבנה של PDH
הקומפלקס Pyruvate Dehydrogenase מקשר את מעגל חומצת הלימון ואת הזרחון החמצוני המלווה לגליקוליזה, לגלוקונאוגנזה ולמסלולי המטבוליזם של שומן וחומצות אמינו. PDH מקטלז את הדקרבוקסילציה החמצונית של פירובאט ליצירת אצטיל קואנזים A, וכן NADH ו-CO2. האנזים PDH מזרז את השימוש בפחמימות כדי לספק את הדרישות האנרגטיות, וכאשר המאגרים הפחמימניים מתדלדלים ביונקים, פעילות PDH עוברת down-regulation על מנת להגביל את השימוש בגלוקוזה על ידי oxidative phosphorylation. חומצות שומן או גופי קטו משמשים אז מקורות אנרגיה ברקמות דוגמת הלב ושרירי השלד.
קומפלקס האנזים PDH הוא בגודל של 9,500,000 דלטון המורכב מעותקים רבים של שלושת האנזימים pyruvate dehydrogenase או E1, וכן dihydrolipoamide transacetylase או E2, ו-dihydrolipoamide dehydrogenase או E3. תת-יחידה מבנית נוספת הידועה כ-E2/E3, נחוצה לסייע באינטראקציה בין תת היחידות E2 ו-E3.
וויסות הפעילות של PDH
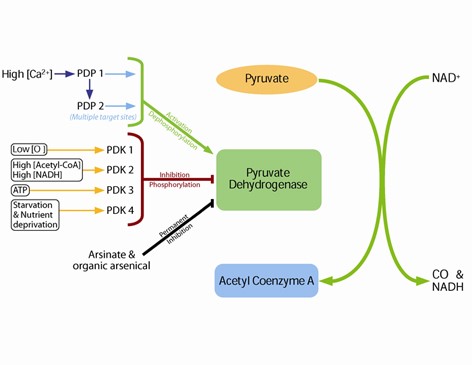
הפעילות של PDH מעוכבת על ידי זרחון הפיך של תת היחידה E1 α, בשיירים serine232, 293 serine ו-serine300. הזרחון של שיירים אלה מקוטלז על ידי ארבעת האיזופורמים של PDH kinases הידועים כ-PDK1-4. דפוספורילציה כדי לשחזר את פעילות PDH, מקוטלזת על ידי שני האנזימים PDH phosphatases המכונים PDP1 ו-PDP2. הקינאזות כמו גם הפוספטאזות באים לביטוי דיפרנציאלי ברקמות, והשעתוק שלהם מבוקר על ידי מגוון של אירועי עקה תאיים, כגון רעב, רמת חמצן נמוכה או ריכוז גבוה של NADH, אצטיל-CoA או סידן (תמונה למטה)
האנזים pyruvate dehydrogenase מעוכב כאשר אחד או יותר מהיחסים הבאים גדל: acetyl-CoA/CoA, NADH/NAD+ , ATP/ADP. באאוקריוטים PDC מבוקר באופן הדוק על ידי ה-pyruvate dehydrogenase kinase או PDK הספציפי שלו ועל ידי ה-pyruvate dehydrogenase phosphatase או PDP, המדכאים או משפעלים אותו, בהתאמה. ה-PDK מזרחן שלושה שיירי serine ספציפיים על E1 עם זיקות זרחון שונות. זרחון של כל אחד משיירים אלה הופך את E1 (ובעקבותיו את כל הקומפלקס) לבלתי פעיל. לעומת זאת, דפוספורילציה של E1 על ידי PDP משחזרת את פעילות הקומפלקס. תוצרים של הריאקציה פועלים כמעכבים אלוסטריים של PDC, שכן הם משפעלים את PDK. לעומת זאת, מצעים של הריאקציה מעכבים את PDK, וכך הם משפעלים מחדש את PDC.
בשעת צום, PDK גדל בכמותו ברוב הרקמות, כולל שריר השלד, על ידי הגברה של שעתוק גני. תחת אותם תנאים, כמות PDP ברקמות פוחתת. העיכוב הנובע מכך של PDC מונע מהשריר ומרקמות אחרות לפרק גלוקוזה וקודמנים של גלוקונאוגנזה. במצב זה מטבוליזם מופנה לכיוון של ניצול שומנים, בה בשעה שיש מזעור של פירוק חלבוני שריר השלד לספק קודמנים לגלוקונאוגנזה, ואילן הגלוקוזה הזמין נשמר לצריכה על ידי המוח. לסידן יש תפקיד ברגולציה של PDC ברקמת השריר, כיוון שהוא משפעל PDP, ומעודד גליקוליזה בהשתחררו לציטוזול בשעת התכווצות השריר.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק