מלנומה - מיפוי שומות - טכנולוגיה חדישה לגילוי מוקדם - Melanoma - mole mapping - modern technology for early detection
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מיפוי שומות: טכנולוגיה חדישה לגילוי מוקדם של מלנומה | ||
|---|---|---|
| ' | ||

| ||
| ICD-10 | Chapter C 43. | |
| ICD-9 | 172.9 | |
| MeSH | D008545 | |
| יוצר הערך | ד"ר ניר נתנזון | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מלנומה
מלנומה ממאירה של העור (Cutaneous malignant melanoma) היא הסרטן השלישי בשכיחותו מבין סרטני העור (לאחר קרצינומת תאי הבסיס וקרצינומת תאי הקשקש) אולם הקטלני משלושתם. לפי נתונים עדכניים של American-n Cancer Society, סיכויי ההחלמה ממלנומה ממאירה בשלב השטחי (in situ) הם 100%, בעוד שסיכויי ההישרדות ל־5 שנים ממלנומה בשלב הגרורתי (שלב 4) הם 20% בלבד.
לפי נתוני משרד הבריאות[1], בשנת 2015 אובחנו בישראל 1,674 חולים חדשים עם מלנומה של העור (רובם המכריע יהודים. מלנומה נדירה מאוד בקרב האוכלוסייה הלא יהודית): 1,115 (2/3 מהחולים) עם גידול חודרני ו-559 (1/3 מהחולים) עם גידול ממוקד (in situ).
שיעורי תחלואה המתוקננים לגיל במלנומה חודרנית בילידי ישראל גבוהים מילידי אסיה וילידי אפריקה, וקרובים (סדר גודל) לשיעורים בילידי אירופה/ אמריקה.
הסיכמ המצטבר ללקות במלנומה במהלך החיים לגברים יהודים ילידי ישראל הוא 2.8%. לנשים יהודיות הסיכון המצטבר הוא 1.8%.
המגמות העתיות של מלנומה חודרנית של העור ביהודים בישראל בשנים 1980–2015 מצביעות על עלייה מובהקת בגברים (אחוז שינוי שנתי = 5.4% + בשנים 1980–1993; אחוז שינוי שנתי = 0.9% + בשנים 1993–2015). בנשים נצפתה עלייה מובהקת בשנים 1980–1993 (שיעור שינוי שנתי = +4.1%), ולאחר מכן, בשנים 1993–2015, המגמה התייצבה. המגמות העתיות של מלנומה ממוקדת של העור ביהודים בישראל בשנים 1980–2015 מצביעות על עלייה מובהקת בגברים בשיעור שנתי של 16.4% בין 1980 ל-1998 ובשיעור שנתי של 1.8% בין 1998 ל-2015. גם בנשים נצפתה עלייה מובהקת לכל אורך התקופה, בשיעור שנתי של 14.1% בין 1980 ל-1998, ובשיעור שנתי של 2.3% בין 1998 ל-2015. מגמה זו מצביעה על מודעות לסיכון למחלה ועל עלייה בשיעור הגילוי המוקדם שלה.
גורמי הסיכון למלנומה
- טבלה 1. גורמי הסיכון למלנומה
| גורם סיכון | סיכון יחסי - Relative Risk or Odds Ratio |
|---|---|
| גורמים גנטיים | |
| היסטוריה משפחתית של מלנומה |
|
| פנמים בתיקון DNA (Xeroderma pigmentosum) | 20% מהחולים מפתחים מלנומה |
| גורמים סביבתיים | |
| חשיפה לסירוגין לשמש | 2.5 |
| מנורים בסמוך לקו המשווה | |
| שימוש במיטות שיזוף | 2-6 |
| דיכוי חיסוני | |
| ביטוי פנוטיפי של גנטיקה וסביבה | |
| ריבוי שומות נרכשות (מעל 50 שומות) | 8-10 |
| שומות אטיפיות- יותר מ-5 שומות אטיפיות | 4-6 |
| שומות אטיפיות - יותר מ-10 שומות אטיפיות | 32 |
| ריבוי נמשי שמש - solar lentigines | 3-4 |
| היסטוריה אישית של מלנומה | 11% יפתחו מלנומה תוך 5 שנים |
| ריבוי נמשים - freckles | 2 |
| היסטוריה של סרטן עור שאינו מלנומה | 4.3 |
| שיער אדמוני (בהשוואה לשיער כהה) | 3.6 |
| שיער בלונדני (בהשוואה לשיער כהה) | 2 |
| עיניים בהירות בהשוואה לכהות | 2 |
| עור בהיר (סוג I מול IV) | 2 |
| עור צרוב שמש | 2 |
גורם הסיכון החשוב ביותר למלנומה הוא ריבוי שומות ("נקודות חן"): במחקרים רבים מכל העולם הוכח, כי קיים מתאם בין מספר השומות ה"רגילות" לסיכוי לפתח מלנומה. הסיכון קיים החל מקיומן של 20 שומות ומעלה.
מחקר מאוסטרליה[2], למשל, מצא כי לצעירים בגיל 15–19 להם מעל 100 שומות סיכון של פי 46.5 לפתח מלנומה בהשוואה לצעירים עם שומות מעטות. מטא־אנליזה משנת 2005[3] הדגימה סיכון יחסי של 6.89 למלנומה אצל אנשים בעלי למעלה מ-101 שומות "רגילות" ומעלה וסיכון יחסי של 10.49 אצל אנשים בעלי 5 שומות אטיפיות (מוזרות למראה) ומעלה. מחקרים אחרים מדברים על סיכון ממוצע של פי 10 אצל אנשים בעלי שומות מרובות.
מחקר שנעשה בישראל בשנת 1989[4] בדק את השכיחות של ריבוי שומות (מעל 20 שומות שקוטרן מעל 2 מ"מ) באוכלוסייה המתגייסים לצה"ל. נמצא כי בכלל האוכלוסייה שנבדקה, ל-3.8% היו שומות מרובות, אולם בקרב צעירים ממוצא אירופאי- אמריקאי השכיחות הייתה 8%, כאשר ל-4.5% היו שומות אטיפיות ול-25% היו נמשים. גורמי סיכון נוספים[5] הם היסטוריה אישית או משפחתית של מלנומה, היסטוריה אישית של סרטן עור שאינו מלנומה, גוון שיער בהיר או אדום (סיכון יחסי של פי 3.64), עור בהיר הנוטה להיכוות בקלות (סיכון יחסי של פי 2), עיניים בהירות, ריבוי נמשים ומצב של דיכוי חיסוני. כמו כן אנשים בעלי שומה מולדת ענקית (Giant congenital nevus, שומה שקוטרה מעל 20 ס"מ) הם בעלי סיכון מוגבר לפתח מלנומה. חשיפה לשמש מעלה את הסיכון היחסי, כאשר חשיפה לסירוגין (אינטרמיטנטית- כגון חשיפה לשמש בעיתות פנאי) היא הבעייתית ביותר. כמו כן חשובה היסטוריה של כוויות שמש בילדות.
חשיבות השינוי בשומות כסמן למלנומה
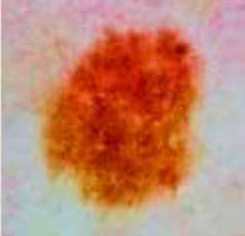
שומה מלנוציטית (Melanocyte nevus) היא גימל שפיר של מלנוציטים, התאים יוצרי הפיגמנט מלנין בעור. מלנומה היא סרטן, כלומר: ריבוי בלתי מבוקר של תאים. לפיכך, שומה ההופכת למלנומה תשתנה: יופיעו שינוי בגודל (ב-3 הממדים), באחידות הגבולות, בגוונים, במרקם, או שיופיעו תסמינים פיזיים כגון גרד או דימום עצמוני (לרוב בשלב מאוחר יחסית של המלנומה).
שינוי לא פחות חשוב הוא הופעה של נגע חדש על פני העור: אצל נבדקים מרובי שומות, רק 1/3 מהמלנומות מופיעות על שומה קיימת ו-2/3 מופיעות בנגע חדש על עור "בריא". רוב המלנומות, המתגלות על ידי גורם לא רפואי, מתגלות לאחר שהפונה ראו בן משפחה שם לב לשינוי בשומות או להופעת נגע חדש[6].
שיטת הבדיקה השכיחה וחסרונותיה
המעקב אחר אנשים מרובי שומות (או בעלי גורמי סיכון אחרים למלנומה) מתבצע לרוב על ידי רופאי עור וכירורגים פלסטיים. לרוב, הבדיקה מתבצעת על ידי סקירה בעין בלבד, כאשר שומות הנראות לעין הבודק "חשודות" או "מוזרות" לפי קריטריוני ה-ABCD ,(Asymmetry, Border irregularity Color variation, Diameter >5mm), נשלחות לביופסיה.
החיסרון הבולט של השיטה הוא חוסר הדיוק שלה: מס׳ רב של מחקרים הדגים, כי רופא העור הטוב ביותר אינו מזהה 40% מהמלנומות המוקדמות בבדיקה זו, ולהפך - חושד בשומות רגילות כי הן מלנומה. אחת הסיבות היא העובדה, כי בעולם כולו מתגלות יותר ויותר מלנומות קטנות (בקוטר פחות מ-5 מ"מ) ששיעורן במרכזים מסוימים הוא עד שליש מכלל המלנומות שמתגלות.
שיעור גדל והולך של רופאי העור משתמש בדרמוסקופ לאבחון שומות. השימוש בדרמוסקופ מעלה את הדיוק האבחנתי של השומה הבודדת לכדי 90%, אולם השימוש דורש מיומנות והתמדה בבדיקת כל השומות על פני הגוף. הוכח[7] כי בבדיקה דרמוסקופית סלקטיבית של שומות לא נבדקות כ-40% מהשומות החשודות. כתוצאה מכך מבוצעות ביופסיות מיותרות מרובות (נתונים לא רשמיים מישראל מצביעים כי 1/3 מרופאי העור מבצעים יותר מ־50 ביופסיות על מנת לגלות מלנומה אחת), בעוד שקיים איחור באבחנה של מלנומות לא חודרניות. נתונים ממדינות אחרות מציינים יחס של 30 עד 100 כריתות של נגעים שפירים לכל מלנומה (Benign/Malignant excised ratio).
מלבד העלות הגבוהה של הביופסיות המיותרות למערכת הבריאות הציבורית והפרטית קיים גם הפן האסתטי - נבדקים מרובי שומות הופכים לנבדקים מרובי צלקות.
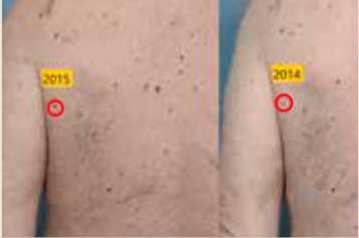
לאור האמור לעיל, נוסף "E" לקריטריוני ה-Evolution :ABCD (שינוי), והודגשה חשיבותו. עם זאת, בשיטת הבדיקה המקובלת במערכת הבריאות הציבורית אין יכולת לעקוב אחר שינויים באופן אובייקטיבי, ואבחנת השינוי תלויה בזיכרון של המטופל.
לפיכך, כל ביקור אצל רופא העור הוא "ביקור ראשון".
מיפוי שומות ממוחשב - Digital Mole Mapping
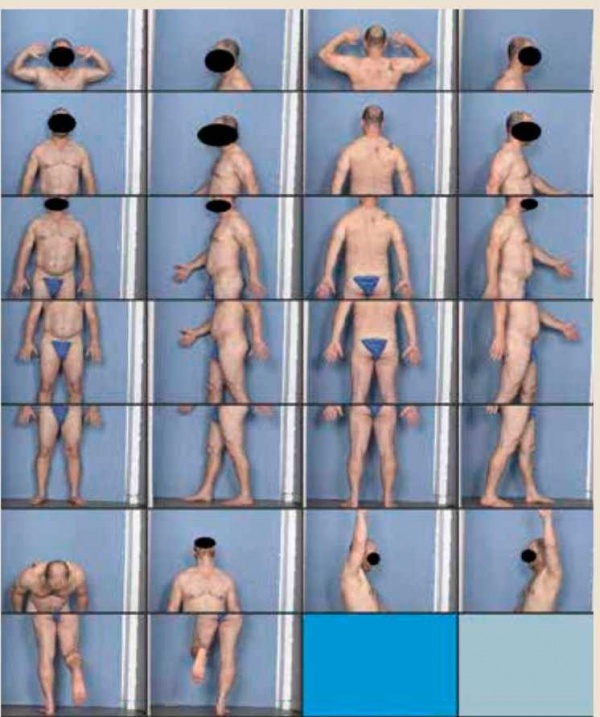
מיפוי שומות ממוחשב היא שיטת אבחנה לא פולשנית, המשלבת בין דרמוסקופיה של כל השומות על פני הגוף, צילום של הגוף כולו מכל עבריו באיכות גבוהה, צילום דרמוסקופי של שומות נבחרות, והשוואה לאורך זמן של התמונות.
בעזרת שיטת בדיקה זו, כל נגע על פני העור נבחן:
- מבחינה מורפולוגית (מראה הנגע דרך הדרמוסקופ) - איך השומה נראית
- מבחינה ביולוגית (קיום שינוי דרמוסקופי או מקרוסקופי} - איך השומה "מתנהגת" לאורך זמן
השיטה נמצאת בשימוש רב בעולם במיוחד במרכזים אקדמיים העוסקים בסרטן העור.
במאמר מ-New York University[8] בו עקבו החוקרים במשך ממוצע של 10 שנים אחר 258 נבדקים בעלי סיכון גבוה למלנומה (אך ללא היסטוריה אישית של מלנומה), נמצאו 38 מלנומות: 17 שטחיות (in situ) וכל השאר בעומק של פחות מ-1 מ"מ (המנבא סיכויי הישרדות גבוהים), ואף לא אחת מהן הייתה גרורתית. גם מחקרים נוספים הדגימו תועלת רבה בשיטת מעקב זו - הן בהיבט של גילוי מלנומה בשלב מוקדם יותר והן בהפחתה משמעותית של מספר הביופסיות המיותרות[9][10][11][12][13][14][15]
במאמר של Saierni et al[10] שסיכם 8 שנות שימוש בשיטה זו בברצלונה, נמצא ששיעור המלנומות שהתגלה בבדיקה זו היה גבוה פי 1,500 בהשוואה לשיעור הצפוי באוכלוסייה הכללית, ושיעור הביופסיות שבוצעו על מנת לאתר מלנומה אחת היה 10:1.
שיטת הבדיקה
מדובר בבדיקת מעקב שנתית, הכוללת שלושה שלבים:
- בדיקה דרמוסקופית של כל השומות על ידי רופא עור המיומן בדרמוסקופיה, וצילום דיגיטלי קליני ודרמוסקופי של שומות בעלות מאפיינים "חשודים" (שאינן מדגימות עדיין קריטריונים מספקים לאבחנתן כמלנומה)
- צילום כל גופי - ביצוע סדרה של צילומים איכותיים והדירים של גוף הנבדק מכיוונים שונים
- החל מהשנה השנייה ואילך - השוואה בין הצילומים לאורך השנים (צילומים קליניים ודרמוסקופים)
משך הבדיקה על ידי צוות מיומן של רופא + צלם רפואי הוא כ-30 דקות. בסיום הבדיקה הנבדק מקבל לידיו הסבר על ממצאי הבדיקה וכן התקן זיכרון הבזק עם התמונות, שיכול לשמש לבדיקה עצמית אחת למספר חודשים (ויכול לשמש גם את הרופא המפנה).
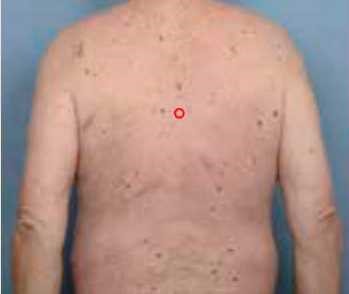
אם בבדיקה נמצאו שומות החשודות כמלנומה (הן בדרמוסקופיה והן בבדיקה השוואתית מקרוסקופית או דרמוסקופית) מקבל הנבדק מכתב לרופא המנתח וכן תמונה דיגיטלית, עליה מסומנת בבירור השומה החשודה.
בפגישות המעקב השנתיות חוזרים על התהליך הנ"ל (בדיקה גופנית ודרמוסקופית) ומתבצעת השוואה בין התמונות לאורך השנים במטרה לגלות בצורה אובייקטיבית שינויים בשומות או הופעה שומות חדשות.
יתרונות השיטה
עלייה ברגישות (sensitivity) ובסגוליות (specificity) הגילוי המוקדם של מלנומה: מצד אחד הפחתה (עד כדי 90%) במספר הביופסיות המיותרות, ומצד שני עליה בשיעור המלבומות המתגלות מוקדם.
Evidence Based Medicine במובנה המילולי- תיעוד אובייקטיבי של מצב הנבדק לאורך זמן- על ידי שלוב של בדיקה סובייקטיבית (דרמוסקופיה) ואובייקטיבית (צילום).
מאחר שכל המידע דיגיטלי, ניתן להשתמש בישומי טלה-רפואה ולהתייעץ עם רופאים מהארץ ומחו"ל.
תהליך העבודה
ביבליוגרפיה
- ↑ משרד הבריאות - רישום הסרטן הלאומי. מלנומה של העור: עדכון נתוני תחלואה ותמותה, יוני 2018
- ↑ Youl P, Aitken J, Hayward N, Hogg D, Liu L, Lassam N, et al. Melanoma in ado¬lescents: a case-control study of risk factors in Queensland, Australia. Int J Cancer. 2002:98(11:92-8.
- ↑ Gandini S, Sera F, Cattaruzza MS, Pasquini P, Abeni D, Boyle P, et al. Meta-analysis of risk factors for cutaneous melanoma: I. Common and atypical naevi. Eur J Cancer. 2005;41(1):28-44.
- ↑ Pavlotsky F, Azizi E, Gurvich R, Lusky A, Barell V, Weiner M, et al. Prevalence of mela-nocytic nevi and freckles in young Israeli males. Correlation with melanoma incidence in Jewish migrants: demographic and host factors. Am J Epidemiol. 1997:146(1 ):78-86.
- ↑ Gandini S, Sera F, Cattaruzza MS, Pasquini P, Zanetti R, Masini C, et al. Meta-analysis of risk factors for cutaneous melanoma: III. Family history, actinic damage and pheno-typic factors. Eur J Cancer. 2005;41(14):2040-59.
- ↑ Tromme I, Sacre L, Hammouch F, Richez P, Degryse JM, Speybroeck N. Melanoma di¬agnosis: predictive value of macroscopic changes observed by the patient. Melanoma Res. 2018.
- ↑ Seidenari S, LongoC, Giusti F, Pellacani G. Clinical selection of melanocytic lesions for dermoscopy decreases the identification of suspicious lesions in comparison with dermoscopy without clinical preselection. The British journal of dermatology. 2006:154(5):873-9.
- ↑ Wang SQ, Kopf AW, Koenig K, Polsky D, Nudel K, Bart RS. Detection of melanomas in patients followed up with total cutaneous examinations, total cutaneous photogra¬phy, and dermoscopy. J Am Acad Dermatol. 2004;50(1):15-20.
- ↑ Puig S, Malvehy J. Monitoring patients with multiple nevi. Dermatol Clin. 2013:31(41:565-77, viii.
- ↑ 10.0 10.1 Salerni G, Carrera C, Lovatto L, Puig-Butille JA, Badenas C, Plana E, et al. Benefits of total body photography and digital dermatoscopy ("two-step method of digital follow-up") in the early diagnosis of melanoma in patients at high risk for melanoma. Journal of the American Academy of Dermatology. 2012:67(1 ):e17-27.
- ↑ Malvehy J, Puig S. Follow-up of melanocytic skin lesions with digital total-body photography and digital dermoscopy: a two-step method. Clinics in dermatology. 2002:20(31:297-304.
- ↑ Salerni G, TeranT, Alonso C, Fernandez-Bussy R.The role of dermoscopy and digital dermoscopy follow-up in the clinical diagnosis of melanoma: clinical and dermoscopic features of 99 consecutive primary melanomas. Dermatol Pract Concept. 2014:4(41:39-46.
- ↑ Argenziano G, Moscarella E, Annetta A, Battarra VC, Brunetti B, Buligan C, et al. Melanoma detection in Italian pigmented lesion clinics. G Ital Dermatol Venereol. .6־161:(2)149;2014
- ↑ Berk-KraussJ, Polsky D, Stein JA. Mole Mapping for Management of Pigmented Skin Lesions. Dermatol Clin. 2017:35(41:439-45.
- ↑ Thomas L, Puig S. Dermoscopy, Digital Dermoscopy and Other Diagnostic Tools in the Early Detection of Melanoma and Follow-up of High-risk Skin Cancer Patients. Acta Derm Venereol. 2017.
המידע שבדף זה נכתב על ידי ד"ר ניר נתנזון, מומחה לרפואת עור ומין, המרכז למיפוי שומות, תל אביב
פורסם ב-חוברת סל הבריאות עמ' 18


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק