מחלות ניוון שרירים שדרתי - Spinal muscular atrophies
| מחלות ניוון שרירים ספינאליות | ||
|---|---|---|
| Spinal muscular atrophies | ||
| ||
| ICD-10 | Chapter G 12. | |
| MeSH | D009134 | |
| יוצר הערך | ד"ר מירה גינזברג, ד"ר דורית לב
|
|
הקדמה
מחלות ניוון שרירים שדרתי (SMAies, Spinal Muscular Atrophies) היא קבוצה מגוונת של מחלות שריר גנטיות, שלהן בסיס פתופיזילוגי משותף, שהוא ניוון מתקדם, בלתי הפיך של גרעיני תאי עצב האלפאה (Alpha, α) המוטורי בחוט השדרה ולעיתים גם בגזע המוח Anterior Motor Neuron :(AMN), אשר בהמשך גורם לפגיעה הדרגתית וקבועה בשרירי השלד, לרוב ללא מעורבות שכלית. בעידן הנוכחי, האבחנה מתבססת על אבחון גנטי. בעבר, בהעדר אבחון גנטי, האבחנה התבססה על שילוב של תסמינים קליניים, מבחנים אלקטרופיזיולוגיים וביופסיה שריר.
אופי התורשה והמאפיינים הקליניים של המחלות הם מגוונים:
Spinal Muscular Atrophy - SMA
זו הצורה השכיחה ביותר. מועברת בתורשה אוטוזומלית נסגנית ((Autosomal recessive כלומר, נדרשת תרומה של שני ההורים. נגרמת כתוצאה ממוטצית חסר (Deletion) בגן (SMN1) Survival Motor Neuron, מתאפיינת בחולשה וניוון מתמשך של שרירי השלד והנשימה. טווח הופעתה והסתמנות הקלינית שלה מגוונים, החל מהחיים העובריים ועד לבגרות המאוחרת. חולשת השרירים היא סימטרית ומתקדמת מהשרירים הקירבניים Proximal Muscles (PM) לכיוון השרירים הרחיקניים Distal Muscles (DM), כלומר, השרירים הקרובים לעמוד השדרה כמו שרירי האגן וחוגרת הכתפיים נפגעים ראשונים ורק בהמשך מתקדמת לשרירים של קצות הגפיים, כולל מעורבות של שרירי הנשימה, שרירי הבליעה ושרירי הלעיסה.
SMARD1 - Spinal Muscular Atrophy Respiratory Distress Type I
מועברת בתורשה אוטוזומלית נסגנית, הנגרמת כתוצאה ממוטציה בגן IGHMBP2 (2 immunoglobulin μ-binding) בכרומוזום 11(q1311).
מאופיינת בשיתוק שריר הסרעפת, בניגוד ל- SMA Type I שבה המעורבות הנשמתית ההתחלתית היא של השרירים הבין צלעתיים.
מתבטאת במצוקה נשימתית חריפה, חולשת ודלדול שרירים רחיקנייים וזאת בניגוד ל-SMA Type I שבה מעורבות הראשונית הינה של השרירים הקרבניים.
בנוסף, הפרעה מעורבת גם פגיעה עצבית תחושתית ואוטונומית וקיבועים של המפרקים כבר בשלב מוקדם. מופיעה בילדות המוקדמת וגורמת לתמותה תוך מספר חודשים[1][2].
Autosomal Dominant SMA - AD SMA
מועברת בתiרשה אוטוזומלית שולטנית (Autosomal dominant)[3]. מאז העידן הגנטי נחשבת כחלק מקבוצת מחלות Autosomal Dominant TRPV4 Disorders. מתאפיינת בחולשת שרירים רחקניים, המופיעה כבר בלידה ואיננה מתדרדרת. נוירופטיה מתקדמת מופיעה בשלב מאוחר יותר בחיים לעיתים מלווה בהפרעה במיתרי הקול והפרעה נשימתית עם מעורבות של המפרקים ולעיתים עם הפרעות בעצמות השלד. שמאז העידן המולקולרי, נתגלו גנים נוספים כמו: BICD2[4] עם תסמינים דומים, כולל תמונה דמוית SMA עם אובדן של נוירונים מסוג אלפה בקרן הקדמית של עמוד השדרה.
X- linked SMA - XL-SMA
תורשה בתאחיזה לכרומוזום ה-X (X- linked), המועברת מאימהות נשאיות לבניהן. הצורה הקלינית זהה לצורה הטרום לידתית החמורה של SMA הקלסי, כולל מעוט תנועות עובר, חולשת שרירים חמורה כבר בלידה מלווה בקיבועים רחיקניים של המפרקים. נגרמת כתוצאה ממוטציה בגן.UBA1 וכן, נמצא קשר ל-p11.3-q11.1[5].
SBMA - Kennedy's disease (spinal and bulbar muscular atrophy)
מופיעה בגברים בלבד, רק בעשור השלישי-רביעי לחיים. נגרמת כתוצאה מהרחבה של מספר חזרות בפוליגלוטאמט (polyQ) בגן המקוד לרצפטור להורמון אנדרוגן (Androgen). גורמת לתסמינים נוירוגניים ומיוגניים: כלומר שם פגיעה עצית וגם פגיעה שרירית עם ניוון של הגרעינים המוטוריים הקדמיים בחוט השדרה ובגזע המוח. כוללת גם מעורבות של שרירי הפנים בנוסף לשרירי השלד, עליית CK, והפרעה אנדוקרינית של אי סבילות לטסטוסטרון כמו ניוון אשכים, אי פוריות והתפתחות רקמת שד[6].
Spinal Muscular Atrophy with Progressive Myoclonic Epilepsy (SMA+PME)
מתחילה בגיל הילדות (15 חודשים עד 17 שנים) ומתבטאת בחולשת שרירים מתקדמת, מהשרירים הקרבניים לרחיקנים, בשילוב פרכוסים מיוקוניים ואטוניים, בלתי נשלטים, רעד והפרעת שמיעה עצבית. לרב ללא מעורבות שכלית. תוחלת החיים קצרה. נגרמת כתוצאה ממוטציה בגן SAH1 המקודד לחלבון-acid ceremidase[7].
SMA + Pontocerebellar hypoplasia
PCH (Ponto Cerebellar hypoplasia) קבוצת מחלות גנטיות, ניווניות נדירות אשר כרוכות בנוון של המוחון וגזע המוח.
אותרו מספר גנים בקבוצת מחלות זו.
PCH1A[8] בנוסף למעורבות המוחית קיימת גם מעורבות של הגרעינים המוטוריים הקדמיים בחוט השידרה. הנגרמת כתוצאה מוטציה בגן VRK1(vaccinia-related kinase 1 gene) השכיח באוכלוסייה האשכנזית[9].
קיימות מחלה נדירות נוספות שלחלקן עדיין לא נמצא הבסיס הגנטי.
ניוון שרירים שידרתי - SMA
הפרק הנוכחי יעסוק באופן מפורט יותר בצורה השכיחה ביותר של ניוון שרירים שידרתי: SMA
המחלה בצורתה החמורה, SMA type I, תוארה לראשונה בשנת 1891 על ידי Guido Werding מהמחלקה לאנטומיה ופיזיולוגיה של אוניברסיטת וינה: "שני מקרים של מחלה תורשתית המופיעים בילדות המוקדמת של ניוון שרירי מתקדם המופיעה כדלדול (Dystrophy) אבל הבסיס הוא עצבי. מאוחר יותר ניתן לה שמה ע"י פרופסור Johonatan Hoffmann.
אפידמיולוגיה
המחלה האוטזומלית הנסיגתית השנייה בשכיחותה: 1 ל-6,000-10,000 לידות. שכיחות הנשאות היא כ-1:35[10]. המחלה המונוגנטית, כלומר נגרמת כתוצאה משיוני בגן בודד, השכיחה ביותר הגורמת לתמותת תינוקות. שכיחות המחלה בישראל בירידה בשל סקר טרום לידתי הקיים החל משנת 2007.
אטיולוגיה
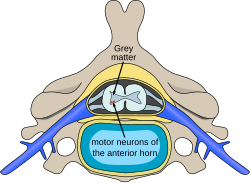
תאי העצב המוטוריים הנמצאים בקרן הקדמית של חוט השדרה, הם תאי מפתח לשליטה בתנועתיות הגוף. אובדן של תאים מוטוריים אלו גורם למגוון של מחלות ניווניות, כמו: טרשת אמיוטרופית צידית (ALS, Amyotrophic Lateral Sclerosis), מחלת קנדי הנקראת גם ניוון שרירים ספינו-בולברי מקושר-X ( Kennedy's disease/X linked spinal and bulbar muscular atrophy) וניוון שרירים שדרתי.
הבנת התהליכים הפתופיזיולוגיים (Pathophysiology) של מחלת ניוון שרירים שדרתי פתחה צוהר לאפשרויות חדשות לריפוי גנטי. מדובר בקבוצה של מחלות בעלות רקע גנטי מגוון שגורמות בסופו של תהליך לניוון של תא העצב המוטורי בקרן הקדמית של חוט השדרה. התהליך הפתופיזיולוגי בקבוצת מחלות ניוון שרירים שדרתי הוא ניוון מתקדם של תא העצב האלפא (Alpha, α) מוטורי בחוט השדרה בשל מוות מואץ של הגרעינים המוטוריים. התהליך הניווני מערב את חוט השדרה לכל אורכו, ללא מעורבות של הגרעינים המוטוריים של עצבי הפנים, פרט לגרעין עצב תת לשוני (Hypoglossal nerve), המעצבב את הלשון. התהליך הניווני אינו גורם לפגיעה מוחית, ולכן הקוגניציה (Cognition) שמורה לחלוטין. מדובר בתהליך עצבי והפגיעה בשרירים היא משנית (לפחות זו הייתה ההנחה עד לאחרונה). מדובר במעורבות של השרירים הרצוניים, פרט לשרירי הפנים, שרירי הנשימה, ללא מעורבות של שריר הלב או מעורבות של השרירים הלא רצוניים.
בדגימת רקמה (Biopsy) של שריר בחולי ניוון שרירים שדרתי ניתן לראות ירידה במספר התאים המוטוריים, ואלו הנותרים קטנים בקוטרם. כמו כן, קיימת ירידה במספר שורשי העצבים, ואלה שנותרו קטנים בגודלם. בחתך פתולוגי בשריר נראים סיבי שריר (Myofibrils) קטנים המסודרים בקבוצות וסיבי שריר בגדילת יתר (Hypertrophic) (תמונה 1).
- הבסיס המולקולרי של ניוון שרירים שדרתי - הגן SMN (Survival Motor Neuron) ותהליכי שעתוק
שלוש הצורות הראשונות של המחלה מופו בעזרת מבחני תאחיזה לכרומוזום 5q13 (8). בשנת 1995 זוהה הגן SMN1 על ידי פרופסור מלקי כגן האחראי למחלה (10,9,8). בגנום האנושי קיימות שתי צורות תואמות (Homologous) של הגן SMN1 :SMN ו-SMN2 הממוקמים במרחק 500 קילו-זוגות-בסיסים (kb, Kilo base) זה מזה באזור 5q13. שני העותקים זהים פרט לשינוי בחמישה זוגות בסיסים הגורם להבדל בפעילות, ולכן הגן התואם, SMN2, פעיל חלקית ואיננו יכול להיות תחליף מלא לגן הטלומרי (Telomeric) SMN1 (תמונה 2). הגן SMN2 מייצר רק 10% של חלבון באורכו המלא - SMN-fl, ואילו תוצר 90% הנותרים הוא חלבון שעבר שחבור חליפי (Alternative splicing) ואינו מכיל את אקסון 7 (SMN2D7). לכן, הוא איננו מתפקד באופן מלא בדומה לתוצר החלבוני של SMN1 (11). נמצא קשר בין מספר העותקים של הגן SMN2 לבין חומרת המחלה. מאחר שכל עותק של SMN2 מייצר 10% מהחלבון הפעיל, עלייה במספר עותקי SMN2 משפיעה על חומרת המחלה במתאם הפוך. מספר רב יותר של SMN2 קשור במופע מחלה פחות חמור.
קיימים כנראה גורמים נוספים פרט לגן עצמו, המשפיעים על חומרת המחלה - גנים מסגלים (Modifier genes). וכהוכחה, תוארו זוגות אחים החולים ב-SMA עם מספר זהה של עותקי SMN2, אך חומרת מחלה שונה. נוכחות של תשניות (Mutations) בגן פלסטין Plastin) 3) דווקא בנקבות, הוצע כאחד המנגנונים האפשריים לוויסות של חומרת המחלה. ייתכן שלגן זה, הנמצא על כרומוזום X, השפעה מגנה בנקבות (13).
קליניקה
מחלת ה-SMA מתאפיינת בחולשת שרירים פזורה ותואמת (Symmetric), מלווה בניוון של השרירים, המתקדמת, למרות המקור העצבי, מהשרירים הקריבניים אל השרירים הרחיקניים (Distal) (בדומה למחלות שריר - Myopathies), בנוכחות ירידה במספר היחידות המוטוריות ברשמת שרירים חשמלית (EMG, Electromyography).
הגורם המשפיע ביותר על חומרת הצורה הקלינית (Phenotype) הוא מספר עותקי SMN2 שבדרך כלל משתנים מעותק 1 עד 4 עותקים, ובמקרים נדירים עד 8 עותקים. חולים הנושאים 8 עותקים של SMN2 מוגנים לחלוטין מהמחלה. ממצאים דומים נמצאו בעכברי SMA טרנסגניים (Transgenic) (12). המַאֲגָד (Consortium) הבינלאומי של SMA הגדיר 4 קבוצות קליניות בהתאם לגיל תחילת המחלה וההישגים המוטוריים (4,3):
- SMA סוג I - או בשמה ההיסטורי מחלת וורדינג-הופמן (Werding-Hoffmann disease) (253300B#MIM). מחלה זאת היא הצורה החמורה ביותר, הכוללת רפיון (Hypotonia) וחולשת שרירים כללית, המתחילה בששת חודשי החיים הראשונים. החולים לא מגיעים אף פעם לישיבה ולהליכה. רוב החולים נושאים 2 עותקים של SMN2 (12)
- SMA סוג II - צורת הביניים (253550#MIM). התסמינים הראשונים מופיעים לאחר גיל 6 חודשים. החולים מגיעים לישיבה, אבל אינם מגיעים להליכה עצמאית. החולים בסוג זה נושאים 3 עותקים של SMN2 (12)
- SMA סוג III - המכונה גם מחלת קוגלברג-וולנדר (Kugelberg–Welander disease), הצורה הצעירה (253400#MIM). החולים מסוגלים לשבת וללכת. כאשר המחלה מתחילה לפני גיל 3 שנים היא מסווגת כ-IIIa, בעוד מחלה המתחילה אחרי גיל 3 שנים, מסווגת כ-IIIb. קיים הבדל משמעותי בין שתי תת-הקבוצות באשר ליכולת הניידות. בתת-הקבוצה הראשונה רק 44% מהחולים עדיין מסוגלים ללכת בגיל 20 ואילו 90% מהחולים המשתייכים לתת-הקבוצה השנייה עדיין ניידים בגיל זה (4). חולי SMA סוג IIIa נושאים 3 עותקים של SMN2. חולי SMA סוג IIIb נושאים 4 עותקי SMN2
- SMA סוג IV - הצורה המבוגרת (MIM#271150). גיל התחלת המחלה מעל 30 שנה. התסמינים הם קלים, ותוחלת החיים רגילה (6). חולי SMA סוג IV נושאים 4-6 עותקי SMN2 (12)
- קיימת קבוצה נוספת שלא נכללה בחלוקה זו והיא סוג 0. בתת-קבוצה זו המחלה מופיעה כבר בלידה עם חולשת שרירים קיצונית, קשיי נשימה וארתרוגריפוזיס (Arthrogryposis)
- צורות נדירות של מחלת תא העצב המוטורי
מדובר בצורות לא אופייניות הן מבחינה קלינית והן מבחינה גנטית הגורמות לתמונה דמויית SMA:
- SMA אוטוזומלי שולטני (AD-SMA, Autosomal Dominant Proximal SMA) - מחלה המתאפיינת בתמונה דמוית SMA המועברת בתורשה שולטנית. הסימנים הקליניים מופיעים בשנות העשרים לחיים, כאשר יש מעורבות לבבית ואף מוות פתאומי המופיעים שנים לאחר הופעת חולשת השרירים. ב-10% מהמקרים נמצאה תשנית בגן LMNA, עובדה המשייכת מחלה זו לקבוצת הלמינופתיות סוג I (Laminopathy Class I) (72)
- SMARD (SMA with respiratory distress) (11q13-q2) - מדובר במחלה מתקדמת המופיעה בינקות המוקדמת, שבה בולטת, בניגוד לצורה הקלאסית, מעורבות של הסרעפת (בצורה הקלאסית יש קודם מעורבות של שרירים בינצלעיים ורק בשלב מאוחר מאוד הסרעפת). הגן המעורב הוא Immunoglobulin Y-binding protein 2
- ארתרוגריפוזיס רחיקני מקושר ל-X (Distal X-linked arthrogryposis) - צורה מולדת מתקדמת עם עיוות מוקדם של המפרקים
עם זאת, נוכחותם של סימנים קליניים נוספים שאינם בהכרח חלק מהמחלה, כמו מעורבות של מערכת עצבים מרכזית, מעורבות מוחון או שריר, אינם שוללים את קיום המחלה. יש תיאורי מקרים שבהם קיימת מעורבות של העצב המוטורי העליון, מעורבות לבבית, מעורבות שריר-שלד, רמות גבוהות של קראטין קינאזה (CK, Creatine Kinase) מעורבות מקטעית (Segmental) בלבד ואף דגימה מרקמת שריר האופיינית יותר למחלת שריר מאשר לניוון קבוצתי (Group atrophy) בנוכחות חסר בגן SMN1 (82).
אבחנה
ברוב המקרים, כאשר התמונה הקלינית ברורה, ניתן להסתפק בביצוע בדיקת רשמת שריר חשמלית מצומצמת, מאחר שהדגמה של שינויים עצביים בנוכחות חולשת שרירים מספיקה כדי להתקדם לבדיקת חומצה דאוקסיריבונוקלאית [DNA (Deoxyribonucleic Acid) testing]. אולם, בדיקת רשמת שריר חשמלית המראה מאפיינים של מחלת שריר יכולה להסיט את המשך הבירור מבדיקת הגן ל-SMA, לכיוון ביצוע דגימת רקמת שריר. יש לזכור שבדיקת רשמת שיר חשמלית היא בדיקה מכאיבה ודורשת לעתים הרדמה כללית כאשר מדובר בתינוקות ובפעוטות. אי לכך, לעתים קרובות כאשר הקליניקה בהירה דייה, במיוחד בנוכחות פעוט ערני, ניתן לבצע כבר בשלב ראשוני בדיקה מולקולרית.
בכ-97% מחולי SMA נמצא חסר הומוזיגוטי של אקסון 7 בגן SMN1 ,5q13 (גנוטיפ 0/0). עם זאת, ב-5% מחולי SMA שאכן נגרמת כתוצאה מפגם בגן SMN, לא נמצא החסר האופייני באקסון 8-7 בגן SMN1 באמצעות בדיקת תגובת שרשרת של פולימראז (PCR, (Polymerase Chain Reaction). קרוב לוודאי, מדובר במצב הקרוי שונה-אללים מורכב (Compound heterozygote) - מצב שבו יש חסר מוחלט באלל אחד, ואילו באלל השני קיימת תשנית נקודתית שאיננה מאובחנת באמצעות בדיקת תגובת שרשרת של פולימראז (גנוטיפ 0/SMN1m) (11). במקרים אלו ניתן לצמצם את האפשרויות על ידי הערכה של מספר העתקי הגן SMN. אם מודגמת נוכחות של SMN1 רק על אלל בודד, ניתן לאשש את האבחנה באמצעות בדיקות רשמת שריר חשמלית ודגימה מרקמת שריר. בדיקת הולכה עצבית (NCV, Nerve Conduction Velocity) שתדגים הולכה עצבית תקינה ובדיקת רשמת שרירים חשמלית שתדגים משרעת (Amplitude) פוטנציאלי פעולה מורכבים (CMAP, Compound Muscle Action Potential) תקינה, בנוכחות של ממצאים עצביים כמו התפרקויות חשמליות עצמוניות (Fibrilations), משרעות גבוהות בעלות משך תקין ובשילוב דגימת שריר אופיינית (ניוון קבוצות סיבים) בנוכחות אלל בודד של SMN - מכוונים לאבחנת המחלה בסבירות גבוהה.
אבחנה של נשאות מתבצעת על ידי הערכת מספר עותקי SMN1. נוכחות עותק בודד מצביעה על נשאות, אך קיימת בעייתיות באיתור חלק מהנשאים ומתן ייעוץ גנטי, מפני שב-4% מהאוכלוסייה שני עותקים ויותר של הגן על אלל אחד, ואילו האלל השני איננו מכיל כלל את הגן, ממצא שלא ניתן לאבחון בבדיקת תגובת שרשרת של פולימראז. במצב זה עדיין יש אפשרות של העברת האלל חסר הגן לצאצאים (6). כמו כן, בכ-2% מהמקרים מתרחשת תשנית חדשה, או קיים פסיפס, זאת אומרת התשנית קיימת רק בתאי המין (Gonad cells). בעזרת טכנולוגיות גנטיות חדשות נעשה ניסיון להתגבר על מצבים אלו (7).
החל משנת 2007 קיימת בארץ בדיקת סקר גנטית לאיתור נשאים למחלת ה-SMA.
טיפול
הטיפול המקובל כיום הוא תמיכתי. בראש וראשונה נשימתי, וכן טיפול אורתופדי ותזונתי. איכות החיים של חולי SMA תלויה בגישה כוללנית רב מערכתית. ב-2007 התפרסמו הנחיות לגבי טיפול מקובל כוללני בחולי SMA (14).
הבנת המנגנונים הביולוגיים במחלת SMA פותחת אפשרויות טיפוליות באמצעות שינוי מנגנונים מולקולריים: שינוי מנגנוני השחבור, השעתוק והשפעה על תרגום SMN1 ו-SMN2. עד כה ננקטו גישות מולקולריות שונות:
- הגברת הביטוי של החלבון המִלְּגַוִּי (Endogenous) SMN-fl המיוצר על ידי SMN2, באמצעות הגברת שעתוק SMN2 על ידי שחזור השחבור התקין של SMN2 pre-mRNA, ייצוב SMN-fl והארכת SMN2D7 G
- הגברת ייצור SMN באמצעות השתלת תאי אב
- שיפור החיות של תאי העצב המוטורי באמצעות גורמים נוירוטרופיים (Neurotrophic factors), כמו קרדיוטרופין (Cardiotrophin), תכשירים מגני עצב (Neuroprotective) כמו Rilutek (Riluzol) ופעילות גופנית
כל אפשרות טיפולית שתגרום להארכת חייו של הגרעין המוטורי, בין שעל ידי מניעת המוות התאי המתוכנן, או על ידי תהליכים גנטיים שמתערבים במנגנונים התאיים ברמת החומצה הדאוקסיריבונוקלאית, החומצה הריבונוקלאית (RNA, Ribonucleic Acid) או התוצר החלבוני הסופי, עשויים להביא לידי ריפוי המחלה ובתחום זה מתרחש עיקר המחקר.
ניסויים קליניים עדכניים
בעולם מתקיימים מספר ניסויים קליניים עדכניים:
מעכבי דה-אצטילציה של היסטונים (Histone deacetylase inhibitors)
ביטוי הגנים נמצא בחלקו תחת בקרה של תהליכי אצטילציה ודה-אצטילציה של היסטונים. עיכוב תהליכי הדה-אצטילציה של ההיסטונים (HADC, Histone Deacetylases) גורם לחשיפת הכרומטין (Chromatin), והופך אותו זמין יותר לשעתוק. מעכבי דה-אצטילציה של היסטונים, הפועלים על קדם (SMN2 (Promotor, גורמים לעלייה בשעתוק SMN2 בתרבית תאים. בין החומרים שניתן לטפל בהם כיום בבני אדם:
- Sodium butyrate שהוא חומר הנמצא בשימוש במחלות חילוף חומרים (Metabolic diseases)
- Valproic acid שהיא תרופה נגד כפיון (Epilepsy) הנמצאת בשימוש נרחב. במספר מרכזים רפואיים ניתן טיפול ב-Valproic acid ו-Carnitine (לא במסגרת מחקרית)
כל התהליך נעשה תוך כדי מעקב אישי אחר השפעת התרופה על החולה המסויים (Specific). נמצא שתרופות אלו מעלות את ייצור ה-L-SMN mRNA ורמת החלבון בתאים שהופקו מחולי SMA. שתי תרופות אלו מאושרות על ידי מנהל המזון והתרופות (FDA, Food and Drug Administration) לשימוש בבני אדם.
- ניסוי קליני אקראי כפול-סמיות, בחולי SMA סוג II, הכולל טיפול משולב ארוך טווח ב-Valproic acid ו-Carnitine-L (תוסף המקובל בזמן טיפול ב-Valproic acid הגורמת לירידה בייצור ה-Carnitine) נמצא כעת בסיום שלב II. תוצאותיו עדיין לא הושלמו (21-15).
- ניסוי קליני אחר, אקראי כפול-סמיות, שנערך במשך 13 שבועות בקרב 107 חולי SMA סוג II, שבו ניתן Phenyl butyrate, לא הראה כל שיפור בתפקודם המוטורי של החולים כפי שהוערך באמצעות סולם מוטורי מסוגל על שם המרסמית (Hammersmith modified motor scale) (41)
מעכבי HADC אחרים פעילים יותר נמצאים כרגע בשלבי מחקר ראשוניים.
- Hydroxyurea (HU)
תרופה נגד סרטן הנמצאת בשימוש בחולי אנמיה חרמשית נמצאה מגבירה ביטויו של SMN-fl ורמת החלבון בתאים מחולי SMA. בניסוי ראשוני בקרב 33 חולי SMA II-III נמצא שהתרופה בטוחה לשימוש, אך לא נמצא שיפור ביכולות המוטוריות או בתפקודי נשימה של החולים. כעת מתקיימים ניסויים מבוקרים יותר כדי לבדוק את יעילות התרופה (22, 33).
חומרים המגנים על העצב
- Rilutek - מעכב שחרור קדם-מצמד (Presynaptic) של גלוטמאט, ובכך מונע השפעה רעילה על קצות העצבים. הוכח כמגביר את אורך חיי העצב המוטורי בעכברי SMA סוג I, אבל התפקוד המוטורי עצמו לא השתפר. בניסוי קליני שנערך בקרב חולים: שלושה חולים מתוך שבעה שקיבלו את הטיפול שרדו 25 חודש לעומת 3 שקיבלו תרופת אינבו (Placebo) ושרדו רק 12 חודש. התרופה לא גרמה לתופעות לוואי חמורות (23)
- Ventolin (Albuterol) - אגוניסט בטא 2 אדרנרגי, בשימוש כתרופה נגד גנחת הסימפונות (Asthma). במחקר קליני פתוח, שהתבצע במשך 6 חודשים בקרב חולי SMA סוג II-III נמצאה עלייה קלה, אך משמעותית במיומטריה (Myometry) ובתפקודי ריאות וכן במסת (Mass) השרירים (24)
- מרכיבים מרחיבי מסגרת שעתוק (Read-through compounds) - נמצא שאמינוגליקוזידים (Aminoglycosides) מרחיבים את מסגרת הקריאה של הגן מעבר לקודון (Codon) העצור ובכך מגדילים את SMN2D7 וגורמים ליצירת חלבון SMND7 עם תוספת של 8 חומצות אמינו מתוך 16 החסרות, דבר הגורם ליצור חלבון יעיל יותר. בשלב זה נערכים מחקרים בחיות מעבדה בלבד (25)
- טיפול בתאי אב - לתאי אב עובריים רבי כושר שהושתלו בחוט השדרה היכולת לשחזור תפקודיים עצביים בדגם חיה עם מחלת תא העצב המוטורי. הוכח שהזרקה לתוך חלל השידרה (Inrathecal) של תאי אב גורמת לנדידת תאים אל רקמת התָּוֶךְ (Parenchyma) ולהגברת ייצור תאי אב מוטוריים בחיות מעבדה. בשלב זה מתוכנן ניסוי קליני בבני אדם (26)
פרוגנוזה
- SMA סוג I - החולים לא מגיעים אף פעם לישיבה ולהליכה, ובדרך כלל מתים במהלך השנתיים הראשונות לחיים. עם זאת, תוארו מקרים נדירים של סוג זה עם הישרדות ארוכה יותר (5)
- SMA סוג II - החולים מגיעים לישיבה, אבל אינם מגיעים להליכה עצמאית. תוחלת החיים היא מעבר לגיל שנתיים
- SMA סוג III - החולים מסוגלים לשבת וללכת. ב-IIIa רק 44% מהחולים עדיין מסוגלים ללכת בגיל 20, ב-IIIb 90% מהחולים עדיין ניידים בגיל זה. (4) בשתי תת-הקבוצות תוחלת החיים רגילה
- SMA סוג IV - תוחלת חיים רגילה
דגלים אדומים
ביבליוגרפיה
- Cusin V, Clermont O, Gérard B, et al. Prevalence of SMN1 deletion and duplication in carrier and normal populations: Implication for genetic counseling. J Med Genet 2003;40(4):39
- Saugier-Veber P, Drouot N, Lefebvre S, et al. Detection of heterozygous SMN1 deletions in SMA families using a simple fluorescent multiplex PCR method. J Med Genet 2001;38(4):240-243
- Munsat TL, Davies KE. International SMA consortium meeting. (26-28 June 1992,Bonn, Germany). Neuromuscul Disord. 1992;2(5-6):423-428
- Zerres K, Rudnik-Schöneborn S. Natural history in proximal spinal muscular atrophy. Clinical analysis of 445 patients and suggestions for a modification of existing classifications. Arch Neurol 1995;52(5):518-523
- Borkowska J, Rudnik-Schoneborn S, Hausmanowa-Petrusewicz I, et al. Early infantile form of spinal muscular atrophy (Werdnig-Hoffmann disease) with prolonged survival. Folia Neuropathol 2002;40(1):19-26
- Gilliam TC, Brzustowicz LM, Castilla LH, et al. Genetic homogeneity between acute and chronic forms of spinal muscular atrophy. Nature 1990;345(6278):823-825
- Ogino S, Leonard DG, Rennert H, et al. Genetic risk assessment in carrier testing for spinal muscular atrophy. Am J Med Genet. 2002;110(4):301-307
- Brzustowicz LM, Lehner T, Castilla LH, et al. Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2-13.3.Nature. 1990;344(6266):540-541
- Bürglen L, Lefebvre S, Clermont O, et al. Structure and organization of the human survival motor neurone (SMN) gene. Genomics 1996;32(3):479-482
- Roy N, Mahadevan MS, McLean M, et al. The gene for neuronal apoptosis inhibitory protein is partially deleted in individuals with spinal muscular atrophy. Cell 1995;80(1):155-165
- Hahnen E, Schönling J, Rudnik-Schöneborn S, et al. Wirth Missense mutations in exon 6 of the survival motor neuron gene in patients with spinal muscular atrophy (SMA). Hum Mol Genet 1997;6(5):821-825
12. Wirth B, Brichta L, Schrank B, et al. Mildly affected patients with spinal muscular atrophy are partially protected by an increased SMN2 copy number. Hum Genet 2006;119(4):422-428
- Oprea GE, Krober S, McWhorter ML, et al. Plastin 3 is a protective modifi er of autosomal recessive spinal muscular atrophy. Science 2008;320:524-527
- Wang CH, Finkel RS, Bertini ES, et al. Consensus statement for standard of care in spinal muscular atrophy. J Child Neurol 2007;22:1027-1049
- Kernochan LE, Russo ML, Woodling NS, et al. The role of histone acetylation in SMN gene expression. Hum Mol Genet 2005;14:1171-1182
- Brichta L, Hofmann Y, Hahnen E, et al. Valproic acid increases the SMN2 protein level: a well-known drug as a potential therapy for spinal muscular atrophy. Hum Mol Genet 2003;12:2481-2489
- Chang JG, Hsieh-Li HM, Jong YJ, et al. Treatment of spinal muscular atrophy by sodium butyrate. Proc Natl Acad Sci USA 2001;98:9808-9813
- Sumner CJ, Huynh TN, Markowitz JA, et al. Valproic acid increases SMN levels in spinal muscular atrophy patient cells. Ann Neurol 2003;54:647-654
- Andreassi C, Angelozzi C, Tiziano FD, et al. Phenylbutyrate increases SMN expression in vitro: relevance for treatment of spinal muscular atrophy. J Hum Genet 2004;12:59-65
- Swoboda K. SMA CARNI-VAL TRIAL: Randomized double-blind placebo-controlled trial of L-carnitine and Valproic acid in children with SMA type II. Presented at the 12th Annual International SMA Research Group Meeting, Boston, MA, June 19-21 2008
- Mercuri E, Bertini E, Messina S, et al. Randomized double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy. Neurology 2007;68:51-55
- Liang WC, Yuo CY, Chang JG, et al. The effect of hydroxyurea in spinal muscular atrophy cells and patients. J Neurol Sci 2008, 268:87-94
- Haddad H, Cifuentes-Diaz C, Miroglio A, et al. Riluzole attenuates spinal muscular atrophy disease progression in a mouse model.Muscle Nerve 2003;28:432-437
- Kinali M, Mercuri E, Main M, et al. Pilot trial of albuterol in spinal muscular atrophy. Neurology 2002;59:609-610
- Wolstencroft EC, Mattis V, Bajer AA, et al. A nonsequence- specifi c requirement for SMN protein activity: the role of aminoglycosides in inducing elevated SMN protein levels. Hum Mol Genet 2005;14:1199-1210
- Corti S, Nizzardo M, Nardini M, et al. Neural stem cell transplantation can ameliorate the phenotype of a mouse model of spinal muscular atrophy. J Clin Invest 2008;118:3316-3330
- Rudnik-Schöneborn S, Botzenhart E, Eggermann T, et al. Mutations of the LMNA gene can mimic autosomal dominant proximal spinal muscular atrophy. Neurogenetics 2007;8(2):137-142
- Rudnik-Schöneborn S, Forkert R, Hahnen E, et al. Clinical spectrum and diagnostic criteria of infantile spinal muscular atrophy: further delineation on the basis of SMN gene deletion findings. Neuropediatrics 1996;27(1):8-15
קישורים חיצוניים
- מחלות ניוון הנוירון המוטורי (Spinal Muscular Atrophies): היבטים קליניים וחידושים, לקראת טיפול גנטי, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר מירה גינזברג, אחראית מחלות עצב-שריר, מרפאה מטבולית-גנטית-נוירולוגית, מרכז רפואי וולפסון, חולון; ד"ר דורית לב, מנהלת המכון לגנטיקה רפואית ומנהלת שותפה, מרפאה מטבולית-גנטית-נוירולוגית, מרכז רפואי וולפסון, חולון
- ↑ Grohmann K, Varon R, Stolz P, Schuelke M, Janetzki C, Bertini E, Bushby K, Muntoni F, Ouvrier R, Van Maldergem L, Goemans NM, Lochmüller H, Eichholz S, Adams C, Bosch F, Grattan-Smith P, Navarro C, Neitzel H, Polster T, Topaloğlu H, Steglich C, Guenther UP, Zerres K, Rudnik-Schöneborn S, Hübner. Infantile spinal muscular atrophy with respiratory distress type 1 (SMARD1) C.Ann Neurol. 2003 Dec;54(6):719-24.
- ↑ Kaindl AM, Guenther UP, Rudnik-Schöneborn S, Varon R, Zerres K, Schuelke M, Hübner C, von Au K. Spinal muscular atrophy with respiratory distress type 1 (SMARD1). J Child Neurol. 2008 Feb;23(2):199-204.
- ↑ Auer-Grumbach M, Olschewski A, Papic L, Kremer H, McEntagart ME, Uhrig S, et al. Alterations in the ankyrin domain of TRPV4 cause congenital distal SMA, scapuloperoneal SMA and HMSN2C. Nat Genet 010; 42: 160–4.
- ↑ Ueda Y, Suganuma T, Narumi-Kishimoto Y, Kaname T, Sato T. A case of severe autosomal dominant spinal muscular atrophy with lower extremity predominance caused by a de novo BICD2 mutati Brain Dev. 2021 Jan;43(1):135-139.
- ↑ Balak CD, Hunter JM, Ahearn ME, Wiley D, D'urso G, Baumbach-Reardon L. Functional characterizations of rare UBA1 variants in X-linked spinal muscular atrophy. F1000Res. 2017; 6:1636.
- ↑ Breza M, Koutsis G. Kennedy's disease (spinal and bulbar muscular atrophy): a clinically oriented review of a rare disease. J Neurol. 2019 Mar;266(3):565-573.
- ↑ Topaloglu H, Melki J .Spinal muscular atrophy associated with progressive myoclonus epilepsy. Epileptic Disord. 2016 Sep 1;18(S2):128-134: Review
- ↑ Pontocerebellar hypoplasia with Spinal muscular atrophy (PCH1A)
- ↑ Renbaum P, Kellerman E, Jaron R, Geiger D, Segel R, Lee M, King MC, Levy-Lahad E.Am. Spinal muscular atrophy with pontocerebellar hypoplasia is caused by a mutation in the VRK1 gene. J Hum Genet. 2009 Aug;85(2):281-9.
- ↑ Cusin V, Clermont O, Gérard B, et al. Prevalence of SMN1 deletion and duplication in carrier and normal populations: Implication for genetic counseling. J Med Genet 2003;40(4):39


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 