מחלות ניוון שרירים שדרתי - Spinal muscular atrophies
| מחלות ניוון שרירים ספינאליות | ||
|---|---|---|
| Spinal muscular atrophies | ||
| ||
| ICD-10 | Chapter G 12. | |
| MeSH | D009134 | |
| יוצר הערך | ד"ר מירה גינזברג, ד"ר דורית לב
|
|
הקדמה
מחלות ניוון שרירים שדרתי (SMAies, Spinal Muscular Atrophies) היא קבוצה מגוונת של מחלות שריר גנטיות, שלהן בסיס פתופיזילוגי משותף, שהוא ניוון מתקדם, בלתי הפיך של גרעיני תאי עצב האלפאה (Alpha, α) המוטורי בחוט השדרה ולעיתים גם בגזע המוח Anterior Motor Neuron :(AMN), אשר בהמשך גורם לפגיעה הדרגתית וקבועה בשרירי השלד, לרוב ללא מעורבות שכלית. בעידן הנוכחי, האבחנה מתבססת על אבחון גנטי. בעבר, בהעדר אבחון גנטי, האבחנה התבססה על שילוב של תסמינים קליניים, מבחנים אלקטרופיזיולוגיים וביופסיה שריר.
אופי התורשה והמאפיינים הקליניים של המחלות הם מגוונים:
Spinal Muscular Atrophy - SMA
זו הצורה השכיחה ביותר. מועברת בתורשה אוטוזומלית נסגנית ((Autosomal recessive כלומר, נדרשת תרומה של שני ההורים. נגרמת כתוצאה ממוטצית חסר (Deletion) בגן (SMN1) Survival Motor Neuron, מתאפיינת בחולשה וניוון מתמשך של שרירי השלד והנשימה. טווח הופעתה והסתמנות הקלינית שלה מגוונים, החל מהחיים העובריים ועד לבגרות המאוחרת. חולשת השרירים היא סימטרית ומתקדמת מהשרירים הקירבניים Proximal Muscles (PM) לכיוון השרירים הרחיקניים Distal Muscles (DM), כלומר, השרירים הקרובים לעמוד השדרה כמו שרירי האגן וחוגרת הכתפיים נפגעים ראשונים ורק בהמשך מתקדמת לשרירים של קצות הגפיים, כולל מעורבות של שרירי הנשימה, שרירי הבליעה ושרירי הלעיסה.
SMARD1 - Spinal Muscular Atrophy Respiratory Distress Type I
מועברת בתורשה אוטוזומלית נסגנית, הנגרמת כתוצאה ממוטציה בגן IGHMBP2 (2 immunoglobulin μ-binding) בכרומוזום 11(q1311).
מאופיינת בשיתוק שריר הסרעפת, בניגוד ל- SMA Type I שבה המעורבות הנשמתית ההתחלתית היא של השרירים הבין צלעתיים.
מתבטאת במצוקה נשימתית חריפה, חולשת ודלדול שרירים רחיקנייים וזאת בניגוד ל-SMA Type I שבה מעורבות הראשונית הינה של השרירים הקרבניים.
בנוסף, הפרעה מעורבת גם פגיעה עצבית תחושתית ואוטונומית וקיבועים של המפרקים כבר בשלב מוקדם. מופיעה בילדות המוקדמת וגורמת לתמותה תוך מספר חודשים[1][2].
Autosomal Dominant SMA - AD SMA
מועברת בתiרשה אוטוזומלית שולטנית (Autosomal dominant)[3]. מאז העידן הגנטי נחשבת כחלק מקבוצת מחלות Autosomal Dominant TRPV4 Disorders. מתאפיינת בחולשת שרירים רחקניים, המופיעה כבר בלידה ואיננה מתדרדרת. נוירופטיה מתקדמת מופיעה בשלב מאוחר יותר בחיים לעיתים מלווה בהפרעה במיתרי הקול והפרעה נשימתית עם מעורבות של המפרקים ולעיתים עם הפרעות בעצמות השלד. שמאז העידן המולקולרי, נתגלו גנים נוספים כמו: BICD2[4] עם תסמינים דומים, כולל תמונה דמוית SMA עם אובדן של נוירונים מסוג אלפה בקרן הקדמית של עמוד השדרה.
X- linked SMA - XL-SMA
תורשה בתאחיזה לכרומוזום ה-X (X- linked), המועברת מאימהות נשאיות לבניהן. הצורה הקלינית זהה לצורה הטרום לידתית החמורה של SMA הקלסי, כולל מעוט תנועות עובר, חולשת שרירים חמורה כבר בלידה מלווה בקיבועים רחיקניים של המפרקים. נגרמת כתוצאה ממוטציה בגן.UBA1 וכן, נמצא קשר ל-p11.3-q11.1[5].
SBMA - Kennedy's disease (spinal and bulbar muscular atrophy)
מופיעה בגברים בלבד, רק בעשור השלישי-רביעי לחיים. נגרמת כתוצאה מהרחבה של מספר חזרות בפוליגלוטאמט (polyQ) בגן המקוד לרצפטור להורמון אנדרוגן (Androgen). גורמת לתסמינים נוירוגניים ומיוגניים: כלומר שם פגיעה עצית וגם פגיעה שרירית עם ניוון של הגרעינים המוטוריים הקדמיים בחוט השדרה ובגזע המוח. כוללת גם מעורבות של שרירי הפנים בנוסף לשרירי השלד, עליית CK, והפרעה אנדוקרינית של אי סבילות לטסטוסטרון כמו ניוון אשכים, אי פוריות והתפתחות רקמת שד[6].
Spinal Muscular Atrophy with Progressive Myoclonic Epilepsy (SMA+PME)
מתחילה בגיל הילדות (15 חודשים עד 17 שנים) ומתבטאת בחולשת שרירים מתקדמת, מהשרירים הקרבניים לרחיקנים, בשילוב פרכוסים מיוקוניים ואטוניים, בלתי נשלטים, רעד והפרעת שמיעה עצבית. לרב ללא מעורבות שכלית. תוחלת החיים קצרה. נגרמת כתוצאה ממוטציה בגן SAH1 המקודד לחלבון-acid ceremidase[7].
SMA + Pontocerebellar hypoplasia
PCH (Ponto Cerebellar hypoplasia) קבוצת מחלות גנטיות, ניווניות נדירות אשר כרוכות בנוון של המוחון וגזע המוח.
אותרו מספר גנים בקבוצת מחלות זו.
PCH1A[8] בנוסף למעורבות המוחית קיימת גם מעורבות של הגרעינים המוטוריים הקדמיים בחוט השידרה. הנגרמת כתוצאה מוטציה בגן VRK1(vaccinia-related kinase 1 gene) השכיח באוכלוסייה האשכנזית[9].
קיימות מחלה נדירות נוספות שלחלקן עדיין לא נמצא הבסיס הגנטי.
ניוון שרירים שידרתי - SMA
הפרק הנוכחי יעסוק באופן מפורט יותר בצורה השכיחה ביותר של ניוון שרירים שידרתי: SMA
המחלה בצורתה החמורה, SMA type I, תוארה לראשונה בשנת 1891 על ידי Guido Werding מהמחלקה לאנטומיה ופיזיולוגיה של אוניברסיטת וינה: "שני מקרים של מחלה תורשתית המופיעים בילדות המוקדמת של ניוון שרירי מתקדם המופיעה כדלדול (Dystrophy) אבל הבסיס הוא עצבי. מאוחר יותר ניתן לה שמה ע"י פרופסור Johonatan Hoffmann.
אפידמיולוגיה
המחלה האוטזומלית הנסיגתית השנייה בשכיחותה: 1 ל-6,000-10,000 לידות. שכיחות הנשאות היא כ-1:35[10]. המחלה המונוגנטית, כלומר נגרמת כתוצאה משיוני בגן בודד, השכיחה ביותר הגורמת לתמותת תינוקות. שכיחות המחלה בישראל בירידה בשל סקר טרום לידתי הקיים החל משנת 2007.
אטיולוגיה
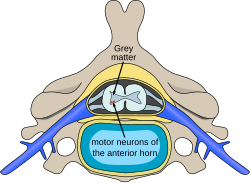
תאי העצב המוטוריים הנמצאים בקרן הקדמית של חוט השדרה, הם המקור לעצבים המוטוריים הפריפריים המעצבבים את שרירי השלד ואחראים לתפקוד המוטורי ותנועתיות הגוף. אובדן של תאים מוטוריים אלו גורם למגוון של מחלות ניווניות, מגוונות שצוינו עוד קודם וכן למחלת טרשת אמיוטרופית צידית (ALS, Amyotrophic Lateral Sclerosis) שהיא מחלה של הגילים המבוגרים יותר שלא תידון בערך זה.
התהליך הניווני מערב את חוט השדרה לכל אורכו לעיתים גם גזע המוח, ללא מעורבות של הגרעינים המוטוריים של עצבי הפנים, פרט לגרעין עצב תת לשוני (Hypoglossal nerve), המעצבב את הלשון. התהליך הניווני מתחיל עוד בחיים העובריים והוא הדרגתי. קצב אובדן הגרעינים המוטוריים תלוי בתת הקבוצות של ה-SMA: Type I-IV והוא הקובע את חומרת המחלה, זמן הופעתה והפרוגנוזה. התהליך הניווני אינו גורם לפגיעה מוחית, ולכן הקוגניציה (Cognition) שמורה לחלוטין. מדובר בתהליך עצבי והפגיעה בשרירים היא משנית (לפחות זו הייתה ההנחה עד לאחרונה). בעקבות הטיפול התרופתי, מאחר ותוחלת החיים התארכה, מתפתחים גם תסמינים חוץ מערכת השרירים. הבסיס המולקולרי הוא הקובע את אופי המחלה ואת תת הקבוצות השונות.
- הבסיס המולקולרי של ניוון שרירים שדרתי - הגן SMN (Survival Motor Neuron) ותהליכי שעתוק.
שלוש הצורות הראשונות של המחלה מופו בעזרת מבחני תאחיזה לכרומוזום 5q13[11]. בשנת 1995 זוהה הגן SMN1 על ידי פרופסור מלקי כגן האחראי למחלה[11][12][13]. בגנום האנושי קיימות שתי צורות תואמות (Homologous) של הגן SMN1 :SMN ו-SMN2 הממוקמים במרחק 500 קילו-זוגות-בסיסים (Kilo base kb) זה מזה באזור 5q13. שני העותקים זהים פרט לשינוי בחמישה זוגות בסיסים הגורם להבדל בפעילות. ולכן הגן התאום, SMN2 הצנטרומרי (Centromeric) אינו יכול להוות תחליף מלא לגן הטלומרי (Telomeric) SMN1 (תמונה 2). הגן SMN2 מייצר רק 10% של חלבון באורכו המלא - SMN-fl, ואילו תוצר 90% הנותרים הוא חלבון שעבר שחבור חליפי (Alternative splicing) ואינו מכיל את אקסון 7 (SMN2D7) לכן, התוצר החלבוני איננו מתפקד באופן מלא בדומה לתוצר החלבוני של SMN1[13]. קיים קשר ישיר בין מספר העותקים של הגן SMN2 לבין חומרת המחלה. מאחר שכל עותק של SMN2 מייצר 10% מהחלבון הפעיל, עלייה במספר עותקי SMN2 מביאה ליצור כמות גדולה יותר של חלבון. ככל שמספר העתקי SMN2 נמוך יותר, כך חומרה גדולה יותר. קיימים כנראה גורמים נוספים פרט לגן עצמו, המשפיעים על חומרת המחלה – כמו גנים מסגלים (Modifier genes). תוארו זוגות אחים החולים בSMA עם מספר זהה של עותקי SMN2, אך חומרת מחלה שונה. הגניםSERF1(H4F5), NAIP, GTF2H2(p44) הממוקמים בקרבת האתר של הגן SMN נמצאו כמשפיעים על חומרת המחלה. יתכן ונוכחות של תשניות (Mutations) בגן פלסטין 3 (3 Plastin), הממוקם בכרומוזום X, השפעה מגנה בנקבות[14]. שניות בגן TLL2 השפעה על חומרת המחלה גם בזכרים[15].
ניתן לומר שחסר ב-SMN1 גורם למחלה ואילו כמות ה-SMN2 קובעת את חומרתה.
בנוסף לתפקיד העיקרי שממלא SMN במערכת עצבית–מוטורית, עדויות מצטברות המצביעות על כך שיש לו תפקיד גם מחוץ למערכת זו – כמו במערכת הלבבית, במערכת העיכול ובכליות [16].
קליניקה
מחלת ה-SMA מתאפיינת בחולשת שרירים פזורה ותואמת (Symmetric),מלווה בניוון של השרירים, המתקדמת, מהשרירים הקריבניים (Proximal) אל השרירים הרחיקניים (Distal). כלומר, בתחילה נפגעים השרירים של חגורת האגן והכתפיים הגפיים תחתונות בעקר של האחרונים, בדומה למחלות שריר (Myopathies). התוצאה היא פגיעה בתפקוד שרירי הירכיים אשר איננה מאפשרת ביצוע מעברים לישיבה, לעמידה ולהליכה. שרירי כפות הידיים והרגליים נפגעים בשלב מאוחר יותר. פרט לפגיעה קשה בתפקוד המוטורי, קיימת מעורבות בעקר של שרירי הנשימה הבין צלעתיים, (בשלב ראשון מעורבות פחותה של שריר הסרעפת), השתנקויות (Aspirations) עד הזדקקות לתמיכה נשימתית מלאכותית בדרגות שונות והזנה מלאכותית בין באמצעות צינורית (Gastric tube) או PEG. אי נוכחות החזרים גידיים (DTR), (פרט ל – SMA מסוג 3-4 בסוגים אלו ההחזרים עדיין יכולים להיות נוכחים בשלבים התחלתיים של המחלה) הינה אופיינית ביותר ואופן כמעט בלעדי ל- SMA וכן פעילות שרירית עצמונית ((Fasiculation של הלשון. שני תסמינים אלו מכוונים ביותר לאבחנת המחלה.
בדיקות אלקטרופיזיולוגיות: תמונה אופיינית המצביעה על תהליך נוירוגני
בדיקת הולכה עצבית (NCV, Nerve Conduction Velocity) תקינה, בשלוב בדיקת אלקטרומיוגרפיה (Electromyography, EMG): המדגימה משרעות (Amplitudes) ענק עם התפרקויות חשמליות עצמוניות (Fibrilations)[17]
ביופסיית שריר אופיינית המדגימה נוון קבוצתי והתארגנות סיבי השריר בקבוצות (Grouped atrophy)
ערוב של תאי שריר קטנים מנוונים, תאי שריר קטנים או תאי שריר גדולים המאורגנים בקבוצות. חומרת הפתולוגיה בביופסיית שריר איננה במתאם לחומרת החלה ואיננה יכולה להבדיל בין צורות SMA השונות[18].
הצורות הקליניות :0-IV SMA type
אבחון המחלה על צורותיה השונות, התבסס בעבר על התמונה הקלינית. אך, מאז העידן המולקולרי האבחנה היא גנטית בעקרה, כולל הגדרת תת- הצורה (types).
חומרת הצורה הקלינית (Phenotype) תלויה באופן ישיר במספר עותקי SMN2 שיכולים להיות מעותק 1 עד 4 עותקים, ובמקרים נדירים עד 8 עותקים. חולים הנושאים 8 עותקים של SMN2 מוגנים לחלוטין מהמחלה. ממצאים דומים נמצאו בעכברי SMA טרנסגניים (Transgenic)[19].
המַאֲגָד (Consortium) הבינלאומי של SMA הגדיר 4 קבוצות קליניות בהתאם לגיל תחילת המחלה וההישגים המוטוריים [20][21].
כוללים במחלה 5 תת קבוצות:
- SMA סוג -0: בסוג זה, המחלה מופיעה עוד בחיים העובריים. מאופיינת תנועות עובר מופחתות, חולשת שרירים קיצונית עם אי ספיקה נשימתית כבר בלידה וקיבועים במפרקי הגפיים ארתרוגריפוזיס (arthrogryposis) . תוחלת החיים קצרה ביותר.
- SMA סוג I: או בשמה ההיסטורי מחלת וורדינג-הופמן, (Werding-Hoffmann disease) (253300B#MIM). מחלה זאת היא הצורה החמורה ביותר, מהווה יותר מ-50% ממקרי ה-.SMA כוללת רפיון (Hypotonia) וחולשת שרירים כללית, המתחילה בששת חודשי החיים הראשונים. החולים אינם מגיעים לישיבה ולהליכה. רוב החולים נושאים 2 עותקים של SMN2[19]. ללא טיפול, תוחלת החיים היא עד שנתיים.
בשתי הצורות החומרות הללו, עלולה להיות גם מעורבות לבבית[22].
- SMA סוג II: צורת הביניים (253550#MIM). התסמינים הראשונים מופיעים לאחר גיל 6 חודשים. החולים מגיעים לישיבה, רק מיעוטם מגיעה לעמידה. החולים בסוג זה נושאים 3 עותקים של SMN2[13], ורובם מגיעים לחיים בוגרים בשלוב טיפול תמיכתי מסיבי.
- SMA סוג III : המכונה גם מחלת קוגלברג-וולנדר (Kugelberg–Welander disease) , הצורה הצעירה (253400#MIM). חולים מסוגלים לשבת וללכת.
- כאשר המחלה מתחילה לפני גיל 3 שנים היא מסווגת כ-IIIa- רובם נושאים 3 עותקים של—2 SMN ורק 44% מהם עדיין מסוגלים ללכת בגיל 20. כאשר התסמינים מופיעים אחרי גיל 3 שנים ואפילו בגיל מתקדם, היא מסווגת כ-IIIb. הצורה הבוגרת
- SMA סוג VI (MIM#271150) רובם נושאים 4 -6 עותקי SMN 2. התסמינים לרב מתחילים לאחר גיל 21 והם קלים, יכולת ההליכה נשמרת ותוחלת החיים רגילה [19].
ישנה לעיתים חפיפה בין סוגי המחלה השונים וההפרדה ביניהם לא תמיד חד משמעית.
נוכחותם של סימנים קליניים נוספים שאינם בהכרח חלק מהמחלה, כמו מעורבות של מערכת עצבים מרכזית, מעורבות מוחון או שריר, אינם שוללים את לחלוטין קיום המחלה. ישנם תיאורי מקרים שבהם קיימת מעורבות של העצב המוטורי העליון, מעורבות לבבית, מעורבות שריר-שלד, רמות גבוהות של קראטין קינאזה (CK ,Creatine Kinase) או עורבות מקטעית (Segmental) בלבד ואף דגימה מרקמת שריר האופיינית יותר למחלת שריר מאשר לניוון קבוצתי (Group atrophy) בנוכחות חסר בגן SMN1[23]
אבחנה
כאשר התמונה הקלינית ברורה, האבחנה היא מולקולרית ולרב אין צורך בבדיקות עזר נוספות כמו : אלקטרופיזיולוגיות ו/או ביופסיית שריר, מאחר ואלו הן בדיקות פולשניות ומכאיבות ורצוי להימנע מהן.
האבחון המולקולרי מתבצע באמצעות בדיקת תגובת שרשרת של פולימראז (PCR, Polymerase Chain Reaction). בכ-97% מחולי SMA נמצא חסר הומוזיגוטי (כלומר חסר בשני העתקי הגן, של אקסון 7 ולעיתים גם 8 בגן SMN1 ,5q13 (גנוטיפ 0/0).
ב-5% מחולי SMA N לא נמצא החסר הומוזיגוטי באקסון 8-7 בגן SMN1, מדובר במצב הקרוי שונה-אללים מורכב (Compound heterozygote) - מצב שבו יש חסר מוחלט של אקסון 7/8 באלל אחד, ואילו באלל השני קיימת תשנית נקודתית שאיננה מאובחנת באמצעות בדיקת תגובת שרשרת של פולימראז (במקרים אלו, יש לבצע ריצוף (sequencing)של הגן SMN1 אבחנה של נשאות מתבצעת על ידי הערכת מספר עותקי SMN1. נוכחות עותק בודד מצביעה על נשאות, אך קיימת בעייתיות באיתור חלק מהנשאים ומתן ייעוץ גנטי, מפני שב-4% מהאוכלוסייה שני עותקים ויותר של הגן נמצאים על אלל אחד, ואילו האלל השני איננו מכיל כלל את הגן, ממצא שלא ניתן לאבחון בבדיקת תגובת שרשרת של פולימראז. במצב זה עדיין יש אפשרות של העברת האלל חסר הגן לצאצאים[11]. כמו כן, בכ-2% מהמקרים מתרחשת תשנית חדשה, או קיים פסיפס, זאת אומרת התשנית קיימת רק בתאי המין (Gonad cells). בעזרת טכנולוגיות גנטיות חדשות נעשה ניסיון להתגבר על מצבים אלו[24].
החל משנת 2007 קיימת בישראל בדיקת סקר גנטית לאיתור נשאים למחלת ה-SMA.
טיפול
הטיפולים מבוססים על שינוי המנגנונים הגנטיים הנמצאים ביסוד הפתופיזיולוגיה של המחלה, זאת בשילוב טיפולים תמיכתיים ובראשם הטיפול הנשימתי וכן טיפול אורתופדי ותזונתי. איכות החיים של חולי SMA תלויה בגישה כוללנית רב מערכתית. ב-2017 התפרסמו הנחיות המחודשות לגבי טיפול מקובל כוללני בחולי SMA [23].
הבנת המנגנונים הביולוגיים במחלת SMA פותחת אפשרויות טיפוליות באמצעות שתי גישות:
- שינוי מנגנונים מולקולריים: שינוי מנגנוני השחבור, השעתוק והשפעה על תרגום SMN1 ו-SMN2. ננקטו גישות מולקולריות שונות: הגברת הביטוי של החלבון המִלְּגַוִּי (Endogenous) SMN-fl המיוצר על ידי SMN2, באמצעות הגברת שעתוק SMN2 על ידי שחזור השחבור התקין של SMN2 pre-mRNA, ייצוב SMN-fl והארכת SMN2D7 G, או באמצעות החדרת גן SMN1 חיצוני באמצעות מוליך נגיפי (viral vector)
- טיפולים שאינם תלויים בגן SMN - עצמו אלא במנגנונים המגנים על תהליכים עצביים, מעכבי מיוסטטין (myostatin) , אקטיבציה של טרופונין (troponin) או השתלת תאי גזע (stem cells)
לקבוצה הראשונה שייכות 3 תרופות שהוכרו עי ה-FDA: לטיפול ב SMA לאחר שהוכחה יעילותם במחקרים קליניים.
- Nusinersen =Spinraza
- Risdiplam
- Zolgenzma
Splicing-Modify Therapy: Nusinersen =Spinraza
טיפול המכוון להגברת יצור SMN2. במחקרים נמצא גורם המשתק את השיחבור באינטרון 7 בגן SMN2: ISS-N1, דבר הגורם לאי הכללה (SKIPININ) של mRNA - אקסון 7. שימוש ב- antisense oligonucleotides (ASOs) מגביר את הכללת mRNA אקסון -7 ובכך מגביר את יצור ה-SMN2 FL. מכאן שיצור SMN2 באורך מלא עשוי לפצות על העדר ייצור של SMN1. הטיפול שניתן בהפרשי זמן קבועים של כל 4 חודשים לאחר השרייה של 4 זריקות עוקבות לתוך חלל חוט השדרה. הטיפול אושר ע"י ארגון המזון והבריאות האמריקאי FDA ואירגון הבריאות האירופאי EMA בשנת 2016 לאחר שהוכח שיפור ניכר בתפקודים המוטוריים של חולי SMA- מסוג 1, במחקרים כפולי סמיות. גם בישראל נכלל בסל התרופות הטיפול לכל חולי SMA מכל סוג שהוא[25][26]
טופלו בעולם מאות חולי SMA מהסוגים השונים ויעילות הטיפול בשיפור התפקודים המוטוריים והנשימתיים, הארכת תוחלת החיים ושיפור איכות החיים עדיין נבחנים, אך מסקנה אחת היא חד–משמעית: ככל שהטיפול יינתן בשלב מוקדם יותר כן סיכויי השיפור בכל המדדים גבוהים יותר.
החסרונות של טפול זה: NUSINERSEN איננה חודרת מחסום דם-מוח B.B.B (Blood Brain Brrier) ולכן מחייבת הזרקה לתוך חלל חוט השדרה. התהליך פולשני וקשה לביצוע בחולי SMA, שלרב סובלים מעקמת קשה של עמוד השדרה וכרוכה בסיכוני זיהומים ודלף של נוזל חוט השדרה. בנוסף, השפעת הטיפול מוגבלת רק למערכת העצבים המרכזית (CNS), ללא השפעה רב מערכתית פריפרית במיוחד במערכת עצב- שריר. זאת לאור העדויות מצטברות המצביעות על תפקידו של-SMN במערכות הפריפריות[27][28].
Zolgensma= AVXS-101 Onasemnogene beparvovec
טיפול המיועד להחדרת הגן SMN1, לתאי העצב המוטוריים.
הגן SMN1 מוחדר לגרעין של נגיף AAV9:Adeno- associated virus9 העובר מחסום דם–מוח וחודר ל- 60% מהעצבים המוטוריים. ההדבקה בנגיף היא שפירה ולרוב אסימפטומטית. במסגרת מחקר הטיפול הגנטי ניתן ל-12 חולי SMAtype1 והראה שיפור משמעותי בתפקוד המוטורי ובתוחלת החיים של החולים.
היתרונות של טיפול זה הם: מתן סיסטמי וחד פעמי בהזרקה לווריד היקפי. מאחר ומדובר במוליך שהינו נגיפי, לחלק גדול מהמטופלים נוגדנים כנגד הנגיף, דבר שמונע מתן הטיפול. בנוסף התרופה עלולה לגרום לעליה באנזימי הכבד כתוצאה מגרימת דלקת כבדית, עליה בטרופונין שמקורו בשריר הלב או ירידה במספר הטסיות. תופעות הלוואי הללו מצריכות טיפול בסטרואידים סביב מתן הטיפול ולרוב חולפים לאחר מספר שבועות.
בישראל הטיפול כלול בסל התרופות ומאושר לכל סוגי ה-SMA עד גיל שנתיים[29][30].
Risdiplam
מולקולה קטנה (RG7916, RO7034067) הניתנת פומית עם פיזור מרכזי ופריפרי המשפיעה על השחבור של SMN2 mRNA. מחקרים קליניים הוכיחו את יעלות הטיפול בכל סוגי ה-SMA כולל עליית ברמת החלבון בדם ושיפור בתפקודים המוטוריים. הטיפול רשום בישראל אך טרם כלול בסל התרופות, בשלב זה ניתן רק כטיפול חמלה במספר מרכזים בארץ[31][32][33].
שלוש התרופות הנ"ל, אושרו ע"י ארגון המזון והתרופות האמריקאי FOOD AND DRUG ADMINISTRATION (FDA) ועדיין נאספים נתונים ממרכזים שונים ברחבי העולם, כולל ישראל על השפעתן ויעילותן על סוגי ה-SMA השונים.
ניסויים קליניים עדכניים
נערכים בעולם מספר ניסויים קדם /וקליניים שמטרתם הארכת חייו של הגרעין המוטורי, בין על ידי מניעת המוות התאי המתוכנן, או על ידי תהליכים גנטיים המיועדים להגברת הביטוי של 2SMN, הגברת יצור 1SNN, הפחתה בפרוק חלבוני SMNאו במנגנוני הגנה . זאת בשימוש בתרופות חדשות המבססות על התהליכים הפתופיזיולוגיים באמצעות שימוש בתרופות קיימות, למטרה שונה (Repurpocing).
Branaplam (LMI070)
טיפול פומי, שמטרתו הכללת אקסון 7 בטרנסקריפט של SMN2-. המחקר נמצא בפאזה I-II בחולי SMA Type I תוצאותיו הראשוניות מעודדות[34].
ייצוב ה-SMA באמצעות תרופות אנטיביוטיות ידועות, כמו; Aminoglycoside antibiotics/ Zithromycin, אשר ממסכות את קודון הפסק (stop codon) ומאפשרות המשך קריאת רצף הנוקלאוזידים (read-through), תרופות אלו עדיין נמצאות בשלבים ראשונים של המחקר[35].
תרופות שאינן פועלות באופן ישיר על SMN
תרופות בעלות השפעה מגינה על התאים העצביים (neuroprotective), מיועדות במיוחד לחולי SMA כרוניים, מסוג I, II ,כמו: Riluzole, המחקר נמצא בפאזה II-III, תוצאותיו עד כה, אינן מעודדות[36].
- מעכבי Myostatin:
- Myostatin - פקטור צמיחה הנמצא בעקר בתאי שריר ומונע גדילת יתר שלהם, עיכוב שלו עשוי, לשפר את מסת וכוח השרירים.
- SRK-015 (Follisttin Scholar Rock), מעכבי ביטוי של מיוסטטין במנגנונים שונים, נמצאים בשלבי מחקר פרה קליני שונים בחלקם תוצאות חיוביות[37][38].
- פעילות על סינפסה עצב-שריר - Neuromuscular Junction) NMJ):
- Pyridostigmine (Mestinon) ,Aminopyridine (4-AP or Ampyra), תרופות הפועלות להגברת אצטיל – כולין (Acetyl –Cholin) ב- NMJ,ונמצאו כשפרות את כוח השרירים בחולי SMA מסוג II-III . נמצאןת כעת בשלבי מחקר קליניים שונים(39,38).
ג. השתלת תאי אב Stem cells)) השתלת תאי אב לאורך חוט השירה אשר יהוו פוטנציאל להתהוות תאי עצב חדשים בריאים, ללא נוכחות המוטציה. ניסויים בחיות מעבדה בשלבים פרה קליניים הראו תוצאות מעודדות, אך עדיין לא נבדקה השפעתם על התפקוד המוטורי(39). ד. שילוב של מספר תרופות
אשר עובדות במנגנונים שונים’ מהווה פוטנציאל טיפולי מבטיח, לאחרונה נוסה שילוב תרופתי של Nusinerssn I- Zolgensma במספר קטן של חוליSMA מסוג I.השפעות ארוכות טווח עדיין צריכות להיבחן .(41)
לציין, שלא כל התרופות למרות שהראו עליה בנוכחות חלבון SMN הביאו לשיפור קליני בתפקודים המוטוריים לכן הופסק הניסוי בהם.
הפרוגנוזה במהלך הטבעי של המחלה
• SMA סוג I - החולים לא מגיעים אף פעם לישיבה ולהליכה, ובדרך כלל מתים במהלך השנתיים הראשונות לחיים. עם זאת, תוארו מקרים נדירים של סוג זה עם הישרדות ארוכה יותר (41) • SMA סוג II - החולים מגיעים לישיבה, אבל אינם מגיעים להליכה עצמאית. תוחלת החיים היא מעבר לגיל שנתיים • SMA סוג III - החולים מסוגלים לשבת וללכת. ב-IIIa רק 44% מהחולים עדיין מסוגלים ללכת בגיל 20, ב- IIIb 90% מהחולים עדיין ניידים בגיל זה. (42) שתי תת-הקבוצות תוחלת החיים רגילה • SMA סוג IV - תוחלת חיים רגילה. הפרוגנוזה של חולי SMA , משתנה בעקבות הטיפולים השונים. במיוחד חולים מסוג I, אשר מאותרים וממטופלים בשלבים ראשונים של המחלה. שלולאיי הטיפולים המתקדמים, לא היו שורדים מעבר למספר חודשים. עדיין אין מספיק פרספקטיבה באשר ליעילותם או תופעות הלוואי של הטיפולים לאורך שנים.
דגלים אדומים
ביבליוגרפיה
- ↑ Grohmann K, Varon R, Stolz P, Schuelke M, Janetzki C, Bertini E, Bushby K, Muntoni F, Ouvrier R, Van Maldergem L, Goemans NM, Lochmüller H, Eichholz S, Adams C, Bosch F, Grattan-Smith P, Navarro C, Neitzel H, Polster T, Topaloğlu H, Steglich C, Guenther UP, Zerres K, Rudnik-Schöneborn S, Hübner. Infantile spinal muscular atrophy with respiratory distress type 1 (SMARD1) C.Ann Neurol. 2003 Dec;54(6):719-24.
- ↑ Kaindl AM, Guenther UP, Rudnik-Schöneborn S, Varon R, Zerres K, Schuelke M, Hübner C, von Au K. Spinal muscular atrophy with respiratory distress type 1 (SMARD1). J Child Neurol. 2008 Feb;23(2):199-204.
- ↑ Auer-Grumbach M, Olschewski A, Papic L, Kremer H, McEntagart ME, Uhrig S, et al. Alterations in the ankyrin domain of TRPV4 cause congenital distal SMA, scapuloperoneal SMA and HMSN2C. Nat Genet 010; 42: 160–4.
- ↑ Ueda Y, Suganuma T, Narumi-Kishimoto Y, Kaname T, Sato T. A case of severe autosomal dominant spinal muscular atrophy with lower extremity predominance caused by a de novo BICD2 mutati Brain Dev. 2021 Jan;43(1):135-139.
- ↑ Balak CD, Hunter JM, Ahearn ME, Wiley D, D'urso G, Baumbach-Reardon L. Functional characterizations of rare UBA1 variants in X-linked spinal muscular atrophy. F1000Res. 2017; 6:1636.
- ↑ Breza M, Koutsis G. Kennedy's disease (spinal and bulbar muscular atrophy): a clinically oriented review of a rare disease. J Neurol. 2019 Mar;266(3):565-573.
- ↑ Topaloglu H, Melki J .Spinal muscular atrophy associated with progressive myoclonus epilepsy. Epileptic Disord. 2016 Sep 1;18(S2):128-134: Review
- ↑ Pontocerebellar hypoplasia with Spinal muscular atrophy (PCH1A)
- ↑ Renbaum P, Kellerman E, Jaron R, Geiger D, Segel R, Lee M, King MC, Levy-Lahad E.Am. Spinal muscular atrophy with pontocerebellar hypoplasia is caused by a mutation in the VRK1 gene. J Hum Genet. 2009 Aug;85(2):281-9.
- ↑ Cusin V, Clermont O, Gérard B, et al. Prevalence of SMN1 deletion and duplication in carrier and normal populations: Implication for genetic counseling. J Med Genet 2003;40(4):39
- ↑ 11.0 11.1 11.2 Brzustowicz LM, Lehner T, Castilla LH, et al. Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2-13.3. Nature. 1990;344(6266):540-54
- ↑ Roy N, Mahadevan MS, McLean M, et al. The gene for neuronal apoptosis inhibitory protein is partially deleted in individuals with spinal muscular atrophy. Cell 1995;80(1):155-165
- ↑ 13.0 13.1 13.2 Hahnen E, Schönling J, Rudnik-Schöneborn S, et al. Wirth Missense mutations in exon 6 of the survival motor neuron gene in patients with spinal muscular atrophy (SMA). Hum Mol Genet 1997;6(5):821-825
- ↑ Oprea GE, Krober S, McWhorter ML, et al. Plastin 3 is a protective modifier of autosomal recessive spinal muscular atrophy. Science 2008;320:524-527
- ↑ Jiang J, Huang J, Gu J, Cai X, Zhao H, Lu H. Genomic analysis of a spinal muscular atrophy (SMA) discordant family identifies a novel mutation in TLL2, an activator of growth differentiation factor 8 (myostatin): a case report BMC Med Genet. 2019 Dec 30;20(1):204
- ↑ Ravindra N. Singh, Matthew D. Howell, Eric W. Ottesen, Natalia N. Singh Biochim Biophys Diverse role of Survival Motor Neuron Protein. Acta. 2017 Mar; 1860(3): 299–315.
- ↑ W David Arnold, Paul N Porensky , Vicki L McGovern , Chitra C Iyer , Sandra Duque, Xiaobai Li , Kathrin Meyer , Leah Schmelzer , Brian K Kaspar , Stephen J Kolb , John T Kissel, Arthur H M Burghes. Electrophysiological biomarkers in spinal muscular atrophy: proof of concept.
- ↑ E L Zalneraitis , J J Halperin, M L Grunnet, B S Russman, N Peress. Muscle biopsy and the clinical course of infantile spinal muscular atrophy. J Child Neurol. 1991 Oct;6(4):324-8
- ↑ 19.0 19.1 19.2 Wirth B, Brichta L, Schrank B, et al. Mildly affected patients with spinal muscular atrophy are partially protected by an increased SMN2 copy number. Hum Genet 2006;119(4):422-428
- ↑ Munsat TL, Davies KE. International SMA consortium meeting. (26-28 June 1992, Bonn, Germany). Neuromuscul Disord. 1992;2(5-6):423-428
- ↑ Zerres K, Rudnik-Schöneborn S. Natural history in proximal spinal muscular atrophy. Clinical analysis of 445 patients and suggestions for a modification of existing classifications. Arch Neurol 1995;52(5):518-523
- ↑ C. A. Wijngaarde1, A. C. Blank, M. Stam1 , R. I. Wadman , L. H. van den Berg and W. L. van der Pol. Cardiac pathology in spinal muscular atrophy: a systematic review. Orphanet Journal of Rare Diseases (2017) 12:67
- ↑ 23.0 23.1 2017 Standards of Care for Spinal Muscular Atrophy (SMA) / The Guide to the 2017 International Standards of Care
- ↑ Ogino S, Leonard DG, Rennert H, et al. Genetic risk assessment in carrier testing for spinal muscular atrophy. Am J Med Genet. 2002;110(4):301-307
- ↑ Finkel, R.S.; Mercuri, E.; Darras, B.T.; Connolly, A.M.; Kuntz, N.L.; Kirschner, J.; Chiriboga, C.A.; Saito, K.;Servais, L.; Tizzano, E.; et al. Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy. N. Engl. J. Med. 2017, 377, 1723–1732
- ↑ Wadman, R.I.; van der Pol, W.L.; Bosboom, W.M.; Asselman, F.L.; van den Berg, L.H.; Iannaccone, S.T.;Vrancken, A.F. Drug treatment for spinal muscular atrophy types II and III. Cochrane Database Syst. Rev. 2020
- ↑ Talbot, K.; Tizzano, E.F. The clinical landscape for SMA in a new therapeutic era. Gene. Ther. 2017, 24,529–533
- ↑ Hamilton G, Gillingwater TH. Spinal muscular atrophy: going beyond the motor neuron. Trends Mol Med 2013; 19: 40–50. 20 Harding BN, Kariya S, Monani UR, Chung WK, Benton M, Yum SW et al. Spectrum of neuropathophysiology in spinal muscular atrophy type I. J Neuropathol Exp Neurol 2015; 74: 15–2
- ↑ Lowes, L.P.; Alfano, L.N.; Arnold, W.D.; Shell, R.; Prior, T.W.; McColly, M.; Lehman, K.J.; Church, K.; Sproule, D.M.; Nagendran, S.; et al. Impact of Age and Motor Function in a Phase 1/2A Study of Infants With SMA Type 1 Receiving Single-Dose Gene Replacement Therapy. Pediatr. Neurol. 2019, 98, 39–45.
- ↑ Shell, R.; Day, J.W.; Chiriboga, C.A.; Crawford, T.O.; Darras, B.T.; Finkel, R.S.; Connolly, A.M.; Lannaccone, S.T.Kuntz, N.L.; Peña, L.D.M.; et al. Onasemnogene Abeparvovec Gene-Replacement Therapy for Spinal Muscular Atrophy Type 1: Pivotal Phase 3 Study (STR1VE) Update. In Proceedings of the Cure SMA 23rd Annual SMA Researcher Meeting, Anaheim, CA, USA, 28–30 June 2019
- ↑ Sturm, S.; Gunther, A.; Jaber, B.; Jordan, P.; Al Kotbi, N.; Parkar, N.; Cleary, Y.; Frances, N.; Bergauer, T.;Heinig, K.; et al. A phase 1 healthy male volunteer single escalating dose study of the pharmacokinetics and pharmacodynamics of risdiplam (RG7916, RO7034067), a SMN2 splicing modifier. Br. J. Clin. Pharmacol.2019, 85, 181–193.
- ↑ Seabrook, T.; Baranello, G.; Servais, L.; Day, J.W.; Deconinck, N.; Mercuri, E.; Klein, A.; Darras, B.; Masson1, R.;Kletzl11, H.; et al. FIREFISH part 1: Early clinical results following an increase of SMN protein in infants with type 1 spinal muscular atrophy (SMA) treated with Risdiplam (RG7916). In Proceedings of theCommunication Presented at MDA Clinical & Scientific Conference, Orlando, FL, USA, 13–17 April 2019.
- ↑ Roche. Roche’s Risdiplam Meets Primary Endpoint in Pivotal SUNFISH Trial in People with Type 2 or 3 Spinal Muscular Atrophy. Available online: https://www.roche.com/media/releases/med-cor-2019-11-11.htm(accessed on 16 March 2019 New two-year data show Roche’s Evrysdi (risdiplam) continues to demonstrate improvement or maintenance of motor function in people aged 2-25 with Type 2 or Type 3 Spinal Muscular Atrophy (SMA). Available online: https://www.roche.com › releases › med-cor-2021-03-16
- ↑ Jevtic, S.; Carr, D.; Dobrzycka-Ambrozevicz, A. Branaplam in Type 1 spinal muscular atrophy: Second part of a phase I/II Study. In Proceedings of the Cure SMA 23rd Annual SMA Researcher Meeting, Anaheim, CA, USA,28–30 June 2019
- ↑ Calder, A.N.; Androphy, E.J.; Hodgetts, K.J. Small Molecules in Development for the Treatment of Spinal Muscular Atrophy. J. Med. Chem. 2016, 59, 10067–10083
- ↑ Haddad, H.; Cifuentes-Diaz, C.; Miroglio, A.; Roblot, N.; Joshi, V.; Melki, J. Riluzole attenuates spinal muscular atrophy disease progression in a mouse model. Muscle Nerve 2003, 28, 432–437.
- ↑ Long, K.K.; O’Shea, K.M.; Khairallah, R.J.; Howell, K.; Paushkin, S.; Chen, K.S.; Cote, S.M.;Webster, M.T.;Stains, J.P.; Treece, E.; et al. Specific inhibition of myostatin activation is beneficial in mouse models of SMAtherapy. Hum. Mol. Genet. 2019, 28, 1076–1089
- ↑ Chyung, Y. Interim Results from a Phase 1 Study of SהםRK-015, a Fully Human Monoclonal Antibody thatInhibits Myostatin Activation. In Proceedings of the CureSMA 23rd Annual SMA Researcher Meeting,Anaheim, CA, USA, 28–30 June 2019.
קישורים חיצוניים
- מחלות ניוון הנוירון המוטורי (Spinal Muscular Atrophies): היבטים קליניים וחידושים, לקראת טיפול גנטי, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר מירה גינזברג, אחראית מחלות עצב-שריר, מרפאה מטבולית-גנטית-נוירולוגית, מרכז רפואי וולפסון, חולון; ד"ר דורית לב, מנהלת המכון לגנטיקה רפואית ומנהלת שותפה, מרפאה מטבולית-גנטית-נוירולוגית, מרכז רפואי וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 