תפקידו של רופא המשפחה באבחון מחלות גנטיות - The role of the family physician in diagnosing genetic diseases
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תפקידו של רופא המשפחה באבחון מחלות גנטיות | ||
|---|---|---|
| The role of the family physician in diagnosing genetic diseases | ||
| יוצר הערך | פרופ' ציפי פליק זכאי ונחמה כהן כפיר | |
הרופא והמשפחה
אבחנה של מחלות גנטיות תורשתיות חשובה הן למטופל עצמו והן לבני משפחתו המורחבת. אבחנה של כל פרט מאובחן במחלה תורשתית מאפשרת כמובן טיפול מתאים, ידע על הפרוגנוזה הצפויה וגם, מפנה "זרקור" המכוון אותנו לחפש בני משפחה נוספים בסיכון.
הכרת הבסיס הגנטי למחלה ואופן צורת ההורשה שלה תכוון את הרופא הגנטיקאי ורופא המשפחה לבני המשפחה המצויים בסיכון, למי מבני המשפחה יש להמליץ על בדיקות גנטיות-אבחנתיות, בדיקות סקירה, ולמי מבני המשפחה המורחבת סיכון להיות חולה בעצמו או להעביר גן (Gene) לא תקין "שקט" לצאצאיו.
רופא המשפחה נמצא בחזית הרפואה. הסתכלות רחבה של רופא המשפחה על המטופל ועל בני משפחתו יכולה לכוון את כל בני המשפחה בסיכון לבירור מתאים, אבחנה גנטית וייעוץ גנטי. במקרים מסוימים, רופא המשפחה הוא היחיד שיכול למנוע הישנות מחלה תורשתית, כמו למשל במקרים שבהם הרופא המטפל מכיר פרטים חולים במשפחה שהבסיס הגנטי למחלתם אותר, ואינם מעוניינים בהעברת המידע לבני משפחה, כולל זו הגרעינית. במקרים אלה תפקידו של רופא המשפחה הוא קריטי ביכולתו לכוון את בני המשפחה המצויים בסיכון לבצוע בירור מתאים ומעקב, בצורה אנונימית ומבלי למסור מידע על בני המשפחה המעוניינים בסודיות, ובכך לתרום במניעת הישנות מחלות קשות במשפחה.
דוגמאות שכיחות הן מחלות הגורמות לאיחור התפתחותי משמעותי גלובלי מחד ומחלות ממאירות במשפחה כגון סרטן שד ושחלה, וסרטן המעי הגס מאידך. בשני המקרים מדובר במחלות שכיחות באוכלוסיה ואשר להן עשוי להיות בסיס תורשתי.
במקרים של חולים במחלות ממאירות, ביצוע בירור גנטי בפרטים בסיכון יאפשר הגעה לאבחנה מדויקת וביצוע מעקב מוקפד אחרי פרטים שהינם נשאים לשינויי רצף בגן הקשור בסיכון לממאירות, כגון BRCA1 או BRCA2 מחד. ומאידך, בירור גנטי "תקין", שאינו מעיד על נשאות, יאפשר לצמצם חרדות ולבצע מעקב רפואי רגיל, על פי הנהלים המקובלים באוכלוסיה הכללית.
הידע על היסטוריה משפחתית של סרטן המעי הגס מאפשר לרופא המשפחה לשוחח עם הפרטים בסיכון על הנושא, ולהפנותם לבדיקות ולמעקבים הרצויים, כולל בירור גנטי כדי לאתר את הפרטים בסיכון המרבי וכדי לאפשר גילוי מוקדם ככל האפשר של גידול ממאיר, מה שיאפשר כמובן סיכויי ריפוי גבוהים.
במקרים של איחור התפתחותי גלובלי משמעותי, הבירור הגנטי חשוב לצורך הגעה לאבחנה מדויקת, ולמתן ייעוץ גנטי מהימן ומדויק להורים לגבי ההריונות הבאים. אבחנה ברורה חשובה גם לאחאים הבריאים של אותו מטופל, בהגיעם לגיל הפוריות, ואיתור זוגות נוספים בסיכון במשפחה הרחבה.
הרופא והפרט
רופא המשפחה הוא החוליה הראשונה בשרשרת הקשר של המטופלים למול מערכת הבריאות. הוא האחראי על ניהול הטיפול בחולה, לרבות הפנייתו לרופאים מומחים ותיאום המשך המעקב והטיפול.
הרופאים בקהילה מלווים את המשפחות ואת הילדים בבריאות ובחולי ברמה היומיומית. אבחון נכון של מחלה גנטית שאותה מציג פרט מביא לטיפול אופטימלי בו ובמחלתו. אבחון של ילד חולה וידיעת המהלך הטבעי של המחלה יאפשרו הכנה כלכלית, מנהלתית ונפשית של ההורים ושל הגורמים המטפלים בקהילה להיערכות לקראת הבאות, כולל הכנה מוקדמת לשינויים במצבו של הילד. כמו כן, היכרות עם המחלה תאפשר התאמת הטיפול, המעקב ולעתים הפנייתו לרופאים מומחים הנדרשים לטיפול בו. בנוסף, אין להמעיט מהערך הגדול שתורמת אבחנה מדויקת לאיכות החיים וליכולת ההתמודדות היומיומית של החולה ושל בני משפחתו.
רבות מהמחלות הגנטיות מתבטאות בתסמינים שלהם אבחנה מבדלת רחבה ולכן היכרות עם המחלות השכיחות בקהילה או במשפחה, שבהן הבסיס הגנטי כבר פוענח, תביא להפחתת בדיקות מיותרות, דבר שיקל הן על החולה ומשפחתו והן על מערכת הבריאות. מאידך, חלק ניכר מהתסמונות הגנטיות, קשורות לליקוי רפואי מורכב.
סיפורים של חולים מורכבים, המציגים רצף של תלונות שלכאורה אין קשר ביניהן, עשויים להציג מכנה גנטי משותף. רופא המשפחה הנתקל במטופל, במיוחד מטופל בגיל צעיר יחסית, המגיע עם שילוב של בעיות רפואיות, לכאורה פשוטות לטיפול, צריך לחשוב כי לכל התלונות יכול להיות גורם גנטי אחד. הדוגמאות הבאות יכולות להמחיש את הכוונה: חולים ב-Myotonic dystrophy – יכולים להתלונן על ליקוי בראייה (Cataract), ליקוי בפוריות ועל הפרעות בקצב הלב. לכאורה מדובר בתלונות שכיחות, ברות טיפול. עם זאת, ריבוי התלונות אצל מטופל אחד, יכול לכוון את רופא המשפחה לחשוב על אפשרות של בסיס גנטי משותף להופעת מגוון הסימנים קליניים.
הפנייה של מטופלים מסוג זה למרפאה לגנטיקה רפואית עשויה לכוון את המטופל לטיפול מכוון ולמנוע הישנות של מקרים מורכבים יותר במשפחה המורחבת.
תיאור מקרה: Tuberous sclerosis (TS)
להלן סיפור מקרה המדגים את חשיבות מעורבותו של רופא המשפחה בתהליך האבחון והמעקב של חולה במחלה גנטית.
זוג שהגיע לבירור גנטי בשל ממצא של רבדומיומות (Rhabdomyomas) בלב העובר. ממצא זה מחשיד לאבחנה של מחלת Tuberous sclerosis שהינה מחלה המורשת באופן אוטוזומלי דומיננטי (Autosomal dominant) ושכיחה יחסית באוכלוסיה. לאור העובדה כי ידועים מקרים לא מעטים של פרטים חולים שהוריהם בריאים ("שינויי רצף חדשים"), ההורים זומנו לבדיקה פיזיקלית בשאלה של מחלת Tuberous sclerosis אצלם.
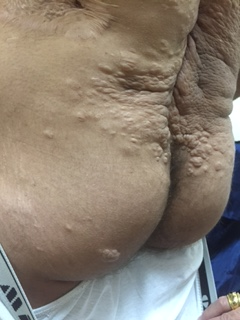
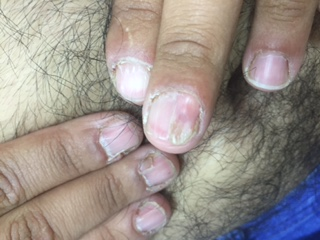
בבדיקת האב זוהו הממצאים הבאים (תמונות מספר 2-1):
גידול מסוג Desmoid בגב. הגידול זוהה בגיל שנתיים עם הישנות בגיל שש שנים.
גידול נוסף מסוג Ungual fibroma - בציפורן בכף רגל שמאל (מעל שלושה גידולים נחשב קריטריון מסוג Major ל-Tuberous sclerosis).
אותרו שני כתמים היפופיגמנטריים (Hypopigmentary) בעור דמויי עלה (Ash leafs). דווח כי כתמים דומים היו על הגב והוסרו עם הסרת ה-Desmoid (קריטריון מסוג Major ל-Tuberous sclerosis).
כתם פיגמנטרי במצח - Shagreen patch/Facial angiofibroma (קריטריון מסוג Major ל-Tuberous sclerosis).
גידולים תת עוריים רבים, החשודים כפיברומות (Fibromas), מפוזרים בגב ובעכוז.
Longitudinal grooves ופיברומות בציפורניים בכפות ידיים.
ממצאים אלה תמכו באבחנה הקלינית של Tuberous sclerosis אצל האב. הדגמת נוכחות של רבדיומיומה בעובר החשידה מחשידה לכך שהעובר ירש את המחלה מאביו.
הומלץ בירור מולקולרי לאימות האבחנה אצל האב ובעובר.
Tuberous sclerosis קשורה להופעת גידולים שפירים ברקמות שונות ולכן לפגיעה במערכות רבות בגוף האדם. במערכת העצבים המרכזית עלולים הגידולים לגרום לאפילפסיה ולפיגור שכלי ברמות שונות (כ-50 אחוזים מהחולים); בעור, להופעה של כתמים היפופיגמנטריים דמויי עלה וגידולים תת עוריים; בכליה, גידולי כליה; בציפורניים ובחניכיים, גידולים מסוג פיברומות; בעיניים - Hamartoma של הרשתית; ובלב – גידולי שריר מסוג רבדיומיומה.
Tuberous sclerosis היא מחלה תורשתית שנובעת משינויי רצף באחד משני הגנים המוכרים למחלה - TCS1 או TCS2. גנים אלה מקודדים לחלבונים הקשורים לבקרה ועיכוב בגדילת תאים. צורת ההורשה היא אוטוזומלית-דומיננטית. במחלות המורשות באופן זה, שינוי (מוטציה) בעותק יחיד של הגן הקשור למחלה יביא לביטוי רפואי. כל חולה יכול להוריש את המוטציה בגן לצאצאיו בסיכון של 50 אחוזים. צאצאים אשר ירשו את ה-Allele התקין, שאינו נושא מוטציה, הם וצאצאיהם יהיו בריאים. צאצאים אשר ירשו את המוטציה, יציגו Tuberous sclerosis.
ביטוי המחלה אצל החולים משתנה. כלומר, הסימנים הקליניים אצל חולים שונים הם בעלי טווח ביטוי רחב ועשויים להיות שונים בין פרטים שונים, אפילו באותה המשפחה (מביטוי קל מאוד, ועד ביטוי קשה).
כשליש מהמקרים קשורים למוטציה "חדשה" כלומר, מוטציה בגן שאינה מורשת מההורים וקשורה להופעה של מוטציה חדשה בתא המין.
אין כיום דרך לנבא את חומרת המחלה הצפויה אצל הפרטים שאובחנו באופן גנטי, כמו במהלך ההיריון למשל.
במקרה דנן, בוצע בירור מולקולרי (ריצוף) של הגנים TSC1 + TSC2 מ-DNA (DeoxyriboNucleic Acid) עוברי (שהופק ישירות ממי שפיר). זוהה שינוי רצף בגן TSC1 שמוכר במאגרי המידע כשינוי גורם מחלה ולשיבוש מבנה ותפקוד של החלבון הקשור לבקרה ועיכוב בגדילת תאים). שינוי רצף זה נמצא גם בדגימת DNA של האב המתואר לעיל.
ממצא זה מאמת את האבחנה של Tuberous sclerosis אצל האב ואצל העובר.
לאב נבנתה תכנית להמשך בירור רפואי רב מערכתי בקהילה לאיתור וטיפול מוקדמים של בעיות רפואיות שעלולות לצוץ. האב הופנה אל רופא המשפחה להשלמת הבירור הקליני הרלוונטי כגון הדמיה מוחית, בדיקת עיניים, הדמיית כליות וכו', וימשיך להיות במעקב מסודר בשאיפה לשמור על איכות חיים טובה ולמנוע בעיות רפואיות רלוונטיות למחלה.
למרות אבחנה של Tuberous sclerosis בעובר, האב ציין שביעות רצון מעצם אבחון הבסיס הרפואי לכל תלונותיו. האבחנה סיפקה לאב תחושה של "שליטה", צמצום אי ודאות למצבו ויכולת התמודדות מכוונת לבעיה. בני הזוג החליטו להפסיק את ההיריון לאור המחלה שאותרה אצל העובר ומתכננים אבחון טרום השרשתי בהיריון הבא.
ברור כי לעתים, שיתוף הפעולה של המשפחה ושל המערכת הרפואית מלווה בקשיים אובייקטיבים, כגון קשיי תחבורה, קשיים כלכליים וקשיי שפה ולכן הגדרת מהלך המחלה והבדיקות הנדרשות על ידי רופא המשפחה ו/או רופא הילדים ביישוב מעודדת את ההורים לבצען ולהתמיד בטיפול ובמעקב המומלץ.
תמונה 2-1. הממצאים שתוארו אצל האב שנמצא חולה במחלת Tuberous sclerosis
צלקת עמוקה, עדות להסרת גידול מסוג דזמואיד; פיברומות תת עוריות; ציפורניים, longitudinal grooves ו-ungal fibroma
פריון וילודה
הרופא המטפל בכל מגזר משמש כתובת סמכותית, מהימנה וזמינה בעיני מרבית האנשים לקבלת החלטות חשובות בנושא של פריון וילודה. לא פעם מטופלים מבקשים לקבל החלטה רפואית רק לאחר התייעצות עם רופא המשפחה המטפל. שיתוף פעולה של המשפחה עם גורם חיצוני וזר במערכת הבריאות מושפע מאוד מגישתו ומעידודו של הרופא המטפל. לכן, שיתוף פעולה ותקשורת ברורה בין הרופא המטפל למכון הגנטי, המשרת את אוכלוסיית מטופליו, חיונית ותורמת רבות לאבחון מהיר ולמתן טיפול מתאים ומדויק, מתוך נוחות מקסימלית למטופל ולמשפחתו. בנוסף, הרופא בקהילה מכיר לא רק את המטופל עצמו ואת משפחתו הגרעינית, אלא מכיר את כל המשפחה הרחבה, כך שרופא המשפחה עשוי להיות הראשון שיאתר זוגות הנמצאים בסיכון ללידת ילדים חולים במחלות קשות.
תפקיד דומה באיתור בני משפחה נוספים בסיכון ניתן לזהות גם בתחנות לבריאות המשפחה. צוות המכון הגנטי בנהריה מקיים שיתוף פעולה הדוק עם האחיות העובדות בתחנות לבריאות המשפחה. האחיות מכירות את הנשים משלב ההיריון המוקדם וכל זמן המעקב אחרי ילדיהן עד גיל חמש שנים, והללו נותנות בהן אמון רב. היכרות רחבה של האחיות עם המשפחה המורחבת של הנשים המגיעות לתחנות לבריאות המשפחה הדגימה לא אחת את החשיבות באיתור נשים בסיכון ללידה של ילודים המציגים מחלות תורשתיות.
שיתוף הפעולה בא לידי ביטוי גם באופן שבו (בצפון הארץ למשל), נציגות מהמכונים הגנטיים באזור מגיעות אל התחנות בקהילה, שם הן מבצעות ייעוצים אישיים שבהם נלקחת היסטוריה רפואית משפחתית, מציעות בדיקות גנטיות ובדיקות סקירה מתאימות בהיריון ומסייעות באיתור הזוגות בסיכון ללידת ילדים חולים.
היסטוריה משפחתית
היסטוריה משפחתית ידועה למחלה גנטית תורשתית דורשת התייחסות מיוחדת מצד הגורמים המטפלים בקהילה. במקרים אלה יש להפנות את בני המשפחה הרחבה לייעוץ גנטי. במקרים שבהם הבסיס הגנטי ידוע, ניתן לבדוק את ההורים לפני ההיריון ולהציע אבחון טרום לידתי או טרום השרשתי. במקרים שבהם הבסיס הגנטי למחלה המשפחתית איננו ידוע, יש אפשרות להציע אבחון טרום לידתי בבדיקות על-קול, במידה שהמחלה גורמת לשינויים מבניים בעובר כבר במהלך החיים התוך-רחמיים, או להציע התחלת בירור רפואי לגורם התורשתי למחלה במשפחה.
"בדיקת האקסום" - ניתן להשתמש בכלי הנקרא "בדיקת האקסום". באמצעות טכנולוגיה מתקדמת זו ניתן לסרוק את כל האזורים בגנים המקודדים לחלבונים ולבדוק האם קיים בהם שינויי רצף בד.נ.א העלול לגרום למחלה. כלי זה מאפשר כיום להגיע לאבחנות גנטיות במקרים רבים שבהם האבחנה לא היתה אפשרית בעבר. בדיקת אקסום מתבצעת כיום, בישראל במסגרת מחקרית, ובעולם כבר כבדיקה אבחנתית קלינית. הבדיקה אינה כלולה עדיין בסל הבריאות.
במהלך היריון, עקב מסגרת הזמן המוגבלת, לא תמיד ניתן להגיע לאבחנה מולקולרית מלאה ולהציע אבחון טרום לידתי, ולכן מומלץ להפנות את הפרטים החולים לבירור במועד מוקדם ככל האפשר טרם שידוע אם יש בני משפחה נוספים בהיריון.
לאחר שמפוענח הבסיס הגנטי, יש להגדיר את "טווח ההשפעה" של הגן. האם מדובר במחלה של המשפחה הגרעינית בלבד? במשפחה הרחבה? מספר משפחות בכפר? אולי כל הכפר בסיכון? האם כל העדה בסיכון? תשובות לשאלות אלו הן קריטיות בהגדרת האוכלוסיה שבסיכון ובהתאמת בדיקות סקירה. רופאי הילדים והמשפחה ממלאים תפקיד מרכזי בתהליך זה.
בחלק מהמחלות הבאות לידי ביטוי בגיל המבוגר, כגון מחלת הנטינגטון כוריאה, מחלת אלצהיימר משפחתית, פרקינסון משפחתית, דמנציה מוקדמת ועוד, הבסיס הגנטי הגורם למחלה ידוע. ביצוע בירור גנטי משפחתי יאפשר להגיע לאבחנה במהירות ובדייקנות ולהתחיל בטיפול מתאים מוקדם ככל האפשר.
גילוי המרכיב הגנטי של מחלות המתבטאות בגיל מאוחר יאפשר לצאצאיהם של החולים לתכנן את חייהם באופן מושכל מבחינה מקצועית, רפואית, ביטוחית וכלכלית. לרופא המשפחה תפקיד מכריע בהכנת בני המשפחה לטיפול הדרוש באב/ אם החולים ובעדכונם לגבי המהלך הטבעי של המחלה אצל יקירם וגם לגבי סיכוייהם לחלות במחלה ובבירור הגנטי שניתן לבצע כדי לנסות ולמנוע את המחלה בדורות עתידיים.
רפואה מותאמת אישית
בתחום הגנטיקה הרפואית ורפואת המשפחה, רפואה מותאמת אישית באה לידי ביטוי במספר אופנים שבהם לרופא המשפחה תפקיד מרכזי.
התאמת בדיקות גנטיות ייחודיות ובדיקות סקירה גנטיות לאנשים בריאים שבמשפחתם מספר פרטים החולים במחלה גנטית מסוימת או לאנשים בריאים ללא כל היסטוריה משפחתית, הנמצאים בסיכון לשאת גן לא תקין ולפתח מחלה, או להעבירו לצאצאיהם. לעתים, "רפואה מותאמת אישית" אינה מספיקה ועל מנת להתאים את הבדיקות הגנטיות באופן מדויק יותר, בעל פוטנציאל טיפולי טוב יותר, יש צורך ב"רפואה מותאמת קהילתית" - התחשבות במאפיינים ייחודיים של קהילת יעד והסתכלות על המטופל מתוך ראייה רחבה של המכלול בו הוא חי.
פרמקוגנטיקה - אנו יודעים מזה זמן כי אנשים שונים יגיבו בצורה שונה לתרופות שונות. חלקם יפתחו תופעות לוואי והאחרים לא. חלקם זקוקים למינון גבוה יותר מאחרים. תחום זה ברפואה נקרא פרמקוגנטיקה. כיום ניתן לבדוק סמנים גנטיים שיעידו על יכולתו של הפרט החולה להתמודד עם תרופות שונות. לדוגמה, מחלות פסיכיאטריות: אחד המרכיבים המרכזיים של הטיפול בהפרעות פסיכיאטריות הוא הטיפול התרופתי. התרופות הפסיכיאטריות מאפשרות לחולים ליהנות מהפחתה במידת החומרה של התסמינים מהם הם סובלים ולנהל אורח חיים קרוב לנורמלי במידת האפשר. ואולם, קיים קושי רב לקבוע מראש וללא התנסות איזו תרופה היא המתאימה ביותר למטופל באופן אישי. בנוסף לכך, קשה מאוד לקבוע מה הוא המינון המתאים עבור המטופל מבלי להתנסות ראשית במינונים שונים לאורך זמן. יש לתת את הדעת תמיד גם על תופעות הלוואי של התרופות השונות שעלולות להיות כה חמורות, עד שהמטופל נאלץ להפסיק ליטול אותן. על רקע הקשיים הללו פותחו לאחרונה בדיקות גנטיות של סמנים גנטיים בד.נ.א של החולה שמטרתן לקבוע מראש וללא תהליך של התנסות, מהי התרופה המתאימה ביותר למטופל ומהו המינון המתאים ביותר עבורו באופן אישי. באמצעות בדיקות אלו ניתן לברר מה תהיה התרופה הטובה ביותר לנבדק מסוים וגם האם עשויות להיות לתרופה זו תופעות לוואי שליליות על החולה.
אונקולוגיה - תחום נוסף שבו פועלת כבר הרפואה הגנטית המותאמת אישית. גידולים ממאירים נבדלים זה מזה בשינויים הגנטיים שהם עוברים בתהליך ההתמרה לממאירות. שינויים גנטיים אלה משפיעים על אלימותו של הגידול, יכולת החלוקה שלו, הסיכון להתפתחות של גרורות מרוחקות, ותגובה של תאי הגידול לטיפולים שונים – כימיים וביולוגיים. אפיון מולקולרי של הגידול יכול לשפר את יעילות הטיפול, לצמצם את תופעות הלוואי ולהקטין את הסיכון לחזרת המחלה.
לאור זאת, חשוב מאד לדעת כי קיימות בדיקות אשר נועדו להתאים את הטיפול לחולה ולגידול הספציפי שלו, במקום לתת טיפול אחיד לכל החולים הסובלים מאותה מחלה ממאירה. טיפולים כאלו כבר נכנסו לשימוש נרחב בסרטן שד, בסרטן המעי הגס וגם בסרטן ערמונית. מודעותם של רופא המשפחה יחד עם האונקולוג והפתולוג המטפלים לאפשרויות אלו והפניית החולה לבדיקות הגנטיות הרלוונטיות יכולות להיטיב מאוד עם החולה ולאפשר טיפול אופטימלי במחלתו.
זיהוי הבסיס הגנטי של מחלות חדשות
ערנות הרופא, היכרות עמוקה של הרופא עם הקהילה שבה הוא מטפל וההבנה כי נישואי הקרובים מעלים את שכיחותן של מחלות גנטיות נדירות, מאפשרות זיהוי ואבחון גנטי למחלות חדשות.
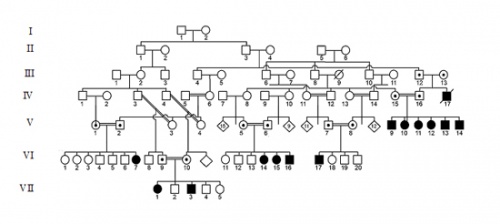
במספר משפחות מכפר ערבי מוסלמי באזורנו, ביניהן דווח על קשר משפחתי, נולדו ילדים שאובחנו כמציגים Cerebral Palsyי(CP) (תמונה מס' 5). כל הילדים היו בנים ובנות להורים קרובי משפחה, כאשר לעתים הופיעו כמה פרטים המציגים CP במשפחה גרעינית אחת. כולם הציגו תמונה קלינית אחידה: היריון ולידה תקינים, איחור התפתחותי ומוטורי החל מהשנה הראשונה לחיים וספסטיות בגפיים תחתונות שמחמירה עם הזמן. כמו כן, לכולם איחור קוגניטיבי קל עד בינוני וקיפוזיס.
CP היא קבוצה הטרוגנית של הפרעות נוירולוגיות, הגורמות לליקוי בתפקודים המוטוריים ומלווות בדרך כלל בשיתוק שרירים. שכיחות המחלה באוכלוסיה הכללית היא אחוז אחד. CP נגרם בעיקר מגורמים סביבתיים, אולם יש מחלות גנטיות שבהן קיימת הפרעה בחילוף חומרים של מערכת העצבים שיכולה לתת תמונה קלינית הדומה ל-CP.
למרות השכיחות הגבוהה של אבחון CP באוכלוסיי הכללית, רופא הילדים חשד כי במשפחות אלו מדובר במחלה על רקע גנטי, זאת עקב נישואי הקרובים, מספר פרטים חולים במשפחה אחת ותמונה קלינית משותפת פרוגרסיבית שאינה מתאימה לאבחנת CP. רופא הילדים הפנה את משפחות החולים לבדיקת רופא גנטיקאי, עזר בבניית עץ המשפחה המורחב, עודד את המשפחות בשיתוף פעולה וקישר בין המשפחות הגרעיניות השונות. בכך תרם לאיתור גן חדש הגורם למחלה באדם.
הילדים אובחנו כמציגים HSP – Hereditary Spastic Paraplegia. זוהי קבוצה של מחלות נוירודגנרטיביות תורשתיות המאופיינות בקושי פרוגרסיבי בהליכה עד לשיתוק כתוצאה מנוקשות של הגפיים התחתונות ולעתים גם העליונות. במחלות אלו ידועות כמה דרכי הורשה אפשריות: אוטוזומלית דומיננטית, אוטוזומלית רצסיבית, או בתאחיזה ל-X.
המחלה בצורתה המורכבת מאופיינת בנוקשות של ארבע הגפיים, בעיות במתן שתן ופגיעות נוספות במערכות נוירולוגיות כגון פיגור, חירשות, פגיעות בעיניים, פרכוסים, דמנציה ועוד. המחלה עצמה אינה ברת ריפוי. אף על פי שאין פגיעה בתוחלת החיים, איכות החיים יכולה להשתנות בין חולה לחולה ואף בתוך המשפחה. המחלה יכולה להתבטא בקושי מסוים בהליכה היכול להחריף במעט במשך השנים, ועד הידרדרות חריפה והזדקקות לכיסא גלגלים ולטיפול סיעודי מלא.
הטיפול בחולי HSP מוגבל היום רק לטיפול סימפטומטי בהקלת נוקשות השרירים, טיפול בבעיות מתן שתן וטיפול פיזיותרפי לשיפור וחיזוק היציבה וההליכה, בנוסף לטיפול תומך בבעיות הנלוות לשיפור איכות החיים.
איתור הבסיס הגנטי במקרה זה לא היה פשוט. שיתוף פעולה של מספר משפחות גרעיניות המכילות פרטים חולים בעלי פנוטיפ זהה חשוב מאוד ותורם רבות ליכולת הפענוח של הבסיס הגנטי למחלה. תהליך איסוף המשפחות הוא מורכב כיוון שהוא דורש מידת זהות מספקת בהתייצגות הקלינית של החולים. לאור זאת, בירור רפואי יעיל מסוג זה תלוי בעיקר ברופאים בקהילה וערנותם לאפשרות כי האבחנה עלולה להיות בעלת בסיס גנטי תורשתי.
המוטציה במשפחות אותרה בגן Vps37A המקודד לתת יחידה בקומפלקס ESCRT-1נ(endosomal sorting complex required for transport). כל החולים נמצאו נשאים הומוזיגוטים למוטציה זו, והוריהם נמצאו נשאים הטרוזיגוטים. זיהוי הבסיס הגנטי מאפשר לבני משפחה נוספים בגיל הפוריות להיבדק ולבצע אבחון טרום לידתי באם מעוניינים. מוטציה זו לא נמצאה במשפחות אחרות מאותו הכפר או בנבדקים אקראיים ממוצא ערבי מוסלמי באזור הגליל המערבי, ולכן בדיקה זו מומלצת לכל בני המשפחה הרחבה הנמצאים בגיל הפוריות מאותו כפר, ונשואים לפרט נוסף שלו שורשים, ולו גם חלקיים, מאותה משפחה.
השנים האחרונות הביאו עימן פיתוח טכנולוגיות חדשות להן זמינות גבוהה, עלות נמוכה יחסית ואפשרות לקבלת תוצאות בטווח הקצר. כל אלה הביאו למהפכה בקצב איתור גנים חדשים הגורמים למחלות ידועות ולמחלות חדשות ובזיהוי הבסיס מולקולרי למחלות במשפחה. מתוך כך המעבר מהחולה למחקר ובחזרה לקליניקה, לחולה, למשפחתו ולקהילתו, התקצר משמעותית ומביא להכללת בדיקות סקירה גנטיות לאוכלוסיה המתאימה עם גילוין של מחלות ומוטציות חדשות.
סיכום
לרופא המשפחה תפקיד מכריע באבחון ואיתור מחלות גנטיות בקרב מטופליו ובגילוי של גורמי סיכון גנטיים בקהילה בה הוא עובד.
כיום רפואה מותאמת אישית מתבטאת בכל תחום ברפואה ובצורה משמעותית עוד יותר בתחום הגנטיקה. החל מהתאמת בדיקות גנטיות לפי מוצא ועד לפרמקוגנטיקה, כלומר התאמת טיפולים תרופתיים לכל אדם על פי הפרופיל הגנטי שלו. כחלק מראייה חדשה זו יש חשיבות מרובה להסתכלות על כלל הנתונים של המטופל, החל מפרטים לגבי מוצאו, אמונתו ומקום מגוריו וכלה במידע על משפחתו הרחבה, עברו הרפואי, פרטי בן הזוג ועוד. מכלול זה תורם לתהליך אבחון וייעוץ אופטימלי ולהתאמת הבדיקות היכולות לנבא בצורה הטובה ביותר הופעת מומים מולדים או מחלות גנטיות במהלך החיים והתאמת הטיפול הטוב ביותר לכל אחד מהמטופלים במחלות השונות.
דגלים אדומים
ביבליוגרפיה
- Zivony-Elboum Y, Westbroek W, Kfir N, Savitzki D, Shoval Y, Bloom A, Rod R, Khayat M, Gross B, Samri M, Cohen H, Sonkin V, Freidman T, Geiger D, Fattal-Valevski A, Anikster Y, Waters A ,Kleta R, Falik-Zaccai TC.A founder mutation in Vps37A causes autosomal recessive complex hereditary spastic paraparesis, J Med Genet doi:10.1136/jmedgenet-2012-100742
- Tarini BA1, Zikmund-Fisher BJ2, Saal HM3, Edmondson L4, Uhlmann WR5. Primary Care Providers' Initial Evaluation of Children with Global Developmental Delay: A Clinical Vignette Study.J Pediatr. 2015 Dec;167(6):1404-1408.e1. doi: 10.1016/j.jpeds.2015.08.065. Epub 2015 Oct 23.
- Mand CM1,2, Gillam L3,4, Duncan RE5,6,7, Delatycki MB2,8,6."I'm scared of being like mum": The Experience of Adolescents Living in Families with Huntington Disease. J Huntingtons Dis. 2015 Sep 29;4(3):209-17. doi: 10.3233/JHD-150148.
- Genetics in Family Medicine: The Australian Handbook for General Practitioners, http://www.biotechnology.gov.au
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' ציפי פליק זכאי - מנהלת המכון הגנטי במרכז הרפואי לגליל, ראש תחום גנטיקה ומנהלת התכנית ל- MD PhD בפקולטה לרפואה בגליל, בר אילן ונחמה כהן כפיר - יועצת גנטית, המכון הגנטי, המרכז הרפואי לגליל


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק