גליפיקן-3 - Glypican-3
| מדריך בדיקות מעבדה | |
| גליפיקן-3 | |
|---|---|
| Glypican-3 | |
| שמות אחרים | SGBS, DGSX, DTR2-2, MXR7, OCI-5, GPC3 |
| מעבדה | פתולוגיה, כימיה |
| תחום | סמן לסרטן הפאטו-קרצינומה של הכבד (HCC). |
| טווח ערכים תקין | תחום ריכוזים תקין של GPC3 בנסיוב: פחות מ-2 ננוגרם/מיליליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
הפיזיולוגיה של GPC3
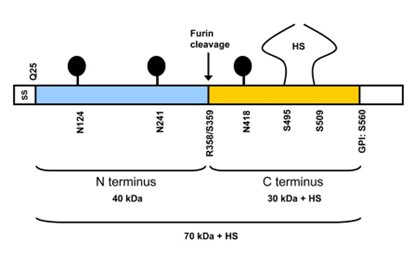
Glypican-3 הוא חלבון, שבאדם הוא מקודד על ידי הגן GPC3 (Pilia וחב' ב-Nature Genetics משנת 1996, Veugelers וחב' ב-Genomics משנת 1998, ו-Jakubovic ו-Jothy ב-Exp Mol Pathol משנת 2007). הגן GPC3 ממוקם על כרומוזום X בעמדה Xq26, מקודד לחלבון בגודל 70 קילו-דלטון המכיל 580 חומצות אמינו (Ho ו-Kim ב-Eur J Cancer משנת 2011). גן זה מכיל 11 exons. זוהו 3 וריאנטים המקודדים לשלושה איזופורמים שעברו splicing חלופי isoform-3 isoform-1 ו-isoform-4. ל-3GPC נקודה איזואלקטרית של 6.01 המצביעה על GPC3 כעל חלבון חומצי. יש ב- GPC314 שיירי ציסטאין, ו-50 חומצות האמינו בקצה ה-C-טרמינלי של, מכילות שרשרת צדדית של heparan sulfate (להלן HS). Leucine היא חומצת האמינו השכיחה ביותר ב-GPC3, ומהווה 10.3% מכלל חומצות האמינו בחלבון זה.
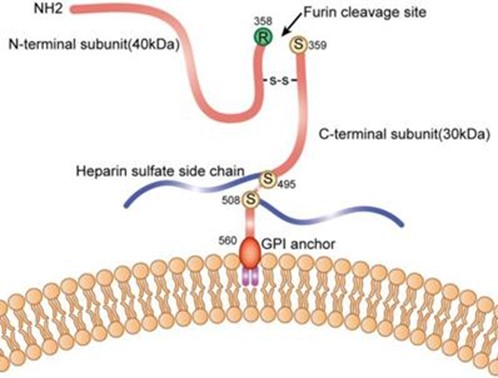
GPC3 מכיל אתר חיתוך לאנזים הפרוטאוליטי furin, ועל ידי ביקוע של הקשר בין חומצות האמינו Arg358 ו-Cys359 נוצרות 2 תת-יחידות של GPC3, כאשר גודל תת-היחידה ה-N-טרמינלית הוא 40 קילו-דלטון, ואילו הגודל של תת-היחידה ה-C-טרמינלית הוא 30 קילו-דלטון. שתי תת-היחידות יכולות להיות קשורות על ידי קשר די-סולפידי, והמודיפיקציה של heparan sulfate מתרחשת בשני אתרים: cys495 ו-cys508. ביונקים זוהו 6 גליפיקנים (GPC1-6) החברים במשפחת הפרוטאו-גליקנים האינטגרליים לממברנה (להלן GRIPS), המכילים חלבון ליבה המעוגן דרך אתר ser560 לליפיד בצד הציטופלזמטי של ממברנת התא בקשר glycosyl phosphatidylinositol (Kirkpatrick וחב' ב-J Cell Sci משנת 2007, ו-Bishop וחב' ב-Nature משנת 2007). ריצוף של GPC3 באדם, בעכבר, באלפקה ובגמל, מצביע על כך ש-GPC3 משומר באופן ניכר בארבעת מינים אלה. כל ששת ה-GPCs מבוטאים במידה רבה בשלב ההתפתחות העוברית (De Cat ו-David ב-Semin Cell Develop Biol משנת 2001, Filmus ב-Glycobiol משנת 2001, ו-Liu וחב' ב-Am J Pathol משנת 2009). GPC1 מבוטא בעצם, במח העצם, בשריר, באפיתליום ובכליות; GPC2 מבוטא בעיקר במערכת העצבים; GPC3 ו-GPC6 מבוטאים בעיקר על פני תאי עוברים; GPC4 מבוטא בעיקר במוח, בכליות ובריאות; GPC5 מבוטא במוח, בריאות, בכבד, בכליות ובגפיים. לעומת הפאזה העוברית, צורת הביטוי של GPCs משתנה מאוד במבוגרים: GPC4, GPC1 ו-GPC6 מבוטאים ברקמות שונות; GPC2 לא מבוטא כלל; GPC3 מבוטא רק בכבד; GPC5 מבוטא בעיקר במוח (Thui ו-Lindskog ב-Hum Protein Atlas משנת 2006, ו-Wu וחב' ב-Nucleic Acids Res משנת 2016).
מחקרים עדכניים מראים ש-GPCs כרוכים במידה רבה עם התפתחות סרטנית: GPC1 כרוך בגידול, בנדידה ובאנגיוגנזה של תאי סרטן בלבלב (Aikawa וחב' ב- J Clin Invest משנת 2008). בנוסף, התגלה שבהתפתחות סרטן הלבלב המושרית על ידי מוטציות ב-KRAS, GPC1 מהווה מולקולת מפתח לאנגיוגניות ולגידול סרטן הלבלב (Whipple וחב' ב-Oncogene משנת 2012). GPC2 מבוטא בעיקר בגידולים של מערכת העצבים כמו נוירובלסטומה. עם זאת, הביטוי של GPC2 בסוגי סרטן אחרים עדיין לא דווח. GPC4 מבוטא בחוזקה בגידול של הלבלב (Cao וחב' ב-J Cell Biochem משנת 2018), ו-GPC5 עובר down regulation ב-NSCLC (Williamson וחב' ב-Cancer Res משנת 2007), ואילו GPC6 משודרג בסרטן השחלות, ויש לו מתאם חיובי עם הפתוגנוזה של סרטן זה (Karapetsas וחב' ב-BioMed Res Int משנת 2015).
חלבונים אלה עשויים לשחק תפקיד בבקרה של חלוקת תאים ושגשוגם. GPC3 נמצא מווסת מסלולים תוך-תאיים המאותתים ל-Yap ול-Wnt/beta-catenin (Gao וחב' ב-Sci Rep משנת 2016, Li וחב' ב-Trends in Cancer משנת 2018, Feng וחב' ב-Proc Natl Acad Sci USA משנת 2013, Meng וחב' ב-Sci Rep משנת 2021, ו-Kolluri וחב' ב-Frontiers in Oncology משנת 2019). חסימה על ידי הנוגדן HN3 של המקטע על פני GPC3 הנקשר ל-Wnt, מונעת את השפעול של Wnt. מוטציות שמט ((deletion) בגן GPC3 קשורות לתסמונת Simpson-Golabi-Bohmel הנדירה המופיעה רק בזכרים עם תווי פנים מעוותים, פגיעה בשלד, בלב ובכליות. עכברי knockout לחלבון GPC3 הם בעלי תסמינים דומים לאלה של תסמונת Simpson-Golabi-Bohmel באדם, מה שמצביע על מעורבות GPC3 בגדילה ובהתפתחות הגוף (Cano-Gauci וחב' ב-J Cell Biol משנת 1999).
המשמעות האבחנתית
צביעה על ידי immunostaining של GPC3 שימושית להבדיל בין hepatocellular carcinoma (להלן HCC), לבין שינויים דיספלסטיים בכבד שחמתי (Filmus ו-Cappuro ב-Mol Diagn משנת 2004), שכן האחרון אינו נצבע בשיטה אימונית (Anatelli וחב' ב-Am J Clin Pathol משנת 2008). שימוש בנוגדן החד-שבטי YP7 מגלה נוכחות של GPC3 ב-HCC אך לא בכבד נורמלי או ב-cholagiocarcinoma (על פי Phung וחב' ב-Monoclonal Abs משנת 2012). GPC3 מבוטא גם אם כי באופן מופחת במלנומה, בקרצינומה של תאי clear בשחלות, בגידולי תאי נבט פרימיטיביים הידועים כגידולי שק החלמון, בנוירובלסטומה, ב-hepatoblastoma, בתאי Wilms' tumor, וכן במספר גידולים נוספים. עם זאת, לא ברורה המשמעות של GPC3 ככלי אבחנתי בגידולי אדם אחרים, פרט ל-HCC.
הפוטנציאל התרפויטי
Hepatocellular carcinoma היא גורם התמותה השני במעלה של כל מקרי המוות מסרטן בעולם (Bernard ו-Stewart ב-World Cancer Rep משנת 2014), ומהווה 8.2% מכלל הפטירות מסרטן בעולם Bray וחב' ב-CA Cancer J Clin משנת 2018), ו-HCC הוא סוג סרטן הכבד השכיח ביותר. ההתפתחות של סרטן הכבד מהירה, והפרוגנוזה דלה, בסין לדוגמה, מספר מקרי המוות מ-HCC מהווה למעלה מ-50% מכל מקרי המוות מסרטן זה בעולם כולו (Chen וחב' ב-CA; A Cancer J for Clinicians משנת 2015). השתלת כבד היא הבחירה הראשונה לטיפול ב-HCC, אם כי השיעור של הישנות מחלה זו תוך שנה מההשתלה מגיע ל-40%, וההישנות שלה תוך 5 שנים היא 50 עד 70% (Fan וחב' ב-Ann Surg משנת 2011). אף על פי ששיעור ההישרדות ללא מחלה למשך 5 שנים במושתלי כבד עשוי להגיע ל-60 עד 80%, בין 10% ל-20% ממושתלי הכבד יחוו הישנות הגידול תוך פרק זמן קצר יחסית (Toso וחב' ב-Am J Transplantation משנת 2011). מחקרים מראים שגידולי כבד עלולים להתפשט דרך הדם לאזורי גוף רחוקים, לכן החיפוש אחר מולקולות של פני השטח של תאי סרטן אלה בדם, הוא בעל משמעות קלינית באיתור, אבחון ותרפיה ממוקדת כנגד סרטן הכבד.
למרות התקדמות משמעותית באבחון ובטיפול, רק 40% ממקרי HCC מאובחנים בשלב מוקדם, ותוצאות הטיפולים הן לעיתים קרובות מאכזבות. טיפול כירורגי הוא עדיין הטיפול המועדף, אך רק 5% מהגידולים מסוג HCC מתאימים לכריתה, והישנותם מתרחשת ב-50-70% מהמטופלים תוך 5 שנים מאז הניתוח. אף על פי שהשתלת כבד היא חלופה, יש מספר מוגבל של תורמים לאחר מותם, ומשך ההמתנה לכבד מותרם ארוכה, מה שעלול להפחית את ההישרדות של מקבל תרומת הכבד (Forner וחב' ב-Lancet משנת 2012).
בהשוואה עם הפטוציטים נורמליים, ישנן מולקולות שטח רבות המתבטאות על פני תאי HCC, כמו GPC3 (Sun וחב' ב-Int Med J Exp Clin Res משנת 2017), הקולטן של asialoglycoprotein (להלן ASGP-R) (Hyodo וחב' ב-Liver משנת 1993), הקולטן ל- transferrin (להלן TfR) (Sciot וחב' ב-Histopathol משנת 1988), האנטיגן AF20 (Shapiro וחב' ב-PLoS One משנת 2016), הקולטן לסומטוסטטין (להלן SSTR) (Reynaert וחב' ב-Gut משנת 2004), ו-lysosomal associated protein transmembrane-4β (להלן LAPTM4B) (Shao וחב' ב-Oncogene משנת 2003). בין מולקולות שטח אלו ASGP-R ,TfR ,AF20 ,SSTR ו-LAPTM4B הם יעדים תרפויטיים פוטנציאליים ב-HCC, אך אינם מתאימים לאבחון של HCC. לעומת מולקולות אלו, GPC3 מבוטא רק לעיתים נדירות בתאי כבד במבוגרים, ואינו מתבטא על תאי כבד במחלות כמו הפטיטיס, צירוזיס, או כבד שומני. כמו כן, בגלל מיקומו על פני תאי HCC, GPC3 זמין לתרופות המבוססות על נוגדנים כגון CAR--T/NK באופן שאלה יהרגו תאי סרטן ללא פגיעה בתאים לא-סרטניים.
תכונות אלו מציבות את GPC3 כמולקות היעד הטובה ביותר לאבחון ולתרפיה של תאי סרטן הכבד. כדי לתקף את GPC3 כיעד תרפויטי בסרטן הכבד, פותחו מספר נוגדנים חד-שבטיים כגון GC33 (Ishiguro וחב' ב-Cancer Res משנת 2008), YP7, HN3 ו-HS20 (Kim ו-Ho ב-Curr Protocols Protein Sci משנת 2018), ונבחנו באופן נרחב. נוגדנים חד-שבטיים אלה (כולם ממקור עכבר) עברו תהליך האנשה בדרך של הנדסה גנטית לצורך הטיפולים הקליניים. נמצא שהנוגדן המואנש HS20 מתכוונן כנגד שרשראות heparan sulfate על פני GPC3, וכן ש-HN3 ו-HS20 מעכבים את איתות Wnt בתאי הכבד הסרטניים. האימונו-טוקסינים המבוססים על HN3 (Wang וחב' ב-Oncotarget משנת 2017, ו-Fleming וחב' ב-Hepatology משנת 2020), הקוניוגט נוגדן-תרופה המבוסס על hYP7 (Fu וחב' ב-Hepatology משנת 2019), נוגדנים המכוונים כנגד תאי-T הנובעים מ-YP7 (Chen וחב' ב-Mol Cancer Therpeut משנת 2021), ונוגדני GC33 (Ishiguro וחב' ב- Translational Sci Med משנת 2017), פותחו כדי לטפל בסרטן הכבד. אימונותרפיות המבוססות על T cell chimeric antigen receptor (להלן (CAR המבוססות על GC33 (Gao וחב' ב-Clin Cancer Res משנת 2014), וכן על hYP7 (Li וחב' ב-Gastroenterology משנת 2020) כמו גם על HN3 (Le Trinh וחב' ב-Am Assoc Cancer Res משנת 2016) פותחו לטיפול בסרטן הכבד.
תפקודים ביולוגיים של GPC3
GPC3 קשור לממברנת תאים ללא מקטע תוך-תאי שעשוי לעביר איתותים לתוך התא. עם זאת, GPC3 הוא מרכיב חשוב של המשתית החוץ-ממברנלית (ECM) (Zhou וחב' ב-Med Rev Res משנת 2018). GPC3 יכול להגיב עם מגוון של פקטורי גדילה, עם כמוקינים וציטוקינים, מה שמסייע לליגנדים אלה להיקשר לקולטנים שלהם. מחקרים מראים שאובדן של GPC3 במהלך ההתפתחות יכול לגרום להחלשת האיתותים דרך Wnt ו-Hedgehog (Yan ו-Lin ב-Nature Cell Biol משנת 2008, Hou וחב' ב-Devevlop Cell משנת 2007, ו-Gallagher וחב' באותו כתב-עת משנת 2007).
זיהוי של GPC3 בנסיוב של מטופלים עם סרטן כבד
GPC3 יכול להיות מופרש מממברנות תאים ולהיפרש לצירקולציה, ולכן GPC3 מסיס (להלן (sGPC3 יכול לשמש סמן חשוב באבחון של HCC (Capurro וחב' ב-Gastroenterology משנת 2003). מחקר זה הראה ש-sGPC3 אינו ניתן לגילוי בנסיוב של תורמים בריאים או של חולי הפטיטיס, אך 53% של מטופלים עם HCC הם בעלי רמות מוגברות של sGPC3 בנסיוב, עם רגישות וספציפיות של 95% (Abdelgawad וחב' ב- Asian Pacific journal of cancer prevention משנת 2013).
ערך פרוגנוסטי של ביטוי GPC3 במטופלים עם HCC
מחקרים מראים ששיעור חיובי של GPC3 בתאי סרטן כבד בדרגת התמיינות גבוהה, משמעותי נמוך יותר מאשר זה בתאי סרטן כבד בדרגת התמיינות ממוצעת או נמוכה. שיעור ההישרדות ל-5 שנים של מטופלים עם HCC חיובי ל-GPC3 נמוך משמעותית מזה של מטופלים עם HCC שלילי ל- GPC3 (54.5% לעומת 87.7%) (Shirakawa וחב' ב-Cancer Res משנת 2009). במטופלים עם HCC עם צירוזיס או כאלה המודבקים עם הנגיף להפטיטיס B ועוברים השתלת כבד, אלה מתוכם החיוביים ל-GPC3 הם בעלי פרוגנוזה גרועה (Cui וחב' ב-Hepat Pancreat Dis Int משנת 2015). מטה-אנליזה של 14 מחקרים שכללו סך של 2,364 מטופלים עם HCC מצאה אף היא פרוגנוזה גרועה באלה עם ביטוי-יתר של GPC3 (Zhang וחב' ב-Medicine משנת 2018). רמה גבוהה של GPC3 במטה-אנליזה זו הייתה כרוכה בחדירה מהירה יותר של התאים הסרטניים לכלי הדם.
הביטוי של GPC3 ברקמות סרטניות אחרות
נראה ש-GPC3 יכול לשמש סמן אימונו-היסטו-כימי גם במקרה של hepatoblastoma. מטה-אנליזה של 4 מחקרים שכללו 134 דגימות של hepatoblastoma, מצאו שיעור חיובי של צביעה ל-GPC3 ב-95.5% מהדגימות (Xiong וחב' ב-Asian Pacific J Cancer Prevention משנת 2015). ל-GPC3 יש שיעור חיובי גבוה יותר בתאי קרצינומה קשקשית של הריאה, אך שיעור חיובי נמוך יותר באדנו-קרצינומה של הריאה (Aviel-Ronen וחב' ב-Modern Pathol משנת 2008, Lin וחב' ב-Medical Oncology משנת 2012, ו-Yu וחב' ב-Genet Mol Res משנת 2015). שיעור חיובי גבוה יותר של ביטוי GPC3 בגידולי שק החלמון (להלן YST) כולל כל גידולי תאי הנבט, הוא סמן מפתח להבדיל בין YST לבין קרצינומת תאי clear של הכליות (Esheba וחב' ב-Am J Surg Pathol משנת 2017). במלנומה, יש ל-GPC3 שיעור חיובי מסוים של ביטוי (Nakatsura וחב' ב-Clin Cancer Res משנת 2004, ו-Ikuta וחב' ב-Clin Cancer Res משנת 2005, ו-Nakatsura ו-Ishimura ב-Biopharmaceutic Gene Ther משנת 2005), אם כי מספר מחקרים מראים ביטוי נמוך של GPC3 בגרורות של מלנומה (Kandi וחב' ב-Cancer משנת 2009). בקרצינומה גרורתית של דרכי השתן ביטויו של GPC3 גדול משמעותית בהשוואה ל-urothelium נורמלי (43.6% לעומת 13.3%). הביטוי של GPC3 עשוי לסייע בהבדלה בין גידולים סרטניים בדרג נמוך או גבוה (Aydin וחב' ב-Diagn Pathol משנת 2015).
קוניוגאט של נוגדן כנגד GPC3 ואימונו-טוקסין
קוניוגאט כזה מבוסס על נוגדן חד-שבטי כנגד GPC3 אליו קשורה מולקולה טוקסית עם פוטנציאל הדברה של תא סרטני עם תופעות לוואי מוגבלות (Thomas וחב' ב- Lancet Oncol משנת 2016). בהתבסס על הנוגדן YP7 הנקשר לחומצות האמינו 511-560 בקצה ה-C טרמינלי של GPC3, יצרו קוניוגאט בו קשרו את התרופה duocarmycin SA או את התרופה pyrrolobenzodiazepine dimer, ונמצא ששני קוניוגאטים אלה הרגו תאי HCC בריכוזים פיקומולריים (Fu וחב' ב-Hepatology משנת 2018). קוניוגאטים אחרים נוצרו על ידי קישור של ציטו-טוקסין לנוגדנים החד-שבטיים הבאים: GC-33 הנקשר לחומצות האמינו 524–563 בקצה ה-C טרמינלי של GPC3; הנוגדן החד-שבטי HS20 הנקשר ל-heparan sulfate שעל פני GPC3, הנוגדן הדו-ספציפי ERY974 הנקשר ל-GPC3 ול-CD3, והנוגדן HN3 הנקשר לכל המולקולה של GPC3. האקסו-טוקסין מ-A פסאודומונס (להלן PE-A) הוא הטוקסין הנמצא בשימוש הרב ביותר כאימונו-טוקסין על מנת לגרום למות תאי סרטן כבד תוך עיכוב של סינתזת חלבונים (Fleming ו-Ho ב-Toxins משנת 2016). מספר אימונו-טוקסינים נוצרו מהשילוב של PE-A ו-GPC3 כגון YP7-PE38 ו-HN3-PE38 שהם בעלי פעילות אנטי-סרטנית טובה, in vitro ו- in vivo (Gao וחב' ב-Nature Commun משנת 2016). אותם חוקרים חתכו את PE-A לבנות את האימונו-טוקסין HN3-mPE24 שהאריך משמעותית את תוחלת החיים של עכברים עם גידול סרטני מושרה (Wang וחב' ב-Oncotarget משנת 2017).
המשמעות של GPC3 באבחון ובפרוגנוזה של hepatocellular carcinoma
בגידולים קטנים בכבד זיהוי מוקדם של חיוביות של GPC3 עשוי לסייע בניבוי של הישנות הגידול הסרטני לאחר כריתתו בכבד, וכן GPC3 זוכה להערכה כגורם פרוגנוסטי בלתי תלוי להישרדות-נקיה-ממחלה (Chen וחב' ב-J Gastroenterol משנת 2014). רמה מוגברת של תת-היחידה האנטיגנית בקצה ה-N-טרמינלי של GPC3 בנסיוב (להלן (sGPC3N) נמצאה כרוכה באופן בלתי-תלוי הן בהישרדות כללית (0.05p<) וכן בהישרדות נטולת מחלה (0.01p<) (Haruyama וחב' ב-Int J Cancer משנת 2015). רמות מוגברות של GPC3 mRNA נכרכו עם ההתפתחות של HCC לאחר השתלת כבד (Wang וחב' ב-World J Gastroenterol משנת 2012). יתרה מכך, פותחה מערכת מבוססת-GPC3 של אימונו-מגנטיות פלואורסצנטית (להלן C6/MMSN-GPC3) לזיהוי של תאי סרטן בצירקולציה של הדם במטופלים עם HCC, מה שתורם לאבחון מוקדם ולקביעת הפרוגנוזה (Chu וחב' ב-Int J Nanomed משנת 2021).
שיטות לזיהוי GPC3 על פני תאי HCC בצירקולציה
מחקר שבוצע בהירושימה-יפן כלל 85 מטופלים שאובחנו עם HCC ועברו כריתת גידול. אף לא אחד מהנכללים בניסוי נמצא חיובי ל-portal vein invasion (להלן PVI) מאקרוסקופי או בשיטות הדמיה. דם היקפי נלקח מ-85 המטופלים עם HCC מיד לפני הניתוח, וכן נלקח דם מ-27 נבדקים ללא HCC (מתוכם 12 מתנדבים בריאים, 4 מטופלים עם צירוזיס, 4 מטופלים עם גידולי כבד שפירים, 5 מטופלים עם גידולי כבד ממאירים שאינם HCC ו-2 מטופלים עם סרטן המעי הגס). תאי סרטן בצירקולציה התגלו על ידי שיטה העשרה אימונו-מגנטית חיובית, משולבת עם flow cytometry (Hamaoka וחב' ב-PLoS One משנת 2019). בקצרה, שכבת התאים החד-גרעיניים המתקבלת לאחר סרכוז של גרדיאנט צפיפות, מלווה על ידי תוצאה חיובית בשיטה אימונו-מגנטית לאיסוף התאים החיוביים ל-GPC3.
הבידוד של תאים חד-גרעיניים: תאים אלה מבודדים מדגימה המכילה את כלל התאים על ידי סרכוז של גרדיאנט צפיפות. בקצרה, 8 מיליליטר של דם נלקחו מהווריד לתוך מבחנה המכילה סודיום ציטראט (פקק בצבע תכלת) כמו גם ג'ל פוליאסטר ונוזל ליצירת גרדיאנט צפיפות. הדגימה סורכזה למשך 20 דקות במהירות של 1,800g בטמפרטורת החדר. הטיפול בדגימות מתבצע תוך שעתיים מנטילת הדם.
העשרה אימונו-מגנטית: שכבת התאים החד-גרעיניים הורחפה בבופר MACS (פריט autoMACS running buffer של חברת Miltenyi Biotec, גרמניה). הדגימות מודגרות עם נוגדנים חד-שבטיים מעכבר כנגד GPC3 אליהם קשור allophycocyanin של חברת R&D Systems Inc, USA ומורחפות. בבופר MACS, הדגימות הודגרו לאחר מכן עם Anti-allophycocyaninMicroBeads של חברת Miltenyi Biotec למשך 15 דקות בקירור בתנאי חושך. התאים שוב נשטפו עם בופר MACS וסורכזו למשך 5 דקות במהירות 300g בחושך. הנוזל העליון הורחק והתאים הנותרים הורחפו בבופר MACS. תאים חיוביים ל-GPC3 נבררו על ידי cell sorter מגנטי (autoMACS Separator).
צביעה אימונו-פלואורסצנטית: לזיהוי תאי HCC בצירקולציה שיטת אימונו-פלואורסצנציה יושמה כפי שתואר (Tan וחב' ב-Biomed Microdevices משנת 2009). בקצרה, פרקציות של תאים חיוביים ל-GPC3, סורכזו למשך 3 דקות במהירות 1,500 סיבובים לדקה, והועברו לזכוכיות נושא מצופות בפוליליזין. זכוכיות נושא אלו עברו פיקסציה למשך 30 דקות בתמיסת 4% פארא-פורמאלדהיד והוטבלו בבופר שטיפה (hosphate buffered saline להלן PBS) עם 0.05% של הדטרגנט Tween 20. אתרי קישור לא-ספציפיים נחסמו על ידי תמיסת 5% של bovine serum albumin (להלן BSA) ב-PBS למשך 30 דקות, וזכוכיות הנושא הודגרו עם נוגדנים חד-שבטיים מעכבר כנגד cytokeratin 7/8 לזיהוי של תאי סרטן, ועם נוגדנים חד-שבטיים מארנבת כנגד CD45 לזיהוי תאי-דם לבנים, למשך 60 דקות בטמפרטורת החדר בתא לחות. נוגדן Horizon-BV480 (של חברת Becton Dickinson) מצומד עם goat anti-mouse IgG ו-Alexa Flour 555 מצומד עם goat anti rabbit IgG (של חברת Thermo-Fisher Scientific) שמשו כנוגדנים שניוניים. זכוכיות הנושא הוצפו עם Vectashield mounting medium עם amino-2-phenylindole-4,6 (להלן DAPI) לצביעת גרעיני התאים. הצביעה הפלואורסצנטית נקלטה תוך שימוש במיקרוסקופ פלואורסצנטי BZ-9000.
אנליזה flow cytometric: דגימות שעברו העשרה אימונו-מגנטית עברו אנליזה על ידי flow cytometry. בקצרה, הדגימות הודגרו למשך 30 דקות בקירור ובחושך עם נוגדנים של עכבר כנגד CD45 אנושי-שאליו קשרו phycoerythrin-cyanine-7, וכן עם fluorescein isothiocyanate n (להלן FITC) שקשור לנוגדן מעכבר כנגד CD235a אנושי על מנת לזהות תאים אריתרואידים. תאים נשטפו עם בופר צביעה של flow cytometry שהוא PBS עם 0.1% BSA ו-0.1% של sodium azide, ועברו סרכוז של 2,000 סיבובים בדקה למשך 5 דקות. הנוזל העליון מורחק והתאים מורחפים מחדש בבופר FACS לגילוי של תאים מתים הוסף -aminoactinomycin D7 מיד לפני ה-flow cytometry.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק