חלבון טאו מזורחן - Phosphorylated tau protein
| מדריך בדיקות מעבדה | |
| חלבון טאו מזורחן | |
|---|---|
| Phosphorylated tau protein | |
| שמות אחרים | p-tau |
| מעבדה | כימיה בדם, פתולוגיה. |
| תחום | הערכת מחלת אלצהיימר |
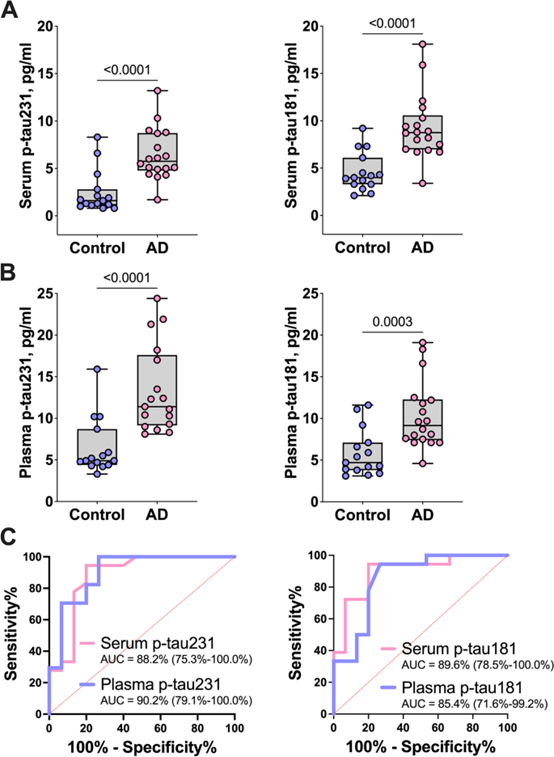
| טווח ערכים תקין | בפלזמה נורמלית-ריכוז ממוצע של p-tau231 הוא 5.1 פיקוגרם/מ"ל, ובפלזמה של חולה AD-12.5 פיקוגרם/מ"ל; בנסיוב נורמלי ריכוז ממוצע של p-tau231 הוא 1.2 פיקוגרם/מ"ל , ובנסיוב של חולה AD 5.2 פיקוגרם/מ"ל. בפלזמה נורמלית ריכוז ממוצע של p-tau181 הוא 4.8 פיקוגרם/מ"ל, ואילו ריכוזו הממוצע בפלזמה של חולה AD הוא 9.9 פיקוגרם/מ"ל. בנסיוב נורמלי הריכוז הממוצע של p-tau181 הוא 4.8 פיקוגרם/מ"ל, ובנסיוב של חולי AD הריכוז הממוצע הוא 8.7 פיקוגרם/מ"ל. הריכוז הממוצע של p-tau231 ב-CSF של חולה אלצהיימר הוא 777.9 פיקוגרם/מ"ל, ואילו ב-CSF של אנשים בריאים הוא 154.4 פיקוגרם/מ"ל. גם הריכוז הממוצע של ptau81 גבוה ב-CSF של חולי אלצהיימר פי 5 מאשר ב-CSF של אנשים בריאים: 895.8 פיקוגרם/מ"ל לעומת 176.4 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – שיטיון
מחלת אלצהיימר (להלן AD) היא הגורם המוביל של שיטיון של הגיל המתקדם, הפוגעת על פי הערכה ב-50 מיליון מבוגרים בעולם והיא כרוכה בסבל גופני וחברותי ובהוצאות כלכליות הצפויות לגדול אקספוננציאלית בעשורים הבאים (Prince וחב' ב-Alzheimers Dement משנת 2013, ו-Nichols וחב' ב-Lancet Neurol משנת 2019). המהלך האיטי של התפתחות המחלה, והחפיפה של חלק מתסמיניה עם צורות שיטיון אחרות, מסבכים את האבחון המדויק של AD על בסיס המצג הקליני בלבד (Jack וחב' ב-Alzheimers Dement משנת 2018, ו-Selvackadunco וחב' ב-J Neural Transm משנת 2019). למעשה, עד שליש מהמאובחנים עם AD באופן בלעדי על בסיס של הפנוטיפ הקליני מתבררים כאלה שאינם לוקים במחלה זו, זאת על בסיס העובדה שאין מוצאים בבחינה היסטולוגית של מוחות נפטרים שהיו חשודים כלוקים ב-AD את המאפיינים הנוירו-פתולוגיים המקובלים. קשיים אבחוניים אלה מחייבים חיפוש אחר סמנים ביולוגיים מובהקים של AD (Zetterberg ו-Blennow ב-Mol Neurodegeneration משנת 2021, Ashton וחב' ב-Nat Rev Neurol משנת 2020, ו-DeTure ו-Dickson באותו כתב עת משנת 2019).
אבחון מוחלט של AD מבוסס על אשרור ב-autopsy של 2 מאפיינים פתולוגיים עיקריים: רבדים עמילואידיים חוץ-תאיים המורכבים מצברים (אגרגטים) של הפפטידים ה-β-עמילואידיים, וסבכים (tangles) נוירופיברילריים תוך-תאיים, המכילים את חלבון tau המזורחן באופן בלתי נורמלי (Nordberg וחב' ב-Nat Rev Neurol משנת 2010). פותחו סמנים ב-CSF כמו גם סמנים בבדיקות דימות (Blennow וחב' ב-Nat Rev Neurol משנת 2010, Strozyk וחב' ב-Neurology משנת 2003, Hansson וחב' ב-Lancet Neurol משנת 2006, Fleisher וחב' ב-JAMA Neurol משנת 2020, Leuzy וחב' ב-Eur J Nucl Med Mol משנת 2021, ו-Engelboghs ב-Neurobiol Aging משנת 2008). באנשים חיים, שינויים פתו-פיזיולוגיים הקשורים ל-AD שיכולים להתגלות במדויק על ידי דימות בשיטת PET, וזיהוי של הפיזור והעוצמה של רובדי Aβ וסבכים נוירופיברילריים של tau, כמו אטרופיה של המוח בבדיקת MRI, וכן בהערכה של השינויים ברמות Aβ1-42 ב-CSF והשינויים ברמות סך ה-Tau וה-tau המזורחן. סמנים אלה נמצאים במתאם טוב עם הממצאים באוטופסיה (Ceburger וחב' ב-J Alzheimers Dis משנת 2015, ו-Dubois וחב' ב-Lancet Neurol משנת 2014), ולכן הם נכללים בהערכה הקלינית של AD (על פי ה-NIA-AA). ניוון נוירונלי מוגדר על ידי זיהוי ב-MRI של אטרופיה של ההיפוקמפוס, או על ידי היפו-מטבוליזם של גלוקוזה, עלייה ברמת tau ב-CSF, וכן עלייה ברמת Nfl ב-CSF כאשר Nfl (או neurofilament light chain) הוא חלבון נוירונלי ציטופלזמטי המבוטא באקסונים גדולים עטופי מיאלין.
סך tau
רמות סך-tau ב-CSF משקפות באופן אמין את הניוון הנוירונלי ב-AD. לעומת זאת, רמות tau בפלזמה מראות חפיפה גדולה עם מפגעים אחרים מה שמגביל את יעילות חלבון זה באבחון AD (Mielke וחב' ב-JAMA Neurol משנת 2017, Zetterberg וחב' ב-Alzheimers Res Ther משנת 2013, Simren וחב' ב-Alzheimer Dement משנת 2021, Deters וחב' ב-J Alzheimers Dis משנת 2021, ו-Pase וחב' ב-JAMA Neurol משנת 2019). אף-על-פי-כן יש ראיות לכך שסך tau בפלזמה הוא בעל ערך פרוגנוסטי: רמות גבוהות שלו מנבאות דעיכה קוגניטיבית מהירה יותר וניוון נוירונלי (Rajan וחב' ב-Ann Neurol משנת 2020, Barthelemy וחב' ב-J Exp Med משנת 2020, ו-Muller וחב' ב-Sci Rep משנת 2017). מתאם חלש בין רמות סך-tau בפלזמה וב-CSF מצביע על כך שמרבית tau בפלזמה מגיעה ממקורות היקפיים, כאשר כמות tau בפלזמה שמקורה ב-CSF מהווה רק 20% מכמות tau בפלזמה, וזו כמות קטנה מדי שאינה מאפשרת זיהוי של ניוון נוירונלי (Olivera וחב' ב-JAMA Neurol משנת 2015, ו-Shahim וחב' באותו כתב עת משנת 2014). לפיכך, רמת tau בפלזמה הופכת משמעותית באופן אבחוני רק במפגעים עם יצירה מאוד מוגברת של tau ב-CSF או בהפרשה של tau לנוזלי-גוף כמו בפגיעה מוחית טראומטית, שבץ-מוחי חריף, מחלת Creutzfeldt-Jakob ובחלק מהלוקים במחלת אלצהיימר (Neselius וחב' ב-Brain Injury משנת 2013, Rubenstein וחב' ב-JAMA Neurol משנת 2017, Thompson וחב' ב-Mol Psychiatry משנת 2021, Chen וחב' ב-Nat Commun משנת 2020, ו-Mengel וחב' ב-Ann Neurol משנת 2020). מדידות חלופיות של tau בפלזמה פותחו שאחת מהן מזהה את הקצה ה-N טרמינלי של האפיטופ 6–128 (על פי Snellman וחב' ב-Brain משנת 2022). בדיקה זו היא סמן פרוגנוסטי טוב באלה ללא פגיעה קוגניטיבית והיא יותר ספציפית ל-AD מאשר מדידת Nfl בפלזמה (Guillozet-Bongaarts וחב' ב-Aging משנת 2005, ו-Zhang וחב' ב-Acta Neuropathol משנת 2009). בדיקה זו היא סמן פרוגנוסטי טוב באלה ללא פגיעה קוגניטיבית, בדיקה חדשה למדידת סך-tau המכוונת כנגד הקצה ה-N-טרמינלי של tau מגלה אי-סדירות של Aβ מוקדם יותר ב-AD מאשר מספר בדיקות מבוססות של סך-tau ב-CSF (Zhang וחב' ב-J Biol Chem משנת 2020).
Tau מזורחן במוח, בנוזל השדרה ובדם
המוחות של אנשים חולים ב-AD מכילים tau מזורחן באופן בלתי רגיל כולל את הצורות שעברו truncation כגון P-tau235 (על פי Lantero-Rodriguez וחב' ב-EMBO Mol Med משנת 2021), p-tau181 ו-Karikari) p-tau217 וחב' ב-Alzheimers Dement משנת 2021). Truncated tau נוצר על ידי פרוטאוליזה במהלך העיבוד הפתו-פיזיולוגי (Koss וחב' ב-Acta Neuropathol משנת 2016, Han וחב' ב- Exp Neurol משנת 2017, Sato וחב' ב-Neuron משנת 2018, ו-Mattsson וחב' ב-EMBO Mol Med משנת 2018). בתהליך זה מתרחשת אגרגציה באופן חלקי על ידי השתחררות של אזורי tau המועדים להתפלמר לסבכים (tangles) נוירו-סיביים בלתי מסיסים. הכמות והפיזור של הסבכים הללו, ניתנת להיות מאופיינת in vivo על ידי tau PET ולאחר המוות על ידי אימונוהיסטוכימיה (Mattsson-Carlgren ב-Sci Adv משנת 2020). לעומת זאת, מקטעים של tau מזורחן שמקורם במוח שאינם עוברים אגרגציה ליצירת פיברילות מהווים את פרקציית tau המסיסה (Blennow וחב' ב-Mol Chem Neuropathol משנת 1995), שחלקה משתחרר לתוך ה-CSF ולבסוף מגיע לדם (Leitao וחב' ב-Alzheimers Res Ther משנת 2019, ו-Lifke וחב' ב-Clin Biochem משנת 2019). תהליך זה מושרה באופן ספציפי על ידי הפתולוגיה של Aβ ולכן הוא אינו מתרחש באלה עם נוירופתיות שאינן אלצהיימר והן שליליות ל-Aβ. לפיכך, p-tau ב-CSF הוא סמן פתולוגי בלתי-ישיר של מוח בתרחיש של אלצהיימר שרמתו גדלה בהדרגה במקביל להתקדמות המחלה ובמקביל ליצירה של סבכים נוירופיברילריים (Meredith וחב' ב-PLoS One משנת 2013).
עם זאת, ידוע שצורות tau ב-CSF אינן מוגבלות לאזור המרכזי של המולקולה, אלא מכילות כמויות ניתנות למדידה של האזור המרכזי ושל האזור ה-N טרמינלי (Mattsson וחב' ב-Neurology משנת 2016, Palmqvist וחב'ב-JAMA משנת 2020, Suarez-Calvet וחב' ב-EMBO Mol Med משנת 2020, Karikari וחב' ב-Front Mol Neurosci משנת 2020). מקטעים של tau מהקצה ה-C טרמינלי פחות שכיחים ב-CSF, כיוון שהם נותרים במוח כמרכיבים אינטגרליים של הסבכים הנוירופיברילרים (Bergen וחב' ב-Proc Natl Acad Sci USA משנת 2000). אכן, המקטעים ה-C טרמינליים (לדוגמה חומצות אמינו 306-378) מהווים מבנים חיוניים קדם-פיברילריים העוברים פולימריזציה ליצירת הסבכים הנוירופיברילרים ב-AD (Lathuliere וחב' ב-Sci Rep משנת 2017). יתרה מזאת, motifs שהם hexa-פפטידים באזור של tau הנקשר ל-microtubule נחוצים לאגרגציה של tau ולמעברו בין תאי המוח (Horie וחב' ב-Brain משנת 2020, Blennow וחב' באותו כתב-עת מאותה שנה, Rubenstein וחב' ב-J Neurotrauma משנת 2014, ו-Shekhar וחב' ב-PLoS One משנת 2016). בדומה ל-truncations המגבילות של הפרשת הקצה ה-C טרמינלי של tau לתוך ה-CSF, truncation של חומצת אמינו 224, יכול למנוע שחרור של מקטע זה מה-CSF לדם, מה שמביא לשליטה של המקטע ה-N טרמינלי בדם. אכן, בהשוואה לאנשים בריאים קוגניטיבית ששימשו קבוצת ביקורת, כמויות קטנות משמעותית של רצף חומצות אמינו 226–230 מוצאים בדם של מאובחנים עם AD מה שרומז למעורבות הפוטנציאלית של רצף זה של tau ביצירת הסבכים הנוירו-פיברילריים.
המבנה של חלבון tau והפוספורילציה שלו
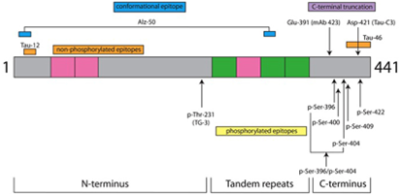
מבנה חלבון tau: חלבון tau מקודד על ידי הגן MAPT ויש לו 6 איזופורמים (עם 352 עד 441 חומצות אמינו במוח של מבוגר, כאשר האיזופורם הארוך ביותר שולט ברקמות היקפיות (Goedert ו-Jakes ב-Biochim Biophys Acta משנת 2005, ו-Hill וחב' ב-Front Mol Neurosci משנת 2020). המבנה של חלבון tau מתחלק לקצה N-טרמינלי, אזור מרכזי, אזור הנקשר ל- microtubule וקצה -C-טרמינלי.
כתוצאה מ-splicing, האזור ה-N-טרמינלי יכול להכיל 0–2 inserts בין חומצות אמינו 45 ו-103. האזור הקושר microtubule מורכב משלושה או ארבעה מקטעי pseudo-repeat (R1-R4). האזור המרכזי מכיל מספר שיירים של threonine ושל serine אשר לפוספורילציה שלהם יש מספר משמעויות פתופיזיולוגיות. אף על פי שלפוספורילציה של tau יש תפקידים פיזיולוגיים, כולל שמירה על ההתכנסות והיציבות של ה-microtubules (Hanger וחב' ב-Trends Mol Med משנת 2009), עודף של פוספורילציה של tau הוא בעל תוצאות פתולוגיות (Braak ו-Braak ב-Acta Neuropathol משנת 1991, ו-2015) שכן מולקולות אלו עוברות בהדרגה אגרגציה למשקעים סיביים בלתי-מסיסים שניתנים לגילוי על ידי בדיקת PET. במצב זה, חלק מהפרקציות המסיסות של p-tau מופרשות באופן הולך וגובר ל-CSF שם הן יכולות להתגלות ולעבור הערכה כמותית כדי לספק באופן בלתי-ישיר מידע על שלב המחלה (Hanger וחב' ב-J Biol Chem משנת 2007). Tau יכול לעבור פוספורילציה במספר אפיטופים כולל בחומצות אמינו 181, 199, 202, 205, 217, 231, 235 ו-396 (על פי Hanes וחב' ב-Neurology משנת 2020, Buerger וחב' ב-Neurology משנת 2002, Karikari וחב' ב-Lancet Neurol משנת 2020, ו-Dage וחב' ב-Alzheimers Dement משנת 2016).
גורמים קדם-אנליטיים יכולים להשפיע על ההדירות של מדידת p-tau בדם. מדידות של ריכוזי p-tau בפלזמת דם שהוכנה במבחנות של EDTA למניעת קרישה, יכולות להניב תוצאות שונות כאשר דגימת הדם נלקחת במונעי קרישה אחרים. לדוגמה, הריכוז המוחלט של p-tau181 בנסיוב, הוא מחצית מריכוזו בפלזמה עם EDTA, וריכוזו בפלזמה שהוכנה במבחנת ציטראט היא 2/3 מזה שבפלזמת-EDTA, אך הוא גבוה יותר בערך ב-82% בפלזמה שהוכנה במבחנת הפארין, מאשר בזו שהוכנה עם EDTA (Grothe וחב' ב-Neurology משנת 2021). אף-על-פי-כן, קיים מתאם חזק לגבי ריכוז p-tau181 בנוגדי קרישה שונים (Thijssen וחב' ב-Lancet Neurol ו-Mattsson-Carlgren ב-Brain משנת 2020). ריכוזי p-tau-181 פוחתים באופן שולי עם הגדלת מספר ההקפאות-הפשרות של הדגימה הן בפלזמת-EDTA וכן בנסיוב, אך ירידה זו בריכוז מתחיל להיות משמעותי לאחר הקפאה-הפשרה רביעית.
המשמעות הקלינית של p-tau בדם
AD קדם-קליני: מצב זה מתייחס לשלב המוקדם של המחלה בו אין עדיין תסמינים קליניים אם כי המטופל נמצא חיובי לסמנים ב-CSF או בבדיקת PET. המטופלים בשלב זה הם חיוביים בדרך כלל ל-Aβ, אך שליליים ל-tau (Shen וחב' ב-Alzheimers Dement משנת 2020). עם זאת, בשלב זה ניכרת כבר פגיעה קלה בקוגניציה והוא מוגדר כ-MCI או mild cognitive impairment. בקרב מבוגרים בגיל מתקדם יותר שאינם פגועים קוגניטיבית, רמת p-tau181 בפלזמה מוגברת באופן שולי באלה שהם חיוביים ל-Aβ לעומת אלה שהם שליליים ל-Aβ. מספר מחקרים מצאו הבדלים משמעותיים בין שתי קבוצות אלו (Smirnov וחב' ב-Acta Neuropathol משנת 2022), אם כי מחקרים אחרים לא מצאו הבדלים כאלה (Lantero-Rodriguez וחב' באותו כתב-עת משנת 2020). מדד p-tau בפלזמה מבדיל באופן מדויק בין אלה עם AD קדם-קליני לבין מבוגרים בגיל מתקדם הבריאים קוגניטיבית ושליליים ל-Aβ (Benussi וחב' ב-J Neurol Neurosurg Psychiatry משנת 2020, ו-Simrén וחב' ב-Alzheimers Dement משנת 2021). במחקר רב-מוסדי הידוע כ- Alzheimer’s Disease Neuroimaging Initiative, נמצא ש- p-tau181 הבדיל בין משתתפי מחקר עם AD קדם-קליני לבין משתתפים שאינם פגועים קוגניטיבית ושליליים ל-Aβ (Brickman וחב' ב-Alzheimers Dement משנת 2021).
במחקרי BioFINDER ו-TRIAD נמצא שכל אחד משני האיזופורמים-p-tau217 ו-p-tau231, מבדיל בין משתתפי המחקרים עם AD קדם-קליני לבין משתתפים בריאים קוגניטיבית שליליים ל-Aβ, טוב יותר מאשר p-tau181, אם כי אחרים מצאו ביצועים דומים. יש ראיות לכך שריכוז p-tau231 בפלזמה מתחיל לעלות לפני שמושג סף הריכוז של מדד זה כאשר Aβ מתקבל חיובי. לפיכך, p-tau231 בפלזמה עשוי להיות שימושי ביותר כאשר נעשה בו שימוש כסמן באופן רציף, בעיקר במצבים של AD קדם-קליני. מחקר אחד מצא שמשתתפי המחקר שהם א-תסמיניים ל-AD משפחתי, הם בעלי רמה מוגברת של p-tau181 בפלזמה שניתן לגלות כבר בערך 16 שנה לפני הופעת התסמינים (Moscoso וחב' ב-JAMA Neurol משנת 2021) .
מחלת אלצהיימר פרודורמלית
רמת p-tau181 בפלזמה מבדילה בין אלה עם MCI החיוביים ל-Aβ לבין אלה עם MCI השליליים ל-Aβ. P-tau231 ו-p-tau217 מבדילים בין אלה עם MCI השליליים ל-Aβו לבין אלה ללא הפרעה קוגניטיבית החיוביים ל-Aβ באופן מדויק יותר מאשר p-tau181. כל שלושת הווריאנטים של p-tau היו גבוהים יותר באלה עם MCI החיוביים ל-Aβ, מאשר באלה עם MCI השליליים ל-Aβ.
שיטיון אלצהיימר
ראיות ממחקרים רבים מעידים על כך שרמות סמני p-tau בדם גדלות עם התקדמות AD, ומגיעות לשיאן בשלב השיטיון הסופני (Moscoso וחב' ב-Brain משנת 2020, Clark וחב' ב-Alzheimers Res משנת 2021, Tissot וחב' ב-Alzheimers Res Ther משנת 2021, Chong וחב' ב-Alzheimers Dement משנת 2021, Lussier וחב' ב-Brain Commun משנת 2021, ו-Mielke וחב' ב-JAMA Neurol משנת 2021). רמת p-tau בפלזמה מבדילה במדויק בין אלה עם שיטיון מוחלט וחיוביים ל-Aβ לבין אלה ללא פגיעה קוגניטיבית החיוביים או שליליים ל-Aβ, לבין אלה עם MCI השליליים ל-Aβ, לבין אלה עם MCI החיוביים ל-Aβ (Andreasson וחב' ב-Front Neurol משנת 2015). גם רמות p-tau בנסיוב נתנו תוצאות דומות. בקבוצת המחקר של Alzheimer’s Disease Neuroimaging Initiative (להלן ADNI) המשמעות האבחונית של p-tau בפלזמה, דומה לזו של p-tau ב-CSF אך טובה יותר מאשר Nfl (או neurofilament light chain) בפלזמה. במדגם BioFINDER-2 שכלל 763 משתתפים, רמות p-tau181 בפלזמה הבדילו היטב בין אלה עם שיטיון AD החיוביים ל-Aβ לבין אלה שאינם פגועים קוגניטיבית השליליים ל- Aβ לבין אלה עם MCI השליליים ל-Aβ. עם זאת, במחקר המשך של BioFINDER-2 שכלל 699 משתתפים, רמת p-tau217 הייתה מדד מדויק יותר מ-p-tau181 בהבדלה בין אלה עם AD החיוביים ל-βbeta לבין אלה שאינם פגועים קוגניטיבית השליליים ל-Aβ, ובין אלה עם MCI השליליים ל-βA (Paskett וחב' ב-Contemp Clin Trials משנת 2008). במחקר באוכלוסייה רב-אתנית, p-tau181 ו-p-tau217 נתנו תוצאות דומות בהבדלה בין משתתפים עם AD לבין קבוצת ביקורת בריאה. P-tau231 בפלזמה הבדיל היטב את אלה עם AD החיוביים ל-Aβ לבין אלה ללא פגיעה קוגניטיבית השליליים ל-Aβ. במדגם ADNI, רמת p-tau181 הבדילה בין מאובחנים עם AD החיוביים או שליליים ל-Aβ. עם זאת, קלסיפיקציה של אלה החיוביים או שליליים ל- Aβ מסובכת בגלל אי ההתאמה בין מדידות של Aβ ב-CSF לבין בדיקות PET בהערכת הפתולוגיה של Aβ.
הוראות למדידת p-tau
לקביעת ריכוזי p-tau בפלזמה ובנסיוב מאותם נבדקים, דם נלקח במבחנות EDTA או במבחנה כימית רגילה (פקק צהוב או אדום), והמבחנות סורכזו תוך שעתיים מנטילת הדם במהירות של 2,000g למשך 10 דקות והנוזל העליון נשמר ב-80°C- עד לבדיקה. דגימת CSF נלקחה על ידי lumbar puncture, סורכזה באותם תנאים והוקפאה אף היא ב-80°C-. לצורך הבדיקה הדגימות הופשרו, טולטלו ב-vortex, וסורכזו למשך 10 דקות במהירות 4,000g. האיזופורמים p-tau181 ו- p-tau231 נמדדו בפלזמה מהולה פי-2, בנסיוב מהול פי-2 או ב-CSF מהול פי-30, בשיטת Simoa שהיא שיטת immunoassay אוטומטית אולטרה-רגישה (פי-1,000 מאשר שיטות רגילות) המבוססת על בידוד של אימונו-קומפלקסים אינדיבידואליים על beads paramagnetic תוך שימוש בראגנטים סטנדרטיים של ELISA. ערכת Simoa לצורך כימות p-tau היא SimoaTM pTau-181 Advantage V2 kit הנרכשת מ- Quanterix (Billerica, MA, USA). בקצרה, שני סוגי נוגדנים חד-שבטיים מעכבר הספציפיים כנגד p-tau, הידועים כ- ADx253 (נרכשים מ-ADx NeuroSciences), ו- AT270 (נרכשים מ-Thermo Fisher) שימשו ללכידת p-tau231 ו-p-tau181, בהתאמה. שני המבדקים עושים שימוש בנוגדן Tau12 (BioLegend) לזיהוי שני האיזופורמים.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק