פוספטידיל אתאנולאמין - Phosphatidylethanolamine
| מדריך בדיקות מעבדה | |
| פוספטידיל אתאנולאמין | |
|---|---|
| Phosphatidylethanolamine | |
| |
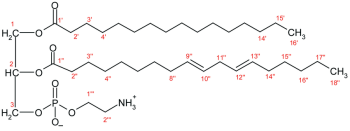
מבנה סכימטי של PE
| |
| מעבדה | כימיה |
| תחום | פוספוליפידים בממברנות תאים. |
| יוצר הערך | פרופ' בן-עמי סלע |
Phosphatidylethanolamine (להלן PE) הוא פוספוליפיד הנמצא בממברנות ביולוגיות (Wellner וחב' ב-Biochim Biophys Acta משנת 2012). הסינתזה שלו מתחילה בהוספה של cytidine diphosphate-ethanolamine ל-diglycerides, תוך שחרור של cytidine monophosphate. בהמשך, S-Adenosyl methionine יכול לגרום למתילציה של ה-amine ב- phosphatidylethanolamines ליצירה של phosphatidylcholine. PE נמצא בעיקר בעַלְעַל (leaflet) הפנימי (ציטופלזמי) של ה-lipid bilayer (Mishkind ב-Trends Cell Biol משנת 2000).
הפיזיולוגיה של PE
PE נמצא בכל התאים כשהוא מהווה 25% מכלל הפוספוליפידים בתא. בפיזיולוגיה של האדם, PE נמצא בעיקר במערכת העצבים כגון בחומר הלבן במוח, בחוט השדרה ובעצבים שם הוא מהווה עד 45% מכלל הפוספוליפידים (Vance ו-Tosseva ב-Biochim Biophys Acta משנת 2012).
PE משחק תפקיד באיחוי של ממברנות וכן בפירוק של ה-contractile ring במהלך הציטוקינזה של חלוקת התא (Emoto וחב' ב-Proc Natl Acad Sci USA משנת 1996). במהלך חלוקת תאים, ה-contractile ring מייצר את הכוח המכווץ הנחוץ להפרדת תא אם לשני תאי-בת. בשלב האחרון של חלוקת התא, הציטוקינזה, נוצר ה-contractile ring המורכב מ-actin סיבי ומ- myosin-2 ביחד עם חלבונים מבניים ורגולטוריים נוספים. נהוג לחשוב ש-PE מווסת גם את עקמומיות הממברנה, והוא מהווה קודמן (precursor) מצע, ו-donor במספר מסלולים ביולוגיים.
PE הוא בעל מבנה קוטבי (polar) ותורם לממברנה ליפידית צמיגה יותר בהשוואה לפוספטידיל-כולין (להלן PC). לדוגמה, טמפרטורת ההתכה של di-oleoyl-PE היא מינוס 16 מעלות צלזיוס, בעוד שטמפרטורת ההתכה של של di-oleoyl-PC היא מינוס 20 מעלות צלזיוס, אם לליפידים היו שתי שרשראות palmitoyl, PE היה מותך ב-63 מעלות צלזיוס, ואילו PC היה מותך ב-41 מעלות צלזיוס. טמפרטורת התכה נמוכה יותר מתאימה לממברנות יותר פלואידיות (Wan וחב' ב-Biochemistry משנת 2008).
תפקוד ביולוגי של PE
אף על פי ש-PE היה מושווה לעיתים ל-PC במערכות ביולוגיות, ישנם הבדלים משמעותיים בכימיה והתכונות הפיזיקליות של שני ליפידים אלה, שאמורים לגרום לתפקידיהם השונים בתהליכים ביוכימיים. PE ו-PC הם מרכיבי מפתח ב-bilayers הממברנליים והיחס בין השניים יכול להיות חשוב בתפקודים תאיים רבים. עם זאת, ל-PE יחידת ראש קטנה יותר, מה שמקנה ל-PE צורת חרוט. משערים ש-PE מקנה לחץ לטרלי חיוני במודולציה של עַקְמוּמִיּוּת או הקֶמֶר של הממברנה, מה שמייצב את חלבוני הממברנה בקונפיגורציה האופטימלית שלהם. PE יכול ליצור קשרי-מימן בין-מולקולריים עם ליפידים שכנים, וכן עם חלבונים דרך קבוצת הראש הקוטבית שלו. לדוגמה, שייר הפוספאט יכול להיות מיוצב בנקודת הקישור שלו לשיירי ליזין או ארגינין, או בנקודת הקישור שלו עם הידרוקסילים של שיירי טירוזין. יש גם אינטראקציות חזקות עם שרשראות acyl של הפוספוליפיד. בניגוד ל-PC ,PE מרוכז עם עם PS ב-leaflet הפנימי של ה-plasma membrane. מאידך גיסא, PE נמצא בחלקים הפנימי והחיצוני של ממברנת המיטוכונדיה אם כי בעיקר בחלק הפנימי, שם הוא נמצא ברמות גבוהות בהרבה מאשר באבְרוֹנים (organelles) אחרים, ומעודד איחוי של חלבונים ותנועתם בממברנה, בתוספת לעוד תפקודים מיטוכונדיאליים, כולל פוספורילציה חמצונית דרך שרשרת הטרנספורט של אלקטרונים. PE הוא מרכיב תפקודי חשוב בנקודת המגע הממברנלית בין המיטוכונדריה לבין הרטיקולום האנדופלזמטי.
PE באדם
בבני אדם, המטבוליזם של PE חשוב בלב. כאשר דם זורם ללב באופן מוגבל, החלוקה הא-סימטרית של PE בין ה-leaflets בממברנה משתבשת, וכתוצאה מכך הממברנה נפגעת. בנוסף, PE משחק תפקיד בהפרשה של ליפופרוטאינים בכבד. זאת כיוון שהבועיות (vesicles) המפרישות ליפופרוטאינים מסוג VLDL הנפלטות מה-Golgi apparatus, הן בעלות ריכוז גבוה בהרבה של PE בהשוואה לבועיות אחרות המכילות VLDL (Vance ב-J Lipid Res משנת 2008). נמצא גם ש-PE מסוגל גם להפיץ prions מדביקים, ללא סיוע של חלבונים או של חומצות גרעין (Deleault וחב' ב- Proc Natl Acad Sci USA משנת 2012). סבורים ש-PE משחק תפקיד בקרישת דם, בהיותו פועל יחד עם עם פוספטידיל-סרין (להלן PS) בהגברת קצב יצירת תרומבין, על ידי סיוע להתקשרות לפקטורי קרישה V ו-X, שני החלבונים המקטלזים יצירת תרומבין מפרותרומבין (Majumder וחב' ב-J Biol Chem משנת 2011). גם הסינתזה של האנדו-קנבינואיד anandamide נוצרת מ-PE על ידי הפעולה הרצופה של שני אנזימים, N-acetyltransferase ו-phospholipase-D (Isidro ב-Front Pharmacol משנת 2014).
PE בחיידקים
בעוד ש-PC הוא פוספוליפיד דומיננטי בחיות, הרי ש-PE הוא הפוספוליפיד הראשי בחיידקים. אחד התפקידים החשובים של PE בממברנות של חיידקים, הוא בהפרדה של המטען השלילי הנתרם על ידי הפוספוליפידים האניוניים בממברנות של חיידקים. ב-E. coli יש ל-PE תפקיד בסיוע לטרנספורט אקטיבי של lactose permease לתוך התא. PE פועל גם כ-"Chaperone" בסיוע לחלבוני הממברנה להתקפל וליצור מבנה שלישוני ראוי המאפשר להם פעילות סדירה. בחסר של PE, יש לחלבוני הטרנספורט מבנה שלישוני שגוי ופעילותם משובשת (Christie ב-AOCS Lipid Library משנת 2012).
המבנה והסינתזה של PE
בהיותו lecithin, מורכב PE משילוב של גליצרול שעבר אסטריפיקציה עם 2 חומצות שומן וחומצה פוספורית. בעוד ששייר הפוספאט מתחבר עם choline ב-PC, הוא מתחבר עם אתנול-אמין ב-PE. שתי חומצות השומן יכולות להיות זהות או שונות, והן בדרך כלל בעמדה 1,2 של הגליצרול, אך גם יכולות להיות בעמדה 1,3 שלו. מסלולי ה-phosphatidylserine decarboxylation ו-cytidine-diphosphate ethanolamine משמשים לסינתזה של PE. האנזים phosphatidylserine decarboxylase גורם לדה-קרבוקסילציה של פוספטידיל-סרין במסלול הראשון, המהווה את עיקר הסינתזה של PE בממברנות של המיטוכונדריה, ו-PE בממברנה האחרונה אף מועבר לממברנות אחרות בתא. PE מיוצר דרך מסלול ה-cytidine-diphosphate ethanolamine תוך שימוש ב-ethanolamine כמצע. דרך מספר צעדים הן בציטוזול וכן ברטיקולום האנדופלזמטי, מסלול הסינתזה מייצר את תוצר הקצה, PE (Kelly ב-AOCS Lipid Library משנת 2011). מוצאים PE גם בלציטין ביצה.
הסינתזה של PE דרך מסלול הדה-קרבוקסילציה של PS מתרחשת במהירות בממברנה הפנימית של המיטוכונדריה. עם זאת, PS נוצר ברטיקולום האנדופלזמטי. מכיוון שכך, הטרנספורט של PS ממקום ייצורו לממברנה המיטוכונדריאלית ומשם לממברנה הפנימית של המיטוכונדריה, מגביל את קצב הסינתזה של PE במסלול זה (Kuge ו-Nishijima ב-J Biochem משנת 2003).
בעיקר יש ל-PE מעורבות על ידי סיוע לטרנספורט אקטיבי של האנזים lactose permease ומערכות טרנספורט אחרות. יש ראיות לכך ש-PE פועל כ"chaperone" במהלך ההַרְכָּבָה של חלבוני ממברנה, הן בהתקפלות הנכונה שלהם, ובמעברם מהציטופלזה לממברנה. PE נקשר באופן לא-קוולנטי למשפחת-על של חלבונים ציטוזוליים עם תפקודים רבים, הידועים כחלבונים קושרי-PE (Yeagle ב-Biochim Biophys Acta משנת 2014). בעוד שארבעה חברים במשפחה זו (PEBP1-4) זוהו ביונקים, למעלה מ-400 חברים במשפחה זו שהשתמרו במהלך האבולוציה ידועים בחיידקים וב-eukaryotes גבוהים יותר. חלבונים אלה הם בעלי תפקודים רבים כגון התקשרות לליפידים, התפתחות נוירונאלית, עיכוב של serine protease ורגולציה של מספר מסלולי איתות. PEBP4, בהיותו מבוטא באופן ניכר במספר רב של סוגי סרטן שונים, בהם הוא מסוגל להגביר עמידות לתרפיות שונות. ברקמות של בעלי חיים, PE חשוב במיוחד בממברנת הסרקולמה הלבבית שהיא ממברנה דקה העוטפת סיבי שריר מפוספס בלב במהלך אי-ספיקה, והוא מעורב גם בהפרשה של VLDLs מהכבד. ל-PE יש גם תפקיד בפעילות האנזים ATPase-+Ca2 בכך שמולקולת PE אחת קשורה בחלל שבין שני סלילים טרנס-ממברנליים, ופועלת כטְרִיז המפריד ביניהם. במיטוכונדריה, הסינתזה של PE בממברנה הפנימית קריטית לתפקוד של הקומפלקס cytochrome be1, בו יש אתר קישור משומר של PE בתת-יחידה ספציפית. רבים מהחלבונים החשובים האחרים קושרים PE באופן לא-קוולנטי, כולל rhodopsin ו-aquaporins. כמות PE בחלקיקים מופרשים חדשים של VLDL, ובחלקיקים המכילים apoB מבודדים המופיעים בנהור (lumen) של Golgi, גבוהה בהרבה מזו שנמצאת בחלקיקים של VLDL בצירקולציה, מה שמצביע על כך ש-PE משתתף בהרכבה ובהפרשה של VLDL, אלא ש-PE מורחק במהירות מחלקיקי VLDL בצירקולציה.
אוטופגיה ופרופטוזיס: (או אוטופאגוציטוזיס) הוא המנגנון הטבעי שגורם להרס ופירוק של מרכיבים תאיים לא מתפקדים או לא נחוצים, דרך תהליך מבוקר.
Ferroptosis הוא סוג של מות תאים מתוכנת התלוי בברזל המאופיין על ידי הצטברות של lipid peroxides, ושונה מאפופטוזיס. Ferroptosis מאותחל על ידי הכישלון של מנגנוני הגנה נוגדי חמצון התלויים בגלוטתיון, מה שגורם לפראוקסידציה בלתי מבוקרת של ליפידים, ובדיעבד למות התא. קוניוגט קו-וולנטי של PE עם חלבון הידוע כ-Atg8, נוצר על ידי הפעולה של האנזים cysteine protease הידוע כ-ATG4, השייך למשפחת ה-caspase, ומעורב בתהליך ה-autophagy באצות. באופן דומה, PE העובר שינוי בתהליך חמצוני הוא גורם חשוב בתהליך ה-ferroptosis. PE הוא מווסת מרכזי בפלואידיות של ממברנות באאוקריוטים ( Dawaliby וחב' ב-J Biol Chem משנת 2016).
PE כקודמן של ליפידים אחרים
PE הוא קודמן של הסינתזה של N-acyl-PE וכתוצאה מכך גם בסינתזה של anandamide (או N-arachidonoylethanolamine) ובנוסף PE הוא donor של ethanolamine phosphate במהלך הסינתזה של glycosylphosphatidylinositol המקשר בין חלבוני איתות רבים לבין ה-plasma membrane (Coulon וחב' ב-Biochimie משנת 2012, ו-Wellner וחב' ב-Biochim Biophys Acta משנת 2013). PE משמש גם מצע לאנזים הכבדי phosphatidylethanolamine N-methyl transferase, המספק בערך שליש מכמות PC בכבד. PE הוא גם קודמן של שייר ה-ethanolamine phosphoglycerol הקשור לשני שיירים משומרים של glutamate בפקטור ה-elongation 1A באאוקריוטים, שהוא מרכיב חשוב בסינתזת חלבונים.
אינטראקציות של חלבונים
לחלבוני ממברנות יש מספר רב של תפקודים ביוכימיים, כולל טרנספורט, יצירת אנרגיה, ביוסינתזה, איתות וקומוניקציה בין-תאית. בתוך הממברנה, רוב החלבונים האינטגרליים מורכבים ממקטעים טרנס-ממברנליים α-סלילוניים הידרופוביים הקשורים ביניהם על ידי לולאות הידרופוביות. באותם חלקים של החלבונים הנמצאים מחוץ ל-bilayer, השיירים הטעונים חיובית הרבה יותר שכיחים בצד הציטופלזמי של חלבוני הממברנה מאשר בחלק הטרנס של חלבונים אלה. נראה של-PE יש תפקיד מפתח בגין היותו מעכב את מיקומן של חומצות אמינו טעונות שלילית בצד הציטופלזמי של הממברנה. רבות מהראיות על התכונות הייחודיות של PE מגיעות ממחקרים ביוכימיים בחיידק E. coli בו PE מהווה מרכיב חשוב בממברנה.
אנליזה של PE
בשיטות המסורתיות הקודמות היה מקובל להפריד בין PE לפוספוליפידים אחרים על ידי כרומטוגרפיה ברובד דק (TLC) או על ידי HPLC. הגישה המודרנית היא בהפרדה וכימות בשיטה מס-ספקטרומטרית. השיטה המקובלת היא אנליזה של N-modified-PE תוך שימוש ב-CH3NH2 לצורך דה-אצילציה (Guo וחב' ב-Anal Chem משנת 2010): לדגימה הביולוגית יש להוסיף internal standard שהוא C17:0 NAPE. המיצוי של הפוספוליפידים מתבצע עם כלורופורם-מתנול (1:2), מלווה על ידי ייבוש על ידי חנקן ממוס בכלורופורם, מיצוי solid phase ב-silica cartridge מלווה על ידי נידוף בחנקן מומס בריאגנט methylamine (או CH3NH2/methanol/1-butanol ביחסים 4:4:1). לאחר הדגרה של שעה בטמפרטורה 53 מעלות צלזיוס, מתבצעת ההזרקה ל-LC/MS/MS.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 