אינסולין - Insulin
| אינסולין - Insulin | ||
|---|---|---|
| 250px | ||
| Computer-generated image of six insulin molecules assembled in a hexamer, highlighting the threefold symmetry, the zinc ions holding it together, and the histidine residues involved in zinc binding. Insulin is stored in the body as a hexamer, while the active form is the monomer | ||
| שם גנרי | "אינסולין" (קישור לדף התרופה במאגר משרד הבריאות) |
|
התוויות |
||
| יוצר הערך | פרופ' מייקל ווקר; פרופ' אלעזר שפריר; פרופ' איתמר רז; ד"ר חוליו וינשטיין פרק הטיפול באינסולין בשאיפה עודכן על ידי ד"ר אורית קרני-רחקוביץ' במרץ 2018 |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אינסולין
אינסולין מופרש בתגובה לשינויים ברמת הגלוקוז (Glucose) בדם, וממלא תפקיד חיוני בבקרה על אחסון האנרגיה בגוף ושחרורה במצבי שובע וצום. אינסולין מיוצר באופן בלעדי על ידי תאי בטא (Beta cells), הממוקמים באיי לנגרהנס (Islets of Langerhans). הוא מורכב משתי שרשרות פוליפפטידיות (Polypeptides): שרשרת ה-A הבנויה מ-21 חומצות אמינו (Amino acids) ושרשרת ה-B הבנויה מ-30 חומצות אמינו. שתי השרשרות מחוברות באמצעות קשרים דיסולפידיים (Disulphide), ומקופלות יחד תוך יצירת מולקולה קומפקטית (Compact molecule) עם גרעין הידרופובי (Hydrophobic), הנתון במעטפת הידרופילית (Hydrophilic).
מדובר בהורמון אנבולי (Anabolic hormone) מובהק, הנקשר לקולטן ומפעיל מערכת איתות תאית באמצעות Tyrosine kinase המצוי על גבי הקולטן. תאי בטא מגיבים לסיגנלים (Signals) הללו, ובהתאם מגבירים את הפרשת האינסולין. השריר, רקמת השומן והכבד הם רקמות המטרה העיקריות של אינסולין.
לקריאת מדריכים בקהילת סוכרת סוג 1
ההתקדמות בתחילת שנות האלפיים הביאה להכרת שני מסלולי האיתות של אינסולין, האיתות המטבולי (Metabolic) והאיתות המיטוטי (Mytotic), אשר יכול להשפיע על ביטוי גנים (Genes) וחלוקת תאים. שני המסלולים מופעלים על ידי Tyrosine kinase על גבי הקולטן ופועלים בעזרת שורת חלבוני איתות ספציפיים (Specific) העוברים זרחון ומשמשים כאמצעים להעברת המסר. מאידך, הבקרה על פעולת האינסולין מבוצעת על ידי פוספטאזות (Phosphatases), או על ידי זרחון מוגבר של Serine.
ייצור אינסולין בגוף
אינסולין הוא הורמון קריטי המשחק תפקיד מרכזי בשמירה על איזון מטבולי בגוף. זהו חלבון דו-שרשרתי בעל משקל מולקולרי (Molecular) של 5.8 kDa (KiloDalton) המורכב מ-51 חומצות אמינו ומיוצר באופן בלעדי על ידי תאי בטא. תאים אלה ממוקמים באיי לנגרהנס, צבר תאים אנדוקריניים (Endocrine) בלבלב. אינסולין מאותת לגוף על ספיגת מזון כאשר רמת הגלוקוז בדם עולה בעקבות ארוחה. תאי בטא מזהים שינויים אלה, ובהתאם מגבירים את הפרשת האינסולין.
ייצור האינסולין בתאי הבטא הוא תהליך מורכב הכולל שלבים רבים. חלק מהשלבים מבוצעים על ידי מנגנון תאי ייחודי שאינו קיים בתאים אחרים. התהליך כולל שעתוק של גן (Gene) האינסולין, תרגום ועיבוד חלבון הקדם-קדם-אינסולין (Pre-Proinsulin) והמרתו לאינסולין. הפרשת האינסולין מווסתת על ידי רמת הגלוקוז בדם וגורמי הפרשה אחרים, וביניהם מרכיבי מזון, הורמונים ונוירוטרנסמיטורים (Neurotransmitters).
בזרם הדם, אינסולין פועל לאחסון אנרגיה במגוון רחב של תאים, כשהחשובים ביניהם הם תאי הכבד, השריר והשומן. פעולה זו מבוצעת על ידי סדרה של תגובות, הכוללת הגברת הקליטה של גלוקוז בתאי השריר והשומן, הקטנת הפרשה של גלוקוז על ידי הכבד, הגברת ייצור גליקוגן (Glycogen) בשריר ובכבד והגברת ייצור חומצות שומן על ידי הכבד.
אינסולין הוא הורמון חיוני והגוף אינו יכול לפצות על חסרונו. חשיבותו המרכזית של אינסולין מודגשת ביתר שאת בסוכרת מסוג 1 (Insulin Dependent Diabetes Mellitus ,IDDM). במחלה זו קיים אבדן מוחלט של תאי בטא בשל תהליך אוטואימוני (Autoimmune), וכתוצאה מכך נוצר מחסור באינסולין שמוביל להיפרגליקמיה (Hyperglycemia) כרונית. ללא טיפול, אותה היפרגליקמיה תגרום בסופו של דבר למות החולה[1].
הצורך לשלוט בצורה מדויקת ברמות האינסולין בדם מודגם בסוכרת מסוג 2 (Non-Insulin Dependent Diabetes Mellitus ,NIDDM). במחלה זו ממשיכים תאי הבטא ליצור אינסולין, אך ההפרשה משובשת, וכתוצאה מכך רמות האינסולין אינן מספיקות. מצב זה, בצירוף עם פגם מטבולי נוסף - תנגודת לאינסולין בתאי ההיקף - מוביל להתפתחות של סוכרת[2]. בשל תפקידו המרכזי של האינסולין בהתפתחות הסוכרת, אחד משטחי המחקר האינטנסיביים מוקדש למנגנון הפרשת האינסולין על ידי תאי הבטא.
תא הבטא הוא תא מורכב ומתוחכם, המגיב למספר גדול של גירויים פיזיולוגיים (Physiological) בצורה מתוזמנת[3]. כתוצאה מכך, התא יודע לייצר את הכמות הנכונה של אינסולין. למעשה, ניתן לראות את תא הבטא כ"בית חרושת לאינסולין"[4], המותאם לייצור כמויות גדולות של הורמון פעיל. ההורמון ארוז בגרנולות (Granules) תוך-תאיות הנקראות "גרנולות הפרשה" (Secretory granules), באופן המאפשר את תגובתו המהירה לגירויים פיזיולוגיים.
שעתוק
גן האינסולין האנושי ממוקם על כרומוזום (Chromosome) 11 (בעמדה 11p15).[5] הגן מורכב משלושה אקסונים (Exons) ושני אינטרונים (Introns) ומדגים שימור גבוה לאורך האבולוציה (Evolution). השלב הראשון בביטוי המידע הגנטי בכל התאים כולל העברת מידע מ-DNA (DeoxyriboNucleic Acid) ל-RNA" שליח" (Messenger RiboNucleic Acid ,mRNA). תהליך השעתוק של גן האינסולין, בדומה לשלב הראשון בתהליכים ביולוגיים רבים, מבוקר היטב. רמת ה-mRNA של אינסולין בתאים שאינם תאי בטא נמוכה מאוד, על סף גבול אפשרות הזיהוי. ריכוזו המוערך של ה-mRNA של אינסולין בתאי בטא גבוה, לפחות פי 100,000 בהשוואה לתאים שאינם תאי בטא[6].
- המנגנונים המובילים להבדלים העצומים בריכוזי האינסולין
ההבדלים בכמויות ה-mRNA בין סוגי התאים השונים נובעים מסיבות שונות, כגון יעילות שונה של תהליך השעתוק, הבדלים ביעילות עיבוד השעתוק הראשוני (Pre mRNA) או הבדלים ביציבות RNA. תהליך השעתוק עצמו, כפי שמודגם בשיטת "גן מדווח" (Reporter gene), הוא התורם המשמעותי לביטוי הספציפי. לפיכך, ההבדל המכריע בין תאי בטא לתאים אחרים הוא ביכולתו הייחודית של תא הבטא לשעתק את גן האינסולין ביעילות רבה[7].
מספר רצפי DNA קצרים, החיוניים לשעתוק הספציפי של גן זה, זוהו בעזרת מוטגנזה (Mutagenesis) של אזור בגן האחראי לשעתוק (פרומוטור, Promotor) של גן האינסולין. חשיבותם של רצפים אלה הוכחה מאוחר יותר: לאזורים אלו ישנה היכולת להיות מוכרים על ידי מספר גורמי שעתוק[8], שהם חלבונים המסוגלים לזהות ולהיקשר לרצף DNA באופן ספציפי. לאחר הקישור, עוברים גורמים אלה אינטראקציה (Interaction) עם מערכת השעתוק של התא, הכוללת את האנזים; RNA polymerase II, וכך מגבירים את יעילות השעתוק[9]. הגורמים המעורבים בתהליך השעתוק הסלקטיבי (Selective) בתאי בטא כוללים את החלבונים: PDX1 ,BETA2 ,E2A. חשיבותם של גורמים אלה הודגמה בניסויים שבהם הם בוטאו בצורה מלאכותית בתא שאיננו תא בטא. בנסיבות אלו הוביל הביטוי של PDX1 ,BETA2 ,E2A להפעלה סינרגיסטית (Synergistic) ויעילה של פרומוטור האינסולין[6].
לחלבון PDX1 יש משמעות מיוחדת בתאי בטא. בעכברי מעבדה שאין להם את החלבון (Knockout mice) לא התפתח לבלב בכלל[10]. תוצאה דומה נצפתה בבני אדם, כאשר מוטציה בגן PDX1 [הקרוי IPF1 (Insulin promoter factor 1) בבני אדם] מנעה את התפתחות הלבלב[11]. לפיכך ניתן להסיק כי PDX1-1, בנוסף לתפקידו כגורם שעתוק הנחוץ לביטוי אופטימלי של גן האינסולין בתאי בטא בוגרים, משמש גם כגן מבקר התפתחות: נוכחותו חיונית להתפתחות הלבלב, כולל מרכיביו האקסוקריניים (Exocrine) והאנדוקריניים (Endocrine). תפקיד זה בא לידי ביטוי בשלבי ההתפתחות העוברית, עוד לפני הופעתם של תאי בטא ראשוניים.
- חשיבותו של PDX1 בהתפתחות הלבלב עוררה את השאלה
- האם ביטויו של PDX1 בתאים שאינם תאי בטא יכול לגרום לביטוי גן האינסולין השקט בתאים אלה?
מצב זה יכול להתרחש בתנאים מסוימים: ביטוי של PDX1 בכבד עכבר גורם ליצירת אינסולין בכבד ומאפשר לעכברים לשמור על רמות גלוקוז כמעט תקינות, גם לאחר הרס תאי הבטא[12]. גלוקוז גורם להגברת שעתוק הגן לאינסולין במספר מנגנונים שונים:[9]
- גלוקוז משנה את היכולת של PDX1 להיקשר לפרומוטור של אינסולין, ככל הנראה בעקבות זרחון (Phosphorylation)
- גלוקוז משנה את היכולת של PDX1 לתקשר ישירות עם מנגנוני השעתוק[13]
- גלוקוז מגביר את קישור קומפלקסי (Complexes) השעתוק BETA2/E2A אל הרצפים המזוהים על הפרומוטור[14]
קיימים דיווחים על ביטוי של גן האינסולין ברמות נמוכות גם בתאים שאינם תאי לבלב, למרות שביטוי יעיל של גן האינסולין מתרחש רק בתאי בטא בלבלב[15]. בשל כך, לביטוי האינסולין בתימוס (Thymus) יש תפקיד חשוב בקביעת הסיכוי לחלות בסוכרת מסוג 1. מחקרים בעכברים הוכיחו בצורה חד-משמעית כי רמות האינסולין בתימוס משפיעות על הסבילות (Tolerance) האימונולוגית (Immunological) לאינסולין ועל חומרת הסוכרת בצורה משמעותית[15]. הגוף מזהה ביטוי של אנטיגנים (Antigens) בתימוס כחלבון עצמי ואינו מפתח תגובה חיסונית נגדם. ביטוי של אינסולין בתימוס מפחית את התגובה האוטואימונית ומקנה עמידות לסוכרת מסוג 1. לעומת זאת, ביטוי של אינסולין בתימוס ברמה נמוכה בלבד מגביר את הסיכוי לחלות במחלה.
אותרו מספר אתרים גנטיים הקשורים לשינויים ברגישויות לסוכרת מסוג 1. אחד מאתרים אלה, שמכיל מספר משתנה של רצפי DNA חוזרים (VNTR, Variable Number Tandem Repeat), ממוקם 360 נוקליאוטידים (Nucleotides) במעלה הזרם (Upstream) מנקודת התחלת שעתוק גן האינסולין. וריאנטים שונים באזור זה קשורים בשינויים בשעתוק גן האינסולין בתימוס. רמות ביטוי גבוהות יותר, כמו בעכבר, נמצאות במתאם עם הגנה מפני התפתחות של סוכרת מסוג 1[15].
תרגום ועיבוד החלבון
ה-mRNA של אינסולין מתורגם לפרקורסור (Precursor) בעל 91 חומצות אמינו, הידוע בשם 3-Pre-proinsulin. פרקורסור זה מכיל "פפטיד איתות" (Signal peptide) בעל 20 חומצות אמינו, שרשרת B (30 חומצות אמינו), שרשרת C (20 חומצות אמינו) ושרשרת A (21 חומצות אמינו). חיתוך של "פפטיד האיתות" נעשה בתוך הרטיקולום האנדופלסמטי (Endoplasmic Reticulum ,ER) על מנת ליצור קדם-אינסולין (פרו-אינסולין, Proinsulin).
מולקולת הפרו-אינסולין מועברת דרך מערכת הגולג׳י (Golgi apparatus) לתוך גרנולות מפרישות. מהפרו-אינסולין מוסרת שרשרת אחת, ה C-Peptide, באמצעות חיתוך פרוטאוליטי (Proteolytic) על ידי שלושה אנזימים:[16] האנדופרוטאזות (Endoproteases) PC2 ,PC1/3 והאקסופפטידאז (Exopeptidases) Carboxypeptidase H (CPH). לאחר החיתוך, נוצר האינסולין הבוגר, המכיל שרשראות B -A המחוברות על ידי קשרים דיסולפידיים. תהליך התרגום מבוקר בצורה הדוקה על ידי גלוקוז ומרכיבים תזונתיים נוספים. המנגנון המעורב בפעולה זו אינו ברור, אך נראה כי הוא ייחודי לתאי בטא ומופעל על ידי איתותים ספציפיים המזהים רצפים בחלקים הלא מתורגמים של ה-mRNA של אינסולין.
פרו-אינסולין מומר לאינסולין בתוך גרנולות ההפרשה בעזרת פעילות משותפת של PC1/3 .CPH- PC2 ,PC1/3 חותך בחיבור בין הפפטידים C-B, ואילו PC2 חותך בעדיפות באזור החיבור בין הפפטידים CPH .A- C אחראי להשלמת התהליך על ידי חיתוך חומצות אמינו בסיסיות בצמתי החיתוך. תהליך זה מבוקר על ידי גלוקוז, אשר מעורר את הפיכת הפרו-אינסולין לאינסולין על ידי בקרת ייצורם של האנזימים PC1/3 ו-PC2.[16]
הפרשת אינסולין
האינסולין המאוחסן בגרנולות בלבלב מופרש מתאי בטא בעקבות גירוי פיזיולוגי. האינסולין מופרש מתאי הבטא אל מערכת הדם הפורטלית (Portal) בצורה פעימתית, כאשר כ-40–50 אחוזים מן הכמות המופרשת נקלטת בכבד ומשמשת לצרכיו המטבוליים והשאר מועבר למחזור הדם הכללי.
ההפרשה היומית של האינסולין היא בערך 0.5-0.3 יחידות לקילוגרם משקל גוף, כאשר תכולת הלבלב במועד נתון היא כ-250 יחידות. מן ההיבט התפקודי ניתן לחלק את הפרשת הלבלב לשני חלקים:
- הפרשה בסיסית בין הארוחות, שהיא כ-50 אחוזים מן ההפרשה היומית הכוללת
- הפרשה בעקבות הארוחות. רמת האינסולין בדם עולה בעקבות הארוחה בתוך 10 דקות ועשויה להגיע כעבור 45 דקות לכדי פי 15 מן ההפרשה הבסיסית. ההפרשה חוזרת לקצב הבסיסי בתוך שעתיים
למעשה, אינסולין מופרש בצורה דו-שלבית, כאשר הוא נחשף לריכוזי גלוקוז גבוהים[17]. בשלב הראשון יש עלייה מהירה אך זמנית ברמת האינסולין המופרש (בין ארבע לשמונה דקות), ובשלב השני קיימת עלייה הדרגתית בקצב שחרור האינסולין, כל עוד קיים ריכוז גבוה של גלוקוז בדם.
מנגנון זה נחקר באופן מקיף בשל המשמעות הפיזיולוגית המכרעת של תגובת הגוף לעליית ריכוז הגלוקוז. השפעה זו מבוקרת בחלקה העיקרי על ידי שינוי בריכוז יוני (Ions) סידן תוך-תאיים (+Ca2). העלייה בריכוז +Ca2 מתרחשת כתוצאה מרצף של אירועים, הכולל חדירה של גלוקוז לתוך תא בטא דרך הטרנספורטר (Transporter) GLUT2, זרחון הגלוקוז על ידי האנזים Glucokinase, וכניסה לתוך המסלול הגליקוליטי (Glycolytic) ומעגל החומצה הטרי-קרבוקסילית (Tricarboxylic acid).
תהליך זה מוביל לעלייה ברמות ה-ATP (Adenosine TriphosPhate) התוך-תאי, מה שמביא לסגירת תעלות האשלגן הרגישות ל-ATP (K-ATP) בקרום התא ולדפולריזציה שלו (Depolarization), לפתיחת תעלות סידן מסוג L ולכניסת יוני +Ca2 לתוך התא. ההשערה היא שמסלול זה מהווה גורם מעורר (Trigger) חיוני להמרצת שני השלבים בתהליך שחרור האינסולין[18].
נוסף על כך, זוהה מנגנון תלוי-גלוקוז שאינו תלוי K -ATP, המגביר את יעילותו של נתיב הגירוי ופועל בעיקר על השלב השני של שחרור האינסולין. מנגנון זה פועל רק על תהליך הגירוי ואינו יכול לפעול בהיעדר רמה גבוהה של +Ca2, ולכן מכונה "הנתיב המגביר". הוצעו מספר מתווכים המעורבים בתהליך ההגברה, אולם עדיין לא ברור מה תרומתם לתהליך זה.
גורמי הפרשה ובקרה נוספים
אף על פי שהגירוי העיקרי להפרשת אינסולין הוא גלוקוז בריכוז גבוה, קיים מספר רב של גירויים נוספים- חיוביים ושליליים- הקשורים בוויסות כמות האינסולין הדרושה לגוף מבחינה פיזיולוגית. גירויים אלה כוללים רכיבי מזון, כגון חומצות אמינו וחומצות שומן[19], הורמונים - כדוגמת GLP-1 (Glucagon-Like Peptide-1), ונוירוטרנסמיטורים - כגון Acetylcholine[20].
גורמים מגרים נוספים מעבר לגלוקוז הם חומצות אמינו, גופי Keto, חומצות שומן חופשיות (Free Fatty Acids ,FFA) והורמונים של מערכת העיכול.
הגורמים המעכבים את הפרשת האינסולין הם קטכולאמינים (Catecholamines), סטרואידים (Steroids) [בעיקר גלוקוקורטיקואידים (Glucocorticosteroids)], הורמון הגדילה וכן מווסתים פאראקריניים (Paracrines), כמו גלוקגון (Glucagon) וסומטוסטטין (Somatostatine).
יש עניין מיוחד בפעילותו של GLP-1 הואיל והתרופה Exenatide (Byetta), המהווה אגוניסט (Agonist) להורמון זה, אושרה לשימוש בסוכרת מסוג 2[21]. GLP-1 הוא הורמון המופרש מהמעי לאחר אכילה, המפעיל קולטן ממשפחת ה-G protein coupled receptors. הפעלת הקולטן מעלה את רמת ה- Cyclic Adenosine MonoPhosphate) cAMP) התוך-תאי ומגבירה את הפרשת האינסולין בתיווך מסלולים שחלקם תלויים באנזים קינאז PKA) A). נוירוטרנסמיטורים, כגון Acetylcholine, מעלים את רמת ה-[+Ca2] על ידי שחרור +Ca2 והגברת פעילות תעלות הסידן, ובדרך זו מגבירים באופן ישיר את סיגנל הגירוי להפרשת אינסולין.
גם לחומצות שומניות חופשיות בזרם הדם יש השפעה ניכרת על תאי בטא. חשיפה קצרת-טווח לחומצות שומן גורמת להפרשת אינסולין מוגברת, התלויה ברמת הגלוקוז. תופעה זו חשובה לנוכח הדרישה המוגברת לאינסולין לאחר ארוחות המכילות מרכיבים שומניים. לעומת זאת, חשיפה ממושכת לחומצות שומניות חופשיות דווקא פוגעת בפעילות תאי בטא, במנגנון המכונה Lipotoxicity או Glucolipotoxicity.[22] ישנה השערה שתופעה זו קשורה למתאם בין השמנה לסוכרת מסוג 2.
המנגנון המסביר את ההשפעות הקצרות וארוכות הטווח של חומצות השומן על תאי הבטא אינו ברור עדיין. אחת ההצעות היא שהחומצות השומניות שחודרות לתאים הופכות ל-Fatty acyl CoA, שגורם מצדו להפרשה מוגברת של אינסולין על ידי הפעלה של Protein Kinase C (PKC), וגורם גם להעלאת ריכוז ה- Ca2+]- ATP] בתוך התא[23].
זוהה קולטן GPR40, הספציפי לתאי בטא[24], ומופעל על ידי חומצות שומניות בעלות שרשראות בינוניות וארוכות. ניסויים שנערכו בשורות תאים וחיות מהונדסות גנטית הראו כי לקולטן זה חשיבות רבה ביצירת ההשפעות הקצרות וארוכות הטווח של החומצות השומניות על תאי הבטא[25]. החלבון GPR40 משמש כמתווך לאותות תוך-תאיים על ידי הפעלת מסלול Gaq-PLC, המביא לשחרור יוני סידן ולהגברת כניסת הסידן לתוך תאי הבטא [26].
ייצור והפרשה של אינסולין – מבט לעתיד
תהליכי הייצור וההפרשה של אינסולין הם תהליכים מורכבים וקריטיים לקיום האדם[3]. אין זה מפתיע, אם כן, שמנגנונים מורכבים מבצעים בקרה של פעילות תאי הבטא. כאשר מנגנונים אלה אינם פועלים כראוי, הגוף עומד בפני בעיות קשות שעלולות להיות אף קטלניות.
שני הסוגים העיקריים של מחלת הסוכרת נובעים מייצור לקוי של אינסולין. בסוכרת מסוג 1, מנגנונים אוטואימוניים משמידים את תאי הבטא, ובכך מביאים למצב של מחסור באינסולין. בסוכרת מסוג 2, אף על פי שיש ייצור והפרשה של אינסולין, רמת האינסולין שנוצרת אינה מספקת על מנת לשמור על רמות תקינות של גלוקוז בדם.
ניסויים בהשתלת איי לנגרהאנס בחולי סוכרת העלימו, לפחות בצורה זמנית, את התלות בזריקות אינסולין[27]. מכאן התקווה כי התקדמות בתהליך ההשתלה תביא בעתיד לריפוי המחלה. גישה זו מוגבלת, בעיקר בשל מחסור ברקמות להשתלה. לאור זאת, קיימת התעניינות רבה בפיתוח מקורות חליפיים ליצירת תאים מפרישי אינסולין, בין היתר מתאי גזע (Stem cells). גישה זו נתמכת על ידי היכולת המוכחת של גורמי השעתוק, כדוגמת PDX1, לגרום להפעלת גנים של תאי בטא (כולל אינסולין) גם בתאים שאינם תאי בטא, ובכך לרפא את מחלת הסוכרת בחיות מעבדה[12]. גם ההתפתחות בחקר תאי גזע עובריים ויכולתם להתמיין לכל סוג תא בגוף האדם הבוגר מצביעה על אפשרות עתידית למלאי אינסופי של תאי בטא[28]. עם כל זאת, אין לזלזל בקשיים הכרוכים בכך: בכדי שהשתלת תאי בטא תהיה ישימה, התאים המושתלים חייבים להגיב לכל ה"איתותים" החשובים בגוף, ובו בזמן גם להיות עמידים לפעילות האוטואימונית המתרחשת כחלק מהמחלה. השגת מטרה זו תחייב גישה מחקרית רב-תחומית.
מנגנון הפעולה של אינסולין
אינסולין, המופרש בתגובה לשינויים ברמת הגלוקוז בדם, ממלא תפקיד חיוני בהסדר של אחסון האנרגיה ושחרורה בגוף במצבי שובע וצום. ההבדל בין שובע וצום אינו גורם לשינויים מרחיקי לכת ברמת האינסולין, היות שרמה זו נקבעת בעיקר על ידי ריכוז הגלוקוז בדם, ונשארת בתחום צר יחסית של 4–7 מילימול לליטר. השריר, רקמת השומן והכבד הן רקמות המטרה העיקריות של אינסולין.
הויסות המטבולי נעשה על ידי גיוס הגלוקוז מהמעי, שינויים בייצור הגלוקוז בכבד, וקליטת הגלוקוז ברקמות ההיקף. אינסולין מגביר את קליטת הגלוקוז בעיקר בשריר, הצורך קרוב ל-80 אחוזים מסך הגלוקוז במחזור הדם. אינסולין מדכא יצירה של גלוקוז בכבד, וכך משמש כמווסת העיקרי של רמת הגלוקוז בדם. כמו כן, אינסולין מעודד ליפוגנזה (Lipogenesis) בכבד ומגביר את פעילות האנזים Lipoprotein lipase בסמיכות לרקמת השומן. אנזים זה אחראי על קליטת השומנים, ובאמצעות ההשפעה עליו אינסולין מווסת את תכולת הטריגליצרידים (Triglycerides) ברקמה השומנית ואת ריכוז השומנים בדם. לאינסולין יש גם השפעה מיטוטית בגרעין התא, שם הוא מעודד חלוקת תאים. מיעוט אינסולין גורם להיפרליפידמיה (Hyperlipidemia) על ידי הגברת ליפוליזה (Lipolysis) ברקמה שומנית וגיוס חומצות שומניות חופשיות.
מדובר בהורמון אנבולי מובהק, הנקשר לקולטן ומפעיל מערכת איתות של התא באמצעות Tyrosine kinase על גבי אותו קולטן. ההתקדמות במחקר הביאה להכרת שני מסלולי האיתות של אינסולין, האיתות המטבולי והאיתות המיטוטי, אשר יכול להשפיע על ביטוי הגנים ופרוליפרציה (Proliferation) של תאים. השריר, רקמת השומן והכבד הן רקמות המטרה העיקריות של אינסולין.
קולטן האינסולין
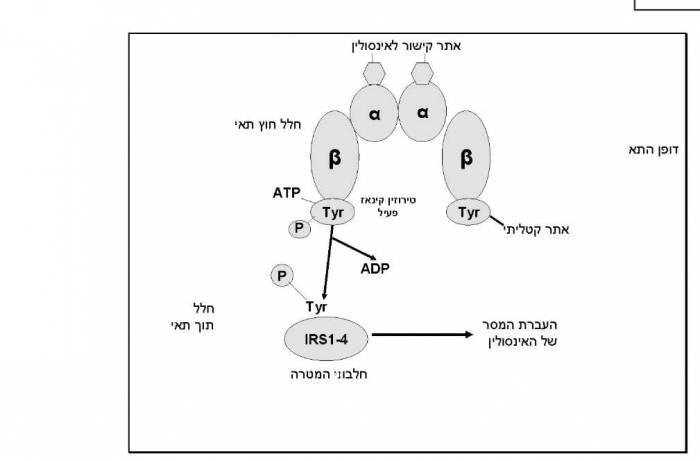
העברת המסר הפיזיולוגי של אינסולין מחייבת את נוכחותו של קולטן מיוחד בדופן התא. מספר קולטני האינסולין על פני התא משתנה מאוד בהתאם לסוג התאים: החל מכמה עשרות קולטנים בכדוריות דם אדומות שאינן רגישות לאינסולין, וכלה בכמה עשרות אלפי קולטנים בתאי רקמת שומן ושריר. מבנה הקולטן טטרמרי (Tetramer) (תמונה מספר 1): שתי זרועות אלפא (Alpha) של הקולטן בולטות מחוץ לדופן התא ומחוברות זו לזו ולזרועות בטא על ידי גשרים דיסולפידיים (S-S; Sulfur-Sulfur, גופרית-גופרית). בקצה כל אחת מהזרועות החיצוניות נמצא אתר הקושר מולקולה של אינסולין. עם היקשרותו של אינסולין, הקונפורמציה (Conformation) של הקולטן משתנה, ועל ידי כך מועבר מסר לשתי זרועות בטא של הקולטן בתוך התא. כתוצאה מכך, האנזים Tyrosine kinase, הממוקם על פני הזרועות הפנימיים, מופעל ומזרחן בנוכחות ATP את שרשרת הקולטן עצמו בתהליך המכונה "זירחון עצמי". במקביל מזורחנים חלבונים שונים המשתתפים בהעברת מסר האינסולין. פעילות ה-Tyrosine kinase קובעת את הקצב ואת יעילות העברת המסר.
חלבוני IRS
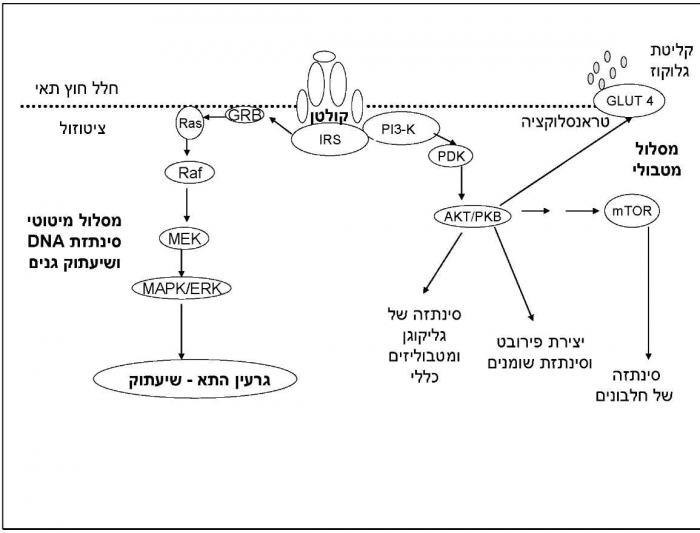
מבין החלבונים המזורחנים על ידי Tyrosine kinase, הראשון והחשוב הוא IRS (Insulin Receptor Substrate). חלבון זה בעל משקל מולקולרי של 185 kDa (kiloDalton). למעשה, IRS היא משפחה של סובסטרטים (Substrates) (4-1 IRS וייתכן אף יותר) בעלי הומולוגיה (Homology) ניכרת. הם משמשים כחלבוני עיגון לחלבונים נוספים במסלול האיתות על ידי צימוד לאתרים מסוימים על פני המולקולה. חלבוני IRS מכילים מספר רב של אתרי SH2 (Src Homology 2) הניתנים לזירחון על ידי Tyrosine ו-Serine, אזור הומולוגי הנקרא Pleckstrin (Pleckstrin Homology ,PH), ואתר קישור ל-Tyrosine. אתרים אלו נמצאים גם במולקולות איתות אחרות ומאפשרים העברת מסר על ידי צימוד. מסר האינסולין מועבר באופן הדרגתי לחלבוני האיתות, כפי שמתואר בתמונה מספר 2.
חשיבותם התפקודית של הסובסטרטים 1–4 IRS לא הובהרה לגמרי, פרט לעובדה שלחלבון 2-IRS יש השפעה אנטי-סכרתית מובהקת. סילוק סלקטיבי של 2-IRS בעכברים גורם להפרעה ניכרת בהעברת איתות האינסולין, היפרגליקמיה, אי-סבילות לגלוקוז ותנגודת היקפית לאינסולין. מופיע עיכוב בקליטת הגלוקוז על ידי השריר, שינוי קטן מדי ברמת הגלוקוז אחרי מתן אינסולין, וחוסר בקרה של גלוקוניאוגנזה (Gluconeogenesis) בכבד על ידי אינסולין. כמו כן, קיים עיכוב בפרוליפירציה של תאי הרקמות וצמצום במסת תאי B. לעומת זאת, סילוק סלקטיבי של 1 ,3 IRS או 4 גורם לשינוי קל בלבד בפנוטיפ (Phenotype) המטבולי ואינו פוגע בהתפתחות.
אחרי הפעלת ה-IRS, איתות האינסולין מתפצל לשני מסלולים: מסלול המפעיל את המערכות המטבוליות - כגון קליטת הגלוקוז, חילוף חומרים של פחמימות, שומנים וחלבונים, ומסלול המפעיל את המערכת המיטוטית בגרעין התא, המבקר את גידול וריבוי התאים והתבטאות הגנים של אנזימי גליקוליזה וגלוקוניאוגניזה (תמונה מספר 2).
המסלול המטבולי
1-IRS המזורחן מפעיל את האנזים Pl-3-K (PhosphoInositide 3-Kinase), המבצע זרחון של הפוספואינוזיטידים בעמדה 3 על פני האינוזיטול (Inositol). קבוצת ה-Hydroxyl של האינוזיטול מזורחנת לביספוספט (Bisphosphate) Pl-3,4P2 ולטריספוספט (Triphosphate) Pl-3,4,5P3. האנזים נמצא באזור הפוספוליפידים בתוך התא ובשל כך קרוי לעיתים "Lipid kinase". פעילותו מתאפשרת הודות לנוכחות מקטעי PH קטליטיים-רגולטוריים (Catalytic regulatory) על פני המולקולה שלו, בעזרתם הוא יכול להפעיל חלבוני איתות מרובים. האנזים PI-3-K פועל גם כ-Serine Kinase, כלומר מזרחן יחידות Serine על פני חלבונים. בצורה זו הוא מפעיל את אנזים האיתות הבא - 3-Phosphoinositide Dependent Kinase) PDK). בהמשך, אנזים זה מפעיל גורם איתות חשוב הקרוי AKT/PKB (Protein Kinase B) המתפקד כ-Serine Threonine Kinase. שלב זה ייחודי היות שהפעילות מוקנית על ידי זרחון Serine או Threonine, ולא Tyrosine. ישנו אזור PH שנוכחותו חשובה בתהליך - אזור זה בעל רגישות לאינטראקציה עם חלבונים שונים, וביניהם IRS. בריאקציה משתתף גם האנזים PDK, קינאז הנמצא בתחום הפוספוליפידים בתא, גם הוא בעל אזור 1-PH.
לאנזימים Pl-3-K ו-PKB/AKT יש השפעה מרחיקת לכת במורד הזרם של איתות האינסולין בגלל יכולתו להפעיל מערכות מטבוליות מרובות הכוללות את ייצור הגליקוגן על ידי הגנת גליקוגן סינתז (Glycogen synthase) מפני הזירחון המעכב הנגרם על ידי ww, GSK3 עצמו הוא מזרחן. הודות לכך מובטחת פעילות של גליקוגן סינתז וקיום עתודת הגליקוגן ברקמות. זירוז המטבוליזם על ידי PKB/AKT כולל גם המרצת קליטת הגלוקוזה על ידי התא, הפעלה של cNOS (מערכת יצירת NO, Constitutive Nitric Oxide Synthase), הפעלת PFK בתהליך הגליקוליזה, והפעלה של ATP citrate lyase ו-Acetyl-CoA carboxylase המווסתים את תהליכי הגליקוליזה והליפוגניזה.
כמו כן, הגלוקוניאוגנזה מעוכבת על ידי השפעה על ביטוי הגנים המקודדים את אנזימי מפתח של הגלוקוניוגניזה בכבד: G6Pase-FDPase ,PEPC (Glucose 6-phosphatase-Fructose 1,6-diphosphatase, Phosphoenolpyruvate carboxylase). היות שהאנזימים הגליקוליטיים מעודדים, בדרך זו גוברת זרימת הפירובט המופנה ליצירת השומנים. האנזימים השולטים בקצב תהליך הליפוגיניזה, Acetyl-CoA carboxylase וייצור של חומצות שומניות מוגנים בפני זירחונם המעכב ויצירת החומצות השומניות מוחשת. מצד שני נמנע תהליך שחרור ה-FFA על ידי עיכוב הליפז ברקמה שומנית על ידי הסרת הזירחון באמצעות הפעלת פוספטז, תוך שילוב עם עיכוב ה-Kinase והורדת רמת ה-cAMP על ידי הפעלת Phosphodiesterase.
הגלוקוז הנקלט ברקמה שומנית בצורה מוחשת על ידי אינסולין משמש בעיקר לאספקת Glycerophosphate לשם איסטור ה-FFA לטריגליצרידים, היות שה-Glycerol הנוצר בעקבות הליפוליזה עוזב את הרקמה בהיעדר מנגנון ברקמה זו לנצלו מחדש על ידי זירחון.
אינסולין מגביר את יצור החלבונים ומונע את פירוקם על ידי הפעלת חלבון האיתות mTOR (Mechanistic Target Of Rapamycin) המשתייך למשפחת חלבוני Pl-3-K ופועל כ-Serine Kinase. הוא מבקר את הליכי התרגום (Translation) על ידי זירחון ישיר בתחום הריבוזומים (Ribosomes) ו-mRNA פעילות ה-mTOR מלווה בזרימה מוגברת של חומצות אמיניות למקומות הייצור הללו. mTOR מעורב גם באיזון פעילות האינסולין דרך זירחון ה-Serine על פני חלבוני IRS.
המסלול המיטוטי
אינסולין מפעיל את המסלול של MAPK (Mitogenic Activated Protein Kinase). מסלול זה תלוי בזרחון ראשוני של חלבוני ה-IRS, אשר בהמשכו מזורחן "חלבון ההסתגלות" GRB (Growth factor Receptor-Bound protein) המוסב לדופן התא ומפעיל את החלבון Ras .Ras פועל כמעין מתג מולקולרי המפעיל שרשרת זרחון הדרגתית של Serine על פני חלבוני האיתות המיטוטי: RAF, המעביר את האיתות ל-MAPK ,MEK ו-ERK (Extracellular Signal-Regulated Kinase). המטרה הסופית היא כניסה לגרעין התא, בו מתרחשת ייצור מוגבר של DNA, קטליזה (Catalysis) של גורמי השעתוק המביאים להתחלקות והתמיינות של התאים, וקליטה מוגברת של חומצות אמינו.
ניתן לעכב את המסלול המיטוטי מבלי לפגוע במסלול המטבולי, ולהפך.
קליטת גלוקוז באמצעות GLUT4
ההשפעה המובהקת של אינסולין על תאי השריר והרקמה השומנית היא בהגברת קליטת הגלוקוז פי 10 עד 30. GLUT4 נאגר בשלפוחיות אנדוזומליות (Endosomal vesicles) בתוך התאים. בהשפעת אינסולין, השלפוחיות המכילות GLUT4 משנות מיקום ונעות לכיוון דופן התא. GLUT4 מכיל אזור רגיש להפעלה, שיכול לעבור מיזוג עם קולטן מיוחד בדופן התא. האנזימים המזרזים את ההסטה של GLUT4 מהשלפוחיות לדופן התא הם PKB/AKT -PI-3-K, ככל הנראה באמצעות הפוספואינוזטידים המזורחנים על ידם. לשני גורמי איתות אלו יש השפעה מכרעת על "התנעת" חלקיקי GLUT4. בכבד, שאינו מכיל GLUT4, אינסולין אינו מגביר את קליטת הגלוקוז.
בקרת מערכת האיתות של אינסולין
כפי שהוסבר, תהליך האיתות מופעל על אנזים Tyrosine kinase המזרחן את חלבוני ה-IRS. עיכוב ה-Tyrosine kinase של הקולטן והתנגודת לאינסולין חייבים מנגנון נגדי של ריסון.
החומצה האמינית Serine, שקבוצת ה-Hydroxyl שלה זמינה לזירחון, עשויה לקלוט פוספט מ-ATP במצב של עודף אינסולין. פרט למקרים ספציפיים, זרחון ה-Serine מונע את זרחון ה-Tyrosine וגורם להאטה או הפסקה של כל מערכת האיתות. למקרה זה קוראים זרחון מרובה (Multiple phosphorylation). קיימת בתאים קבוצת אנזימים המכונים PKC, שהסובסטרט שלהם הוא קבוצת Serine על החלבונים של מערכת האיתות. הגברה בפעילותם עשויה לשתק את פעולת ה-Tyrosine kinase הן על פני הקולטן והן על פני IRS.
תנגודת לאינסולין מתרחשת בגלל ביטוי יתר של אחד מחברי הקבוצה, האנזים PKC Epsilon. בבני אדם נמצא שהזלפת תחליב שומני גורמת לתנגודת לאינסולין והתבטאות יתר של PKC Theta. מאידך, נמצא כי מיסוך של אתר הזירחון על ידי פפטידים ספציפיים מעכב את זירחון ה-Serine על פני IRS ומאפשר את המשך תהליך האיתות.
אחדים מאנזימי PKC, כולל PKC Epsilon ו-PKC Theta, מופעלים על ידי Diacylglycerol (DAG). DAG הוא חומר ביניים הנוצר בתאים בזמן ייצור או פירוק של הטריגליצרידים. בזמן תזונה עשירה והשמנה עלולה להיווצר הצטברות של טריגליצרידים בתאי השריר ולגרום לעליה ברמות DAG המפעיל את PKC. במצב זה יהיה זרחון מוגבר של Serine על פני חלבוני האיתות, ותיווצר תנגודת לאינסולין. זוהי נקודת קשר (שלילית) בין איתות האינסולין ומטבוליזם השומנים הנגרמת על ידי הצטברות שומן בתאי השריר.
ריסון מערכת האיתות מבוצע גם על ידי פעילות פוספטזות שונות (Protein Tyrosine Phosphatase ,PTPase) המסוגלות לפרק את הקשר בין ה-Tyrosine והפוספט על פני החלבונים. קיימות פוספטזות שונות המפרקות את ה-Phosphotyrosine, שפעילותן בדופן התא מוגברת בסוכרת. מאידך, במצב של צום ורזון יורדת פעילות הפוספוטז ברקמת השומן. מבין הפוספוטזות, הנפוצה ביותר היא PT1B (Protein Tyrosine 1B) שבודדה לראשונה מרקמת שלייה. פוספטאזה זו צמודה לקולטן האינסולין ומופעלת במצבים של עודף אינסולין. משערים שפוספטאזה זו מאזנת את איתות האינסולין in vivo על ידי פרוק Tyrosine phosphate על פני הקולטן. סילוק סלקטיבי של PT1B בעכברים מעלה את הרגישות לאינסולין ומוריד את משקל הגוף הנגרם על ידי תזונת יתר. פעילות זו מהווה מטרה טובה לתרופות העשויות למנוע את התנגודת לאינסולין. פוספטאזה אחרת מצויה ב-Cytosol של התא ומכונה SHP2 (Src-Homology 2 domain-containing Phosphatase 2). היא יכולה להתחבר ל-Tyrosines מזורחנים על פני IRS וחלבונים אחרים בזמן האיתות, ומהווה גורם בקרה שלילי בתהליך האיתות.
השמנה ותנגודת לאינסולין
הופעה של תנגודת לאינסולין בבעלי חיים ובני אדם עם עודף משקל היא תופעה ידועה היטב שיש לה סיבות אחדות. רקמת שומן משחררת ציטוקינים (Cytokines) המעכבים את זרחון חלבוני האיתות. אחד הציטוקינים, TNF-alpha (Tumor Necrosis Factor alpha), מופרש בעודף בחולים עם עודף משקל. TNF-alpha מזרחן Serine במקום Tyrosine ועל ידי כך מעכב את הזרחון של IRS על ידי Tyrosine kinase. נמצא כי Rosiglitazone מחלישה את היכולת של TNF-alpha לגרום לתנגודת לאינסולין.
הציטוקין Leptin נחשב לסמן ההשמנה. הוא נקשר לקולטנים שלו במערכת העצבים ובמקומות אחרים וגורם לצמצום של צריכת המזון ומאידך גם להוצאת אנרגיה במצב של תנגודת לאינסולין. במצבי חסר גנטי של Leptin, הידוע בעכברים ob/ob -db/db, קיימת נטייה להשמנה ניכרת. כמו כן, נמצא כי Leptin משפיע על תאי בטא בלבלב על ידי ויסות הטריגליצרידים הגורמים להפחתה בהפרשת אינסולין. הציטוקין Adiponectin, שמקורו ברקמת השומן, מונע גיוס חומצות שומן מרקמות האחסון, מזרז את חימצונן, ומעלה את הרגישות לאינסולין ואת יכולתו של אינסולין לדכא גלוקוניאוגניזה. רמותיו של Adiponectin יורדות בהשמנה, ונמצא שטיפול בו משפר את התגובה לאינסולין.
השפעתו של אינסולין על תפקוד תאי בטא
היעדרה של מערכת המפצה על התנגודת לאינסולין על ידי הפרשת יתר של אינסולין מהלבלב מאפיינת את מחלת הסוכרת. ההיפרגליקמיה המופיעה במצבים של חסר 2-IRS מדגישה את הצורך בעידוד ההפרשה מתאי בטא. מכאן ניתן להסיק כי מיעוט 2-IRS, במיוחד בתאי בטא, עלול להיות הגורם הקריטי בהבטחת הפרשת אינסולין. עיכוב בקליטת גלוקוז על ידי רקמת השריר מביא לתנגודת חלקית לאינסולין, אך הפחתת אספקת האינסולין מהלבלב גורמת לתנגודת חמורה יותר בסוכרת מסוג 2.
הפקת אינסולין וסוגי אינסולין
עד שנות ה-80 של המאה הקודמת הופק האינסולין בעיקר מלבלבים של בקר ושל חזיר. בתחילת שנות ה-80 הופיע בשוק לראשונה אינסולין ממקור אנושי שיוצר בשיטות של הנדסה גנטית, תוך שימוש בחיידקי Escherichia coli) E. coli). בתהליך הייצור הנוכחי של האינסולין האנושי התוצר מזוקק ומטוהר לחלוטין, ופחתו מאד הסיבוכים המיוחסים למוצר עצמו. ניתן להאריך את משך פעולת האינסולין באמצעות קשירתו לחלבון או לאבץ, המעכבים את קצב ספיגתו מאתר ההזרקה. הארכת משך הפעולה נותנת מענה טוב יותר לצורך בהפרשה הבסיסית בין הארוחות. בשנות ה-60 המוקדמות הופיעו לראשונה בשוק תוצרי אינסולין דו שלביים: תערובות של אינסולין קצר-טווח ובעל טווח בינוני, ונכון לעשור הראשון של המאה ה-21, הנוסחאות הנפוצות ביותר בשימוש קליני. קיים מגוון של מוצרים ביחסים משתנים של שני מרכיבים אלה.
בדרך כלל מוזרק האינסולין אל השומן התת-עורי, ומשום כך על המטופל להמתין 15–30 דקות עד שהאינסולין קצר-הטווח מתפרק מן ההקסמרים (Hexamer) למונומרים (Monomer) בני-ספיגה.
מתחילת שנות האלפיים התוודענו לאנלוגים (Analogues) של אינסולין, המיוצרים בשיטות ההנדסה הגנטית. אנלוגים אלו של אינסולין מונומרי מצטיינים בכך, שבעקבות השינוי במבנה המולקולה נמנעת האגרגציה (Aggregation) של האינסולין להקסמרים. בכך מתאפשרת ספיגה מהירה מאד של המונומרים אל תוך מחזור הדם ומושגת פעילות ביולוגית מואצת הקרובה יותר לסיטואציה הפיזיולוגית.
כמו כן, מיוצרים ומשווקים גם אנלוגים ארוכי-טווח, המחקים את קצב ההפרשה הבסיסי, הפיזיולוגי. פרופיל הספיגה של אנלוגים אלה הוא בעל תנודות מתונות יותר, ולכן הם מאפשרים רמה קבועה ומתמשכת בין הארוחות.
באמצעות השילוב בין אנלוגים קצרי-טווח לאנלוגים ארוכי-טווח, אנו מתקרבים יותר לסימולציה (Simulation) של פרופיל ההפרשה הפיזיולוגי של אינסולין.
אינסולין בשאיפה
שיפור שחל בתחילת שנות האלפיים בטכנולוגיות מאפשר מתן אינסולין דרך המיטה האלוואולרית (Alveolar). מקום שבו האינסולין נספג במהירות לנימים האלוואולרים ומתפזר דרך מחזור הדם המערכתי. שטח האפיתל האלוואולרי הוא כ-100 מטרים רבועים, יש בו כלי דם מרובים והוא מאד חדיר (Permeabil). עובדות אלו הופכות את מתן האינסולין בשאיפה לאופציה אטרקטיבית יותר מאשר בזריקות. לפני השטח האלוואולריים יש יכולת ספיגה גבוהה, בניגוד לזו של הרירית בעלת השכבות העבות של דרכי הנשימה העליונות ושל העץ הברונכיאלי (Bronchial), שתרופות פפטידיות אינן עוברות דרכו בקלות.
אינסולין בשאיפה נספג מהר יותר מאשר אינסולין במתן תת-עורי, עם ערכי Time of maximum observed concentration) Tmax) עבור אינסולין בשאיפה של 0.3, 0.6, 1.2, 1.8 יחידות לקילוגרם, בשיעור של 49, 48, 62, ו-65 דקות בהתאמה, לעומת 119 דקות עבור מנת אינסולין במתן תת-עורי. זמן השיעור המרבי של אינפוזיית (Infusion) הגלוקוז היה קצר יותר עבור אינסולין בשאיפה במנות של 0.3, 0.6, ו-1.2 יחידות לקילוגרם מאשר עבור אינסולין במתן תת-עורי. תוצאות אלה מרמזות כי אינסולין בשאיפה נספג מהר יותר וההשפעות המטבוליות מתחילות מהר יותר מאשר אינסולין רגיל במתן תת-עור.
התוויות לטיפול
- סוכרת סוג 1 - ההמלצה היא לשימוש באינסולין תת-עורי מאשר אינסולין בשאיפה לצורך טיפול בזמן הארוחות[29][30],[31],[32],[33],[34], אינסולין בשאיפה אינו מומלץ לטיפול ב- Diabetic ketoacidosis (DKA) או בחולים הנמצאים בסיכון גבוה ל-DKA[35].
אינסולין Technosphere בשאיפה (Technosphere Insulin, TI) היא חלופה לא פולשנית לטיפול בזמן הארוחות אך עם יעילות גליקמית נמוכה יותר משל הטיפול התת-עורי[36][37],
- סוכרת סוג 2 - לרוב החולים הזקוקים לטיפול באינסולין, ההמלצה היא לשימוש באינסולין תת-עורי לטווח בינוני-ארוך ("בזאלי", "Basal") כטיפול התחלתי. לחולים הזקוקים לטיפול בזמן הארוחות מומלץ לטפל באינסולין תת-עורי מאשר באינסולין בשאיפה[38].[39],[40],
TI היא חלופה לא פולשנית לחולים עם סוכרת מסוג 2 אשר בשל חוסר רצון או חוסר יכולת להשתמש באינסולין בזריקות היו דוחים את תחילת הטיפול באינסולין, או לצורך הגברת הטיפול באינסולין ואשר יכולים "לסבול" שיעול חולף פוטנציאלי בכל שימוש, ובנוסף, תהיה היענות מצידם למעקב על ידי בדיקת תפקודי ריאות[41]
- בחולים עם סוכרת מסוג 1 או 2 הזקוקים לאינסולין: היפוגליקמיה (Hypoglycemia) קשה דווחה בהיארעות נמוכה יותר בטיפול ב-TI לעומת איסולין תת-עורי[40][30],[31],[33],[34],
- TI הייתה קשורה לדרגת עליה קטנה יותר במשקל לעומת אינסולין תת-עורי[40][30],[31],[34],
- TI קשור לשיעול קל, לא יצרני (Nonproductive) אשר עלול להופיע בכל שאיפה[34] וכן ירידה קלה בבדיקת תפקודי הריאות [Forced Expiratory Volume at one second (FEV1)][40][29],[31],
- על אף שנדיר, תופעות של רגישות יתר נרשמו עם TI
התוויות נגד
- מעשנים וכאלו שהפסיקו לעשן במהלך ששת החודשים האחרונים. בנוסף, חולים עם מחלת ריאות כרונית [[[אסטמה]] (Asthma), COPD (Chronic obstructive pulmonary disease)] בשל הסיכון ל-Bronchospas[43][44],
- לפני תחילת טיפול באינסולין בשאיפה, כל החולים צריכים לעבור בדיקה רפואית מקיפה הכוללת אנמנזה (Anamnesis, history), בדיקה פיזיקלית ובדיקת תפקודי ריאות (Spirometry) לצורך אבחון מחלת ריאות אפשרית. אין להתוות TI בחולים עם FEV1 נמוך מ-70 אחוזים
- בדיקת תפקודי ריאות צריכה להיעשות לפני תחילת הטיפול (בסיס), לאחר 6 חודשי טיפול ולאחר מכן באופן שנתי, גם ללא תסמינים ריאתיים. תדירות גבוהה יותר של הבדיקה צריכה להיעשות אם ישנם תסמינים עקשנים (צפצופים, שיעול מתמשך). בחולים עם ירידת FEV1 של 20 אחוזים ויותר מהבסיס, טיפול ב-TI, Afrezza, צריך להיפסק
ביבליוגרפיה
- ↑ Aly T, Devendra D, Eisenbarth G.S. Immunotherapeutic approaches to prevent, ameliorate, and cure type 1 diabetes. Am J Ther, 2005;12:481490־.
- ↑ Kahn BB. Type 2 diabetes: when insulin secretion fails to compensate for insulin resistance. Cell, 1998;92:593596־.
- ↑ 3.0 3.1 Halban PA, Kahn SE, Lernmark A, et al. Gene and cell־ replacement therapy in the treatment of type 1 diabetes: how high must the standards be set? Diabetes, 2001;50:21812191־.
- ↑ Orci L, Vassalli JD, Perrelet A. The insulin factory. Sci. Amer, .61־259:50;1988.
- ↑ Bell GI, Pictet RL, Rutter WJ, et al. Sequence of the human insulin gene. Nature, 1980;284:2632־.
- ↑ 6.0 6.1 Glick E, Leshkowitz D, Walker MD. Transcription factor BETA2 acts cooperatively with E2A and PDX1 to activate the insulin gene promoter. J Biol Chem, 2000;275:21992204־.
- ↑ Walker MD, Edlund T, Boulet AM, et al. Cell־specific expression controlled by the 5' flanking region of insulin and chymotrypsin genes. Nature, 1983;306:557561־.
- ↑ German MS, Ashcroft K, Docherty, et al. The insulin gene promoter. A simplified nomenclature. Diabetes, 1995;44:1002־ 1004.
- ↑ 9.0 9.1 Ohneda K, Ee H, German M. Regulation of insulin gene transcription. Semin Cell Dev Biol, 2000;11:227233־.
- ↑ Jonsson J, Carlsson L, Edlund T, et al. Insulin promoter factor 1 is required for pancreas development in mice. Nature, .609־371:606;1994.
- ↑ Stoffers DA, Stanojevic V, Habener JF. Insulin promoter factor1־ gene mutation linked to early־onset type 2 diabetes mellitus directs expression of a dominant negative isoprotein. J Clin Invest, 1998;102:232241־.
- ↑ 12.0 12.1 Meivar־Levy I, Ferber S. New organs from our own tissues: liver־to־pancreas transdifferentiation. Trends Endocrinol Metab, 2003;14:460466־.
- ↑ Marshak S, Totary H, Cerasi E, et al. Purification of the beta־cell glucose־sensitive factor that transactivates the insulin gene differentially in normal and transformed islet cells. Proc Natl Acad Sci USA, 1996;93:1505715062־.
- ↑ German MS, Wang JH. The insulin gene contains multiple transcriptional elements that respond to glucose. Mol Cell Biol, .4075־14:4067;1994.
- ↑ 15.0 15.1 15.2 Pugliese A. Insulin: a critical autoantigen and potential therapeutic agent in type 1 diabetes. Expert Rev. Clin Immunol, .413־2:419;2006
- ↑ 16.0 16.1 Hutton J, Wasmeier C, Amaria R, et al. Proprotein processing and pancreatic islet function. Adv Exp Med Biol, 2004;552:39־65.
- ↑ Creemers JW, Jackson RS, Hutton JC. Molecular and cellular regulation of prohormone processing. Semin Cell Dev Biol,.10־9:3;1998.
- ↑ Henquin JC, Ravier MA, Nenquin M, et al. Hierarchy of the beta־cell signals controlling insulin secretion. Eur J Clin Invest, 2003;33:742750־.
- ↑ GA. Insulin Secretion: Fatty Acid Signalling via Serpentine Receptors. Curr Biol, 2003;13:R403405־.
- ↑ Gilon P, Henquin JC. Mechanisms and physiological significance of the cholinergic control of pancreatic beta־cell function. Endocr Rev, 2001;22:565-604.
- ↑ Drucker DJ. The biology of incretin hormones. Cell Metab, 2006;3:153-165.
- ↑ Zraika S, Dunlop M, Proietto J, et al. Effects of free fatty acids on insulin secretion in obesity. Obes Rev, 2002;3:103־ 112.
- ↑ Prentki M, Joly E, El־Assaad W, et al. Malonyl־CoA signaling, lipid partitioning, and glucolipotoxicity: role in beta־cell adaptation and failure in the etiology of diabetes. Diabetes, 2002;51:S405־ 413.
- ↑ Briscoe CP, Tadayyon M, Andrews JL, et al. The orphan G protein־coupled receptor GPR40 is activated by medium and long chain fatty acids. J Biol Chem, 2003;278:1130311311־.
- ↑ Steneberg P, Rubins N, Bartoov־Shifman R, et al. The FFA receptor GPR40 links hyperinsulinemia, hepatic steatosis, and impaired glucose homeostasis in mouse. Cell Metab, 2005;1:245־ 258.
- ↑ Shapiro H, Shachar S, Sekler I, et al. Role of GPR40 in fatty acid action on the beta cell line INS1־E. Biochem Biophys Res Commun, 2005;335:97104־.
- ↑ Ryan EA, Paty BW, Senior PA, et al. Five־year follow־up after clinical islet transplantation. Diabetes, 2005;54:20602069־.
- ↑ Lavon N, Benvenisty N. Study of hepatocyte differentiation using embryonic stem cells. J Cell Biochem, 2005;96:11931202־.
- ↑ 29.0 29.1 Raskin P, Heller S, Honka M, Chang PC, Boss AH, Richardson PC, Amin N. Pulmonary function over 2 years in diabetic patients treated with prandial inhaled Technosphere Insulin or usual antidiabetes treatment: a randomized trial. Diabetes Obes Metab. 2012 Feb;14(2):163-73. Epub 2011 Nov 3.
- ↑ 30.0 30.1 30.2 A phase 3, multicenter, open-label, randomized, forced-titration clinical trial evaluating the efficacy and safety of Technosphere insulin inhalation powder in combination with a basal insulin versus insulin aspart in combination with a basal insulin in subjects with type 1 diabetes mellitus over a 24-week treatment period. NLM identifier: NCT01445951
- ↑ 31.0 31.1 31.2 31.3 Efficacy & safety of inhaled insulin in type 1 diabetes. NLM identifier: NCT00308308
- ↑ A 3 month, randomized, open label, multi-center study of Technosphere/insulin compared to insulin aspart in subjects with type 1 diabetes mellitus receiving insulin glargine. NLM identifier: NCT00539396
- ↑ 33.0 33.1 Safety and efficacy of Technosphere insulin inhalation powder and Lantus compared to Humalog and Lantus over 16-weeks. NLM identifier: NCT00700622
- ↑ 34.0 34.1 34.2 34.3 Pittas AG, Westcott GP, Balk EM. Efficacy, safety, and patient acceptability of Technosphere inhaled insulin for people with diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2015;3(11):886
- ↑ Endocrinologic and Metabolic Drugs Advisory Committee Meeting. Afrezza (Technosphere Insulin Inhalation System). FDA Briefing Document
- ↑ Turner RC, Cull CA, Frighi V, Holman RR. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). UK Prospective Diabetes Study (UKPDS) Group. JAMA. 1999;281(21):2005
- ↑ Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, Lachin J, Cleary P, Crofford O, Davis M, Rand L, Siebert C. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 1993;329(14):977
- ↑ Clinical trial evaluating the efficacy and safety of Technosphere inhalation insulin (TI) inhalation powder using the Gen2 inhaler. NLM identifier: NCT01196104
- ↑ Comparison between Technosphere/insulin inhalation powder versus rapid acting insulin in subjects with type 2 diabetes mellitus. NLM identifier: NCT00539890
- ↑ 40.0 40.1 40.2 40.3 Rosenstock J, Lorber DL, Gnudi L, Howard CP, Bilheimer DW, Chang PC, Petrucci RE, Boss AH, Richardson PC. Prandial inhaled insulin plus basal insulin glargine versus twice daily biaspart insulin for type 2 diabetes: a multicentre randomised trial. Lancet. 2010;375(9733):2244
- ↑ Uptodate: Inhaled insulin therapy in diabetes mellitus#CANDIDATES FOR INHALED INSULIN#Type 2 diabetes
- ↑ Afrezza. US Food and Drug Administration (FDA) approved product information. Last updated June 2014. US National Library of Medicine
- ↑ Ford ES. Trends in the control of risk factors for cardiovascular disease among adults with diagnosed diabetes: findings from the National Health and Nutrition Examination Survey 1999-2008*. J Diabetes. 2011 Dec;3(4):337-47
- ↑ Fan AZ, Rock V, Zhang X, Li Y, Elam-Evans L, Balluz L. Trends in cigarette smoking rates and quit attempts among adults with and without diagnosed diabetes, United States, 2001-2010. Prev Chronic Dis. 2013;10:E160. Epub 2013 Sep 19
- ביבליוגרפיה כללית
- Ikeda Y, Olsen GS, Ziv E, et al. CGllular mechanism of nutritionally induced insulin resistance in Psammomys obesus: overexpression of protein kinase C? in skeletal muscle precedes the onset of hyperinsulinemia and hyperglycemia. Diabetes. 2001;50:584-592.
- Klarlund JK, Cherniack AD, Conway BR, et al. Mechanisms of insulin action. In D Porte Jr, RS Sherwin, A Baron (Eds) Diabetes Mellitus, Mc Graw-Hill publishers. 2003, pp. 67-83.
- Myers Jr MG, White, MF. The molecular basis of insulin action. In G. Grunberger and Y. Zick (Eds) Insulin Signaling: From Cultured Cells to Animal Models. Taylor and Francis publishers. 2002, pp. 55-87.
- Pessin JE, Saltiel AR. Signaling pathways in insulin action: molecular targets of insulin resistance. J Clin Invest. 2000;106:165־ 169.
- Saltiel AR, Kahn CR. Insulin signaling and the regulation of glucose and lipid metabolism. Nature. 2001;414:799-805.
- Shafrir E, Ziv E, Mosthaf L. Nutritionally induced insulin resistance and receptor defect leading to B-cell failure in animal models. Ann NY Acad Sci. 1999;892:223-246.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' מייקל ווקר, פרופ' אלעזר שפריר, פרופ' איתמר רז, ד"ר חוליו וינשטיין


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק