שיטיון – אבחנה והערכה - Dementia - assessment and diagnosis
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| שיטיון | ||
|---|---|---|
| Dementia | ||
| יוצר הערך | ד"ר צבי דוולצקי, ד"ר יאן פרס 
|
|
דמנציה היא תסמונת בעלת גורמים רבים, הפוגעת תחילה ביכולות הקוגניטיביות ומובילה להשפעה שלילית על היכולת התפקודית של המטופל. ב-DSM-IV דמנציה מוגדרת כתסמונת המאופיינת בהתפתחות לקות קוגניטיבית משולבת הכוללת ירידה בזיכרון ונוסף על כך, לפחות אחת מההפרעות הבאות: אפרקסיה, אגנוזיה, אפזיה או לקות בתפקודים הניהוליים (Executive Function) [1]. כדי שמטופל יוגדר כלוקה בדמנציה, חייבת להיות ירידה ברמת התפקוד בשל הלקויות הקוגניטיביות.
אפידמיולוגיה
אטיולוגיה
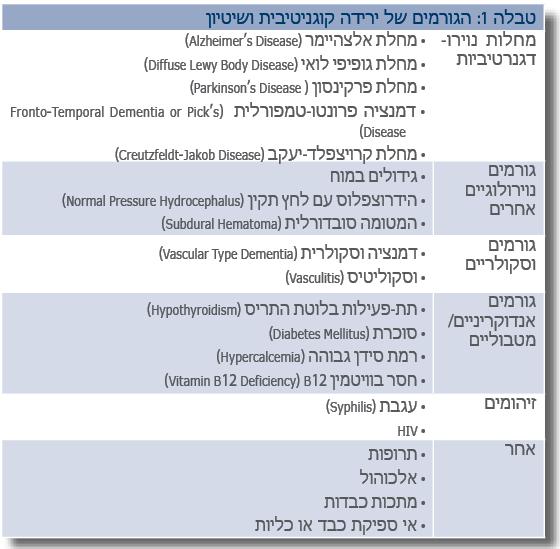
בטבלה 1 מוצגת רשימה של הגורמים העיקריים לדמנציה. הגורם השכיח ביותר הוא מחלת אלצהיימר, עם שכיחות מדווחת של יותר מ-60% מתוך הדמנציות השונות [2]. גם דמנציה וסקולרית שכיחה (15%-10%). לאחרונה, יש התעניינות מיוחדת בדמנציה עם גופיפי לואי DLB (Diffuse Lewy Body Disease) , ומדווח במחקרים שונים על שכיחות של יותר מ-20% לפי הממצאים ההיסטולוגיים [3].
דגש רב הושם במשך השנים על חיפוש אחרי גורמים הפיכים לדמנציה. ההיגיון לכך ברור, אם יימצאו גורמים כאלה, תיתכן אפשרות לטיפול ולריפוי התסמינים (וזאת על ידי התערבויות קלות יחסית, כמו תוספת ויטמין B12 או מתן תוספת הורמון בחולים עם תת-פעילות בלוטת התריס). אולם, למרות מציאת גורמים אלו, הטיפול בהם אינו מרפא את החולה במקרים רבים. במטה-אנליזה שנעשתה על ידי Clarfield [4], נמצא כי כאשר בכ-9% מהחולים שסבלו מדמנציה נמצאו גורמים הפיכים אפשריים, רק 0.6% מתוכם באמת "הבריאו" מהדמנציה אחרי התערבויות ספציפיות.
קליניקה
נפוץ הקשר בין לקות קוגניטיבית לבין סימפטומים של דיכאון. המונח הישן של "פסאודו-דמנציה" מתאר שילוב של תסמונת דמנציה בתסמינים של דיכאון. אף שבמקרים רבים מטופלים אלו משתפרים מבחינה קוגניטיבית באופן ניכר בעקבות טיפול תרופתי נוגד דיכאון, לאחר תקופה מרבית של חמש שנים רובם מפתחים דמנציה מתקדמת. בשל כך, סביר להניח שלרבים ממטופלים אלו התמונה הדיכאונית היא ביטוי ראשוני של ירידה קוגניטיבית שמתפתחת במהלך הזמן[5] .
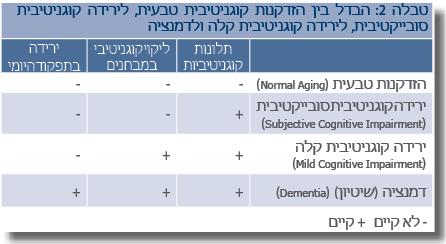
הנוכחות של ירידה קוגניטיבית קלה MCI (Mild Cognitive Impairment) ללא דמנציה היא בעלת חשיבות רבה. תלונות קוגניטיביות סובייקטיביות, במיוחד בקרב מבוגרים, שכיחות ביותר. כאשר נוסף על תלונות, כמו ירידה בזיכרון, בעיות בשיום או קשיי ריכוז והתמצאות, נמצאים לקויים קוגניטיביים במבחנים אובייקטיביים, יש לאבחן ירידה קוגניטיבית קלה, וזאת בתנאי שרמת התפקוד היומי נשמרת[6] . יש לציין שבערך 10% מחולים אלו מפתחים דמנציה כל שנה, וכמעט מחציתם יסבלו מדמנציה לאחר מעקב של 5 שנים. בטבלה 2 ניתן לראות הבדלים מהותיים בין הזדקנות קוגניטיבית טבעית, ירידה קוגניטיבית סובייקטיבית, MCI לדמנציה.
אבחנה
דמנציה, שמחלת אלצהיימר היא הגורם השכיח ביותר לה, היא תסמונת קשה המשפיעה על מספר הולך וגדל של אנשים מבוגרים. כל תלונה על שינוי במצב הקוגניטיבי הרגיל דורש אבחון. ההערכה הכוללת דורשת קבלת אנמנזה מלאה עם דגש על תיאור התלונות הקוגניטיביות של המטופל, בדיקה גופנית, הערכה קוגניטיבית ומעבדתית והערכה תפקודית וסוציאלית. השגת מידע זה מאפשר ברוב המקרים קביעת אבחנה ודרכי טיפול. הערכה זו ניתנת לביצוע במסגרת המרפאה הראשונית על ידי השימוש בגישה מובנית, רב פגישתית ורב מקצועית.
לפני התחלת הערכה
הפרעות ראייה ושמיעה מקשות על התקשורת עם החולה, ולכן חשוב להדגיש בפני החולה שעליו להצטייד במשקפי הקריאה ובמכשיר השמיעה לצורך ההערכה. במידת האפשר מומלץ להחזיק מגבר קול לכבדי שמיעה בכל מרפאה (היות והמטופלים רבים עם ליקוי שמיעה אינם משתמשים במכשירי השמיעה שלהם!).
הערכת הפרעות קוגניטיביות
- אנמנזה
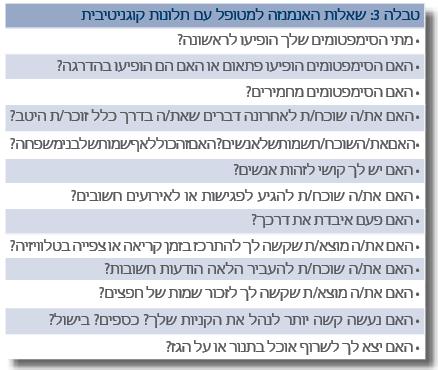
חשוב להשקיע זמן בפרטי האנמנזה ובתולדות המחלה. שאלות שחשוב מאוד לשאול במסגרת לקיחת אנמנזה מוצגות בטבלה 3.
חשוב מאוד לקבל אנמנזה גם מהמטופל עצמו וגם מהמטפל העיקרי, היות ובמקרים רבים הסובל מירידה קוגניטיבית אינו מודע למצבו. לכן, תמיד מומלץ לאמת את הדיווח של המטופל מול זה של בן משפחה או מכר אחר.
לרבים מגורמי הדמנציה יש סממנים אופייניים שמסייעים להבדיל ביניהם, למשל: במחלת אלצהיימר בשלבים המוקדמים, היכולת לשמר ידע חדש נפגע וזה גורם לירידה בזיכרון לטווח קצר. קיימות הפרעות בהתמצאות בזמן ובמקום שעלולות להתבטא במקרים, כגון: החמצת פגישות או מקרים שבהם המטופל מתעורר בשעות המוקדמות של הבוקר כדי להתארגן ליציאה לתיאטרון או התארגנות לביקור במרפאה או במכון. מצד שני, תנודות ברמת ההכרה שוללות לרוב אבחנה של מחלת אלצהיימר ומצביעות יותר על גורמים מטבוליים או אנדוקריניים, על השפעת אלכוהול או תרופות או על מחלת DLB [7] .
מידע לגבי זמן הופעת הסימפטומים יסייע לעתים קרובות להבדיל מחלת אלצהיימר בעלת התפתחות הדרגתית מדמנציה עם התפתחות מהירה או פתאומית, כמו דמנציה וסקולרית. מצב בלבולי, ישנוניות יתר או בעיות זיכרון המופיעים לאחר נפילה או חבלה (לא בהכרח חבלת ראש) יעלו את ההשערה שמדובר ב-Subdural Hematoma. המהלך של מחלת אלצהיימר הוא בדרך כלל ארוך ומתמשך, ולעומת זאת בדמנציה וסקולרית החמרה מדורגת אופיינית יותר[8] . הקצב האיטי של התפתחות מחלת אלצהיימר או DLB מנוגד לקצב המהיר יחסית שבו מתפתחות מחלות, כגון: Creutzfeldt-Jakob Disease או תהליכים תופסי מקום במוח [9] .
השילוב של תסמינים שונים יכול לסייע בהבחנה בין הגורמים השונים לדמנציה. כדוגמה, השילוב של בעיות סמנטיות, כגון: קושי במציאת מילים עם הפרעות התנהגותיות, יכול להצביע על דמנציה פרונטו-טמפורלית או על סיבה וסקולרית. הפרעות בהליכה ואי שליטה בשתן המופיעים בשלבים הראשונים של תהליך דמנציה, יכולים לבשר על הממצא של Normal Pressure Hydrocephalus. פרקינסוניזם מלווה בהזיות ראייה ותנודות בקוגניציה ובהכרה הם סממנים שכיחים של DLB [7] .
נתונים מתוך האנמנזה הרפואית יכולים לכוון את הקלינאי, לדוגמה, כריתת גידול מהשד, אף לפני שנים רבות, עלול להעלות אצל הרופא השערה שמדובר בגרורות במוח. כריתת בלוטת התריס בעבר מעלה השערה שמדובר בתת-פעילות של בלוטת התריס. גורמי סיכון וסקולריים חשובים לא רק לדמנציה וסקולרית אלא גם למחלת אלצהיימר.
סימפטומים, כגון איבוד עניין בפעילות חברתית, ריכוז נמוך, נדודי שינה או איבוד תיאבון, מעלים השערה לאבחנה של דיכאון. כמו שכבר נאמר, דיכאון יכול להוביל ללקות קוגניטיבית או להיות בעל קשר לשלבים ראשונים של מחלת אלצהיימר.
עקב השפעתן של תרופות רבות על הקוגניציה חשוב לקבל דיווח על כל התכשירים שהחולה נוטל, כולל אלו הנרשמים על ידי רופא, תרופות ללא מרשם, ויטמינים ותוספי מזון ותרכיבים הומאופתיים וצמחיים. מכיוון שבחלק מהמקרים יש פער בין התרופות שהקשיש נוטל בפועל ובין רשימת התרופות המופיעה בתיק הרפואי, מומלץ לבקש מהמטופל להביא איתו את כל התרופות והחומרים שהוא נוטל. התרכיבים השכיחים שמשפיעים על הקוגניציה הם החומרים עם השפעה אנטיכולינרגית, וביניהם תרופות עם השפעה על תפקוד שלפוחית השתן, סירופים נגד שיעול והצטננות. חשוב לזכור שלחלק גדול מאוד מהתרופות יש פרופיל אנטיכולינרגי, כמו תרופות הרגעה ונוגדי דיכאון, [[צימטדין] ואפילו פורוסמיד. הגישה המקובלת היא לנסות לצמצם עד כמה שאפשר את השפעת התרופות על הקוגניציה. נוסף על כך, חשוב להתייחס תמיד לאפשרות של שימוש לרעה באלכוהול.
בהשלמת האנמנזה חשוב לשלול את החשיפה לחומרים מסוכנים, כגון: עופרת או חומרים כימיים נוירו-טוקסיים.
בדיקה
בדיקה גופנית יסודית צריכה להתבצע אצל כל המטופלים. חשוב למדוד לחץ דם גם בשכיבה וגם בעמידה כדי לשלול אורטוסטטיזם. דופק לא סדיר, איוושות וביטויים של טרשת עורקים מרמזים על גורם וסקולרי לתסמינים הקוגניטיביים.
בדיקה נוירולוגית קפדנית מסייעת באבחנה. יש לציין כי היעדר ממצאים נוירולוגיים חשוב לא פחות מסימנים נוירולוגיים חיוביים. סימני צד תומכים בגורם וסקולרי או בגורם מוחי ממוקם אחר. סימנים פרונטליים נמצאים בדמנציה פרונטו-טמפורלית ובמחלת אלצהיימר, אך יכולים גם להיות נוכחים במצבים אחרים, כגון: פגיעה וסקולרית של האונה הקדמית.
צריך לשים לב להימצאותו של דיסקינזיה או מיוקלונוס. ברדיקינזיה, רעד וחוסר יציבה מעידים על מחלת פרקינסון, על DLB או לעתים קרובות על תופעות לוואי של תרופות, כמו קבוצת הנוירולפתיים.
הערכת המצב הקוגניטיבי
חשוב להעריך את המצב הקוגניטיבי, ולחלק ממצב זה כבר נעשית הערכה בעת לקיחת האנמנזה הרפואית של המטופל. הערכה זו כוללת אומדן מצב ההכרה של המטופל, כושר ריכוז ורמת קשב. הערכת זיכרון כוללת בתוכה את היכולת לזכור שמות ואירועים מהעבר, זיכרון עבודה (Working Memory) ואיבוד מידע חדש. ההתמצאות בזמן ובמקום חשובה, כמו גם השטף המילולי.
כלים שימושיים להערכה קוגניטיבית הוצגו בגיליון מס' 150 של כתב העת.
ההערכה התפקודית
כאמור, האבחנה של דמנציה מבוססת על ירידה ביכולת התפקודית של המטופל נוסף על ירידה קוגניטיבית. לכן, כל מטופל בעל לקות קוגניטיבית צריך לעבור נוסף על כך, הערכה תפקודית. הבדיקה של פעילויות אינסטרומנטליות יום-יומיות IADL (Instrumental Activities of Daily Living) תכלול בתוכה הערכה של יכולת המטופל לעסוק במשימות של משק הבית, כגון: בישול, ניקיון, כביסה ושימוש בטלפון. נוסף על כך, נאסף מידע על יכולת המטופל לנהל כספים, לערוך קניות ולנהוג או להשתמש בתחבורה הציבורית. מספר כלים פותחו ועברו בדיקת תוקף ומהימנות כדי להעריך את רמת התפקוד ב-IADL[10] , [11] . צריכה להתבצע נוסף על כך הערכה של התפקוד היומי הבסיסי BADL (Basic Activities of Daily Living), כגון: רחיצה, הלבשה, השימוש בשירותים ויכולת האכלה עצמית, וכן בדיקה של ניידות המטופל והעברות. כלי ה-Barthel Index נמצא בשימוש רחב במיוחד כדי להעריך את תפקודי היום-יום אצל מטופלים הסובלים ממגבלה נוירולוגית כרונית, אך יש גם כלים נוספים בשימוש[12] .
בדיקות מעבדה
בדיקות המעבדה המומלצות למטופלים בעלי ירידה קוגניטיבית כוללים: ספירת דם, תפקודי בלוטת התריס, תפקודי כבד וכליות ואלקטרוליטים, סידן וסוכר בדם. רק אם יש ראיות קליניות אחרות, יידרשו בדיקות נוספות, לדוגמה: שקיעת דם, רמות תרופות, ויטמין B12 ובדיקות מעבדה נוספות [13] .
בדיקות דימות
המטרה העיקרית של ביצוע בדיקת דימות היא שלילת ממצאים תוך-מוחיים, כמו גידולים, המטומה סובדורלית והידרוצפלוס בעל לחץ תקין. מצבים אלו נדירים ובדרך כלל (אך לא תמיד) מספקים ביטויים קליניים על קיומם. על פי ההמלצות של ועידת הקונצנזוס של קנדה, הדימות של המוח על ידי CT צריכה להתבצע אם אחד או יותר מהקריטריונים הבאים קיימים [13] :
- גיל צעיר מ-60 שנה וירידה קוגניטיבית ותפקודית מהירה (לדוגמה, תוך מספר חודשים)
- התפתחות של דמנציה במשך פרק זמן קצר (פחות משנתיים)
- פגיעת ראש משמעותית בעת האחרונה. סימפטומים נוירולוגיים לא מוסברים (לדוגמה: הופעה חדשה של כאב ראש חזק במיוחד, פרכוסים)
- היסטוריה של גידולים/סרטן (במיוחד מסוגים הידועים בשליחת גרורות למוח)
- שימוש בחומרים נוגדי קרישה או רקע של הפרעה במערכת הקרישה
- רקע של חוסר שליטה בסוגרים וכן בעיות הליכה בשלבים המוקדמים של הדמנציה (כמו שמוצאים במקרה של הידרוצפלוס בלחץ תקין)
- סימנים נוירולוגיים פוקאליים
- הפרעות בהליכה
קריטריונים אלו עברו בדיקת תוקף ומציעים ספציפיות ודיוק מקובלים. כאשר יש צורך בדימות, במקרים רבים של דמנציה, לא נמצא שום עדיפות לבדיקת MRI על פני CT.
הערכה חברתית/סוציאלית
אבן פינה בהערכה הגריאטרית היא ההערכה החברתית של המטופל, הכוללת את המעמד שלו וכן את מעגל התמיכה מסביבו. מבוגרים רבים חיים לבד ולעתים קרובות אף נמצאים בבידוד חברתי או במצוקה כלכלית. כתוצאה מכך, רבים מהם סובלים מדיכאון, מתת-תזונה וממעקב רפואי בלתי מספיק וכתוצאה מכך הם נוטלים תרופות באופן מועט או מוגזם, וכל הנ"ל יכולים להשפיע על מצבם הקוגניטיבי. ההערכה החברתית חייבת להיות חלק בלתי נפרד מהערכה של דמנציה.
תוכנית ההערכה המדורגת
ההערכה המורכבת והנכונה עבור הפרעות קוגניטיביות עלולה לארוך שעות רבות. מתוך הכרה כי רופא המשפחה עובד לרוב בתוך מסגרת זמן מצומצמת מאוד, יש יתרונות רבים בשימוש בתוכנית ההערכה המדורגת[14] . על פי תוכנית זאת, מקיימים כ-4 מפגשים:
- מפגש 1: לקיחת אנמנזה ובדיקה גופנית
- מפגש 2: הערכה קוגניטיבית ותפקודית
- מפגש 3: הערכה אפקטיבית, שקילת ביצוע בדיקת הדימות וווווווווווווווווווהערכה סוציאלית
- מפגש 4: אבחנה וקביעה של תוכנית התערבות
במקביל, צוות אחר של המרפאה יכול אף הוא לבצע חלקים רבים מתוך ההערכה זו. כך למשל, בשירותי בריאות כללית הוכנסה לאחרונה תוכנה ממוחשבת של הערכת הקשיש שמתבצעת בעיקר על ידי אחות המרפאה הראשונית. הערכה על ידי אחות כוללת תשאול ראשוני ולפי צורך העולה מהתשאול, הערכה תפקודית, הערכה קוגניטיבית והערכה אפקטיבית מתומצתת [15].
כדי לחסוך זמן יקר, ניתן להסתפק בהערכה ראשונית בלבד של הקשיש הסובל מירידה קוגניטיבית, ואם נמצאות ראיות לירידה קוגניטיבית, ניתן להפנות את הקשיש להערכה על ידי גריאטר/נוירולוג/פסיכיאטר או במרפאת זיכרון רב תחומי.
טיפול
מעקב
המטופלים שאובחנו כבעלי קוגניציה תקינה או MCI, צריכים לחזור למעקב מדי שנה. בחולים שתוצאות המעבדה שלהם אינן תקינות, יש לתקן בשלב הראשון את הלקוי ולהמליץ על הערכה נוספת של המצב הקוגניטיבי כעבור מספר חודשים.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- ↑ American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, 4th ed, Washington DC 1994
- ↑ Lopez OL, Kuller LH, Fitzpatrick A, et al. Evaluation of dementia in the cardiovascular health cognition study. Neuroepidemiology 2003;22:1-12
- ↑ Barker WW, Luis CA, Kashuba A, et al. Relative frequencies of Alzheimer disease, Lewy body, vascular and frontotemporal dementia, and hippocampal sclerosis in the State of Florida Brain Bank. Alzheimer Dis Assoc Disord 2002;16:203-212
- ↑ Clarfield AM. The decreasing prevalence of reversible dementias: an updated meta-analysis. Arch Intern Med 2003;163:2219-2229
- ↑ Taylor MA. Pseudo-pseudodementia. Neuropsychiatry Neuropsychol Behav Neurol 1999;12:81
- ↑ Petersen RC, Smith GE, Waring SC, et al. Mild cognitive impairment. Arch Neurol 1999;56:303-308
- ↑ 7.0 7.1 Zesiewicz TA, Baker MJ, Dunne PB, et al. Diffuse Lewy Body Disease. Curr Treat Options Neurol 2001;3:507-518
- ↑ Rockwood K. Vascular cognitive impairment and vascular dementia. J Neurol Sci 2002;203-204:23-27
- ↑ Ballard C, O'Brien J, Morris CM, et al. The progression of cognitive impairment in dementia with Lewy bodies, vascular dementia and Alzheimer's disease. Int J Geriatr Psychiatry 2001;16:499-503
- ↑ Doble SE, Fisher AG. The dimensionality and validity of the older Americans resources and services (OARS) activities of daily living (ADL) Scale. J Outcome Meas 1998;2:4-24
- ↑ Whitelaw NA, Liang J. The structure of the OARS physical health measures. Med Care 1991;29:332-347
- ↑ Mahoney FI, Barthel DW. Functional evaluation: the Barthel Index. Md State Med J 1965;14:61-65
- ↑ 13.0 13.1 Patterson CJ, Gauthier S, Bergman H, et al. The recognition, assessment and management of dementing disorders: conclusions from the Canadian Consensus Conference on Dementia. CMAJ 1999;160:1-15
- ↑ Rockwood K, MacKnight C (Eds). Understanding dementia. A primer of diagnosis and management. Pottersfield Press, Halifax, Nova Scotia, Canada 2001
- ↑ Press Y, Hazzan R, Clarfield AM, et al. A semi-structured computerized screening interview for the assessment of older patients in the primary care setting. Int J Disabil Hum Dev (Accepted for publication)
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר צבי דוולצקי, ד"ר יאן פרס
ירידה קוגניטיבית בגיל המבוגר היא שכיחה. תהליך הבירור וההערכה הראשונית דורש זמן רב, ובמסגרת פרקטיקה עמוסה של רופא המשפחה היא מטלה לא פשוטה. במאמר זה מוצגים מושגים בסיסיים וגישה מעשית להערכה קוגניטיבית, המאפשרת לרופא הראשוני להעריך את המטופל עם תסמינים קוגניטיביים בצורה טובה במסגרת המרפאה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק