תסמונת פראדר-וילי - Prader-Willi syndrome
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונת פראדר-וילי | ||
|---|---|---|
| Prader-Willi syndrome | ||
| שמות נוספים | PWS | |
| יוצר הערך | ד"ר מרינה מיכלסון, ד"ר דורית לב
|
|
תסמונת פראדר-וילי (PWS ,Prader-Willi), הנקראת בעברית "תסמונת הרעב הקטלני", היא תסמונת גנטית מורכבת, רב מערכתית עם תסמינים דיסמורפיים (Dysmorphic), עצביים והתנהגותיים אופייניים. התסמונת תוארה לראשונה בשנת 1956 על יד צוות רופאים שוויצרים: Guido Fanconi, Andrea Prader, Heinrich Willi, Alexis Labhart, Andrew Ziegler, שעקבו במשך שנים רבות אחרי תינוקות עם רפיון שרירים חמור לאחר הלידה (1). יותר מ-50 שנה עברו מהתיאורים הראשונים של תסמונת פראדר-וילי ו-27 שנים מאז שנמצא הפגם הגנטי האחראי לתסמונת. התסמונת נגרמת מחוסר תרומה אבהית של גנים בכרומוזום מספר 15 באזור PWS/AS. בשנים האחרונות חלה התקדמות רבה בהבנת המנגנון הגנטי, מהלך התסמונת ודרכי הטיפול. ברוב המקרים ניתן לבצע אבחון מולקולרי. טיפול במתן הורמון גדילה, שהוא התפתחות מהותית בטיפול בתסמונת, שיפר באופן ניכר את מהלך התסמונת ואת מניעת הסיבוכים הקשים הנלווים.
אפידמיולוגיה
ההערכה כיום היא כי שכיחות התסמונת כ-1/15,000-1/30,000 (2)
אטיולוגיה
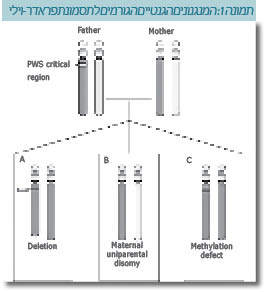
תסמונת פראדר-וילי היא "הפרעה גנומית", כלומר: נובעת מהפרעה במבנה הגנום או הפרעה אפיגנטית במנגנון ההחתמה (Genomic imprinting). התסמונת נגרמת מחוסר תרומה אבהית של גנים בכרומוזום מספר 15 (אזור 15q11-q13 PWS/AS). זו התסמונת הגנטית הראשונה שתוארה בהקשר להחתמה גנומית והיא יכולה להיגרם כאשר יש תרומה של שני מקטעים כרומוזומליים אימהיים בלבד בכרומוזום 15 (UPD ,Uniparental Disomy).
אזור זה כולל גנים שביטויים שונה בהתאם לתרומה ההורית. באופן תקין הגנים באזור זה, שמקורם בכרומוזום 15 האימהי, מושתקים, ואילו אלה שמקורם בכרומוזום 15 האבהי מתבטאים. כאשר יש חסר של תרומה אבהית שיכול להיגרם בשל מספר מנגנונים, תיגרם תסמונת PWS. יש 3 מנגנונים עיקריים הגורמים לתסמונת:
- חסר מזערי(Microdeletion) של האזור - במרבית המקרים (70%)
- UPD אימהי - תרומה אימהית בלבד של שני עותקים של האזור 15q11-13 ב-30%-25% מהמקרים
- פגמים בתהליך ההשתקה בכרומוזום האבהי (תמונה 1).
- שינויי מבנה כרומוזומליים באזור תוארו במספר מקרים (11,10,3).
האזור בכרומוזום 15q11.2-q13 מורכב וכולל מספר גנים שחלקם מוחתמים (Imprinted) וחלקם לא מוחתמים. חלקו הפרוקסימלי (Proximal) של האזור כולל מספר גנים שמתבטאים מהאלל האבהי, מתוכם 5 גנים מקודדים לחלבונים: MKRN3 ,MAGEL2 ,NECDIN, SNURF-SNRPN וקבוצת גנים לא מקודדי חלבון: snoRNA ו-Antisense transcripts. עד היום לא זוהה גן האחראי על המאפיינים הפנוטיפים בניגוד לתסמונת אנגלמן שם ידוע הגן האחראי - UBE3A. דיווחים אחרונים בספרות מצביעים על הגן HBII-85 מקבוצת snoRNA כאחראי על הופעת הפנוטיפ במודל עכבר (12). מקרים של תסמונת PWS הנגרמים בעקבות חסר מזערי, UPD ושינויי מבנה כרומוזומליים באזור, אינם תורשתיים אלא אקראיים, ולכן סיכון החזרה נמוך ביותר. מוטציה במרכז ההשתקה היא תורשתית עם סיכון הישנות של 50%.
קליניקה
תסמונת PWS היא תסמונת גנטית מורכבת המתאפיינת במעורבות של מערכות גוף שונות. הסימנים העיקריים כוללים ריפיון שרירים חמור המופיע מיד לאחר הלידה, קשיי האכלה והפרעות בשגשוג (FTT, Failure To Thrive) בשנה הראשונה לחיים, איחור התפתחותי ופיגור שכלי קל עד בינוני, תת-פעילות בלוטות מין (Hypogonadism), קומה נמוכה, מאפיינים דיסמורפיים ייחודיים, בעיות ראייה והפרעת התנהגות אופיינית המתבטאת באכילת יתר ללא תחושת שובע, התקפי זעם וטורדניות. אכילת יתר זו גורמת להשמנה חולנית (Morbid obesity), הפרעות אנדוקריניות, הפרעות שינה קשות ועקמת. סוכרת סוג II (סוכרת שאינה תלויית אינסולין) מופיעה אצל רוב הלוקים בתסמונת.
- כאמור, מדובר במצב שמאפייניו מיד לאחר הלידה כוללים מתח נמוך מאוד של השרירים, קשיי האכלה, עלייה איטית במשקל ובגובה וכן מראה אופייני. רפיון השרירים מופיע בתוך הרחם ומתבטאת במיעוט תנועות עובר, מצג עובר לא תקין ולעתים סיבוכים בלידה. לאחר הלידה בעיות קשות בהאכלה, איחור בהתפתחות המוטורית וקשיי עלייה במשקל. רוב החולים נזקקים להאכלה דרך מחדר אפי-קיבתי ("זונדה", Nasogastric feeding tube) עקב בעיות מציצה והפרעות במנגנון הבליעה. רפיון השרירים נמשך עם הגיל, מאופיין כמרכזי. החזרים גידיים בדרך כלל תקינים.
- לאחר גיל שנה (בד"כ סביב גיל שנתיים) מתחילה להופיע השמנה בשילוב של אכילת יתר טורדנית ללא תחושת שובע, מיעוט פעילות גופנית ובעיות התנהגות סביב האוכל. אכילת יתר נגרמת מהפרעה בתת רמה (Hypothalamus) שיכולה גם להתבטא בעליות חום בלתי מוסברות (4-1). מאפיינים התנהגותיים שחלקם נובעים מחיפוש מזון מתמיד מתבטאים בהתנהגות מרוכזת בעצמם (Egocentric), עמידה בלתי מתפשרת על הרצון ושתלטנות כפייתית. בגיל הרך יכולים להופיע התפרצויות זעם (Temper tantrums) וסחיטה רגשית (Manipulative). חלק מהתסמינים ההתנהגותיים מזכירים הפרעות מהקשת האוטיסטית שנמצאים בכ-25% מהחולים. נוסף על כך, קיימות הפרעות קשב וריכוז שמתחילות בגיל צעיר (5), חוסר שליטה והפרעות בהתנהגות וכתוצאה מכך, הפרעת אכילה טורדנית המובילים להשמנה מרכזית, ירידה בקצב חילוף החומרים, ירידה בפעילות גופנית וכתוצאה מכך לאי ספיקת לב.
הפרעות בהתפתחות מינית אופייניות לשני המינים ומתבטאות בהיפופלזיה של איברי המין, איחור בהתבגרות המינית והפרעות בפוריות. ל-90%-80% מהבנים הלוקים בתסמונת PWS איבר מין קטן, אשכים היפופלסטיים עם אשך טמיר אחד או דו-צדדי. איחור והפרעה בהתבגרות המינית מאפיינת את שני המינים. מנרכה יכול להופיע בגיל כ-30 שנים ובדרך כלל קיימים אוליגו-ואמנוריה.
הפרעות גניטליות נגרמות מהפרעה היפותלמית עם סימנים של Hypogonadotropism - רמות טסטוסטרון או אסטרוגן נמוכים, FSH ו-LH נמוכים.
לחלק מחולי PWS תת-פעילות של בלוטת התריס ממקור מרכזי או פריפרי, המחייבת מעקב תפקודי בלוטת התריס וטיפול אם יש בעיה.
קומה נמוכה קיימת אצל כל החולים, והיא נובעת מחוסר הורמון גדילה. בהיעדר טיפול הגובה הסופי הוא כ-155 ס"מ אצל זכרים ו-148 ס"מ אצל נקבות 6)).
סיבוכים
הסיבוכים המתפתחים הם הפרעות שינה חסימתיות (Obstructive Sleep Apnea) OSA, טרומבופלביטיס ובצקות רגליים כרוניות. יותר מ-25% מחולי PWS מפתחים סוכרת מסוג 2 (NIDDM). גיל הופעה ממוצע 20 שנה (7).
איחור התפתחותי רב תחומי מופיע במרבית החולים. ההישגים הראשונים (ישיבה, זחילה, הליכה) מופיעים בד"כ באיחור של כפי שניים מהתקין: ישיבה בגיל 12 חודשים, זחילה בגיל 18 חודשים והליכה בגיל 24 חודשים. מילים ראשונות בסביבות גיל שנתיים. איחור בהתפתחות השפה, התקשורת ובעיקר בעיות למידה הם שכיחים. לרוב החולים פיגור שכלי קל (IQ 60-70), אצל 40% רמה שכלית גבולית תקינה, ולכ-20% - פיגור שכלי בינוני. ללא קשר לרמה הקוגניטיבית, בעיות למידה קיימות אצל הרוב הגדול של החולים. מרבית המבוגרים זקוקים לסיוע במשך כל החיים גם בהסתגלות וגם בשליטה התנהגותית (9,8).
המראה האופייני כולל מבנה עיניים בצורת שקד, שפה עליונה צרה, לחיים מלאות והיפוגניטליזם. לחלק גם היפופיגמנטציה של העור ושיער בהיר, ונוסף על כך, כפות ידיים ורגליים קטנות. קיימת נטייה לפתח עקמת בהמשך. חלק מחולי PWS מפתחים הפרעות נשימה בשינה (Sleep-Related Breathing Disorders). הפרעות אלה נגרמות מהשמנה, עקמת, היפרטרופיה של השקדים והיפוטוניה.
בעיות נוספות שתוארו כוללות בעיות עיניים ובעיות שיניים ורוק סמיך.
Genotype-Phenotype Correlations
אצל חולים שאצלם נגרמה התסמונת בגלל UPD, בעיות התנהגות ואיחור התפתחותי קלים יותר והסימנים הדיסמורפיים פחות בולטים ופחות שכיחה היפופיגמטציה. לעומת זאת, הפרעות נפשיות והפרעות בתקשורת מהספקטרום האוטיסטי שכיחות יותר. חולים עם חסר מזערי מפגינים בעיות התנהגות, קשיי למידה ובעיות הסתגלות קשות יותר (15-13).
אבחנה
יש חשיבות רבה באבחון התסמונת בשלבים מוקדמים, עדיף לפני שלב ההיפרפגיה. הקריטריונים הקליניים שמעלים חשד לתסמונת PWS לפי גילאים שונים תוארו ע"י .Gunay-Aygun et al. ב-2001 (16).
על סמך הממצאים הקליניים הבאים מומלץ לבצע בדיקה גנטית לתסמונת פראדר-וילי:
- מהלידה עד גיל שנתיים: היפוטוניה קשה, קשיי האכלה ומציצה.
- גיל שנתיים עד גיל 6 שנים: היפוטוניה עם היסטוריה של קשיי מציצה ואיחור התפתחותי כללי.
- מגיל 6 שנים עד 12 שנים: סיפור של היפוטוניה עם קשיי מציצה. היפטוניה, איחור התפתחותי גלובלי, אכילת יתר, אובססיביות, השמנה מרכזית.
- מגיל 12 שנים ומעלה: קשיים קוגניטיביים, פיגור שכלי קל, אכילת יתר עם השמנה מרכזית בלתי נשלטת, Hypothalamic Hypogonadism ותסמינים התנהוגתיים אופייניים (שתלטנות כפייתית, Temper Tantrum).
אבחון גנטי
ש לציין, שמעל %99 מהמקרים של תסמונת PWS ניתנים לאבחון מולקולרי (3).עם זאת, עדיין לא זוהה הגן האחראי לתסמונת. זיהוי גנים אלה יאפשר הבנת התהליכים הקשורים בהשמנה, באכילת יתר, בהתנהגות אובססיבית, בהיפוגונדיזם ובמנגנונים היפותלמיים. מבחינה מולקולרית, אין הפרעה בריצוף הדנ"א באזור כרומוזום 15q11-q13 וביטוי הגנים נקבע בהתאם לתרומה ההורית. השתקת הגנים מתבצעת על ידי תהליך מטילציה של הדנ"א או החתמה. גנים מוחתמים אינם מתבטאים. כך, ע"י בדיקת דגם המטילציה של האזור ניתן לזהות תרומה אימהית, אבהית ותרומה משני ההורים. בדיקת המטילציה מקובלת כיום כבדיקה המולקולרית לתסמונת PWS (7,8). בשיטה זאת בודקים את דגם המטילציה של הפרומוטר (אזור 5') של האתר Snurf-Snrpn. במצב תקין יש שני אללים: אלל שעבר מטילציה (מהאם) שהוא מושתק, ואלל ללא מטילציה (מהאב) שהוא מתבטא. אצל חולי PWS מדגימים באזור רק אלל אחד שעבר מטילציה (האימהי) - חוסר תרומה אבהית.
לאחר בדיקת מטילציה, מקובל להמשיך בבירור המולקולרי כדי לקבוע באיזה תת-קבוצה גנטית מדובר ולאפשר ייעוץ גנטי. בדיקת HSIF (Hybridization Fluorescence in situ) עם גלאי SNRPN מאפשרת לאבחן חסר מזערי (Microdeletion), שקיים בכ-70% מהלוקים בתסמונת. במקרים אלה חשוב לבצע בדיקת כרומוזומים אצל החולה ואצל הוריו, כי לעתים קיימת טרנסלוקציה בכרומוזומים.
תרומה של שני אללים מהאם בלבד, או Maternal UPD, אחראית על 30%-20% מהמקרים של PWS. על ידי בדיקת סמנים פולימורפיים בבדיקת דנ"א של החולה והוריו ניתן לאבחן הפרעה זאת (10,9).
כ-5%-2% מהמקרים של PWS נגרמים בעקבות פגם בתהליך ההשתקה Imprinting Defects. מרבית המקרים הם אפיגנטיים, כלומר: מופיעים כתקלה בספרמטוגנזיס, ואינם תורשתיים (17). אולם, אצל 15% מקבוצה זאת התסמונת נובעת ממוטציה במרכז השתקה Imprinting Center)), בקצה 5' של גן SNRPN. במצב זה סיכון ההישנות הוא 50%.
שיטה מולקולרית חדשנית APLM Methylation-Specific) Multiplex Ligation PCR Amplification) מאפשרת כיום לאבחן מטילציה כמותית של הדנ"א ולהבדיל בין מיקרודלציה ל-UPD ול-Imprinting Defects (81).
אבחנה מבדלת
אבחנה מבדלת של היפוטניה בגיל הינקות כוללת מחלות שונות, חלקן גנטיות וחלקן נרכשות. ניתן לתאר את ההיפוטוניה כמרכזית או פריפרית, והיא יכולה להיות מבודדת או כחלק מתסמונת.
תסמונת אנגלמן (AS) נובעת גם היא מחסר מזערי בכרומוזום 15q11.2-q13 ב-70% מהמקרים, אך בניגוד ל-PWS, החסר בתסמונת אנגלמן הוא של התרומה האימהית. בשלבים הראשונים של תסמונת אנגלמן יש לעתים היפוטוניה ובעיות אכילה. לכן, ממצא של חסר ב-15q11.2-q13 בבדיקת FISH אצל יילוד עם היפוטוניה וקשיי אכילה מחייב בדיקת דגם מטילציה כדי להבדיל בין שתי התסמונות.
אבחנה מבדלת של השמנה, היפרפגיה, כוללת בין היתר את תסמונת ה-X השביר, תסמונות Cohen ,Bardedt-Biedl ,Alstrom ושינויים מבניים בכרומוזומים, כמו: דופליקציה בכרומוזום 3p25.3-p26.2 ו-Xq27.2ter, וחסרים (Deletions) בכרומוזומים 1p36 ,6q16.2 ,10q26 הניתנים לזיהוי ע"י בדיקת CGH Microarray. כמו כן, גם UPD אימהי של כרומוזום 14 (3).
טיפול
הטיפול הוא תומך, מורכב ורב תחומי. לאחרונה הוכח כי מתן הורמון גדילה גורם לשיפור במספר בעיות הכוללות גדילה, שליטה על העלייה במשקל על ידי הגדלת ה-Lean Body Mass ואף שיפור בהפרעות התנהגותיות. הטיפול הוא רב מערכתי ונעשה ע"י צוות רב תחומי שכולל דיאטנים, צוות התפתחות הילד, נוירולוג, אורטופד, אופתלמולוג, אנדוקרינולוג, פסיכולוג ועובד סוציאלי (20,19).
הפרעות האכילה שנובעות מהיפוטוניה קשה וקשיי מציצה בגיל הרך דורשות לעתים האכלה דרך גסטרוסטומיה, אולם חשוב לציין שבעיית האכילה משתפרת עם הזמן והופכת לאכילת יתר.
טיפול ממוקד באיחור ההתפתחותי, ההיפרפגיה והפרעות ההתנהגות הקשות הוא טיפול רב תחומי ודורש מעקב צמוד.
כיום ניתן לטפל בחלק מהבעיות המתוארות ע"י מתן הורמון גדילה שהוכח כיעיל, הן בשיפור עקומות הגדילה והן בשליטה בעלייה במשקל על ידי הגדלת ה-Lean Body Mass וכתוצאה מכך ירידה באחוזי השומן ושמירה על תכולת המינרלים של העצם (24-21). זאת נוסף על טיפול תומך רב תחומי. כאשר הטיפול מתחיל בחודשים הראשונים לחיים, ניתן לגרום לשיפור גם בסימנים הדיסמורפיים האופייניים ומבנה הגוף (26,25). תופעות לוואי לטיפול בהורמון גדילה נדירות, וכוללות בצקות ברגליים, החמרה בסקוליוזיס, Slipped Capital Femoral Epiphysis, Pseudotumor Cerebri ו-Premature Adrenarche.
במשך מספר שנים היו דיווחים בספרות על מוות פתאומי והחמרה בחסימה נשימתית בקשר למתן הורמון גדילה. דיונים רבים בהמשך ומעקב אחר קבוצות גדולות של מטופלים הביאו למסקנה שאין קשר בין מוות פתאומי למתן הורמון גדילה (29-27).
ההמלצה כיום היא לבצע מבחן שינה, לעבור בדיקת אף אוזן גרון לאבחון הגדלת שקדים והיפרטרופיה של אדנואידים ולבדוק תפקודי בלוטת התריס לפני תחילת הטיפול.
לגבי השאלה אם עקמת מחמירה בעקבות מתן הורמון גדילה ומהי הגישה לאלה שכבר סובלים מעקמת, הדעה כיום היא, שאין החמרה בעקמת בעקבות מתן הורמון גדילה. אולם, עדיין אין קונצנזוס במקרים שהעקמת כבר קיימת. יש מספר עבודות העוקבות כרגע אחר עקמת בחולים בתסמונת המקבלים הורמון גדילה, והדעה כיום היא שיש להמשיך בטיפול בעקמת ולחדש טיפול בהורמון גדילה (33-30).
בעיות התנהגות ובעיות נפש חשוב לנטר מוקדם ולטפל בהתאם. Serotonin Agonists נחשבים כתרופות יעילות ביותר בטיפול בהתקפי זעם ובאובססיביות וקומפולסיביות (35-33).
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- Bittel DC, Butler MG. Prader-Willi Syndrome: clinical genetics, cytogenetics and molecular biology. Expert Rev Mol Med 2005;7:1-20
- Golstone AP. Prader-Willi syndrome: advances in genetics, pathophysiology and treatment. Trends Endocrinol Metab 2004;15:12-20
- Cassidy SB, Driscoll DJ. Prader-Willi Syndrome Eur J Hum Genet 2009;17:3-13
- Miller SP, Riley P, Shevell MI. The neonatal presentation of Prader-Willi syndrome revisited. J Pediatr 1999;134:226-228
- Dykens EM, Roof E. Behavior in Prader-Willi syndrome: relationship to genetic subtypes and age. J Child Psychol Psychiatry 2008;49(9):1001-1008
- Butler MG, Meaney FJ. Standards for selected anthropometric measurements in Prader-Willi syndrome. Pediatr 1991;88:853-860
- Butler JV, Whittington JE, Holland AJ, et al. Prevalence of, and risk factors for, physical ill-health in people with Prader-Willi syndrome: a population-based study. Dev Med Child Neurol 2002;44:248-255
- Dykens EM, Hodapp RM, Walsh K, et al. Profiles, correlates and trajectories of intelligence in individuals with Prader-Willi syndrome. J Am Acad Child Adolesc Psychiatry 1992;31:1125-1130
- Whittington J, Holland A, Webb T, et al. Cognitive abilities and genotype in population-based sample of people with Prader-Willi syndrome. J Intellect Disabil Res 2004;48:172-187
- Glenn CC, Saitoh S, jong MT, et al. Gene structure, DNA methylation, and imprinted expression of the human SNRPN gene. Am J Hum Genet 1996;58:335-346
- Glenn CC, Discoll DJ, Yang TP, et al. Genomic imprinting: potentional function and mechanisms revealed by the Prader-Willi and Angelman syndromes. Mol Hum Reprod 1997;3:321-332
- Ding F, Li HH, Zhang S, et al. SnoRNA Snord116(pwcr1/MBII-85) deletion causes growth deficiency and hyperphagia in mice. PLoS ONE 2008;3:1709
- Cassidy SB, Forsythe M, Heeger S, et al. Comparison of phenotypic features between patients with Prader-Willi syndrome due to deletion 15q and uniparental disomy 15. Am J Med Genet 1997;68:433-440
- Gillesen-Kaesbach G, Robinson W, Lohman D, et al. Genotype-phenotype correlation in a series of 167 deletion and non-deletion patients with Prader-Willi syndrome. Hum Genet 1995;96:638-664
- Milner KM, Craig EE, Thompson RJ, et al. Prader-Willi syndrome: intellectual abilities and behavioural features by genetic subtype. J Child Psychol Psychiatry 2005;46:1089-1096
- Gunay-Aygun M, Schwartz S, O’Riordan MA, et al. The changing purpose of Prader-Willi syndrome clinical diagnostic criteria and proposed revised criteria. Pediatrics 2001;108:92
- Buiting K, Gross S, Lich C, et al. Epimutations in Prader-Willi and Angelman syndromes: a molecular study of 136 patients with an imprinting defect. Am J Hum Genet 2003;72:571-577
- Bittel DC, Kibiryeva N, Butler MG. Methylation-specific multiplex ligation-dependent probe amplification analysis of subjects with chromosome 15 abnormalties. Genet Test 2007;11:467-475
- Golstone AP, Holland AJ, Hauffa BP, et al. Recommendations for the diagnosis and management of Prader-Willi syndrome. J Clin Endocrinol Metab 2008;93 (11):4183-4197
- Wigren M, Hansen S. Prader-Willi syndrome: clinical picture, psychosocial support and current management. Child Care Health Dev 2003;29:449-454
- Lingen AC, Hagenas L, Muller J, et al. Growth hormone treatment of children with Prader-Willi syndrome affects linear growth and body composition favourably. Acta Paediatr 1998;87:29-31
- Mogul HR, Lee PDK, Whitman BY, et al. Growth hormone treatment of adults with Prader-Willi syndrome and growth hormone deficiency improves lean body mass, fractional body fat, and serum triiodothyronine without glucose impairment: results from the US multi-center trial. J Clin Endo Metab 2008;93:1238-1245
- EiholzerU. Prader-Willi Syndrome. Effects of Human Growth Hormone Treatment. Basel, Karger 2001
- Carrel AL, Moerchen V, Myers SE, et al. Growth hormone improves mobility and body composition in infants and toddlers with Prader-Willi syndrome. J Pediatr 2004;145:744-749
- Haqq AM, Stadler DD, Jackson RH, et al. Effects of growth hormone on pulmonary function, sleep quality, behavior, cognition, growth velocity, body composition, and resting energy expenditure in Prader-Willi syndrome. J Clin Endocrinol Metab 2003;88:2206-2012
- Carrel AL, Lee PDK, Mogul HR. Growth hormone and Prader-Willi syndrome; in Butler MG Lee PDK, Whitman BY (eds): Management of Prader-Willi Syndrome. Springer: New-York, 2006;201-244
- Fillion M, Deal C, van Vilet G. Retrospective study of the potential benefits and adverse events during growth hormone treatment in children with Prader-Willi syndrome. J Pediatr 2008;22:1-4
- Eiholzer U. Deaths in Children with Prader-Willi syndrome. Horm Res 2005;63:33-39
- Craig ME, Cowell CT, Larsson P, et al. Growth hormone treatment and adverse events in Prader-Willi syndrome: data from KIGS (the Pfizer International Growth Database). Clin Endocrinol (Oxf) 2006;65:178-188
- Lindgen AC. Somatotropin therapy for children with Prader-Willi syndrome: guidelines for use. Treat Endocrinol 2006;5:223-228
- Hoybye C. Five-years growth (GH) treatments in adults with Prader-Willi syndrome. Acta Paediatr 2007;96:410-413
- Miller J, Silverstein J, Shuster J, et al. Short-term effects of growth hormone on sleep abnormalities in Prader-Willi syndrome. J Clin Endocrinol Metab 2006;91:413-417
- Diene G, de Gauzy JS, Tauber M. Is scoliosis an issue for giving growth hormone to children with Prader- Willi syndrome? Arch Dis Child 2008;93:1004-1006
- DykensE, Shah B. Psychiatric disorders in Prader-Willi syndrome: epidemiology and management. CNS Drugs 2003;17:167-178
- Steinhausen HC, Eiholzer U, Hauffa BP, et al. Behavioural and emotional disturbances in people with Prader-Willi syndrome. J Intellect Disabil Res 2004;48:47-52
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר מרינה מיכלסון, ד"ר דורית לב; המכון לגנטיקה ומרפאת מגן, מרכז רפואי וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק