תסמונת רב בלוטית - Multiple endocrine neoplasia
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של הבלוטות האנדוקריניות | |
התסמונת הרב-בלוטית הינה מן המעניינות והמורכבות שבתסמונות המוכרות לנו. גילויים חדשים בשטח זה נתאפשרו הודות לשכלול אמצעי האבחון, והביאו לשינויים בהבנת הפתוגנזה של התסמונת. מקובל לחלק את התסמונת הרב-בלוטית לשתי קבוצות עיקריות, כאשר אחת מהן מתחלקת לשתי תת-קבוצות. יש המחלקים את התסמונת לשלוש קבוצות: 1, 2, 3.
תסמונת רביבלוטית מסוג 1, המוכרת גם כתסמונת על-שם Wermer, כוללת:
- אדנומה של יותרת-המוח.
- אדנומה או היפרפלזיה של יותרת-התריס.
- אדנומה של איי הלבלב השונים: אלפא, ביתא או דלתא. אדנומות לבלביות אלו יכולות לגרום תסמונות קליניות שונות (היפוגליקמיה, זולינגר-אליסון וכוי), בהתאם לטיב התאים. לפעמים נכללות בתסמונת הרב-בלוטית מסוג זה גם שאתות קרציונאידיות.
- שאת של קליפת יותרת-הכליה (אדרנל).
- ליפומות, פוליפים של הקיבה, תימומות ושוואנומות.
תסמונת רביבלוטית מסוג 2, על-שם Sipple, הינה פחות רב-גונית וכוללת:
- פאוכרומוציטומה.
- אדנומה או היפרפלזיה של בלוטות יותרת-התריס.
- קרצינומה מדולרית של בלוטת התריס.
קיים וריאנט של תסמונת רב-בלוטית מסוג 2, אשר מאופיין על-ידי אותה פגיעה בשלוש הבלוטות (הפגיעה ביותרת-התריס שכיחה פחות בסוג זה), בנוסף לשאתות העצב (neuroma) בריריות, שפתיים עבות (בשרניות), מראה מרפאנואידי והיפרפלזיה של עצבים קראניאליים וכן פגיעות שונות במערכת העיכול. סוג מיוחד זה נקרא תסמונת רב-בלוטית מסוג 2B או מסוג 3.
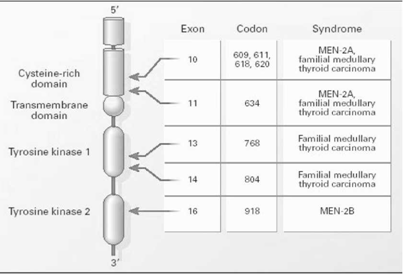
כל סוגי התסמונת הרב-בלוטית מועברים בצורה תורשתית על-ידי גן אוטוסומלי המופיע כמוטציה ומועבר כצורה שולטנית בעלת חדירות גבוהה (איור 5.14 ).
עד כה תוארו בספרות כ-250 מקרים אשר סווגו תמיד לאחת מהקבוצות הללו, וכאשר הופיעו מקרים אשר כללו שאתות משתי הקבוצות, הם נקראו על-שם אחד מסוגי התסמונת הרב-בלוטית בצירוף אותה שאת השייכת כביכול לסוג השני. לדוגמה: תסמונת רב-בלוטית מטיפוס 2 ביחד עם תסמונת זולינגר-אליסון, או למשל קרצינואיד המלווה את התסמונת הרב-בלוטית מסוג 2. הטענה היתה שהחפיפה בין הסוגים הינה אפסית.
התקדמות רבה בהבנת התסמונת הרב-בלוטית חלה הודות לתגליתו של פירס, שטבע את המונח APUD (amine precursor-uptake & decarboxylation), הכולל בתוכו תאים ממקור עצבי המפוזרים בגוף, החל ממערכת העצבים המרכזית ועד למערכת העיכול. לתאים אלה יש יכולת לשגשג או להפוך לשאתות (אפודומות) בעת מוטציה גנטית. הם מסוגלים לעשות דקארבוקסילציה של מבשרים אמיניים (amine precursors) ולייצר פפטידים המוכרים היטב. תכונה שלישית, הקיימת בתאים אלה והמאפיינת תאים ממקור עצבי, היא נוכחות כולינאסטראזה בתוך התאים.
מערכת עצבית-אנדוקרינית זו נחקרה רבות בעזרת שיטות אימונו- פלורסצנטיות, היסטו-כימיות וציטו-כימיות והמידע שנתקבל עד כה תומך במקור המשותף לכל תאי המערכת. Marangos וחבריו מצאו נוכחות איזואנזימים של אנולאזה (enolase) בתאי ה-APUD. הן באלה הנמצאים במערכת העצבים המרכזית, והן באלה שבפריפריה. איזואנזים זה נחשב פעם כספציפי רק לתאי עצב.
Orci הדגים בתאי ה-APUD גרגרים (גראנולות) המכילים פפטידים או מבשריהם, או אמינים, בהתאם לסוג התא. גרגרים אלה אופייניים לתאים אנדוקריניים המאחסנים הורמונים בצורה זו ומשחררים אותם לפי הצורך.
האפודומות נחקרו רבות ותרמו להבנה בשטח זה. ניתן להגדיר אפודומה כשאת המורכבת מתאי APUD, אשר מבחינה ביולוגית מפרישה פפטידים פעילים, או בלתי פעילים (מבשרים או פרגמנטיים), או אמינים ביולוגיים. מבחינה פתולוגית מאופיינת האפודומה על-ידי היכולת לקלוט מבשרים אמיניים, ועל-ידי נוכחות הגרגרים האופייניים בתוכה. באופן נורמלי נוצר הורמון פוליפפטידי פעיל כתוצאה מפעולה של פרוטאזה ספציפית על מולקולה גדולה יותר (פרוהורמון או פרה-פרו-הורמון) שהוא המבשר של אותו הורמון. באפודומות נמצאו ריכוזים גבוהים של מבשרים הורמוניים כאלה (פרואינסולין, פרופאראתהורמון). כאשר ריכוז הפרוטאזה הספציפית אינו גבוה דיו, ניתן לגלות את המבשרים הללו גם בדם הפריפרי.
תגלית מעניינת בנושא זה היתה גילויו של חלבון בעל משקל מולקולרי של 65,000 דלטון בשאתות אנדוקריניות, אשר היה מסוגל לשחרר אינסולין, גסטרין וכו', בהתאם לפרוטאזות שהופעלו עליו, וניתן היה להשקיעו עם אנטי-נסיובים שונים, כגון אנטי-אינסולין ואנטי-גסטרין. חלבון זה שכונה "המבשר המשותף", נמצא גם בקרצינומה מדולרית של התריס, בעלת דרגת התמיינות גבוהה. פרוטאזות מיקרוסומיות שמקורן בשאת זו, מסוגלות לשחרר ממנה פפטיד השוקע עם אנטיסרום לקלציטונין.
על סמך הנתונים, שהצטברו במחקרים שהוזכרו, מסכם פירס את סקירתו המאלפת בהנחה הבאה: בשלב הראשון גורמת מוטציה גנטית לריגוש של תאי APUD; בשלב השני מתרחש גירוי המעורר את כל שורת תאי ^APUD, או מספר גירויים, שכל אחד מעורר שורה ספציפית של תאי APUD, וגורם להם לעבור היפרפלזיה או אפילו להפוך לשאתות. אם אמנם נכון הדבר, שמקורם של תאים אלה בתא משותף אחד, והוא המקנה להם את תכונותיהם המשותפות, הרי מיותר לחלק תאי APUD לתאים ממקור אנדודרמי - תסמונת רב-בלוטית מסוג 1 , או ממקור אקטודרמי - תסמונת רב-בלוטית מסוג 2.
בספרות הופיעו מספר הודעות על אדנומה פיטואיטרית המפרישה פרולקטין בנוסף לתסמונת רב-בלוטית מסוג 1 . Jacobs היה הראשון שתיאר חולה כזה ב-1974 , כאשר ההוכחה ההיסטולוגית המוצקת על- ידי צביעה מיוחדת של השאת הופיעה רק ב-1977, כך שכיום אדנומה של יותרת המוח יכולה להיות מלווה פרולאקטינומה ואולי להיפך.
המקור המשותף של גידולים אלה - תאי האפוד - מסביר ביתר קלות את אותם המקרים. המתרבים והולכים, שבהם קיימות שאתות השייכות לשתי הקבוצות של תסמונת רב-בלוטית. בנוסף, יש להיות ערניים לכך, שגילוי תסמונת מסוג מסוים בחולה, אינה פוטרת המשך חיפוש של שאתות השייכות לתסמונת רב-בלוטית מהסוג האחר. עד כדי כך התקדמו הדברים, שהופיע תיאור של משפחה שבה נמצאה תסמונת רב-בלוטית מעורבת באותו בן משפחה ובבני המשפחה השונים ולהם סמן (marker) גנטי על כרומוסום 15.
לאחר הניסיונות המרובים שנעשו במטרה לסווג את תאי ה-APUD לקבוצות (אקטודרם, אנדודרם), שוב חוזרת הקונספציה לנקודת המוצא של מקום משותף לכל התאים. זאת על סמך התגליות של קיום איזואנזימים כמו האנולאזה בתאי ה-APUD , במערכת העצבים המרכזית ובפריפריה, הדגמת גרגרים המאחסנים בתוכם הורמונים, נוכחות "המבשר המשותף", ותכונות משותפות אחרות שנתגלו הודות לשיטות ציטוכימיות, היסטוכימיות ואימונופלורוסצנטיות חדישות.
תסמונת על-שם Wermer (MEN-1)
1-MEN תוארה על-ידי Wermer וכללה אדנומה של ההיפופיזה, אדנומה של בלוטת הפאראתירואיד ושאת בלבלב.
גנטיקה
MEN1 מורש בדגם אוטוזומאלי דומיננטי. הגן שגורם לתסמונת ממוקם על גבי כרומוזום מספר 11. הגן מקודד לחלבון המכונה "MENIN" המתפקד בוויסות גדילה של תאים. מוטציה בגן זה מצויה ב>90% מהחולים עם MEN1. בדיקה גנטית נעשית באנשים עם סיכון לפתח את התסמונת. באנשים הנושאים את הגן יש לבצע בדיקות סקר תקופתיות לביטויים השונים של התסמונת. בדיקות סקר משפחתי נעשות מגיל חמש לבירור גידולי היפופיזה (הביטוי המוקדם ביותר של התסמונת).
תסמינים קליניים
רוב החולים פונים עם תלונות המעידות על כיב פפטי או סיבוכיו. היפוגליקמיה הינה הסיבה השנייה בשכיחותה. לעומת זאת, כאבי ראש, הפרעות בראייה, אל-וסת וכו', בדרך כלל אינם שכיחים כסימנים ראשונים.
- פאראתירואיד: היפר-פאראתירואידיזם ניתן למצוא ב-90% מהחולים. ברוב החולים קיימת היפרפלזיה של כל הבלוטות. נוכחות אבנים בדרכי השתן או נפרוקלצינוזיס שכיחים. לעומת זאת פגיעה בעצמות נדירה יחסית. היפרפלזיה של תאי chiefs היא האופיינית.
- לבלב: ב-80% מהחולים ניתן למצוא מעורבות של הלבלב. רוב השאתות בלבלב הן מרובות. 40% מהשאתות הן מסוג תאי ביתא ומאופיינות בהיפוגליקמיה. 10% משאתות הביתא הן ממאירות, בעוד ש-60% מאלה שאינן מסוג תאי הביתא הן ממאירות. יש המתארים היעלמות של הגרורות לאחר כריתת קיבה עקב Zollinger-Ellison syndrome. אולם הסיפור הקלאסי הינו התפשטות הגידול ומוות. שלשולים מימיים מופיעים בשאתות שאינן ממקור תאי הביתא וחלקם נובעים מהפרשת יתר של חומצה. בחלק מהחולים השלשולים נובעים מנוכחות פוליפפטיד כמו VIP. (פירוט-יתר על השאתות הללו ראה בפרק על הלבלב.)
- היפופיזה: אדנומה כרומופובית נמצאה ב-70%-60% מהחולים בעלי MEN והיא מתבטאת באמנאוראה או היפוגונדיזם, כאבי ראש והפרעות בראייה. ב-30% מהחולים ניתן למצוא אקרומגליה. השאת השכיחה בהיפופיזה היא הפרולקטינומה המפרישה פרולקטין.
- אדרנל: ב-40% מהחולים משתתף האדרנל במחלה (קורטקס). הפתולוגיה יכולה להיות: אדנומה בודדת, אדנומות מרובות והיפרפלזיה. לרוב לא ניתן למצוא עדות לפעילות-יתר.
- תירואיד: מעורבות התירואיד שכיחה ב-15%-10% מהחולים. השאת השכיחה ביותר הינה אדנומה קולואידית, למרות שדווח גם על קרצינומה ותירוטוקסיקוזיס.
אבחנה
מעבדה: מציאת רמות נמוכות של סוכר בדם מעוררת חשד. בעזרת רדיואימונואסאי ניתן למדוד את רמת הגסטרין בדם. ניתן לבצע מבחן גירוי לגסטרין על-ידי מתן קלציום וסקרטין. ניתן למדוד את רמת האינסולין בדם. מציאת רמה גבוהה של אינסולין בצום מהווה אישור לאבחנה.
אמצעי הדמיה: בטומוגרפיה ממוחשבת וב- MRI ניתן להדגים את הנגעים באדרנל, בהיפופיזה ובלבלב. מיפוי כפול וסריקה אולטרה- סנוגרפית של הבלוטה יכולים לספק אינפורמציה על מיקום אדנומת הפאראתירואיד.
טיפול
כריתה תת-שלמה של בלוטות הפאראתירואיד או כריתה שלמה והשתלה של חלקי הבלוטה בזרוע. בתסמונת זולינגר-אליסון יש לבצע כריתה שלמה או תת-שלמה של הקיבה. טיפול בגידולי הלבלב: הטיפול בעיקרו כירורגי. ישנם מספר מאפיינים של גידולי הלבלב שמקשים על הטיפול: ( 1) הגידולים לרוב מופיעים במספר מוקדים (2) ממאירים בכ-30% מהמקרים (3) מפרישים הורמונים הגורמים כנ"ל להסתמנויות קליניות שונות (5) כריתת לבלב מלווה בתחלואה משמעותית (בין השאר הופעת סכרת). ישנם טיפולים תרופתיים היכולים להפחית את האפקט המתקבל מהפרשת ההורמון ביתר, לדוגמא: לוסק-LOSEC (אומפרזול) - המעכב משאבת H-K ATPase ומוריד הפרשת חומצה הנגרמת מעודף גסטרין בגסטרינומה, אנלוגים של סומטוסטטין היעילים בטיפול בתסמונת קרצינואיד, ועוד. בהפרשת-יתר של אינסולין מבצעים כריתת הגוש בלבלב, אם זה גוש יחיד. כאשר יש גושים מרובים, כורתים את האזור הנגוע עד כריתה שלמה של הלבלב. במחלה גרורתית לכבד ניתן לשקול כימואמבוליזציה. טיפול בגידולי בלוטת יתרת המוח - בגידול המפריש פרולקטין ניתן לטפל בתרופות המחקות פעילות דופמין (חומר האחראי על דיכוי הפרשת פרולקטין) המורידות את רמת הפרולקטין בדם. התרופות העיקריות הן ברומוקריפיטן (Parilac) וקברגולין (Dostinex). כריתה כירורגית בגישה טרנס-ספנואידאלית (דרך האף) מביאה להורדת מסת הגידול. בגידולים המפרישים הורמון גדילה (GH) או הורמון המעודד הפרשת קורטיזול (ACTH) אפשר לטפל באופן כירורגית או בטיפולים תרופתיים כשהעיקריים הם אנלוגים של סומטוסטטין. טיפול בהקרנות יכול להיות יעיל בגידול היפופיזארי גדול או חוזר.
תסמונת על-שם Sipple (MEN-2)
התסמונת מורכבת מ-3 שאתות:
- קרצינומה מדולרית של בלוטת התריס.
- פאוכרומוציטומה.
- היפרפלזיה של הפאראתירואיד.
התסמונת הינה משפחתית ותורשתית.
הקרצינומה המדולרית מייצרת את התירוקלציטונין בתאים הפאראפוליקולרים של בלוטת התריס. Sipple שתיאר לראשונה את התסמונת, תיאר רק את השאת בבלוטת התריס ופאוכרומוציטומה בילטרלית. תירוקלציטונין מוגבר מהווה קריטריון אבחנתי של קרצינומה מדולרית. ה-MEN-2b (או 3-MEN) מוגדרת כתסמונת ה- MEN ללא היפרפאראתירואידיזם, בנוסף לשאתות עצביות (נוירומות) בריריות, שפתיים עבות, מראה מרפאנואידי וכוי. התבטאות התסמונת בהתאם לשינויים הגנטיים מוצג באיור 5.14 .
פתולוגיה
10%-5%משאתות בלוטת התריס הן שאתות מדולריות. אלה מהן הקשורות לתסמונת משפחתית הינן בילטרליות, למרות ש-80% מהשאתות המדולריות הן ללא רקע משפחתי. בהיסטולוגיה, התאים הם מצורת הכישור, או עגולים, מסודרים בשורות עם הרבה סטרומה אמורפית סביבם. פאוכרומוציטומה מופיעה בשכיחות גבוהה בעשור החיים ה-3. הפתולוגיה היא דו-צדדית (70%) ולרוב שפירה. בפאראתירואיד הממצא השכיח הינו היפרפלזיה. נדיר לראות אדנומה.
תסמינים קליניים ומהלך
גוש בצוואר, כאבי ראש והיפרקלצמיה הם התסמינים השכיחים. ניתן למצוא תמיד את השאת המדולרית של בלוטת התריס. ב-60% מהחולים ניתן למצוא היפרפאראתירואידיזם וב-40% פאוכרומוציטומה.
- הקרצינומה המדולרית של בלוטת התריס מופיעה כקשר בודד, כגויטר מולטינודיולר, כבלוטות לימפה מוגדלות או כגרורות מרוחקות. היא הממצא השכיח שבגללו פונה החולה לייעוץ. השאת המדולרית לעתים רחוקות מייצרת הורמונים אחרים כמו ACTH, MSH, סרוטונין ופרוסטגלנדינים. ב-30% מהחולים ניתן למצוא שלשולים, לעתים מלווים באודם בפנים וכאבי בטן בדומה לתסמונת הקרצינואיד. הגרורות בדרך כלל נוטות לעבור הסתיידות, לכן ניתן להדגימן בצילום רנטגן.
- פאוכרומוציטומה יכולה שלא לתת סימנים קליניים. בחלק מהחולים הקליניקה דרמטית עם יתר-לחץ-דם חריף, כאבי ראש עזים, פליפטציות, חרדה וכו'.
- היפרפאראתירואידיזם מתבטאת לרוב בהיפרקלצמיה א- סימפטומטית, או אבנים בדרכי השתן. סימנים אחרים נדירים יותר.
- מהלך המחלה תלוי בשאת המדולרית. ב-50% מהשאתות, בקוטר 10-1 מ"מ, ניתן למצוא גרורות בבלוטות הלימפה. שיעור ההיוותרות בחיים ל-10 שנים הוא 50%. הפרוגנוזה הטובה ביותר היא בחולים שבהם השאת מוגבלת והוצאה בשלמותה. פרוגנוזה פחות טובה יש לחולים שמהם הוצאה השאת אולם חזרה תוך זמן קצר באופן מקומי. בקבוצה עם מהלך סוער ומחלה מפושטת הפרוגנוזה גרועה. בין קבוצה 1 ו-2 קיימת קבוצה שבה החזרה היא לאחר שנים.
אבחנה
- עלייה ברמת התירוקלציטונין הינה אבחנתית לשאת מדולרית של בלוטת התריס. באנשים בריאים הרמה נמוכה מ-0.2 ננוגרם למ"ל. בחולים ניתן לראות ערכים של 1000 ננוגרם למ"ל ויותר. בדיקה בודדת שבה מתגלה רמה גבוהה של תירוקלציטונין היא אבחנתית. באבחנה מבדלת יש לזכור את שאת הריאה, קרצינואיד וקרצינומה של השד. הבדיקה הזו הינה רגישה ביותר ואפשר לאבחן במבחן זה שאתות בגודל של 1 מ"מ. אפשר לבצע מבחן פרובוקטיבי לתירוקלציטונין על-ידי עירוי של קלציום לווריד במינון של 15 מ"ג לכל ק"ג. בעזרת בדיקה זו ניתן לגלות מצבים פרהמליגניים כמו היפרפלזיה של תאי ה-C. מודיפיקציה אחרת של המבחן היא מתן של פנטהגסטרין במינון של 0.5 מיקרוגרם לק"ג. תוך 3 דקות ניתן לראות עלייה בתירוקלציטונין תוך השגת רמות הגבוהות פי 3-2 מאשר עם קלציום. מאבחן אחר של שאת מדולרית הוא נוכחות של היסטמינז ברמה גבוהה ב-50% מהחולים. רמה גבוהה של היסטמינז מצביעה לרוב על נוכחות של גרורות. אם רמת האנזים נשארת גבוהה גם לאחר הניתוח מדובר במחלה מתמידה או חוזרת.
- האבחנה של פאוכרומוציטומה מאושרת על-ידי נוכחות רמה גבוהה של קטכולאמינים, או תוצרי הפירוק שלהם, בשתן. איסוף שתן של 24 שעות לקטכולאמינים, מטאנפרינים ו-VMA הוא הבסיסלאבחנה. לפעמים השאת מייצרת אפינפרין ופחות נוראפינפרין, בניגוד לפאוכרומוציטומה שמקורה מחוץ לאדרנל. כאשר השאת גדולה ומפרישה קטכולאמינים בכמות גדולה הפירוק מוגבר, ולכן רמת הקטכולאמינים בשתן יכולה להיות תקינה, ואילו רמות המטאנפרינים ™-VMA גבוהות. המבחנים הפרובוקטיביים הינם מסוכנים, מכיוון שהם עלולים לגרום ליתר-לחץ-דם חד ולאריתמיות.
- האבחנה של היפרפאראתירואידיזם מאושרת על-ידי עלייה ברמת הקלציום בדם, עלייה ברמת ה-PTH, או קלינית כאשר לחולה אבנים חוזרות בדרכי השתן.
- כלי עזר אחרים חשובים לאבחנה הם:
- טומוגרפיה ממוחשבת - בטומוגרפיה ממוחשבת ניתן להדגים את הנגע באדרנלים.
- מיפוי בלוטת התריס - במיפוי ניתן לראות את הנגעים בבלוטת התריס.
- אולטרה-סאונד - באולטרה-סאונד אפשר לאתר נגעים בבלוטת התריס וכן להדגים את בלוטת הפאראתירואיד.
טיפול כירורגי
כאשר האבחנה של שאת מדולרית הינה פרה-קלינית - זה הזמן לנתח, מכיוון ששכיחות הגרורות בשלב זה נמוכה. מובן שיש הכרח לשלול קיום של פאוכרומוציטומה לפני הניתוח. כאשר מנתחים את הפאוכרומוציטומה יש לבצע אקספלורציה של שני האדרנלים על מנת לשלול קיום שאת דו-צדדית. הגישה הנוחה הינה דרך חתך סוב קוסטלי דו-צדדי. הגישה הלפרוסקופית להוצאת בלוטת האדרנל היא נוחה יותר לחולה ולמנתח ולכן גם המקובלת כיום. למרות שפאוכרומוציטומה מחוץ לאדרנל הינה נדירה בתסמונת זו, הרי שיש בכל זאת לחפש אותה. יש הממליצים על ביצוע ביופסיה של האדרנל השני באופן שגרתי מפאת החשש לקיום היפרפלזיה בבלוטה השנייה, ואז יש לבצע כריתה דו-צדדית של האדרנל. מדיניות זאת לא מקובלת. מקובל לעקוב אחר חולים אלה אחת ל-6 חודשים עד שנה ולבצע טיפולים בהתאם לתוצאות המעקב.
לפני הניתוח יש להכין חולים אלה על-ידי טיפול בחוסמי אלפא כמו: phenoxybenzamine 200-40 , מ"ג ליממה. אם החולה לוקה בטכיקרדיה יש להשתמש בחוסמי ביתא כמו propranolol 40-12 , מ"ג ליממה. יש לתת לחולים אלה הידרציה טובה. בניתוח ניתן לשלוט היטב על לחץ-הדם על-ידי מתן phentolamine. לאחר אדרנלקטומיה דו-צדדית יש לתת לחולים תחליפי סטרואידים.
הטיפול בשאת מדולרית הינו תירואידקטומיה שלמה. אין להשאיר כל רקמת תירואיד בגלל האפשרות של חזרת המחלה. כריתה של בלוטות הלימפה המרכזיות, מסחוס התירואיד ועד ה-sternal notch, ומהוורידים הצוואריים (jugular). אם קיימות בלוטות נגועות לטרלית לוורידים אלו יש לבצע modified neck dissection. כללית ניתן לומר שככל שהשאת גדולה יותר, והתסמונת הקלינית ממושכת יותר, כך הסיכון לנגיעות בלוטות הלימפה גדול יותר. באנשים עם מחלה מפושטת בצוואר, הקרנה יכולה להוריד את מסת גידול ולמנוע חזרה מקומית. יעילותה טיפול הכימותרפי (בשילוב עם אדריאמיצין, וינקריסטין, ציקלופוספמיד ודקרבזין) וניסיונות טיפוליים חדשים במעכב של טירוזין קינאז (GLEEVEC) מוטלים בספק.
היפרפאראתירואידיזם - לרוב מדובר בהיפרפלזיה ולכן יש לבצע כריתה תת-שלמה של בלוטות הפאראתירואיד או כריתה שלמה והשתלה (ראה פרק על בלוטות יותרת התריס).
טיפול בגידולי בלוטת יתרת המוח - בגידול המפריש פרולקטין ניתן לטפל בתרופות המחקות פעילות דופמין (חומר האחראי על דיכוי הפרשת פרולקטין) המורידות את רמת הפרולקטין בדם. התרופות העיקריות הן: ברומוקריפיטן (Parilac) וקברגולין (Dostinex). כריתה כירורגית בגישה טרנס-ספנואידאלית (דרך האף) מביאה להורדת מסת הגידול. בגידולים המפרישים הורמון גדילה (GH) או הורמון המעודד הפרשת קורטיזול (ACTH) ניתן גם כן לטפל כירורגית או בטיפולים תרופתיים כשהעיקריים הם אנלוגים של סומטוסטטין. טיפול בהקרנות יכול להיות יעיל בגידול היפופיזארי גדול או חוזר.
מעקב
השאת המדולרית היא קטלנית, ולכן יש לעקוב אחרי עדות לחזרתה על-ידי בדיקות חוזרות של תירוקלציטונין, בעזרת גירוי על-ידי פנטה-גסטרין. קביעת המיקום של השאת החוזרת אפשרי על-ידי קתטריזציה סלקטיבית של הוורידים, כאשר הצנתר נמצא: (א) בשני ה-innominate vein; (ב) בווריד ההפטי ובווריד פריפרי. אם הריכוז הגבוה הוא בווריד ההפטי הרי זה אבחנתי לגרורות רבות. אם הממצא מוגבל לוורידי הצוואר המחלה לרוב מקומית.
ראו גם
- לנושא הקודם: סרטן בלוטת התריס - היבטים כירורגיים - Thyroid cancer - surgical aspects
- לנושא הבא: בלוטות יותרת-התריס - היבטים כירורגיים - Parathyroid - surgical aspects
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: בקעים
- לפרק הבא: המערכת הוורידית
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק