אדרנומדולין - Adrenomedullin
| מדריך בדיקות מעבדה | |
| אדרנומדולין | |
|---|---|
| Adrenomedullin | |
| שמות אחרים | ADM |
| מעבדה | כימיה בדם |
| תחום | בחינה מולטי-דיסציפלינרית להערכת תרחישים וסקולריים |
| טווח ערכים תקין | 2-4 פיקומול/ליטר (או 15–18 ננוגרם/ליטר) |
| יוצר הערך | פרופ' בן-עמי סלע |
אדרנומדולין (להלן ADM) הוא הורמון פפטידי מרחיב כלי-דם וכן בעל תכונות natriuretic, שבודד לראשונה בשנת 1993 במיצוי חומצי של הגידול pheochromocytoma שמקורו במדולה של האדרנל (Kitamura וחב' ב-Biochim Biophys Res Commun משנת 1998). באדם, ADM מקודד על ידי הגן ADM הממוקם על הזרוע הקצרה של כרומוזום 11 באתר 11p15.4, גן המכיל 4 אקסונים ו-3 introns (Ishimitsu וחב' ב-Biochim Biophys Res commun משנת 1994). ADM מבוטא בכל רקמות הגוף, ומופרש לצירקולציה.
תפקידו של ADM
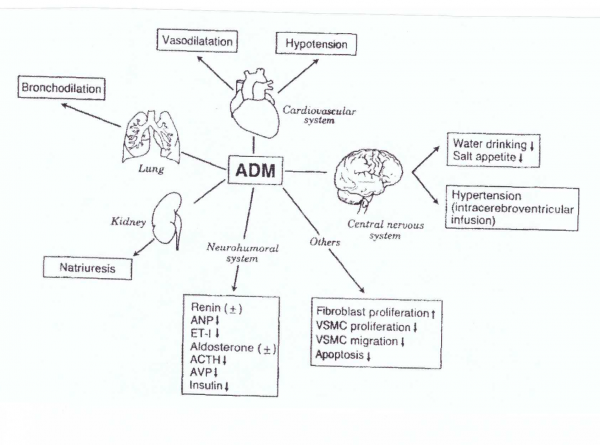
ריכוזיו של ADM בצירקולציה משמעותיים. כבר בתחילה ייחסו לו תפקיד של vasoliator, ויש סבורים ש-ADM הוא מרחיב כלי הדם האנדוגני הפוטנטי ביותר בגוף. השפעות נוספות של ADM כוללות את גירוי הגדילה של כלי דם חדשים (אנגיוגניות), והגדלת העמידות של תאים לעקה חמצונית, ולנזק היפוקסי. יש המייחסים ל-ADM השפעה חיובית במצבי יתר לחץ-דם, אוטם שריר הלב, COPD ותרחישים קרדיו-וסקולריים אחרים, אך באותה מידה הוא מצטייר כגורם שלילי בכך שהוא מגביר את אספקת הדם לתאים סרטניים מה שעלול להגביר את שגשוגם.
ADM וה-mRNA שלו מבוטאים באופן נרחב במערכת הקרדיו-וסקולרית, כולל חדרי הלב ופרוזדוריו, כלי-דם, ריאות, וכליות. המרכיבים של הקולטן של ADM, הכוללים את CRL ואת RAMP2 ו-RAMP3, ממוקמים יחד ADM במערכת הקרדיו-וסקולרית, מה שמרמז לכך ש-ADM משמש כווסת חשוב של התפקוד הקרדיו-וסקולרי (Nishikimi וחב' ב-Endocrinol Heart Health Dis משנת 2017). ביטוי הגן ADM גדל בחדרים של לבבות היפר-טרופיים, לבבות כושלים או לאחר מצבי אוטם. קרדיומיוציטים ו-קרדיופיברובלסטים, מייצרים ומפרישים 2 צורות מולקולריות של ADM, הצורה הבשלה ו-ADM-glycine וכן הם מבטאים CRL, RAMP2 ו-RAMP3. בתוך הלב, יש ל-ADM השפעות מעכבות על סינתזה של קולאגן, ושל שגשוג של פיברובלסטים. בנוסף, ADM מעכב היפר-טרופיה לבבית, ומדגים פעילויות אנטי-אפופטוטיות, אנגיוגניות, אנטי-דלקתיות ונוגדות חמצון. ל-ADM יש גם השפעה אינוטרופית על כושר ההתכווצות של שריר הלב. איתות תאי של ADM מתבצע בתיווך של cyclic AMP/protein kinase A, של nitric oxide/cyclic GMP, ושל phosphoinositide 3-kinase/Akt. נראה ש-ADM מפגין השפעות אינוטרופיות חיוביות, וכן השפעות אנטי-פיברוטיות, ואנטי-היפרטרופיות במצבי כשל לבבי, באוטם שריר הלב, ובתרחיש של אי-ספיקה מיו-קרדיאלית וזילוח מחדש. כן מייחסים ל-ADM השפעה חיובית במצב של יתר לחץ-דם ריאתי.
מבנה הפפטיד
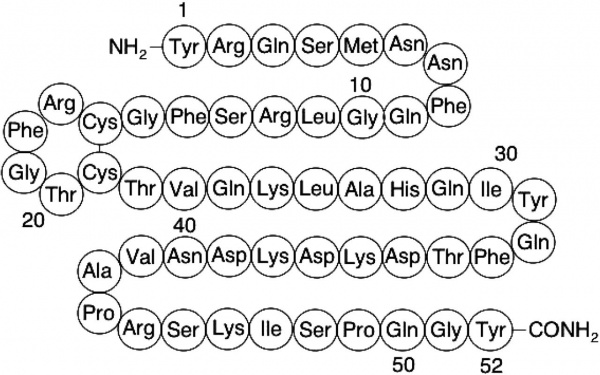
ADM הוא פפטיד בעל משקל מולקולרי של 6,029 דלטון המכיל 52 חומצות אמינו ויש לו קשר די-סולפידי בודד בין שיירי ציסטאין בעמדות 16 ו-21, מה שיוצר מבנה טבעתי פנימי בן-6 חומצות אמינו (Ishimitsu וחב' ב-J Clin Invest משנת 1994).
מבנהו בעל הומולוגיה מבנית מסוימת עם משפחת קלציטונין של הפפטידים הרגולטוריים כגון קלציטונין, CGRP (calcitonin gene-related peptide) ו-amylin. הקודמן שלו-preproadrenomedullin, מורכב מ-185 חומצות אמינו. באנליזת RNA-blot, ה-mRNA של ADM באדם, נמצא מבוטא בכל הרקמות, ובעיקר בשלייה, בתאי שומן, בריאות, באיי הלבלב, בשריר חלק, בעור ובמערכת העצבים המרכזית. הגן ADM מקודד בתחילה לפפטיד קודמן המכיל 185 חומצות אמינו, אך הוא יכול באופן דיפרנציאלי ליצור מספר פפטידים, כולל ADM בלתי פעיל המכיל 53 חומצות אמינו, adrenotensin ו-ADM95-146. ADM בצירקולציה מורכב מהצורה הפעילה שעברה אמידציה בשייר הקצה קרבוקסי-1 (15%) ומהצורה הלא-פעילה שעברה גליקציה (85%). תקופת מחצית החיים של ADM בפלזמה היא של 22 דקות עם קצב פינוי מהגוף של 274 mL/kg/min (Meeran וחב' ב-J Clin Endocrinol Metabol משנת 1997). ADM בשל מתפרק בדם על ידי aminopeptidase neprilysin.
קולטנים של ADM
ADM פועל על ידי תגובה עם 2 סוגי קולטנים: הקולטן CALCRL או calcitonin receptor like receptor, ועם אחד מ-2 סוגי הקולטנים-RAMP2 או receptor activity-modifying protein 2 או עם RAMP3, כאשר 2 הקולטנים האחרונים ידועים גם כ-AM1 ו-AM2, בהתאמה. שני הקולטנים מעבירים איתות הנוצר מקישור ההורמון למסלולי העברת איתותים תוך-תאיים על ידי cascades של nd messenger2. הקולטן AM2 הוא בעל זיקה נמוכה ל-CGRP, אך לכך אין כל משמעות פיזיולוגית. האינטראקציה של שני ה-CALCRLs עם RAMP על פני הממברנה, נדרשת על מנת ש-ADM יפעיל את פעילותו. אף לא אחד מ-2 הקולטנים, CALCRL ו-RAMP, יכולים לקשור את ADM לבד לצורך העברת האיתות. גירוי של הקולטנים על ידי ADM מגביר את יצירת cAMP ו-NO (על פי McLatchie וחב' ב-Nature משנת 1998, ו-Hay וחב' ב-Pharmacol Ther משנת 2006).
לפני הזיהוי של קולטני RAMPs, והזיהוי של הקולטנים ההטרומריים של משפחת הפפטידים של קלציטונין, זוהה קולטן בודד של ADM הקשור לחלבון G (על פי Kapas וחב' ב-J Biol Chem משנת 1995), אך דיווחים עדכניים יותר מטילים ספק בהקשר של חשיבות קולטן בודד זה במכלול ההשפעות של ADM. מחקרים עדכניים יותר הבהירו את תפקידי הקולטנים AM1 ו-AM2 על ידי שימוש בעכברים שעברו מניפולציה גנטית. עכבר knockout ללא ADM הוא פנוטיפ קטלני שמת ברחם בערך במחצית תקופת ההיריון, ממצב של hydrops fetalis, בו העובר לוקה בבצקת כללית חמורה. גם עכברי knockout עם חסר של CALCRL מפגינים פנוטיפ דומה, בהיותם חסרים את הקולטנים AM1 ו-AM2. גם עכברי knockout פגומים ב-RAMP2 מתים בעודם ברחם, מה שמדגים שההשפעות הפיזיולוגיות הבולטות של ADM מתבצעות דרך קישורו לקולטניו. אפילו עכברים הטרוזיגוטיים ל-RAMP2 הם בעלי פיזיולוגיה לקויה, עם פגמים בלתי רגילים בעצם ובבלוטות החלב, וליקויים אנדוקריניים הפוגעים בפוריות וביכולת ההנקה. מה שמפתיע מאוד היא העובדה שחסר RAMP3 חסר כל השפעה שלילית, והוא אף יוצר יתרונות בגין צפיפות עצם גדולה יותר (Kadmiel וחב' ב-Mol Endocrinol משנת 2011), ומפחית עלייה במשקל בגיל המתקדם ( Dackor וחב' ב- J Biol Chem משנת 2007).
ADM בצירקולציה
ADM נע בצירקולציה בריכוזים פיקומולריים, כאשר במצב נורמלי ריכוזיו בפלזמה נעים בין 2–4 פיקומול/ליטר. ריכוזי ADM בפלזמה מוגברים בצום ובהיריון, כמו גם במגוון מצבי מחלה כגון אוטם שריר לב, מחלת לב איסכמית, אי-ספיקת לב גדושה, יתר לחץ-דם, כשל כרוני של הכליות, hyperparathyroidism, ספסיס וצירוזיס. מְכַנֶּה משותף אחד יכול להיות הדבקה חיידקית ו/או דלקת, שכן חשיפה של תאי אפיתל של הקיבה לזני חיידקים שונים, כולל הליקובקטר פילורי, וכן חשיפה לציטוקינים שונים כגון IL-6, IL-1 ו-TNF-α, כמו גם אינטרפרון ו-LPS, מעודדים יצירת ADM והפרשתו. הורמונים בצירקולציה כגון קורטיקוסטרואידים, הורמוני התירואיד, אנגיוטנסין II ו-norepinephrine, מעודדים אף הם הפרשת ADM. בניגוד לכך, אינטרפרון-γ, פפטיד וזוֹ-אקטיבי של המעי (VIP) ותרומבין מדכאים את יצירת ADM.
בפלזמה, ADM יוצר קומפלקס עם AMBP (או ADM-binding protein). AMBP בודד מאוחר יותר ונמצא זהה ל-factor H של המשלים, חלבון המעכב את מסלול המשלים האלטרנטיבי, ואחראי למודולציה של תפקוד ניטרופילים ומונוציטים. רק ADM בלתי-קשור יכול להימדד בפלזמה על ידי RIA. complement factor H מעודד את הפעלות הביולוגית של ADM על ידי הגנת ADM מפני פירוק, בלי שהוא משפיע על יכולת הקישור של ADM לקולטן שלו.
ריכוזי ADM בפלזמה של מטופלים עם יתר לחץ-דם ראשוני
ל-ADM יש השפעות מגוונות ובולטות על שגשוג תאי, על כיווץ תאים, על נדידת תאים ועל אינטראקציה עם גורמים נירו-הורמונליים אחרים, כולל ANP (או atrial natriuretic peptide) ו-BNP (אוbrain natriuretic peptide) על פי Eto ב-Peptides משנת 2001. התפקיד הפתו-פיזיולוגי החשוב ומוכר ביותר של ADM הוא בהיותו מרחיב כלי-דם ופפטיד נתרי-אורטי (Kato וחב' ב-Hypertens Res משנת 1999, Ishimitsu וחב' ב-Pharmacol Ther משנת 2006, ו-Li וחב' ב-Peptides משנת 2007). עירוי ורידי של ADM נמצא מפחית את לחץ הדם ומגביר את קצב הלב ואת תפוקתו (Lainchbury וחב' ב-J Clin Endocrinol Metabol משנת 2000). השפעה קרדיו-סטימולטורית ישירה נמצאה בלב חולדה מבודד שעבר זילוח עם ADM (על פי Szokodi וחב' ב-Acta Physiol Scand משנת 1996). ADM מפעיל את פעילותו הביולוגית העיקרית, על ידי הצטברות של cAMP (על פי Federico ב-Heart Views משנת 2010), בעוד שחלק מפעולות ANP ו-BNP מתווכות על ידי cGMP (על פי Kitamura ו-Eto ב-Curr Opin Nephrol Hypertens משנת 1997). חוקרים אחרים מדווחים על תוצאות סותרות. ADM הישרה הגדלה תלוית-ריכוז של אלדוסטרון ושל הפרשת קורטיקסטרון מהאדרנל של חולדה שעבר זילוח, (Mazzocchi וחב' ב-Peptides משנת 1996).
Hu וחב' דיווחו ב-Exp The Med משנת 2015, את השינויים ברמת ADM ב-64 חולים עם יתר לחץ-דם ראשוני וב-35 אנשים עם לחץ-דם תקין. ערכי ADM נמצאו גבוהים משמעותית במטופלים עם לחץ דם מוגבר, וערכים אלה היו במתאם עם דרגת יתר לחץ הדם. בעוד שרמת ADM הממוצעת ב-35 הנבדקים הנורמו-טנסיביים נקבעה כ-18.1 ננוגרם/ליטר, רמתו ב-20 הנבדקים עם יתר לחץ-דם דרגה I נקבעה כ-22.3 ננוגרם/ליטר, ב-25 נבדקים עם יתר לחץ-דם דרגה II הייתה רמת ADM הממוצעת 29.9 ננוגרם/ליטר, ואילו ב-19 הנבדקים עם יתר לחץ-דם דרגה III רמת ADM נקבעה כ-38.9 ננוגרם/ליטר, בממוצע. לאחר 4 שבועות של טיפול תרופתי עם תכשירים להפחתת לחץ הדם, נמדדו שוב ערכי ADM. לאחר פרק זמן טיפולי זה, פחתו ערכי ADM באופן משמעותי אם כי לא בחדות.
אינטראקציה של ADM עם גורמים נוספים
- Atrial natriuretic peptide (או ANP): בתרבית של קרדיומיוציטים של יילודים, ADM מגביר את ריכוזי cAMP באופן תלוי-ריכוז, וכתוצאה מכך מעכב את ביטוי הגן המקודד ל-ANP ואת הפרשת האחרון (Sato וחב' ב-Biochim Biophys Res Commun משנת 1997). לעומת זאת, עירוי לאדם של ANP במינון של 0.1 microgram/kg/min למשך 60 דקות, העלה את ריכוזי ADM בצירקולציה פי-4, הגברה שנמשכה כל זמן שנמשך העירוי של ANP, וחזרה לערכי הבסיס שלה עם הפסקת עירוי זה. ההשפעות הדיאורטיות והפחתת לחץ-הדם שיוחסו בעבר ל-ANP, עשויות באופן חלקי להיות תוצאה של פעילות ADM, כיוון שלשני הפפטידים, ANP ו-ADM, יש השפעת דומה על הכליות.
- Renin-עירוי תוך-ורידי של ADM לארנבות (Fukuhara וחב' ב-Am J Physiol משנת 1995), ולכבשים (Parkes ו-May ב- J Neuroendocrinol משנת 1995), הפחית את לחץ הדם העורקי, והגביר את פעילות renin בפלזמה. Jensen וחב' חקרו את השפעת ADM על הביטוי של הגן המקודד לרנין, ועל הפרשת הורמון זה בתאי juxtaglomerular כלייתיים גרנולריים (ב-Hypertension משנת 1997). ההפרשה של רנין מכליות חולדה מבודדות שעברו זילוח, גדלה באופן תלוי-ריכוז של ADM. בתרבית ראשונית של תאים גרנולריים של עכבר, ADM הגביר באופן תלוי-ריכוז את הפרשת רנין, את הצטברות mRNA של רנין, ואת יצירת cAMP. נראה ש-ADM עשוי לשמש כגורם אוטוקריני או פרקריני, בוויסות של הפרשת רנין, ובביטוי של הגן המקודד לרנין.
- אלדוסטרון - למרות ש-ADM לא השפיע על הפרשת אלדוסטרון המתווכת על ידי ACTH, נמצא ש-ADM מדכא באופן בולט את יצירת אלדוסטרון בתיווך של אנגיוטנסין II, בתאים מבודדים של קליפת האדרנל מחולדה (Yamaguchi וחב' ב-Life Sci משנת 195, ו-Andreis וחב' באותו כתב עת משנת 1997). השפעה מעכבת זו של ADM נחסמה באופן מוחלט על ידי CGRP8-37. הפרשת אלדוסטרון בתיווך ionophore של סידן, גם כן עוכבה על ידי ADM, מה שמרמז ש-ADM הוא בעל השפעה המעכבת הפרשת אלדוסטרון, בעזרת הגברת הריכוז של סידן חופשי בתוך תאים.
- הזרקת ADM עיכבה באופן משמעותי את העלייה בריכוזי אלדוסטרון בפלזמה וכן בבלוטת האדרנל של חולדות הניזונות מדיאטה נטולת נתרן (Yamaguchi וחב' ב-Hypertension משנת 1996). חוקרים אחרים דיווחו על תוצאות סותרות. ADM הישרה עליה בהפרשת אלדוסטרון וקורטיקוסטרון בתאי בלוטת האדרנל של חולדות שעברו זילוח (Mazzocchi וחב' ב-Peptides משנת 1996). כמו כן, CGRP8-37 עיכב את השפעות ADM, מה שמרמז שהשפעות ADM על האדרנל של חולדות, מתווכות על ידי תת-סוג של הקולטן של CGRP
- Norepinephrin: מחקרם של Fukuhara וחב' הראה שעירוי תוך-ורידי של ADM ממקור אדם לארנבות, גרם להפחתה תלוית-ריכוז של לחץ-דם עורקי מה שעומד בהתאמה עם עליה ברמות norepinephrin בפלזמה
- AVP או arginine vasopressin: ההשפעה של החדרת ADM על הפרשה של AVP, נחקרה בחולדות (Kohno וחב' ב-Hypertension משנת 1995). הזרקה מוחית אינטרה-ונטריקולרית של ADM, החלישה באופן חלקי אם כי משמעותי הגברת רמות AVP המושרה על ידי היפר-אוסמולליות ועל ידי hypovolemia. עם זאת, עירוי תוך-ורידי של ADM לא גרם לשינוי ברמות AVP בפלזמה
- Endothelin-1: למרות שהיצירה הבסיסית של endothelin-1 אינה משתנה על ידי ADM, פפטיד זה עיכב יצירת endothelin-1 המושרית על ידי תרומבין ועל ידי PDGF (או platelet-derived growth factor), בתאי שריר חלק ממקור וסקולרי של חולדות, הגדלים בתרבית (Kohno וחב' ב-Hypertension משנת 1996), וכן בתאי mesangium של חולדה הגדלים בתרבית
- ACTH: נמצא על ידי Samson וחב' ב-Endocrinology משנת 1995, ש-ADM מעכב רמה בסיסית והפרשה של ACTH המושרית על ידי CRH, מתאי יותרת המוח הגדלים בתרבית
התפקיד של ADM בוויסות של לחץ הדם
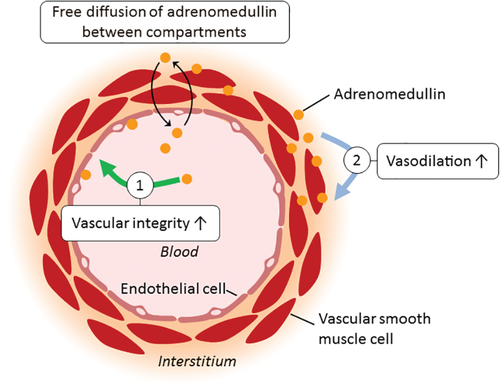
התפקיד המקורי של ADM שהתגלה היה היותו מרחיב כלי-דם, מה שגורם להפחתת לחץ הדם, ולתנגודת היקפית מופחתת (Kitamura וחב' ב-Biochim Biophys Res Commun משנת 1993, Nuki וחב' באותו כתב עת מאותה שנה ו-Ishiyama וחב' ב-Eur J Pharmacol משנת 1993). מחקרים in vitro הדגימו את תכונותיו מרחיבות כלי הדם על כלי דם מבודדים (Passaglia וחב' ב-J Pharm Pharmacol משנת 2014, ו-Nakamura וחב' ב-Jpn J Pharmacol משנת 1995), וכן על כליית חולדה (Hirata וחב' ב-Hypertension משנת 1995). מחקרים in vivo על ידי עירוי ישיר של ADM, הראו ירידה בלחץ הדם, הגברת קצב הלב, וכן הגברת רמת noradrenaline ו-renin בבעלי חיים שונים כולל האדם, מה שהגביר את תפוקת הלב (Lainchbury וחב' ב-J Clin Endocrinol Metab משנת 2000, Nagaya וחב' ב-Heart משנת 2000, Nakamura וחב' ב-Circulation משנת 1997, Rademaker וחב' ב-Hypertension משנת 2002 ו-Kita וחב' ב-Hypertens Res משנת 2010).
השפעות מרחיבות כלי-דם אלו של ADM מתווכות על ידי קישורו לקולטנים המופיעים על תאי אנדותל ועל תאי שריר חלק בדופן כלי הדם. תוארו מספר מסלולים של איתות דרכם גורם ADM להרחבת כלי-דם: במסלול שאינו תלוי באנדותל, קישור ADM לקולטניו על פני תאי שריר חלק, מגביר את רמת cAMP תוך-תאי (Rossi וחב' ב-Regul Pept משנת 2006, ו-Yoshimoto וחב' ב-Br J Pharmacol משנת 1998), מה שמשפעל בהמשך את האנזים protein kinase (או PKA). אנזים זה מעכב את ההתכווצות של תאי שריר חלק בדרכים אחדות: לדוגמה, PKA משרה את פתיחתם של תעלות אשלגן בדופן כלי הדם, מה שמביא לזליגה החוצה של אשלגן ובהמשך להיפר-פולריזציה של הפוטנציאל הממברנלי, לסגירת תעלות סידן ולהפחתת תכולת הסידן התוך-תאי (Ross וחב' ב-Endocrinology משנת 2010, Dettmann וחב' ב-Invest Ophthalmol Vis Sci משנת 2003, ו-Terata וחב' ב-Am J Physiol Heart Circ Physiol משנת 2000).
השפעות נוספות של PKA כוללות את עיכוב תעלות הסידן הסרקו-פלזמטיות, ואת myosin light chain kinase או MLCK. המנגנונים התלויים באנדותל, דרכם ADM משרה הרחבת כלי-דם, הם מערכת ה-inositol-1,4,5-triphosphate, ומערכת P13K/Akt או phosphatidylinositl-4,5-biphosphate 3-kinase-protein kinase B. שתי מערכות אלו מגרות את פעילות האנזים האנדותליאלי nitric oxide synthase הידוע כ-eNOS, מה שגורם להפרשת מרחיב כלי הדם, NO. כתוצאה מכך, NO משפעל את cGMP בתאי שריר חלק, מה שגורם לשפעול של protein kinase G, ובסוף התהליך להרחבת כלי-דם על ידי שפעול של myosin light chain phosphatase (על פי Shimekake וחב' ב- J Biol Chem משנת 1995, ו-Nishimatsu וחב' ב-Circ Res משנת 2001).
גם פרוסטגלנדינים נכרכו עם הרחבת כלי הדם על ידי ADM, על ידי מסלול cyclooxeginase-1 התלוי באנדותל (Yang וחב' ב-J Cardiovasc Pharmacol משנת 1996). הודגם ש-ADM מופיע גם בהיפותלמוס (Satoh וחב' ב-Neurosci Lett משנת 1996), ומספר מחקרים דיווחו שמיקרו-הזרקה של ADM לגרעין הפארא-ונטריקולרי של ההיפותלמוס גרמה לירידה מהירה בלחץ הדם (Smith ו-Ferguson ב-J Neuroendocrinol משנת 2001, ו-Xu ו-Krukoff ב-Regul Pept משנת 2004). לעומת זאת, עירוי של ADM לתוך הנוזל התוך-צרברלי או מיקרו-הזרקה שלו למדולה הרוסטרלית הוונטרו-לטרלית, גרמה לעלייה בלחץ הדם במודלים של חיות ( Xu ו-Krukoff ב-Br J Pharmacol משנת 2006, ו-Saita וחב' ב-Am J Physiol משנת 1998).
השפעות שונות של ADM הרלוונטיות לספסיס
מספר תהליכים המתרחשים בתרחיש של ספסיס מעודדים הפרשת ADM, כולל היפוקסיה, רמות מוגברות של LPS בצירקולציה, ויצירה של ציטוקינים כגון TNFα, IL-1 ואינטרפרון-γ (Kubo וחב' ב-J Biol Chem משנת 1998, Isumi וחב' ב-Endocrinology משנת 1998, Hofbauer וחב' ב-Am J Physiol Regul Integr Comp Physiol משנת 2000, Shoji וחב' ב-Biochim Biophys Res Commun משנת 1995, ו-Garayoa וחב' ב-Mol Endocrinol משנת 2000). רמות של ADM נמדדו בצירקולציה במצבים פתו-פיזיולוגיים שונים, הרמות הגבוהות ביותר נמצאו במצב של הלם ספטי (Marino וחב' ב-Crit Care משנת 2014, Chen ו-Li ב-Am J Emerg Med משנת 2013, Guignant וחב' ב-Intensive Care Med משנת 2009, ו-Ueda וחב' ב-Crit Care Med משנת 1999). במטופלים עם ספסיס, רמות ADM בצירקולציה תואמות את שיכוך הטונוס הווסקולרי (Nishio וחב' ב-Crit Care Med משנת 1997), כמו גם עם חומרת הספסיס והתמותה ממנו (Caironi וחב' ב-Chest משנת 2017).
ממצאים אלה מרמזים לכך ש-ADM הוא בעל תפקיד מזיק בהתרחשות ספסיס, וכן שטיפולים המכוונים כנגד ADM עשויים להואיל. עם זאת, אין נתונים על קשר מנגנוני בין רמות ADM ודרגת ספסיס, וייתכן שהעלייה הנצפית ברמות ADM, מייצגת תגובה מפצה חסרת משמעות. במלים אחרות, ייתכן שהעלייה ברמות ADM בספסיס היא תגובת הגוף למנוע נזק לאיברים במהלך ספסיס. מאז שנות ה-90 המאוחרות, רבים ניסו לחקור שמא הזרקת ADM, מודולציה של תפקודו או מניעת תפקודו, יכולים להשפיע על התוצאים במספר מודלים קדם-קליניים, כמו גם במודלים סיסטמיים של דלקת ופציעת איברים.
השפעות אימונו-רגולטוריות של ADM
מערכת החיסון משחקת תפקיד מפתח בפּתוגגנזה של ספסיס (Gotts ו-Matthay ב-Br Med J משנת 2016), לכן ראוי לנתח את ההשפעות האימונו-רגולטוריות הפוטנציאליות של ADM בתרחיש זה. מספר מחקרים in vitro הדגימו שיש ל-ADM השפעות אנטי-דלקתיות, ואחד הממצאים הראשונים בחן את ההשפעה של ADM במקרופאגים אלבאולריים של חולדה שעברו סטימולציה על ידי LPS. הממצא המעניין היה ש-ADM עיכב באופן משמעותי את ההפרשה של chemoattractant מניטרופילים שעברו גירוי על ידי ציטוקינים, כנראה במנגנון התלוי ב-cAMP (על פי Kamoi וחב' ב-Biochim Biophys Res Commun משנת 1995). ניסויים נוספים בתאים של פיברובלסטים של עכברים מסוג Swiss 3T3, מצאו ש-ADM מעכב הפרשה של TNFα, מושרית על ידי IL-1β, מה שאישר את התפקיד המרכזי של מסלול ה-cAMP-PKA: מעכב תלוי-cAMP של protein kinase היה מסוגל להתנגד להשפעות המעכבות של ADM (על פי Isumi וחב' ב-FEBS Lett משנת 1999). השפעות דומות של ADM נצפו בתאי מיקרוגליה שטופלו עם LPS, שעיכבו את TNFα עברו גירוית הציטוקין IL-6 (על פי Consonni וחב' ב-Mol Cell Neurosci משנת 2011), כמו גם עיכבו את פעילות 2 האחרונים במקרופאגים של עכברים שעברו גירוי על ידי LPS, וכן בתאי Kupffer מחולדות (Wu וחב' ב-Regul Pept משנת 2003).
ניסויים in vivo אישרו את המחקרים in vitro. החדרה בעת ובעונה אחת של ADM ושל AMBP-1 (או ADM-binding protein-1, שהוא פפטיד מגן עם השפעות מעודדות פעילות ADM), במודל אנדוטוקסמיה של חולדות, החלישה את תגובת TNFα במנגנון בו מעורב PPAR או peroxisome proliferator-activated receptor-γ (על פי Miksa וחב' ב-J Immunol משנת 2007). כן שימש ADM לטיפול במחלות מעי דלקתיות. החדרת ADM למעי הגס הפחיתה משמעותית את גודלם של נגעים כיביים במודל של השריית קוליטיס על ידי חומצה אצטית, וכן החלישה את רמות IL-6 ברקמת המעי הנגועה (Ashizuka וחב' ב-Peptides משנת 2005). מחקרי המשך אישרו ממצאים אלה. לדוגמה, רמות נמוכות יותר של אינטרפרון-γ ושל TNFα נמצאו במודל של מכרסמים בו קוליטיס הושרתה על ידי sodium-dextran sulfate (על פי Ashizuka וחב' ב-Microbiol Immunol משנת 2009, ו-Hayashi וחב' ב-J Colorectal Dis משנת 2011). ניסוי שנערך ב-7 מטופלים עם קוליטיס כיבית שעברו עירוי תוך-ורידי של ADM למשך 8 שעות מדי יום לתקופה של שבועיים, הביא לשיפור במדדי המחלה, ולהקטנה בגודל הכיבים שנצפתה בבחינה אנדוסקופית (Ashizuka וחב' ב-Dig Dis Sci משנת 2016).
תכונות אנטי-מיקרוביאליות של ADM
האפיתליום מהווה מחסום הגנה ראשון מפני פתוגנים. סוגים רבים של תאי אפיתל מפרישים ADM, וניתן למצוא פפטיד זה בנוזלי גוף רבים בריכוזים גבוהים יותר מאשר בפלזמה (Lundy וחב' ב-Arch Oral Biol משנת 2006, ו-Kishikawa וחב' ב-Peptides משנת 2009). ל-ADM יש דמיון מבני וכימי לפפטידים אנטי-מיקרוביאליים אחרים כגון β-defensin-2, בכל הקשור לגודל הפפטיד, למטען החשמלי החיובי שלו, לקשר הדיסופידי בין שיירי ציסטאין 16 ו-21, וכן באמידציה של שייר הטירוזין ה-C טרמינאלי (Diamond וחב' ב-Curr Pharm Des משנת 2009). לפפטידים אלה יש מבנה אמפיפתי המאפשר התקשרות לממברנת החיידק (Zasloff ב-Nature משנת 2002). מחקרים in vitro הדגימו ש-ADM ואף מקטעים קטנים שלו מסוגלים לעכב צמיחת חיידקים (Allaker וחב' ב-Peptides משנת 2006).
הגנה על הלב
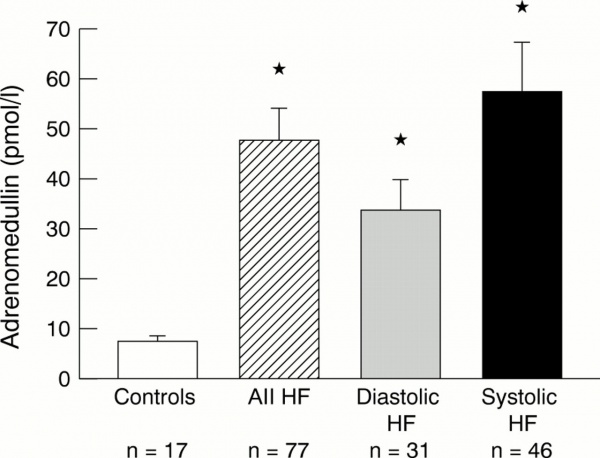
ל-ADM יש גם השפעות של הגנה על הלב. עכברי knockout עם חסר ADM לקו בהיפרטרופיה לבבית מוגברת ובפיברוזיס, לאחר שהם נחשפו להיפרטרופיה לבבית על ידי עקה, וזאת בהשוואה לעכברים בריאים מאותו זן (Niu וחב' ב-Circulation משנת 2004). מחקר נוסף הדגים הפחתה מושרית על ידי ADM של אפופטוזיס של תאי שריר הלב שנגרם על ידי doxorubicin, דרך מנגנון תלוי-cAMP (על פי Tokudome וחב' ב-Endocrinology משנת 2002), מה שאושר לאחר מכן in vivo במודל עכברים (על פי Yoshizawa וחב' ב-Biol Pharm Bull משנת 2016). במטופלים עם אי-ספיקת לב, בוצעו כבר צעדי הטיפול הראשונים עם ADM. במטופלים עם אי-ספיקת לב גדושה ויציבה, עירוי קצר של ADM, הביא להפחתה משמעותית בלחץ-עורקי ריאתי, וביתר לחץ-דם ריאתי, וכן גרם להגדלת האינדקס הלבבי. יתרה מכך, ADM הגביר את נפח השתן והפרשת נתרן בשתן, בה בשעה שהוא הפחית את רמות אלדוסטרון בפלזמה.
מחקר pilot במטופלים עם אי-ספיקת לב חריפה, טיפול משולב עם ADM ו-ANP, הביא לשיפור המודינאמי, כולל הפחתה בלחץ עורקי ריאתי, הגברת הפרשת שתן, וירידה ברמות אלדוסטרון ו-BNP בפלזמה (Nishikimi וחב' ב-Circ J משנת 2009). בניגוד לנתונים מוקדמים יותר, ADM כונה "cardiac depressant factor" כיוון שהזרקה של אנטגוניסט של הקולטן של ADM, הביאה להגברת כושר הכיווץ של מיוציטים קרדיאליים, בשלב המוקדם של אנדוטוקסמיה של חולדות (Hyvelin וחב' ב-J Card Surg משנת 2002, ו-Mittra וחב' ב-Am J physiol Heart Circ Physiol משנת 2004).
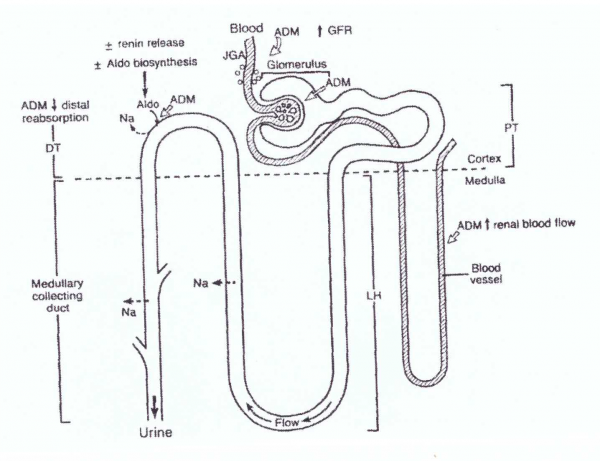
פעילות ADM בכליות
כאשר ADM הוזרק לתוך כליה אחת של כלבים נורמליים, במינונים של 1, 5 ו-25 ננוגרם/ק"ג/דקה, כאשר הכליה השנייה שימשה כביקורת והוזרקה עם saline (על פי Jougasaki וחב' ב-Am J Physiol משנת 1995), נגרמה תגובה דיורטית ונתריאורטית משמעותית, בעוד שעירוי ה-saline היה ללא כל השפעה. ההשפעה של ADM הייתה כרוכה בעלייה של ה-GFR, וירידה בספיגה מחדש של האבוביות הדיסטליות. השפעות אלו של ADM בוטלו לחלוטין על ידי עיכוב סינתזת פרוסטגלנדין (Jougasaki וחב' ב-Am J Physiol משנת 1997). עירוי תוך כלייתי של ADM, גרם כמו כן לעלייה בלחץ הדם העורקי, בתיווך של עצבי הכליה. הממצאים על השפעה נתריטורטית של ADM אושרה על ידי מספר מחקרים בכלבים (Ebara וחב' ב-Eur J Pharmacol משנת 1994, ו-Majid וחב' ב-Am J Physiol משנת 1995), וכן בחולדות (Hirata וחב' ב-Hypertension משנת 1995, ו-Vari וחב' ב-Br J Pharmacol משנת 1995). למרות שהפעילות בכליות של ADM לא נחסמה על ידי CGRP8-37 (על פי Elwahari וחב' באותו כתב עת מאותה שנה), Majid וחב' דיווחו שתגובת הכליות ל-ADM, נחלשה במהלך העיכוב של סינתזת NO, מה שמצביע על כך שהתגובה הדיורטית והנתריאורטית של הכליות ל-ADM, עשויה להיות מתווכת על ידי ההפרשה של NO אנדוגני.
Miura וחב' גם כן דיווחו על כך שפעילויות הרחבת כלי הדם והנתריאורטיות של ADM בכליות, נחלשו על ידי טיפול קודם עם (NG-nitro L-arginine (l-NOARG, והן התהפכו חלקית על ידי L-arginine (Miura וחב' ב-Br J Pharmacol משנת 1995). דיווח נוסף הראה ש-ADM הגביר את הפרשת NO אנדוגני בכליות מבודדות (Hirata וחב' ב-Hypertension משנת 1995). Blakely וחב' דיווחו ב- Am J Physiol משנת 1997, ש-ADM הגביר בכליות את צפיפות הקולטנים של תיאזיד באופן מתון ללא כל השפעה על הפרשת סידן בשתן.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק