אונקוסטטין - Oncostatin - M
| מדריך בדיקות מעבדה | |
| אונקוסטטין M | |
|---|---|
| Oncostatin M | |
| שמות אחרים | OSM |
| מעבדה | פתולוגית אונקולוגית |
| תחום | ציטוקין המשפיע במערכות מגוונות |
| טווח ערכים תקין | בנסיוב – פחות מ-35 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
Oncostatin M (להלן OSM) הוא חלבון המקודד באדם על ידי הגן OSM על פי Rose ו-Bruce ב-Proc Natl Acad Sci USA משנת 1991. OSM הוא ציטוקין פלאוטרופי השייך למשפחת הציטוקינים של IL-6 ( Tanaka ו-Myajima ב-Pharmacol Rev Physiol Biochem Pharmacol משנת 2003). מבין הציטוקינים האמורים OSM דומה ביותר ל-Leukemia Inhibitory Factor (להלן LIF) במבנה וגם בתפקוד. OSM הוא בעל תפקיד בהתפתחות הכבד, בהמאטופויזה, בדלקת ולכאורה גם בהתפתחות ה-CNS. הוא כרוך גם ביצירת העצם וכן בתהליכי הרס העצם (Walker וחב' ב-J Clin Invest משנת 2010). OSM מאותת דרך קולטנים על פני התא המכילים את החלבון gp130. הקולטן type 1 מורכב מ-gp130 ומ-LIFR ואילו הקולטן type 2 מורכב מ-gp130 ומ- OSMR (Auguste וחב' ב-J Biol Chem משנת 1997).
הצורה האנושית של OSM בודדה במקור בשנת 1986 מנוזל הגדילה של תאי histiocytic lymphoma (תאי U- 937) מטופלים בתרבית עם PMA (או phorbol 12-myristate 13-acetate), בגין יכולתו של OSM לעכב גידולם של שורות תאים ממקור של מלנומה או של גידולים סרטניים סולידיים אחרים (Zarling וחב' ב-Proc Natl Acad Sci USA משנת 1986). החלבון OSM יציב בתחום רחב של pH2-11 והוא עמיד לחימום למשך שעה בטמפרטורה של 56° צלזיוס. ריצוף חלקי של חומצות האמינו של OSM אפשר את הבידוד של OSM cDNA אנושי, ובדיעבד את הבידוד של קלונים גנומיים (Malik וחב' ב-Mol Cell Biol משנת 1989). שבט (clone) ה-cDNA השלם של OSM אנושי מקודד לקודמן (precursor) המכיל 252 חומצות אמינו, כאשר 25 חומצות האמינו הראשונות מתפקדות כפפטיד איתות מפריש, שבהסרתו מתקבל pro-OSM המכיל 227 חומצות אמינו. ביקוע על ידי טריפסין של 31 חומצות אמינו מהקצה ה-C טרמינלי, יוצר את צורת OSM הבשלה והפעילה המכילה 196 חומצות אמינו. ב-OSM אנושי ישנם 2 אתרי N-glycosylation (Linsley וחב' ב-Mol Cell Biol משנת 1990, ו-Malik וחב' ב-DNA Cell Biol משנת 1992).
OSM הבשל עם 196 חומצות האמינו היא הצורה השלטת המבודדת ממגוון של שורות תאים, המתאימה לגליקופרוטאין בגודל של 28 קילו-דלטון, למרות שהשייר הגדול יותר המכיל 227 חומצות אמינו של pro-OSM ניתן לבידוד מתאים שעברו טרנספקציה ביתר. למרות ש-pro-OSM הוא בסדר גודל פחות יעיל בעיכוב גדילה, הוא בעל זיקת קישור דומה לתאים, במבחני קישור רדיואקטיביים. נראה אם כן שתהליכי עיבוד post translational משחקים תפקיד משמעותי בתפקוד in vivo של OSM. בדומה לציטוקינים רבים, OSM מיוצר בתאים על ידי סינתזה de novo, המלווה על ידי הפרשה מהתאים דרך מסלולי הפרשה קלאסיים. עם זאת, OSM יכול להיות מופרש ממאגרים נתונים בתוך לויקוציטים פולימורפונוקלאריים בתהליך דה-גרנולציה של תאים אלה (Grenier וחב' ב-Blood משנת 1999).
המבנה של OSM
המבנה התלת-ממדי של OSM אנושי נפתר ברזולוציה אטומית, תוך אישור של המבנה המצופה של טופולוגיה של שרשרת ארוכה המורכבת מ-4 גדילים (helices) (על פי Deller וחב' ב-Structure משנת 2000). השוואה של מבנה זה עם מבנים ידועים של ציטוקינים בתאי Langerhans, מראה שמבנה זה דומה ביותר ל-LIF באורך של Å2.1. כאמור, יש דמיון רב בין OSM ו-LIF עם 22% של זהות ברצף חומצות האמינו, ו-30% דמיון ברצפים של השניים. אכן, הגנים המקודדים ל-OSM ול-LIF ממוקמים בסמיכות גדולה בכרומוזום 22 באדם, ולשני גנים אלה יש מבנה מאוד דומה עם אלמנטים דומים של promoter ודמיון רב במבני ה-intron-exon שלהם (Rose וחב' ב-Genomics משנת 1993). נתונים אלה מרמזים לכך ש-OSM ו-LIF נובעים אבולוציונית ממצג של gene duplication. מתוך 5 שיירי ציסטאין ברצף של OSM אנושי, 4 שיירים כאלה משתתפים ביצירת גשרים די-סולפידיים, כאשר אחד מגשרים די-סולפידיים אלה, המקשר בין helix A ו-helix B, חיוני ונחוץ לפעילות של OSM. השייר החמישי והחופשי של ציסטאין אינו גורם לדימריזציה של OSM.
הקולטנים של OSM
קולטנים של OSM נמצאים על פני מגוון של תאים במגוון של רקמות. באופן כללי, תאים שמקורם באנדותל או בגידולים סרטניים מבטאים על פניהם רמה גבוהה של קולטנים ל-OSM, בעוד שתאים ממקור המטופויאטי הם בעלי מספר נמוך יותר של קולטנים אלה. אנליזת Scatchard או נתוני קישור של ליגנד כמו OSM מסומן רדיואקטיבית על ידי I125 למגוון של שורות תאים המגיבים ל-OSM, יצרו גרפים מעוקלים-ליניאריים, מה שמביא חוקרים להערכה שישנם 2 סוגי קולטנים, האחד, אליו נקשר OSM בזיקה גבוהה (עם קבוע דיסוציאציה K של 1-10 פיקומולר, וצורת קולטן אליו נקשר OSM בזיקה נמוכה יותר של 0.4-1.0 ננומולר (Linsley וחב' ב-J biol Chem משנת 1989). בדיעבד נמצא שהנוכחות של gp130 כשלעצמה הייתה מספיקה לייצר את צורת הקולטן אליו נקשר OSM בזיקה נמוכה, כאשר טרנספקציה של תאי COS-7 עם LIFR ועם gp130 יצרה את הקולטן אליו נקשר OSM בזיקת קישור גבוהה (Gearing וחב' ב-Science משנת 1992). עם זאת, מחקרים נוספים הדגימו ש-LIF לא היה מסוגל לבצע את כל הפעילויות של OSM, דהיינו מספר תאים שלא הגיבו ל- LIF כן הגיבו ל-OSM (Thoma וחב' ב-J Biol Chem משנת 1994).
נתונים אלה רומזים למציאות של קולטן ספציפי נוסף מה שהוביל לשיבוט של הקולטן של OSM (Mosley וחב' ב-J Biol Chem משנת 1996). שני הקולטנים הללו, דהיינו gp130/LIFR ו-gp130/OSMR, המכונים type I OSMR ו-type II OSMR. היכולת של OSM לפעול דרך 2 קולטנים מספק הסבר מולקולרי להשפעות המשותפות והייחודיות של OSM ושל LIF (או leukemia inhibitory factor). הפעילויות הביולוגיות המשותפות של OSM ושל LIF מתווכות דרך הקולטן type I ואילו הפעילויות הספציפיות של OSM מתווכות דרך קולטן type II. עד שנת 1996 לא התגלה ההומולוג של OSM בעכברים (Yoshimura וחב' ב-EMBO J משנת 1996), כאשר הומולוג עכברי זה לא שובט עד שנת 1998 (על פי Lindberg וחב' ב-Mol Cell Biol משנת 1998). המחשבה הייתה ש-OSM מעכבר יכולים לאותת רק דרך הקולטן type II דהיינו mOSMR/mgp130 בגלל הזיקה הנמוכה לקולטן type I (Ichihara וחב' ב-Blood משנת 1997). אלא שכעת ידוע שלפחות בעצמות, mOSM מסוגל לאותת דרך שני הקולטנים, mOSMR/mgp130 ו-mLIFR/mgp130.
האם OSM הוא בעל תפקיד אנטי-דלקתי או מקדם דלקת
עד שנת 1986 התפקיד של OSM כתווך דלקתי לא היה ברור. נכון ל-2022 ההשפעה המדויקת של OSM על מערכת החיסון אינה ברורה. עם זאת קיימות שתי דעות, האחת המצדדת בהשפעה תומכת-דלקת, והשנייה מנוגדת לה. לפני שנת 1997 ההבדלים בשימוש בקולטני OSM של אדם ועכבר לא היו ידועים (Hermanss וחב' ב-J Immunol משנת 1999). לפיכך, מספר מחקרים השתמשו ב-OSM אנושי במערכות של עכברים ולכן מסקנותיהם אינן מבוססות. OSM מסונתז על ידי תאי-T ומונוציטים משופעלים. ההשפעות של OSM על תאי אנדותל מציעות תפקיד תומך-דלקת של OSM. תאי אנדותל מכילים מספר גדול של קולטנים של OSM (Brown וחב' ב-J Immunol משנת 1991), והקישור של OSM לקולטנים אלה מעודד יצירה של IL-6 בתאים אלה. תמיכה בדיעה ש-OSM מדכא תגובה חיסונית נשענת על העובדה ש-OSM מפחית את הרס המפרק במודל מושרה על ידי נוגדן של rheumatoid arthritis (Wallace וחב' ב-J Immunol משנת 1999). OSM הוא גורם גדילה עיקרי לתאי Kaposi's sarcoma שהם ממקור אנדותליאלי (Nair וחב' ב-Science משנת 1992). תאים אלה אינם מבטאים LIFR אך מבטאים OSMR ברמות גבוהות (Murakami-Mori וחב' ב-J Clin Invest משנת 1995). בנוסף, OSM מווסת את הביטוי של פרוטאות ושל מעכבי-פרוטאזות כגון gelatinase ו-chymotrypsin inhibitor.
הגילוי של OSM והניקוי של חלבון זה אפשרו את האיפיון הביוכימי שלו שהתבסס על הפעילות מדכאת השגשוג in vitro של שורת תאי המלנומה A375 (Zarling וחב' ב-Proc Natl Acad Sci USA משנת 1986). בהמשך נחקרו התפקיד הפוטנציאלי של OSM בוויסות התהליך הסרטני, ומחקרים הצביעו על פעולותיו הפליוטרופיות בתהליכים המטופויאטיים, בהשפעה על רקמת השלד, כמו גם בתהליכים מטבוליים, אימונולוגיים, בהתמיינות ובתהליכים דלקתיים. OSM נמצא מגיב עם קולטנים הכוללים את מולקולת האיתות התאית gp130, ולכן OSM נכלל במשפחת gp130 של ציטוקינים. לאחר שהושלם השיבוט של OSM מתאי U937 (Malik וחב' ב-Mol Cell Biol משנת 1989), נקבע שעותק של RNA שגודלו 2kb מקודד לפוליפפטיד באורך של 252 חומצות אמינו עם קצה signal peptide N-טרמינלי הידרופובי. למרות שפוליפפטיד שלם זה פעיל ביולוגית, חל ביקוע של קטע בקצה ה-C טרמינלי שלו, ליצירת המולקולה הבשלה באורך של 196 חומצות אמינו עם פעילות ביולוגית מוגברת (Linsley וחב' ב-Mol Cell Biol משנת 1990). המבנה הגבישי של OSM גילה טופולוגיה אופיינית לציטוקין המטופויאטי המורכב מצְרוֹר המורכב מ-4 גדילים (helices) דו-כיווניים עם אפּיטופּים המגיבים עם הקולטנים הרלוונטיים (Bravo ו-Heath ב-EMBO J משנת 2000, Deller וחב' ב-Structure משנת 2000, ו-Plun-Favreau וחב' ב-J Biol Chem משנת 2003). OSM אנושי נקשר in vitro גם לקולאגן types I, III & IV (Somasundaran וחב' ב-J Biol Chem משנת 2002), מה שמרמז לכך שקולאגנים אינטרסטיציאליים כרוכים במתווה המרחבי של OSM וזמינותו ברקמות.
אוכלוסיות תאים אינדיבידואליים המבטאים OSM כוללות מקרופאגים משופעלים, מונוציטים, תאי-T ודנדריטים (Suda וחב' ב-Cytokine משנת 2002), אם כי זה לא ברור האם תת-קבוצות ספציפיות של תאי-T מבטאות OSM באופן דיפרנציאלי. נמצא ש-OSM יכול להיות מופרש על ידי נויטרופילים שמסוגלים לסנתז OSM לאחר גירוי על ידי ליפופוליסכרידים או על ידי GM-CSF (Grenier וחב' ב-Blood משנת 1999). כמו כן נמצא ש-OSM יכול להיות מופרש מנויטרופילים של אנשים עם פגיעה ריאתית קשה (Grenier וחב' ב-Lab Invest משנת 2001). רמות מוגברות של OSM יכולות להתגלות באופן סיסטמי בהלם ספטי (Guillet וחב' ב-Ann NY Acad Sci משנת 1995), ובמצבים של פריטוניטיס בקטריאלי (Hurst וחב' ב-J Immunol משנת 2002). מונוציטים ומקרופאגים מפרישים OSM לאחר גירוי עם פרוסטגלנדינים (Ganesh וחב' ב-J Immunol משנת 2012), כן נמצא שגם תאי פיטום (mast cells) מייצרים OSM לאחר שפעול של תאי-T (Salamon וחב' ב-J Allergy Clin Immunol משנת 2008).
השפעת OSM על ההפטוציטים ועל הכבד
הכבד מגיב לתווכים דלקתיים על ידי סינתזה של מספר חלבוני acute phase המופרשים לצירקולציה. הזיהוי של OSM כווסת של תגובת acute phase של ההפטוציטים סייעה לכלול את OSM באותה קבוצה כמו IL-6 ו-LIF (Richards וחב' ב-J Immunol משנת 1992). מחקרים הראו ש-OSM מווסת את הקולטן ל-LDL בתאי הכבד (Grove וחב' ב-J Biol Chem משנת 1991) ומאידך מתגלה תפקידו של OSM במטבוליזם של כולסטרול. מחקרים עדכניים יותר הראו ש-hepcidin נתון לוויסות על ידי OSM מה שמוריד רמות ברזל בנסיוב וכורך את OSM במפגעים כגון אנמיה (Kanda וחב' ב-Int J Haematol משנת 2009, ו-Chung וחב' ב-FASEB J משנת 2010). התפקיד הפוטנציאלי של OSM בהתפתחות הכבד בעכבר, זוהה במחקרים שמצאו את תפקידו בהתמיינות של תאי כבד בעוברי עכברים, כמו גם בהמטופויאזה של הכבד העוברי בעכברים (Miyajima וחב' ב-Cytokine Growth Factor Rev משנת 2000). הודגם שעכברי knockout מסוג OSMRβ היו בעלי תגובה מוחלשת לתהליכי רגנרציה של הכבד במודל בו נגרם לכבד נזק על ידי פחמן טטרה-כלורידי (CCL4) או על ידי כריתה חלקית של אונת כבד (Nakamura וחב' ב-Hepatology משנת 2004). OSM מבוטא בתאי Kupffer וביחד עם ציטוקינים אחרים מקבוצת gp130, OSM מווסת תגובה של הפטוציטים. בתהליכי פיברוזיס של הכבד יש תפקיד מרכזי לתאי stellate הפאטיים, ונראה ש-OSM משתתף בתהליכים אלה (Mann ו-Marra ב-J Hepatol משנת 2010).
OSM מווסת תהליכים בסינוביום המפרקי וב-remodeling של הסחוס
התצפיות על כך ש-OSM מצוי בנוזל הסינוביאלי בדלקת מפרקים שגרונית )RA) עודדו מחקרים על התפקיד הפוטנציאלי של OSM במחלת מפרקים דלקתית זו (Cawston וחב' ב-Rheumatism משנת 1998, Langdon וחב' ב-Arthritis Rheum משנת 1997, ו-Hui וחב' ב-Ann Rheum Dis משנת 1997). נמצא ש-OSM מווסת את שיווי המשקל בין matrix metalloproteinase (להלן MMP) לבין המעכבים של אנזימים אלה (TIMPs) בתאי רקמת החיבור (Richards וחב' ב-J Immunol משנת 1993). הודגם in vitro ש-OSM מווסת את TIMP-1 ואת TIMP-3 בכונדרוציטים (Li ו-Zafarullah ב-J Immunol משנת 1998), וכן נמצא ש-OSM אנושי משרה את CCL-13 בפיברובלסטים סינוביאליים באדם, ועל תפקיד אפשרי של OSM בתהליכי דלקת בסינוביום (Hintzen וחב' ב-Arthritis Rheum משנת 2009). CCL-13 הוא ציטוקין קטן המשרה כמוטקסיס במונוציטים, אאוזינופילים, בזופילים ותאי-T, ופעילותו משמעותית בתגובות אלרגיה בהיותו מושרה על ידי IL-1 ועל ידי TNFα.
OSM ומטבוליזם של העצם
ידוע שציטוקינים ממשפחת gp130 יכולים לווסת את הפעילות של אוסטאובלסטים ואוסטאוקלסטים (Heymann ו-Rousselle ב-Cytokine משנת 2000). הדעה ש-OSM יכול לשנות את הרכב רקמת העצם נבעה מניסויים עם עכברים טרנסגניים בהם נעשה שימוש ב-OSM בעכברים עם סימנים של אוסטאופורוזיס (Malik וחב' ב-Mol Cell Biol משנת 1995).
אוסטאובלסטוגניות: מחקר של Jay וחב' ב-Endocrinology משנת 1996, הראה פעילות ביולוגית של OSM בתאי גולגולת בתרבית של עכברים וחולדות לאחר לידתם, בהשרייה של שגשוג תאים אלה ובהפחתה של ספיגת העצם. Bellido וחב' הדגימו ב-J Clin Invest משנת 1996, ביטוי של הקולטן type II של OSM על פני שורת תאים אוסטאובלסטיים של עכברים מזן MG-63. מחקרים שהתבצעו עם תאי אדם בתרבית, הראו שנוזל גידול המכיל LPS, גרם למקרופאגים/מונוציטים להשרות התמיינות של אוסטאובלסטים של אדם שמקורם בתאי-גזע מזנכימליים, כאשר נוגדנים כנגד OSM עכבו באופן חלקי תהליכי אוסטאוגנזה (Guihard וחב' ב-Stem Cells משנת 2012). Knockdown על ידי siRNA של תת-יחידות בקולטן של OSM, גם כן פגע באוסטאוגנזה, מה שמחזק את ההערכה על התפקיד של OSM ושל הקולטן הספציפי שלו type II באוסטאובלסטוגנזה באדם. הערכה זו מתחזקת גם על פי מחקר עדכני שהדגים שמקרופאגים מדם טבורי מפרישים OSM המעודד תאי גזע מזנכימליים להתמיין לכיוון של אוסטאובלסטים (Fernandes וחב' ב-PLoS ONE משנת 2013), ומחקר נוסף שהראה שמגע בין מונוציטים לבין תאי גזע מזנכימליים הגביר את הביטוי של OSM שהשרה הגברה של הפנוטיפ האוסטאובלסטי (Nicolaidou וחב' ב-PLoS ONE משנת 2012).
אוסטאוקלסטוגניות: גם האוסטאוקלסטוגניות מווסתת על ידי הציטוקינים ממשפחת gp130, מה שתורם לרגולציה המורכבת של מטבוליזם העצם על ידי ציטוקינים וגורמי גדילה. Palmqvist וחב' דיווחו ב-J Immunol משנת 2002, שרקמה שנלקחה מהגולגולת של עכבר לצורך תרבית רקמה (explant) הגיבה בהפרשה של מינרלים ושל קולאגן בהוספה של OSM של עכבר, של אדם וכן בהוספה של LIF, תוך וויסות הביטוי של RANK ושל osteoprotegerin (להלן OPG) במערכת זו. ההוספה של OPG מסוגלת לעכב את הפעילות של ספיגת העצם, מה שמרמז על מעורבות RANK/RANKL במטבוליזם של עצם הגולגולת בעכבר.
OSM וסרטן
הפעילות המתוארת של OSM בעיכוב in vitro של הפרוליפרציה של שורות תאי מלנומה (A375 ו-SK-MEL28) כמו גם העיכוב של תאי קרצינומה של הריאה (A549), וכן העיכוב של תאי נוירובלסטומה (HTB10), הביא להתעניינות באפשרות של שימוש ב-OSM כגורם אנטי-סרטני. ניסויים קדם-קליניים עם OSM אנושי לטיפול בסרטן לא הושלמו כנראה בגלל תופעות הלוואי הסיסטמיים של הזרקת OSM. בנוסף, בשנת 1993 הודגם ש-OSM עודד גידול של תאי סרקומה ע"ש Kaposi בכך שהוא שפעל את מסלולי P13K, Stat-1 ו-Stat-3, ERK ו-JNK (Soldi וחב' ב-Oncogene משנת 1994, ו-Faris וחב' ב-AIDS משנת 1996).
OSM ומלנומה: למרות שהשגשוג של שורות תאי מלנומה אנושית עוכבו על ידי OSM במספר מחקרים, תאי מלנומה גרורתית לא הגיבו ל-OSM, מה שיוחס לאובדן ספציפי של OSMRβ (Lacreusette וחב' ב-Oncogene משנת 2007). חוקרים אלה הראו שפעילות האנזים histone deacetylase עודדה את הביטוי של OSMRβ, מה שהצביע על אפשרות שמנגנונים אפיגנטיים משנים את האופי של מלנומה גרורתית in vivo. מחקר נוסף על שורת תאי מלנומה 1286, הראתה ביטוי ניכר של SOCS-3, שהוא המעכב הטבעי של איתות במערכת JAK/SAT3, ושעידוד הדיכוי של SOCS-3 עשוי לשקם את תגובת תאים אלה לפעילות המעכבת של OSM (Komyod וחב' ב-Mol Cancer Res משנת 2007 ). בבחינה רטרוספקטיבית של אוכלוסיות מטופלים עם מלנומה stage 3, נמצא שהישרדות ללא relapse הייתה כרוכה ברגישות ל-OSM (Lacreusette וחב' ב-J Physiol משנת 2008). מחקרים נוספים הראו שחלק מתאי המלנומה במטופלים שונים היו פגומים במנגנוני האיתות שלהם כולל השפעול בתלות ב-PKCδ של הפוספורילציה של שייר serine727 בחלבון STAT-3, הנדרשת לפעילות המעכבת של OSM (Lacrusette וחב' ב-J Pathol משנת 2009). לפיכך נראה שישנם מספר מנגנונים דרכם תאי מלנומה עלולים להתחמק מהעיכוב על ידי OSM.
OSM ואוסטאוסרקומה: הרגולציה של אוסטאוסרקומה על ידי ציטוקינים ממשפחת gp130, נחקרה בכמה היבטים (Mori וחב' ב-Oncology Rep משנת 2006). נמצא ש-OSM יכול לווסת את השגשוג של תאי אוסטאוסרקומה בחולדה (Chipoy וחב' ב-J Bone Mineral Res משנת 2004). מחקרי המשך הראו ש-OSM יכול לרגש תאי אוסטאוסרקומה באופן שאלה יגיבו להשפעות של גורמים המשרים אפופטוזיס, זאת דרך מנגנון הכורך STAT5 ו-p53 (Brounais וחב' ב-Bone משנת 2009). היעילות in vivo של הגורם המשרה אפופטוזיס Midistaurin, הוגברה על ידי שדרוג סיסטמי של OSM על ידי ביטוי-יתר אדנו-נגיפי של OSM בחולדות (Brounais וחב' ב-Clin Cancer Res משנת 2008).
OSM וסרטן השד: Douglas וחב' דיווחו בשנת 1997 ב-Oncogene שקולטנים לציטוקינים ממשפחת gp130 מופיעים ברוב שורות תאי סרטן השד. נמצא ש-OSM יכול לעכב כ-75% משורות תאים אלה שנבדקו במחקר האמור. תוך שימוש בשיטות כגון Western Blot או אימונוהיסטוכימיה, נמצא אחוז גבוה של דגימות חיוביות ל-OSM בתאי קרצינומה של השד בהשוואה למחלה שפירה של השד ( Garcia-Tuňón וחב' ב-Cancer Invest משנת 2008). מחקר עדכני מצא שרמות מוגברות של OSMRβ היו כרוכות בהישרדות נמוכה יותר בקרב חולות עם סרטן השד (West וחב' ב-Endocrine Related Cancers משנת 2012).
למרות היכולת לעכב את השגשוג של אדנו-סרקומה M6 בעכברים וכן את התאים הגרורתיים M6c, כפי שנצפה עם שורות תאי סרטן שד אחרים, נמצא ש-OSM הגדיל את האינטראקציה הבינתאית ואת הקישור למצע של תאי M6 בבדיקה in vitro של היכולת החודרנית של תאים אלה (Holzer וחב' ב-Clin Exp Metastasis משנת 2004). בהמשך נמצאה פעילות דומה בשתי שורות תאי סרטן שד אנושיים אחרים (Jorcyk וחב' ב-Cytokines משנת 2006), מה שמצביע על אחידות הממצאים בסרטן שד באדם ובעכבר. הודגם במערכות אדם ועכבר, ש-OSM משרה fascin במנגנון התלוי ב-STAT3, ובכך תורם לפנוטיפ התנועתי והגרורתי של תאי סרטן השד (Snyder וחב' ב-J Biol Chem משנת 2011). יתרה מכך, נתונים עדכניים יותר רומזים לכך ש-c-myc משמש כ-switch לשינוי התגובות של תאי סרטן השד ל-OSM, כאשר עלייה ברמת c-myc מפחיתה את הפעילות נוגדת השגשוג של תאים אלה, ומגבירה את פנוטיפ שגשוגם שאינו תלוי בספיחה למצע (anchorage) (Kan וחב' ב-Cancer Res משנת 2011). אכן, בעוד שיש ל-OSM השפעות מעכבות על אוסטאוסרקומה ועל כונדרוסרקומה (David וחב' ב-Int J Cancer משנת 2011), ההשפעה מעודדת השגשוג שלו על Ewing sarcoma הייתה כרוכה עם עלייה ברמת c-myc (David וחב' ב-J Pathol משנת 2012). בנוסף, OSM יכול להשרות מעבר ממתווה אפיתליאלי למזנכימלי, וכן להשפיע ביצירת תכונות אופייניות למתווה של תאי גזע סרטניים בתאי סרטן השד in vitro (West וחב' ב-Oncogene משנת 2013, ו-Guo וחב' באותו כתב עת מאותה שנה). באופן כולל נתונים אלה מצביעים על סדרה שלמה של השפעות OSM על תאי סרטן השד.
OSM וסוגי סרטן אחרים
תפקיד מעודד טומורוגניות של OSM הודגם גם בסוגי סרטן אחרים. OSN מעודד שגשוג של תאי SKOV3 של סרטן השחלות (Li וחב' ב-Int J Mol Med משנת 2011), ואת השגשוג של תאי Ewing sarcoma. בהקשר של סרטן פי הרחם, OSMRβ mRNA נמצא מוגבר בתאי squamous carcinoma של פי הרחם, אך לא בתאי הקשקש בנגעים התוך-אפיתליאליים (Ng וחב' ב-J Pathol משנת 2007). בעלי המחקר סבורים שהגברת הביטוי של הקולטן, הייתה כרוכה עם שלבים מתקדמים של הקרצינוניות של פי הרחם, ועם הישרדות נמוכה יותר. יש הגורסים שביטוי מוגבר של OSM כרוך בהגברת האנגיוגניות ושגשוג סרטן זה (Winder וחב' ב-J Pathol משנת 2011). באשר לתאים סרטניים ברקמה העצבית, איתות תאי המושרה על ידי OSM התגלה גם כן, למרות שהתגובות לאיתות זה מגוונות, באופן שתאי גליומה לא הושפעו, ואילו השגשוג של תאי astroglioma כן דוכא על ידי OSM (Krona וחב' ב-Oncology Rep משנת 2005, ו-Chen וחב' ב-Glia משנת 2006).
נמצא ש-OSM מסוגל לעודד את השגשוג של תאי 22Rv1 של סרטן הערמונית (Godoy-Tundidor וחב' ב-Prostate משנת 2005), ולעודד VEGF בתאי DU-145 של סרטן הערמונית (Weiss וחב' ב-Anticancer Res משנת 2011). בנוסף, למרות ש-OSM התגלה בצביעה אימונוהיסטוכימית בתרחיש של BPH, הוא היה מבוטא בכמות גדולה יותר בקרצינומה של הערמונית בשלב מתקדם (Royuela וחב' ב-J Pathol משנת 2004). כמו כן תואר in vivo בעכברים, שהפרשה פאראקרינית של OSM יכלה לעודד התקדמות ממאירה של התהליך הסרטני התוך-אפיתליאלי בערמונית, כתוצאה מאיבוד של תפקוד PTEN ושפעול-יתר של מסלול PI3K/Akt (Smith וחב' ב-Mol Cancer Res משנת 2013).
תאי אפיתל הם המקור העיקרי של קרצינומות בריאות, ומסתבר שיש ל-OSM פחות יכולת לעכב תאי אפיתל קדם-ממאירים (Loewen וחב' ב-BMC Cancer משנת 2005). נראה שעיכוב על ידי OSM פחות יעיל בתאי סרטן ריאות וסרטן הלבלב בשורות תאים in vitro (Argast וחב' ב-Cells Tissues Organs משנת 2010). Chen וחב' דיווחו ב-J Pathol משנת 2008 שתאי סרטן ריאות באדם מבטאים בעיקר צורה קצרה יותר של OSMRβ שמשמשת בתור מולקולת קולטן הסחה (decoy) ועל ידי כך מפחיתה את ההשפעות המעכבות של OSM על השגשוג של תאי סרטן הריאות. הביטוי המוגבר של צורת קולטן מקוצרת זו, נמצאת במתאם עם התקדמות המחלה וההישרדות הדלה. יתרה מכך, נמצא ש ה-OSMRβ המקוצר נמצא שעבר מתילציה באופן שכיח ברקמת סרטן ראשונית של המעי הגס, אך לא ברקמות בריאות, והמתילציה אכן משתיקה את הקולטן, ומפחיתה את רגישותו להשפעה המעכבת של OSM על שגשוג התאים הסרטניים (Kim וחב' ב-PLos ONE משנת 2009, Deng וחב' ב-Clin Cancer Res משנת 2009, ו-Hibi וחב' ב-Anticancer Res משנת 2011). וריאנט שעבר splicing ומקודד לצורה המסיסה של OSMRβ, נמצא ברקמת סרטן הוושט אם כי לא ברקמת וושט בריאה (Kausar וחב' ב-Cell Oncol משנת 2011). כן נמצא שפולימורפיזמים של הגן המקודד לקולטן של OSM, תוארו בתאי סרטן פפילרי של התירואיד (Hong וחב' ב-Otorhinolaryngology משנת 2011). במרוכז, ממצאים אלה מצביעים על כך שבסוגי סרטן של מערכת העיכול שנלמדו עד כה, החלבון OSMRbeta מתפקד בתאי סרטן באופן מופחת מה שמונע עיכוב יעיל של שגשוג תאים אלה על ידי OSM.
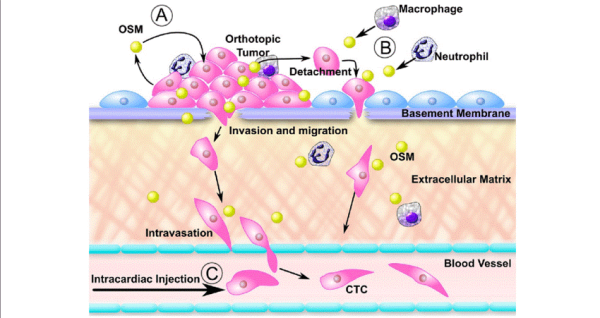
OSM ומערכת העצבים המרכזית
מחקרים אחדים ניסו לברר את התפקודים של OSM בתאי ה-CNS ואת תפקידו הפוטנציאלי במחלות דלקתיות של ה-CNS. זיהוי של OSM ברקמת המוח של מטופלים עם טרשת נפוצה על ידי צביעה אימונוהיסטוכימית, מצא מיקום בולט שלו במיקרוגליה, באסטרוציטים פעילים, ובלויקוציטים שעברו הסננה למוח, אך לא נמצאה צביעה של OSM בפרנכימה של מוחות בריאים (Ruprecht וחב' ב-J Neuropathol Exp Neurol משנת 2001). ביטוי של MCP-1 ושל IL-6 בתאי אנדותל מוחיים, מהווה יעד של גירוי in vitro על ידי OSM, כמו גם רמות מוגברות של COX-2 ,IL-6 ,VEGF ו-PGE2 (Van Wagoner וחב' ב-J Neurochem משנת 2000, Repovic וחב' ב-Glia משנת 2003, ו-Repovic וחב' ב-Oncogene משנת 2003). כן נמצא ש-OSM מגביר את הפעילות של תאים קודמנים של אוליגודנדרוציטים, מה שעשוי לסייע בתיקון נזקים רקמתיים.
הוראות לביצוע הבדיקה
דגימות דם נלקחות במבחנה כימית (פקק אדום או צהוב) או במבחנה עם נוגדי-קרישה כ-EDTA או הפארין. לאחר סרכוז הנסיוב או הפלזמה מופרדים מהתאים ונשמרים בהקפאה עמוקה (-80°C) עד לביצוע הבדיקה. ערכה מסחרית (Thermo Fischer, Waltham, USA) לבדיקת ELISA משמשת במדידה הקולורימטרית לכימות של OSM אנושי, כאשר סף הגילוי התחתון בשיטה זו הוא 1.37 פיקוגרם/מ"ל, שמתחתיו ריכוז OSM מדווח כ-0. גם שיטת chemiluminescence immunoassay (CLIA) יכולה לשמש לכיות רמת OSM בנסיוב.
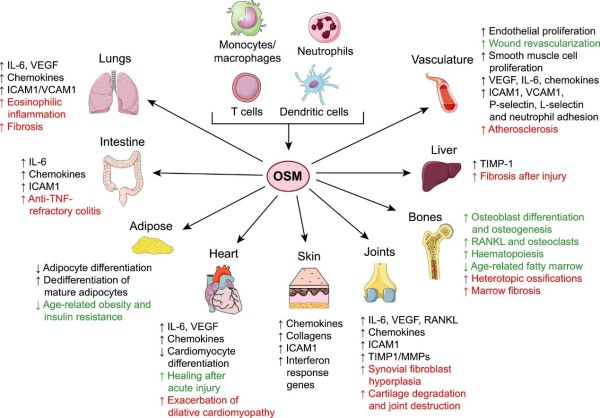
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 