אלפא-סינוקלאין - Alpha-synuclein
| מדריך בדיקות מעבדה | |
| אלפא-סינוקלאין | |
|---|---|
| Alpha-synuclein | |
| שמות אחרים | α- synculein, αSyn |
| מעבדה | פתולוגית |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
זיהוי של α synuclein במפגעים נוירו-ניווניים.
הביולוגיה של α-Synculein
החלבון α-Synculein (להלן αSyn) נחקר רבות בהקשר לתפקידו בפתוגנזה של מחלת פרקינסון (PD), והיותו מרכיב חלבוני עיקרי בגופיפי Lewy (Anderson וחב' ב-J Biol Chem משנת 2006). אף על פי שהתפקיד המדויק של αSyn אינו ברור במלואו, נראה שהטוקסיות של חלבון זה כרוכה ביצירת צברים שלו בגופיפי Lewy ובנוירונים (Baba וחב' ב- Am J Pathol משנת 1998) השערה זו גרמה לרעיון של מודולציה של הביטוי של αSyn כאמצעי להחליש את המהלך הפתולוגי ב-PD. אך מחקרים רבים מראים ששינוי הביטוי של αSyn או אפילו הרחקתו מנוירונים, גורמים להשפעות מרחיקות לכת על תהליכים תוך תאיים רבים, ובמקרים אחדים אף השרו נוירו-דגנרציה. נתונים אלה מרמזים לכך שתפקוד נורמלי של αSyn חיוני לאוכלוסיות נוירונים מסוימות וש-PD עלול להיגרם דווקא מטוקסיות שמקורה בחסר תפקוד של αSyn (Perez ו-Hastings ב-J Neurochem משנת 2004, ו-Benskey וחב' באותו כתב-עת משנת 2016). אכן, αSyn הוא אחד החלבונים הנפוצים ביותר במערכת העצבים. תפקידו בהעברת סיגנלים בסינפסות מתועד היטב, והמחקרים מאשרים גם תפקידים שלו בסינתזה של נוירו-טרנסמיטורים, בהמוסטאזיס של סידן, בתפקוד המיטוכונדריאלי, וברגולציה של גנים. לפיכך, חיוני להגדיר באופן גורף את תפקודו הנורמלי של αSyn לפני שפועלים להפחתתו בגישה תרפויטית. נבחנו הראיות לכך שתפקוד נורמלי של כל שלושת ההומולוגים של αSyn הוא בעל תפקיד רגולטורי בביטוי גנים המתרחש בעת האינטראקציה שלו עם חומצות גרעין, עם גורמי שעתוק ועם גורמי תרגום (Surguchov ב-Adv Parkinson Dis משנת 2013). זוהו תפקידים אפיגנטיים של αSyn על ידי אינטראקציות קישור שלו שהשפיעו על מתילציה של DNA, על RNA-associated-gene-silencing ועל אצטילציה של histone.
יתרה מכך, גנים הכרוכים בתיקון של DNA גם כן מושפעים ממודולציה על ידי αSyn, מה שמסביר כיצד איבוד של αSyn מסיס עלול לפגוע בתפקוד התא. גם Benskey וחב' במחקרם הדגימו את תפקידו של αSyn בשמירה על החיוניות של נוירונים דופאמינרגיים בחומר השחור. ניסויים עם חולדות בוגרות בריאות בהן גרמו להפחתת ה-αSyn ב-substantia nigra בעזרת adeno-associated-virus short hairpin RNA, הראו פגיעה בתפקוד נוירונים כתוצאה מדלקת ואובדן של נוירונים דופמינרגיים באזור זה. לעומת זאת מחקרים אחרים מצאו ש-αSyn מעכב את הסינתזה של דופאמין בנוירונים (Perez וחב' ב-J Neurosci משנת 2002), וכן מעכב הפרשת אינסולין מתאי β בלבלב על ידי התקשרות לתת היחידה Kir6.2 של תעלות K-ATP על פני הגרנולות של אינסולין (Geng וחב' ב-Am J Physiol Endocrinol Metabol משנת 2011). יתרה מכך, Kir6.2 נמצא מעכב את הפרשת דופאמין במוח (Avshalumov ו-Rice ב-Proc Natl Acad Sci U.S.A משנת 2003), מה שמצביע על כך שתרפיות השומרות על האינטראקציות בין αSyn ו-Kir6.2, וכן מעודדות את הביטוי של הפקטור הנוירוטרופי BDNF תוך חסימת הדלקת, עשויות להגן מפני סוכרת ומפני PD (על פי Vargas-Medrano וחב' ב-ACS Med Chem Lett משנת 2014).
פגיעה מיטוכונדריאלית השכיחה ב-PD, משפיעה על המטבוליזם האנרגטי, על ההומאוסטאזיס, על התגובות לעקה וכן על האפופטוזיס (Winklhofer ו-Haass ב-Biochim Biophys Acta משנת 2010). יש ראיות לכך ש-αSyn משפיע ישירות על המיטוכונדריה על ידי מודולציה של הפוטנציאל הממברנלי במיטוכונדריה ושל ההומאוסטאזיס של סידן, על ידי הפרשה של ציטוכרום C, ועל ידי יצירת ATP. המיקום של αSyn על פני המיטוכונדריה הודגם לראשונה בתאים דופמינרגיים על ידי Perez וחב' בשנת 2002, ובאופן עדכני יותר תוך בתאים דופמינרגיים המבטאים ביתר αSyn בהם נמצא ש-αSyn מעכב איחוי ומעודד בִּקּוּעַ של המיטוכונדריה (Kemp וחב' משנת 2010). מחקרים נוספים בעכברי knockout משוללי PINK1, מצאו הצטברות תלויה-בגיל של αSyn בסינפסות, כמו גם הצטברות ספונטנית של αSyn בלתי-מסיס בקורטקס, בתלמוס, ב-striatum ובמוח המרכזי הקִדְמִי. באופן מפתיע, פתולוגיה הקשורה ל-αSyn מופיעה בחולדות גם כאשר αSyn אינו מבוטא ביתר (Wender וחב' ב-EMBO J משנת 2010).
נמצא ששינויים מטבוליים הגורמים לירידה במסת הגוף ולהפחתת מאגרי השומן מופיעים בעכברים זכרים טרנסגניים ל-Thy-1 בגיל מתקדם, המבטאים αSyn הומני (Rockenstein וחב' ב-J Neurosci Res משנת 2002, ו-Fleming וחב' ב-J Neurosci משנת 2004). עכברים זכרים מסוג Thy-1-αSyn גם הפגינו פעילות מוגברת, צריכה נמוכה יותר של מזון, ופחות בזבוז פחות אנרגיה בהשוואה לעכברי ביקורת. נמצא גם לגבי αSyn בנוירונים, שקיימת אינטראקציה בין αSyn, דופאמין וסידן המשפיעה על דלדול ה-substantia nigra ושל נוירונים ב-locus coeruleus בחולי PD. סקירה של Betzer ו-Jensen ב-Front Neurosci משנת 2018, שקלה מחדש את "היפותזת הסידן" לפיה רמות מוגברות של סידן בנוירונים מגבירים את הרס תאים אלה. חוקרים אלה הראו שכאשר בנוירונים יש עלייה הדרגתית של αSyn, רמת הסידן הציטוזולי למעשה פוחתת כאשר צברים של αSyn נקשרים לרטיקולום האנדופלזמי הסרקופלזמי (להלן SERCA). הצברים של αSyn הנקשר ל-SERCA משפעלים אותו וגורמים לירידה ברמת הסידן הציטוזולי אך מגדילים את רמת הסידן ברטיקולום האנדופלזמי (Betzer וחב' ב-EMBO Rep משנת 2018). הוצע שאם מתכווננים כנגד SERCA המשופעת בצורה לא נורמלית, או מונעים את האינטראקציה בין αSyn ו-SERCA, יתאפשר אולי להאט את מהלך PD.
נמצא שבתאים המייצרים נור-אפינפרין (NE) המבטאים αSyn בעודף, αSyn עובר טרנסלוקציה לגרעין התא שם הוא מפריע לשעתוק של dopamine ß-hydroxylase (להלן DBH), שהוא האנזים האחרון בתהליך הביו-סינתזה של NE, ובכך להפחית את יצירת NE (על פי Kim וחב' ב-Exp Neurol משנת 2014). אובדן של NE בנוירונים נוראדרנרגיים יכול להחמיר על ידי עיכוב של טירוזין הידרוקסילאז ושל amino acid decarboxylase (על פי Tehranian וחב' ב-J Neurochem משנת 2006). על ידי αSyn, ליצירה של רמות נמוכות יותר של דופאמין.
ביטוי רקמתי
חלבון זה שכיח במוח, וכמויות קטנות שלו מבוטאות בלב ברקמת השריר וברקמות אחרות. במוח הוא מרוכז בעיקר בקצוות הסינפטיות, בהן הוא מגיב עם פוספוליפידים (Chandra וחב' ב-J Biol Chem משנת 2003), ועם חלבונים (Sun וחב' ב-Proc Natl Acad Sci USA משנת 2019, ו-Atias וחב' באותו כתב-עת מאותה שנה). מחקרים מצביעים על תפקיד של αSyn בהגבלת תנועתן של vesicles סינפטיים מה שמחליש את השחרור של נוירוטרנסמיטרים מתוכם (Larsen וחב' ב-J Neurosci משנת 2006, Nemani וחב' ב-Neuron משנת 2010, Scott וחב' ב-J Neurosci משנת 2010, Scott ו-Roy באותו כתב-עת משנת 2012, Vargas וחב' באותו כתב-עת משנת 2014, ו-Wang וחב' ב-Curr Biol משנת 2014). דעה חלופית היא ש-αSyn נקשר ל-VAMP2 (שהוא synaptobrevin) ומייצב קומפלקסים של SNARE. סינפטוברבינים הם חלבונים איטגרלים קטן-מולולריים (18 קילו-דלטון) של ממברנות בועיות מפרישות, שהם חלק מה-vesicle-associated membrane protein (להלן VAMP) (על פי Burré וחב' ב-Cold Spring Harbor Prospect Med משנת 2018, ו-Diao וחב' ב-eLife משנת 2013). לעומת זאת, מחקרים עדכניים מראים שהקשר αSyn-VAMP2 קריטי להחלשה בתיווך αSyn של תהליך המחזור של ה-synaptic vesicles, מה שמאחד למראית עין שתי דעות מנוגדות. αSyn מסוגל גם לווסת את ההפרשה של דופאמין.
החלבון αSyn מופיע בעיקר ברקמה העצבית בה הוא מהווה כ-1% מכלל חלבוני הציטוזול של תאי המוח (Sun וחב' ב-Proc Natl Acad Sci USA משנת 2019). חלבון זה מבוטא בעיקר ב-neocortex, ב-היפוקמפוס, ב-substantia nigra, בתלמוס ובמוחון (cerebellum). αSyn הוא בעיקר חלבון נוירונלי, אך ניתן למצאו גם בתאי נוירוגליה (Bonini ו-Giasson ב-Cell משנת 2005). במלנוציטים הביטוי של αSyn עשוי להיות מווסת על ידי Chandra וחב' באותו כתב-עת מאותה שנה. נמצא ש-αSyn ממוקם באופן בולט בגרעין של נוירונים במוח (Cooper וחב' ב-Science משנת 2006), כמו גם בקדם-סינפסות (Kochan וחב' ב-Behav Brain Res משנת 2012), כאשר 15% מחלבון זה קשור לממברנת הנוירונים בכל רגע נתון (Tauro ב-Thesis Depository משנת 2019). דווח גם כן ש-αSyn ממוקם במיטוכונדריה של נוירונים (Williingham ב-Science משנת 2003, ו-Uversky ב-J Neurochem משנת 2007). כן נמצא ש-αSyn מבוטא בחוזקה במיטוכונדריה של פקעת הריח (olfactory bulb), בהיפוקמפוס, ב-striatum ובתלמוס, כאשר ריכוז החלבון הזה בציטוזול גם כן גבוה. עם זאת, שני יוצאי דופן הם קליפת המוח והמוחון, בהם הריכוז הציטוזולי של αSyn גבוה, אך רמותיו במיטוכונדריה מאוד נמוכים. כמו כן נמצא ש-αSyn ממוקם בממברנה הפנימית של המיטוכונדריה, וכן שההשפעה המעכבת של חלבון זה על הפעילות של Complex I בשרשרת הנשימה המיטוכונדריאלית, נמצאת במתאם עם ריכוז חלבון זה. נראה אם כן שהפעילות המיטוכונדריאלית של αSyn באזורי מוח שונים, יכולה להיות גורם המשפיע על פעילות המיטוכונדריה באופן הגורם לניוון נוירונים מסוימים.
מבנה החלבון
החלבון aSyn מקודד באדם על ידי הגן SNCA, ומורכב מ-140 חומצות אמינו (Xia וחב' ב-J Alzheimers' Dis משנת 2001). חלבון זה שכיח במוח, וכמויות קטנות שלו מבוטאות בלב ברקמת השריר וברקמות אחרות. במוח הוא מרוכז בעיקר בקצוות הסינפטיות, בהן הוא מגיב עם פוספוליפידים (Chandra וחב' ב-J Biol Chem משנת 2003), ועם חלבונים (Sun וחב' ב-Proc Natl Acad Sci USA משנת 2019, ו-Atias וחב' באותו כתב-עת מאותה שנה). המבנה הראשוני של aSyn מורכב מ-3 מקטעים נבדלים:
- שיירים 1–60 המהווים את האזור ה-N טרמינלי האמפיפתי נשלטים על ידי ארבעה מקטעים החוזרים על עצמם (repeats) שכל אחד מהם מורכב מ-11 חומצות אמינו, והוא מכיל את רצף הקונצנזוס KTKEGV. רצף זה הוא בעל מבנה של α helix (Clayton ו-George ב-Trends in Neurosci משנת 1998). אזור זה שמור ביותר והוא מגיב עם ממברנות הבנויות מליפידים חומציים, וכל המוטציות הנקודתיות של הגן SNCA ממוקמות בתוך האזור ה-N טרמינלי הזה (Bussell ו-Eliezer ב-J Mol Biol משנת 2003)
- שיירים 61–95 המהווים אזור הידרופובי מרכזי הכולל את המרכיב הלא-עמילואדי-בטא (להלן NAC) הכרוך באגרגציה של החלבון (Uéda וחב' ב-Proc Natl Acad Sci USA משנת 1993). מקטע מרכזי זה הוא ייחודי ל-aSyn בתוך משפחת synuclein (על פי Uchihara ו-Giasson ב-Acta Neuropathol משנת 2016)
- שיירים 96–140 מהווים אזור מאוד חומצי ועשיר בחומצת האמינו פרולין שאין לו נטייה מבנית ייחודית. מקטע זה משחק תפקיד חשוב בתפקוד, במסיסות ובאינראקציה של aSyn עם חלבונים אחרים (Burré וחב' ב-Science משנת 2010, ו-Sorrentino וחב' ב-FEBS Lett משנת 2020)
מקטע של αSyn הידוע כ-nonAβ component (או NAC) של העמילואיד המזוהה במחלת אלצהיימר (Alim וחב' ב-J Alzheimers' Dis משנת 2004, ו-Iwai וחב' ב-Neuron משנת 2006), נמצא שהוא מקטע של הקודמן של αSyn, הידוע כ-NACP (על פי Weinreb וחב' ב-Biochemistry משנת 1996). בהמשך נקבע ש-NACP הוא ההומולוג האנושי של synculein של דג הטורפדו. αSyn בתמיסה נחשב לחלבון בלתי מאורגן באופן אינטרינזי, דהיינו הוא חסר מבנה תלת-ממדי בודד ויציב (Chandra וחב' ב-J Biol Chem משנת 2003, ו-Theillet וחב' ב-Nature משנת 2016).
באופן קלאסי, αSyn נחשב לחלבון "בלתי מסודר" מסיס, כאשר טטרמר יציב בצורתו המקופלת באופן המונע אגרגציה (Bartels וחב' ב-Nature משנת 2011). נתון זה שהוכח על ידי מספר מעבדות (Dettmer וחב' ב-J Biol Chem משנת 2013), עדיין נתון בוויכוח בגין תוצאות מספר הסותרות נתוני מעבדות אחרות. אף-על-פי-כן, αSyn עובר אגרגציה ליצירת פיברילים בלתי-מסיסים בתרחישים פתולוגיים המאופיינים על ידי גופיפי Lewy, כגון מחלת פרקינסון, שיטיון עם גופיפי Lewy או באטרופיה רב-מערכתית. מודלים in vitro של סינקלואינפתיות, הראו שהאגרגציה של αSyn יכולות להוליך למספר מפגעים תאיים הכוללים פגיעה במיקרו-טובולים, פגיעה בתפקוד של המיטוכונדריה ושל הסינפסות, כמו גם לגרום לעקה חמצונית, לדיסרגולציה של איתות על ידי סידן, ולהגברת המסלול הפרוטאזומלית. צורת prion של החלבון αSyn הוא גורם לתרחיש של אטרופיה רב-מערכתית (Mezey וחב' ב-Nature Medicine משנת 1998, Marvian וחב' ב-J Neurochem משנת 2019, ו-Arima וחב' ב-Brain res משנת 1999). תוארו צברים עמילואדים דמויי-prion של αSyn שאינם נצבעים על ידי ריאגנט Thioflavin T הספציפי לעמילואיד, המופיעים בנוירונים in vivo ו-in vitro (על פי Yokota וחב' ב-Acta Neuropathol משנת 2002).
לפחות שלושה איזופורמים של synculein נוצרים על ידי splicing אלטרנטיבי (Jao וחב' ב-Proc Natl Acad Sci USA משנת 2008): הצורה העיקרית והנחקרת ביותר של חלבון זה, היא של החלבון השלם בן 140 חומצות האמינו. איזופורמים אחרים הם αSyn-126 בו חסרים השיירים 41–54 כתוצאה מאובדן exon 3 ו-αSyn-112 בו חסרים השיירים 103–130 כתוצאה מאובדן exon 5 (על פי Jhu וחב' ב-J Biol Chem משנת 2003).
פעילות אוטו-פרוטאוליטית
השימוש ב-ion-mobility mass spectrometry (להלן IMS-MS) ברזולוציה גבוהה לבחינת αSyn שנוקה על HPLC, מצא שחלבון זה הוא אוטו-פרוטאוליטי, שיוצר מגוון של פרגמנטים במשקל מולקולרי קטן לאחר הדגרה (Vlad וחב' ב-ChemBioChem משנת 2011). החלבון αSyn שמשקלו המולקולרי 14.46 קילו-דלטון נמצא יוצר באוטו-פרוטאוליזה את הפרגמנט במשקל מולקולרי 12.16 קילו-דלטון (חומצות אמינו 14–133), את הפרגמנט במשקל מולקולרי 10.44 קילו-דלטון (חומצות אמינו 40–140) הנוצרים על ידי קיטום הקצוות ה-N וה-C טרמינליים, ואת הפרגמנט במשקל מולקולרי 7.27 קילו-דלטון (חומצות אמינו 72–140) המכיל את רוב האזור NAC, עובר אגרגציה הרבה יותר מהר מאשר αSyn באורכו המלא. ייתכן ששלושת פרגמנטים אלה, תוצרי האוטו-פרוטאוליזה של החלבון השלם, משחקים תפקיד כתוצרי ביניים או כקו-פקטורים in vivo בתהליך האגרגציה של αSyn.
משמעות קלינית
מנגנון האגרגציה של aSyn אינו ברור. ישנן ראיות של תוצר ביניים העשיר במבנה β שיכול להיות הקודמן (precursor) של האגרגציה וגופי Lewy (Kim וחב' ב-ChemBioChem משנת 2007). מחקר של Sandal וחב' ב-PLos Biol משנת 2008 מציע ש-αSyn קיים כתערובת של α ו-β helices, המצויים בשיווי משקל. מוטציות ידועות כמשפרות את האגרגציה, תוך העדפה של סליל β, מה שעלול לגרום לאגרגציה פתוגנית. קיימת תיאוריה שרוב האגרגציות של αSyn ממוקמות בקדם-סינפסה כמשקעים קטנים יותר המשבשים את פעילות הסינפסה (Schulz-Schaeffer ב-Acta Neuropathol משנת 2010). בין האסטרטגיות לטיפול ב-סינקוליין-פתיות מופיע השימוש בתרכובות המעכבות את האגרגציה של aSyn. הודגם גם שמולקולה קטנה דוגמת cuminaldehyde מעכבת את הפיברילציה של αSyn (Morshedi ו-Aliakbari ב-Modares J Med Sci Pathobiol משנת 2012). גם הנגיף Epstein Barr נכרך במפגע זה (Woulfe וחב' Neurology משנת 2000).
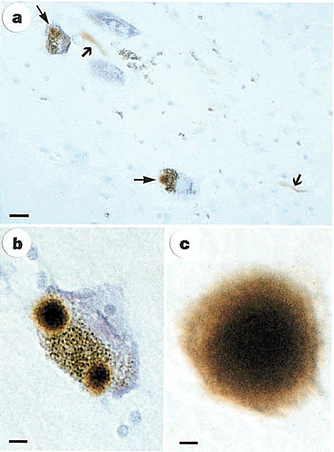
b) תא עצב פיגמנטרי עם 2 גופיפי Lewy חיוביים ל- α-synuclein. Scale bar, 8 מיקרון.
c) גופיפי Lewy חוץ-תאיים חיוביים ל-Scale bar ,α-Synuclein, 4 מיקרון.
במקרים נדירים של הצורות המשפחתיות של PD, מופיעה מוטציה בגן המקודד ל-αSyn. חמש מוטציות נקודתיות זוהו: A53T (Polymeropoulos ב-Science משנת 1997), המוטציה A30P (Krüger וחב' ב-Nature Genet משנת 1998), המוטציה E46K (Zarranz וחב' ב-Ann Neurol משנת 2004), המוטציה H50Q (Appel-Cresswell וחב' ב-Movement Disorders משנת 2013), ו-G51D (על פי Lesage וחב' ב-Ann Neurol משנת 2013). דווח שמוטציות אחדות משפיעות על האתחול וההגברה של תהליך האגרגציה (Giasson וחב' ב-J Biol Chem משנת 1999, ו-Flagmeier וחב' ב-Proc Natl Acad Sci USA משנת 2016). דופליקציה וטריפליקציה גנומית של הגן מהווה סיבה נדירה של PD, אם כי יותר שכיחה מאשר מוטציות נקודתיות (Singleton וחב' ב-Science משנת 2003, ו-Chartier-Harlin וחב' ב-Lancet משנת 2004). לפיכך, מוטציות מסוימות של αSyn עלולות לגרום לחלבון זה ליצור פיברילות דמויות-עמילואיד וכך לתרום לפתוגנזה של PD. ביטוי-יתר של המוטציה האנושית A53T ב-αSyn של פרימטים מאיץ שקיעה של αSyn בחלק הקדמי של המוח המרכזי, לניוון של המערכת הדופמינרגית ולפגיעה בפעילות המוטורית (Eslamboli וחב' ב-Brain משנת 2007). מקטעים אחדים של החלבון αSyn עשויים לשחק תפקיד בפתולוגיה של tau (על פי Takeda וחב' ב-Acta Neuropathol משנת 2000, ו-Williams וחב' ב-Brain Commun משנת 2020). צורת prion של החלבון αSyn יכולות להוות סיבה לאטרופיה הרב-מערכתית של המחלה (Prusiner וחב' ב-Proc Natl Acad Sci USA משנת 2015, Weiler ב-Research משנת 2015, ו-Rettner ב-Wired Science משנת 2015).
נוגדנים כנגד αSyn מקובלים יותר מאשר נוגדנים כנגד ubiquitin כמדד הזהב בצביעה ההיסטו-אימונית של גופיפי Lewy (Fujiwara וחב' ב-Nature Cell Biol משנת 2002). החלבון αSyn בצורתו המונומרית מופיע בתמיסות באופן טבעי בצורה unfolded, אך מסוגל להיקשר לממברנות גם בצורתו ה- α-הֶליקלית. ממחקר in vitro נובע שהמונומר ה-unfolded יכול לעבור אגרגציה בהתחלה לאוליגומרים קטנים המיוצבים על ידי אינטראקציות דמויות β sheet ובהמשך להתגבש לפיברילות גבה-מולקולריות בלתי-מסיסות. בהקשר התאי, יש ראיות מסוימות שנוכחות ליפידים יכולה לסייע ליצירת אולימרים: αSyn יכול גם ליצור מבנים טַבַּעְתִּיים המגיבים עם ממברנות. השקיעה של αSyn לתוך מבנים פתולוגיים כגון גופיפי Lewy, היא כנראה שלב מאוחר יותר המתרחש בנוירונים אחדים. פעילות חשמלית בנוירונים משנה את הקשר בין αSyn לבין vesicles ועשויה גם לעודד את האנזים polo-like kinase 2 (להלן PLK2), המזרחן את αSyn בעמדה Ser129. גם קינאזות אחרות הוצעו כמשתתפות בתהליך. בדומה לפוספורילציה, גם קיטום (truncation) על ידי פרוטאזות כגון calpains, וניטרציה על ידי NO או על ידי מולקולות חנקניות פעילות המופיעות במצבי דלקת, כל אלה יכולים להביא למודיפיקציה של synculein, באופן שיש למולקולה נטייה מוגברת לאגרגציה. הוצעו מספר יעדים לטוקסיות שגורם αSyn כגון טרנספורט של מולקולות מהרטיקולום האנדופלזמי ל-golgi, פגיעה ב-vesicles הסינפטיים, במיטוכונדריה ובליזוזומים. בכל המקרים הללו, נראה שיש ל-αSyn השפעות שליליות, אם כי בשלב זה לא ברור איזה מהשפעות אלה נחוצה או מספיקה לייצר טוקסיות בנוירונים.
במצב של אגרגציה, ל-αSyn יש פעילות ספציפית המסייעת ל-peroxidation של ליפידים, והוא משרה חמצון עצמי בממברנות עתירות חומצות שומן רב-בלתי-רוויות (PUFA) בנוירונים ובאסטרוציטים ובכך הוא מחליש את עמידותם של תאים אלה לאפופטוזיס (Lee וחב' ב-FASEB J משנת 2001). לעומת זאת, אין ל-αSyn אינטראקציה עם חומצות שומן חד-בלתי-רוויות (Zhu וחב' ב-Biochemistry משנת 2006). כמו כן הודגם ש-αSyn מגיב באופן משמעותי עם tubulin (על פי Alim וחב' ב-J Biol Chem משנת 2002), כמו גם עם חלבונים הכרוכים עם ה-microtubules כגון tau (על פי Jensen וחב' ב-J Biol Chem משנת 1999 ו-Arima וחב' ב-Acta Neuropathol משנת 2000).
ראיות עדכניות מצביעות על כך ש-αSyn מתפקד כ-chaperone מולקולרי ביצירה של קומפלקסים של SNARE (משפחת חלבונים הכרוכים באיחוי של vesicles). בעיקר, αSyn נקשר ספציפית לפוספוליפידים בממברנות דרך הקצה ה-N-טרמינלי שלו, והוא נקשר ל-synaptobrevin-2 דרך הקצה ה-C-טרמינלי שלו, שחשוב לפעילות הסינפטית. αSyn חיוני להתפתחות התקינה של התפקוד הקוגניטיבי, ואכן, עכברים שעברו אינאקטיבציה של הביטוי של αSyn, לוקים בכושר לימוד ובזיכרון.
התפקוד של αSyn בתיקון של DNA
החלבון αSyn משתתף במודולציה של תהליכי DNA כולל תיקון שברים בסליל הכפול (על פי Simon ב-Sci Parkinson משנת 2019). חסר של αSyn בתאי אדם מגביר את השברים ב-DNA לאחר החשיפה ל-bleomycin עם יכולת מוחלשת לתקן שברים אלה. כמו כן, בעכברי knockout ל-αSyn, מוצאים עלייה ניכרת בשברי DNA, שניתן להקל על ידי החדרה מחדש באופן טרנסגני של αSyn אנושי. עם זאת, בגופיפי Lewy בנוירונים התפקוד המתקן שברי DNA של αSyn נפגם, מה שמגביר את מותם של התאים.
הוראות לביצוע הבדיקה
שיטת הבדיקה-אימונוהיסטוכימית. הדגימה היא של רקמת מוח, או מרכיב אחר של מערכת העצבים המרכזית. מועדפות שתי זכוכיות נושא (25- x 75- x 1-mm) טעונות חיובית. הרקמה הנבדקת אמורה להיות בעובי של 4 מיקרון. מתקבלים בלוקים של דגימות שעברו קיבוע בפורמלין ותהליך של embedding בפרפין. מועדפות דגימות המגיעות למעבדה בטמפרטורת החדר, אך גם בקירור.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 